Производные арилсульфониламиногидроксамовой кислоты
Формула / Реферат
1. Соединение формулы

или его фармацевтически приемлемые соли, где
R1 и R2, каждый независимо, выбраны из (С1-С6)алкила, или R1 и R2 могут быть взяты вместе с образованием (С3-С6)циклоалкила или группы формулы
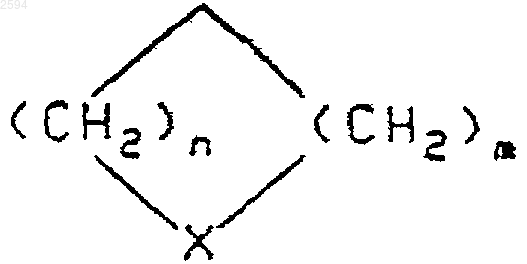
где n и m независимо равны 1 или 2, и Х представляет собой О; и Q является (С6-С10)арилом, (С6-С10)арилокси(С6-С10)арилом, (С6-С10)арил-(С6-С10)арилом, (С2-С9)гетероарил(С2-С9)гетероарилом, (C1-С6)алкокси(С6-С10)арилом, (С6-С10)арил(С1-С6)алкокси(С6-С10)арилом, где каждая арильная группа возможно замещена фторо, хлоро или (С1-С6)алкокси, и где (С6-С10)арил представляет собой фенил или нафтил, и (С2-С9)гетероарил представляет собой моно- или бициклическое гетероциклическое ароматическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из N, S или О.
2. Соединение по п.1, где R1 и R2 взяты вместе с образованием (С3-С6)циклоалкила или группы формулы
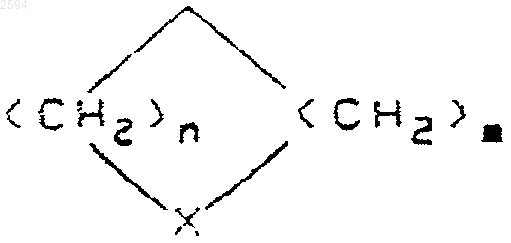
где n и m независимо равны 1 или 2, и Х является О.
3. Соединение по п.2, где R1 и R2 взяты вместе с образованием (С3-С6)циклоалкила.
4. Соединение по п.1, где Q является (С6-С10)арилом, (С6-С10)арил(С6-С10)арилом, (С6-С10)арилокси(С6-С10)арилом, (С2-С9)гетероарил(С2-С9)гетероарилом.
5. Соединение по п.4, где Q является (С6-С10)арилокси(С6-С10)арилом.
6. Соединение по п.1, где R1 и R2, каждый независимо, являются (С1-С6)алкилом.
7. Соединение по п.1, где R1 и R2 взяты вместе с образованием (С3-С6)циклоалкила или группы формулы

где n и m независимо равны 1 или 2, и Х является О; и Q является (С6-С10)арилом, (С6-С10)арил(С6-С10)арилом, (С6-С10)арилокси(С6-С10)арилом, (С2-С9)гетероарил(С2-С9)гетероарилом.
8. Соединение по п.1, где R1 и R2 взяты вместе с образованием (С3-С6)циклоалкила; и Q является (С6-С10)арилом, (С6-С10)арил(С6-С10)арилом, (С6-С10)арилокси(С6-С10)арилом, (С2-С9)гетероарил(С2-С9)гетероарилом.
9. Соединение по п.1, где R1 и R2, каждый независимо, являются (С1-С6)алкилом; и Q является (С6-С10)арилом, (С6-С10)арилокси(С6-С10)арилом, (С2-С9)гетероарил(С2-С9)гетероарилом.
10. Соединение по п.1, где R1 и R2, каждый независимо, являются (С1-С6)алкилом; и Q является (С6-С10)арилокси(С6-С10)арилом.
11. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из
гидроксиамида 1-[4-(4-фторфенокси)бензолсульфониламино]циклопропан-1-карбоновой кислоты;
гидроксиамида 1-[4-(4-хлорфенокси)бензолсульфониламино]циклопропан-1-карбоновой кислоты;
гидроксиамида 1-[4-(4-фторфенокси)бензолсульфониламино]циклобутан-1-карбоновой кислоты;
гидроксиамида 1-[4-(4-фторфенокси)бензолсульфониламино]циклопентан-1-карбоновой кислоты;
гидроксиамида 1-[4-(4-фторфенокси)бензолсульфониламино]циклогексан-1-карбоновой кислоты;
2-[4-(4-фторфенокси)бензолсульфониламино]-N-гидрокси-2-метилпропионамида;
N-гидрокси-2-метил-2-(5-пиридин-2-илтиофен-2-сульфониламино]пропионамида;
гидроксиамида 1-(5-пиридин-2-ил-тиофен-2-сульфониламино)циклопентан-1-карбоновой кислоты; и
гидроксиамида 1-(4'-фторбифенил-4-суль-фониламино)циклопентан-1-карбоновой кислоты.
12. Фармацевтическая композиция для (а) лечения состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани, дегенерации желтого пятна, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза, склерита, в комбинации со стандартными НСПВС и анальгетиками и в комбинации с цитотоксическими противораковыми агентами, и других заболеваний, характеризующихся активностью матриксных металлопротеиназ, СПИДа, сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование фактора некроза опухоли (ФНО), или для (б) ингибирования матриксных металлопротеиназ или продуцирования фактора некроза опухоли (ФНО), у млекопитающего, включая человека, содержащая соединение по п.1 в количестве, эффективном при таком лечении, и фармацевтически приемлемый носитель.
13. Фармацевтическая композиция для (а) лечения состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани, дегенерации желтого пятна, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза, склерита и других заболеваний, характеризующихся активностью матриксных металлопротеиназ, СПИДа, сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование фактора некроза опухоли (ФНО), или для (б) ингибирования матриксных металлопротеиназ или продуцирования фактора некроза опухоли (ФНО), у млекопитающего, включая человека, содержащая соединение по п.1 в количестве, эффективном при таком лечении, и фармацевтически приемлемый носитель.
14. Способ ингибирования (а) матриксных металлопротеиназ или (б) продуцирования фактора некроза опухоли (ФНО) у млекопитающего, включая человека, при котором указанному млекопитающему вводят эффективное количество соединения формулы по п.1.
15. Способ лечения состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани, дегенерации желтого пятна, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза, склерита, соединения формулы I могут быть использованы в комбинации со стандартными НСПВС и анальгетиками и в комбинации с цитотоксическими противораковыми агентами, и других заболеваний, характеризующихся активностью матриксных металлопротеиназ, СПИДа, сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование фактора некроза опухоли (ФНО), у млекопитающего, включая человека, при котором указанному млекопитающему вводят соединение по п.1 в количестве, эффективном при лечении такого состояния.
16. Способ лечения состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани, дегенерации желтого пятна, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза, склерита и других заболеваний, характеризующихся активностью матриксных металлопротеиназ, СПИДа, сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование фактора некроза опухоли (ФНО), у млекопитающего, включая человека, при котором указанному млекопитающему вводят соединение по п.1 в количестве, эффективном при лечении такого состояния.
Текст
1 Настоящее изобретение относится к производным арилсульфониламиногидроксамовой кислоты, которые являются ингибиторами матриксных металлопротеиназ или продуцирования фактора некроза опухоли (ФНО) и как таковые пригодны при лечении состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза,склерита и других заболеваний, характеризующихся активностью матриксных металлопротеиназ, СПИДа, сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование ФНО. Кроме того, соединения по настоящему изобретению могут применяться в комбинированной терапии вместе со стандартными нестероидными противовоспалительными средствами (здесь и далее НСПВС (NSAID и анальгетиками для лечения артрита, и в комбинации с цитотоксическими лекарственными средствами, такими как адриамицин, дауномицин, цис-платина, этопосид, таксол, таксотер, и алкалоидами, такими как винкристин, при лечении рака. Это изобретение также относится к способу применения таких соединений при лечении вышеуказанных заболеваний у млекопитающих,особенно у людей, и к фармацевтическим композициям, пригодным для этого. Существует ряд ферментов, которые осуществляют расщепление структурных белков и которые являются структурно родственными металлопротеазами. Расщепляющие матрикс металлопротеиназы, такие как желатиназа,стромелизин и коллагеназа, участвуют в деградации матрикса ткани (например коллагеновый коллапс) и вовлечены во многие патологические состояния, включающие в себя патологический метаболизм матрикса соединительной ткани и базальной мембраны, такие как артрит (например остеоартрит и ревматоидный артрит), изъязвление ткани (например изъязвление роговицы, эпидермиса и желудка), ненормальное заживление ран, заболевание периодонта, заболевание костей (например болезнь Педжета и остеопороз), метастазирование опухоли или инвазия, также ВИЧ-инфекцию (J. Leuk. Biol, 52 (2): 244-248, 1992). Признано, что фактор некроза опухоли вовлечен во многие инфекционные и аутоиммунные заболевания (W. Fiers, FEBS Letters, 1991,285, 199). Кроме этого, было показано, что ФНО является первичным медиатором воспалительного ответа, проявляемым при сепсисе и септическом шоке (С. Е. Spooner et al, Clinical Immunology and Immunopathology, 1992, 62, S11). Настоящее изобретение относится к соединению формулы 2 или его фармацевтически приемлемым солям,где(С 1-С 6)алкила,трифторметила,трифторметил(С 1-С 6)алкила,(С 1-С 6)алкил(дифторметилен)а, (С 1-С 3)алкил(дифторметилен(С 1-С 3)алкила, (С 6-С 10)арила, (С 2-С 9)гетероарила, (С 6(С 2-С 9)гетероарил(С 1 С 10)арил(С 1-С 6)алкила,С 6)-алкила, или R1 и R2 могут быть взяты вместе с образованием (С 3-С 6)циклоалкила или бензоконденсированного(С 3-С 6)циклоалкильного кольца или группы формулы(С 1-С 6)алкилом,(С 6 С 10)арилом,(С 6-С 10)арилокси(С 6-С 10)арилом,(С 6-С 10)арил(С 6(С 6-С 10)арил(С 6-С 10)арилом,С 10)арил(С 1-С 6)алкилом, (С 6-С 10)арил(С 2-С 9)гетероарилом,(С 6-С 10)арилокси(С 2-С 9)гетероарилом, (С 2-С 9)гетероарилом, (С 2-С 9)гетероарил(С 2-С 9)гетероарилом,(С 2-С 9)гетероарил(С 6 С 10)арилом, (С 1-С 6)алкил(С 6-С 10)арилом, (C1-С 6)алкокси(С 6-С 10)арилом, (С 6-С 10)арил(С 1-С 6)алкокси(С 6 С 10)арилом, (С 6-С 10)арил(С 1-С 6)алкокси(С 1-С 6)алкилом, (С 2-С 9)гетероарилокси(С 6-С 10)арилом, (С 1 С 6)алкил(С 2-С 9)гетероарилом, (С 1-С 6)алкокси(С 2-С 9)гетероарилом, (С 6-С 10)арил(С 1-С 6)алкокси(С 2-С 9)гетероарилом, (С 2-С 9)гетероарилокси(С 2-С 9)гетероарилом, (С 6-С 10)арилокси(С 1-С 6)алкилом, (С 2C9)гетероарилокси(С 1-С 6)алкилом,(С 1-С 6)алкил(С 6-С 10)арилокси(С 6-С 10)арилом, (С 1-С 6)алкил(С 2-С 9)гетероарилокси(С 6-С 10)арилом, (С 1 С 6)алкил(С 6-С 10)арилокси(С 2-С 9)гетероарилом,(С 1-С 6)алкокси(С 6-С 10)арилокси(С 2-С 10)арилом,(C1-С 6)алкокси(С 2-С 9)гетероарилокси(С 6-С 10)арилом или (С 1-С 6)алкокси(С 6-С 10)арилокси(С 2 С 9)гетероарилом, где каждая арильная группа возможно замещена фторо, хлоро, бромо, (С 1 С 6)алкилом, (С 1-С 6)алкокси или перфтор(С 1 С 3)алкилом. Термин алкил, используемый здесь, если не указано иначе, включает в себя насыщенные одновалентные углеводородные радикалы,имеющие нормальные, разветвленные или циклические группировки или их комбинации. Термин алкокси, используемый здесь,включает в себя O-алкильные группы, где алкил является таким, как определено выше. Термин арил, используемый здесь, если не указано иначе, включает в себя органический радикал, полученный из ароматического углеводорода путем удаления одного водорода, такой как фенил или нафтил, возможно замещен 3 ный заместителями в количестве от 1 до 3, выбранными из группы, состоящей из фторо, хлоро,трифторметила,(С 1-С 6)алкокси,(С 1 С 6)арилокси, трифторметокси, дифторметокси и(С 1-С 6)алкила. Термин гетероарил, используемый здесь,если не указано иначе, включает в себя органический радикал, полученный из ароматического гетероциклического соединения путем удаления одного водорода, такой как пиридил, фурил,пироил, тиенил, изотиазолил, имидазолил, бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, бензофурил, изобензофурил, бензотиенил, пиразолил, индолил,изоиндолил, пуринил, карбазолил, изоксазолил,тиазолил, оксазолил, бензтиазолил или бензоксазолил, возможно замещенный заместителями в количестве от 1 до 2, выбранными из группы,состоящей из фторо, хлоро, трифторметила, (С 1 С 6)алкокси, (С 6-С 10)арилокси, трифторметокси,дифторметокси и (С 1-С 6)алкила. Термин ацил, используемый здесь, если не указано иначе, включает в себя радикал общей формулы RCO, где R является алкилом,алкокси, арилом, арилалкилом или арилалкилокси, а термины алкил или арил являются такими, как определено выше. Термин ацилокси, используемый здесь,включает в себя O-ацильные группы, где ацил является таким, как определено выше. Соединение формулы I может иметь хиральные центры, и, следовательно, существовать в разных энантиомерных формах. Это изобретение относится ко всем оптическим изомерам и стереоизомерам соединений формулы I и их смесям. Предпочтительные соединения формулы I включают в себя соединения, где R1 и R2 взяты вместе с образованием (С 3-С 6)циклоалкила или бензоконденсированного (С 3-С 6)циклоалкильного кольца или группы формулы где n и m независимо равны 1 или 2, и Х представляет собой CF2, S, О или NR3, где R3 является водородом, (С 1-С 6)алкилом, (С 6-С 10)арилом,(С 2-С 9)гетероарилом, (С 5-С 10)арил(С 1-С 6)алкилом, (С 2-С 9)гетероарил(С 1-С 6)алкилом, (С 1-С 6)алкилсульфонилом, (С 6-С 10)арилсульфонилом или ацилом. Другие предпочтительные соединения формулы I включают в себя соединения, где R1 и R2 взяты вместе с образованием (С 3 С 6)циклоалкила или бензоконденсированного(С 3-С 6)циклоалкильного кольца. Другие предпочтительные соединения формулы I включают в себя соединения, где Q является(C2-С 9)гетероарилокси(С 6-С 10)арилом. Другие предпочтительные соединения формулы I включают в себя соединения, где Q является (С 6-С 10)арилокси(С 6-С 10)арилом. Другие предпочтительные соединения формулы I включают в себя соединения, где R1 и R2, каждый независимо, являются (С 1 С 6)алкилом. Более предпочтительные соединения формулы I включают в себя соединения, где R1 и R2 взяты вместе с образованием(С 3-С 6)циклоалкильного кольца или группы формулы где n и m независимо равны 1 или 2, и Х представляет собой CF2, S, О или NR3, где R3 является водородом, (С 1-С 6)алкилом, (С 5-С 10)арилом,(С 2-С 9)гетероарилом, (С 6-С 10)арил(С 1-С 6)алкилом, (С 2-С 9)гетероарил(С 1-С 6)алкилом, (С 1 С 6)алкилсульфонилом, (С 6-С 10)арилсульфонилом или ацилом; и Q является (С 6-С 10)арилом,(С 6-С 10)арил(С 6-С 10)арилом,(С 6-С 10)арилокси(С 6-С 10)арилом, (С 6-С 10)арилокси(С 2-С 9)гетероарилом,(С 2-С 9)гетероарилом,(С 2-С 9)гетероарил(С 2-С 9)гетероарилом, (С 6-С 10)арил(С 2 С 9)гетероарилом, (C2-С 9)гетероарил(С 6-С 10)арилом или (С 2-С 9)гетероарилокси(С 6-С 10)арилом. Более предпочтительные соединения формулы I включают в себя соединения, где R1 и R2 взяты вместе с образованием (С 3-С 6)циклоалкила или бензоконденсированного (С 3 С 6)циклоалкильного кольца; и Q является (C6 С 10)арилом, (С 6-С 10)арил(С 6-С 10)арилом, (С 6 С 10)арилокси(С 6-С 10)aрилом,(С 6-С 10)арилокси(С 2-С 9)гетероарилом,(С 2-С 9)гетероарилом,(С 2-С 9)гетероарил(С 2-С 9)гетероарилом, (С 6-С 10)арил(С 2-С 9)гетероарилом, (С 2-С 9)гетероарил(С 6 или(С 2-С 9)гетероарилокси(С 6 С 10)арилом С 10)арилом. Более предпочтительные соединения формулы I включают в себя соединения, где R1 и R2,каждый независимо, являются (С 1-С 6)алкилом; иQ является (С 6-С 9)арилом, (С 6-С 10)арил(С 6(С 6-С 10)арилокси(С 6-С 10)арилом,С 10)арилом,(С 6-С 10)арилокси(С 2-С 9)гетероарилом, (С 2-С 9)гетероарилом,(С 2-С 9)гетероарил(С 2-С 9)гетероарилом, (С 6-С 10)арил(С 2-С 9)гетероарилом, (C2 С 9)гетероарил(С 6-С 10)арилом или (С 2-С 9)гетероарилокси(С 6-С 10)арилом. Более предпочтительные соединения формулы I включают в себя соединения, где R1 и R2,каждый независимо, являются (С 1-С 6)алкилом; иQ является (С 6-С 10)арилокси(С 6-С 10)арилом. Конкретные предпочтительные соединения формулы I включают в себя следующие:N-гидрокси-2-метил-2-(5-пиридин-2 илтиофен-2-сульфониламино]-пропионамид; гидроксиамид 1-(5-пиридин-2-ил-тиофен 2-сульфониламино)циклопентан-1-карбоновой кислоты; гидроксиамид 1-(4'-фторбифенил-4-сульфониламино)циклопропан-1-карбоновой кислоты,гидроксиамид 1-(4'-фторбифенил-4-сульфониламино)циклобутан-1-карбоновой кислоты; гидроксиамид 1-(4'-фторбифенил-4-сульфониламино)циклопентан-1-карбоновой кислоты; гидроксиамид 2-(4-метоксибензолсульфониламино)индан-2-карбоновой кислоты; и гидроксиамид 2-[4-(4-фторфенокси)бензолсульфониламино]-индан-2-карбоновой кислоты. Настоящее изобретение также относится к фармацевтической композиции для (а) лечения состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани, дегенерации желтого пятна, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза,склерита, в комбинации со стандартными НСПВС и анальгетиками и в комбинации с цитотоксическими противораковыми агентами, и других заболеваний, характеризующихся активностью матриксных металлопротеиназ, СПИДа,сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование фактора некроза опухоли (ФНО), или для (б) ингибирования матриксных металлопротеиназ или 6 продуцирования фактора некроза опухоли(ФНО), у млекопитающего, включая человека,содержащая соединение формулы I или его фармацевтически приемлемую соль в количестве, эффективном при таком лечении, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу ингибирования (а) матриксных металлопротеиназ или (б) продуцирования фактора некроза опухоли (ФНО) у млекопитающего,включая человека, при котором указанному млекопитающему вводят эффективное количество соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу лечения состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани, дегенерации желтого пятна, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза, склерита, соединения формулы I могут быть использованы в комбинации со стандартными НСПВС и анальгетиками и в комбинации с цитотоксическими противораковыми агентами, и других заболеваний,характеризующихся активностью матриксных металлопротеиназ, СПИДа, сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование фактора некроза опухоли (ФНО), у млекопитающего, включая человека, при котором указанному млекопитающему вводят соединение формулы I или его фармацевтически приемлемую соль в количестве, эффективном при лечении такого состояния. Следующие схемы реакций иллюстрируют получение соединений по настоящему изобретению. Если не указано иначе, R1, R2 и Q на схемах реакций и в последующем обсуждении являются такими, как определено выше. Получение А 7 В реакции 1 получения А аминокислоту формулы III обрабатывают бензиловым спиртом и кислотой формулы НХ, где Х предпочтительно представляет собой 4-толуолсульфонат, в инертном растворителе, таком как бензол или толуол (предпочтительно толуол), с получением соответствующей кислотной соли дибензилового эфира формулы V. Реакцию обычно проводят в течение периода времени между приблизительно 1 ч и приблизительно 24 ч, при температуре кипения используемого растворителя. Воду, которая образуется в ходе реакции, обычно собирают в ловушку Дина-Старка. В реакции 2 получения А соединение формулы V превращают в соответствующее соединение формулы VI путем взаимодействия V с реакционноспособным функциональным производным сульфоновой кислоты (QSO2OH), таким как сульфонилхлорид (QSO2Cl), в присутствии основания, такого как гидроксид натрия или триэтиламин, и растворителя, такого как метиленхлорид, тетрагидрофуран, диоксан, вода или ацетонитрил, предпочтительно смесь диоксана и воды. Реакционную смесь перемешивают при температуре между приблизительно 0 и приблизительно 50 С, предпочтительно при комнатной температуре, в течение периода времени между приблизительно 10 мин и приблизительно 2 сутками, предпочтительно около 60 мин. В реакции 3 получения А промежуточное соединение формулы VI гидрируют с получением промежуточного соединения формулы II. Реакцию проводят в растворителе, таком как этанол, в атмосфере водорода (предпочтительно при давлении 3 атмосферы), используя катализатор, такой как 10% палладий на активированном угле. Реакционную смесь обычно перемешивают при комнатной температуре в течение периода времени между приблизительно 30 мин и приблизительно 24 ч, предпочтительно приблизительно 1,5 ч. В реакции 1 схемы 1 аминокислотное соединение формулы III превращают в соответствующее соединение формулы II путем взаимодействия III с реакционноспособным функциональным производным сульфоновой кислоты формулы QSO2OH, где Q такой, как определено выше, таким как сульфонилхлорид (QSO2Cl), в присутствии основания, такого как гидроксид натрия или триэтиламин, и полярного растворителя, такого как тетрагидрофуран, диоксан, вода или ацетонитрил, предпочтительно смесь диоксана и воды. Реакционную смесь перемешивают при температуре между приблизительно 0 до приблизительно 50 С, предпочтительно при комнатной температуре, в течение времени между 10 мин и приблизительно 2 сутками, предпочтительно около 60 мин. В реакции 2 схемы 1 карбоновую кислоту формулы II превращают в соединение гидроксамовой кислоты формулы I путем обработки 8 имидом и 1-гидроксибензтриазолом в полярном растворителе, таком как N,N-диметилформамид,с последующим добавлением гидрокcиламина к реакционной смеси после периода времени между приблизительно 15 мин и приблизительно 1 ч, предпочтительно около 30 мин. Гидроксиламин предпочтительно образуется in situ из солевой формы, такой как гидрохлорид гидроксиламина, в присутствии основания, такого как триэтиламин. Альтернативно, защищенное производное гидроксиламина или его солевая форма,где гидроксильная группа защищена как третбутил,бензил,аллил или 2-триметилсилилэтиловый эфир, может быть использовано вместо гидроксиламина или соли гидроксиламина. Удаление защитной группы гидроксила проводят гидрированием в случае бензильной защитной группы (5% палладий на сульфате бария является предпочтительным катализатором) или обработкой сильной кислотой, такой как трифторуксусная кислота, в случае трет-бутильной защитной группы. Аллильная защитная группа может быть удалена обработкой трибутилоловогидридом и уксусной кислотой в присутствии катализатора бис(трифенилфосфин)палладия(II) хлорида. 2 Триметилсилилэтилэфирная группа может быть удалена взаимодействием с сильной кислотой,такой как трифторуксусная кислота, или взаимодействием с источником фтора, таким как эфират трифторида бора. Реакцию II с гидроксиламином, солью гидроксиламина, защищенным производным гидроксиламина или солью защищенного производного гидроксиламина можно проводить в присутствии гексафторфосфата(бензтриазол-1-илокси)трис(диметиламино)фосфония и основания, такого как триэтиламин, в инертном растворителе, таком как метиленхлорид. Реакционную смесь перемешивают при температуре между приблизительно 0 и приблизительно 50 С, предпочтительно при комнатной температуре, в течение периода времени от приблизительно 1 ч до приблизительно 3 суток, предпочтительно около 1 суток. Предпочтительной процедурой для превращения соединения II в соединение I является взаимодействие(бензтриазол-1-илокси)трис(диметиламино)фосфония и триэтиламина с использованием метиленхлорида в качестве растворителя. Последующее удаление O-бензильной защитной группы с получением соединения формулы I затем проводят гидрированием под давлением водорода 3 атмосферы при комнатной температуре с использованием 5% палладия на сульфате бария в качестве катализатора. Предпочтительным растворителем является метанол. Время реакции может варьировать от приблизительно 1 до приблизительно 5 ч (предпочтительно 3,5 ч). 9 В некоторых случаях предпочтительно получать соединение формулы I путем взаимодействия гидроксиламина, соли гидроксиламина,защищенного производного гидроксиламина или соли защищенного производного гидроксиламина с активированным эфиром формулы IV,как показано в реакции 3 схемы 1. Реакцию проводят в инертном растворителе, таком какN,N-диметилформамид, при температуре в интервале от приблизительно комнатной температуры до приблизительно 80 С, предпочтительно около 50 С, в течение периода времени от приблизительно 1 ч до приблизительно 2 суток. Если используют защищенное производное гидроксиламина или соль защищенного производного гидроксиламина, удаление защитной группы проводят, как описано выше. Активированное эфирное производное формулы IV получают обработкой соединения формулы II гексафторфосфатом(бензтриазол-1-илокси)трис(диметиламино)-фосфония и основанием, Таким как триэтиламин, в инертном растворителе, таком как метиленхлорид (реакция 4, схема 1). Реакционную смесь перемешивают при температуре между приблизительно 0 и приблизительно 50 С, предпочтительно при комнатной температуре, в течение периода времени между приблизительно 1 ч и приблизительно 3 сутками, предпочтительно около 1 суток. Фармацевтически приемлемые соли кислотных соединений по изобретению представляют собой соли, образованные основаниями, а именно катионные соли, такие как соли щелочных и щелочно-земельных металлов, таких как натрий, литий, калий, кальций, магний, а также аммониевые соли, такие как соли аммония, триметиламмония, диэтиламмония и трис(гидроксиметил)-метиламмония. Подобным образом соли присоединения кислот, такие как соли минеральных кислот,органических карбоновых и органических сульфоновых кислот, например соляной кислоты,метансульфоновой кислоты, малеиновой кислоты, также могут иметь основную группу, такую как пиридил, составляющую часть структуры. Способность соединений формулы I или их фармацевтически приемлемых солей (именуемые здесь как соединения по настоящему изобретению) ингибировать матриксные металлопротеиназы или продуцирование фактора некроза опухоли (ФНО) и, следовательно, проявлять эффективность при лечении заболеваний,характеризующихся матриксной металлопротеиназой или продуцированием фактора некроза опухоли, показана в следующих биологических испытаниях in vitro. Биологические испытания Ингибирование коллагеназы человека (ММР-1) Рекомбинантную коллагеназу человека активируют трипсином, используя следующее соотношение: 10 мкг трипсина на 100 мкг коллагеназы. Трипсин и коллагеназу инкубируют 10 при комнатной температуре в течение 10 мин,затем добавляют пятикратный избыток (50 мкг/10 мкг трипсина) соевого ингибитора трипсина. 10 мМ исходные растворы ингибиторов готовят в диметилсульфоксиде, а затем разводят, используя следующую схему: 10 мМ 120 мкМ 12 мкМ 1,2 мкМ 0,12 мкМ Трижды по двадцать пять микролитров каждой концентрации затем добавляют в соответствующие лунки 96-луночного микропланшета. Конечная концентрация ингибитора будет составлять разведение 1:4 после добавления фермента и субстрата. Позитивные контроли(фермент, ингибитор отсутствует) ставят в лунках D1-D6, а холостые контроли (нет фермента,нет ингибитора) ставят в лунках D7-D12. Коллагеназу разводят до 400 нг/мл, а затем 25 мкл добавляют в соответствующие лунки микропланшета. Конечная концентрация коллагеназы в образце для анализа составляет 100 нг/мл. Субстрат (Dnp-Pro-Cha-Gly-Cys(Me)-HisAla-Lys(NMA)-NH2) готовят в виде 5 мМ исходного раствора в диметилсульфоксиде, а затем разводят до 20 мкМ в буфере, используемом в анализе. Анализ инициируют добавлением 50 мкл субстрата на лунку микропланшета с получением конечной концентрации 10 мкМ. Показания флюоресценции (возбуждение при 360 нм, эмиссия при 460 нм) снимают во время 0, а затем через 20-минутные интервалы. Анализ проводят при комнатной температуре в течение обычного времени анализа 3 ч. Затем строят график зависимости флюоресценции от времени как для холостого контроля, так и для содержащих коллагеназу образцов (данные трех параллельных определений усредняют). Точку времени, которая соответствует хорошему сигналу (холостой контроль), и которая находится на линейной части кривой(обычно около 120 мин) выбирают для определения значений ИK50. Время ноль используют как холостой контроль для каждого соединения при каждой концентрации, и эти значения вычитают из данных на 120 мин. Данные наносят на график как концентрацию ингибитора против% контроля (флюоресценция ингибитора, деленная на флюоресценцию одной коллагеназы х 100). Значения ИК 50 определяют по концентрации ингибитора, которая дает сигнал, который составляет 50% от контроля. Если оказывается, что значения ИК 50 составляют величину 0,03 мкМ, то ингибиторы анализируют при концентрациях 0,3 мкМ, 0,03 мкМ, 0,03 мкМ и 0,003 мкМ. Ингибирование желатиназы (ММР-2) Ингибирование активности желатиназы определяют с использованием Dnp-Pro-Cha-GlyCys(Me)-His-Ala-Lys(NMA)-NH2 субстрата (10 11 мкМ) при тех же условиях, что и ингибирование коллагеназы человека (ММР-1). Желатиназу с молекулярной массой 72 кДа активируют 1 мМ АФМА (р-аминофенилмеркуриацетат) в течение 15 ч при 4 С и разводят до получения конечной концентрации образца для анализа 100 мг/мл. Ингибиторы разводят как для анализа ингибирования коллагеназы человека (ММР-1) до получения конечных концентраций в образце для анализа 30 мкМ, 3 мкМ, 0,3 мкМ и 0,03 мкМ. Каждую концентрацию готовят в трех экземплярах. Показания флюоресценции (возбуждение при 360 нм, эмиссия при 460) регистрируют во время ноль, а затем через 20-минутные интервалы в течение 4 ч. Значения ИK50 определяют так же, как при ингибировании коллагеназы человека (ММР-1). Если оказывается, что ИК 50 составляет величину менее чем 0,03 мкМ, то ингибиторы анализируют при конечных концентрациях 0,3 мкМ, 0,03 мкМ, 0,003 мкМ и 0,003 мкМ. Ингибирование активности стромелизина(ММР-3) Тест на ингибирование активности стромелизина основан на модифицированном спектрофотометрическом анализе, описанном Вейнгартеном и Федером (Weingarten, H. and Feder,J., Spectrophotometric Assay for Vertebrate Collagenase, Anal. Biochem. 147, 437-440 (1985. Гидролиз тиопептолидного субстрата [Ac-ProLeu-Gly-SCH[CH2CH(CH3)2]CO-Lue-Gly-OC2H5] приводит к получению меркаптанового фрагмента, который можно наблюдать в присутствии реагента Эллмана. Рекомбинантный простромелизин человека активируют трипсином, используя соотношение 1 мкл 10 мг/мл концентрированного раствора трипсина на 26 мкг стромелизина. Трипсин и стромелизин инкубируют при 37 С в течение 15 мин, после чего добавляют 10 мкл 10 мг/мл соевого ингибитора трипсина в течение 10 мин при 37 С для подавления активности трипсина. Анализы проводят в общем объеме 250 мкл буфера, используемого в анализе (200 мМ хлорида натрия, 50 мМ MES и 10 мМ хлорида кальция, рН 6,0) в 96-луночном микропланшете. Активированный стромелизин разводят в буфере, используемом в анализе, до 25 мкг/мл. Реагент Эллмана(3-карбокси-4-нитрофенилдисульфид) готовят в виде 1 М исходного раствора в диметилформамиде и разводят до 5 мМ в буфере, используемом в анализе, используя 50 мкл на лунку, с получением конечной концентрации 1 мМ. 10 мМ исходные растворы ингибиторов готовят в диметилсульфоксиде и разводят серийно в буфере, используемом в анализе, так,чтобы добавление 50 мкл в соответствующие лунки приводило к конечным концентрациям 3 12 мкМ, 0,3 мкМ, 0,003 мкМ и 0,0003 мкМ. Все условия выполняют трижды. 300 мМ исходный раствор пептидного субстрата в диметилсульфоксиде разводят до 15 мМ в буфере, используемом в анализе, и анализ инициируют добавлением 50 мкл в каждую лунку с получением конечной концентрации 3 мМ субстрата. Холостые контроли состоят из пептидного субстрата и реагента Эллмана без фермента. Образование продукта наблюдают при 405 нм на считывающем устройстве Molecular Device UVmax. Значения ИK50 определяют таким же способом, как и для коллагеназы. Ингибирование ММР-13 Рекомбинантный ММР-13 человека активируют 2 мМ АФМА (р-аминофенилмеркуриацетат) в течение 1,5 ч при 37 С и разводят до 400 мг/мл в буфере, используемом для анализа(50 мМ Трис, рН 7,5, 200 мМ хлорида натрия, 5 мМ хлорида кальция, 20 мM хлорида цинка,0,02 brij). Двадцать пять микролитров разведенного фермента добавляют на лунку 96 луночного микропланшета. Фермент затем разводят в отношении 1:4 для анализа добавлением ингибитора и субстрата с получением конечной концентрации для анализа 100 мг/мл. 10 мМ исходные растворы ингибиторов готовят в диметилсульфоксиде, а затем разводят в буфере, используемом в анализе, по схеме разведения ингибитора для ингибирования коллагеназы человека (ММР-1): двадцать пять микролитров каждой концентрации добавляют трижды в микропланшет. Конечными концентрациями в тесте являются 30 мкМ, 3 мкМ, 0,3 мкМ и 0,03 мкМ. Субстрат (Dnp-Pro-Cha-Gly-Cys(Me)-HisAla-Lys(NMA)-NH2) готовят так же, как и для ингибирования коллагеназы человека (ММР-1),и 50 мкл добавляют в каждую лунку с получением конечной концентрации для анализа 10 мкМ. Показания флюоресценции (возбуждение при 360 нм, эмиссия при 450) снимают во время 0 и каждые 5 мин в течение 1 ч. Положительные контроли состоят из фермента и субстрата без ингибитора, а холостые контроли состоят только из субстрата. Значения ИК 50 определяют также, как и для ингибирования коллагеназы человека(ММР-1). Если оказывается, что значения ИК 50 составляют величину менее чем 0,03 мкМ, ингибиторы затем анализируют при конечных концентрациях 0,3 мкМ, 0,03 мкМ, 0,003 мкМ и 0,0003 мкМ. Ингибирование продуцирования ФНО Способность соединений или их фармацевтически приемлемых солей ингибировать продуцирование ФНО и, следовательно, демонстрировать их эффективность при лечении заболеваний, в которые вовлечено продуцирование ФНО, показана следующим in vitro анализом: 13 Мононуклеарные клетки человека выделяли из антикоагулированной крови человека с использованием методики одностадийного разделения Ficollhypaque. (2) Мононуклеарные клетки трижды промывали в сбалансированном солевом растворе Хенкса (HBSS), содержащем двухвалентные катионы, и ресуспендировали до плотности 2 x 106/мл в HBSS, содержащем 1% БСА (бычьего сывороточного альбумина). Дифференциальные подсчеты, выполненные с использованием анализатора Abbott Cell Dyn 3500, показали, что моноциты составляли от 17 до 24% от общего количества клеток в этих препаратах. Аликвоты по 180 мкл суспензии клеток помещали в 96-луночный планшет с плоским дном (Costar). Добавляя соединения и LPS (липополисахариды) (конечная концентрация 100 нг/мл), получали конечный объем 200 мкл. Все условия выполняли трижды. После 4 ч инкубации при 37 С в увлажняемом СО 2 инкубаторе,планшеты вынимали и центрифугировали (10 мин при приблизительно 250 х g), и супернатанты удаляли и анализировали на ФНО- с использованием набора RD ELISA (твердофазный иммуноферментный анализ). Для введения млекопитающим, включая людей, для ингибирования матриксных металлопротеиназ или продуцирования фактора некроза опухоли (ФНО), можно использовать множество традиционных способов, включая пероральный, парентеральный и местный. Как правило, активное соединение будут вводить перорально или парентерально при дозировках между приблизительно 0,1 и 25 мг/кг веса тела субъекта, которого лечат, в сутки, предпочтительно от приблизительно 0,3 до 5 мг/кг. Однако некоторые отклонения в дозировке будут обязательно иметь место в зависимости от состояния субъекта, которого лечат. Лицо, ответственное за введение, в любом случае будет определять подходящую дозу для индивидуального субъекта. Соединения по настоящему изобретению можно вводить в широком разнообразии различных лекарственных форм. Как правило, терапевтически эффективные соединения по этому изобретению присутствуют в таких лекарственных формах при уровнях концентрации в интервале от приблизительно 5,0 до приблизительно 70 маc.%. Для перорального введения таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, фосфат кальция и глицин, могут быть использованы вместе с различными разрыхлителями, таким как крахмал (и предпочтительно кукурузный, картофельный или крахмал тапиоки), альгиновая кислота и некоторые сложные силикаты, вместе со связующими для гранулирования, такими как поливинилпирролидон, сахароза, желатин и ара 002594 14 вийская камедь. Дополнительно, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк часто очень полезны в целях таблетирования. Твердые композиции подобного типа также могут быть использованы в качестве наполнителей в желатиновых капсулах; предпочтительные материалы в этой связи также включают в себя лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии и/или эликсиры, активный ингредиент может быть комбинирован с различными подсластителями или корригентами, красящими веществами или красителями, и,если желательно, также эмульгирующими и/или суспендирующими агентами, вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их различными подобными комбинациями. В случае животных, их преимущественно включают в состав корма животного или питьевой воды в концентрации 5-5000 млн-1, предпочтительно 25-500 млн-1. Для парентерального введения (внутримышечное, внутрибрюшинное, подкожное и внутривенное применение) обычно готовят стерильный инъекционный раствор активного ингредиента. Могут быть использованы растворы терапевтического соединения по настоящему изобретению либо в кунжутном или арахисовом масле либо в водном пропиленгликоле. Водные растворы следует соответствующим образом отрегулировать и забуферить, предпочтительно при рН более чем 8, если необходимо, а жидкий разбавитель сначала сделать изотоничным. Эти водные растворы пригодны в целях внутривенных инъекций. Масляные растворы пригодны в целях внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех этих растворов в стерильных условиях легко осуществить стандартными фармацевтическими способами, хорошо известными специалистам. В случае животных, соединения можно вводить внутримышечно или подкожно при уровнях дозировки от приблизительно 0,1 до 50 мг/кг/сутки, преимущественно от 0,2 до 10 мг/кг/сутки, давая их как разовую дозу или до 3 раздельных доз. Настоящее изобретение иллюстрируется следующими примерами, но не ограничивается деталями таковых. Получение А. 4-(4-Фторфенокси)бензолсульфонилхлорид. Хлорсульфоновую кислоту (26 мл, 0,392 моля) добавляли по каплям к охлажденному на льду 4-фторфеноксибензолу (36,9 г, 0,196 моль) при механическом перемешивании. После добавления всего количества, смесь перемешивали при комнатной температуре в течение 4 ч. Смесь затем вливали в ледяную воду. Продукт,4-(4-фторфенокси)бензолсульфонилхлорид (18,6 г, 33%) собирали фильтрацией и высушивали на воздухе.(3,3 г, 83 ммоль) в воде смешивали с раствором 1-иод-3-метилбутана (11,3 мл, 86,4 ммоль) в изопропаноле (60 мл), и полученную смесь нагревали при температуре дефлегмации в течение 2 суток. Изопропанол удаляли выпариванием под вакуумом. Указанное в заголовке соединение, 10,0 граммов (87%), собирали фильтрацией,промывая изопропанолом. Получение В. 4-(3-Mетилбутокси)бензолсульфонилхлорид. Смесь 4-(3-метилбутокси)бензолсульфоната натрия (2,5 г, 9,4 ммоль), тионилхлорида(10 мл), и 5 капель N,N-диметилформамида нагревали при температуре дефлегмации в течение 5 ч. После охлаждения избыток тионилхлорида выпаривали, а остаток переносили в этилацетат. Раствор охлаждали в ледяной бане и добавляли воду. Органическую фазу отделяли и промывали водой и рассолом. После сушки над сульфатом натрия растворитель выпаривали с получением указанного в заголовке соединения в виде масла, 2,34 г (95%). Получение Г. 4-(2-Циклопентилэтокси)бензолсульфонат натрия. Раствор 4-гидроксибензолсульфоновой кислоты (6,5 г, 28,2 ммоль) и гидроксида натрия(2,2 г, 55 ммоль) в воде (15 мл) смешивали с раствором 2-(бромэтил)циклопентана (15,0 граммов, 84,7 ммоль) в изопропаноле (40 мл), и полученную смесь нагревали при температуре дефлегмации в течение 2 суток. Изопропанол удаляли выпариванием под вакуумом. Указанное в заголовке соединение, 4,7 г (57%), собирали фильтрацией, промывая изопропанолом. Получение Д. 4-(3-Метилбутокси)бензолсульфонилхлорид. Смесь 4-(2-циклопентилэтокси)бензолсульфоната натрия (2,5 г, 8,6 ммоль), тионилхлорида (15 мл) и нескольких капель N,Nдиметилформамида нагревали при температуре дефлегмации в течение 5 ч. После охлаждения избыток тионилхлорида выпаривали, а остаток переносили в этилацетат. Раствор охлаждали в ледяной бане и добавляли воду. Органическую фазу отделяли и промывали водой и рассолом. После сушки над сульфатом натрия растворитель выпаривали с получением указанного в заголовке соединения в виде масла, 2,24 г (90%). Получение E. 4'-Фторбифенилсульфонилхлорид. Хлорсульфоновую кислоту (8,7 мл, 0,13 моль) добавляли по каплям к 4-фторбифенилу(10,2 г, 59 ммоль) при перемешивании на ледяной бане. Перемешивание продолжали при охлаждении во льду в течение 0,5 ч, а затем реакционную смесь выливали на лед. Полученный белый осадок собирали фильтрацией и растворяли в хлороформе. Хлороформовый раствор 16 промывали водой и рассолом, сушили над сульфатом магния и концентрировали с получением белого твердого вещества. Целевой продукт, 4'фторбифенилсульфонилхлорид (4,3 г, 27%), отделяли от 4'-фторбифенилсульфоновой кислоты(нежелательный побочный продукт) кристаллизацией последней из этилацетата и кристаллизацией оставшегося вещества из гексана. Получение Ж 4-(4-Фторбензилокси)бензолсульфонат натрия. К раствору 4-гидроксибензолсульфоновой кислоты (5,13 г, 22,1 ммоль) в 1 н. водном растворе гидроксида натрия (23 мл) добавляли раствор 4-фторбензилбромида (3,3 мл, 26,5 ммоль) в этаноле (20 мл). Полученную смесь нагревали при температуре дефлегмации в течение 2 суток. После охлаждения и стояния, осаждалось белое твердое вещество. Осажденный продукт,4-(4-фторбенезилокси)бензолсульфонат натрия,4,95 г (74%), собирали фильтрацией, промывая этилацетатом и диэтиловым эфиром. Получение З. 4-(4-Фторбензилокси)бензолсульфонилхлорид. К суспензии 4-(4-фторбензилокси)бензолсульфоната натрия (0,5 г, 1,64 ммоль) в метиленхлориде (5 мл) добавляли пентахлорид фосфора (275 мг, 1,31 ммоль). Полученную смесь нагревали при температуре дефлегмации в течение 7 ч. После охлаждения в ледяной бане и прекращения реакции водой (15 мл) смесь экстрагировали этилацетатом. Органическую фазу промывали рассолом, сушили над сульфатом натрия и концентрировали с получением 4-(4 фторбензилокси)бензолсульфонил хлорида в виде белого твердого вещества (130 мг, 26%). Получение И. 4-(4-Хлорфенокси)бензолсульфонилхлорид. Хлорсульфоновую кислоту (9,7 мл, 0,147 моль) добавляли по каплям к 4 хлорфеноксибензолу (12,6 мл, 73,4 ммоль) при комнатной температуре при перемешивании. После окончания добавления смесь перемешивали при комнатной температуре в течение 1 ч,а затем вливали в ледяную воду. Твердое вещество собирали фильтрованием, сушили на воздухе и перекристаллизовывали из петролейного эфира и этилацетата с получением 4-(4 хлорфенокси)бензолсульфонилхлорида (7,43 г,33%). Пример 1. 1-(4-Метоксибензолсульфониламино)циклопентан-1-карбоновой кислоты гидроксиамид.(А) К раствору 1-аминоциклопентан-1 карбоновой кислоты (6,0 г, 46,5 ммоль) и триэтиламина (14 мл, 100 ммоль) в диоксане (90 мл) и воде (90 мл) добавляли 4-метоксибензолсульфонилхлорид (10,6 г, 51,3 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4 ч, подкисляли 1 н. водным раствором соляной кислоты и экстрагировали дважды этилацетатом. Объединенные этилацетатные экстракты промывали рассолом, 17 сушили над сульфатом магния и концентрировали с получением желто-коричневого твердого вещества, которое растирали с хлороформом с получением 1-(4-метоксибензолсульфониламино)циклопентан-1-карбоновой кислоты в виде белого твердого вещества, 5,42 г (39%).(бензотриазол-1-илокси)трис(диметиламино)фосфония (7,4 г, 16,3 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2,5 суток. Растворитель выпаривали, и остаток переносили в этилацетат. Раствор промывали последовательно 0,5 н. водным раствором соляной кислоты, водой и рассолом. После сушки над сульфатом магния растворитель выпаривали с получением бензотриазол-1-илового эфира 1-(4 метоксибензолсульфониламино)-циклопентанкарбоновой кислоты в виде желтого твердого вещества. Его растворяли вN,Nдиметилформамиде (120 мл) и к полученному раствору добавляли диизопропилэтиламин (5,3 мл, 30 ммоль) и O-бензилгидроксиламина гидрохлорид (3,2 г, 20 ммоль). Смесь нагревали на масляной бане при 50 С в течение 20 ч. Растворитель выпаривали и добавляли этилацетат. Смесь фильтровали для сбора белого твердого вещества. Фильтрат промывали последовательно 0,5 н. водным раствором соляной кислоты,водным насыщенным раствором бикарбоната натрия и рассолом. После выпаривания растворителя получали твердое вещество, которое объединяли с веществом, выделенным фильтрацией и растирали с этилацетатом с получением бензилоксиамида 1-(4-метоксибензолсульфониламино)циклопентан-1-карбоновой кислоты в виде белого твердого вещества, 2,92 г (47%).(В) Раствор бензилоксиамида 1-(4 метоксибензолсульфониламино)-циклопентан 1-карбоновой кислоты (1,50 г, 3,71 ммоль) в метаноле (200 мл) обрабатывали 5% палладием на сульфате бария (0,75 г) и гидрировали при давлении 3 атмосферы в течение 3,5 ч в шейкере Парра. Катализатор удаляли пропусканием через 0,45 мкм нейлоновый фильтр, и фильтрат концентрировали с получением гидроксиамида 1-(4-метоксибензолсульфониламино)циклопентан-1-карбоновой кислоты в виде белого твердого вещества, 1,13 г (97%). Массспектроскопия (МС): 313 (М-1). Указанные в заголовках примеров 2-8 соединения были получены способом, аналогичным способу, описанному в примере 1, с использованием указанных реагентов. Пример 2. 1-(4-Метоксибензолсульфониламино)циклогексан-1-карбоновой кислоты гидроксиамид.(A) Раствор гидрохлорида бензилового эфира 2-амино-2-метилпропионовой кислоты (12,0 г, 52,2 ммоль) и 4-метоксибензолсульфонилхлорида (11,9 г,57,6 ммоль) в диоксане (100 мл) и воде (100 мл) охлаждали в ледяной бане. Затем добавляли триэтиламин (18,2 мл, 0,13 моль). Ледяную баню убирали, и реакционную смесь оставляли перемешиваться при комнатной температуре в течение 2 суток. Растворители удаляли под вакуумом, и остаток переносили в этилацетат и воду. Водный слой отделяли и экстрагировали дважды этилацетатом. Объединенные органические слои промывали насыщенным водным раствором бикарбоната натрия, 1 н. водным раствором соляной кислоты и рассолом. После сушки над сульфатом 19 натрия растворитель выпаривали, пока не останется желтое масло (19,3 г), часть которого (10 г) хроматографировали на силикагеле, элюируя смесью 3:7 ацетат/гексан, с получением, после перекристаллизации из смеси этилацетат/гексан, бензилового эфира 2-(4-метоксибензолсульфониламино)-2-метилпропионовой кислоты в виде белого твердого вещества,6,59 г (67%).(Б) Раствор бензилового эфира 2-(4 метоксибензолсульфониламино)-2-метилпропионовой кислоты (1,5 г, 4,13 ммоль) в этаноле (80 мл) обрабатывали 10% палладием на угле (0,17 г) и гидрировали при давлении 3 атмосферы в течение 1,5 ч в шейкере Парра. Катализатор удаляли пропусканием через 0,45 мкм нейлоновый фильтр, и фильтрат концентрировали с получением 2-(4 метоксибензолсульфониламино)-2-метилпропионовой кислоты в виде белого твердого вещества, 1,09 г (96%).(B) Раствор 2-(4-метоксибензолсульфониламино)-2-метилпропионовой кислоты (1,08 г, 3,95 ммоль) в метиленхлориде (120 мл) охлаждали в ледяной бане. Последовательно добавляли триэтиламин (2,2 мл, 15,8 ммоль), гексафторфосфат(бензотриазол-1-илокси)трис(диметиламино)-фосфония (2,6 г, 5,88 ммоль) и Oбензилгидроксиамина гидрохлорид (0,95 г, 5,95 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель выпаривали, и остаток переносили в этилацетат. Раствор промывали последовательно 1 н. водным раствором соляной кислоты, водным насыщенным раствором бикарбоната натрия, водой и рассолом. После сушки над сульфатом натрия растворитель выпаривали с получением масла, из которого хроматографией на силикагеле, элюируя смесью 1:2 ацетат/гексан,получали целевой продукт, N-бензилокси-2-(4 метоксибензолсульфонила-мино)-2 метилпропионамид (1,41 г, 95%), белое твердое вещество.(80 мл) обрабатывали 5% палладием на сульфате бария (0,75 г) и гидрировали при давлении 3 атмосферы в течение 1,5 ч в шейкере Парра. Катализатор удаляли пропусканием через 0,45 мкм нейлоновый фильтр, и фильтрат концентрировали с получением N-гидрокси-2-(4 метиоксибензолсульфониламино)-2-метилпропионамида в виде белого твердого вещества,1,06 г (100%). Т.пл.: 122-125 С. МС: 289 (М-1): Анализ: Вычислено для C11H16N2O5S: С, 45,82,Н, 5,59, N, 9,72; Найдено: С, 45,88, Н, 5,60, N,9,69. Указанные в заголовках примеров 10-12 соединения были получены способом, аналогичным способу, описанному в примере 9, с использованием указанных реагентов. 20 Пример 10. 2-[4-(4-Фторфенокси)бензолсульфониламино]-N-гидрокси-2-метилпропионамид. Гидрохлорид бензилового эфира 2-амино 2-метилпропионовой кислоты; 4-(4-фторфенокси)-бензолсульфонилхлорид. Т.пл.: 133-134 С. МС: 369 (М+1), Анализ: Вычислено для C16H17FN2O5S: С, 52,17, Н, 4,65,N, 7,60; Найдено: С, 52,21, Н, 4,83, N, 7,80. Пример 11. N-Гидрокси-2-метил-2-[4-(3 метилбутокси)бензолсульфониламино]-пропионамид. Гидрохлорид бензилового эфира 2-амино-2 метилпропионовой кислоты; 4-(3-метилбутокси)-бензолсульфонилхлорид. Перекристаллизован из этилацетата/гексана. Т.пл.: 126,5-128 С. МС: 343 (М-1), Анализ: Вычислено дляC15H24N2O5S: С, 52,31, Н, 7,02, N, 8,13; Найдено: С,52,30, Н, 7,07, N, 8,16. Пример 12. 2-[4-(2-Циклопентилэтокси)бензолсульфониламино]-N-гидрокси-2-метил пропионамид. Гидрохлорид бензилового эфира 2-амино 2-метилпропионовой кислоты; 4-(2-циклопентилэтокси)бензолсульфонилхлорид. Перекристаллизован из смеси этилацетат/гексан. Т.пл.: 126-127 С. МС: 369 (М-1), Анализ: Вычислено для C17H26N2O5S: С, 55,12, Н, 7,07, N, 7,56; Найдено: С, 55,46, Н, 7,09, N, 7,38. Пример 13. N-Гидрокси-2-метил-2-(5 пиридин-2-илтиофен-2-сульфониламино)пропионамид.(А) К раствору 2-амино-2-метилпропионовой кислоты (2,0 г, 19,4 ммоль) в 1 н. водном растворе гидроксида натрия (45 мл) и диоксана(45 мл) добавляли 5-пиридин-2-илтиофен-2 сульфонилхлорид (8,41 г, 32,4 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч. К реакционной смеси добавляли дополнительно 1 н. водный раствор гидроксида натрия (45 мл), и ее затем экстрагировали диэтиловым эфиром. Органические экстракты отбрасывали. Водный слой подкисляли 1 н. раствором соляной кислоты и экстрагировали этилацетатом. Этилацетатные фракции промывали рассолом, сушили над сульфатом магния и концентрировали с получением 2 метил-2-(5-пиридин-2-илтиофен-2-сульфониламино)пропионовой кислоты в виде белого твердого вещества (2,18 г, 34%).(160 мл) добавляли триэтиламин (2,3 мл, 16,5 ммоль), гексафторфосфат (бензотриазол-1 илокси)трис(диметиламино)фосфония (2.4 г,5.41 ммоль) и гидрохлорид O-(2-триметилсилилэтил)гидроксиламина (0,92 г, 5,41 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель выпаривали, а остаток переносили в этилацетат. Раствор промывали водой, водным 21 насыщенным раствором бикарбоната натрия и рассолом. После сушки над сульфатом магния растворитель выпаривали с получением белой пены, из которой путем хроматографии на силикагеле, элюируя смесью 3:2 этилацетат/гексаны, получали целевой продукт, 2 метил-2-(5-пиридин-2-илтиофен-2-сульфониламино)-N-(2-триметилсиланэтокси)пропионамид (220 мг, 10%), белое вещество.(В) 2-Метил-2-(5-пиридин-2-илтиофен-2 сульфониламино)-N-(2-триметилсиланилэтокси)пропионамид (80 мг, 0,18 ммоль) растворяли в трифторуксусной кислоте, и полученный раствор перемешивали при комнатной температуре в течение 16 ч. Трифторуксусную кислоту выпаривали под вакуумом, прогоняя с метанолом, с получением N-гидрокси-2-метил 2-(5-пиридин-2-илтиофен-2-сульфониламино)пропионамид, желтого масла (60 мг, 97%), которое кристаллизовали из этанола. Т.пл.: 165166 С. МС: 342 (М+1). Указанные в заголовках примеров 14-15 соединения получали способом, аналогичным способу, описанному в примере 13, с использованием указанных реагентов. Пример 14. 1-(5-Пиридин-2-илтиофен-2 сульфониламино)циклопентан-1-карбоновой кислоты гидроксиамид. 1-Аминоциклопентан-1-карбоновая кислота; 5-пиридин-2-илтиофен-2-сульфонилхлорид. МС: 368 (М+1). Пример 15. 1-[4-(4-Хлорфенокси)бензолсульфониламино]циклопропан-1-карбоновой кислоты гидроксиамид. 1-Аминоциклопропан-1-карбоновая кислота; 4-(4-хлорфенокси)бензолсульфонилхлорид. МС: 381 (М-1). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или его фармацевтически приемлемые соли, где(С 1-С 6)алкила, или R1 и R2 могут быть взяты вместе с образованием (С 3-С 6)циклоалкила или группы формулы где n и m независимо равны 1 или 2, и Х представляет собой О; и Q является (С 6-С 10)арилом,(С 6-С 10)арилокси(С 6-С 10)арилом, (С 6-С 10)арил(С 6-С 10)арилом, (С 2-С 9)гетероарил(С 2-С 9)гетероарилом, (C1-С 6)алкокси(С 6-С 10)арилом, (С 6 С 10)арил(С 1-С 6)алкокси(С 6-С 10)арилом, где каждая арильная группа возможно замещена фторо,хлоро или (С 1-С 6)алкокси, и где (С 6-С 10)арил представляет собой фенил или нафтил, и (С 2 С 9)гетероарил представляет собой моно- или 22 бициклическое гетероциклическое ароматическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из N, S или О. 2. Соединение по п.1, где R1 и R2 взяты вместе с образованием (С 3-С 6)циклоалкила или группы формулы(С 6-С 10)арилом,С 10)арилом, (С 2-С 9)гетероарил(С 2-С 9)гетероарилом. 10. Соединение по п.1, где R1 и R2, каждый независимо, являются (С 1-С 6)алкилом; и Q является (С 6-С 10)арилокси(С 6-С 10)арилом. 11. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из гидроксиамида 1-[4-(4-фторфенокси)бензолсульфониламиноциклопропан-1-карбоновой кислоты; гидроксиамида 1-[4-(4-хлорфенокси)бензолсульфониламино]циклопропан-1-карбоновой кислоты; гидроксиамида 1-[4-(4-фторфенокси)бензолсульфониламино]циклобутан-1-карбоновой кислоты; гидроксиамида 1-[4-(4-фторфенокси)бензолсульфониламино]циклопентан-1-карбоновой кислоты;N-гидрокси-2-метил-2-(5-пиридин-2 илтиофен-2-сульфониламино]пропионамида; гидроксиамида 1-(5-пиридин-2-ил-тиофен 2-сульфониламино)циклопентан-1-карбоновой кислоты; и гидроксиамида 1-(4'-фторбифенил-4-сульфониламино)циклопентан-1-карбоновой кислоты. 12. Фармацевтическая композиция для (а) лечения состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани,дегенерации желтого пятна, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза, склерита, в комбинации со стандартными НСПВС и анальгетиками и в комбинации с цитотоксическими противораковыми агентами, и других заболеваний, характеризующихся активностью матриксных металлопротеиназ, СПИДа, сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование фактора некроза опухоли (ФНО),или для (б) ингибирования матриксных металлопротеиназ или продуцирования фактора некроза опухоли (ФНО), у млекопитающего, включая человека, содержащая соединение по п.1 в количестве, эффективном при таком лечении, и фармацевтически приемлемый носитель. 13. Фармацевтическая композиция для (а) лечения состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани,дегенерации желтого пятна, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза, склерита и других заболеваний,характеризующихся активностью матриксных металлопротеиназ, СПИДа, сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование фактора некроза опухоли (ФНО), или для (б) ингибирования 24 матриксных металлопротеиназ или продуцирования фактора некроза опухоли (ФНО), у млекопитающего, включая человека, содержащая соединение по п.1 в количестве, эффективном при таком лечении, и фармацевтически приемлемый носитель. 14. Способ ингибирования (а) матриксных металлопротеиназ или (б) продуцирования фактора некроза опухоли (ФНО) у млекопитающего, включая человека, при котором указанному млекопитающему вводят эффективное количество соединения формулы по п.1. 15. Способ лечения состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани, дегенерации желтого пятна, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза, склерита, соединения формулы I могут быть использованы в комбинации со стандартными НСПВС и анальгетиками и в комбинации с цитотоксическими противораковыми агентами, и других заболеваний,характеризующихся активностью матриксных металлопротеиназ, СПИДа, сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование фактора некроза опухоли (ФНО), у млекопитающего, включая человека, при котором указанному млекопитающему вводят соединение по п.1 в количестве, эффективном при лечении такого состояния. 16. Способ лечения состояния, выбранного из группы, состоящей из артрита, рака, изъязвления ткани, дегенерации желтого пятна, рестеноза, заболевания периодонта, врожденного буллезного эпидермолиза, склерита и других заболеваний, характеризующихся активностью матриксных металлопротеиназ, СПИДа, сепсиса, септического шока и других заболеваний, в которые вовлечено продуцирование фактора некроза опухоли (ФНО), у млекопитающего,включая человека, при котором указанному млекопитающему вводят соединение по п.1 в количестве, эффективном при лечении такого состояния.
МПК / Метки
МПК: A61P 35/00, C07D 409/04, A61K 31/18, C07C 311/29
Метки: производные, кислоты, арилсульфониламиногидроксамовой
Код ссылки
<a href="https://eas.patents.su/13-2594-proizvodnye-arilsulfonilaminogidroksamovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Производные арилсульфониламиногидроксамовой кислоты</a>
Предыдущий патент: N-связанные сульфонамиды гетероциклических тиоэфиров
Следующий патент: Фармацевтический препарат, содержащий амоксициллин и клавуланат, способ его приготовления и гранулят, содержащий амоксициллин и клавуланат
Случайный патент: Высокочастотная сетевая мультиплексированная передача данных по различным линиям с использованием множества модулированных несущих частот

















