Пространственно затрудненные нафтоксииминовые бидентатные и тридентатные лиганды и металлические комплексы с этими лигандами
Номер патента: 18057
Опубликовано: 30.05.2013
Авторы: Кириллов Евгений, Разави Аббас, Карпантье Жан-Франсуа
Формула / Реферат
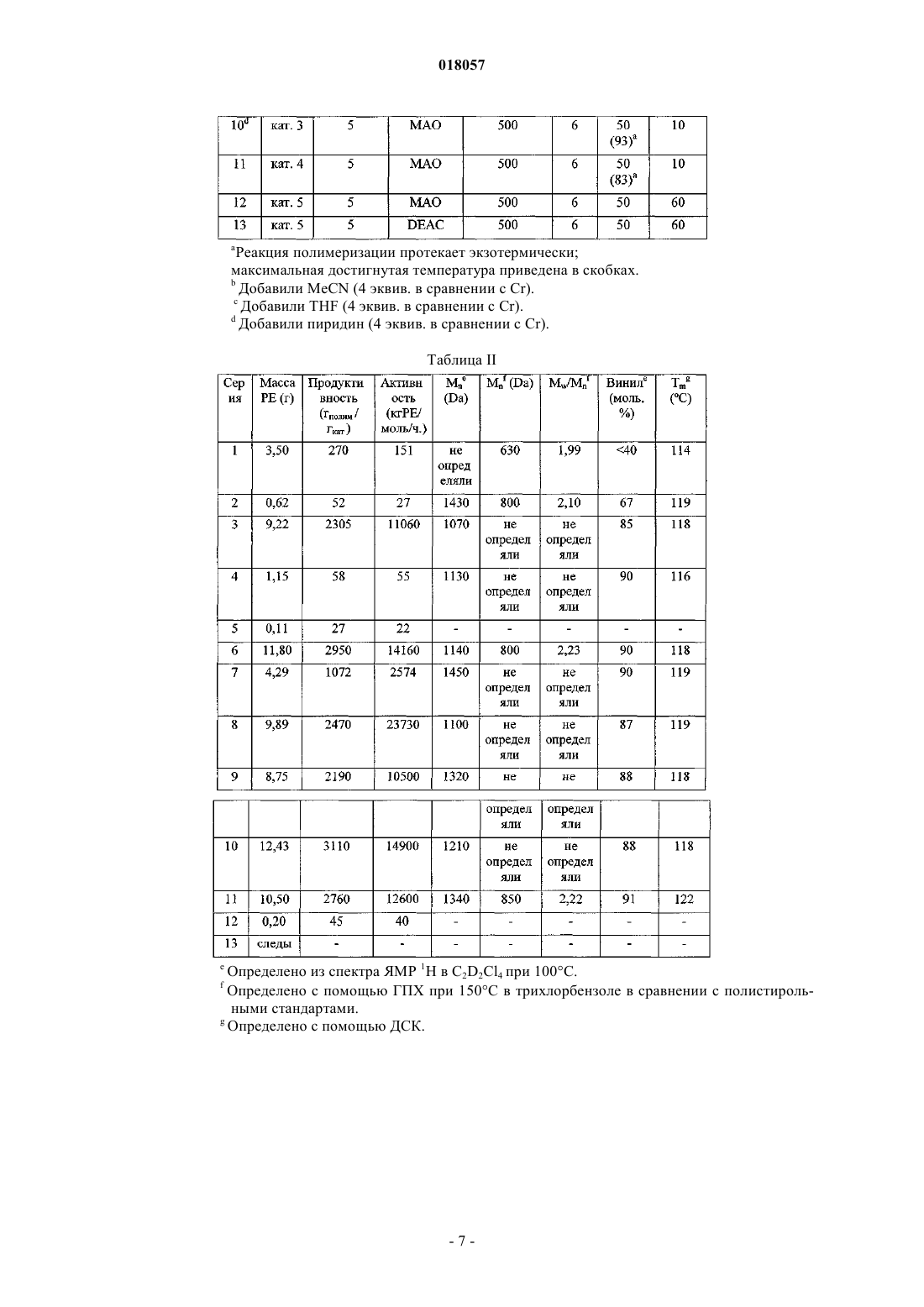
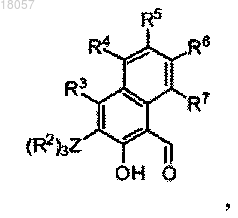
1. Лиганд формулы I или его таутомерная форма формулы I'

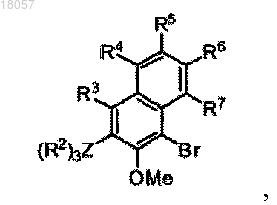
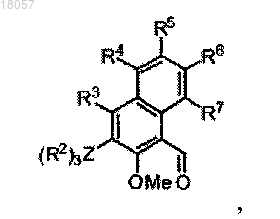
где каждый из R1, R3, R4, R5, R6 и R7 является водородом,
Z является Si,
R2 является фенильной группой,
R8 является СН2-(2-пиридилом), альфа-хинолином или C6F5.
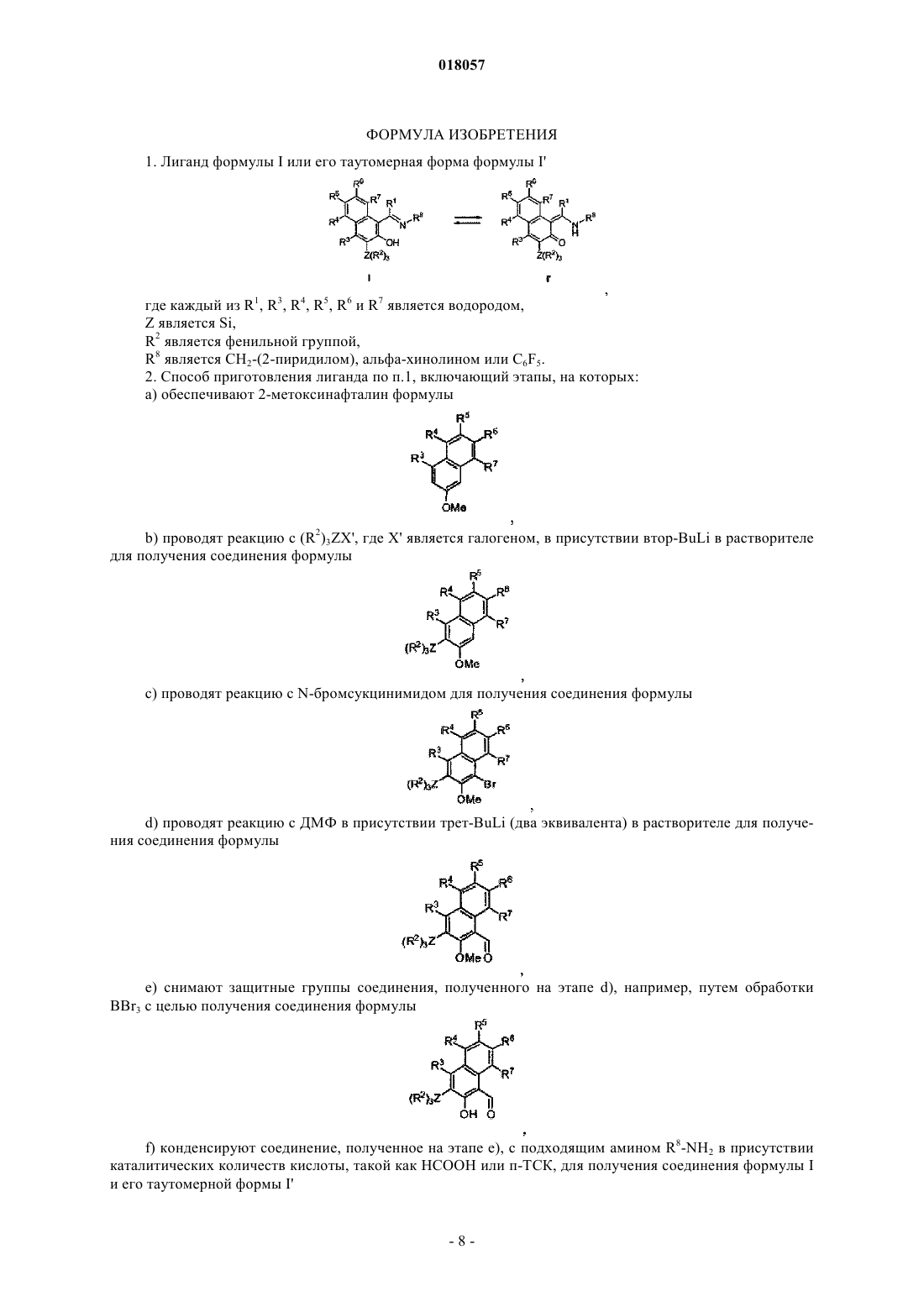
2. Способ приготовления лиганда по п.1, включающий этапы, на которых:
а) обеспечивают 2-метоксинафталин формулы
b) проводят реакцию с (R2)3ZX', где X' является галогеном, в присутствии втор-BuLi в растворителе для получения соединения формулы

с) проводят реакцию с N-бромсукцинимидом для получения соединения формулы
d) проводят реакцию с ДМФ в присутствии трет-BuLi (два эквивалента) в растворителе для получения соединения формулы
е) снимают защитные группы соединения, полученного на этапе d), например, путем обработки BBr3 с целью получения соединения формулы
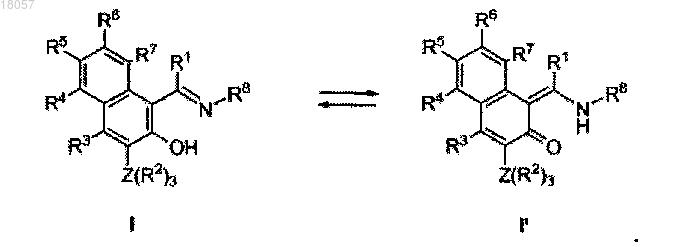
f) конденсируют соединение, полученное на этапе е), с подходящим амином R8-NH2 в присутствии каталитических количеств кислоты, такой как НСООН или п-ТСК, для получения соединения формулы I и его таутомерной формы I'.
3. Металлический комплекс формулы II
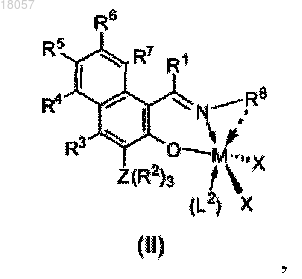
где М является металлом Группы 6 Периодической таблицы, предпочтительно хромом, где все X являются одинаковыми и являются Br, или один X является паратолилом, а другой X является Br, где L2 является растворителем, таким как, например, ацетонитрил, THF (тетрагидрофуран) или пиридин, предпочтительно ацетонитрил, где все другие параметры являются такими, как описано выше.
4. Способ приготовления металлического комплекса по п.3, при котором проводят реакцию комплексообразования лиганда по п.1 с металлической солью MXn, где М является металлом Группы 6 Периодической таблицы, предпочтительно хромом, где или все X являются одинаковыми и являются Br, или один X является паратолилом, а другой X является Br, в растворителе, таком как, например, ацетонитрил, THF (тетрагидрофуран) или пиридин, предпочтительно ацетонитрил.
5. Каталитическая система для полимеризации олефинов, содержащая металлический комплекс по п.3 и активирующее средство, имеющее ионизирующее действие, выбранное из алкила алюминия, алюмоксана или борсодержащего средства.
6. Способ олиго-, гомо- или сополимеризации этилена и альфа-олефинов, включающий этапы, на которых:
а) вводят каталитическую систему по п.5 в реактор;
b) вводят мономер и необязательный сомономер или до, или после, или одновременно с этапом а);
c) поддерживают при условиях полимеризации;
d) извлекают олигомеры и/или полимер.
7. Способ по п.6, где мономер является этиленом или пропиленом, предпочтительно этиленом, и необязательный сомономер является пропиленом или 1-гексеном.
Текст
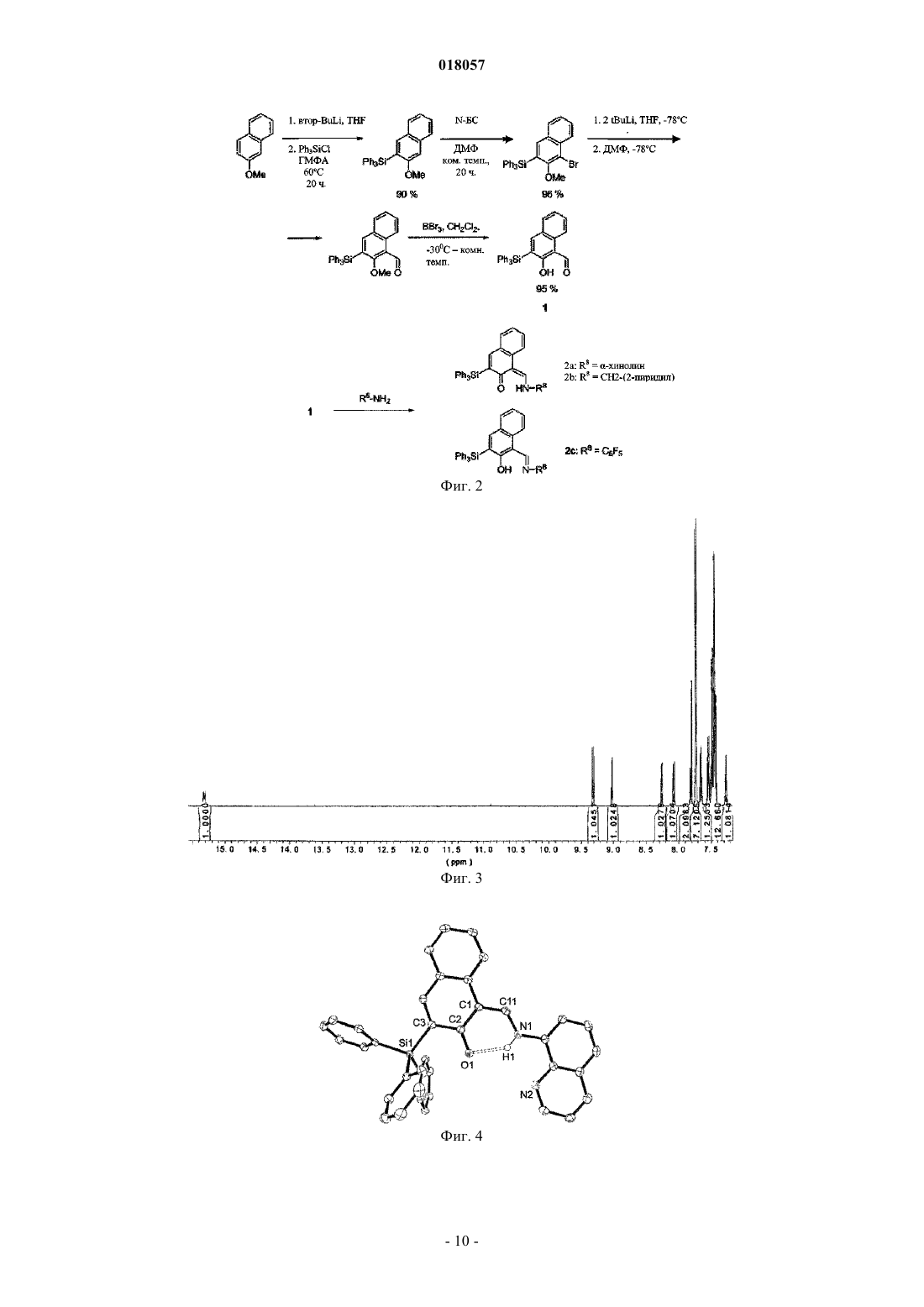
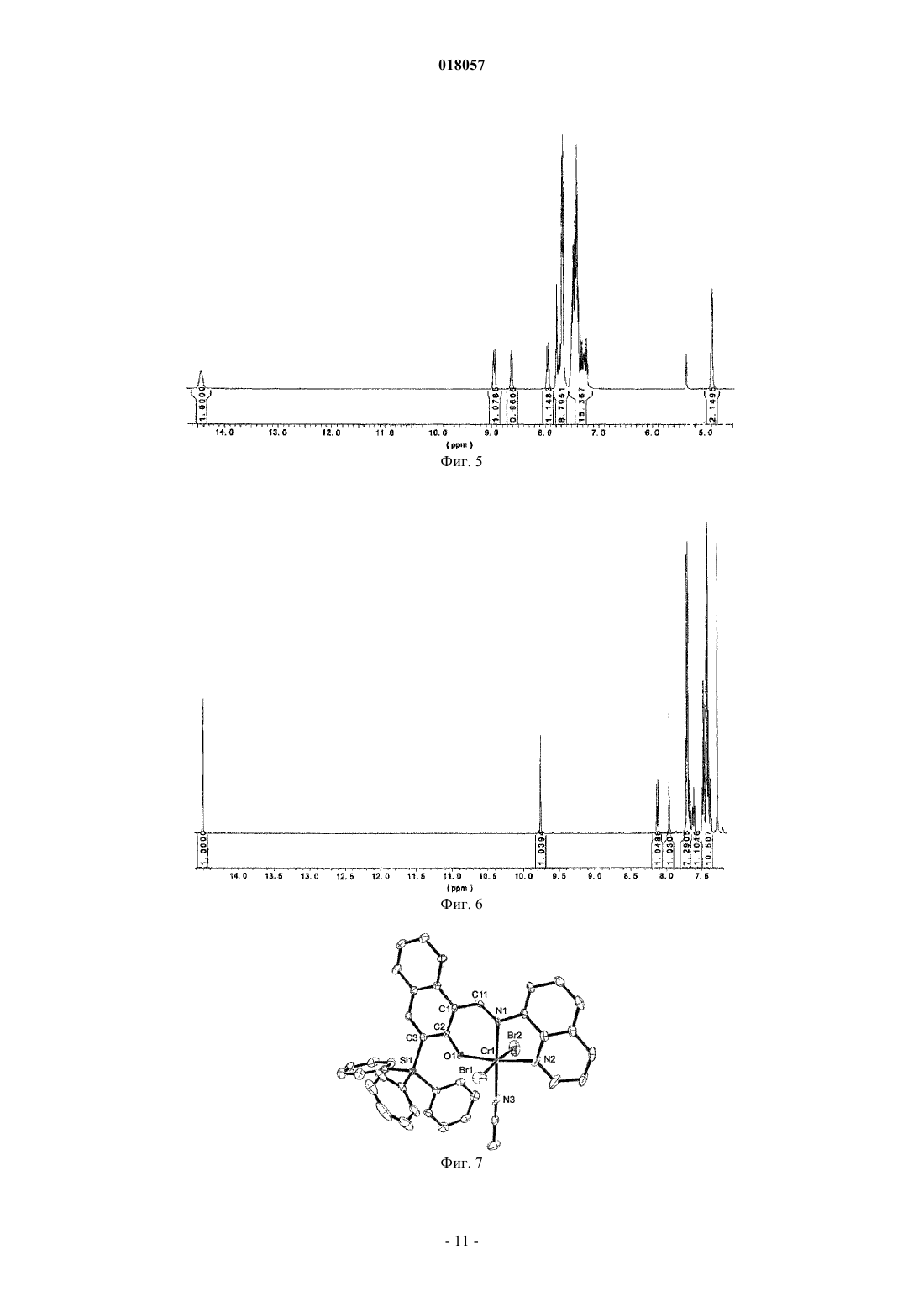
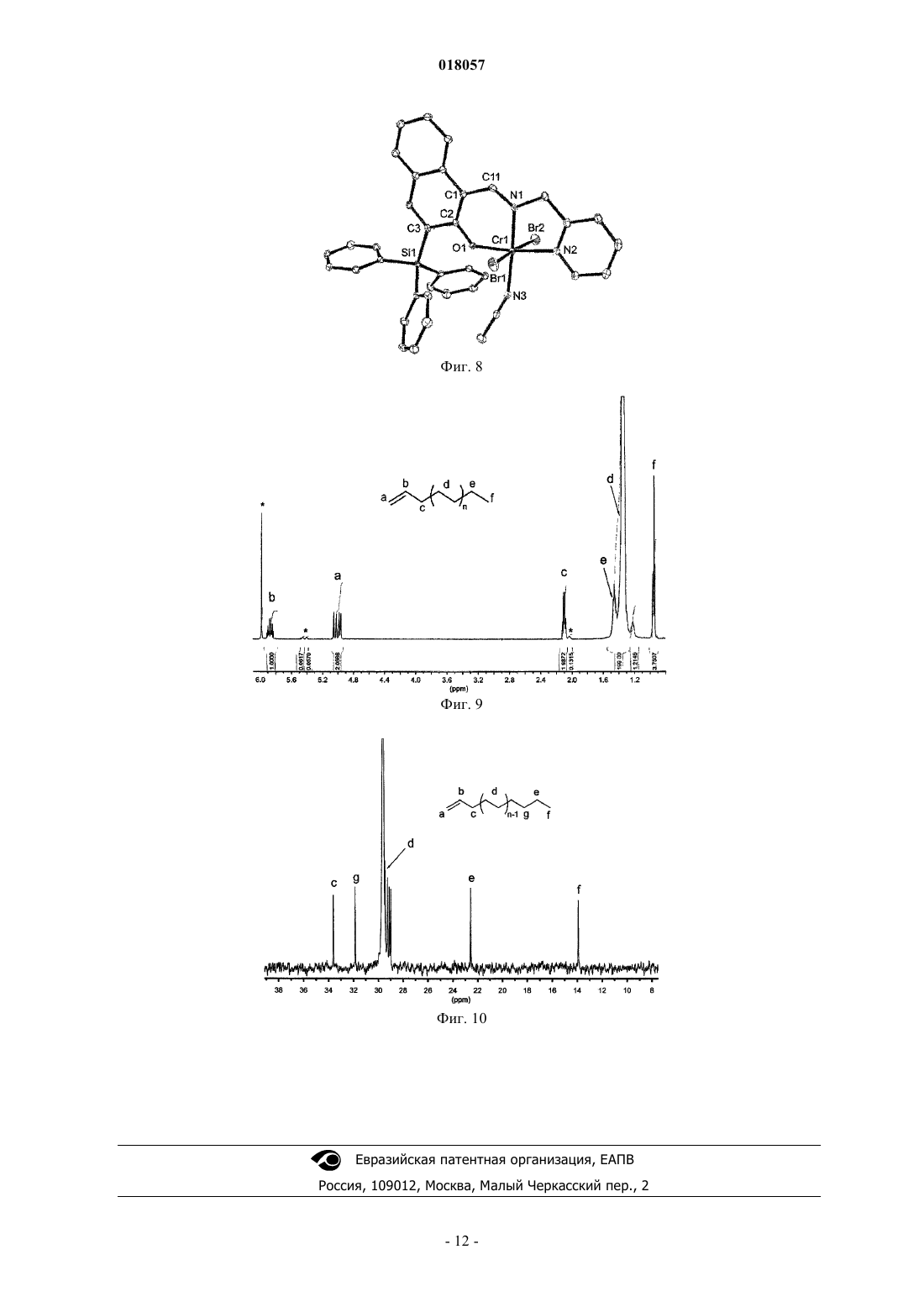
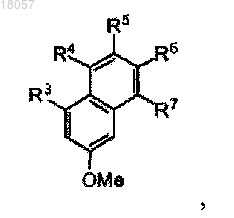
ПРОСТРАНСТВЕННО ЗАТРУДНЕННЫЕ НАФТОКСИИМИНОВЫЕ БИДЕНТАТНЫЕ И ТРИДЕНТАТНЫЕ ЛИГАНДЫ И МЕТАЛЛИЧЕСКИЕ КОМПЛЕКСЫ С ЭТИМИ ЛИГАНДАМИ Данное изобретение раскрывает постметаллоценовые комплексы, основанные на пространственно затрудненных би- и тридентных нафтоксииминовых лигандах. Оно также относится к применению таких постметаллоценовых комплексов в олигомеризации этилена для селективного приготовления линейных альфа-олефинов, кэппированных на конце винилом.(71)(73) Заявитель и патентовладелец: ТОТАЛ ПЕТРОКЕМИКАЛЗ РЕСЕРЧ ФЕЛЮИ (BE); САНТР НАСИОНАЛЬ ДЕ ЛЯ РЕШЕРШ СЬЯНТИФИК Данное изобретение относится к области пост-металлоценовых комплексов, основанных на пространственно затрудненных би- и тридентатных нафтоксииминовых лигандах. Оно также относится к применению таких постметаллоценовых комплексов в олигомеризации этилена для селективного приготовления линейных альфа-олефинов, кэппированных на конце винилом. Существует потребность в новых высокоактивных каталитических системах полимеризации алкена,основанных на постметаллоценах, и многие исследования были проведены в этой области, такие как рассмотренные, например, у Gibson и Sptizmesser (Gibson, V. С; Spitzmesser, S. K. in Chem. Rev. 2003, 103,283), или у Ittel и др. (Ittel, S. D.; Johnson, L. K.; Brookhart, M. in Chem. Rev. 2000, 100, 1169), или у Britovsek и др. (Britovsek, G. J. P.; Gibson, V. C; Wass, D. F. in Angew. Chem., Int. Ed. 1999, 38,429). Среди множества недавно раскрытых каталитических систем отдельная группа 3-6 металлических комплексов, несущих различные хелатирующие лиганди на основе арилоксида, наглядно показывает удивительные характеристики при полимеризации этилена и -олефинов. В частности, промышленно применимые высокоэффективные феноксииминовые системы на основе Сг(Ш) были исследованы Gibson и др., такие как раскрытые, например, у Jones и др. (Jones, D.J.; Gibson, V.C.; Green, S. M.; Maddox, P.J.;(Gibson, V.C.; O'Reilly, R.K. в патентном документе США 20060258867 А 1), или у Gibson и др. (Gibson,V.C.; Mastroianni, S.; Newton, С; Redshaw, С; Solan, G.A.; White, A.J. P.; Williams, D.J. Dalton Trans. 2000,1969). Типичные металлические комплексы этого семейства представлены на фиг. 1. Перечень фигур Фиг. 1 представляет различные феноксиимино соединения Cr(III), раскрытые в литературе, которые подходят для олигомеризации или полимеризации этилена. Фиг. 2 - схему, применяемую для приготовления ONNH и ONH лигандов. Фиг. 3 - спектр ЯМР 1 Н лиганда 2 а. Фиг. 4 - молекулярную структуру лиганда 2 а. Фиг. 5 - спектр ЯМР 1 Н лиганда 2b. Фиг. 6 - спектр ЯМР 1 Н лиганда 2 с. Фиг. 7 - молекулярную структуру хромового комплекса 3a. Фиг. 8 - молекулярную структуру хромового комплекса 3b. Фиг. 9 - типичный спектр ЯМР 1 Н олигоэтиленов, кэппированных на конце винилом, полученных с помощью системы 3a/МАО (метилалюмоксан). Фиг. 10 - типичный спектр ЯМР 13 С (область сильного поля) олигоэтиленов, кэппированных на конце винилом, полученных с помощью системы 3a/МАО. Однако по-прежнему существует потребность в разработке новых, особо активных каталитических систем, имеющих специфические функциональные группы для того, чтобы сшивать полимеры с желаемыми свойствами. Целью данного изобретения является приготовление пространственно затрудненных лигандов на основе нафтоксигрупп. Также целью данного изобретения является приготовление особо активных каталитических систем для олигомеризации и полимеризации этилена и альфа-олефинов. Каждая из этих целей, по меньшей мере, частично, достигается данным изобретением. Следовательно, данное изобретение раскрывает лиганд формулы I или его таутомерную форму формулы I где каждый R1, R3, R4, R5, R6 и R7 является водородом, Z является Si, R2 является фенильной группой, R8 является СН 2-(2-пиридилом), альфа-хинолином или C6F5. Данный лиганд включает нафтокси группу, тогда как большинство лигандов, раскрытых в уровне техники, включают фенокси группу. Каталитические системы для полимеризации олефинов, основанные на данном лиганде, который включает нафтоксигруппу, являются более устойчивыми благодаря сочетанию пространственных и/или электронных эффектов. К тому же, в лигандах согласно данному изобретению Z является Si. Замещение C на Si также приводит к улучшению устойчивости каталитической системы. Например, в каталитической системе, где Z является C, нейтрализуется ее активность посредством добавления ацетонитрила, тогда как нет наблюдаемого изменения или в активности, или в свойствах олигомера/полимера для эквивалентной каталити-1 018057 ческой системы, где Z является Si. Были протестированы несколько методик с целью приготовления лигандов данного изобретения,большинство из них без успеха. Они могут быть приготовлены с высоким выходом продукта из начального 2-метоксинафталина посредством способа, включающего этапы, на которых: а) обеспечивают 2-метоксинафталин формулыb) проводят реакцию с (R2)3ZX', где X' является галогеном, в присутствии втор-BuLi в растворителе для получения соединения формулы с) проводят реакцию с N-бромсукцинимидом для получения соединения формулыd) проводят реакцию с ДМФ (диметилформамидом) в присутствии 2 эквивалентов трет-BuLi в растворителе для получения соединения формулы е) снимают защитные группы соединения, полученного на этапе d) с целью получения соединения формулыf) конденсируют соединение, полученное на этапе е), с амином R8-NH2 в присутствии каталитических количеств около 1 мол.% муравьиной кислоты для получения соединения формулы I и его таутомерной формы I'. Способ приготовления может быть представлен на схеме, показанной на фиг. 2. Снятие защитных групп этапа е) может быть проведено, например, посредством обработки с BBr3. Кислота этапа f) может быть выбрана, например, из НСООН или п-ТСК (п-толуолсульфоновой кислоты). Данное изобретение также раскрывает металлические комплексы общей формулы II Металлические комплексы II получаются в результате комплексообразования лиганда I (I') с металлическими солями MXn в растворителе, где М является металлом Группы 6 Периодической таблицы, гдеX все являются или одинаковыми и представляют собой Br, или один X является паратолилом, а другойX является Br, и где L является растворителем, таким как, например, ацетонитрил, THF (тетрагидрофуран) или пиридин, предпочтительно ацетонитрил. Предпочтительно М является хромом. Предпочтительно один эквивалент металлической соли применяется на каждый нафтоксииминовый комплекс. Реакция металлирования проводится при температуре от -80C до температуры +25C и в течение периода времени от 1 до 18 ч. Данное изобретение также раскрывает каталитическую систему, содержащую каталитический компонент, имеющий в одном центре металл Группы 6, формулы II и активирующее средство, имеющее алкилирующее/ионизирующее действие. Подходящие активирующие средства хорошо известны в данном уровне техники. Активирующее средство может быть алкилом алюминия, представленным формулой AlR+nX3-n, где R+ является алкилом,имеющим от 1 до 20 атомов углерода, и X является галогеном, в сочетании с [Ph3C][B(C6F5)4]. Предпочтительными алкилами алюминия являются триизобутилалюминий (ТИБАЛ) или триэтилалюминий (ТЭАЛ). Алкилы алюминия используются в сочетании с тритилом. Альтернативно, он может быть алюмоксаном и содержать олигомерные линейные и/или циклические алкилалюмоксаны, представленные формулой для олигомерного, циклического алюмоксана, где n составляет 1-40, предпочтительно, 1-20, m составляет 3-40, предпочтительно 3-20, и R является C1-C8 алкильной группой и предпочтительно метилом или изобутилом. Предпочтительно активирующее средство является метилалюмоксаном (МАО). Количество активирующего средства выбирают для обеспечения соотношения Al/М от 500 до 10000, предпочтительно от 1000 до 5000. Количество активирующего средства зависит от его природы. Подходящие борсодержащие средства могут также использоваться для активации каталитического компонента, имеющего в одном центре металл Группы 6, формулы II, где R является алкильной или бензильной группой. Они включают, например, трифенилкарбениумборат, такой как тетракис(пентафторфенил)борат-трифенилкарбениум, который описан в европейском патентном документеEP-A-0427696, или таковой общей формулой [L'-H]+[В Ar1 Ar2 X3 Х 4]-, которые описаны в европейском патентном документе EP-A-0277004 (от стр. 6, линия 30 до стр. 7, линия 7). Количество борсодержащего активирующего средства выбирают так, чтобы обеспечить В/М соотношение от 0,5 до 5, предпочтительно около 1. В другом варианте осуществления согласно данному изобретению каталитический компонент,имеющий один центр, формулы II может быть расположен на стандартной подложке. Предпочтительно стандартная подложка является кремнеземом, насыщенным МАО. Альтернативно, подложка может также быть активирующей подложкой, такой как фторированный глинозем кремнезем. Каталитическая система может содержать необязательный поглотитель, который может быть выбран из триэтилалюминия, триизобутилалюминия, трис-н-октилалюминия, тетраизобутилдиалюмоксана или диэтилцинка. Данное изобретение раскрывает способ олигомеризации, или гомо- или сополимеризации этилена иa) вводят активную каталитическую систему в реактор;b) вводят мономер и необязательный сомономер или до, или после, или одновременно с этапом а);c) поддерживают при условиях полимеризации;d) извлекают олигомеры и/или полимер. Давление в реакторе может варьировать от 0,5 до 50 бар, предпочтительно от 5 до 25 бар. Температура полимеризации может изменяться в пределах от 10 до 100C, предпочтительно от 25 до 85C. Предпочтительный мономер и необязательный сомономер могут быть выбраны из этилена, пропилена, 1-гексена. Предпочтительным мономером является этилен. Примеры Все испытания выполнялись в очищенной атмосфере аргона с использованием стандартных методик Шленка, или в перчаточном боксе. Растворители дистиллировали под азотом из Na/бензофенона дляTHF и Et2O, из СаН 2 для ацетонитрила и из сплава Na/K для толуола и пентана. Их глубоко дегазировали и хранили под азотом до применения. Дейтеризованные растворители (бензол-d6, толуол-d8, THF-d8; 99,5% D от Eurisotop) перенесли с применением вакуума из сплава Na/K в накопительные трубки. Исходные материалы приобрели у Acros, Strem и Aldrich. Спектры ЯМР комплексов регистрировали спектрометрами Брукера АС-200, АС-300 и АМ-500 в ЯМР трубках с тефлоновым клапаном при 25C, если не указано иное. Химические сдвиги 1 Н и 13 С даны в ppm в сравнении с SiMe4 и были определены, исходя из пиков остаточных количеств растворителя. Передачу резонансов для органометаллических комплексов рассчитали из 2 Н-13 С ГМКК (гетероядерная многоквантовая корреляция) и ГМПК (гетероядерная многополюсная корреляция) ЯМР испытаний. Константы взаимодействия даны в Герцах. Элементарные анализы выполнялись Микроаналитической лабораторией в Институте химии при Реннском университете и являются средним двух независимых определений.I. Приготовление ONNH и ONH лигандов. А. Приготовление 3-метокси-2 нафтил-трифенилсилана. Раствор 15,3 мл втор-BuLi 1,3 М в гексане/циклогексане (19,91 ммоль) добавили по каплям в перемешанный раствор 3,0 г 2-метоксинафталина (18,96 ммоль) в 70 мл тетрагидрофурана (THF) при температуре -30C и в течение периода времени 15 мин. После перемешивания в течение ночи при комнатной температуре к полученному окрашенному раствору добавили раствор 5,87 г Ph3SiCl (19,91 ммоль) и 3,46 мл гексаметилфосфорамида (ГМФА) (19,88 ммоль) в 50 мл THF. Реакционную смесь нагревали в колбе с обратным холодильником в течение периода времени 20 ч, охладили и разбавили 500 мл воды. Органическую часть экстрагировали 3 раза по 50 мл Et2O. Комбинированные органические экстракты высушили над MgSO4 и выпарили. Неочищенный осадок перекристаллизовали из гептана и высушили над вакуумом для обеспечения 7,11 г (3-метокси-2-нафтил)(трифенил)силана (17,07 ммоль) с выходом продукта 90%. Спектр ЯМР был следующим: ЯМР 1 Н (200 МГц, CDCl3, 25C):7,80 (m, 2 Н), 7,67 (m, 7 Н), 7,55-7,23 (m, 12 Н), 3,69 (s, 3H, ОСН 3). Аналит. рассчитано для C29H24OSi: С, 83,61; Н, 5,81. Получено: С, 82,15; Н, 5,23.B. Приготовление (4-бром-3-метокси-2-нафтил)трифенилсилана. 150 мл колбу Шленка наполнили 4,68 г (3-метокси-2-нафтил)(трифенил)силана (11,23 ммоль) и 2,20 г N-бромсукцинимида (N-БС) (12,36 ммоль) под аргоном с последующим прибавлением 10 мл диметилформамида (ДМФА). Полученную смесь перемешивали всю ночь при комнатной температуре, затем разбавляли 500 мл воды и экстрагировали 3 раза по 50 мл CH2Cl2. Комбинированные органические экстракты отмыли 200 мл воды, погрузили в соляной раствор и высушили над Na2SO4. Продукт очистили,пропуская через короткую колонну (кремнеземную), применяя смесь гептан: EtOAc в соотношении 15:1 в качестве элюента, для обеспечения 5,28 г продукта в форме беловатой твердой фазы (10,66 ммоль) с выходом продукта 96%. Спектр ЯМР был следующим: ЯМР 1 Н (200 МГц, CDCl3, 25C):8,29 (d, J = 8,4 Hz, 1H), 7,80 (s, 1H), 7,66 (m, 8 Н), 7,52-7,27 (m, 10 Н), 3,18 (s, 3H, ОСН 3). Аналит. рассчитано для C29H23BrOSi: С, 70,30; Н, 4,68. Получено: С, 68,99; Н, 4,56.C. Приготовление 2-гидрокси-3-(трифенилсилил)-1-нафтальдегида (1). Раствор 16,1 мл трет-BuLi 1,5 М в пентане (24,10 ммоль) добавили по каплям в перемешанный раствор 6,02 г (4-бром-3-метокси-2 нафтил)трифенилсилана (12,05 ммоль) в 50 мл Et2O при -78C. Реакционную смесь перемешивали в течение 1,5 ч при установленной температуре и 30 мин при 0C с последующим добавлением 0,94 мл ДМФ. Полученную смесь перемешивали всю ночь при комнатной температуре и разбавляли 200 мл воды. Органическую часть экстрагировали с помощью CH2Cl2 (350 мл). Комбинированные органические экстракты высушили над MgSO4. Полученный раствор перенесли в колбу Шленка под аргон и раствор 24,1 мл BBr3 1M в CH2Cl2 (24,1 ммоль) добавили по каплям при -78C. Реакционную смесь перемешивали всю ночь при комнатной температуре, затем осторожно гидролизовали с по-4 018057 мощью 500 мл воды. Органическую часть экстрагировали CH2Cl2 (350 мл). Комбинированные органические экстракты высушили над MgSO4 и выпарили. Неочищенный осадок перекристаллизовали из метанола и высушили под вакуумом, чтобы обеспечить 5,44 г 1 (12,63 ммоль) с выходом продукта 95%. Спектр ЯМР был следующим: ЯМР 1 Н (200 МГц, CDCl3, 25C):13,58 (s, 1H, ОН), 10,88 (s, 1H, =СНО), 8,40 (d, J = 8,4 Hz, 1H),8,03 (s, 1H), 7,67 (m, 6H), 7,43 (m, 12H). Аналит. рассчитано для C29H22O2Si: С, 80,90; Н, 5,15. Получено: С, 80,17; Н, 4,67.D. Приготовление 1-[(хинолин-8-иламино)метилен]-3-(трифенилсилил)нафталин-2-она (2 а) как стабильной таутомерной формы 1-[(хинолин-8-илимино)метил]-3-(трифенилсилил)-2-нафтола. К перемешанной смеси 1,09 г (2,53 ммоль) 1 и 0,37 г (2,53 ммоль) 8-аминохинолина в 40 мл метанола добавили муравьиную кислоту (приблизительно 10 мг) при комнатной температуре. Полученную смесь перемешивали в колбе с обратным холодильником в течение 25 ч, и продукт осаждался как микрокристаллический порошок. Реакционную смесь перенесли на фильтр Шотта и отфильтровали. Полученную оранжевую твердую фазу отмыли холодным метанолом и высушили под вакуумом, чтобы обеспечить 0,77 г (1,38 ммоль) 2 а с выходом продукта 55%. ЯМР спектры были следующие: ЯМР 1H (500 МГц, CD2C12, 25C):15,31 (d, J = 11,1 Гц, 1 Н, NH), 9,31 (d, J = 11,1 Hz, 1H, =CHN),9,02 (dd, 1H), 8,26 (dd, 1H), 8,07 (d, J = 8,2 Гц, 1H), 7,81 (m, 2H), 7,73 (m, 7H), 7,66 (m, 1H), 7,57-7,40 (m,12H), 7,27 (m, 1H). ЯМР 13C (125 МГц, CD2Cl2, 25C):185,2, 151,7, 150,1, 146,4, 139,8, 137,4, 136,4, 136,1, 135,8, 135,0,133,2, 130,0, 129,3, 129,2, 129,0, 127,7, 126,6, 126,5, 124,4, 123,5, 122,3, 118,3, 113,9, 108,2. ЯМР 1H лиганда представлен на фиг. 3. Аналит. рассчитано для C38H28N2OSi: С, 81,98; Н, 5,07. Получено: С, 81,04; Н, 4,98. Молекулярную структуру этого лиганда можно увидеть на фиг. 4. Е. Приготовление 1-[(пиридин-2-илметил)амино]метилен)-3-(трифенилсилил)нафталин-2-она (2b) как стабильной таутомерной формы 1-[(пиридин-2-илметил)имино]метил-3-(трифенилсилил)-2 нафтола. Используя тот же протокол, как описано выше, лиганд 2b приготовили с выходом продукта 0,78 г(1,50 ммоль, 60%) из 1,08 г 1 (2,51 ммоль) и 0,29 г 2-аминометилпиридина (1,50 ммоль). ЯМР спектры были следующие: ЯМР 1 Н (500 МГц, CD2Cl2, 25C):14,44 (br m, 1H, NH), 8,96 (d, J = 8,8 Гц, 1 Н), 8,63 (dd, 1H), 7,95(d, J = 8,8 Гц, 1H), 7,79 (s, 1H), 7,70 (m, 1H), 7,67 (m, 6 Н), 7,60-7,35 (m, 11 Н), 7,32 (d, 1H), 7,25 (m, 1H),7,23 (m, 1H), 4,88 (m, 2 Н, CH2Py). ЯМР 13 С (125 МГц, CD2Cl2, 25C):180,6, 158,6, 156,4, 149,8, 149,3, 136,9, 136,3, 135,6, 135,1, 131,5,129,8, 129,2, 128,9, 127,7, 126,1, 122,8, 122,6, 121,9, 117,8, 106,1, 57,7. ЯМР 1 Н лиганда представлен на фиг. 5. Аналит. рассчитано для C35H28N2OSi: С, 80,73; Н, 5,42. Получено: С, 79,94; Н, 5,00.F. Приготовление 1-[(пентафторфенил)имино]метил-3-(трифенилсилил)-2-нафтола (2 с). Лиганд 2 с синтезировали путем конденсации 1,04 г 1 (2,42 ммоль) и 0,44 г пентафторанилина (2,42 ммоль) в толуоле в колбе с обратным холодильником в течение 40 ч в присутствии п-ТСК (приблизительно 5 вес.%), применяя аппарат Дина-Старка. Реакционную смесь выпарили и осадок перекристаллизовали из метанола для обеспечения 2 с с выходом продукта 0,93 г (1,57 ммоль, 65%). ЯМР спектры были следующие: ЯМР 1 Н (500 МГц, CDCl3, 25C):14,49 (s, 1H, ОН), 9,76 (s, 1H), 8,13 (d, J = 8,5 Гц, 1H), 7,96 (s, 1H),7,71 (d, J = 6,7 Гц, 6 Н), 7,69 (d, J = 10,2 Гц, 1H), 7,62 (t, J -10,2 Гц, 1H), 7,52-7,30 (m, 10H). ЯМР 13 С (125 МГц, CDCl3, 25C):168,5, 165,9, 148,1, 136,4, 134,2, 134,0, 130,2, 129,6, 129,4, 127,9,127,7, 126,3, 123,9, 118,9, 108,8 (сигналы группы Ph едва наблюдались). ЯМР 19F (188 МГц, CDCl3, 25C):-152,4 (m, 2F), -159,1 (t, 1F), -162,8 (m, 2F). ЯМР 1 Н лиганда представлен на фиг. 6. Аналит. рассчитано для C35H22F5NOSi: С, 70,58; Н, 3,72. Получено: С, 69,89; Н, 3,14.B. Синтез комплекса (ONNQuin)CrBr2(MeCN) (3a). Трубку Шленка наполнили 0,150 г 2 а (0,269 ммоль) и 0,140 г (p-Tol)CrBr2(THF)3 (0,269 ммоль) и 5 мл толуола перенесли туда с помощью вакуума. Реакционную смесь перемешивали всю ночь при комнатной температуре, выпарили и высушили в вакууме. Тмно-розовый осадок перекристаллизовали из 20-25 мл высушенного ацетонитрила для обеспечения 0,187 г (0,232 ммоль) 3 а с выходом продукта 86%.(В.М.) = 3,87. Аналит. рассчитано для C40H30Br2CrN3OSi: С, 59,42; Н, 3,74. Получено: С, 58,65; Н, 3,08. Молекулярная структура хромового комплекса представлена на фиг. 7.C. Синтез комплекса (ONNPy)CrBrz(MeCN) (3b). Следуя той же методике, что применяется для приготовления комплекса 3a, комплекс 3b получили из 0,100 г 2b (0,192 ммоль) и 0,100 г (p-Tol)CrBr2(THF)3 (0,192 ммоль) и выделили в количестве 0,135 гFAB-MS (масса/заряд): CHCl3: 1090,7 ([ML2]+); ацетонитрил: 1090,6 ([L2Cr]+). Аналит. рассчитано для C37H30Br2CrN3OSi: С, 57,52; Н, 3,91. Получено: С, 57,11; Н,3,13. Молекулярная структура хромового комплекса представлена на фиг. 8.(В.М.) = 3,87. Аналит. рассчитано для C39H27Br2CrF5N3OSi: С, 52,72; Н, 3,06. Получено: С, 51,89; Н, 2,78. Гомополимеризация этилена Полимеризацию проводили следующим образом. 300 мл стеклянный реактор высокого давления наполнили 80 мл свежедистиллированного толуола под аргоновой вспышкой. Начали механическое перемешивание (турбина Пелтона, 1000 об./мин), реактор затем продули этиленом и загрузили раствором поглотителя, выбранного из МАО или DEAC, под атмосферным давлением, и затем выдерживали при желаемой температуре посредством циркуляции воды в двойной стенке. Раствор предкатализатора в 2 мл толуола ввели внутрь шприцом. Давление газа в реакторе поддерживали непосредственно и держали постоянным с обратным регулятором на протяжении эксперимента. Потребление этилена контролировали с помощью расходомера Aalborg. Через заданный период времени реактор разгерметизировали и реакцию подавили путем добавления около 5 мл 10% раствора HCl в метаноле. Полимер затем осадили путем добавления 500 мл метанола, промыли и высушили в вакууме в течение ночи при комнатной температуре. Условия полимеризации представлены в табл. I, а результаты полимеризации показаны в табл. II. Кат. 1 был создан in situ из 2 а и (p-Tol)CrBr2(THF)3. Кат. 2 создан in situ из 2b и (p-Tol)CrBr2(THF)3 Кат. 3 является выделенным комплексом 3a. Кат. 4 является выделенным комплексом 3b. Кат. 5 является выделенным комплексом 3c Мономер был этиленом. Таблица I Реакция полимеризации протекает экзотермически; максимальная достигнутая температура приведена в скобках. Определено из спектра ЯМР 1 Н в C2D2Cl4 при 100C. Определено с помощью ГПХ при 150C в трихлорбензоле в сравнении с полистирольными стандартами. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Лиганд формулы I или его таутомерная форма формулы I' где каждый из R1, R3, R4, R5, R6 и R7 является водородом,Z является Si,R2 является фенильной группой,R8 является СН 2-(2-пиридилом), альфа-хинолином или C6F5. 2. Способ приготовления лиганда по п.1, включающий этапы, на которых: а) обеспечивают 2-метоксинафталин формулыb) проводят реакцию с (R2)3ZX', где X' является галогеном, в присутствии втор-BuLi в растворителе для получения соединения формулы с) проводят реакцию с N-бромсукцинимидом для получения соединения формулыd) проводят реакцию с ДМФ в присутствии трет-BuLi (два эквивалента) в растворителе для получения соединения формулы е) снимают защитные группы соединения, полученного на этапе d), например, путем обработкиBBr3 с целью получения соединения формулыf) конденсируют соединение, полученное на этапе е), с подходящим амином R8-NH2 в присутствии каталитических количеств кислоты, такой как НСООН или п-ТСК, для получения соединения формулы I и его таутомерной формы I' 3. Металлический комплекс формулы II где М является металлом Группы 6 Периодической таблицы, предпочтительно хромом, где все X являются одинаковыми и являются Br, или один X является паратолилом, а другой X является Br, где L2 является растворителем, таким как, например, ацетонитрил, THF (тетрагидрофуран) или пиридин, предпочтительно ацетонитрил, где все другие параметры являются такими, как описано выше. 4. Способ приготовления металлического комплекса по п.3, при котором проводят реакцию комплексообразования лиганда по п.1 с металлической солью MXn, где М является металлом Группы 6 Периодической таблицы, предпочтительно хромом, где или все X являются одинаковыми и являются Br,или один X является паратолилом, а другой X является Br, в растворителе, таком как, например, ацетонитрил, THF (тетрагидрофуран) или пиридин, предпочтительно ацетонитрил. 5. Каталитическая система для полимеризации олефинов, содержащая металлический комплекс по п.3 и активирующее средство, имеющее ионизирующее действие, выбранное из алкила алюминия, алюмоксана или борсодержащего средства. 6. Способ олиго-, гомо- или сополимеризации этилена и альфа-олефинов, включающий этапы, на которых: а) вводят каталитическую систему по п.5 в реактор;b) вводят мономер и необязательный сомономер или до, или после, или одновременно с этапом а);c) поддерживают при условиях полимеризации;d) извлекают олигомеры и/или полимер. 7. Способ по п.6, где мономер является этиленом или пропиленом, предпочтительно этиленом, и необязательный сомономер является пропиленом или 1-гексеном.Z = связывающий агент или некоординационная R группа (алкил, арил).L1 = боковая донорная группа (амино, пиридин, хинолин).
МПК / Метки
МПК: C07F 11/00, C08F 4/69, B01J 31/16
Метки: затрудненные, тридентатные, лигандами, этими, пространственно, металлические, комплексы, бидентатные, нафтоксииминовые, лиганды
Код ссылки
<a href="https://eas.patents.su/13-18057-prostranstvenno-zatrudnennye-naftoksiiminovye-bidentatnye-i-tridentatnye-ligandy-i-metallicheskie-kompleksy-s-etimi-ligandami.html" rel="bookmark" title="База патентов Евразийского Союза">Пространственно затрудненные нафтоксииминовые бидентатные и тридентатные лиганды и металлические комплексы с этими лигандами</a>
Предыдущий патент: Абсорбирующий предмет одежды одноразового использования
Следующий патент: Устройство для контроля подлинности банкнот
Случайный патент: Сушильная машина, оборудованная теплообменником с облицовкой