Тестирование чувствительности вирусов к лекарству
Номер патента: 6161
Опубликовано: 27.10.2005
Авторы: Мальмстен Андерс, Келландер Клас, Схао Ксингву, Гроновиц Симон
Формула / Реферат
1. Способ тестирования фенотипической чувствительности к лекарству у инфицированного оболочечным вирусом индивидуума, представляющего собой млекопитающее, путем тестирования по ферменту, упакованному в оболочечный вирус, выделенный из биологического образца, полученного от указанного индивидуума, включающий следующие стадии:
а) к образцу добавляют агент, инактивирующий фермент, для инактивации полимеразной активности, отличной от той, которая присутствует в оболочечном вирионе,
б) удаляют агент, инактивирующий фермент, антитела, блокирующие ферментативную активность, эндогенные ингибиторы ферментативной активности и противовирусные лекарства,
в) осуществляют лизис вирусных частиц с высвобождением фермента,
г) выделяют концентрированный очищенный вирусный фермент, полученный на стадии (в), и определяют профиль чувствительности к лекарству у индивидуума на основе выделенного фермента с помощью чувствительных ферментных анализов.
2. Способ по п.1, где индивидуум, представляющий собой млекопитающее, является человеком.
3. Способ по п.1 или 2, где биологический образец представляет собой образец крови.
4. Способ по п.3, где образец крови представляет собой образец плазмы.
5. Способ по п.4, где оболочечный вирус представляет собой ретровирус.
6. Способ по п.5, где ретровирус представляет собой вирус иммунодефицита человека (ВИЧ) и фермент представляет собой обратную транскриптазу (reverse transcriptase, RT) ВИЧ.
7. Способ по п.1, где профиль чувствительности к лекарству у индивидуума используют для выбора лекарственной терапии для этого индивидуума.
8. Набор, включающий письменные инструкции или инструкции на носителе информации для проведения тестирования фенотипической чувствительности к лекарству у млекопитающего, инфицированного оболочечным вирусом, в соответствии со способом по любому из пп.1-7, агент, инактивирующий фермент, для инактивации полимеразной активности, комплект для осуществления чувствительного ферментного анализа, и по меньшей мере одно рассматриваемое лекарство.
Текст
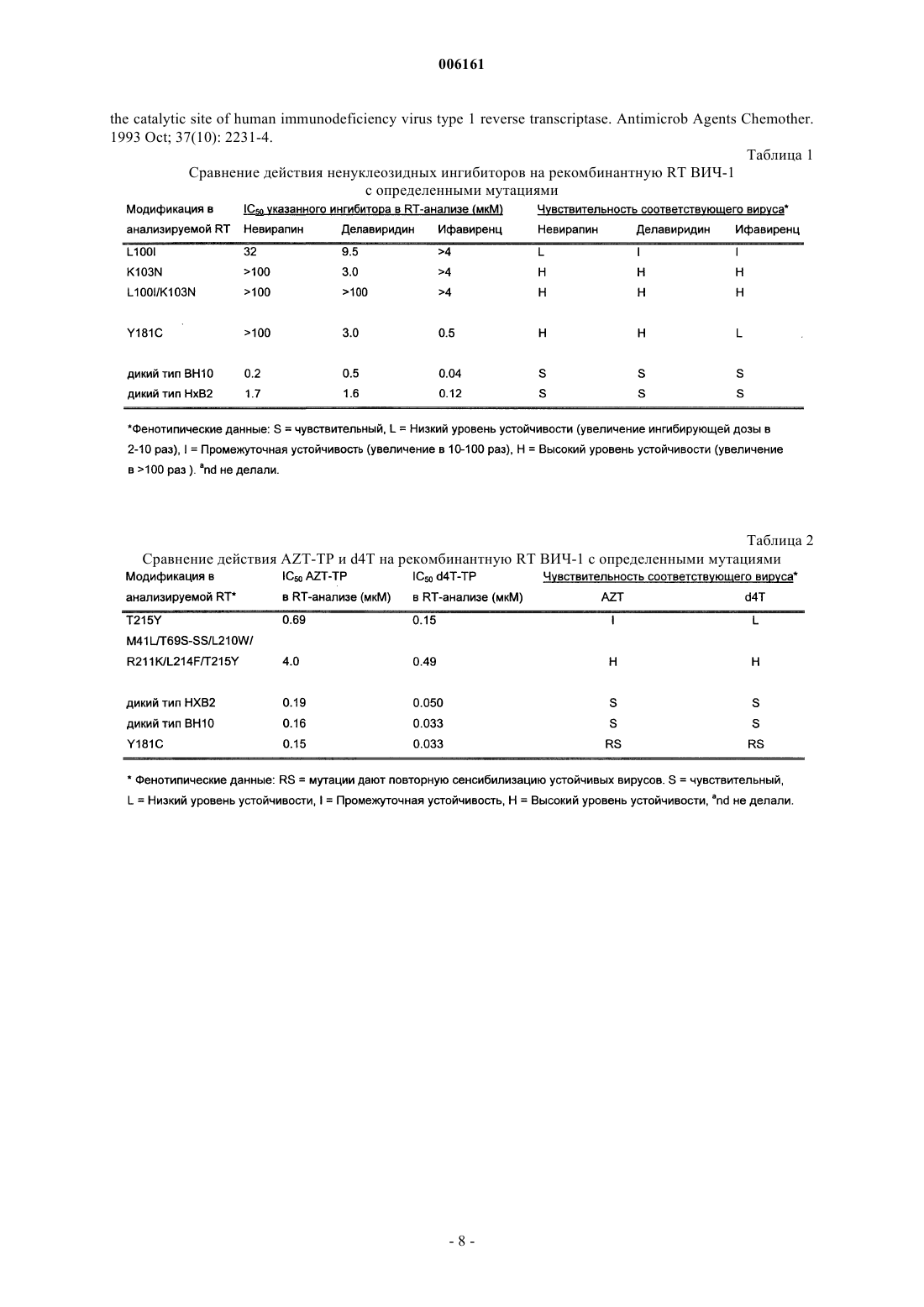
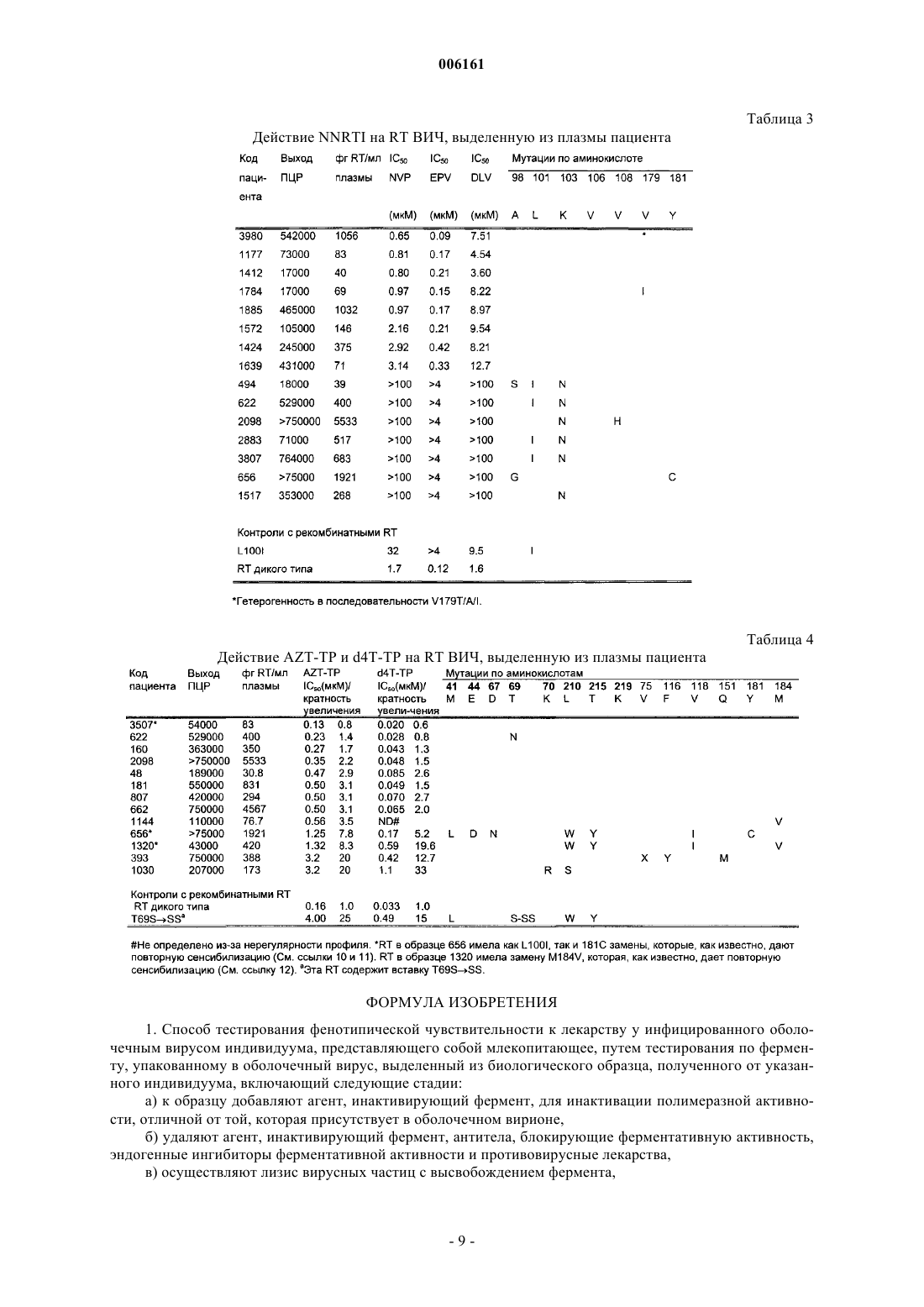
006161 Настоящее изобретение относится к тестированию чувствительности вирусов к лекарству, в частности, к способу тестирования фенотипической чувствительности к лекарству подвергающегося лекарственной терапии индивидуума, инфицированного оболочечным вирусом, например индивидуумамлекопитающего, инфицированного ретровирусом, например вирусом иммунодефицита человека (ВИЧ 1), путем тестирования по ферменту, упакованному в оболочечный вирус, выделенный из биологического образца, полученного от упомянутого выше индивидуума. Предшествующий уровень техники Чувствительность ВИЧ к лекарству связана с реакцией вируса на новые способы лечения. Сейчас имеются стандартные тесты на устойчивость к лекарству, и данные клинических испытаний позволяют предполагать, что применение тестирования на устойчивость к лекарствам может быть связано с улучшением исходов вирусной инфекции. Однако устойчивость к лекарствам сложна с точки зрения осуществления, интерпретации и клинического применения. Фенотипические тесты определяют способность изолята ВИЧ расти в присутствии лекарственного средства и осуществляются с применением анализов, в которых оценивается степень ингибирования репликации вируса при разных концентрациях лекарственного средства. Результаты используют для расчета 50%- или 90%-ной ингибирующей концентрации лекарства для данного изолята. Проблема, которая может возникнуть при проведении классического фенотипического анализа, состоит в наличии генетического дрейфа в вирусной популяции в процессе выделения вируса. В худшем случае выделенный вирусный клон представляет собой клон, который наиболее приспособлен к росту в условиях in vitro и не является клоном, наиболее распространенным у пациента. Определение фенотипической чувствительности к лекарству можно в настоящее время осуществлять с помощью автоматизированных анализов, основанных на технологии рекомбинантной ДНК. Эти подходы включают амплификацию плазматической РНК, кодирующей ВИЧ-протеазу и обратную транскриптазу (reverse transcriptase, RT), и получение рекомбинантного вируса с другими генами из лабораторной конструкции (вирусной кассеты) [1]. Генотипические анализы определяют наличие определенных мутаций в генах, являющихся мишенью для противоретровирусных лекарств. В то время как фенотипическая устойчивость определяет чувствительность вируса к лекарству, генотипирование определяет мутации, которые придают вирусу фенотипическую устойчивость. ПЦР-амплификация (ПЦР - полимеразная цепная реакция) последовательностей ВИЧ-1 из плазмы, содержащей от 500 до 1000 копий РНК на мл, является начальным этапом в обоих этих анализах и в фенотипических анализах рекомбинантных вирусов. В зависимости от предполагаемых мутаций и лабораторных условий осуществления теста, генотипические анализы могут различать мутант на уровне от 10 до 50% в смеси вирусов. Комплексность данных, полученных в результате секвенирования, привела к трудностям в интерпретации результатов. Могут существовать различия в интерпретации, касающиеся уровня фенотипической устойчивости, которая обусловлена специфическим характером мутаций. Когда появляются новые данные, существует риск предоставления неадекватной или даже некорректной их интерпретации [2]. Для всех использовавшихся до сих пор антиретровирусных лекарств механизм реакции состоит во вмешательстве в ферментативную реакцию, осуществляемую либо вирусной протеазой, либо RT. В зависимости от производительности ферментных анализов и использующихся методов выделения вирусов, тестирование чувствительности к лекарству теоретически можно проводить либо на супернатантах, полученных при выращивании вируса в культуре, первичного посева вируса, либо на препаратах вируса, полученного непосредственно от пациентов. Тестирование чувствительности к лекарству по RT из первичного посева вируса дает два преимущества по сравнению с традиционными тестами на ингибирование репликации вируса. Уменьшается время размножения вируса, и что более важно, будет иметь место меньшая селекция вирусной популяции. В идеале в конце нужно характеризовать фермент, который был выделен непосредственно из вируса, циркулирующего в крови пациента. Преимущество такого подхода заключается в том, что этот образец отражает вирусную популяцию, которая присутствует у пациента во время отбора образца крови. До сих пор это не было осуществлено на практике, но эту концепцию изучали путем тестирования устойчивости с помощью Amp-RT ПЦР-анализа [3].RT ВИЧ-1, а также другие обратные транскриптазы осуществляют три разные ферментативные реакции: РНК-зависимую ДНК-полимеризацию, ДНК-зависимую ДНК-полимеризацию и разрушение РНК в гибриде ДНК-РНК (РНКазаН). RT ВИЧ, кодируемая геном pol, представляет собой гетеродимер, состоящий из субъединиц p66 и р 51. Как РНК-зависимая ДНК-полимеризация, так и ДНК-зависимая ДНКполимеризация осуществляются одним и тем же активным сайтом, находящимся в субъединице р 66. Субъединица р 51 получается путем удаления С-концевого фрагмента р 66, соответствующего домену РНКазы Н [4]. Все ингибиторы RT, одобренные в настоящее время для клинического применения, ингибируют полимеразную активность этого фермента. Механизм реакции этих лекарств был определен в основном по их действию на реакцию РНК-зависимой ДНК-полимеризации. Влияние на реакцию ДНКзависимой ДНК-полимеризации является сравнительно менее изученным. Стандартный анализ RT-активности осуществляют с использованием искусственной матричнопраймерной конструкции и меченного дезоксинуклеотидтрифосфата в качестве нуклеотидного субстра-1 006161 та. Матрично-праймерная пара поли(rА)/олиго(dТ) является наиболее эффективной и чаще всего применяемой комбинацией для определения RT ВИЧ, а также других ретровирусных RT. Недостаток этого вида анализа, когда речь идет о тестировании чувствительности к лекарству, состоит в том, что могут быть протестированы только ненуклеозидные аналоги или аналоги, которые могут спариваться с rА. Аналоги других нуклеотидных оснований требуют анализа на основе вариабельной полимерной матрицы. Все антиретровирусные лекарства, одобренные до настоящего времени, препятствуют ферментативной реакции, осуществляемой либо вирусной протеазой, либо RT. Кроме того, в разработке находятся кандидаты в лекарственные средства, которые действуют на функцию ретровирусной интегразы.RT-Ингибиторы представляют собой либо нуклеозидные аналоги, либо ненуклеозидные аналоги. Ненуклеозидные ингибиторы связываются с гидрофобным "карманом" в ферменте RT, близким к активному сайту, но не соприкасающимся с ним. Репликация ВИЧ-1 ингибируется аллостерически путем смещения каталитических остатков аспартата относительно сайта связывания полимеразы. Устойчивость обычно появляется быстро, если ненуклеозиды применяют в виде монотерапии или при наличии неполной супрессии вируса. В настоящее время только три ненуклеозидных ингибитора: невирапин, ифавиренц и делавирдин одобрены для клинического применения Комитетом США по контролю за продуктами питания и лекарствами (FDA). Нуклеозидные ингибиторы, применяемые сегодня, останавливают элонгацию ДНК-цепи, так как у них отсутствует 3'-гидроксильная группа. Длительная терапия нуклеозидными ингибиторами часто приводит к развитию устойчивых вирусов. Этот процесс связан с постепенным появлением мутаций в вирусном гене роl, каждая из которых приводит к определенным аминокислотным заменам [5]. Эффекты этих замен на ферментативных уровнях являются сложными и включают усиление функции коррекции первичной ДНК. Эта реакция является нуклеотидзависимой и образует динуклеозид полифосфат и 3'конец ДНК, допускающий удлинение [6]. ВИЧ-терапия сегодня базируется на мультилекарственной терапии. Схемы лечения основаны на комбинации всех трех имеющихся типов лекарств: нуклеозидных аналогов, ненуклеозидных аналогов и ингибиторов протеазы. Стратегия заключается в сведении к минимуму вероятности выживания мутантного вируса. Сталкиваясь с неудачами вирусологии, современные руководства по терапии рекомендуют переключение на совершенно новую группу лекарств. Эта рекомендация является бесполезной, поскольку для многих ВИЧ-инфицированных людей не имеется трех или более неопробованных лекарств, из которых можно выбирать. Кроме того, может быть также нерациональным решение отменить лекарство,которое фактически еще является эффективным. С помощью усовершенствованного тестирования на лекарственную устойчивость можно исключить неэффективное лекарство или лекарства в заданной комбинации. Описание изобретения Согласно настоящему изобретению предложен способ осуществления тестирования фенотипической устойчивости к лекарству по ферменту, который выделяют непосредственно из образцов плазмы крови пациента. Этот способ основан на комбинации методов выделения вирусных ферментов в значительной степени свободных от их клеточных эквивалентов, с последующим их определением с помощью чувствительных ферментных анализов. Описанный метод выделения ферментов может быть использован для любого фермента, упакованного в оболочечный вирус, но в настоящем описании его применение только исследуется путем использования RT из плазмы для тестирования устойчивости к лекарству. Таким образом, один аспект изобретения относится к способу тестирования фенотипической чувствительности к лекарству у инфицированного оболочечным вирусом индивидуума, представляющего собой млекопитающее, путем тестирования по ферменту, упакованному в оболочечный вирус, выделенный из биологического образца, полученного от указанного индивидуума, включающий следующие стадии: а) к образцу добавляют агент, инактивирующий фермент, для инактивации полимеразной активности, отличной от той, которая присутствует в оболочечном вирионе,б) удаляют агент, инактивирующий фермент, антитела, блокирующие активность фермента, эндогенные ингибиторы активности фермента и противовирусные лекарства,в) осуществляют лизис вирусных частиц с высвобождением фермента,г) выделяют концентрированный очищенный вирусный фермент, полученный на стадии (в), и определяют профиль чувствительности к лекарству у индивидуума на основе выделенного фермента с использованием чувствительных ферментных анализов. В реализации изобретения индивидуум представляет собой человека. В предпочтительном на данный момент воплощении биологический образец представляет собой образец крови, например образец плазмы. В другом предпочтительном воплощении оболочечный вирус представляет собой ретровирус, например, вирус иммунодефицита человека (ВИЧ). В последнем случае предпочтительным ферментом является обратная транскриптаза (RT) ВИЧ.-2 006161 Профиль чувствительности к лекарству у индивидуума, полученный по способу настоящего изобретения, может быть использован для подбора лекарств для лечения этого индивидуума. На практике инфицированный оболочечным вирусом индивидуум, являющийся млекопитающим, будет подвергаться тестированию на профиль чувствительности к лекарству в несколько временных точек для наблюдения за развитием инфекции и противовирусным лечением указанного индивидуума. Изобретение также относится к коммерческому комплекту, включающему письменные инструкции или инструкции на носителе информации для тестирования фенотипической чувствительности к лекарству у инфицированного оболочечным вирусом индивидуума, представляющего собой млекопитающее,в соответствии с настоящим изобретением, агент, инактивирующий фермент, для инактивации полимеразной активности, чувствительный ферментный анализ и по меньшей мере одно рассматриваемое лекарство. Изобретение далее проиллюстрировано следующими описанием воплощений и графическими материалами, не ограничивающими изобретение. Содержание ссылочных материалов включено сюда посредством ссылки. Краткое описание графических материалов Фиг. 1 демонстрирует корреляцию между выделенной RT ВИЧ-1 и вирусной РНК, определенной с помощью РНК-ПЦР; фиг. 2 дает примеры зависимости между количеством RT, использованным в анализах чувствительности к лекарству, и найденными значениями IC50. Символы:Ифавиренц - RT дикого типа,Ифавиренц -RT L100I, (о) AZT-TP - RT дикого типа,AZT-TP-RT T215Y. Описание воплощений Используемая процедура состоит из четырех разных стадий. I). Инактивация полимеразной активности хозяина, которая присутствует в образце, без воздействия на вирусные ферменты, присутствующие в оболочечном вирионе. II). Удаление агента, инактивирующего фермент, антител, блокирующих ферментативную активность, эндогенных ингибиторов ферментативной активности и противовирусных лекарственных средств. III). Выделение концентрированного очищенного вирусного фермента. IV). Определение профиля чувствительности к лекарству выделенного фермента.(Стадии I-III). Протокол выделения вирусной RT из материала, который содержит антитела, блокирующие RT, основанного на деструкции растворимых клеточных ферментов с последующим выделением вирусной RT из миниколонок. 1). Пометьте пластиковые пробирки объемом 4,5 мл, которые будут использованы. Поместите их в контейнер Nalgene. Добавьте 1 мл образца (например, ЭДТА (этилендиаминтетрауксусная кислота)плазмы от ВИЧ-инфицированных индивидуумов) в каждую помеченную пробирку. Добавьте 100 мкл 66 мМ раствора 5,5'-дитиобис-(2-нитробензойной кислоты) в забуференной воде, интенсивно перемешайте и инкубируйте образцы 1 ч при комнатной температуре. Во время этой процедуры свободные ферменты плазмы разрушаются, тогда как ферменты, находящиеся внутри вирионов, остаются интактными. Вирионы затем могут быть очищены от 5,5'-дитиобис-(2 нитробензойной кислоты), антител, блокирующих ферментативную активность, и других веществ, которые могут мешать количественному определению вирусной RT, с использованием нескольких процедур выделения. Приведенный ниже протокол основан на применении геля Fractogel EMD TMAE Hicap. 2). Осторожно суспендируйте гель для разделения и перенесите по 1500 мкл суспензии геля в каждую пробирку с предварительно обработанным образцом. 3). Инкубируйте образцы с суспензией геля в течение 90 мин при комнатной температуре, причем пробирки лежат горизонтально на орбитальном шейкере. 4). Пометьте необходимое количество пластиковых миниколонок объемом 10 мл для идентификации анализируемых образцов. Установите колонки в устройство для промывки колонок, т.е. в вакуумный коллектор для твердофазной экстракции Supelco Visiprep. Перенесите содержимое пробирок, предназначенных для связывания, в соответствующие колонки. До переноса в течение короткого периода времени интенсивно перемешайте содержимое пробирок для равномерного распределения геля. 5). Когда все колонки будут заполнены, подсоедините вакуум и высушите гели. Отключите вакуум и начните промывку, заполняя каждую колонку 9 мл буфера А. Когда все колонки будут заполнены, подсоедините вакуум и высушите гели. 6). Повторите стадию 5 еще три раза, сделав в целом четыре промывки. Высушивайте гели после каждой промывки. После вакуумного высушивания гелей после четвертой промывки отключите вакуум и переходите к стадии 7. На стадии промывки из системы удаляются несвязанные антитела, блокирующие RT, и 5,5'дитиобис-(2-нитробензойная кислота). 7). Добавьте ко всем высушенным гелям по 9 мл кондиционирующего буфера (В). Через 1 мин подсоедините вакуум и высушите гели. 8). Повторите стадию 7. До отключения вакуума проверьте, чтобы кондиционирующий буфер (В) был полностью удален из всех гелей.-3 006161 9). Снимите верхнюю часть устройства для промывки колонок. Установите держатель с помеченными пробирками в чистый контейнер. Установите верхнюю часть этого устройства на прежнее место. Проследите, чтобы маленькие трубки от каждой колонки опустились в соответствующие им пробирки. 10). Добавьте 600 мкл лизирующего буфера (С) в каждую колонку. Оставьте колонку стоять с буфером 5 мин. Затем подсоедините медленный вакуум и высушите гели. В каждой пробирке эта процедура даст приблизительно по 600 мкл вирусного лизата из соответствующего геля.RT-активность, полученная в лизатах на стадии 10, по существу, свободна от антител, блокирующих RT, лекарственных средств и клеточной полимеразной активности, и она может быть количественно определена с помощью чувствительного анализа RT-активности, т.е. с помощью Cavidi HS-kit Lenti RT,который основан на методе, описанном Ekstrand et al. [7]. Для определения RT-активности в образце достаточно 25 мкл лизата, полученного согласно настоящему протоколу. Оставшиеся 575 мкл образца следует заморозить при температуре -70 С или ниже для последующего использования в тесте на чувствительность к лекарству. Замечание: Ферменты RT, которые нечувствительны к цистеин-модифицирующим агентам, например RT ВИЧ-1 дикого типа, можно по выбору анализировать в присутствии вплоть до 5 мМ 5,5'дитиобис-(2-нитробензойной кислоты). С другой стороны, чувствительные ферменты, такие как RT вируса MuLV (вируса лейкоза мышей Молони) и RT из определенных устойчивых к терапии штаммов ВИЧ-1 (содержащих, например, мутацию Y181C), требуют добавления в лизирующий буфер сульфгидрильного восстановителя, т.е. цистеина или цистеамина.(Стадия IV). Протокол определения чувствительности к лекарству RT-активности в лизатах. Модифицированный колориметрический анализ RT (Cavidi HS-kit Lenti RT), доступный от фирмыCavidi Tech (Uppsala, Sweden), использовали для определения уровня RT-активности в исследуемых вирусных препаратах. Кратко, поли(rА), ковалентно связанный с лунками 96-луночного микропланшета для титрования, служит в качестве матрицы для включения 5-бромдезоксиуридин-5'-трифосфата(BrdUTP) во время стадии обратной транскрипции, осуществляемой при 33 С. Количество бромдезоксиуридин-монофосфата (BrdUMP), включенного в ДНК, определяют с помощью щелочной фосфатазы(alkaline phosphatase, АР), конъюгированной с анти-BrdU-моноклональными антителами. И наконец, для флуориметрического определения используют 4-метилумбеллиферилфосфат - субстрат для АР. Количество RT в изоляте, использованное для определения IC50, было стандартизировано для нуклеозидных аналогов относительно активности, соответствующей 5 фг (4,310-20 моль) контрольной RT ВИЧ-1 на лунку, тогда как для ненуклеозидных аналогов использовали 1,7 фг (1,510-20 моль) RT. Лизаты разводили в ложных лизатах, т.е. лизатах, полученных после ложного разделения фетальной телячьей сыворотки. Исследования ингибирования RT проводили с помощью двух разных модифицированных версийHS Lenti RT-анализа. Делали серийные разведения ненуклеозидных аналогов в стадиях пятикратного разведения в реакционной смеси для RT, и аликвоты по 25 мкл переносили в каждую лунку микропланшета для титрования, смешивая с 125 мкл реакционной смеси для RT, и ферментативную реакцию инициировали добавлением 25 мкл разведенного лизата. Конечная концентрация нуклеотидного субстрата (BrdUTP) составляла 16 мкМ, а количество праймера (odT22) - 12 нг на лунку. Делали серийные разведения аналогов dT в стадиях пятикратного разведения в реакционной смеси для обрыва цепи, и аликвоты по 25 мкл переносили в каждую лунку микропланшета для титрования, смешивая с 125 мкл реакционной смеси для обрыва цепи RT, и ферментативную реакцию инициировали добавлением 25 мкл разведенного лизата. Конечная концентрация нуклеотидного субстрата (BrdUTP) составляла 1,5 мкМ, а количество праймера (odT22)- 12 нг на лунку. Как для нуклеозидных, так и для ненуклеозидных RT-ингибиторов RT-реакции давали идти в течение ночи (16-24 ч при 33 С). После этого реакцию прекращали, промывая планшет. ЗначениеIC50 определяли как концентрацию лекарственного средства, которая дает 50%-ное ингибирование исследуемой RT-активности. Материалы. Гель для разделения: например, Fractogel EMD ТМАЕ или Fractogel EMD ТМАЕ Hicap в 314 мМ 2-(N-морфолино)этансульфоновой кислоты (MES), рН 5.1, 413 мМ иодида калия и с 0,5 мг/мл гепарина. Миниколонки, например, Biorad Poly-Prep (7311553). Устройство для промывки миниколонок, т.е. вакуумный коллектор для твердофазной экстракцииSupeico Visiprep. Пластиковые пробирки, например, криогенные пробирки Nunc объемом 4,5 мл. Микропланшеты для титрования с иммобилизованным рrА, т.е. Nalge Nunc NucleoLinck. Цистеин-модифицирующий агент, например, 66 мМ 5,5'-дитиобис-(2-нитробензойной кислоты) в воде, забуференной 0,87 М Тris(гидроксиметил)аминометана (рН 8,3). Мягкий сульфгидрильный восстановитель, например, 33 мМ цистеамина в воде.(d4T-TP) были закуплены у фирмы Moravek Biochemicals (California). Невирапин: (11-циклопропил-5,11 дигидро-4-метил-6 Н-дипиридо[3,2-b:2',3'-f][1,4]диазепин-6-он) (NVP, Nevirapine); делавиридин: 1-(5 метансульфонамидо-1 Н-индол-2-илкарбонил)-4-[3-(1-метилэтиламино)пиридинил]пиперазинмонометана сульфонат (DLV, Deiaviridine); и ифавиренц: (-)6-хлор-4-циклопропилэтинил-4-трифторметил-1,4 дигидро-2 Н-3,1-бензоксазин-2-он) (EFV, Efavirenz) были закуплены у фирмы Apoteksbolaget (Uppsala,Sweden). Образцы плазмы от ВИЧ-инфицированных индивидуумов. Образцы плазмы получали, соответственно, от пациентов, не подвергавшихся лечению, или от пациентов, подвергающихся обычной комбинированной терапии. Закодированные образцы доставляли замороженными в виде двух различных панелей, представляющих пациентов с устойчивостью, соответственно, к NNRTI (non-nucleoside RT inhibitors - ненуклеозидные RT-ингибиторы) и к Т-аналогам. Количество РНК ВИЧ-1 в каждом образце определяли с помощью стандартного ПЦР-анализа РНК ВИЧ-1(Cobas, Roche Diagnostica), и присутствующий вирусный генотип анализировали с помощью набора для генотипирования ВИЧ-1 TRUGENE (Visible Genetics). Рекомбинантные ферменты RT. Были получены устойчивые к NNRTI мутантные формы RT (L100I, K103N, L100I/K103N, Y181C). В качестве матрицы для мутаций использовали вектор экспрессии pETRT, который был сконструирован из изолята ВН 10. Мутации осуществляли с использованием имеющихся в продаже наборов для сайтнаправленного мутагенеза QuikChange (Stratagene). Наличие мутаций подтверждали с помощью анализа последовательности ДНК. Мутантные и нативные формы RT выделяли как описано ранее [8]. Рекомбинантные RT с мутациями, специфичными в отношении AZT, получали путем введения мутации в участок, кодирующий RT, в EcoRI-NdeI-рестрицированного фрагмента штамма HXB2-D дикого типа, клонированного в векторе экспрессии рКК 233-2 (Amersham Biotech). Мутации производили с использованием имеющихся в продаже наборов для осуществления сайт-направленного мутагенеза QuikChange (Stratagene). Клонированные мутантные векторы экспрессии вводили путем трансформации в клетки штамма E.coli XL1-Blue и генотипы подтверждали с помощью анализа последовательности ДНК. Используемые буферы.A). Буфер для промывки: 20 мМ MES, рН 5.4, 500 мМ ацетата калия (КАс). Б). Кондиционирующий буфер. Буфер, совместимый с RT-анализом, например, 50 мМ N-2 гидроксиэтилпиперазин-N'-(2-этансульфоновой кислоты) (Hepes), рН 7.6, 25 мМ ацетата калия, 20 мМ хлорида магния (MgCl2), 0,2 мМ этиленгликоль-бисаминоэтилового эфира N,N,N',N'-тетрауксусной кислоты (ЭГТА), 2 мМ спермина и 0,5 мг/мл термоинактивированного бычьего сывороточного альбумина (БСА).B). Лизирующий буфер. Буфер, совместимый с RT-анализом, включающий детергент, например,1,25% полиоксиэтилен-4-лаурилового эфира (Brij 30), 13 нг/мл odT22 и те же компоненты, что и в кондиционирующем буфере (В). Сульфгидрильный восстановитель, т.е. 0,2 мМ цистеамина, добавляют по выбору при осуществлении процедур с вирусами с RT, которая чувствительна к SHокислению/модификации. Г). Реакционная смесь для RT, например, 10 мМ Hepes, рН 7.6, 19 мкМ BrdUTP, 80 нг/мл odT22,4 мМ MgCl2, 0,5 г/л декстрансульфата, 2 мМ спермина, 0,5% (oб./oб.) Triton X100, 0,2 мМ ЭГТА и 0,5 мг/мл БСА. Д). Реакционная смесь для обрыва цепи: 10 мМ Hepes, рН 7.0, 1,75 мкМ BrdUTP, 80 нг/мл odT22, 10 мМ MgCl2, 7 мМ АТР, 0,05 г/л декстрансульфата, 2 мМ спермина, 0,5% (об./об.) Triton X100, 0,2 мМ ЭГТА и 0,5 мг/мл БСА. Примеры Пример 1. Корреляция между выделенной RT ВИЧ-1 и вирусной РНК, определенной с помощью РНК-ПЦР. Образцы ЭДТА-плазмы объемом 1 мл от ВИЧ-инфицированных индивидуумов обрабатывали в соответствии с "Протоколом выделения вирусной RT из материала, который содержит антитела, блокирующие RT, основанного на разрушении растворимых клеточных ферментов с последующим выделением вирусной RT из миниколонок" и количество RT-активности, выделенной из каждого образца, определяли в течение ночи в RT-анализе с использованием набора Cavidi HS-Kit Lenti RT. Полученные RTактивности были пересчитаны в фемтограммы (фг) RT ВИЧ-1 на мл плазмы в соответствии с внутренней стандартной кривой. Количество РНК ВИЧ-1 в каждом образце определяли с помощью стандартного ПЦР-анализа РНК ВИЧ-1 (Roche Amplicor). Наблюдение ограничивается образцами с выходами ПЦР 500 копий/мл. Была обнаружена строгая корреляция между количеством выделенной RT плазмы и количеством РНК ВИЧ, определенным с помощью ПЦР (r = 0.93, n = 33, р 0,001). См. фиг. 1. Из этого примера можно сделать вывод, что обработка 1 мл плазмы индивидуума, содержащего 50000 копий РНК ВИЧ на мл плазмы, приведет к выделению примерно 200 фг RT-активности. При ис-5 006161 пользовании 1,7 фг RT на тест, указанное количество соответствует 118 тестам, которые можно использовать для определения профиля чувствительности выделенной RT к лекарству. Пример 2. Влияние количества RT, используемой в тестах на чувствительность к лекарству. Действие NNRTI, AZT-TP и d4T-TP на указанную рекомбинантную RT ВИЧ-1 определяли в соответствии с "Протоколом определения чувствительности к лекарству RT-активности в лизатах" с использованием указанных концентраций RT. На фиг. 2 приведены примеры зависимости между количествомIC50 для NNRTI, таких как ифавиренц, совсем не подвергались влиянию изменения количества RT в пределах исследуемого диапазона. Среди исследуемых NRTI, AZT-TP демонстрирует наибольшее варьирование в зависимости от количества RT, включенного в анализ. Это варьирование было максимальным для RT дикого типа, и IC50 увеличилась от 0,13 до 0,22 мкМ при увеличении количества RT от 2 до 162 фг/лунка (фиг. 2). Количество RT-активности, имеющейся в образцах плазмы, устанавливает ограничения для данных тестов. Для получения воспроизводимых значений IC50 для исследуемых лекарств требуется сигнал, превышающий фоновый сигнал по меньшей мере в пять раз. Низкая вариабельность значений IC50 при увеличении количества RT делает возможным определение чувствительности к лекарству без предварительной калибровки количества RT, используемого в каждом анализе. Пример 3. Сравнение действия ненуклеозидных ингибиторов на рекомбинантную RT ВИЧ-1 с определенными мутациями. Действие трех ненуклеозидных ингибиторов на указанную рекомбинантную RT ВИЧ-1 определяли в соответствии с "Протоколом определения чувствительности к лекарству RT-активности в лизатах". Количество каждой RT было стандартизовано для того, чтобы их активность соответствовала активности 1,7 фг/лунку нашей контрольной RT. Длительность RT-реакции составляла 19 ч, и полученные активности были пересчитаны в % от активности той же самой RT, инкубированной в отсутствие ингибитора. Фенотипические данные были взяты из литературы (базы данных International antiviral news иhttp://stanford.edu/hiv) (табл. 1). В основном имела место строгая корреляция между значениями IC50 из анализа ингибирования RT и фенотипическими данными из литературы. Всегда можно было различить RT от вирусов с высокой или средней устойчивостью (табл. 1). Пример 4. Сравнение действия аналогов dT на рекомбинантную RT ВИЧ-1 с определенными мутациями. Действие AZT-TP и d4T на указанную рекомбинантную RT ВИЧ-1 определяли в соответствии сRT было стандартизировано для того, чтобы их активность соответствовала активности 5 фг/лунка контрольной RT. Длительность RT-реакции составляла 19 ч, и полученные активности были пересчитаны в% от активности той же самой RT, инкубированной в отсутствие ингибитора. Фенотипические данные были взяты из литературы (базы данных International antiviral news иhttp://stanford.edu/hiv) (табл. 2). Реакционная смесь для обрыва цепи, используемая для определения чувствительности к Таналоговым лекарствам, должна обладать способностью поддерживать энергозависимую реакцию фосфоролиза. К сожалению, эффективность реакции фосфоролиза сразу же проявляется в уменьшении скорости полимеризации и, как следствие, также в уменьшении чувствительности определения. Поэтому данный анализ требует большей RT-активности по сравнению с соответствующим анализом для NNRTI. Другим следствием является то, что диапазон между устойчивыми и чувствительными RT меньше, чем вNNRTI-анализе. Однако в целом имела место строгая корреляция между значениями IC50 из анализа ингибирования RT и фенотипическими данными из литературы. Всегда можно было различить RT от вирусов с высокой или промежуточной устойчивостью (табл. 2). Пример 5. Определение чувствительности к NNRTI с использованием выделенных из плазмы RT. Образцы плазмы объемом 1 мл от 17 ВИЧ-инфицированных индивидуумов из Стокгольма (Швеция) обрабатывали в соответствии с "Протоколом выделения вирусной RT из материала, который содержит антитела, блокирующие RT, основанного на деструкции растворимых клеточных ферментов с последующим выделением вирусной RT из миниколонок". 15 из них содержали достаточное количество RT для осуществления тестирования на чувствительность к лекарству. Выходы ПЦР для этих образцов составляли 17000 копий/мл или больше. Каждую RT плазмы и два контрольных фермента титровали относительно ряда серийных разведений невирапина, ифавиренца и делавирдина в соответствии с Протоколом определения чувствительности к лекарству RT-активности в лизатах. Используя RT-активность из каждого выделения RT, соответствующую 1,7 фг/лунку контрольнойRT ВИЧ-1, авторы изобретения обнаружили, что 7 образцов из 15 содержали RT, которые были высоко устойчивы ко всем трем NNRTI (табл. 3). Все имели замену K103N или, в одном случае, (образец 656) комбинацию замен A98G и Y181C в их генах, кодирующих RT. Восемь образцов были чувствительны ко всем трем NNRTI. Шесть из них не имели релевантных мутаций в их генах RT, тогда как оставшиеся два-6 006161 имели либо V179I, либо V179T/A/I мутации, про которые не известно, что они влияют на чувствительность к NNRTI. Пример 6. Определение чувствительности к AZT-TP и d4T-TP с использованием выделенных из плазмы RT. Образцы плазмы объемом 1 мл от 27 ВИЧ-инфицированных индивидуумов из Стокгольма (Швеция) обрабатывали в соответствии с "Протоколом выделения вирусной RT из материала, который содержит антитела, блокирующие RT, основанного на деструкции растворимых клеточных ферментов с последующим выделением вирусной RT из миниколонкок". Только 13 из них содержали достаточное количество RT для осуществления тестирования на чувствительность к лекарству. Выходы ПЦР для этих образцов составляли 43000 копий/мл или больше. Каждую RT плазмы и два контрольных фермента титровали относительно ряда серийных разведений AZT-TP и d4T-TP в соответствии с Протоколом определения чувствительности к лекарству RT-активности в лизатах. См. табл. 4. Используя RT-активность из каждого выделения RT, соответствующую 5 фг/лунку контрольной RT ВИЧ-1, и реакционную смесь для обрыва цепи, авторы обнаружили, что значения IC50 для обоих лекарств увеличивались параллельно с накоплением мутаций, про который известно, что они вовлечены в устойчивость к NRTI (табл. 4). Мутации D69N или M184V сами по себе, как и ожидалось, не приводили к увеличению значений IC50. Образцы 656 и 1320 содержали RT, которые, несмотря на наличие нескольких аминокислотных замен, про которые известно, что они влияют на устойчивость к NRTI, проявляли промежуточные значения IC50 как для AZTT-TP, так и для d4T-TP. Было обнаружено, что эти изоляты также содержат замены Y181C или M184V, которые, как известно, вызывают повторную сенсибилизацию в отношении Т-аналоговых лекарств. Две RT в этой панели проявляли значения IC50, которые превышали по меньшей мере в 20 раз контрольную RT дикого типа (табл. 4). Одна из них имела набор аминокислотных (а.к.) вставок, характерных для комплекса Q151M [8], а другая содержала классическую замену K70R и, кроме того, замену L210S. Применяя значения IС 50 1 мкМ и 0,1 мкМ границы дляAZT-TP и d4T-TP, соответственно, можно классифицировать указанные экстракты как содержащие 9 чувствительных и 4 устойчивых RT, что согласуется с результатами генотипического анализа. Список литературы 1. Petropoulos C.J., Parkin N.T. Limoli K.L., Lie Y.S., Wrin T., Huang W., Tian H., Smith D., Winslowthe catalytic site of human immunodeficiency virus type 1 reverse transcriptase. Antimicrob Agents Chemother. 1993 Oct; 37(10): 2231-4. Таблица 1 Сравнение действия ненуклеозидных ингибиторов на рекомбинантную RT ВИЧ-1 с определенными мутациями-8 006161 Таблица 3 Действие NNRTI на RT ВИЧ, выделенную из плазмы пациента Таблица 4 Действие AZT-TP и d4T-TP на RT ВИЧ, выделенную из плазмы пациента ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ тестирования фенотипической чувствительности к лекарству у инфицированного оболочечным вирусом индивидуума, представляющего собой млекопитающее, путем тестирования по ферменту, упакованному в оболочечный вирус, выделенный из биологического образца, полученного от указанного индивидуума, включающий следующие стадии: а) к образцу добавляют агент, инактивирующий фермент, для инактивации полимеразной активности, отличной от той, которая присутствует в оболочечном вирионе,б) удаляют агент, инактивирующий фермент, антитела, блокирующие ферментативную активность,эндогенные ингибиторы ферментативной активности и противовирусные лекарства,в) осуществляют лизис вирусных частиц с высвобождением фермента,-9 006161 г) выделяют концентрированный очищенный вирусный фермент, полученный на стадии (в), и определяют профиль чувствительности к лекарству у индивидуума на основе выделенного фермента с помощью чувствительных ферментных анализов. 2. Способ по п.1, где индивидуум, представляющий собой млекопитающее, является человеком. 3. Способ по п.1 или 2, где биологический образец представляет собой образец крови. 4. Способ по п.3, где образец крови представляет собой образец плазмы. 5. Способ по п.4, где оболочечный вирус представляет собой ретровирус. 6. Способ по п.5, где ретровирус представляет собой вирус иммунодефицита человека (ВИЧ) и фермент представляет собой обратную транскриптазу (reverse transcriptase, RT) ВИЧ. 7. Способ по п.1, где профиль чувствительности к лекарству у индивидуума используют для выбора лекарственной терапии для этого индивидуума. 8. Набор, включающий письменные инструкции или инструкции на носителе информации для проведения тестирования фенотипической чувствительности к лекарству у млекопитающего, инфицированного оболочечным вирусом, в соответствии со способом по любому из пп.1-7, агент, инактивирующий фермент, для инактивации полимеразной активности, комплект для осуществления чувствительного ферментного анализа, и по меньшей мере одно рассматриваемое лекарство.
МПК / Метки
Метки: вирусов, тестирование, чувствительности, лекарству
Код ссылки
<a href="https://eas.patents.su/12-6161-testirovanie-chuvstvitelnosti-virusov-k-lekarstvu.html" rel="bookmark" title="База патентов Евразийского Союза">Тестирование чувствительности вирусов к лекарству</a>
Предыдущий патент: Долгоживущий глюкагоноподобный пептид 2(glp-2, гпп-2) для лечения желудочно-кишечных заболеваний и расcтройств
Следующий патент: Препарат для бесклеточного синтеза белка, способ синтеза белка с использованием данного препарата и устройство для его осуществления
Случайный патент: Интеллектуальная система контроля микроклимата в хлевах для домашних животных