Средство для обеспечения защиты трансплантата от отторжения иммунной системой хозяина на основе штамма генетически сконструированных эукариотических клеток, содержащих днк, кодирующую трансмембранныйбелок lag-3
Формула / Реферат
1. Применение штамма генетически сконструированных эукариотических клеток, содержащих ДНК, кодирующую трансмембранный белок LAG-3, экспрессирующийся на поверхности указанных клеток, для защиты трансплантата от отторжения иммунной системой хозяина.
2. Применение по п.1, где указанная ДНК, кодирующая белок LAG-3, является экзогенной.
3. Применение по п.1, где указанная ДНК, кодирующая белок LAG-3, является эндогенной и ее экспрессия активируется или модифицируется путем направленного встраивания регуляторной последовательности и/или амплифицируемого гена посредством гомологичной рекомбинации.
4. Применение по любому из пп.1-3, где указанные клетки принадлежат ткани или органу, подлежащим трансплантации.
5. Применение по любому из пп.1-3, где указанные клетки являются клетками-хозяевами для генной терапии.
6. Применение по п.5, где генная терапия является соматической или ex vivo генной терапией.
7. Применение по любому из пп.1-6, где указанные клетки являются клетками трансгенного животного.
8. Применение по любому из пп.1-7, где указанные клетки выбраны из миобластов, фибробластов, гемопоэтических стволовых клеток, эмбриональных стволовых клеток, гепатоцитов плода, эндотелиальных клеток пупочной вены или клеток CHO.
9. Применение комбинации штамма генетически сконструированных эукариотических клеток, содержащих ДНК, кодирующую трансмембранный белок LAG-3, экспрессирующийся на поверхности указанных клеток, и дополнительного иммуносупрессорного агента, например IL-10, TGF-b или Fas-лиганда, для защиты трансплантата от отторжения иммунной системой хозяина.
10. Применение по п.9, где указанные клетки являются клетками трансгенного животного.
11. Применение по п.9 или 10, где указанные клетки выбраны из миобластов, фибробластов, гемопоэтических стволовых клеток, эмбриональных стволовых клеток, гепатоцитов плода, эндотелиальных клеток пупочной вены или клеток CHO.
12. Применение штамма генетически сконструированных эукариотических клеток, содержащих ДНК, кодирующую трансмембранный белок LAG-3, экспрессирующийся на поверхности указанных клеток, и ген тимидинкиназы (tk), который сообщает этим клеткам восприимчивость к системе "самоубийства" под действием tk-ганцикловира, для защиты трансплантата от отторжения иммунной системой хозяина.
13. Применение по п.12, где указанные клетки являются клетками трансгенного животного.
14. Применение по п.12 или 13, где указанные клетки выбраны из миобластов, фибробластов, гемопоэтических стволовых клеток, эмбриональных стволовых клеток, гепатоцитов плода, эндотелиальных клеток пупочной вены или клеток CHO.
15. Применение штамма генетически сконструированных эукариотических клеток, содержащих ДНК, кодирующую трансмембранный белок LAG-3, экспрессирующийся на поверхности указанных клеток, для изготовления лекарственного средства для индуцирования защиты трансплантата от отторжения иммунной системой хозяина.
Текст
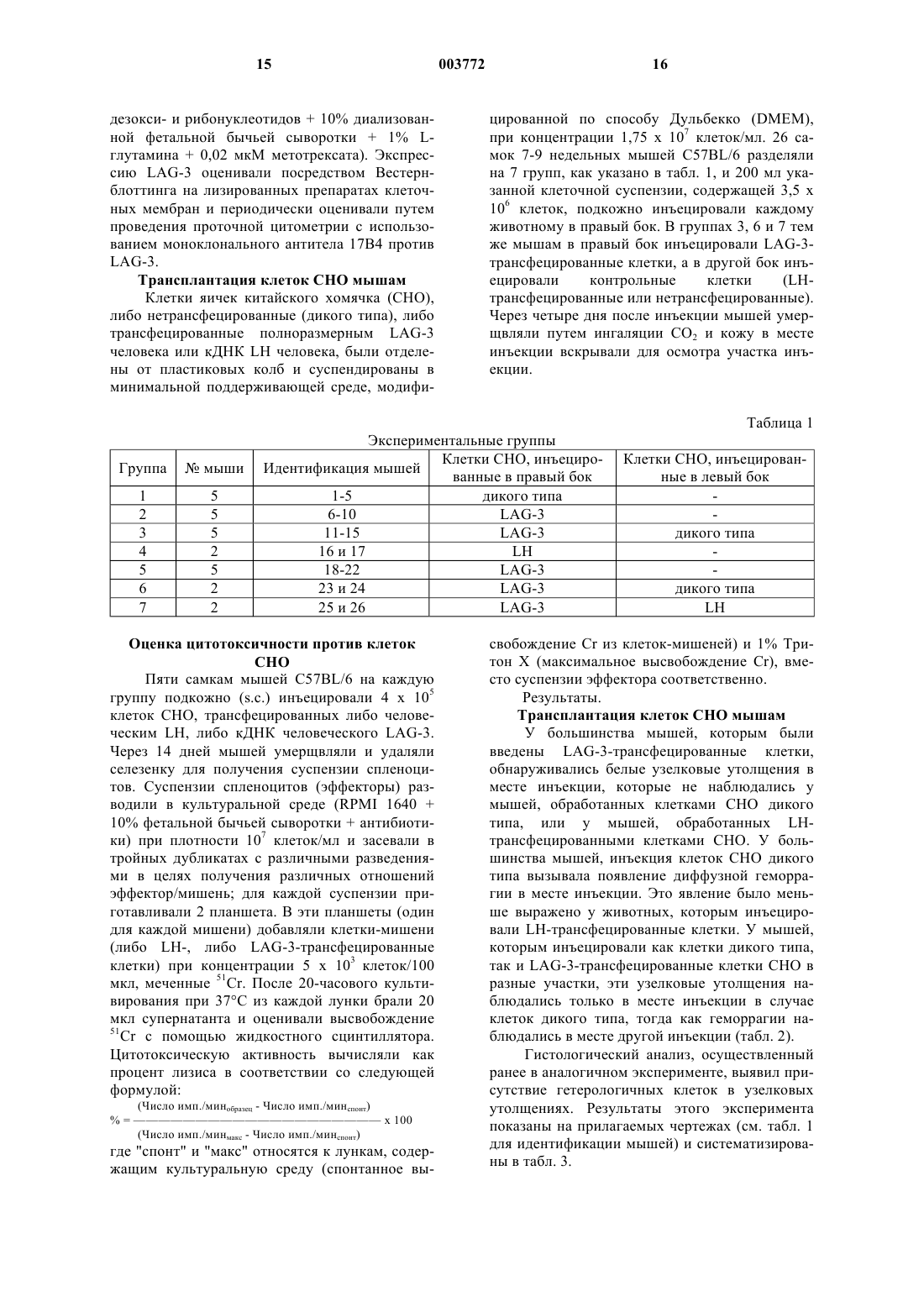
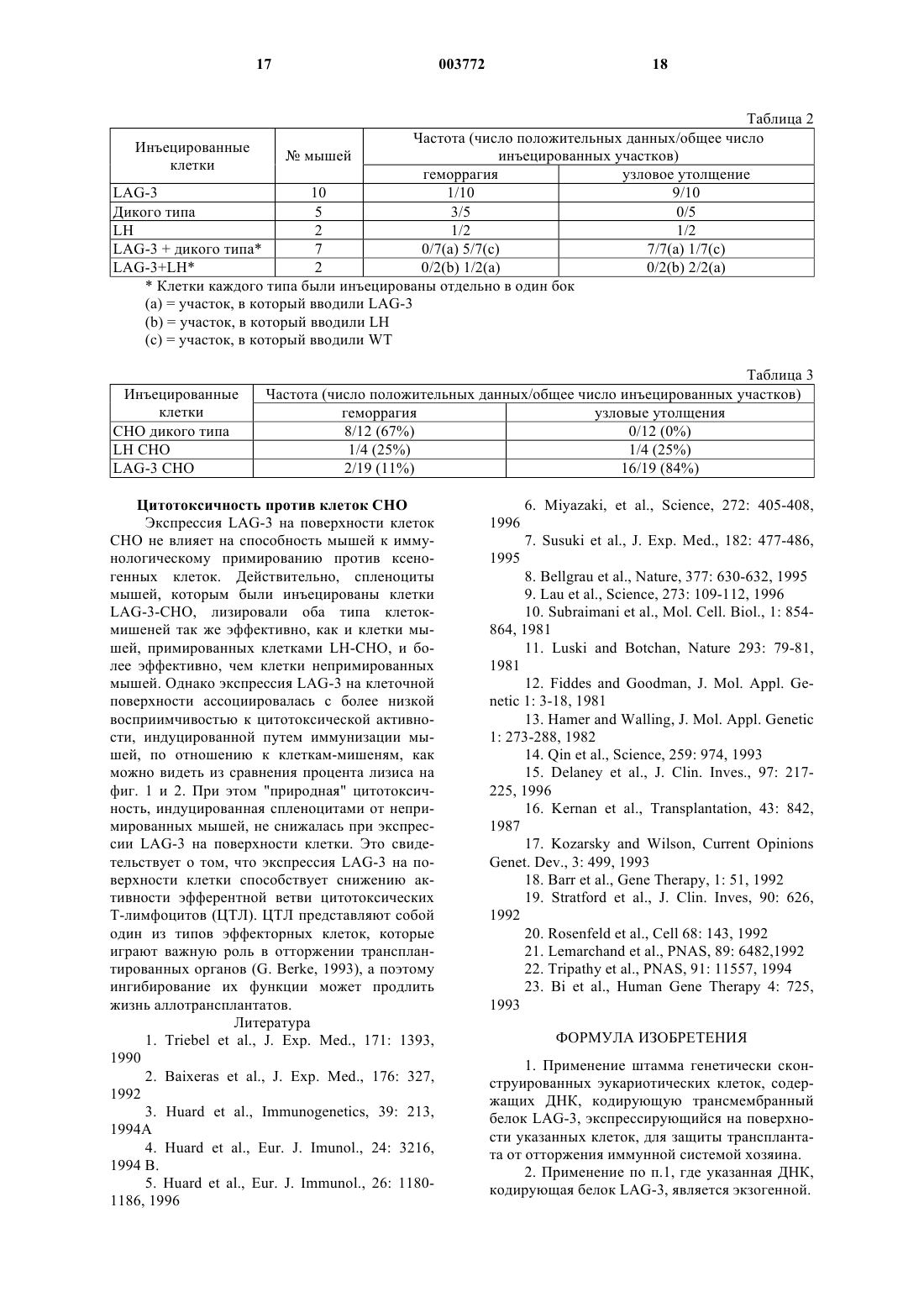
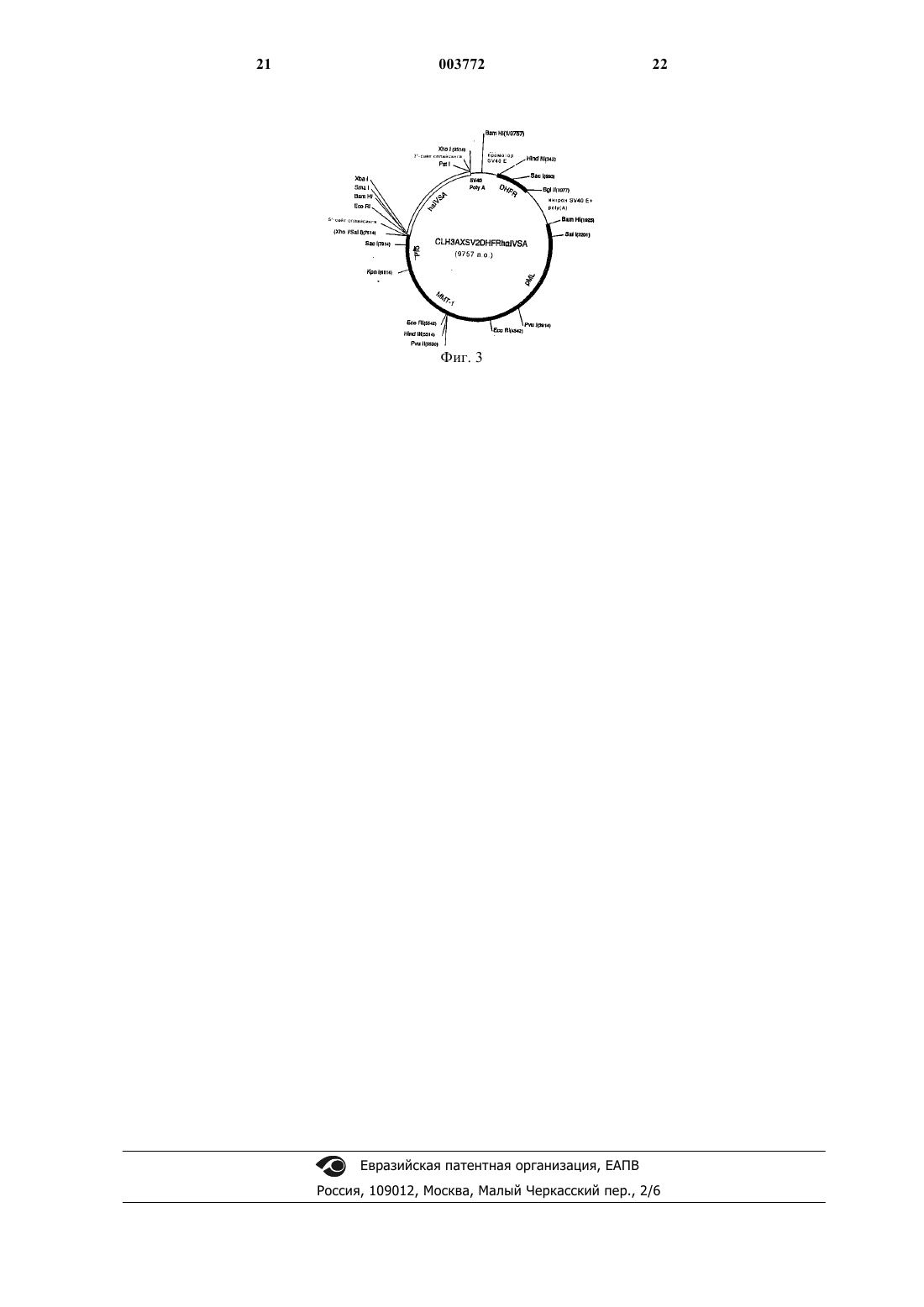
1 Область, к которой относится изобретение Настоящая заявка относится к способам предупреждения отторжения трансплантированных органов, тканей или клеток, а в частности, к способам, предусматривающим конструирование такого типа клеток, которые экспрессируют белок LAG-3 при трансплантации хозяину. Более конкретно, настоящее изобретение относится к продуцированию универсальной клетки-хозяина для генной терапии, экспрессирующей белок LAG-3 нa своей поверхности. Описание предшествующего уровня техники Ген активации лимфоцитов (LAG-3) является членом надсемейства иммуноглобулинов и селективно транскрибируется в активированных Т-клетках как в CD4+, так и в CD8+) и в NKклетках человека (Triebel et al., 1990). Данные о последовательности гена, сравнение его экзон/интронной структуры и хромосомной локализации выявили, что белок LAG-3 является близкородственным CD4 (Baixeras et al., 1992). Кроме того, близкое родство между LAG-3 иCD4 было еще наглядней продемонстрировано тем, что оба эти белка имеют один и тот же общий лиганд, т.е. молекулы МНС класса II (Baixeras et al., 1992). Однако в противоположностьCD4, белок LAG-3 не связывается с gp120 вируса иммунодефицита человека (Baixeras et al.,1992). Экспрессия LAG-3 -in vivo не была обнаружена ни в первичных лимфоидных органах,таких как селезенка, ни в лимфоидной ткани,ассоциированной со слизистой, ни в нормальных лимфатических узлах. Однако этот белок легко обнаруживался в воспаленных небных миндалинах или в лимфатических узлах с фолликулярной гиперплазией, что подтверждает ту точку зрения, что даже in vivo, LAG-3 экспрессируется после активации (Huard et al., 1994A). Антиген-специфическая стимуляция Т-клеточных клонов в присутствии моноклонального антитела (mAb) против LAG-3 приводит к повышенному включению тимидина, к повышенной экспрессии маркера активации CD25 и к увеличению продуцирования цитокинов (Huardet al., 1994B). В соответствии с этим, добавление растворимой рекомбинантной формы LAG-3 ингибировало пролиферацию антиген-специфических Т-клеток, что дало основание предположить регуляторную роль LAG-3 в активации CD4+ Тлимфоцитов (Huard, 1996) и его участие в торможении действующих иммунных реакций. Недавно было показано, что LAG-3 также действует как корецептор для NK-клеток и определяет различные механизмы уничтожения опухолевых клеток, контролируемого неизмененной иммунной системой (Miyazaki et al., 1996). Механизмы, с помощью которых развивается Т-клеточный ответ к чужеродному (аллогенному или ксеногенному) белку или к клетке или к органу, пока еще не достаточно ясны. Ан 003772 2 тиген-презентирующие клетки (АПК) обладают хемотаксисом к участкам воспаления или повреждения (которые могут быть индуцированы хирургической трансплантацией). Популяция Тклеток на периферии осуществляет постоянный"надзор" за тканями в целях выявления патогенов или присутствия чужеродной (алло- или ксеногенной) ткани. После распознавания сигналов "тревоги", МНС захватывают этот белок,гидролизуют его и презентируют его иммунной системе хозяина. Были сконструированы аллогенные или сингенные опухолевые клетки, экспрессирующие вирусный IL-10, который индуцирует локальную толерантность к опухолям. Такое лечение не влияет на отторжение нетрансдуцированной опухоли на удаленном участке (Suzuki etal., 1995). Очевидно, что IL-10, поставляемый локально, индуцирует сдвиг популяции Тклеток, являющихся реактивными по отношению к трансплантированным клеткам, в сторону фенотипа Th2, который не является цитолитическим и может даже быть протективным. Клетки, которые в норме экспрессируютFas-лиганд, были трансплантированы через аллогенные или экзогенные барьеры без иммуносупрессии. Надзор хозяйских Т-клеток за участком имплантации приводил к их уничтожению при контакте с Fas-лигандом (Bellgrau et al.,1995). Более того, отторжение аллотрансплантата панкреатических островков предотвращалось котрансплантацией сингенных миобластов, генетически сконструированных для экспрессииFas-лиганда (Lau et al., 1996). Иммунная система обладает способностью быстро идентифицировать чужеродную, патологическую или воспаленную ткань и быстро разрушает ее. Это явление всегда создавало большие препятствия для трансплантации ткани,органа или клетки, а также для генной терапии. Главные проблемы связаны, в основном, с хронической иммуносупрессией, инкапсулированием или иммуноизоляцией. Нежелательными побочными эффектами хронической иммуносупрессии являются повышенная восприимчивость к условно-патогенной инфекции и образованию опухолей. Возможность добиться продолжительной приживляемости трансплантированной ткани в отсутствие непрерывной иммуносупрессии давно является давней целью исследователей в области медицины человека. Цитирование любого документа в настоящем описании не означает, что заявитель считает этот документ прототипом, или считает рассматриваемый материал патентоспособным по любому из заявленных пунктов формулы изобретения настоящей заявки. Любое указание на содержание или дату любого документа основано на информации, известной заявителю в момент подачи заявки, и не должно рассматри 3 ваться как подтверждение точности такого указания. Краткое описание изобретения В соответствии с настоящим изобретением было обнаружено, что трансплантация клеток,которые экспрессируют белок LAG-3 на своей поверхности, приводит к защите трансплантата от отторжения иммунной системой хозяина. Таким образом, настоящее изобретение относится к генетически сконструированной клетке, которая может быть частью трансплантированной ткани или трансплантированного органа и которая включает ДНК, кодирующую трансмембранный белок LAG-3 на своей поверхности, что приводит к защите трансплантата от отторжения иммунной системой хозяина; при этом, указанной ДНК является геномная ДНК или кДНК. Указанная ДНК может быть экзогенной, или, в конкретном варианте осуществления изобретения, эндогенной ДНК, экспрессия которой активируется или модифицируется путем направленной инсерции регуляторной последовательности и/или амплифицируемого гена посредством гомологичной рекомбинации. Белок LAG-3 представляет собой белок, который распознается антителами, направленными против LAG-3. В том случае, когда клетка является частью трансплантируемой ткани или трансплантируемого органа, трансфекция LAG-3-ДНК может быть осуществлена непосредственно в ткани или органе, подлежащем трансплантации. В частности, эта клетка представляет собой универсальную клетку-хозяина для генной терапии, которая является подходящей, например, для любого вида соматической или ех vivo генной терапии. В конкретном варианте осуществления изобретения клетка-хозяин для генной терапии,кроме того, включает экзогенную ДНК, кодирующую нужный терапевтический агент; и эти генетически сконструированные клетки используют в качестве терапевтического агента. Термин "терапевтический", используемый в настоящем описании, относится к лечению и/или профилактике. В еще одном варианте осуществления изобретения, ген, кодирующий нужный терапевтический агент, присутствует в геноме клетки, и эта клетка, кроме того, включает экзогенную ДНК, кодирующую регуляторную последовательность, или амплифицируемый ген для активации или модификации экспрессии нужного эндогенного гена. Генетически сконструированная клетка настоящего изобретения может, так или иначе,содержать только экзогенную LAG-3-ДНК, которая может быть использована в смеси с другими клетками-хозяевами для генной терапии,содержащими нужную терапевтическую ДНК. Клетку настоящего изобретения предпочтительно, выбирают из миобластов, фибробла 003772 4 стов, гемопоэтических стволовых клеток, эмбриональных стволовых клеток, фетальных гепатоцитов, эндотелиальных клеток пупочной вены и клеток СНО. Клетки, указанные выше, происходящие от трансгенных животных, также входят в объем настоящего изобретения. Другой целью настоящего изобретения является использование трансмембранного белкаLAG-3, включая его мутеины и варианты, экспрессированные на поверхности клеток, в изготовлении лекарственных средств для индуцирования защиты трансплантата от отторжения иммунной системой хозяина. Кроме того, настоящее изобретение относится к использованию клетки, содержащей ДНК, кодирующую трансмембранный белокLAG-3, экспрессируемый на поверхности этой клетки, в изготовлении лекарственных средств для индуцирования защиты трансплантата от отторжения иммунной системой хозяина. В объем настоящего изобретения также входит использование указанной клетки, экспрессирующей LAG-3 на своей поверхности, в изготовлении лекарственного средства, смешиваемого с трансплантируемыми клетками, тканями или органами, для индуцирования защиты трансплантата от отторжения иммунной системой хозяина. Краткое описание чертежей Фиг. 1 - цитотоксическая активность спленоцитов по отношению к клеткам LH-CHO, где указанные спленоциты были получены от мыши, примированной клетками LAG-3-CHO илиLH-CHO. Приводятся средние значения ( ст. откл.) для 5 мышей, как указано в надписи к чертежу; были также оценены 2 интактные мыши; фиг. 2 - цитотоксическая активность спленоцитов по отношению к клеткам LAG-3-CHO,где указанные спленоциты были получены от мыши, примированной клетками LAG-3-CHO или LH-CHO. Приводятся средние значения ( ст. откл.) для 5 мышей, как указано в надписи к чертежу; были также оценены 2 интактные мыши; фиг. 3 - карта экспрессирующего вектораD млекопитающего. Используемые сокращения: DHFR, единица транскрипции дегидрофолатредуктазы (Subraimani et al., 1981); pML,производное pBR322 (LuskyBotchan, 1981);hAIVSA, фрагмент от интрона А субъединицы гликопротеиновых гормонов человека (FiddesGoodman, 1981); ММТ-1, промотор мышиного металлотионеина 1 (HamerWalling, 1982). Подробное описание изобретения Каждый год сотни тысяч людей умирают от сердечной недостаточности, почечной недостаточности, печеночной недостаточности, дыхательной недостаточности или от недостаточно 5 сти функции поджелудочной железы. Единственным наиболее эффективным лечением является трансплантация. Лечение, связанное с трансплантацией клеток, тканей или органов, индуцирует общее иммунопротективное состояние в организме хозяина по отношению к имплантированным клеткам, тканям или органам. Желательно обеспечить специфическую защиту трансплантата от его отторжения иммунной системой хозяина, в частности, при аллогенной трансплантации,ксеногенной трансплантации и генной терапии. При этом также желательно ингибировать толерантность к опухолевым тканям или каким-либо другим способом обеспечить реакцию иммунной системы хозяина на опухолевую ткань. В соответствии с этим настоящее изобретение относится ко всем вышеописанным способам использования обнаруженного факта, что трансплантация клеток или тканей, которые экспрессируют трансмембранный белок LAG-3,способствует защите трансплантата от отторжения иммунной системой хозяина. В настоящем изобретении использован только что открытый ген и белок LAG-3, который обычно экспрессируется на активированных Т-клетках и активированных NK-клетках. Термин "трансмембранный белок LAG-3",используемый в настоящем описании, означает трансмембранный белок, содержащий экстрацитоплазматический домен LAG-3, его соли,функциональные производные, предшественники и активные фракции, а также его активные мутанты и его активные варианты, каждый из которых экспрессируется на поверхности клетки. Этот термин также означает трансмембранный белок, который экспрессируется в его природном состоянии или который может быть гибридизован, например, методами генной инженерии, с другим белком, таким как гликозилфосфатидилинозит-содержащий "якорь", или с любыми подходящими фрагментами другого трансмембранного белка, например, TNFрецептора, MPL-лиганда или трансмембранного иммуноглобулина. Термин "соли", используемый в настоящем описании, означает соли карбоксильных групп и соли функциональных аминогрупп соединений,получаемых хорошо известными способами. Соли карбоксильных групп включают неорганические соли, например, соли натрия, калия,кальция, и соли, образованные с органическими основаниями, например, с аминами, такими как триэтаноламин, аргинин или лизин. Соли аминогрупп включают, например, соли неорганических кислот, таких как соляная кислота, и соли органических кислот, таких как уксусная кислота. Термин "функциональные производные",используемый в настоящем описании, означает производные, которые могут быть получены 6 известными методами из функциональных групп, присутствующих на боковых цепях аминокислотных молекул или на концевых N- или С-группах и которые входят в объем настоящего изобретения, при условии, что они являются фармацевтически приемлемыми, т.е. не нарушают активности белка или не оказывают токсического воздействия, входя в состав фармацевтических композиций. Такими производными являются, например, сложные эфиры или алифатические амиды карбоксильных групп иN-ацильные производные свободных аминогрупп или O-ацильные производные свободных гидроксильных групп и производные, образованные ацильными группами, например алканоильными или ароильными группами. Термин "предшественники" означает соединения, которые превращаются в LAG-3 в организме человека или животного. Термин "активные фракции" белка настоящего изобретения означает любой фрагмент или предшественник полипептидной цепи самого соединения, взятый отдельно или в комбинации со связанными с ним родственными молекулами или остатками, например, с остатками сахаров или фосфатов; или агрегаты полипептидных молекул, при условии, что такие фрагменты или предшественники, используемые в качестве лекарственного средства, обладают активностью, аналогичной активности LAG-3. Термин "активные фракции", предпочтительно, означает растворимые фракции внеклеточной части белка LAG-3, включая один или несколько из четырех доменов D1, D2, D3, D4 внеклеточного домена LAG-3. Термин "активные мутанты", используемый в настоящем описании, означает другие белки или полипептиды, где одна или несколько аминокислот этой структуры делетированы или заменены другими аминокислотами или где одна или несколько аминокислот добавлены к данной последовательности с получением полипептидов или белков, имеющих активность,аналогичную активности LAG-3. Так, например,Аrg 73 и/или Arg 75 и/или Аrg 76 могут быть заменены другой аминокислотой, предпочтительно Glu. Термин "активные варианты" LAG-3 означает альтернативно-сплайсированные варианты,а также все первичные генные транскрипты,которые возникают в результате механизмов альтернативного сплайсинга в различных сайтах расщепления генов. Предпочтительными вариантами являются растворимые или трансмембранные белки, не имеющие доменов D3 и/илиD4 во внеклеточной части LAG-3 и необязательно содержащие несколько дополнительных аминокислот после домена D2 или D3. Экспрессия трансмембранного белка LAG3 на поверхности клеток подтверждается иммунореактивными методами. Трансмембранный белок распознается, например, антителами 11 Е 3( депозита CNCM I-1240) или 15 А 9 ( депозита CNCM 1-1239). Настоящее изобретение также относится к смеси полипептидов и производных, указанных выше. Термин "LAG-3", "белок LAG-3" или "молекула LAG-3", используемый в описании и формуле изобретения в выражении "экспрессияLAG-3, белка LAG-3 или молекулы LAG-3",означает природные, синтетические и рекомбинантные формы полипептида, а также все определения, описанные выше. Клетки настоящего изобретения могут быть отобраны из первичных или вторичных клеток. Используемый в настоящем описании термин "первичная клетка" означает клетки,присутствующие в суспензии клеток, выделенных из источника ткани позвоночных (перед тем, как они были засеяны, т.е. связаны с субстратом культуры ткани, таким как чашка или колба); клетки, присутствующие в эксплантате,полученном из ткани; клетки обоих из вышеуказанных типов, засеянных в первый раз; и клеточные суспензии, полученные из этих засеянных клеток. Термин "вторичная клетка" или"клеточный штамм" относится к клеткам во всех последующих стадиях культивирования. Таким образом, в первый раз посеянная первичная клетка удаляется из культурального субстрата и засеивается снова, и такая клетка именуется в настоящем описании вторичной клеткой, как и все клетки в последующих пассажах. Вторичными клетками являются клеточные штаммы,состоящие из вторичных клеток, которые были пассированы один или несколько раз. Клеточный штамм состоит из вторичных клеток, которые: 1) были посеяны один или несколько раз; 2) имеют ограниченное число средних удвоений популяции в культуре; 3) обладают способностью к контакт-ингибированному субстратзависимому росту (рост на субстрате не применим к клеткам, которые размножаются в суспензионной культуре); и 4) не являются иммортализованными. Термин "клональный клеточный штамм" означает клеточный штамм, который происходит от одиночной стволовой клетки. Термин "гетерологичный клеточный штамм" означает клеточный штамм, который происходит от двух или нескольких стволовых клеток. Настоящее изобретение относится к первичным и вторичным соматическим клеткам,таким как фибробласты; кератиноциты; эпителиальные клетки; эндотелиальные клетки; глиальные клетки; нервные клетки; форменные элементы крови; мышечные клетки; другие соматические клетки, которые могут быть культивированы; и предшественники соматических клеток, где все указанные клетки являются трансфицированными экзогенной ДНК, стабильно интегрированной в их геном, или эписомально экспрессированной в клетках. Получен 003772 8 ные клетки называются, соответственно, трансфицированными первичными клетками и трансфицированными вторичными клетками. Если ген, кодирующий молекулу LAG-3,вводят в клетки млекопитающего, и эти клетки трансплантируют аллогенному или ксеногенному хозяину, то они узнаются иммунной системой хозяина, но при этом иммунный ответ не вырабатывается. Иммунная система хозяина становится неспособной отторгать клетки, которые, в противном случае, т.е. в случае, если они не были бы сконструированы так, чтобы они экспрессировали на своей поверхности молекулы LAG-3,должны были бы отторгнуться. LAG-3 может также экспрессироваться на клеточной поверхности клеток не родственного типа и может быть смешан с трансплантируемыми клетками или тканями, что приводит к результатам, аналогичным описанным выше. Таким образом,настоящее изобретение относится к трансплантации клеток, тканей или органов, в основном,без индуцирования общей иммуносупрессии. Эти клетки, ткани или органы трансплантируют в целях введения белков или индуцирования некоторых функций, необходимых для лечения некоторых заболеваний. Они могут приживляться в организме хозяина путем использования механизма, посредством которого белок LAG-3 презентируется иммунной системе хозяина. Профилактика отторжения трансплантированных специфических клеток, тканей или органов у реципиента может быть также достигнута путем совместного введения фибробластов или других первичных или вторичных клеток,которые были сконструированы так, что они экспрессируют LAG-3. Этот протективный статус может быть обусловлен локальным или общим ингибированием механизмов, опосредующих иммунные ответы. Указанный протективный статус может быть обусловлен анергией,делецией, невосприимчивостью, толерантностью или предупреждением клеточноопосредованной цитотоксичности. После установления протективного статуса, он продолжается в течение длительного периода времени,или даже длится непрерывно, что обусловлено таким явлением, как инфекционная толерантность (Qin et al., 1993). Настоящее изобретение может быть использовано для трансплантации клеток, тканей,органов или клеток-хозяев для доставки генов или генных продуктов, необходимых для различных медицинских целей. Экспрессия гена LAG-3 может быть индуцирована с помощью стандартной техники рекомбинантных ДНК или техники с использованием гомологичной рекомбинации для активации эндогенного гена LAG-3. Эти типы клеток могут быть получены от трансгенных животных, которые имеют ген LAG-3, экспрессируе 9 мый в специфических тканях или в неродственных клетках, любым методом. Затем эти клетки могут быть смешаны с клетками, в которых было бы желательно обеспечить защиту от отторжения трансплантата. Это дает основание предположить, что локальная секреция иммунопротективной молекулы LAG-3 не имеет системного действия. LAG-3-трансдуцированные нетрансформированные фибробласты дают аналогичный ответ in vivo. Иммунопротективные эффекты инокулята LAG-3-трансдуцированных фибробластов являются дозозависимыми, но не зависят от источника молекулы LAG-3. Совместное введение LAG-3-экспрессирующих клеток приводит к инактивации донорных Т-клеток и в то же время к предотвращению атакующего действия иммунной системы хозяина. Это введение индуцирует специфическую анергию, толерантность или какую-либо другую защиту от клеточно-опосредованной цитотоксичности у реципиента, которая может затем приводить к длительному изменению в иммунном микроокружении, обеспечивая защиту против аутореактивных Т-клеток. Это может быть достигнуто путем совместного введения небольшого числа аллогенных клеток костного мозга от здорового донора вместе с аллогенными клетками человека, которые были сконструированы так, что они экспрессируют LAG-3. Это приводит к снижению числа аутореактивных Т-клеток посредством развития микрохимеризма (Delaney et al., 1996). Люди со специфическими заболеваниями или дефицитными состояниями могут вылечиться благодаря аллогенной трансплантации множества различных клеток, тканей или органов. Так, например, обычно трансплантируются такие органы, как печень, почки, сердце, поджелудочная железа, тонкая кишка; и подходящими для трансплантации являются такие клетки, как островковые клетки, нервная ткань для лечения болезни Паркинсона или очаговой эпилепсии,гемопоэтические стволовые клетки для лечения состояний при химиотерапии или лучевой терапии, нормальные гепатоциты для лечения гиперхолестеринемии, клетки сердечной ткани для лечения инфаркта миокарда и мышечные клетки для лечения мышечной дистрофии. Введение аллогенных трансплантатов костного мозга является довольно трудной задачей по ряду причин. Такими причинами являются отторжение трансплантата; инфицирование,обусловленное условно-патогенной инфекцией в результате контаминации трансплантата или иммуносупрессорных лекарственных средств; или другие причины. Отторжение трансплантата может быть обусловлено резистентностью реципиента к приживлению костного мозга донора и тенденцией компетентных иммунных клеток к индуцированию иммунного ответа у реципиента, т.е. к индуцированию реакции 10 может регулироваться путем истощения Тклеток у трансплантата или путем совместного введения иммуносупрессорных лекарственных средств. При элиминации Т-клеток, вероятность приживления трансплантата снижается. В результате элиминации Т-клеток, риск отторжения трансплантата возрастает. Очевидно, эти клетки могут играть важную роль в приживлении трансплантата, такую как вырабатывание цитокинов (Kernal et al., 1987). Было показано, что только небольшое число аллогенных, но здоровых клеток костного мозга может снижать или даже предупреждать возникновение аутоиммунных заболеваний в экспериментальных моделях. Однако лечение таких болезней приводит к индуцированию реакции "трансплантат против хозяина". Трансплантация костного мозга была также использована в качестве метода уничтожения некоторых опухолей. Это может быть достигнуто благодаря способности аллогенных Тклеток распознавать и уничтожать опухолевую ткань, например, при трансплантационном лейкозе. Во всех вышеуказанных случаях, общую иммуносупрессию можно предотвратить путем создания предназначенных для трансплантации клеток или органов, которые содержали бы ген,кодирующий LAG-3, так, чтобы при их трансплантации хозяину, экспрессировался белокLAG-3 и обеспечивалась защита трансплантата. Первая проблема, возникающая при аллогенной трансплантации, заключается в недостатке трансплантируемой ткани человека и в сильно возросшем в настоящее время спросе на поставку органов. Хотя ксенотрансплантация рассматривается пока еще как экспериментальная процедура, однако, она является реальной альтернативой к аллотрансплантации. В качестве доноров клеток или органов в настоящее время используются животные, такие как свиньи или павианы. Защита от отторжения трансплантата может иметь важное значение для успешного использования органов от различных видов животных. Резистентность хозяина может быть преодолена, по крайней мере, частично,например, с использованием антител противCD4, CD8, NK-клеток, или путем микроинкапсулирования клеток животных, предназначенных для трансплантации. В соответствии с настоящим изобретением животные могут быть трансгенно модифицированы так, чтобы в их клетках некоторых типов, подобно островковым клеткам, экспрессировался ген LAG-3, что может быть осуществлено путем использования промотора гена инсулина и системы доставки,или специфической маркерной системы от других тканей. Очевидно, что экспрессия LAG-3 на опухолевой ткани играет важную роль в резистентности к клеточно-опосредованной реакции им 11 мунной системы хозяина, направленной на опухолевые ткани. В соответствии с конкретным вариантом своего осуществления, настоящее изобретение относится к использованию генной терапии или ех vivo-обработки небольшого количества опухолевой ткани и ее реимплантации, причем, указанная опухолевая ткань может быть модифицирована так, чтобы она экспрессировала антисмысловые молекулы LAG-3 или рибозимы,специфичные к транскрипту LAG-3. Это должно индуцировать реакцию иммунной системы на данную ткань, и "научить" иммунную систему разрушать эту ткань. Небольшое количество опухолевой ткани может быть также обработано антителом против LAG-3 для предупрежденияLAG-3-индуцированного игибирования Тклеток и продуцирования клеточного и гуморального иммунного ответа против этой опухоли. Генная терапия является в настоящее время наиболее предпочтительной для лечения ряда заболеваний, включая, но не ограничиваясь ими, дефицит аденозиндезаминазы (АДА), серповидноклеточная анемия, талассемия, гемофилия, сахарный диабет, дефицит альфаантитрипсина, нарушения функций головного мозга, такие как болезнь Альцгеймера, и другие заболевания, такие как нарушения роста, и сердечно-сосудистые заболевания, вызываемые изменениями в пути метаболизма холестерина,и нарушения иммунной системы. Для трансплантации индивидуумам, нуждающимся в такой трансплантации, могут быть использованы различные клетки, например, миобласты для доставки дистрофина; клетки, секретирующие такой материал, как ТРО, GH, ЕРО,Фактор IX или другие факторы; клетки крови для лечения не наследственных болезней крови; и другие первичные клетки человека или животных, такие как эндотелиальные клетки, эпителиальные клетки, клетки соединительной ткани, фибробласты, мезенхимальные клетки, мезотелиальные клетки и паренхиматозные клетки. Результаты генной терапии были не совсем удачными, что обусловлено рядом проблем. Даже при наиболее успешных испытаниях, в которых молодая девушка проходила курс лечения с использованием гена аденозиндезаминазы(АДА), пациентке все еще еженедельно вводили инъекцию ПЭГ-АДА из-за опасений, что одна генная терапия окажется неэффективной. Один из недостатков существующих на сегодняшний день схем генной терапии заключается в том, что она требует индивидуального продуцирования клеток-хозяев для предупреждения отторжения клетки иммунной системой хозяина. Генная терапия должна быть осуществлена индивидуально для каждого отдельного пациента. Кроме того, было установлено, что экспрессия трансгенов является, обычно, крат 003772 12 ковременной, что обусловлено экспрессией других вирусных белков, которые "отвлекают на себя" иммунную систему хозяина даже при использовании аутологичных клеток для генной терапии. Были использованы аттенюированные аденовирусные векторы, но в этом случае возникают проблемы, связанные с другими экспрессируемыми вирусными белками, которые продуцируют иммунный ответ. Большие концентрации вируса, даже ослабленного, стимулируют воспалительную реакцию и иммунный ответ. Клетки иммунной системы хозяина "запоминают" вирусный вектор, в результате чего,последующие введения будут даже менее эффективными. Обычно в схемах генной терапии используются дефектные по репликации аденовирусы,у которых был делетирован вирусный белок E1. К сожалению, они обладают лишь кратковременным действием у взрослых иммунокомпетентных хозяев, что вероятно обусловлено иммунным ответом, направленным против аденовирусных или рекомбинантных белков (KozarskyWilson, 1993; Barr et al., 1992; Stratford etal., 1992; Rosenfeld et al., 1992; Lemarchand et al.,1992). Поэтому существует крайняя необходимость в разработке новых векторов, которые не являются такими иммуногенными, или в разработке методов, которые обеспечивают иммунологическую защиту генетически сконструированных клеток. Эти векторы были получены с высоким титром, составляющим вплоть до 1011 колониеобразующих единиц на один мл, и они инфицируют многие реплицирующиеся и не реплицирующиеся клетки. Дефектные по репликации аденовирусы используют для доставки физиологических уровней рекомбинантного белка в систему кровообращения. Ген LAG-3 находится предпочтительно под транскрипционным контролем конститутивно активного клеточного промотора EF1 и энхансера 4F2HC (Tripathy etal., 1994). Были сделаны попытки избежать этой проблемы путем инкапсулирования клеток и путем индуцирования иммуносупрессии хозяина. В методах, описанных в настоящей заявке,ксеногенные или аллогенные клетки могут быть использованы в качестве хозяев для генной терапии, экспрессирующих молекулу LAG-3 на своей поверхности, в результате чего будет обеспечиваться защита трансплантата от отторжения иммунной системой хозяина. Такими клетками являются, например, миобласты, фибробласты, гемопоэтические стволовые клетки,эмбриональные стволовые клетки, фетальные гепатоциты, эндотелиальные клетки пупочной вены или клетки СНО. Клетки-хозяева для генной терапии могут быть также сконструированы так, чтобы они экспрессировали ген тимидин 13 киназы вируса простого герпеса. Такие клетки могут быть специфически разрушены путем добавления ганцикловира. Клетки, восприимчивые к tk-ганцикловиру имеют преимущество перед невосприимчивыми клетками, заключающееся в том, что они могут быть удалены в любое время (Bi et al., 1993). Универсальная клетка-хозяин, полученная в соответствии с настоящим изобретением, экспрессирует ген LAG-3 и ген Hsv-tk на своей поверхности, что позволяет, тем самым, генерировать универсальные клетки-хозяева для генной терапии, которые могут быть имплантированы без индуцирования иммуносупрессии, и которые могут быть разрушены в любое время, когда их активность больше не нужна. Аллогенные или ксеногенные клеткихозяева для генной терапии настоящего изобретения, которые экспрессируют трансген и/или ген LAG-3, могут быть сконструированы любыми методами переноса гена, такими как, но не ограничиваясь ими, метод с использованием дефектных по репликации вирусов, аденоассоциированного вируса, ретровируса высокой эффективности; прямая инъекция ДНК в костный мозг; электропорация; трансфекция с использованием фосфата кальция; микроинъекция; инкапсуляция в липосомы или "тени" эритроцита. Клетки, экспрессирующие LAG-3, такие как миобласты, или клетки СНО, могут быть введены совместно с клетками, экспрессирующими нужный белок, для длительного приживления. Если достаточно кратковременного воздействияLAG-3, то LAG-3-трансфицированные миобласты или клетки СНО могут содержать ген"самоубийцу", такой как ген tk, упомянутый выше, так, чтобы они могли быть удалены после введения ганцикловира. Этот метод может быть использован для восстановления нормальной функции при введении гена или генного продукта, либо для удаления или инактивации гена, который опасен для организма (такой как онкоген). Эта цель может быть также достигнута путем имплантации клеток, которые доставляют рибозимы или антисмысловую кДНК для ингибирования продуцирования нежелательного белка, такого как белки ВИЧ или факторы роста. Этот метод может быть использован для коррекции состояния дефицита ферментов, такого как болезнь Гоше или дефицит АДА. В соответствии с другим вариантом своего осуществления настоящее изобретение относится к способу генной терапии, предусматривающему: (i) введение в выбранные клетки человека или животного гена, необходимого для этой терапии, и гена, кодирующего молекулу LAG-3; и (ii) введение пациенту клеток, полученных в стадии (i). Альтернативно вышеуказанные гены могут быть введены в ткань или орган пациентаin vivo путем прямой трансфекции генов как 14 таковых или в носителе, который доставляет эти гены в такую ткань или орган. Так, например, заявленная система экспрессии позволяет инъецировать "оголенную" ДНК или вирусный вектор непосредственно в клетки определенного типа, такие как мышечные клетки, или вводить их непосредственно в дыхательные пути (например, для лечения кистозного фиброза). Эта конструкция содержит не только нужный ген (такой как ген-регулятор проводимости (кДНК CFTR), но также и генLAG-3, предназначенный для коэкспрессии на клетке определенного типа в целях предупреждения возможного гуморального иммунного ответа, например, против капсидных аденовирусных белков, который может ограничивать эффективность повторного введения. Для устранения побочного действия, заключающегося в вызываемой химиотерапией супрессии быстро делящихся иммунных клеток, может быть использован перенос гена в гемопоэтические стволовые клетки в целях введения генов резистентности к нескольким лекарственным средствам. Для стимуляции деления стволовых клеток могут быть использованы ретровирусные векторы в комбинации с цитокинами, такими как фактор Steel, лиганд из готового набора, IL3, GM-CSF, IL-6, G-CSF, LIF, IL-12. Выбранные клетки могут быть котрансфицированы, помимо гена LAG-3, генами, кодирующими другие иммуносупрессорные агенты,такие как IL-10, TGF-, Fas-лиганд. В конкретном варианте осуществления настоящего изобретения вышеописанные способы используются для лечения реципиента с использованием небольшого числа представляющих интерес клеток, сконструированных так, что они экспрессируют ген LAG-3, который сообщает хозяину толерантность к последующему введению клеток, тканей или органов, обусловленную толерантностью к этой инфекции иммунной системы хозяина. Более подробно настоящее изобретение описано ниже со ссылками на следующие иллюстративные примеры. Пример 1. Методы. Генерирование клеток СНО, экспрессирующих трансмембранный LAG-3 кДНК LAG-3 вырезали в виде 1650 п.o.Xho-фрагмента из плазмиды pCDM8 (InvitrogenpCLH3AXSV2DHFRhIVSA (D) (фиг. 3), гидролизованный ферментом Xho. Клетки CHODUKX (DHFR-) трансфецировали с использованием конструкции DLAG-3 методом осаждения CaPO4. Трансфецированные клетки культивировали в среде для отбора (в среде MEM без 15 дезокси- и рибонуклеотидов + 10% диализованной фетальной бычьей сыворотки + 1% Lглутамина + 0,02 мкМ метотрексата). Экспрессию LAG-3 оценивали посредством Вестернблоттинга на лизированных препаратах клеточных мембран и периодически оценивали путем проведения проточной цитометрии с использованием моноклонального антитела 17 В 4 противLAG-3. Трансплантация клеток СНО мышам Клетки яичек китайского хомячка (СНО),либо нетрансфецированные (дикого типа), либо трансфецированные полноразмерным LAG-3 человека или кДНК LH человека, были отделены от пластиковых колб и суспендированы в минимальной поддерживающей среде, модифи 003772 16 цированной по способу Дульбекко (DMEM),при концентрации 1,75 х 107 клеток/мл. 26 самок 7-9 недельных мышей C57BL/6 разделяли на 7 групп, как указано в табл. 1, и 200 мл указанной клеточной суспензии, содержащей 3,5 х 106 клеток, подкожно инъецировали каждому животному в правый бок. В группах 3, 6 и 7 тем же мышам в правый бок инъецировали LAG-3 трансфецированные клетки, а в другой бок инъецировали контрольные клетки(LHтрансфецированные или нетрансфецированные). Через четыре дня после инъекции мышей умерщвляли путем ингаляции СО 2 и кожу в месте инъекции вскрывали для осмотра участка инъекции. Таблица 1 Экспериментальные группы Клетки СНО, инъецироИдентификация мышей ванные в правый бок 1-5 дикого типа 6-10 Оценка цитотоксичности против клеток СНО Пяти самкам мышей C57BL/6 на каждую группу подкожно (s.c.) инъецировали 4 х 105 клеток СНО, трансфецированных либо человеческим LH, либо кДНК человеческого LAG-3. Через 14 дней мышей умерщвляли и удаляли селезенку для получения суспензии спленоцитов. Суспензии спленоцитов (эффекторы) разводили в культуральной среде (RPMI 1640 + 10% фетальной бычьей сыворотки + антибиотики) при плотности 107 клеток/мл и засевали в тройных дубликатах с различными разведениями в целях получения различных отношений эффектор/мишень; для каждой суспензии приготавливали 2 планшета. В эти планшеты (один для каждой мишени) добавляли клетки-мишени(либо LH-, либо LAG-3-трансфецированные клетки) при концентрации 5 х 103 клеток/100 мкл, меченные 51 Сr. После 20-часового культивирования при 37 С из каждой лунки брали 20 мкл супернатанта и оценивали высвобождение 51 Сr с помощью жидкостного сцинтиллятора. Цитотоксическую активность вычисляли как процент лизиса в соответствии со следующей формулой: где "спонт" и "макс" относятся к лункам, содержащим культуральную среду (спонтанное вы Клетки СНО, инъецированные в левый бок дикого типа дикого типа свобождение Сr из клеток-мишеней) и 1% Тритон Х (максимальное высвобождение Сr), вместо суспензии эффектора соответственно. Результаты. Трансплантация клеток СНО мышам У большинства мышей, которым были введены LAG-3-трансфецированные клетки,обнаруживались белые узелковые утолщения в месте инъекции, которые не наблюдались у мышей, обработанных клетками СНО дикого типа, или у мышей, обработанных LHтрансфецированными клетками СНО. У большинства мышей, инъекция клеток СНО дикого типа вызывала появление диффузной геморрагии в месте инъекции. Это явление было меньше выражено у животных, которым инъецировали LH-трансфецированные клетки. У мышей,которым инъецировали как клетки дикого типа,так и LAG-3-трансфецированные клетки СНО в разные участки, эти узелковые утолщения наблюдались только в месте инъекции в случае клеток дикого типа, тогда как геморрагии наблюдались в месте другой инъекции (табл. 2). Гистологический анализ, осуществленный ранее в аналогичном эксперименте, выявил присутствие гетерологичных клеток в узелковых утолщениях. Результаты этого эксперимента показаны на прилагаемых чертежах (см. табл. 1 для идентификации мышей) и систематизированы в табл. 3. Таблица 2 Частота (число положительных данных/общее число Инъецированные инъецированных участков)мышей клетки геморрагия узловое утолщениеLAG-3+LH 2 0/2(b) 1/2(a) 0/2(b) 2/2(а)Клетки каждого типа были инъецированы отдельно в один бок(c) = участок, в который вводили WT Инъецированные клетки СНО дикого типа Таблица 3 Частота (число положительных данных/общее число инъецированных участков) геморрагия узловые утолщения 8/12 (67%) 0/12 (0%) 1/4 (25%) 1/4 (25%) 2/19 (11%) 16/19 (84%) Цитотоксичность против клеток СНО Экспрессия LAG-3 на поверхности клеток СНО не влияет на способность мышей к иммунологическому примированию против ксеногенных клеток. Действительно, спленоциты мышей, которым были инъецированы клеткиLAG-3-CHO, лизировали оба типа клетокмишеней так же эффективно, как и клетки мышей, примированных клетками LH-CHO, и более эффективно, чем клетки непримированных мышей. Однако экспрессия LAG-3 на клеточной поверхности ассоциировалась с более низкой восприимчивостью к цитотоксической активности, индуцированной путем иммунизации мышей, по отношению к клеткам-мишеням, как можно видеть из сравнения процента лизиса на фиг. 1 и 2. При этом "природная" цитотоксичность, индуцированная спленоцитами от непримированных мышей, не снижалась при экспрессии LAG-3 на поверхности клетки. Это свидетельствует о том, что экспрессия LAG-3 на поверхности клетки способствует снижению активности эфферентной ветви цитотоксических Т-лимфоцитов (ЦТЛ). ЦТЛ представляют собой один из типов эффекторных клеток, которые играют важную роль в отторжении трансплантированных органов (G. Berke, 1993), а поэтому ингибирование их функции может продлить жизнь аллотрансплантатов. Литература 1. Triebel et al., J. Exp. Med., 171: 1393,1990 2. Baixeras et al., J. Exp. Med., 176: 327,1992 3. Huard et al., Immunogenetics, 39: 213,1994A 4. Huard et al., Eur. J. Imunol., 24: 3216,1994 В. 5. Huard et al., Eur. J. Immunol., 26: 11801186, 1996Genet. Dev., 3: 499, 1993 18. Barr et al., Gene Therapy, 1: 51, 1992 19. Stratford et al., J. Clin. Inves, 90: 626,1992 20. Rosenfeld et al., Cell 68: 143, 1992 21. Lemarchand et al., PNAS, 89: 6482,1992 22. Tripathy et al., PNAS, 91: 11557, 1994 23. Bi et al., Human Gene Therapy 4: 725,1993 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение штамма генетически сконструированных эукариотических клеток, содержащих ДНК, кодирующую трансмембранный белок LAG-3, экспрессирующийся на поверхности указанных клеток, для защиты трансплантата от отторжения иммунной системой хозяина. 2. Применение по п.1, где указанная ДНК,кодирующая белок LAG-3, является экзогенной. 19 3. Применение по п.1, где указанная ДНК,кодирующая белок LAG-3, является эндогенной и ее экспрессия активируется или модифицируется путем направленного встраивания регуляторной последовательности и/или амплифицируемого гена посредством гомологичной рекомбинации. 4. Применение по любому из пп.1-3, где указанные клетки принадлежат ткани или органу, подлежащим трансплантации. 5. Применение по любому из пп.1-3, где указанные клетки являются клетками-хозяевами для генной терапии. 6. Применение по п.5, где генная терапия является соматической или ex vivo генной терапией. 7. Применение по любому из пп.1-6, где указанные клетки являются клетками трансгенного животного. 8. Применение по любому из пп.1-7, где указанные клетки выбраны из миобластов, фибробластов, гемопоэтических стволовых клеток,эмбриональных стволовых клеток, гепатоцитов плода, эндотелиальных клеток пупочной вены или клеток СНО. 9. Применение комбинации штамма генетически сконструированных эукариотических клеток, содержащих ДНК, кодирующую трансмембранный белок LAG-3, экспрессирующийся на поверхности указанных клеток, и дополнительного иммуносупрессорного агента, например IL-10, TGF- или Fas-лиганда, для защиты трансплантата от отторжения иммунной системой хозяина. 20 10. Применение по п.9, где указанные клетки являются клетками трансгенного животного. 11. Применение по п.9 или 10, где указанные клетки выбраны из миобластов, фибробластов, гемопоэтических стволовых клеток, эмбриональных стволовых клеток, гепатоцитов плода, эндотелиальных клеток пупочной вены или клеток СНО. 12. Применение штамма генетически сконструированных эукариотических клеток, содержащих ДНК, кодирующую трансмембранный белок LAG-3, экспрессирующийся на поверхности указанных клеток, и ген тимидинкиназы(tk), который сообщает этим клеткам восприимчивость к системе "самоубийства" под действием tk-ганцикловира, для защиты трансплантата от отторжения иммунной системой хозяина. 13. Применение по п.12, где указанные клетки являются клетками трансгенного животного. 14. Применение по п.12 или 13, где указанные клетки выбраны из миобластов, фибробластов, гемопоэтических стволовых клеток, эмбриональных стволовых клеток, гепатоцитов плода, эндотелиальных клеток пупочной вены или клеток СНО. 15. Применение штамма генетически сконструированных эукариотических клеток, содержащих ДНК, кодирующую трансмембранный белок LAG-3, экспрессирующийся на поверхности указанных клеток, для изготовления лекарственного средства для индуцирования защиты трансплантата от отторжения иммунной системой хозяина.
МПК / Метки
МПК: A61P 37/06, C07K 14/52, C12N 15/19, A61K 48/00
Метки: штамма, иммунной, генетически, отторжения, средство, кодирующую, основе, трансплантата, сконструированных, трансмембранныйбелок, днк, эукариотических, клеток, хозяина, содержащих, обеспечения, защиты, lag-3, системой
Код ссылки
<a href="https://eas.patents.su/12-3772-sredstvo-dlya-obespecheniya-zashhity-transplantata-ot-ottorzheniya-immunnojj-sistemojj-hozyaina-na-osnove-shtamma-geneticheski-skonstruirovannyh-eukarioticheskih-kletok-soderzhashh.html" rel="bookmark" title="База патентов Евразийского Союза">Средство для обеспечения защиты трансплантата от отторжения иммунной системой хозяина на основе штамма генетически сконструированных эукариотических клеток, содержащих днк, кодирующую трансмембранныйбелок lag-3</a>
Предыдущий патент: Композиция пропофола, включающая пентетат
Случайный патент: Производство анионоактивных моющих частиц