Стопчатые моделированные биоматериалы и/или подложки для тканевой инженерии
Номер патента: 17224
Опубликовано: 30.10.2012
Авторы: Врана Нихал Энгин, Хасирси Васиф, Зорлотуна Пинар
Формула / Реферат
1. Способ получения стопочных моделированных биоматериалов и/или 3D подложек для тканевой инженерии, имеющих физические, химические и структурные особенности поверхности, характеризующийся следующими стадиями:
получение раствора полимера типа коллаген,
заливание раствора на моделированные шаблоны, полученные на кремниевых пластинках путём фотолитографии, или электронно-лучевой литографией, или интерференционной литографией, или штампованием, или контактной литографией и имеющие микромоделированную или наномоделированную структуру типа булыжной мостовой, столбиков, 2D полос, квадратов, кругов и 3D структур,
сушка и отделение плёночных структур от шаблонов,
осуществление процедуры сшивки для получения стабильных пленок,
промывка пленок,
соединение нескольких сшитых пленок друг с другом, где количество точек спайки/контакта, относительная ориентация поверхностных, топографических особенностей, размер и геометрия особенностей, габариты каждого плёночного слоя и количество слоев регулируются в течение производственного процесса согласно определённым потребностям ткани-мишени.
2. Способ по п.1, характеризующийся тем, что раствор коллагена имеет концентрацию 2-25 мг/мл.
3. Способ по п.1 или 2, характеризующийся тем, что количество заливаемого на шаблон раствора коллагена составляет 50 мкл - 1 мл на 1 см2 поверхности шаблона.
4. Способ по любому из предшествующих пунктов, характеризующийся тем, что сушку осуществляют в течение 10-24 ч при комнатной температуре с циркуляцией любого газа или воздуха.
5. Способ по любому из предшествующих пунктов, характеризующийся тем, что сшивку осуществляют преимущественно инкубацией в EDC и NHS.
6. Способ по любому из предшествующих пунктов, характеризующийся тем, что продолжительность сшивки составляет от 30 мин до 4 ч в зависимости от требуемой степени сшивки, при температуре от +4 до 37°С, где верхний предел определяется денатурацией коллагена при температурах выше 37°С, преимущественно 2 ч при комнатной температуре.
7. Способ по любому из предшествующих пунктов, характеризующийся тем, что сшивку осуществляют с помощью глютаральдегида, генипина, дендримеров.
Текст
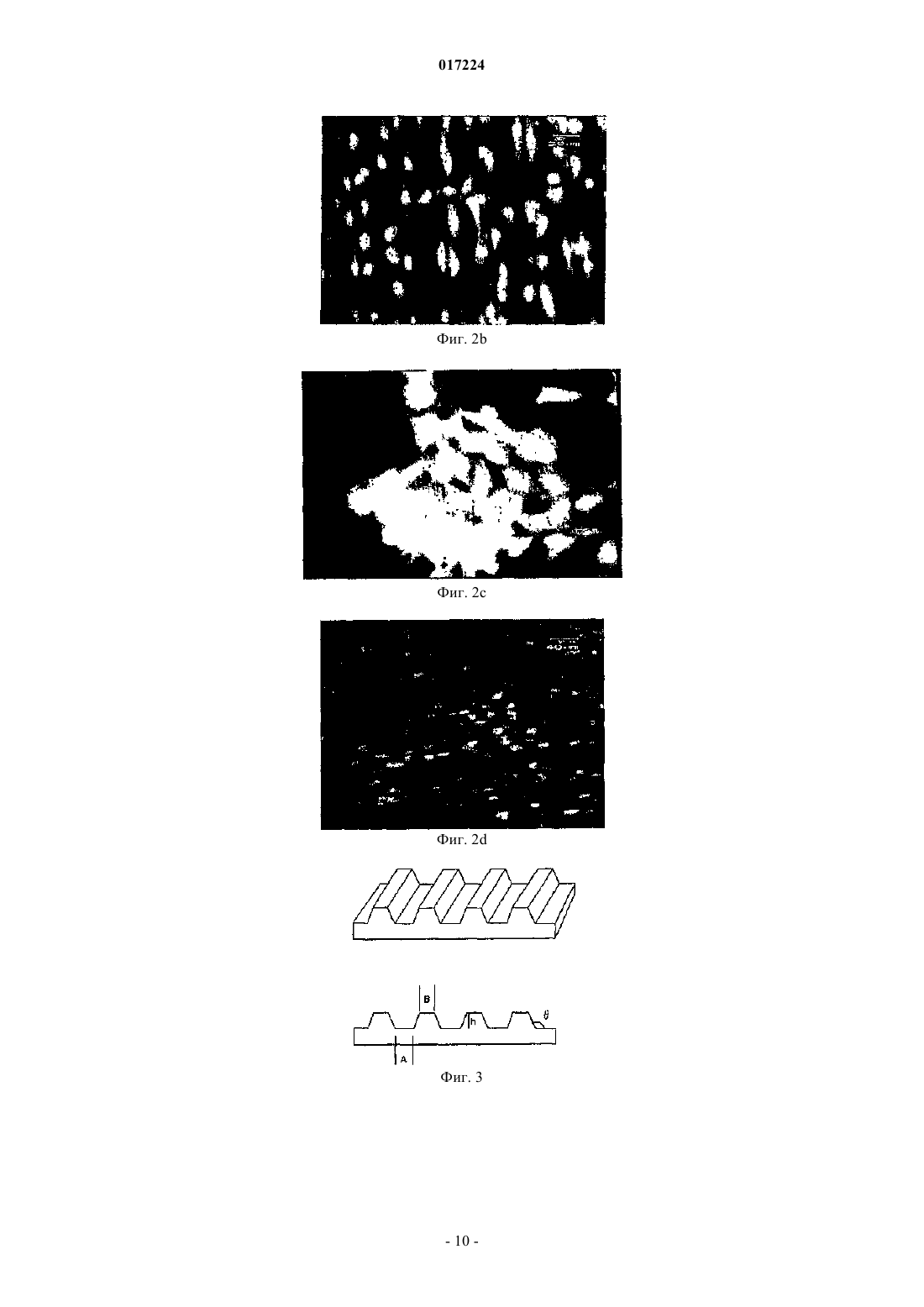
СТОПЧАТЫЕ МОДЕЛИРОВАННЫЕ БИОМАТЕРИАЛЫ И/ИЛИ ПОДЛОЖКИ ДЛЯ ТКАНЕВОЙ ИНЖЕНЕРИИ Разработаны сложенные, слоистые конструкции, включающие синтетические или природные полимерные мембраны, которые соединены вместе с образованием 3D (трехмерных) подложек для биоматериалов, применяемых в тканевой инженерии. Каждый слой может иметь одинаковые или отличающиеся друг от друга 2D и 3D (двухмерные и трехмерные) нано- и микротопографические особенности, которые создаются в процессе конструирования каждого слоя или ламеллы, и их организация может регулироваться на стадии конструирования 3D структуры. Такая конструкция используется для создания искусственной роговой оболочки с первичными человеческими клетками, в которой моделированная или скопированная поверхность компонентов ламеллярной структуры подражает ориентированной структуре коллагена в естественной роговой оболочке. Подобное применение трехмерной шаблонной структуры может быть осуществлено для тканей,где упорядоченная структура ВКМ является критической, типа связок, костей, сухожилий, кожи. 017224 Область изобретения Целью изобретения является улучшение эффективности биоматериалов и подложек для тканевой инженерии путем точного регулирования топографии поверхности 3D (трехмерного) биоматериала или структуры для тканевой инженерии, используя полимерные нано и микромоделированные структурные элементы (элементарные звенья). Предпосылки создания изобретения Как альтернативный метод трансплантации для восстановления поврежденной или утерянной ткани тканевая инженерия использует подложки, которые являются пермиссивными для клеточного роста и могут деградировать и модернизироваться в естественных условиях in vivo. Большинство подложек для тканевой инженерии предназначены для того, чтобы обеспечить достаточное место для клеточного роста и имеют случайную пористость для молекулярной и клеточной диффузии. Найдено, что можно воздействовать на модернизацию процесса путем расположения на поверхности подложки для тканевой инженерии физических или химических стимуляторов клеток. Ответные реакции клеток варьируются в пределах от ориентации клеток до выровненной внеклеточной матричной секреции к более тонким изменениям, таким как степень дифференциации. Для многих тканей сложная внеклеточная матричная структура является критической для функциональных свойств ткани и свойства ткани в основном зависят от ориентации молекул внеклеточного матрикса (ВКМ), типа коллагена и эластина, и распределения клеток. Природные ткани содержат в основном более одного типа клеток в каждом индивидуальном слое,расположенном в определенной пространственной ориентации по отношению друг к другу. Эта ориентация и разделение являются важными для функционирования этих тканей. Например, ткань роговицы содержит 5 различных слоев и 3 различных типа клеток и для того, чтобы создать искусственную роговицу, необходимо имитировать их пространственную организацию. Таким образом, подложка для тканевой инженерии для сложных тканей с более чем одним типом клеток должна обеспечить необходимое разделение между различными типами клеток и в то же самое время должна позволить взаимодействие между различными типами клеток через физически и химически доступные стимуляторы. Большинство современных подложек для тканевой инженерии имеют гомогенные формы, типа пены со случайным, рандомизированным распределением пор или имеют двухмерные (2D) или трехмерные (3D) особенности, ограниченные поверхностью, которые в свою очередь могут воздействовать на 2D организацию клеток. Различные типы клеток реагируют с различными топографическими особенностями(тип и величина) и точная имитация или моделирование этих различий на подложках для тканевой инженерии улучшили бы их эффективность. Например, показано, что ответные реакции роговичных эпителиальных и стромальных клеток на поверхностные стимуляторы различны и размеры оптимальных топографических особенностей поверхности каждого типа клеток различны. Так трехмерная конструкция ламеллы или тонкого слоя с уникальными 2D или 3D свойствами может обеспечить различные топографические особенности каждого слоя и позволит создать подложку, подходящую для сложной многослойной многоклеточной ткани. Таким образом, биоматериалы указанной конструкции могут быть полезны для тканевой и не тканевой инженерии. Кроме того, клеточные биоматериалы с моделированными и сложенными с образованием многослойных конструкций слоями могут быть предпочтительнее биоматериалов с одним не моделированным слоем из-за их повышенной организации и таким образом могут более точно имитировать ткань, которую они имитируют и/или заменяют. Краткое изложение сущности изобретения Настоящее изобретение описывает трехмерную мультиламеллярную конструкцию, полученную из предварительно изготовленной индивидуальной ламеллы природного или синтетического полимерного происхождения, которая имеет микро- или нано- поверхностные особенности, предназначенную для воздействия на функциональные характеристики биоматериала или поведение клетки. Изобретение включает различные, разработанные для различных полимеров, способы получения трехмерных конструкций и трехмерных подложек различных размеров и рисунков, как физических так и химических, в отношении ориентации ламелл и различных особенностей поверхности, и мультиламеллярных или многослойных структур различной толщины. Изобретение также относится к применению этих структур в основном в биоматериалах и, в особенности, в подложках для тканей в тканевой инженерии, особенно для тканимишени роговицы. Иллюстрирующие настоящее изобретение примеры выполнены с двумя различными полимерными веществами: 1) полиэфиром сополимера L-лактида с D,L-лактидом P(L/DL)LA) и сополимера 3 гидроксимасляной кислоты с 3-гидроксивалериановой кислотой (PHBV) и 2) коллагеном. Коллагеновые и P(L/DL)LA )-PHBV мембраны с топографическими особенностями на микро пластинках получали, используя методы фотолитографии и мягкой литографии с последующим формованием окунанием в раствор. Затем твердые мембраны соединяли вместе путем подведения тепла к определенным контактным точкам, тщательно определенным с учетом желательных для определенного применения механических свойств. Второй разработанный способ представляет собой применение минимальных количеств подходящего растворителя в контактных точках для локального смачивания с последующим процессом сушки. Третий метод включает применение сшивающего раствора, в котором прочность связывания двух слоев-1 017224 можно регулировать концентрацией, количеством и типом сшивающего раствора. Следующее детальное описание воплощения изобретения и прилагаемые рисунки, фигуры и описания к ним только иллюстрируют изобретение и не должны быть расценены как ограничивающие его объем. Дальнейшие особенности и аспекты настоящего изобретения станут очевидными для специалиста в данной области после прочтения и понимания следующего детального описания. Краткое описание фигур Сопутствующие рисунки, которые включены в описание и являются частью описания, схематично иллюстрируют одно или более типичных воплощений изобретения и вместе с основным, приведенным выше описанием и приведенными ниже детальными предпочтительными воплощениями изобретения,служат для объяснения изобретения. Фиг. 1 а: СЭМ микроснимок моделированной коллагеновой пленки. Фиг. Ib: Стереомикроснимок моделированной коллагеновой пленки (Увеличение 30) Фиг. 1 с: Стереомикроснимок трехмерной многослойной конструкции на основе коллагеновой пленки. В каждом слое направление моделирования ортогонально к последующему слою. Из-за прозрачности коллагеновой пленки могут быть видны нижние слои. Фиг. 1d: Флуоресцентный микроснимок (окрашивание клеточных ядер 4',6-диамидино-2 фенилиндол дигидрохлоридом (ДАПИ многослойной коллагеновой пленки, обсемененной роговичными кератоцитами человека, после 14 дней инкубации. Фиг. 1 е: Флуоресцентный микроснимок (окрашивание клеточных ядер 4',6-диамидино-2 фенилиндол дигидрохлоридом (ДАПИ отдельного моделированного коллагенового пленочного слоя,обсемененного другим типом клеток, D407 ретинальными пигментными эпителиальными клетками, после 7 дней инкубации. Фиг. 1f: Флуоресцентный микроснимок (окрашивание клеточных ядер акридиновым оранжевым) отдельной моделированной коллагеновой пленки, обсемененной роговичными кератоцитами человека,после 7 дней инкубации. Фиг. 1g: Флуоресцентный микроснимок, показывающий распределение ФИТЦ-меченного (флуоресцеин изотиоцианатом), окрашенного фаллоидином элемента цитоскелета (F-актин) и ориентацию роговичного кератоцита человека на отдельном слое моделированных коллагеновых пленок после 7 дней инкубации. Фиг. 1h: Скорость пролиферации человеческого роговичного кератоцита на трехслойной коллагеновой многослойной пленке в соответствии с пробирным анализом на основе восстановления красителяAlamar Blue. В качестве контроля использовали полистирольную тканевую культуру. Фиг. 2 а: СЭМ (сканирующая электронная микроскопия) микроснимок двухслойных A3 моделированных P(L/DL)LA) - PHBV пленок. Пленки соединяли вместе в такой ориентации, чтобы оси моделирования были ортогональны друг другу. Фиг. 2b: Флуоресцентный микроснимок (окрашивание клеточных ядер акридиновым оранжевым) обсемененной D407 ретинальными пигментными эпителиальными клетками моделированнойP(L/DL)LA)-PHBV пленки после 1 дня инкубации. Фиг. 2 с: Флуоресцентный микроснимок (окрашивание клеточных ядер акридиновым оранжевым) обсемененной D407 ретинальными пигментными эпителиальными клетками моделированнойP(L/DL)LA)-PHBV пленки после 7 дней инкубации. Фиг. 2d: Флуоресцентный микроснимок (окрашивание клеточных ядер 4',6-диамидино-2 фенилиндол дигидрохлоридом (ДАПИ обсемененных роговичными кератоцитами человека моделированных P(L/DL)LA)-PHBV пленок после 21 дня инкубации. Фиг. 3: Увеличенное перспективное изображение шаблона (темплата) (А: ширина бороздки, В: ширина выступа, h: глубина бороздки, 6: угол наклона) Фиг. 4 а: Световая микрофотография шаблона (микромоделированный кремниевый шаблон - 350)(Sm: гладкая не моделированая область, МР: микромоделированная область),Фиг. 4b: Световая микрофотография полимерной пленки, полученной в шаблоне (микромоделированная PHBV-P(L/DL)LA пленка- 100) (Sm: гладкая не моделированная область, МР: микромоделированная область. Детальное описание изобретения В разработанных в настоящем изобретении способах использовали полимеры природного или синтетического происхождения. Были приготовлены растворы коллагена и растворы смесей полиэфиров природного и синтетического происхождения в различных соотношениях с различными концентрациями. Как пример полиэфиров использовали смеси P(IZDL)LA и PHBV. Растворы заливали на моделированные шаблоны, полученные на кремниевых пластинках фотолитографией или полученные переносом рисунков "параллельные бороздки и выступы" с первичных шаблонов, сделанных из кремниевых пластинок, на вторичные шаблоны. Мембранные структуры, которые имеют обращенный профиль поверхности моделированных шаблонов, были получены формованием окунанием в раствор. Структура шабло-2 017224 нов может иметь любые топографические особенности, такие как выступы и бороздки любого размера,связанные наклонными поверхностями под любым градусом наклона. Любой тип микромоделированной структуры, типа булыжной мостовой, столбиков, 2D полос, квадратов, кругов и т.д., может быть получен или фотолитографией, или для наномоделированных структур электронно-лучевой литографией, или интерференционной литографией, или штампованием, или контактной литографией, или литографией на основе АСМ (атомно-силовой микроскопии) с получением любой необходимой 3D структуры. Так как трехмерная (3D) структура природных полимеров вообще очень чувствительна к грубой обработке, был изобретен протекающий в мягких условиях химический метод создания трехмерного(3D) многослойного коллагена. Раствор коллагена в уксусной кислоте заливали на микромоделированные шаблоны (темплаты) и после высушивания раствора воздухом отделяли образовавшиеся коллагеновые пленки. В качестве раствора коллагена могут использоваться различные растворы. В качестве примера можно привести 0,2 мл, 15 мг/мл в 0,5 М уксусной кислоте. Для стабилизации этих пленок осуществляют процедуру сшивки. Процедуру сшивки выполняют путем инкубации в 1,2 дихлорэтане (EDC) и Nгидроксисукцинимиде (NHS). Например, сшивка может быть достигнута инкубацией в 33 мМ EDC и 6 мМ NHS в 50 мМ буфераNaH2PO4 (pH 5,5) в течение 2 ч при комнатной температуре. Конструкции промывали буфером Na2HPO4(pH 9,1) 1 ч и затем последовательно промывали 1 и 2 М NaCl. Соединение нескольких сшитых пленок друг с другом осуществляли путем добавления разбавленного раствора коллагена в 0,1% уксусной кислоте. Добавление растворителя вызывает до некоторой степени ограниченное, локальное растворение в зависимости от концентрации и количества растворителя. Последующая воздушная сушка обеспечивает контакт между мембранами из-за одновременного растворения и сушки в тех местоположениях, которые входят в контакт с растворителем. Разработан второй метод соединения коллагеновых пленок, использующий раствор коллагена и концентрированный сшивающий раствор. Раствор коллагена наносили в желательных точках контакта,где он действует как клей между этими двумя слоями, и после добавления раствора коллагена добавляли концентрированный сшивающий раствор, состоящий из EDC/NHS, для связывания коллагена в растворе с этими двумя мембранами. Благодаря этому методу, изменяя параметры, такие как концентрация раствора коллагена и концентрация сшивающего раствора, можно точно регулировать прочность контакта.P(L/DL)LA-PHBV мембраны получали путем формования окунанием в раствор P(LZDL)LA иPHBV в органических растворителях, типа хлороформа или дихлорметана, с получением микромоделированных мембран с инверсией профильных размеров как таковых с шаблона. Микромоделированные кремниевые шаблоны различных размеров и конфигураций изготавливали фотолитографией с последующим химическим травлением. Сформированные мембраны удаляли путем отслаивания (средняя толщина пленки 42 мкм) и соединяли их друг с другом путем подвода тепла к 4 углам и расплавляя тем самым полимерные пленки в этих точках. Альтернативно, связывание может быть выполнено как в случае коллагеновых конструкций, помещая капельку растворителя в углах, что вызывает локальное некоторое растворение полимера в зависимости от количества растворителя. Воздушная сушка структуры обеспечивает контакт между двумя мембранами из-за одновременного растворения и сушки в точках,которые входят в контакт с растворителем. Количество точек спайки/контакта, относительная ориентация поверхностных топографических особенностей, размер и геометрия особенностей, габариты каждого пленочного слоя и количество слоев может регулироваться в течение производственного процесса согласно определенным потребностям ткани -мишени. Если требуется слой ткани с каждым слоем, имеющим различную организацию и клетки,можно отдельно изготовить множество слоев с различной ориентаций и затем их соединить вместе с тем,чтобы создать многослойную мультиориентированную конструкцию. Если необходим усиленный уровень взаимодействия между различными присутствующими типами клеток или, если требуется увеличенная проницаемость для переноса растворенных веществ, факторов роста и биоактивных агентов, то могут быть созданы частично пористые пленки путем добавления соответствующих частиц растворенного вещества желаемых размеров и их последующего растворения подходящим растворителем, который растворяет только эти частицы, а не пленочный материал. Подобное свойство может быть достигнуто путем образования пор под воздействием корпускулярного и электромагнитного излучения. Если необходим градиент биоактивных агентов, типа факторов роста, эти агенты могут быть растворены в мембране. Пример. Пленочный препарат Были получены три типа пленок: 1) Моделированные (P(L/DL)LA-PHBV пленки на профильной модели Тип 1,2) Моделированные (P(L/DL)LA-PHBV пленки на профильной модели Тип 2,3) Моделированные коллагеновые пленки на иверсивной профильной модели Тип 1. Пленки были получены путем формования окунанием в раствор, как описано выше; геометрия и размеры профильной модели приведены в табл. 1.-3 017224 Таблица 1. Геометрия и габариты используемых профильных моделей Многослойный препарат Моделированные пленки (P(LZDL)LA-PHBV соединяли друг с другом термической обработкой по краям пленок. Этим методом были успешно соединены до 8 слоев (P(L/DL)LA-PHBV пленки. Моделированные коллагеновые пленки соединяли друг с другом путем последовательного применения растворов коллагена и EDC/NHS. Этим методом были успешно приварены или склеены до 3 слоев коллагеновой пленки. Так как эти трехмерные конструкции были приготовлены специально для тканевой инженерии роговицы, ориентация профильных моделей по отношению друг к другу была перпендикулярной для того,чтобы имитировать естественную структуру стромы роговицы. Многослойные конструкции стерилизовали путем погружения в стерильный EtOH (70%) на 2 ч при 4 С. Затем конструкции 4 раза промывали фосфатно-солевым буфером (PBS). Исследования In Vitro Культивирование кератоцитов человека было начато с 2 пассажей первичной клеточной линии и доведено до 8 пассажей. Во всех экспериментах использовалось 4-8 пассажей. Состав питательной среды для 500 мл был следующий: 225 мл высокомолекулярной глюкозы DMEM (модифицированная по способу Дульбекко среда Игла), 225 мл среды Хема 12 (Ham F12), 50 мл сыворотки новорожденных телят, 10 нг/мл человеческого рекомбинантного b-FGF (фактора роста фибробластов), амфотерицин (1 мкг/мл),стрептомицин (100 мкг/мл) и пенициллин (100 Ед/мл) при 37 С, 5% СО 2 в СО 2-инкубаторе. Клетки пассивировали, используя 0,05% раствор трипсина-ЭДТК.D407 ретинальные пигментные эпителиальные клетки (от 5 пассажей до 15) культивировали в высокомолекулярной глюкозе DMEM, дополненной 5%-ой фетальной бычьей сывороткой (FBS), 100 Ед/мл пенициллина и 100 Ед/мл стрептомицина при 37 С, 5% СО 2 в СО 2-инкубаторе. Клетки пассивировали,используя 0,05% раствор трипсина-ЭДТК. Кератоциты и клетки D407 отделяли от культуры тканей в колбах, используя трипсин 0,05% в течение 5 мин при 37 С, затем центрифугировали в течение 5 минпри 3000 об/мин и ресуспендировали в соответствующей среде. Количество клеток подсчитывали, используя NucleoCounter (ChemoMetec A/S,Дания). На каждую конструкцию засевали 50000 клеток/20 мкл и конструкции оставляли стоять в покое в течение 30 мин, чтобы дать возможность клеткам закрепиться. Через 30 мин к каждой конструкции добавляли 500 мкл среды. Конструкции инкубировали в СО 2-инкубаторе (5% СО 2, 37 С) в течение 21 дня. Питательную среду освежали каждый день. В качестве контроля использовали полистирольную тканевую среду (TCPS). СЭМ характеристики Образцы для СЭМ промывали диметиларсиновокислым буфером (0,1 М, рН 7,4) и дистиллированной водой и сушили вымораживанием. Образцы были исследованы с помощью СЭМ после покрытия золотом путем напыления в вакууме. Флуоресцентное окрашивание Для флуоресцентной микроскопии (IX 70, Olympus, Japan) образцы для испытания сначала фиксировали с помощью глутаральдегида (2,5%) в течение 2 ч и затем дважды промывали фосфатно-солевым буфером (ФСБ) (10 мМ, рН 7,4). Для окрашивания акридиновым оранжевым образцы промывали HCl(0,1 М) в течение 1 мин и добавляли Акридиновый оранжевый. Через 15 мин акридиновый оранжевый удаляли и образцы промывали дистиллированной водой. Клетки исследовали под флуоресцентным микроскопом с диапазоном длины волны возбуждения 450-480 нм. Для окрашивания ДАПИ и фаллоидином клетки фиксировали на пленках с помощью 4%-ого формальдегида в течение 15 минут и дважды промывали ФСБ. Затем для проницаемости клеточных мембран клетки обрабатывали 1%-ым Тритоном-Х-100 в течение 5 мин и опять 3 раза промывали фосфатносоляным буфером (ФСБ). Затем образцы инкубировали в блокирующем растворе (1% БСА (бычий сыво-4 017224 роточный альбумин) в ФСБ) в течение 30 мин при комнатной температуре и в окрашивающем растворе до 1 ч при 37 С. В качестве окрашивающего раствора использовали 1%-ый фаллоидин и 0,1% ДАПИ в 0,1% БСА в растворе ФСБ. После инкубации образцы промывали ФСБ и исследовали под флуоресцентным микроскопом при длинах волн возбуждения 450-480 нм для фаллоидина и 330-385 нм для ДАПИ. Пробирный анализ пролиферации клетки Для определения скорости клеточной пролиферации осуществляли пробирный анализ пролиферации клетки на основе восстановления красителя Alamar Blue. В случае обсемененных кератоцитами многослойных конструкций питательную среду удаляли на 1, 4, 7 и 10 день и образцы несколько раз промывали стерильным ФСБ. Затем добавляли 500 мкл 5% раствора Alamar Blue и образцы инкубировали в СО 2-инкубаторе (5% СО 2, 37 С) в течение 1 ч. После инкубации среду, содержащую краситель AlamarBlue, собирали и определяли поглощение при 570 и 600 нм с помощью спектрофотометра УФ и видимой области спектра. Затем определяли процент восстановления красителя за счет метаболической активности клеток, используя коэффициенты поглощения восстановленного и окисленного красителя. Число клеток определяли на основании калибровочной кривой, построенной с использованием процента восстановления красителя в присутствии известного числа клеток. Краткое объяснение процесса Изобретение включает различные, разработанные для различных полимеров, способы получения трехмерных конструкций и трехмерных подложек различных размеров и рисунков, как физических так и химических, в отношении ориентации ламелл или слоев и различных особенностей поверхности, и мультиламеллярных или многослойных структур различной толщины. Основные стадии осуществления способа Получение растворов коллагена и растворов смесей P(LZDL)LA и PHBV различных концентраций. Растворы полимеров заливали на моделированные шаблоны, полученные на кремниевых пластинках фотолитографией или полученные переносом рисунков "параллельные бороздки и выступы" или"квадратные углубления" с первичных шаблонов, сделанных из кремниевых пластинок, на вторичные шаблоны. Мембранные структуры, которые имеют обращенный профиль поверхности моделированных шаблонов, были получены формованием окунанием в раствор. Структура шаблонов может иметь любые топографические особенности, такие как выступы или бороздки любого размера, связанные наклонными поверхностями под любым градусом наклона. Любой тип микромоделированной структуры, типа булыжной мостовой, столбиков, 2D полос, квадратов, кругов и т.д., может быть получен или фотолитографией или, для наномоделированных структур, электроннолучевой литографией, или интерференционной литографией, фотолитографией или штампованием, или контактной литографией, или литографией на основе АСМ (атомно-силовой микроскопии) с получением любой необходимой 3D структуры. Для случая, когда используемый полимер представляет собой коллаген, описывается протекающий в мягких условиях химический метод создания трехмерного (3D) многослойного коллагена, так как трехмерная (3D) структура природных полимеров вообще очень чувствительна к грубой обработке. Раствор коллагена (в уксусной кислоте), имеющий концентрацию 2-25 мг/мл (предпочтительно 15 мг/мл) заливают на микромоделированные шаблоны. Нижний предел концентрации обусловлен низкой толщиной и низкими механическими свойствами, тогда как верхний предел обусловлен чрезмерной вязкостью, которая препятствует соответствующей обработке. Количество заливаемого на шаблон коллагенового раствора составляет 50 мкл - 1 мл на квадратный см поверхности шаблона; количество раствора не ниже чем 50 мкл выбрано для того, чтобы предотвратить образование слишком тонких пленок с недостаточной толщиной и механической прочностью, и не выше чем 1 мл, потому что будет невозможно поддерживать высокие объемы на такой малой площади поверхности, а также потому, что получающиеся пленки были бы слишком толстыми, слишком жесткими и с низкой прозрачностью. После сушки раствора воздухом отделяют образовавшиеся коллагеновые пленки. Высыхание достигается между 10-24 ч при комнатной температуре без циркуляции какого-либо газа или воздуха. Длительность сушки может быть снижена при более высокой температуре, при циркуляции воздуха или газа, при нагреве или при использовании меньшего объема раствора. Для стабилизации пленок осуществляют процедуру сшивки. Сшивки достигают инкубацией в 33 мМ EDC и NHS в буфере, предпочтительно фосфатном буфере(при рН предпочтительно 5,5) в течение 2 ч при комнатной температуре. Значение рН буфера между 4 и 6 определяется снижением реакционной способности EDC вне этого диапазона. Продолжительность сшивки составляет от 30 мин до 4 ч, в зависимости от требуемой степени сшивки, при температуре от +4 до 37 С, где верхний предел определяется денатурацией коллагена при температурах выше 37 С. Сшивки можно достичь глютаральдегидом, генипином, дендримерами и др. Конструкции промывают буфером, предпочтительно фосфатным буфером 1 ч и затем последовательно промывают 1 М и 2 М NaCl. Буфер предпочтительно представляет собой Na2HPO4 и его значение рН предпочтительно составляет 9,1.-5 017224 Соединение нескольких сшитых пленок друг с другом осуществляют применением капелек разбавленного раствора коллагена в 0,1% уксусной кислоты. Применение растворителя вызывает до некоторой степени ограниченное, локальное растворение в зависимости от концентрации и количества растворителя. Последующая воздушная сушка обеспечивает контакт между мембранами из-за одновременного растворения и сушки в тех местоположениях, которые входят в контакт с растворителем. Получают растворы смесей полиэфиров в органических растворителях в различных соотношениях. Полиэфиры предпочтительно представляют собой P(LZDL)LA и PHBV. Пленки получают путем формования окунанием в раствор P(LZDL)LA и PHBV в органических растворителях с получением микромоделированных мембран с инверсией профильных размеров как таковых с шаблона. Органическими растворителями могут быть хлороформ, дихлорметан и тому подобное. Концентрация раствора полимера составляет 2-10%, предпочтительно 4% в органическом растворителе; не ниже чем 2%, чтобы достигнуть достаточной толщины и механической прочности, и не выше чем 10%, чтобы достигнуть соответствующей вязкости для образования соответствующей пленки. Микромоделированные кремниевые шаблоны различных размеров и конфигураций изготавливают фотолитографией с последующим химическим травлением. Соотношение смеси P(L/DL)LA и PHBV может варьироваться от 1:0 до 0:1, предпочтительно 1:1,чтобы получить пленки с различной прозрачностью и жесткостью. Количество заливаемого на шаблон раствора P(LZDL)LA и PHBV составляет 50 мкл - 1 мл на квадратный см поверхности шаблона; количество раствора не ниже чем 50 мкл выбрано для того, чтобы предотвратить образование слишком тонких пленок с недостаточной толщиной и механической прочностью, и не выше чем 1 мл, потому что будет невозможно поддерживать высокие объемы на такой малой площади поверхности, а также потому, что получающиеся пленки были бы слишком толстыми, слишком жесткими и с низкой прозрачностью. Высыхание достигается через 10 и более часов при комнатной температуре без циркуляции какоголибо газа или воздуха или применения вакуума или нагрева. Более короткая продолжительность сушки привела бы к удерживанию растворителя и ненадлежащему исполнению. Продолжительность сушки может быть снижена при использовании более высокой температуры, наличии воздушной или газовой циркуляции, применении вакуума или при снижении используемого объема раствора. Сформированные мембраны удаляют отслаиванием (средняя толщина пленки 42 мкм) и соединяют друг с другом путем подвода тепла к 4 углам, расплавляя в этих точках полимерные пленки. Альтернативно, связывание может быть выполнено путем помещения в углах капелек растворителя, который вызывает локальное некоторое растворение полимера в зависимости от количества растворителя. Сушка структуры обеспечивает контакт между двумя мембранами из-за одновременного растворения и сушки в точках, которые входят в контакт с растворителем. Краткое объяснение альтернатив для процесса Разработан второй метод соединения коллагеновых пленок, использующий раствор коллагена и концентрированный сшивающий раствор. Раствор коллагена наносят в желательных точках контакта, где он действует как клей между этими двумя слоями. После добавления раствора коллагена добавляют концентрированный сшивающий раствор, состоящий из EDC/NHS, для связывания коллагена в растворе с этими двумя мембранами. Благодаря этому методу, изменяя параметры, такие как концентрация раствора коллагена и концентрация сшивающего раствора, можно точно регулировать прочность контакта. Третий способ последовательного соединения слоев коллагеновой пленки друг с другом заключается в применении клея, типа фибринового клея или цианакрилата. Количество точек спайки/контакта, относительная ориентация поверхностных топографических особенностей, размер и геометрия особенностей, габариты каждого слоя пленки и количество слоев может регулироваться в течение производственного процесса согласно определенным потребностям ткани мишени. Структура шаблона может представлять собой любой тип микромоделированной структуры, типа булыжной мостовой, столбиков, 2D полос, квадратов, кругов. Шаблоны могут быть получены фотолитографией, электронно-лучевой литографией, интерференционной литографией, штампованием, контактной литографией, литографией на основе АСМ (атомносиловой микроскопии) с получением любой необходимой 3D структуры. Рисунки на шаблонах могут быть в масштабе нано или микроуровня. Конструкции могут быть обсеменены клетками, которые соответствуют ткани-мишени. Конструкции могут быть обсеменены одним или более типом клеток согласно клеточной популяции ткани-мишени. Если требуются слои ткани, где каждый слой имеет различную организацию и клетки, тогда можно отдельно изготовить множество слоев с различной ориентаций и затем их соединить вместе с созданием-6 017224 многослойной мультиориентированной конструкции. Если необходим усиленный уровень взаимодействия между различными присутствующими типами клеток или, если требуется увеличенная проницаемость для переноса растворенных веществ, факторов роста, биоактивных агентов, могут быть созданы частично пористые пленки путем выщелачивания частиц растворенного вещества желаемых размеров, содержавшихся в подходящем растворителе, который растворяет только эти частицы, а не пленочный материал. Поры могут быть также созданы под воздействием корпускулярного и электромагнитного излучения. Если необходим градиент биоактивных агентов, типа факторов роста, эти агенты могут быть растворены в пленках. Процесс применим к природным и синтетическим полимерам, таким как хитозан, N-изопропиламид(NIPAM), полидиметилсилоксан, поликапролактон (PCL), гиалуроновая кислота, хондроитин сульфат или смеси биодеградируемых и недеградируемых полимеров. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения стопочных моделированных биоматериалов и/или 3D подложек для тканевой инженерии, имеющих физические, химические и структурные особенности поверхности, характеризующийся следующими стадиями: получение раствора полимера типа коллаген,заливание раствора на моделированные шаблоны, полученные на кремниевых пластинках путм фотолитографии, или электронно-лучевой литографией, или интерференционной литографией, или штампованием, или контактной литографией и имеющие микромоделированную или наномоделированную структуру типа булыжной мостовой, столбиков, 2D полос, квадратов, кругов и 3D структур,сушка и отделение плночных структур от шаблонов,осуществление процедуры сшивки для получения стабильных пленок,промывка пленок,соединение нескольких сшитых пленок друг с другом, где количество точек спайки/контакта, относительная ориентация поверхностных, топографических особенностей, размер и геометрия особенностей, габариты каждого плночного слоя и количество слоев регулируются в течение производственного процесса согласно определнным потребностям ткани-мишени. 2. Способ по п.1, характеризующийся тем, что раствор коллагена имеет концентрацию 2-25 мг/мл. 3. Способ по п.1 или 2, характеризующийся тем, что количество заливаемого на шаблон раствора коллагена составляет 50 мкл - 1 мл на 1 см 2 поверхности шаблона. 4. Способ по любому из предшествующих пунктов, характеризующийся тем, что сушку осуществляют в течение 10-24 ч при комнатной температуре с циркуляцией любого газа или воздуха. 5. Способ по любому из предшествующих пунктов, характеризующийся тем, что сшивку осуществляют преимущественно инкубацией в EDC и NHS. 6. Способ по любому из предшествующих пунктов, характеризующийся тем, что продолжительность сшивки составляет от 30 мин до 4 ч в зависимости от требуемой степени сшивки, при температуре от +4 до 37 С, где верхний предел определяется денатурацией коллагена при температурах выше 37 С,преимущественно 2 ч при комнатной температуре. 7. Способ по любому из предшествующих пунктов, характеризующийся тем, что сшивку осуществляют с помощью глютаральдегида, генипина, дендримеров.
МПК / Метки
МПК: C08J 5/18
Метки: инженерии, стопчатые, подложки, моделированные, тканевой, биоматериалы
Код ссылки
<a href="https://eas.patents.su/12-17224-stopchatye-modelirovannye-biomaterialy-i-ili-podlozhki-dlya-tkanevojj-inzhenerii.html" rel="bookmark" title="База патентов Евразийского Союза">Стопчатые моделированные биоматериалы и/или подложки для тканевой инженерии</a>
Предыдущий патент: Жидкая композиция для предварительно увлажненного очищающего изделия для протирания и изделие для протирания
Следующий патент: Устройство для пробивки пластмассовых бутылок
Случайный патент: Надувное изделие, образуемое газонепроницаемым слоем на основе двух термопластичных эластомеров