Новые соединения бензотиазина и бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат
Номер патента: 10308
Опубликовано: 29.08.2008
Авторы: Десо Патрис, Корди Алексис, Лестаж Пьер, Данобер Лоранс
Формула / Реферат
1. Соединения формулы (I)
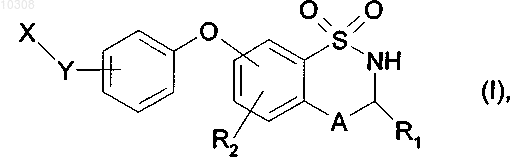
в которой R1 представляет собой атом водорода,
R2 представляет собой атом водорода,
А представляет собой атом азота и вместе со смежной группой -CHR1- образует кольцо
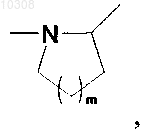
где m представляет собой 1,
Y представляет собой С2-С6-алкиленовую цепь, необязательно замещенную одним или несколькими одинаковыми или разными заместителями, выбранными из линейных или разветвленных C1-С6-алкильных групп и атомов галогена,
или Y представляет собой группу
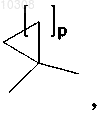
где р равно 1,
X представляет собой группу NR5R6 или C(O)R9, где
R5 представляет собой атом водорода или линейную или разветвленную C1-С6-алкильную группу или группу S(O)tR11,
R6 представляет собой атом водорода или линейную или разветвленную С1-С6-алкильную группу,
R9 представляет собой гидроксигруппу, линейную или разветвленную C1-С6-алкоксигруппу, или аминогруппу, необязательно замещенную одной или двумя одинаковыми или разными линейными или разветвленными С1-С6-алкильными группами,
R11 представляет собой линейную или разветвленную С1-С6-алкильную группу, а t означает 2,
их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1, в которых Y представляет собой алкиленовую цепь, содержащую 2 или 3 атома углерода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединение формулы (I) по п.1, которое представляет собой N-(2-{4-[(5,5-диоксидо-2,3,3а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенил}этил)метансульфонамид, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Способ получения соединений формулы (I) по п.1, который характеризуется тем, что в качестве исходного вещества используют соединение формулы (II)
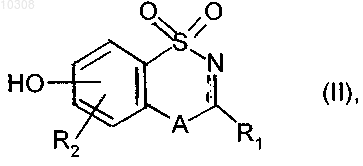
где A, R1 и R2 имеют значения, указанные для формулы (I), и символ ![]() обозначает, что связь является простой или двойной,
обозначает, что связь является простой или двойной,
которое подвергают реакции в присутствии ацетата меди(II) с соединением бороновой кислоты формулы (III)
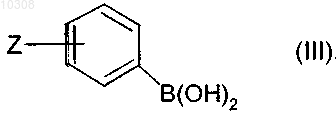
где Z представляет собой линейную или разветвленную C1-С6-ацильную группу, группу -Y-X, в которой X и Y имеют значения, указанные для формулы (I), или группу -Y-X', в которой Y имеет значения, указанные для формулы (I), и X' представляет собой циано или карбоксигруппу,
с получением непосредственно или после восстановления (если символ ![]() представляет собой двойную связь) при помощи гидрида металла и/или путем необязательного превращения X' группы или ацильной группы, соединение формулы (I)
представляет собой двойную связь) при помощи гидрида металла и/или путем необязательного превращения X' группы или ацильной группы, соединение формулы (I)

где соединение формулы (I) очищают, при необходимости, в соответствии с обычным способом очистки, разделяют, если это является подходящим, на его изомеры в соответствии с обычным способом разделения и превращают, если это является желательным, в его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Фармацевтическая композиция, обладающая модулирующей AMPA активностью, которая содержит в качестве активного компонента соединение в соответствии с любым из пп.1-3 в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями.
6. Фармацевтическая композиция по п.5, содержащая в качестве активного компонента соединение в соответствии с любым из пп.1-3, предназначенная для применения в качестве лекарственного средства, такого как АМРА модулятор.
Текст
010308 Настоящее изобретение относится к новым соединениям бензотиазина и бензотиадиазина, к способу их получения и к фармацевтическим композициям, которые их содержат. В настоящее время известно, что инициирующие аминокислоты, особенно глутамат, играют очень важную роль в физиологических процессах приспосабливаемости нейронов к воздействиям внешней среды и в механизмах, лежащих в основе обучения и памяти. Патофизиологические исследования свидетельствуют о том, что нарушение в глутаматэргической нейротрансмиссии тесно связано с развитием болезни Альцгеймера (Neuroscience and Biobehavioral reviews, 1992, 16, 13-24; Progress in Neurobiology,1992, 39, 517-545). Кроме того, в многочисленных исследованиях в последние годы показано, что существуют подтипы рецепторов инициирующих аминокислот и их функциональное взаимодействие (Molecular Neuropharmacology, 1992, 2, 15-31). Среди этих рецепторов рецептор АМРА (-амино-3-гидрокси-5-метил-4-изоксазол-пропионовая кислота) в наибольшей степени вовлечен в процессы физиологической возбудимости нейронов и, в особенности, в те процессы, которые связаны с запоминанием. Например, было показано, что обучаемость связана с увеличением связывания АМРА с его рецептором в гиппокампе, одном из участков головного мозга, который отвечает за процессы памяти и распознавания. Также в последнее время описаны ноотропные средства, такие как анирацетам в качестве положительных модуляторов рецепторов АМРА нейронов (Journal of Neurochemistry, 1992, 58, 1199-1204). В литературе описаны соединения, имеющие бензамидную структуру, в качестве средств, имеющих такой же механизм действия и улучшающих память (Synapse, 1993, 15, 326-329). Из этих новых фармакологических средств наиболее активным является, в частности, соединение ВА 74. Дополнительно, в патентной заявке ЕР 692484 описано соединение бензотиадиазина, которое способствует току, вызываемому АМРА, и в международной патентной заявке WO 99/42456 также описаны частные соединения бензотиадиазина в качестве модуляторов рецепторов АМРА. Соединения бензотиазина и бензотиадиазина, раскрытые в настоящем изобретении, кроме того, что являются новыми, неожиданно обнаруживают фармакологическое действие на ток, вызываемый АМРА,которое существенно выше по сравнению с соединениями, обладающими подобной структурой, описанными в уровне техники. Они являются пригодными в качестве модуляторов АМРА для лечения или предотвращения нарушений памяти и распознавания, которые связаны со старением, с синдромами тревоги или депрессии, с прогрессирующими нейродегенеративными заболеваниями, с болезнью Альцгеймера, с болезнью Пика (предстарческая органическая атрофия мозга), с хореей Хантингтона, с шизофренией, с последствиями острых нейродегенеративных заболеваний, с последствиями ишемии и с последствиями эпилепсии. В частности, настоящее изобретение относится к соединениям формулы (I) в которой R1 представляет собой атом водорода, линейную или разветвленную C1-С 6-алкильную группу или С 3-С 7-циклоалкильную группу,R2 представляет собой атом водорода, атом галогена или гидроксигруппу,А представляет собой CR3R4 группу или NR3 группу, гдеR3 представляет собой атом водорода или линейную или разветвленную C1-С 6-алкильную группу, иR4 представляет собой атом водорода или атом галогена,или А представляет собой атом азота и вместе со смежной группой -CHR1- образует кольцо где m представляет собой 1, 2 или 3,Y представляет собой С 2-С 6-алкиленовую цепь, необязательно замещенную одним или несколькими одинаковыми или разными заместителями, выбранными из линейных или разветвленных C1-С 6 алкильных групп и атомов галогена и где одна из -СН 2- групп может быть заменена группой как определено выше,X представляет собой NR5R6, S(O)nR7, OR8, C(O)R9, амидино (необязательно замещенную одной или двумя одинаковыми или разными группами, выбранными из линейного или разветвленного C1-С 6 алкила, гидрокси, линейного или разветвленного C1-С 6-алкокси иR5 представляет собой атом водорода или линейную или разветвленную C1-С 6-алкильную, S(O)tR11,COR12 или P(O)OR13OR14 группу,R6 представляет собой атом водорода или линейную или разветвленную C1-С 6-алкильную группу,или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую группу,R8 представляет собой линейную или разветвленную C1-С 6-алкильную группу или C(O)R15 группу,R9 представляет собой гидроксигруппу, линейную или разветвленную С 1-С 6-алкоксигруппу или аминогруппу (необязательно замещенную одной или двумя одинаковыми или разными линейными или разветвленными C1-С 6-алкильными группами),R7, R10, R11, R12, R13, R14 и R15, которые могут быть одинаковыми или разными, каждый представляет собой атом водорода; линейную или разветвленную С 1-С 6-алкильную группу, необязательно замещенную одним или несколькими атомами галогена; арил-С 1-С 6-алкильную группу, в которой алкильная часть является линейной или разветвленной; или арильную группу,n и t, которые могут быть одинаковыми или разными, каждый представляет собой 0, 1 или 2,к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием,где подразумевается, что гетероциклическая группа обозначает моноциклическую или бициклическую, ароматическую или неароматическую группу, содержащую от одного до четырех одинаковых или разных гетероатомов, выбранных из азота, кислорода и серы, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из галогена, линейного или разветвленного C1-С 6-алкила, линейного или разветвленного C1-С 6-алкокси, линейного или разветвленного C1-С 6-полигалоалкила, линейного или разветвленного C1-С 6-алкоксикарбонила, оксо, тиоксо, карбокси, линейного или разветвленного C1 С 6-ацила, линейного или разветвленного C1-С 6-полигалоалкокси, гидрокси, циано, нитро, аминогруппы(необязательно замещенной одной или несколькими линейными или разветвленными C1-С 6-алкильными группами), аминосульфонила (необязательно замещенного одной или несколькими линейными или разветвленными C1-С 6-алкильными группами) и C1-C6-алкилсульфониламино,арильная группа обозначает моноциклическую ароматическую группу или бициклическую группу,в которой по крайней мере одно из колец является ароматическим, содержащую от 5 до 10 атомов углерода, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из галогена, линейного или разветвленного C1-С 6-алкила (необязательно замещенного одной или несколькими гидроксигруппами), линейного или разветвленного C1-С 6-алкокси, линейного или разветвленного C1-С 6-полигалоалкила, линейного или разветвленного C1-С 6-алкоксикарбонила, оксо, тиоксо,линейного или разветвленного C1-С 6-алкилтио, карбокси, линейного или разветвленного С 1-С 6-ацила,линейного или разветвленного C1-С 6-полигалоалкокси, гидрокси, циано, нитро, аминогруппы (необязательно замещенной одной или несколькими линейными или разветвленными C1-С 6-алкильными или линейными или разветвленными С 1-С 6-ацильными группами), аминокарбонила (необязательно замещенного одной или несколькими линейными или разветвленными C1-С 6-алкильными группами), аминосульфонила (необязательно замещенного одной или несколькими линейными или разветвленными C1-С 6 алкильными группами), моно- или ди(С 1-С 6-алкилсульфонил)амино, моно- или ди(трифторметилсульфонил)амино, PO(ORa)(ORb), где Ra и Rb, которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или линейную или разветвленную С 1-С 6-алкильную группу, бензилокси и фенила (необязательно замещенного одной или несколькими одинаковыми или разными группами, выбранными из галогена, линейного или разветвленного C1-С 6-алкила, линейного или разветвленного C1-С 6-полигалоалкила, гидрокси и линейного или разветвленного C1-С 6-алкокси). Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, ли-2 010308 монную кислоту, аскорбиновую кислоту, метансульфокислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно отметить, но не ограничиваясь только ими,гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Более предпочтительно изобретение относится к соединениям формулы (I), в которой А представляет собой атом азота и, вместе со смежной группой -CHR1-, образует кольцо Предпочтительно группа R2 представляет собой атом водорода. Y предпочтительно представляет собой незамещенную или замещенную алкиленовую цепь, содержащую 2 или 3 атома углерода. Заместители алкиленовой цепи, представленной Y, если они присутствуют, предпочтительно представляют собой атом фтора или метильную группу. Предпочтительным значением для группы X является NR5R6 или C(O)R9 группа, более предпочтительно группа NHSO2R11, в которой R11 предпочтительно представляет собой линейную или разветвленную C1-С 6-алкильную группу. Наиболее предпочтительно изобретение относится к соединениям формулы (I), которые представляют собойN-(2-4-[(5,5-диоксидо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилэтил)метансульфонамид,3-4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропионовую кислоту,3-4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропанамид,3-4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]окси]фенил-N,N-диметилпропанамид,N-(3-4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропил)метансульфонамид,N-(2-4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенил-2-фторпропил)-2-пропансульфонамид,N-(2-4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенил-2-фторпропил)метансульфонамид,N-(2-4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропил)метансульфонамид,N-(2-4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилэтил-N,N-диметиламин,N-(1-4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилциклопропил)метансульфонамид. Изобретение также относится к способу получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества применяют соединение формулы (II) где A, R1 и R2 имеют значения, указанные для формулы (I), и обозначает, что связь является простой или двойной,символ которое подвергают реакции в присутствии ацетата меди (II) с соединением бороновой кислоты формулы (III) где Z представляет собой линейную или разветвленную C1-С 6-ацильную группу, группу -Y-X, в которойX и Y имеют значения, указанные для формулы (I), или группу -Y-X', в которой Y имеет значения, указанные для формулы (I), иX' представляет собой циано или карбоксигруппу,-3 010308 представляет собой двойную получая, непосредственно или после восстановления (если символ связь) при помощи гидрида металла и/или путем необязательного превращения X' группы или ацильной группы, соединение формулы (I) где соединение формулы (I) очищают, при необходимости, в соответствии с обычным способом очистки,разделяют, если это является подходящим, на его изомеры в соответствии с обычным способом разделения и превращают, если это является желательным, в его аддитивные соли с фармацевтически приемлемой кислотой или основанием. Соединения формулы (II), определенные выше, получают путем обычных органических химических реакций и, в особенности, путем способа, описанного в WO 03053979. Изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного компонента соединение формулы (I) с одним или несколькими подходящими, инертными, нетоксичными наполнителями. Среди фармацевтических композиций согласно изобретению особенно можно отметить те, которые являются пригодными для перорального, парентерального (внутривенного или подкожного) или назального введения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, суппозитории, кремы, мази, кожные гели, составы для инъекций, суспензии для питья и т.д. Полезная дозировка может изменяться в зависимости от природы и тяжести расстройства, пути введения, возраста, веса пациента и находится в пределах от 1 до 500 мг в сутки на одно или больше введений. Примеры, представленные далее, приведены только с целью иллюстрации и никоим образом не ограничивают изобретение. Используемые исходные вещества являются известными продуктами или их получают в соответствии с известными способами. Структуры соединений, описанных в примерах, были определены в соответствии с обычными спектрофотометрическими способами (ИК, ЯМР, масс-спектрометрия и т.п). Пример 1. N-(2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилэтил)метансульфонамид. 25 мл CH2Cl2, 240 мкл (2,96 ммоль) пиридина, 238 мг (0,99 ммоль) 2,3,3 а,4-тетрагидро-1Hпирроло[2,1-с][1,2,4]бензотиадиазин-7-ол 5,5-диоксида, 2,5 г 4 молекулярного сита, 340 мгCu(OAc)2 вносили в колбу Эрленмеера объемом 100 мл. Суспензию интенсивно перемешивали при температуре окружающей среды, колбу Эрленмеера оставляли открытой на воздухе. Через 4 ч 30 мин реакционную смесь дополнительно разводили 50 мл CH2Cl2 и суспензию фильтровали. Фильтрат упаривали насухо и остаток очищали последовательно путем хроматографии два раза на колонке диоксида кремния,элюируя CH2Cl2/ацетоном (96/4) при осуществлении первой хроматографии и CH2Cl2/AcOEt (70/30) при второй. Полученное бесцветное масло кристаллизовали путем растирания в порошок в смеси Et2O и нескольких капель изопропанола, получая, после фильтрации, указанное в заглавии соединение в виде белого порошка. Точка плавления: 99-102 С. Элементный микроанализ: Пример 2. 3-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропионовая кислота. Стадия А. Метил 3-4-[(5,5-диоксидо-2,3-дигидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенил пропаноат. Указанное в заглавии соединение получали путем взаимодействия 2,3-дигидро-1H-пирроло[2,1 с][1,2,4]бензотиадиазин-7-ол 5,5-диоксида с 4-(3-метокси-3-оксопропил)фенилбороновой кислотой согласно методике из примера 1, несмотря на то что время реакции увеличивалось до 48 ч. Очистку осуществляли путем хроматографии на колонке диоксида кремния, элюируя смесью CH2Cl2/ацетон 95/5. Точка плавления: 138-140 С. Стадия В. 3-4-[(5,5-Диоксидо-2,3-дигидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилпропионовая кислота Суспензию 580 мг (1,45 ммоль) соединения, полученного на стадии А, перемешивали в колбе с обратным холодильником в 9 мл 1 н. HCl в течение 5 ч. Затем реакционную смесь разводили водой и суспензию фильтровали, получая указанное в заглавии соединение в виде белого твердого вещества. Точка плавления: 216-222 С. Элементный микроанализ: Стадия С. 3-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]-бензотиадиазин-7 ил)окси]фенилпропионовая кислота. 62 мг (1,63 ммоль) NaBH4 добавляли к суспензии 210 мг (0,54 ммоль) соединения с предыдущей стадии в 6 мл этанола. После перемешивания в течение 2 ч при температуре окружающей среды реакционный раствор охлаждали на ледяной бане и подкисляли путем добавления 1 н. HCl. Вязкую суспензию экстрагировали CH2Cl2; затем органическую фазу промывали насыщенным водным раствором NaCl, высушивали над MgSO4 и упаривали. Остаток растирали в порошок в Et2O и образованное твердое вещество отфильтровали, получая указанное в заглавии соединение. Точка плавления: 178-183 С. Элементный микроанализ: Пример 3. 3-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропанамид. Стадия А. 3-4-[(5,5-Диоксидо-2,3-дигидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилпропанамид. 415 мг (1,30 ммоль) TBTU добавляли к суспензии (500 мг, 1,30 ммоль) соединения, полученного на стадии В примера 2 в 25 мл CH2Cl2. Суспензию перемешивали при температуре окружающей среды в течение 10 мин и добавляли 293 мкл (1,68 ммоль) диизопропилэтиламина. Реакционная смесь превращалась в раствор, который продолжали перемешивать в течение 10 мин. Затем раствор насыщали газообразным аммиаком и продолжали перемешивать в течение 30 мин. Тонкослойная хроматография (AcOEt) указывала на то, что все исходное вещество израсходовалось. Затем реакционную смесь подкисляли путем добавления 1 н. HCl; органическую фазу сливали, промывали (водой, а затем насыщенным растворомNaCl), высушивали (MgSO4) и упаривали. Остаток растирали в порошок в Et2O и образованное твердое вещество отфильтровали, получая указанный в заглавии продукт. Точка плавления: 178-183 С. Стадия В. 3-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропанамид. Осуществляли методику согласно стадии С примера 2, исходя из соединения, полученного на стадии А. Точка плавления: 195-198 С. Элементный микроанализ: Пример 4. 3-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенил-N,N-диметилпропанамид. Стадия А. 3-4-[(5,5-Диоксидо-2,3-дигидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенил-N,N-диметилпропанамид. Осуществляли методику согласно стадии А примера 3, но заменяли газообразный аммиак 2 М диметиламином в ТГФ. Очистку осуществляли путем хроматографии на колонке диоксида кремния, элюируя-5 010308 смесью CH2Cl2/MeOH 98/2. Точка плавления: 77-80 С. Стадия В. 3-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенил-N,N-диметилпропанамид. Осуществляли методику согласно стадии С примера 2, исходя из соединения, полученного на стадии А. Очистку осуществляли путем хроматографии на колонке диоксида кремния, элюируя смесью Пример 5. N-(3-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]-бензотиадиазин-7 ил)окси]фенилпропил)метансульфонамид. Стадия А. (3-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропил)амин. 192 мг (5,06 ммоль) LiAlH4 небольшими порциями добавляли к суспензии (390 мг, 1,01 ммоль) соединения, полученного на стадии А примера 3 в 20 мл ТГФ, и реакционную смесь перемешивали в колбе с обратным холодильником в течение 1 ч 30 мин. Реакционную смесь охлаждали на ледяной бане и обрабатывали путем добавления по каплям водного раствора NH4Cl. Соли алюминия отфильтровывали и промывали ТГФ, затем ацетоном, и фильтрат концентрировали. Полученный продукт разводили CH2Cl2 и указанный в заглавии амин экстрагировали 1 н. HCl. Кислую водную фазу промывали CH2Cl2, подщелачивали при помощи 10%-ного раствора NaHCO3 и трижды экстрагировали AcOEt. Органические фазы собирали, высушивали над MgSO4 и упаривали. Остаток растирали в порошок в Et2O и образованное твердое вещество отфильтровали, получая указанное в заглавии соединение. Точка плавления: 126-131 С. Стадия В. N-(3-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропил)метансульфонамид. К раствору соединения, полученного на стадии А, (106 мг, 0,28 ммоль) в 2 мл CH2Cl2, охлажденному на ледяной бане, при 0 С добавляли 59 мкл (0,43 ммоль) триэтиламина и затем, по каплям, 74 мг(0,43 ммоль) метансульфоновой кислоты, растворенной в 2 мл CH2Cl2. Реакционный раствор перемешивали в течение 2 ч, при этом позволяли температуре возвратиться до температуры окружающей среды. Органическую фазу промывали 1 н. HCl и затем насыщенным водным раствором NaCl и высушивали надMgSO4. После упаривания указанное в заглавии соединение очищали путем хроматографии на колонке диоксида кремния, элюируя смесью CH2Cl2/ацетон 95/5. Точка плавления. 65-69 С. Элементный микроанализ: Пример 6. N-2S)-2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенил-2-фторпропил)пропан-2-сульфонамид. Указанное в заглавии соединение получали путем взаимодействия 2,3,3 а,4-тетрагидро-1Hпирроло[2,1-с][1,2,4]-бензотиадиазин-7-ол 5,5-диоксида с 4-1-фтор-2-[(изопропилсульфонил)амино]-1 метилэтилфенилбороновой кислотой согласно методике из примера 1, несмотря на то что время реакции увеличивалось до 16 ч. Очистку осуществляли путем последовательного хроматографирования два раза на колонке диоксида кремния, элюируя смесью CH2Cl2/MeOH 98/2 при осуществлении первой хроматографии и смесью циклогексан/этилацетат 70/30 при второй. Точка плавления: 90 С. Элементный микроанализ: Пример 7. N-(2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенил-2-фторпропил)метансульфонамид. Стадия А. 1-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилэтанон. Указанное в заглавии соединение получали путем взаимодействия 2,3,3 а,4-тетрагидро-1Hпирроло[2,1-с][1,2,4]-бензотиадиазин-7-ол 5,5-диоксида с 4-ацетилфенилбороновой кислотой согласно-6 010308 методике из примера 1, несмотря на то, что время реакции увеличивалось до 16 ч. Очистку осуществляли путем хроматографии на колонке диоксида кремния, элюируя смесью CH2Cl2/ацетон 98/2. Точка плавления: 150-152 С. Стадия В. 1-Амино-2-4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилпропан-2-ол. К раствору, содержащему 1,0 г (2,79 ммоль) соединения, полученного на стадии А, 23 мг(0,09 ммоль) 18-краун-6 эфира и 18,5 мг (0,28 ммоль) KCN в 25 мл ТГФ добавляли по каплям 840 мкл(6,26 ммоль) TMSCN. Реакционный раствор перемешивали в течение 3 ч при температуре окружающей среды и затем небольшими порциями добавляли 424 мг (11,2 ммоль) LiAlH4. Через 1 ч 30 мин избыток гидрида гидролизовали путем добавления по каплям насыщенного водного раствора NaCl. Реакционную смесь фильтровали, твердое вещество несколько раз промывали ТГФ и фильтрат упаривали, получая белую меренгу, которая соответствует указанному в заглавии соединению. Точка плавления: 76-78 С. Стадия С. N-(2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенил-2-гидроксипропил)метансульфонамид. К раствору соединения, полученного на стадии В (640 мг, 1,64 ммоль) в 25 мл CH2Cl2, охлажденного на ледяной бане, добавляли 354 мл (2,53 ммоль) триэтиламина и затем, по каплям, 441 мг (2,53 ммоль) метансульфонового ангидрида, растворенного в 10 мл CH2Cl2. Реакционный раствор перемешивали в течение 2 ч, при этом позволяли температуре возвратиться до температуры окружающей среды. Органическую фазу промывали 1 н. HCl и затем насыщенным раствором NaCl и высушивали над MgSO4. После упаривания остаток очищали путем хроматографии на колонке диоксида кремния, элюируя смесьюCH2Cl2/МеОН 96/4. Точка плавления: 90-92 С. Стадия D. N-(2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенил-2-фторпропил)метансульфонамид. К раствору соединения, полученного на стадии С (230 мг, 0,49 ммоль) в 15 мл CH2Cl2, охлажденного на ледяной бане, добавляли по каплям 133 мкл (0,99 ммоль) DAST. Реакционный раствор перемешивали в течение 2 ч, при этом позволяли температуре возвратиться до температуры окружающей среды. Органическую фазу промывали H2O и затем насыщенным раствором NaCl и высушивали над MgSO4. После упаривания остаток очищали путем хроматографии на колонке диоксида кремния, элюируя смесью CH2Cl2/MeOH 99/1. Точка плавления: 84-86 С. Элементный микроанализ: Пример 8. N-(2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропил)метансульфонамид. Стадия А. 2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропаннитрил. 840 мг (4,30 ммоль) тозилметилизонитрила добавляли к раствору соединения со стадии А примера 7(700 мг, 1,95 ммоль) в 25 мл 1,2-диметоксиэтана. Реакционный раствор охлаждали до -25 С и по каплям добавляли 6 мл (6 ммоль) 1 М трет-BuOK. в ТГФ. Реакционную смесь перемешивали в течение 30 мин при -25 С и затем оставляли нагреться до температуры окружающей среды в течение 1 ч. После добавления 1 н. HCl реакционную смесь экстрагировали AcOEt; органические фазы собирали, промывали насыщенным раствором NaCl и высушивали (MgSO4). После упаривания остаток очищали путем хроматографии на колонке диоксида кремния, элюируя смесью CH2Cl2/MeOH 99/1, получая белую меренгу, которая соответствует указанному в заглавии соединению. Стадия В. (2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропил)амин. 200 мг (5,25 ммоль) LiAlH4, небольшими порциями, добавляли к раствору, содержащему 485 мг(1,31 ммоль) соединения с вышеописанной стадии А в 15 мл ТГФ. После взаимодействия в течение 3 ч избыток гидрида гидролизовали путем добавления по каплям насыщенного водного раствора NaCl. Реакционную смесь фильтровали, твердое вещество несколько раз промывали ТГФ и фильтрат упаривали,получая белую меренгу, которая соответствует указанному в заглавии соединению. Стадия С. N-(2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилпропил)метансульфонамид. К раствору соединения, полученного на стадии В (394 мг, 1,06 ммоль) в 20 мл CH2Cl2, охлажденного на ледяной бане, добавляли 441 мкл (3,17 ммоль) триэтиламина и затем по каплям 404 мг(2,32 ммоль) метансульфонового ангидрида, растворенного в 5 мл CH2Cl2. Реакционный раствор перемешивали в течение 2 ч, при этом позволяли температуре возвратиться до температуры окружающей-7 010308 среды. Органическую фазу промывали 1 н. HCl и затем насыщенным раствором NaCl и высушивали надMgSO4. После упаривания остаток очищали путем хроматографии на колонке диоксида кремния, элюируя смесью CH2Cl2/MeOH 99/1. Точка плавления: 83-85 С. Элементный микроанализ: Пример 9. (2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилэтил)диметиламин. Стадия А. Метил 4-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилацетат. Указанное в заглавии соединение получали путем взаимодействия 2,3,3 а,4-тетрагидро-1Hпирроло[2,1-с][1,2,4]-бензотиадиазин-7-ол 5,5-диоксида с 4-(2-метокси-2-оксоэтил)фенилбороновой кислотой согласно методике из примера 1, но увеличивая время реакции до 16 ч. Очистку осуществляли путем хроматографии на колонке диоксида кремния, элюируя смесью CH2Cl2/МеОН 98/2. Точка плавления: 140-142 С. Стадия В. 4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилуксусная кислота. Суспензию сложного эфира, полученного на стадии А (538 мг, 1,38 ммоль), в 6 мл раствора NaOH перемешивали при 100 С в течение 3 ч 30 мин. Реакционный раствор подкисляли при помощи 1 н. HCl и белый осадок отфильтровали, получая указанное в заглавии соединение. Точка плавления: 166-169 С. Стадия С. 2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенил-N,N-диметилацетамид. Осуществляли методику согласно стадии А примера 3, но заменяя газообразный аммиак 2 М диметиламином в ТГФ и 3-4-[5,5-диоксо-2,3-дигидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилпропионовую кислоту соединением, полученным на стадии В. Очистку осуществляли путем хроматографии на колонке диоксида кремния, элюируя смесью CH2Cl2/MeOH 99/1, затем путем кристаллизации из воды. Точка плавления: 154 С Элементный микроанализ: Стадия D. (2-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси] фенилэтил)диметиламин. Осуществляли методику, как описано на стадии В примера 8. Очистку осуществляли путем хроматографии на колонке диоксида кремния, элюируя смесью CH2Cl2/MeOH/NH4OH 97/3/0,3, затем путем кристаллизации из Et2O. Точка плавления: 159 С. Элементный микроанализ: Пример 10. N-(1-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с] [1,2,4]-бензотиадиазин-7 ил)окси]фенилциклопропил)метансульфонамид Стадия А. [1-(4-Йодфенил)циклопропил]амин. 7,09 мл (24,01 ммоль) Ti(O-изоPr)4 добавляли к раствору 4-йодбензонитрила (5,0 г, 21,83 ммоль) в 140 мл безводного Et2O и реакционную смесь охлаждали до -65 С. Затем к полученному раствору добавляли, по каплям, 16 мл (48,00 ммоль) 3 М раствора этилбромида магния в Et2O, и реакционную смесь нагревали до температуры окружающей среды. Продолжали перемешивать в течение 1 ч при температуре окружающей среды и добавляли 5,53 мл (43,66 ммоль) BF3OEt2. Продолжали перемешивать в течение 1 ч 15 мин при температуре окружающей среды и добавляли 65 мл 1 н. HCl. Получали двухфазную суспензию; добавляли 300 мл Et2O и затем 200 мл 1 н. раствора NaOH. Суспензию фильтровали и фильтрат два раза экстрагировали Et2O. Органические фазы собирали, промывали (водой, насыщенным растворомNaCl), высушивали над MgSO4 и концентрировали в два раза. Оставшийся раствор экстрагировали 1 н.HCl и ожидаемый амин осаждали в результате подщелачивания концентрированным раствором NaOH. Точка плавления: 69-72 С. Стадия В. N-[1-(4-Йодфенил)циклопропил]метансульфонамид. К раствору соединения, полученного на стадии А (3 г, 11,58 ммоль), в 50 мл CH2Cl2 добавляли 2,7 мл (18,05 ммоль) DBU и затем, по каплям, раствор 2,09 г (12 ммоль) метансульфонового ангидрида,разведенного 20 мл CH2Cl2. Раствор перемешивали всю ночь при температуре окружающей среды и затем добавляли 20 мл 1 н. HCl. Органическую фазу сливали, промывали (насыщенным раствором NaCl) и высушивали (MgSO4) и, после упаривания в вакууме, остаток хроматографировали на диоксиде кремнияN-1-[4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил]циклопропилметансульфонамид. Смесь 1,75 г (5,19 ммоль) соединения, полученного на стадии В, 1,71 г (7,27 ммоль) бис(пинаколато)дибора, 1,53 г (15,57 ммоль) AcOK и 127 мг (0,156 ммоль) PdCl2(dppf)CH2Cl2 в 20 мл ДМСО перемешивали в течение 30 мин при 85 С в атмосфере азота. При температуре окружающей среды добавляли 50 мл воды и водную фазу трижды экстрагировали AcOEt. Органические фазы собирали,промывали (насыщенным раствором NaCl) и высушивали (MgSO4). После упаривания в вакууме остаток хроматографировали на диоксиде кремния (CH2Cl2/AcOEt 96/4), получая указанное в заглавии соединение. Элементный микроанализ: Стадия D. (4-1-[(Метилсульфонил)амино]циклопропилфенил)бороновая кислота. Суспензию 810 мг (2,40 ммоль) соединения, полученного на стадии С, и 1,95 г (9,12 ммоль) NaIO4 в смеси 25 мл ацетона и 7 мл 1 М водного раствора ацетата аммония перемешивали в течение 24 ч при температуре окружающей среды. Твердое вещество отфильтровали и промывали большим количеством ацетона. Фильтрат концентрировали в два раза и оставшийся раствор экстрагировали AcOEt. Органическую фазу промывали (насыщенным раствором NaCl) и высушивали (MgSO4) получая, после упаривания в вакууме, указанное в заглавии соединение. Стадия Е. N-(1-4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилциклопропил)метансульфонамид. Суспензию, состоящую из 290 мг (1,21 ммоль) 2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ол 5,5-диоксида, 465 мг (1,82 ммоль) соединения, полученного на стадии D, 330 мг(1,82 ммоль) ацетата меди (II), 294 мкл (3,64 ммоль) пиридина и около 3,5 г 4 молекулярного сита в 35 мл CH2Cl2, перемешивали в течение 5 ч при температуре окружающей среды. Реакционную смесь фильтровали и промывали CH2Cl2/МеОН (1/1). Фильтрат концентрировали и затем сразу наносили на колонку диоксида кремния, элюируя смесью CH2Cl2/ацетон 96/4. Фракции, содержащие ожидаемое соединение, собирали и упаривали, затем остаток ресуспендировали в небольшом количестве этилового эфира. После отфильтровывания твердого вещества указанное в заглавии соединение собирали в виде белого порошка. Точка плавления: 192-194 С. Элементный микроанализ: Фармакологическое исследование соединений по изобретению Исследование возбуждающих токов, вызванных АМРА, на ооцитах лягушки. Способ. Получали мРНК из коры головного мозга самцов крыс Wistar при помощи способа с использованием тиоцианата гуанидиния/фенола/хлороформа. Выделяли поли-(А+) мРНК путем хроматографии на олиго-dT целлюлозе и вводили в дозе 50 нг на ооцит. Ооциты инкубировали 2-3 дня при 18 С, чтобы позволить проявиться экспрессии рецепторов и затем хранили при 8-10 С. Электрофизиологическую регистрацию осуществляли в камере Plexiglass при 20-24 С в средеOR2 (J. Exp. Zool., 1973, 184, 321-334) при помощи 2-электродного "voltage-clamp" метода, третий электрод, помещенный в ванну, был контрольным, как описано в ссылке. Все соединения применяли при помощи инкубационной среды и электрический ток измеряли в-9 010308 конце периода введения. АМРА использовали в концентрации 10 мкМ. Для каждого исследуемого соединения определяли концентрацию, которая вызывает двукратное увеличение (ЕС 2 Х) или пятикратное увеличение (ЕС 5 Х) интенсивности тока, вызванного одним АМРА (5-50 нА). Результаты. Соединения по изобретению в значительной степени усиливают возбуждающие действие АМРА и их активность существенно выше по сравнению с активностью сравнительных соединений. Например, соединение из примера 1 обеспечивает ЕС 2 Х при концентрации 0,1 мкМ. Фармацевтическая композиция. Состав для приготовления 1000 таблеток, каждая из которых содержит 100 мг N-(2-4-[(5,5 диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилэтил) метансульфонамид (пример 1) 100 г гидроксипропилцеллюлоза 2 г пшеничный крахмал 10 г лактоза 100 г стеарат магния 3 г тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) в которой R1 представляет собой атом водорода,R2 представляет собой атом водорода,А представляет собой атом азота и вместе со смежной группой -CHR1- образует кольцо где m представляет собой 1,Y представляет собой С 2-С 6-алкиленовую цепь, необязательно замещенную одним или несколькими одинаковыми или разными заместителями, выбранными из линейных или разветвленных C1-С 6 алкильных групп и атомов галогена,или Y представляет собой группу где р равно 1,X представляет собой группу NR5R6 или C(O)R9, гдеR5 представляет собой атом водорода или линейную или разветвленную C1-С 6-алкильную группу или группу S(O)tR11,R6 представляет собой атом водорода или линейную или разветвленную С 1-С 6-алкильную группу,R9 представляет собой гидроксигруппу, линейную или разветвленную C1-С 6-алкоксигруппу, или аминогруппу, необязательно замещенную одной или двумя одинаковыми или разными линейными или разветвленными С 1-С 6-алкильными группами,R11 представляет собой линейную или разветвленную С 1-С 6-алкильную группу, а t означает 2,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) по п.1, в которых Y представляет собой алкиленовую цепь, содержащую 2 или 3 атома углерода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединение формулы (I) по п.1, которое представляет собой N-(2-4-[(5,5-диоксидо-2,3,3 а,4 тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилэтил)метансульфонамид, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Способ получения соединений формулы (I) по п.1, который характеризуется тем, что в качестве исходного вещества используют соединение формулы (II) обозначает, что связь являетгде A, R1 и R2 имеют значения, указанные для формулы (I), и символ ся простой или двойной,которое подвергают реакции в присутствии ацетата меди(II) с соединением бороновой кислоты формулы где Z представляет собой линейную или разветвленную C1-С 6-ацильную группу, группу -Y-X, в которойX и Y имеют значения, указанные для формулы (I), или группу -Y-X', в которой Y имеет значения, указанные для формулы (I), и X' представляет собой циано или карбоксигруппу,с получением непосредственно или после восстановления (если символ представляет собой двойную связь) при помощи гидрида металла и/или путем необязательного превращения X' группы или ацильной группы, соединение формулы (I) где соединение формулы (I) очищают, при необходимости, в соответствии с обычным способом очистки,разделяют, если это является подходящим, на его изомеры в соответствии с обычным способом разделения и превращают, если это является желательным, в его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Фармацевтическая композиция, обладающая модулирующей AMPA активностью, которая содержит в качестве активного компонента соединение в соответствии с любым из пп.1-3 в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями. 6. Фармацевтическая композиция по п.5, содержащая в качестве активного компонента соединение в соответствии с любым из пп.1-3, предназначенная для применения в качестве лекарственного средства,такого как АМРА модулятор.
МПК / Метки
МПК: A61P 25/28, C07D 513/04, A61K 31/549
Метки: композиции, которые, способ, получения, содержат, фармацевтические, новые, бензотиазина, бензотиадиазина, соединения
Код ссылки
<a href="https://eas.patents.su/12-10308-novye-soedineniya-benzotiazina-i-benzotiadiazina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения бензотиазина и бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат</a>
Предыдущий патент: Фармацевтическое соединение
Следующий патент: Трубка для имитации курения
Случайный патент: Способ получения порошкообразного меламина, имеющего высокую степень чистоты
















