Амиды карбамоилкарбоновой кислоты.
Номер патента: 515
Опубликовано: 28.10.1999
Авторы: Веттерих Франк, Вагнер Оливер, Штратман Зигфрид, Аммерманн Эберхард, Айкен Карл, Дитрих Клаус, Лоренц Гизела
Формула / Реферат
1. Амиды карбамоилкарбоновой кислоты общей формулы I
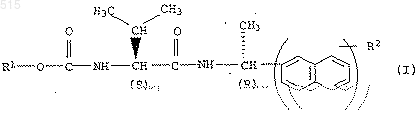
где R1 означает С1-С8алкил, С2-С8алкенил или С2-С8алкинил, причем эти радикалы могут быть частично либо полностью галогенированы и/или могут быть замещены одной-тремя группами из числа следующих: циано, С1-С4алкокси, С1-C4галогеналкокси, С1-С4алкилтио, C1-С4алкоксикарбонил, С3-С7циклоалкил, С3-С7циклоалкенил, арил, арилокси и гетероарил, причем циклические и ароматические кольца этих групп в свою очередь могут содержать от одного до трех заместителей из числа следующих: галоген, циано, С1-С4алкил, С1-С4алкоксиалкил, С1-С4галогеналкил, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкоксикарбонил, арил, арилокси и гетероарил;
R2 означает водород, галоген, циано, нитро, С1-С8алкил, С1-С4алкоксиалкил, С1-С4галогеналкил, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4галогеналкилтио либо представляет собой связанную через кислород или серу фенильную группу, которая может быть замещена одним-тремя заместителями из числа следующих: галоген, С1-С4алкил и С1-С4алкокси, со степенью чистоты изомеров более 90 мас.%.
2. Способ получения амидов карбамоилкарбоновой кислоты общей формулы I по п.1, отличающийся тем, что карбамоилкарбоновую кислоту общей формулы II
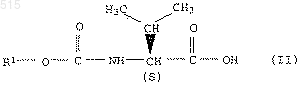
подвергают взаимодействию с амином общей формулы III
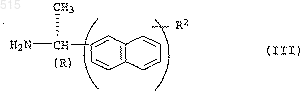
3. Способ получения амидов карбамоилкарбоновой кислоты общей формулы I по п.1, отличающийся тем, что
а) амид карбамоилкарбоновой кислоты общей формулы I
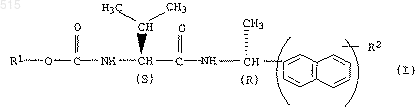
в которой группа R1-О-(СО) представляет собой защитную группу, переводят в амид аминокислоты формулы IV
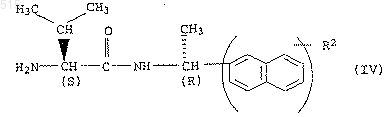
и б) полученный таким путем амид аминокислоты формулы IV подвергают взаимодействию с эфиром хлормуравьиной кислоты общей формулы V
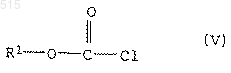
в присутствии основания.
4. Средство, предназначенное для борьбы с фитопатогенными грибами, содержащее эффективное количество, по меньшей мере, одного соединения общей формулы I по п.1 и, по меньшей мере, один вспомогательный агент.
5. Способ получения средства по п.4, отличающийся тем, что фунгицидно эффективное количество, по меньшей мере, одного соединения общей формулы I по п.1 и, по меньшей мере, один вспомогательный агент подвергают совместной переработке.
6. Способ борьбы с фитопатогенными грибами, отличающийся тем, что грибы, среду их обитания либо требующие защиты от поражения ими растения, помещения, площади или материалы обрабатывают эффективным количеством, по меньшей мере, одного соединения общей формулы I по п.1 или средством по п.4.
7. Применение соединений общей формулы I по п.1 или средств по п.4 для борьбы с фитопатогенными грибами.
Текст
1 Настоящее изобретение относится к амидам карбамоилкарбоновой кислоты общей формулы I со степенью чистоты изомеров более 90 мас.%,в которых переменные имеют следующее значение:R1 означает С 1-С 8 алкил, С 2-С 8 алкенил или С 2-С 8 алкинил, причем эти радикалы могут быть частично либо полностью галогенированы и/или могут нести от одной до трех групп из числа следующих: циано, C1-С 4 алкокси, С 1-С 4 галогеналкокси, С 1-С 4 алкилтио, С 1-С 4 алкоксикарбонил, С 3-С 7 циклоалкил, С 3-С 7 циклоалкенил,арил, арилокси и гетероарил, причем циклические и ароматические кольца этих групп в свою очередь могут нести от одного до трех заместителей из числа следующих: галоген, циано, С 1 С 4 алкил, С 1-С 4 алкоксиалкил, С 1-С 4 галогеналкил,С 1-С 4 алкокси,С 1-С 4 галогеналкокси,С 1 С 4 алкилтио, С 1-С 4 алкоксикарбонил, арил, арилокси и гетероарил;R2 означает водород, галоген, циано, нитро, С 1-С 8 алкил, С 1-С 4 алкоксиалкил, С 1-С 4 галогеналкил, С 1-С 4 алкокси, С 1-С 4 галогеналкокси,С 1-С 4 алкилтио, С 1-С 4 галогеналкилтио либо представляет собой связанную через кислород или серу фенильную группу, которая не замещена или может нести от одного до трех заместителей из числа следующих: галоген, С 1 С 4 алкил и С 1-С 4 алкокси.(S) означает S-конфигурацию, а (R) означает R-конфигурацию обозначенного таким образом асимметричного атома углерода согласно номенклатуре ИЮПАК. Конфигурация S-центра в соединениях общей формулы I прежде всего соответствует таковой L-валина. В целях упрощения конфигурация соединений формулы I обозначена в последующем как(SR)конфигурация. Понятие "степень чистоты изомеров" обозначает процентную долю соединения I (конфигурация (SR от общего количества возможных четырех диастереомеров этих соединений ISR), (RS), (RR) и (SS. Кроме того, изобретение относится к способу получения соединений формулы I. Изобретение относится далее к средствам, содержащим соединения I, к способу получения таких средств, а также к способу борьбы с вредоносными грибами и к применению соединений I или средств в этих целях. Рацемические смеси фунгицидных соединений типа I известны прежде всего из заявки Германии DE-A 4321897 и из более ранней заявки Германии Р 4431467.1. Однако эти смеси по своей фунгицидной эффективности не удов 000515 2 летворяют в достаточной степени соответствующим требованиям. Исходя из вышеизложенного, в основу изобретения была положена задача получить новые амиды карбамоилкарбоновой кислоты с высокой степенью чистоты изомеров, которые обладали бы более эффективным действием против вредоносных грибов. В соответствии с этим были получены соединения формулы I, определение которых представлено выше, а также содержащие их средства. Далее были разработаны способ получения соединений I и содержащих их средств, а также способ борьбы с вредоносными грибами и предлагается применение соединений I или средств в этих целях. Соединения формулы I могут быть получены по известной методике исходя из соответствующих, основанных на L-валине карбамоилкарбоновых кислот формулы II. Предпочтительно соединения I получают по описанным ниже способам А, соответственно Б (ссылки на"Houben-Weyl" относятся к: Houben-Weyl,Methoden der Organischen Chemie, 4-е издание,изд-во Thieme Verlag, Штутгарт). Способ А. Амиды карбамоилкарбоновой кислоты формулы I получают взаимодействием карбамоилкарбоновых кислот формулы II с аминами формулы III Карбамоилкарбоновые кислоты II известны либо могут быть получены по известным методам, прежде всего исходя из аминокислотыL-валина (ср. "Houben-Weyl", том 15/1, стр. 46305, прежде всего стр. 117-125). Амины III также известны либо их можно легко получить (ср. Organikum, изд-во VEBChem. 10, стр. 366 (1972); Journ. Am. Chem. Soc. 58, стр. 1808-1811 (1936. Из рацематов аминов III может быть выделен R-изомер по известной методике, в частности путем фракционированной кристаллизации с помощью оптически активной винной кислоты или предпочтительно путем ферментативно 3 катализованной этерификации и последующим омылением (ср., например, международную заявку WO-A 95/08636). Предпочтительно в этом способе А работают таким образом, что сначала карбамоилкарбоновые кислоты II переводят в карбоксиактивированные производные, прежде всего в ацилцианиды либо ангидриды (ср. Tetrahedron Letters, том 18, стр. 1595-1598 (1973), соответственно "Houben-Weyl", том 15/1, стр. 28-32). Затем эти производные подвергают взаимодействию с аминами III в присутствии оснований. Для получения карбоксиактивированных ацилцианидов можно осуществлять, например,реакцию между карбамоилкарбоновыми кислотами II и диэтиловым эфиром цианфосфоновой кислоты, прежде всего в инертном растворителе, таком как тетрагидрофуран или толуол. Для получения карбоксиактивированных ангидридов предпочтительно осуществлять взаимодействие карбамоилкарбоновой кислотыII с хлорангидридами угольной кислоты, такими как изобутиловый эфир хлормуравьиной кислоты, в присутствии оснований и необязательно в инертном растворителе, таком как толуол или тетрагидрофуран. Взаимодействие аминов III с карбоксиактивированными карбамоилкарбоновыми кислотами II осуществляют предпочтительно в растворителе, таком как дихлорметан, тетрагидрофуран или толуол. В качестве оснований могут служить также амины III, причем их преимущественно возвращают обычным путем из сырого продукта. В предпочтительном варианте осуществления этой стадии способа карбамоилкарбоновую кислоту II, амин III, реагент, пригодный для получения карбоксиактивированного производного карбамоилкарбоновой кислоты II, и основание подвергают взаимодействию в так называемом способе получения в одном аппарате, необязательно в инертном растворителе, после чего сырой продукт перерабатывают по известной технологии с получением в результате амида карбамоилкарбоновой кислоты формулыI. Способ Б. Амиды карбамоилкарбоновой кислоты формулы I получают благодаря тому,что амиды карбамоилкарбоновой кислоты I, в которых группа R1-O-(CO) представляет собой защитную группу, которую можно отщеплять известным путем, переводят в амиды аминокислоты формулы IV, которые затем подвергают взаимодействию с эфирами хлормуравьиной кислоты формулы V в присутствии одного из оснований. Стадия Ба. Получение амидов аминокислоты формулы IV. Отщепление группы R1-О-(СО) из амидов карбамоилкарбоновой кислоты I может проводиться известным путем (ср. "Houben-Weyl",том 15/1, стр. 46-305, прежде всего стр. 126129). Соответствующие отщепляемые группы содержат в качестве остатка R1 трет-бутиловую или наряду с нею бензильную группу. В случае,если R1 означает трет-бутил, например, отщепление осуществляют обычно взаимодействием с какой-либо кислотой, прежде всего с протоновой кислотой, такой как соляная кислота или трифторуксусная кислота (см. вышеуказанную публикацию, стр. 126-129). Пригодные для применения в качестве исходных материалов амиды карбамоилкарбоновой кислоты I могут быть получены по известным методам (ср. "Houben-Weyl", том 15/1, стр. 28-32) или прежде всего по способу А согласно изобретению. Стадия Бб. Получение амидов карбамоилкарбоновой кислоты формулы I. Синтезируемые на стадии Ба амиды аминокислот формулы IV подвергают взаимодействию с эфирами хлормуравьиной кислоты формулы V в присутствии оснований. Эфиры хлормуравьиной кислоты V общеизвестны либо могут быть получены с помощью известных способов. Указанное выше взаимодействие осуществляют предпочтительно в органическом растворителе, прежде всего в толуоле, метиленхлориде или тетрагидрофуране, либо в смесях этих растворителей. В качестве оснований приемлемы в равной степени как неорганические, так и органические основания, причем предпочтение отдают органическим основаниям, среди которых в свою очередь предпочтительны третичные амины,такие как триэтиламин, пиридин и Nметилпиперидин. Реакцию проводят, как правило, при температурах в интервале от -40 до+50 С, предпочтительно от -10 до +20 С. В остальном методика осуществления этой реакции специалисту в данной области техники известна и поэтому не требует дальнейших по 5 яснений (ср. "Houben-Weyl", том 15/1, стр. 117139). Переработку полученных с помощью способов А, соответственно Б реакционных смесей осуществляют по обычной технологии, например, смешением с водой, разделением фаз и необязательно хроматографической очисткой сырых продуктов. Промежуточные и конечные продукты получают частично в виде бесцветных либо слегка окрашенных в коричневатый цвет вязких масел, из которых при пониженном давлении и умеренно повышенной температуре удаляют летучие компоненты. При получении промежуточных и конечных продуктов в виде твердых веществ очистку можно осуществлять также, например, путем перекристаллизации или выщелачивания. При указанной выше расшифровке соединений формулы I были использованы обобщающие понятия, общепринятые для обозначения следующих заместителей: галоген: фтор, хлор, бром и иод; алкил: прямоцепочечные либо разветвленные алкильные группы с 1-8 атомами углерода,например, С 1-С 6 алкил, такой как метил, этил, нпропил, 1-метил-этил, н-бутил, 1-метилпропил,2-метилпропил, 1,1-диметилэтил, н-пентил, 1 метилбутил, 2-метилбутил, 3-метилбутил, 1,1 диметилпропил, 2,2-диметилпропил, 1,2-диметилпропил, 1-этилпропил, н-гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4 метилпентил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил, 1,2-диметилбутил, 1,3 диметилбутил, 2,3-диметилбутил, 1-этилбутил,2-этилбутил,1,1,2-триметилпропил,1,2,2 триметилпропил, 1-этил-1-метилпропил и 1 этил-2-метилпропил; галогеналкил, соответственно частично либо полностью галогенированный алкил: прямоцепочечные либо разветвленные алкильные группы с 1-4, соответственно 8 атомами углерода (как указано выше), причем в этих группах атомы водорода частично либо полностью могут быть заменены на атомы галогена (как указано выше), например, С 1-С 2 галогеналкил, такой как хлорметил, дихлорметил, трихлорметил,фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2 хлор-2,2-дифторэтил,2,2-дихлор-2-фторэтил,2,2,2-трихлорэтил и пентафторэтил; алкокси: прямоцепочечные либо разветвленные алкоксигруппы с 1-4 атомами углерода,например, С 1-С 3 алкокси, такой как метилокси,этилокси, пропилокси и 1-метилэтилокси; алкоксиалкил: прямоцепочечные либо разветвленные алкильные группы с 1-8 атомами углерода (как указано выше), несущие в любом положении прямоцепочечную либо разветвленную алкоксигруппу (как указано выше) с 1-4 атомами углерода в случае С 1-С 4 алкоксиалкила, 000515 6 такой как метоксиметил, этоксиметил, нпропоксиметил, н-бутоксиметил, 1-метоксиэтил,2-метоксиэтил, 1-этоксиэтил, 2-этоксиэтил, 2-нпропоксиэтил и 2-бутоксиэтил; галогеналкокси: прямоцепочечные либо разветвленные алкоксигруппы с 1-4 атомами углерода (как указано выше), причем в этих группах атомы водорода могут быть частично либо полностью заменены на атомы галогена(как указано выше), например С 1-С 2 галогеналкокси, такой как хлорметилокси, дихлорметилокси, трихлорметилокси, фторметилокси,дифторметилокси, трифторметилокси, хлорфторметилокси, дихлорфторметилокси, хлордифторметилокси, 1-фторэтилокси, 2-фторэтилокси, 2,2-дифторэтилокси, 2,2,2-трифторэтилокси, 2-хлор-2-фторэтилокси, 2-хлор-2,2-дифторэтилокси, 2,2-дихлор-2-фторэтилокси, 2,2,2 трихлорэтилокси и пентафторэтилокси; алкилтио: прямоцепочечные либо разветвленные алкильные группы с 1-4 атомами углерода (как указано выше), связанные через атом серы (-S-) со скелетом, например С 1 С 4 алкилтио, такой как метилтио, этилтио, пропилтио, 1-метилэтилтио, н-бутилтио и третбутилтио; алкоксикарбонил: прямоцепочечные либо разветвленные алкоксигруппы с 1-4 С-атомами(как указано выше), связанные через карбонильную группу (-СО-) со скелетом; алкенил: прямоцепочечные либо разветвленные алкенильные группы с 2-8 атомами углерода и двойной связью в любом положении,например С 2-С 6 алкенил, такой как этенил, 1 пропенил, 2-пропенил, 1-метилэтенил, 1 бутенил, 2-бутенил, 3-бутенил, 1-метил-1 пропенил,2-метил-1-пропенил,1-метил-2 пропенил, 2-метил-2-пропенил, 1-пентенил, 2 пентенил, 3-пентенил, 4-пентенил, 1-метил -1 бутенил, 2-метил-1-бутенил, 3-метил-1-бутенил,1-метил-2-бутенил, 2-метил-2-бутенил, 3-метил 2-бутенил,1-метил-3-бутенил,2-метил-3 бутенил, 3-метил-3-бутенил, 1,1-диметил-2 пропенил,1,2-диметил-1-пропенил,1,2 диметил-2-пропенил, 1-этил-1-пропенил, 1-этил 2-пропенил, 1-гексенил, 2-гексенил, 3-гексенил,4-гексенил, 5-гексенил, 1-метил-1-пентенил, 2 метил-1-пентенил, 3-метил-1-пентенил, 4 - метил-1-пентенил, 1-метил-2-пентенил, 2-метил-2 пентенил, 3-метил-2-пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил,3-метил-3-пентенил, 4-метил-3-пентенил, 1 метил-4-пентенил, 2-метил-4-пентенил, 3-метил 4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2 бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-1 бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3 бутенил, 1,3-диметил-1-бутенил, 1,3-диметил-2 бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3 бутенил, 2,3-диметил-1-бутенил, 2,3-диметил-2 бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-1 бутенил, 3,3-диметил-2-бутенил, 1-этил-1-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2 7 этил-1-бутенил, 2-этил-2-бутенил, 2-этил-3 бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1 метил-2-пропенил, 1-этил-2-метил-1-пропенил и 1-этил-2-метил-2-пропенил; алкинил: прямоцепочечные либо разветвленные алкинильные группы с 2-8 атомами углерода и тройной связью в любом положении,например С 2-С 6 алкинил, такой как этинил, 1 пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3 бутинил, 1-метил-2-пропинил, 1-пентинил, 2 пентинил, 3-пентинил, 4-пентинил, 1-метил-2 бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 3-метил-1-бутинил, 1,1-диметил-2-пропинил, 1-этил-2-пропинил, 1-гексинил, 2-гексинил,3-гексинил, 4-гексинил, 5-гексинил, 1-метил-2 пентинил, 1-метил-3-пентинил, 1-метил-4-пентинил, 2-метил-3-пентинил, 2-метил-4-пентинил, 3-метил-1-пентинил, 3-метил-4-пентинил, 4-метил-1-пентинил, 4-метил-2-пентинил, 1,1-диметил-2-бутинил, 1,1-диметил-3 бутинил, 1,2-диметил-3-бутинил, 2,2-диметил-3 бутинил,3,3-диметил-1-бутинил,1-этил-2 бутинил, 1-этил-3-бутинил, 2-этил-3-бутинил и 1-этил-1-метил-2-пропинил; циклоалкил: моноциклические алкильные группы с 3-7 углеродными членами кольца, например, С 3-С 7 циклоалкил, такой как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил; циклоалкенил: моноциклические алкильные группы с 5-7 углеродными членами кольца,содержащие одну или несколько двойных связей, например, С 5-С 7 циклоалкенил, такой как циклопентенил, циклогексенил и циклогептенил; арилокси: арильные группы (как указано выше), связанные через атом кислорода (-О-) со скелетом, такие как фенокси, 1-нафтокси и 2 нафтокси,гетероарил: ароматические моно- либо полициклические радикалы, которые наряду с углеродными членами кольца дополнительно могут содержать 1-4 атома азота либо 1-3 атома азота и один атом кислорода или серы либо один атом кислорода или серы, например:- 5-членный гетероарил, содержащий 1-3 атома азота: 5-циклические гетероарильные группы, которые наряду с атомами углерода могут содержать в качестве членов кольца 1-3 атома азота, например 2-пирролил, 3-пирролил,3-пиразолил, 4-пиразолил, 5-пиразолил, 2 имидазолил, 4-имидазолил, 1,2,4-триазол-3-ил и 1,3,4-триазол-2-ил;- 5-членный гетероарил, содержащий 1-4 атома азота либо 1-3 атома азота и 1 атом серы или кислорода, либо 1 атом кислорода или 1 атом серы: 5-циклические гетероарильные группы, которые наряду с атомами углерода могут содержать в качестве членов кольца 1-4 атома азота либо 1-3 атома азота и 1 атом серы или кислорода либо один атом кислорода или серы, например, 2-фурил, 3-фурил, 2-тиенил, 3 000515- сконденсированный с бензольным ядром 5-членный гетероарил, содержащий 1-3 атома азота либо 1 атом азота и/или один атом кислорода или серы: 5-циклические гетероарильные группы, которые наряду с атомами углерода могут содержать в качестве членов кольца 1-4 атома азота либо 1-3 атома азота и 1 атом серы или кислорода либо 1 атом кислорода или серы и в которых 2 смежных углеродных члена кольца либо 1 азотный член кольца и 1 смежный углеродный член кольца могут быть соединены мостиковой связью посредством бута-1,3-диен 1,4-дииловой группы;- связанный через азот 5-членный гетероарил, содержащий 1-4 атома азота, или связанный через азот сконденсированный с бензольным ядром 5-членный гетероарил, содержащий 1-3 атома азота: 5-циклические гетероарильные группы, которые наряду с атомами углерода могут содержать в качестве членов кольца 1-4 атома азота, соответственно 1-3 атома азота и в которых 2 смежных углеродных члена кольца либо азотный член кольца и смежный углеродный член кольца могут быть соединены мостиковой связью посредством бута-1,3-диен-1,4 дииловой группы, причем эти кольца соединены соответственно через один из азотных членов кольца со скелетом;- 6-членный гетероарил, содержащий 1-3,соответственно 1-4 атома азота: 6-циклические гетероарильные группы, которые наряду с атомами углерода могут содержать в качестве членов кольца 1-3, соответственно 1-4 атома азота,например, 2-пиридинил, 3-пиридинил, 4 пиридинил, 3-пиридазинил, 4-пиридазинил, 2 пиримидинил, 4-пиримидинил, 5-пиримидинил,2-пиразинил, 1,3,5-триазин-2-ил, 1,2,4-триазин 3-ил и 1,2,4,5-тетразин-3-ил;- сконденсированный с бензольным ядром 6-членный гетероарил, содержащий 1-4 атома азота: 6-циклические гетероарильные группы, в которых 2 смежных углеродных члена кольца могут быть соединены мостиковой связью посредством бута-1,3-диен-1,4-дииловой группы,например, хинолин, изохинолин, хиназолин и хиноксалин. Под понятием "частично либо полностью галогенированы" имеется в виду, что в охарактеризованных таким образом группах атомы водорода частично либо полностью могут быть заменены на идентичные либо различные атомы галогена, как указано выше. С учетом их действия против вредных грибов предпочтительными являются такие соединения формулы I, степень чистоты изомеров в которых составляет, по крайней мере, 93% и прежде всего, по крайней мере, 95%. С учетом их действия против вредоносных грибов предпочтительны далее такие соединения формулы I, в которых радикалы R1 и R2 имеют следующие значения, а именно, индивидуально либо в соответствующем сочетании. Группы, указанные ниже при расшифровке значений радикалов, также могут быть согласно изобретению замещены:R2 представляет собой водород, галоген,циано, С 1-С 4 алкил или С 1-С 4 алкокси, предпочтительно водород, хлор, циано, метил или метокси и прежде всего водород. К наиболее предпочтительным с учетом их применения относятся соединения формулы I,представленные в нижеследующих таблицах 1 и 2. Таблица 1 Среди представленных в таблице 1 соединений предпочтительны в свою очередь таковые, в которых заместитель R2 находится в положении 5 или 6 циклической системы нафталина. Новые соединения формулы I пригодны для борьбы с вредоносными грибами. Новые соединения формулы I могут применяться, например, в виде предназначенных для непосредственного опрыскивания растворов, порошков, суспензий, в том числе высококонцентрированных водных, масляных или каких-либо других суспензий, или дисперсий,эмульсий, масляных дисперсий, паст, препаратов для опыливания, опудривания или гранулятов, причем обработку проводят различными методами, такими как опрыскивание, обработка в виде туманов, опыливание, опудривание или полив. Технология и формы применения полностью зависят от целей применения, но во всех случаях должно быть обеспечено максимально тонкое и равномерное распределение действующих веществ по изобретению. Обычно при обработке растений растения опрыскивают либо опыливают действующими веществами или же действующими веществами обрабатывают семена растений. Композиции приготавливают, применяя обычные для этих целей вспомогательные средства, более подробно указанные ниже, по известной методике, например, разбавлением действующих веществ с помощью растворителей и/или введением наполнителей, при необходимости с использованием эмульгаторов и диспергаторов, причем в случае использования в качестве разбавителя воды могут применяться также другие органические растворители, служащие вспомогательными агентами растворимости. В качестве таких вспомогательных агентов для указанных целей могут служить в основном следующие:- растворители, такие как ароматические углеводороды (например, ксилол), хлорирован 11 ные ароматические углеводороды (например,хлорбензолы), парафины (например, нефтяные фракции), спирты (например, метанол, бутанол),кетоны (например, циклогексанон), амины (например, этаноламин, диметилформамид) и вода;- наполнители, такие как природная минеральная мука (например, каолины, глиноземы,тальк, мел) и синтетическая минеральная мука- эмульгаторы, такие как неионогенные и анионные эмульгаторы (например, эфиры жирных спиртов и полиоксиэтилена, алкилсульфонаты и арилсульфонаты), и- диспергаторы, такие как отработанный лигнинсульфитный щелок и метилцеллюлоза. В качестве поверхностно-активных веществ могут рассматриваться соли щелочных и щелочно-земельных металлов и аммониевые соли ароматических сульфоновых кислот, например, лигнинсульфоновой кислоты, фенолсульфоновой кислоты, нафталинсульфоновой кислоты и дибутилнафталинсульфоновой кислоты, а также жирных кислот, алкил- и алкиларилсульфонаты, алкилсульфаты, сульфаты лаурилового эфира и жирных спиртов, а также соли сульфированных гекса-, гепта- и октадеканолов,гликолевого эфира жирных спиртов, продукты реакции конденсации сульфированного нафталина и его производных с формальдегидом,продукты реакции конденсации нафталина, соответственно нафталинсульфоновых кислот с фенолом и формальдегидом, полиоксиэтиленоктилфеноловые эфиры, этоксилированный изооктил-, октил- или нонилфенол, полигликолевые эфиры алкилфенола и трибутилфенила,алкилариловые эфиры полиспиртов, изотридециловый спирт, конденсаты этиленоксида и жирных спиртов, этоксилированное касторовое масло, простой полиоксиэтилен- или полиоксипропиленалкиловый эфир, ацетат эфира лаурилового спирта и полигликоля, сложные эфиры сорбита, отработанный лигнинсульфитный щелок или метилцеллюлоза. Порошковые препараты, препараты для опыливания и опудривания могут изготавливаться смешением или совместным измельчением действующих веществ с каким-либо твердым наполнителем. Грануляты, например грануляты в оболочке, импрегнированные грануляты и гомогенные грануляты могут быть получены за счет связывания действующих веществ с твердыми наполнителями. Такими твердыми наполнителями могут служить минеральные земли, в частности силикагель, кремниевые кислоты, силикаты,тальк, каолин, известняк, известь, мел, болюс,лесс, глина, доломит, диатомовая земля, сульфат кальция и сульфат магния, оксид магния,измельченные синтетические вещества, удобрения, такие как сульфат аммония, фосфат аммония, нитрат аммония, мочевины и продукты 12 растительного происхождения, такие как мука зерновых, мука из коры деревьев, древесная мука и мука из ореховой скорлупы, целлюлозные порошки или какие-либо другие твердые наполнители. Примерами описанных выше композиций являются следующие:I. Раствор из 90 мас. ч. соединения формулы I согласно изобретению и 10 мас. ч. N-метил 2-пирролидона, предназначенный для применения в виде мельчайших капель.II. Смесь из 10 мас. ч. соединения формулы I согласно изобретению, 70 мас. ч. ксилола,10 мас. ч. продукта присоединения 8-10 молей этиленоксида к 1 молю N-моноэтаноламида олеиновой кислоты, 5 мас. ч. кальциевой соли додецилбензолсульфоновой кислоты, 5 мас. ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла; после тонкого и равномерного распределения этой композиции в воде получают соответствующую дисперсию.III. Водная дисперсия из 10 мас. ч. соединения формулы I согласно изобретению, из 40 мас. ч. циклогексанона, 30 мас. ч. изобутанола и 20 мас. ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла.IV. Водная дисперсия из 10 мас. ч. соединения формулы I согласно изобретению, 25 мас. ч. циклогексанола, 55 мас. ч. фракции нефтяного топлива с температурой кипения 210-280 С,получаемой при перегонке нефти, и 10 мас. ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла.V. Измельченная в молотковой мельнице смесь из 80 мас. ч. предпочтительно твердого соединения формулы I согласно изобретению, 3 мас. ч. натриевой соли диизобутилнафталин-2 сульфоновой кислоты, 10 мас. ч. натриевой соли лигнинсульфоновой кислоты из отработанного сульфитного щелока и 7 мас. ч. порошкообразного силикагеля; после тонкого и равномерного распределения этой смеси в воде получают соответствующий раствор для опрыскивания.VI. Гомогенная смесь из 3 мас. ч. соединения формулы I согласно изобретению и 97 мас. ч. тонкодисперсного каолина; этот препарат для опыливания содержит 3 мас.% действующего вещества.VII. Гомогенная смесь из 30 мас. ч. соединения формулы I согласно изобретению, 62 мас. ч. порошкообразного силикагеля и 8 мас. ч. парафинового масла, которое напыляют на поверхность этого силикагеля; благодаря такой технологии приготовления действующее вещество приобретает хорошую адгезионную способность.VIII. Устойчивая водная дисперсия из 40 мас. ч. соединения формулы I согласно изобретению, 10 мас. ч. натриевой соли конденсата фенолсульфоновой кислоты - мочевины - формальдегида, 2 мас. ч. силикагеля и 48 мас. ч. 13 воды, которую можно дополнительно разбавлять.IX. Устойчивая масляная дисперсия из 20 мас. ч. соединения формулы I согласно изобретению, 2 мас. ч. кальциевой соли додецилбензолсульфоновой кислоты, 8 мас. ч. полигликолевого эфира жирного спирта, 20 мас. ч. натриевой соли конденсата фенолсульфоновой кислоты-мочевины-формальдегида и 50 мас. ч. парафинового минерального масла. Новые соединения отличаются исключительно высокой эффективностью против широкого спектра фитопатогенных грибов, прежде всего относящихся к классу фикомицетов, а также дейтеромицетов, аскомицетов и базидиомицетов. Они обладают частично системным действием и могут применяться в качестве фунгицидов для обработки листьев и в качестве почвенных фунгицидов. Особое значение они имеют для борьбы с многочисленными грибами, поражающими различные культурные растения, такие как пшеница, рожь, ячмень, овес, рис, кукуруза, газонные травы, хлопчатник, соя, кофе, сахарный тростник, виноград, плодовые и декоративные растения, овощные культуры, такие как огурцы, бобовые и тыквенные, а также поражающими семена этих растений. Принцип применения соединений формулы I состоит в том, что грибы, среду их обитания либо семена, растения, помещения, площади или материалы, требующие защиты от поражения грибами, обрабатывают эффективным количеством действующих веществ. Такую обработку проводят до либо после заражения материалов, растений или семян грибами. Новые соединения формулы I особенно пригодны для борьбы со следующими болезнями растений: Erysiphe graminis (настоящая мучнистая роса) на зерновых, Erysiphe cichoracearum и Sphaerotheca fuliginea на тыквенных,Podosphaera leucotricha на яблоневых, Uncinulahumuli на хмеле и виды Alternaria на овощных и плодовых культурах. Новые соединения могут применяться также для защиты материалов, в частности дре 000515Paecilomyces variotii. Фунгицидные препараты содержат действующие вещества, как правило, в количестве от 0,1 до 95, предпочтительно от 0,5 до 90 мас.%. Нормы расхода в зависимости от того, какой эффект хотят получить, составляют от 0,025 до 2, предпочтительно от 0,1 до 1 кг действующего вещества на гектар. При обработке семенного материала действующие вещества применяют,как правило, в количестве от 0,001 до 50, предпочтительно от 0,01 до 10 г на кг семян. Предлагаемые согласно изобретению средства при их использовании в качестве фунгицидов могут применяться также с другими действующими веществами, например с гербицидами, инсектицидами, регуляторами роста, фунгицидами или же с удобрениями. При смешении с фунгицидами при этом во многих случаях достигают расширения спектра фунгицидного действия. Ниже представлен перечень фунгицидов, в сочетании с которыми могут применяться соединения по изобретению, причем этот перечень служит для пояснения таких комбинационных возможностей, не ограничивая объем изобретения. К указанным фунгицидам относятся: сера, дитиокарбаматы и их производные,такие как ферридиметилдитиокарбамат, диметилдитиокарбамат цинка, этиленбисдитиокарбамат цинка,этиленбисдитиокарбамат марганца, марганец - цинк - этилендиаминбисдитиокарбамат, тетраметилтиурамдисульфиды,аммиачный комплекс цинк-(N,N-этиленбисдитиокарбамат), аммиачный комплекс цинк(N,N'-пропиленбисдитиокарбамат),цинк(N,N'пропиленбисдитиокарбамат),N,N' полипропиленбис(тиокарбамоил) дисульфид; нитропроизводные, такие как динитро(1 метилгептил)фенилкротонат, 2-втор-бутил-4,6 динитрофенил-3,3-диметилакрилат,2-вторбутил-4,6-динитрофенилизопропилкарбонат,диизопропиловый эфир 5-нитроизофталевой кислоты; гетероциклические субстанции, такие как 2-гептадецил-2-имидазолинацетат, 2,4-дихлор 6-(о-хлоранилино)-s-триазин, O,O-диэтилфталимидфосфонтиоат, 5-амино-1- [бис(диметиламино)фосфинил]-3-фенил-1,2,4-триазол,2,3 дициано-1,4-дитиоантрахинон, 2-тио-1,3-дитиоло-[4,5-b]хиноксалин, метиловый эфир 1(бутилкарбамоил)-2-бензимидазолкарбаминовой кислоты, 2-метоксикарбониламинобензимидазол, 2-(фурил-(2-бензимидазол, 2-(тиазолил(4 бензимидазол, N-(1,1,2,2-тетрахлорэтилтио) тетрагидрофталимид, N-трихлорметилтиотетрагидрофталимид, N-трихлорметилтиофталимид; диамидN-дихлорфторметилтио-N',N'диметил-N-фенилсерной кислоты, 5-этокси-3 трихлорметил-1,2,3-тиадиазол, 2-роданметилтиобензтиазол, 1,4-дихлор-2,5-диметоксибензол, 15 4-(2-хлорфенилгидразоно)-3-метил-5-изоксазолон,пиридин-2-тион-1-оксид,8-гидроксихинолин, соответственно его медная соль, 2,3 дигидро-5-карбоксанилидо-6-метил-1,4-оксатиин, 2,3-дигидро-5-карбоксанилидо-6-метил-1,4 оксатиин-4,4-диоксид, анилид 2-метил-5,6 дигидро-4 Н-пиран-3-карбоновой кислоты, анилид 2-метилфуран-3-карбоновой кислоты, анилид 2,5-диметилфуран-3-карбоновой кислоты,анилид 2,4,5-триметилфуран-3-карбоновой кислоты, циклогексиламид 2,5-диметилфуран-3 карбоновой кислоты, амид N-циклогексил-Nметокси- 2,5-диметилфуран-3-карбоновой кислоты, анилид 2-метилбензойной кислоты, анилид 2-иодбензойной кислоты, N-формил-Nморфолин-2,2,2-трихлорэтилацеталь,пиперазин-1,4-диилбис-1-(2,2,2-трихлорэтил) формамид, 1-(3,4-дихлоранилино)-1-формиламино 2,2,2-трихлороэтан; 2,6-диметил-N-тридецилморфолин, соответственно его соли,2,6-диметил-Nциклододецилморфолин, соответственно его соли,N-[3-(п-трет-бутилфенил)-2-метилпропил]-цис-2,6-диметилморфолин, N-[3-(п-третбутилфенил)-2-метилпропил] пиперидин, 1-[2(2,4-дихлорфенил)-4-этил-1,3-диоксолан-2-илэтил]-1 Н-1,2,4-триазол, 1-[2-(2,4-дихлорфенил)4-н-пропил-1,3-диоксолан-2-илэтил]-1 Н-1,2,4 триазол,N-(н-пропил)-N-(2,4,6-трихлорфеноксиэтил)-N'-имидазолилмочевина, 1-(4-хлорфенокси)-3,3-диметил-1-(1 Н-1,2,4-триазол-1-ил)-2 бутанон, (2-хлорфенил)-(4-хлорфенил)-5-пиримидинметанол, 5-бутил-2-диметиламино-4-гидрокси-6-метилпиримидин, бис(п-хлорфенил)-3 пиридинметанол, 1,2-бис(3-этоксикарбонил-2 тиоуреидо)бензол, 1,2-бис(3-метоксикарбонил 2-тиоуреидо)бензол, [2-(4-хлорфенил)этил]-(1,1 диметилэтил)-1 Н-1,2,4-триазол-1-этанол, 1-[3(2-хлорфенил)-1-(4-фторфенил)-оксиран-2-илметил]-1 Н-1,2,4-триазол; а также ряд других фунгицидов, таких как додецилгуанидинацетат,3-[3-(3,5-диметил-2 оксициклогексил)-2-гидроксиэтил] глутаримид,гексахлорбензол, DL-мeтил-N-(2,6-димeтилфeнил)-N-фypoил(2)aлaнинaт, метиловый эфир 16 фторфенил)метилсилил)метил)-1 Н-1,2,4-триазол; стробилурины, такие как метил-Е-метоксимино-[-(о-толилокси)-о-толил]ацетат, метил-Е 2-[2-[6-(2-цианофенокси)пиридимин-4-ил-окси] фенил]-3-метоксиакрилат, метил-Е-метоксимино-[-(2,5-диметилокси)-о-толил]ацетамид, анилинопиримидины, такие как N-(4,6-диметилпиримидин-2-ил)анилин, N-[4-метил-6-(1-пропинил)пиримидин-2-ил]анилин, N-(4-метил-6 циклопропилпиримидин- 2-ил) анилин; фенилпирролы, такие как 4-(2,2-дифтор 1,3-бензодиоксол-4-ил)-пиррол-3-карбонитрил; амиды коричной кислоты, такие как морфолид 3-(4-хлорфенил)-3-(3,4-диметоксифенил) акриловой кислоты. Пример синтеза. Приведенные в нижеследующем примере синтеза рекомендации могут использоваться при соответствующей модификации исходного соединения для получения других представителей соединений формулы I. Физические характеристики полученных таким путем продуктов представлены в нижеследующей таблице 2. 1. (R)-1-амино-1-(-нафтил)этан. 1.1 Получение (R)-1-(-нафтил)этиламида метоксиуксусной кислоты. 39 г (0,23 моля) рацемического 1-амино-1(-нафтил) этана растворяли в 200 мл метилтрет-бутилового эфира. Затем раствор смешивали с 29,5 г (0,25 моля) метилового эфира метоксиуксусной кислоты, начало реакции инициировали добавлением 0,5 г липазы (приблизительно 1000 ед./г, Pseudomonas spec., депонированная в Немецкой коллекции микроорганизмов под каталожным номером 8246) и в ходе реакции реакционную смесь перемешивали на вибрационном столе. По достижении 50%-ного результата реакции (контроль посредством хроматографии), по истечении примерно 48 ч, фермент отфильтровывали. Далее фильтрат концентрировали и растворяли разбавленной соляной кислотой (300 мл) и диэтиловым эфиром (300 мл). После отделения эфирной фазы кислую фазу повторно экстрагировали диэтиловым эфиром. После объединения, сушки и концентрирования эфирных фаз получили 18,7 г (0,08 моля) (R)-1(-нафтил)этиламида метоксиуксусной кислоты. Из водной фазы после добавления едкого натра до щелочного значения рН экстрагировали диэтиловым эфиром (S)-1-амино-1-(-нафтил)этан. После сушки и концентрирования органической фазы получили 15 г (0,09 моля) (S)-1-амино-1 17(-нафтил) этана. Избыток энантиомера (ее показатель) после конверсии в трифторацетамид,который определяли на хиральной ГХ-колонне(R)-1-(нафтил)этиламида метоксиуксусной кислоты растворяли в 75 мл этиленгликоля и к этому раствору добавляли 15 г 50%-ного раствора гидроксида калия. После нагревания в течение 3 ч до 150 С охлаждали, разбавляли 300 мл воды и четырежды экстрагировали порциями по 500 мл диэтилового эфира соответственно. Объединенные эфирные фазы сушили и концентрировали. Таким путем получили 8,1 г (47 ммолей)(R)-1-амино-1-(-нафтил) этана в 50 мл тетрагидрофурана добавляли 1,0 г (5,9 ммолей) диэтилового эфира цианфосфорной кислоты и 1,3 г (12 ммолей) триэтиламина, после чего перемешивали в течение одного часа при 0 С и в течение 15 ч при 20 С. Затем растворитель удаляли и остаток растворяли в 300 мл этилового эфира уксусной кислоты. Органическую фазу последовательно промывали соответственно 200 мл 5%-ного едкого натра, 10%-ной соляной кислоты, 10%-ного раствора гидрокарбоната натрия и воды, сушили и концентрировали. В результате получили 2,0 г (5,4 ммолей) (R)-1-(нафтил)этиламида N-(трет-бутилоксикарбонил)L-валина (tпл 93 С, соединение 2.1 в таблице 2). 3. (R)-1-(-нафтил)этиламид N-(изопропилоксикарбонил)-L-валина. К 1,70 г(R)-1-(нафтил)этиламида N-(трет-бутилоксикарбонил)L-валина при охлаждении добавляли 5 мл трифторуксусной кислоты и смесь перемешивали в течение одного часа при 0 С. Затем нагревали до 20 С, трифторуксусную кислоту практически полностью отгоняли, остаток растворяли в 100 мл дихлорметана и последовательно промывали соответственно 50 мл 2 н. едкого натра, 5%-ного раствора гидрокарбоната натрия и воды. После сушки и концентрирования органической фазы получили 1,07 г (4,0 ммоля) (R)-1-(нафтил)этиламида L-валина в виде вязкотекучего масла желтого цвета. 0,54 г (2,0 ммоля) этого соединения и 0,22 г (2,2 ммоля) триэтиламина в 40 мл толуола смешивали при 0 С с 0,24 г (2,1 ммоля) изопропилового эфира хлормуравьиной кислоты и перемешивали в течение 15 ч при 20 С. После 18 удаления растворителя остаток растворяли 50 мл этилового эфира уксусной кислоты и последовательно промывали соответственно 40 мл 5%-ного едкого натра, 10%-ной соляной кислоты, 10%-ного раствора гидрокарбоната натрия и воды. После сушки органической фазы растворитель удаляли. В результате получили 0,6 г (1,7 ммоля) указанного в заголовке соединения в виде бесцветного кристаллического продукта Примеры по применению. В следующих опытах, проводившихся для исследования и подтверждения фунгицидной эффективности соединений формулы I, использовали эмульсию, содержавшую 10 мас.% действующего вещества общей формулы I и 90 мас.% смеси, включающей:- 70 мас.% циклогексанола,- 20 мас.% Nekanil LN (Lutensol АР 6,смачиватель с эмульгирующим и диспергирующим действием на основе этоксилированных алкилфенолов) и- 10 мас.% Emulphor EL (Emulan EL,эмульгатор на основе этоксилированных жирных спиртов). Требуемую концентрацию действующего вещества получали за счет разбавления этой эмульсии водой. Действие против Plasmopara viticola. Листья горшечных растений виноградной лозы сорта "Mueller-Thurgau" опрыскивали водным раствором, приготовленным по описанной выше технологии. Для определения продолжительности действия активных веществ растения после того, как покрывавший листья раствор высох, помещали на 8 дней в теплицу. Лишь затем листья инфицировали взвесью зооспорPlasmopara viticola (ложная мучнистая роса винограда). Растения выдерживали сначала в течение 48 ч в камере в насыщенной водными парами атмосфере при 24 С, а затем в течение 5 дней в теплице при температуре 20-30 С. По истечении этого времени с целью ускорить вскрытие носителя спорангия растения повторно помещали на 16 ч во влажную камеру. После этого проводили визуальную оценку степени поражения грибами нижней поверхности листьев. Результаты этих опытов представлены в нижеследующей таблице 3. Таблица 3 Результаты опытов по выявлению действия соединений по изобретению против Plasmopara viticola в сравнении с таковым содержащих их рацематов (известных из заявки Германии Пораженная нижняя поверхность листьев(%) при применении действующего вещества в концентрации: 63 ч./млн 16 ч./млн 4 ч./млн 1 ч./млн 0 3 5 15 0 15 40 0 0 Степень поражения грибами нижней поверхности листьев у растений, не обработанных указанными соединениями, достигала 75%. подвергают взаимодействию с амином общей формулы III 3. Способ получения амидов карбамоилкарбоновой кислоты общей формулы I по п.1,отличающийся тем, что а) амид карбамоилкарбоновой кислоты общей формулы I ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Амиды карбамоилкарбоновой кислоты общей формулы I в которой группа R1-О-(СО) представляет собой защитную группу, переводят в амид аминокислоты формулы IVR1 означает С 1-С 8 алкил, С 2-С 8 алкенил или С 2-С 8 алкинил, причем эти радикалы могут быть частично либо полностью галогенированы и/или могут быть замещены одной-тремя группами из числа следующих: циано, С 1-С 4 алкокси, С 1C4 галогеналкокси, С 1-С 4 алкилтио, C1-С 4 алкоксикарбонил,С 3-С 7 циклоалкил,С 3-С 7 циклоалкенил, арил, арилокси и гетероарил, причем циклические и ароматические кольца этих групп в свою очередь могут содержать от одного до трех заместителей из числа следующих: галоген,циано, С 1-С 4 алкил, С 1-С 4 алкоксиалкил, С 1 С 4 галогеналкил, С 1-С 4 алкокси, С 1-С 4 галогеналкокси,С 1-С 4 алкилтио,С 1-С 4 алкоксикарбонил, арил, арилокси и гетероарил;R2 означает водород, галоген, циано, нитро, С 1-С 8 алкил, С 1-С 4 алкоксиалкил, С 1-С 4 галогеналкил, С 1-С 4 алкокси, С 1-С 4 галогеналкокси,С 1-С 4 алкилтио, С 1-С 4 галогеналкилтио либо представляет собой связанную через кислород или серу фенильную группу, которая может быть замещена одним-тремя заместителями из числа следующих: галоген, С 1-С 4 алкил и С 1 С 4 алкокси, со степенью чистоты изомеров более 90 мас.%. 2. Способ получения амидов карбамоилкарбоновой кислоты общей формулы I по п.1,отличающийся тем, что карбамоилкарбоновую кислоту общей формулы II и б) полученный таким путем амид аминокислоты формулы IV подвергают взаимодействию с эфиром хлормуравьиной кислоты общей формулы V в присутствии основания. 4. Средство, предназначенное для борьбы с фитопатогенными грибами, содержащее эффективное количество, по меньшей мере, одного соединения общей формулы I по п.1 и, по меньшей мере, один вспомогательный агент. 5. Способ получения средства по п.4, отличающийся тем, что фунгицидно эффективное количество, по меньшей мере, одного соединения общей формулы I по п.1 и, по меньшей мере, один вспомогательный агент подвергают совместной переработке. 6. Способ борьбы с фитопатогенными грибами, отличающийся тем, что грибы, среду их обитания либо требующие защиты от поражения ими растения, помещения, площади или материалы обрабатывают эффективным количеством, по меньшей мере, одного соединения общей формулы I по п.1 или средством по п.4. 7. Применение соединений общей формулы I по п.1 или средств по п.4 для борьбы с фитопатогенными грибами.
МПК / Метки
МПК: C07C 271/22, A01N 47/12
Метки: амиды, карбамоилкарбоновой, кислоты
Код ссылки
<a href="https://eas.patents.su/11-515-amidy-karbamoilkarbonovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Амиды карбамоилкарбоновой кислоты.</a>
Предыдущий патент: Способ нормализации липопротеидного профиля плазмы крови у млекопитающего и фармацевтическая композиция для его осуществления
Следующий патент: Способ получения окиси алюминия из гидроокиси алюминия
Случайный патент: Новые соединения инденоиндолона, способ их получения и фармацевтические композиции их содержащие















