Способ определения качества клеточной культуры
Номер патента: 9326
Опубликовано: 28.12.2007
Формула / Реферат
1. Способ определения качества клеточной культуры, включающий масс-спектрометрический анализ поверхностных клеточных белков, отличающийся тем, что предварительно промытые живые клетки исследуемой клеточной культуры подвергают витальному воздействию протеазы, отбирают отщепленные фрагменты поверхностных белков и масс-спектрометрически определяют их массы, контролируют наличие качественных характеристик у исследуемой культуры клеток путем сравнения совокупности полученных масс с совокупностью масс-спектрометрически определенных масс фрагментов поверхностных белков живых клеток с известными качественными характеристиками.
2. Способ по п.1, отличающийся тем, что в качестве протеазы используют трипсин.
3. Способ по п.1, отличающийся тем, что контролируют наличие качественных характеристик, определяющих источник клеток.
4. Способ по п.1, отличающийся тем, что контролируют наличие качественных характеристик, определяющих пригодность для проведения противоопухолевой иммунотерапии.
5. Способ по п.1, отличающийся тем, что контролируют наличие качественных характеристик, свидетельствующих об отсутствии изменений фенотипа клеток исследуемой клеточной культуры в процессе культивирования.
6. Способ по п.1, отличающийся тем, что в качестве живых клеток с известными качественными характеристиками используют первичную культуру клеток.
7. Способ по п.1, отличающийся тем, что в качестве живых клеток с известными качественными характеристиками используют клетки, не претерпевшие изменений в фенотипе.
8. Способ по п.1, отличающийся тем, что отщепленные фрагменты поверхностных белков перед масс-спектрометрическим анализом дегликозилируют.
Текст
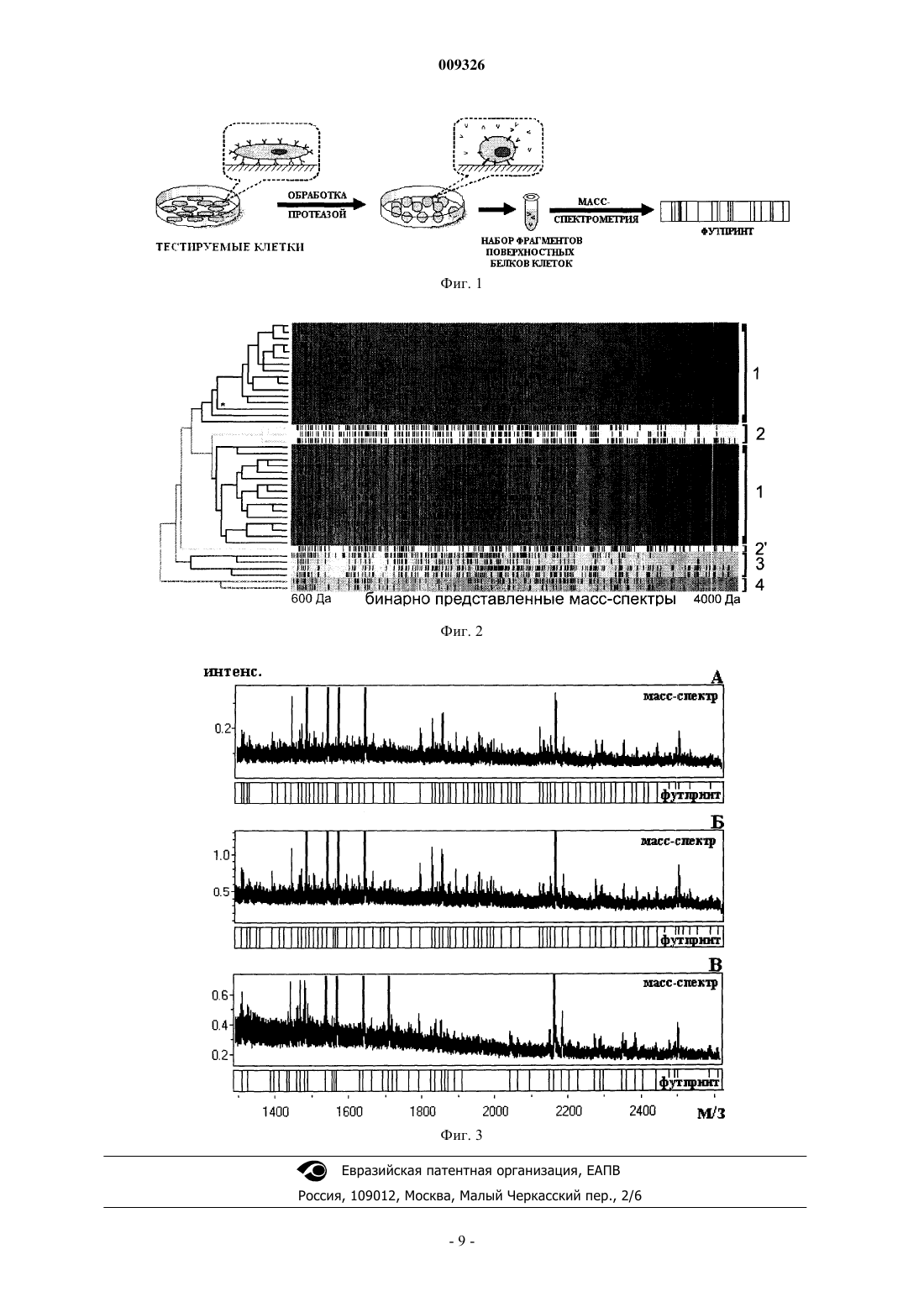
009326 Изобретение относится к области клеточных технологий, а именно к анализу культивируемых in vitro клеток и может быть использовано в биотехнологии, косметологии, медицине (клеточной трансплантологии), для получения охарактеризованного клеточного материала, обладающего лечебными или косметологическими свойствами. Проблема анализа клеточного материала, а именно контроля изменчивости, является актуальной задачей во всех областях, где применяются культивируемые клетки. Так, эксперименты на клеточных культурах являются неотъемлемой частью исследований в биологии и медицине. На клеточных моделях исследуют такие биологические процессы, как апоптоз, дифференцировка, онкологическая трансформация клеток, изучают многие аспекты метаболизма, выявляют механизмы действия лекарств и т.д. Последние достижения клеточных технологий позволяют использовать культивируемые клетки в качестве лекарственных препаратов, перспективных, по мнению многих ученых, в лечении многих ранее неизлечимых болезней (Terskikh A.V. et al., "Mammalian stem cells", Pediatr. Res., 2006, v. 59, 13-20). Однако фенотип культивируемых клеток изменчив. Перенос клеток из физиологичных условий invivo в культуральные флаконы приводит к стрессу клеток и существенной перестройке их метаболизма. Причина тому - невозможность воссоздания "в пробирке" естественной для клеток среды обитанияin human fibroblasts", Crit. Rev. Eukaryotic Gene Expression, 1998, v. 8, 43- 80); активации лизосомальных гидролаз (Bayreuther K. et al., "Human skin fibroblasts in vitro differentiateused for the passaging of adherent cultured cells", Toxicol. Lett., 2000, v. 115, 153-163); потере в процессе культивирования экстрацеллюлярных белков и деградации рецепторного аппарата (Huggins J.W. et al., "Molecular changes in cell surface membranes resulting from trypsinization of sarcoma 180 tumor cells", Biochim. Biophys. Acta, 1976, v. 426, 630-637); повышению в клетках с каждым пассированием активности теломеразы и укорочению теломеров(Hayflick L., Moorhead P.S., "The serial cultivation of human diploid cell strains", Exp. Cell Res., 1961, v. 25,585-621); потере комплекса гистосовместимости (Collins T. et al., "Loss of HLA in culture", Proc. Natl. Acad.antigens and their loss on culture in renal carcinoma", Eur. J. Cancer, 1993, v. 29, 2158-2160). Таким образом, in vitro клетки подвержены морфофункциональной дегенерации, ведущей к их гибели. Более того, действующие in vitro дестабилизирующие условия и естественный отбор клеточного материала приводят к возникновению спектра отличающихся друг от друга популяций клеток. В медицинских клеточных технологиях вопрос изменчивости клеточных культур стоит наиболее остро. Возьмем, к примеру, создание противоопухолевых вакцин на основе культивируемых опухолевых клеток пациента. При культивировании существенно искажается антигенный фенотип клеток (Angus R.,et al., "Expression of major histocompatibility complex (MHC) antigens and their loss on culture in renal carcinoma",Eur. J. Cancer, 1993, v. 29, 2158-2160; Nanchahal J. et al., "Cultured composite skin grafts: biological skinequivalents permitting massive expansion", Lancet, 1989, v. 22, 191-193), что ведет к несовпадению антигенов вакцины и опухоли. Вероятно, именно с этим связан тот факт, что в большинстве проведенных в последнее десятилетие рандомизированных исследований таких вакцин не было получено очевидной противоопухолевой активности (Fisher R.I. et al., "Adjuvant immunotherapy or chemotherapy for malignant melanoma",Preliminary report of the National Cancer Institute randomized clinical trial. Surg. Clin. North Am., 1981, v. 61,1267-1277; Mitchell M.S., "Perspective on allogeneic melanoma lysates in active specific immunotherapy",Semin. Oncol., 1998, v. 25, 623-635).He менее актуален вопрос изменчивости клеток при использовании клеточных трансплантатов, полученных путем размножения клеток самого пациента. В частности, известны способы лечения аутологичными фибробластами (см., например, "Биотрансплантат и способ коррекции дефектов мягких тканей,способ получения биотрансплантата", заявка: 2005127087/15, опубл. 20.08.2006, МПК А 61K35/36; А 61K35/36, а также WO9840027, опубл. 17.09.1998, МПК A61F2/10; A61L27/24; A61L27/38; C12N5/00;US5660850, опубл. 26.08.1997, МПК C12N5/06; A61F2/00). Изменение в процессе культивирования анти-1 009326 генов (Collins T. et al., "Loss of HLA in culture", Proc. Natl. Acad. Sci. USA, 1986, v. 83, 446-450) или, например, утрата возможности пролиферировать (Hayflick L., Moorhead P.S., "The serial cultivation of humandiploid cell strains", Exp. Cell Res., 1961, v. 25, 585-621) делает подобные биотрансплантанты бессмысленными, а, возможно, и вредными. Таким образом, культивированные клетки, используемые в медицинских и косметологических препаратах, должны в обязательном порядке подвергаться качественному анализу. Сегодня к оценке качества культивируемых клеток относят способы, направленные на выявление контаминаций, определение количества живых клеток, их тканевой принадлежности, выявление кроссконтаминаций (загрязнение клетками другого вида), а также абсолютную их идентификацию. Существуют различные методы обнаружения контаминаций клеточных препаратов микоплазмой,грибами и вирусами. Данные способы позволяют характеризовать качество клеточного препарата, но не характеризуют качество самих клеток препарата. Существуют различные методы оценки качества культуры, основанные на исключении красителя живыми клетками, эффективности клонирования и пролиферации в массовой культуре (Хэй P. "Сохранение и оценка качества клеток", в кн.: "Культура животных клеток", под ред. З. Фрешни, M.: Мир, 1989,с. 108-164). Данные методы позволяют только определять процент живых клеток в клеточном препарате и их жизнеспособность, но не дают представления о качественных (специальных) характеристиках самих клеток. Известны различные способы определения тканевой принадлежности клеточных линий, а именно основанные на тонком структурном анализе клеток с помощью электронного микроскопа; иммунологическом тесте белков цитоскелета (Ramaekers F.С.S. et al., Cold Spring Harbor Symp. Quant. Biol., 1982, v. 46,331); выявлении тканеспецифических антигенов (Nijweide P.J. and Mulder R.J.P., "Identification of osteocytesin osteoblast-like cell cultures using a monoclonal antibody specifically directed against osteocytes", 1986, v. 84,342-347); биохимическом тестировании специфических функций клеток (применим для клеток со специфическими функциями, см., например, Hay R.J. et al., "American Type Culture Collection Catalogue I I", 4thedn., 1983, Rockville, MD, p. 12), количественной оценке иммунологических продуктов (применим для идентификации гибридом). Недостатком тестов на тканеспецифичность при оценке клеточных препаратов является невозможность определить источник клеток. В частности, фибробласты, применяемые в клеточных препаратах,могут быть как фетального (эмбрионального) происхождения, так и выделенными из тканей взрослого человека, например из кожи или жировой клетчатки (адипогенные фибробласты). Таким образом, фибробласты, полученные из различных источников, хоть и относятся к одному типу ткани, обладают различными полезными качествами. В настоящее время известно несколько способов выявления кроссконтаминаций и идентификации клеточных культур. Известен метод непрямой окраски клеток флуоресцентно-мечеными антителами. Данный способ позволяет верифицировать культуру клеток, определить кроссконтаминацию, установить изменчивость по определенным антигенам (Stulberg C.S. in: "Contamination in Tissure Culture", Fogh J. (ed.), AcademicPress, 1973, London and New York, p. 1). Недостатком данного способа является необходимость предварительного получения видоспецифических антител для конкретной культуры, которые получают путем иммунизации животного тестируемыми клетками. Метод не может характеризовать утрату полезных свойств клетками в процессе культивирования. Известен метод, основанный на анализе изоферментного состава. Показано, что определение изоформ семи ферментов с помощью электрофореза достоверно позволяет определить принадлежность клеток человеку (O'Brien S.J. et al., "Enzyme polymorphisms as genetic signatures in human cell cultures", Science,1977, v. 195, 1345-1348). Недостатком данного метода является длительность его исполнения (электрофорез идет 16-18 ч) и применимость только для выявления межвидовых кроссконтаминаций. Метод не может характеризовать утрату полезных свойств клетками в процессе культивирования. Известен цитогенетический (кариологический) способ оценки наличия примесей других типов клеток в культуре. Метод основан на том, что хромосомные наборы могут значительно отличаться у клеток разных видов, что можно обнаружить с помощью микроскопа. Однако при наличии загрязнения клетками близкородственного вида анализ резко усложняется (применяется G-сегментирование, см., например,Seabright M., "A rapid banding technique for human chromosomes", Lancet, 1971, v.2, 971-972). Метод позволяет выявлять только межвидовую кроссконтаминацию и не может установить утрату полезных свойств клетками в процессе культивирования. Известен иммунологический тест на антигены группы крови (Hay R.J. In: "Markers of Colonic Celltumor cell lines", J. Natl. Cancer Inst., 1981, v. 66, 1003-1012). Недостатком данного метода является частичное или полное отсутствие экспрессии этих антигенов у некоторых клеточных культур. Известно использование полимеразной цепной реакции и ДНК секвенирования (Liu M.Y. et al.,"Identification and authentication of animal cell culture by polymerase chain reaction amplification and DNAidentification and confirmation of human and animal cell lines: a PCR-based method", Biotechniques, 2002, v. 32,432-434, 436, 438-440). Недостатком метода является применимость к клеточным линиям неблизкородственных видов, а также длительность исполнения, т.к. он требует проведение электрофореза. Метод не может характеризовать утрату полезных свойств клетками в процессе культивирования. Известен ДНК фингерпринтинг (см., например, US2005123947, опубл. 09.06.2005; WO2005116257,опубл. 08.12.2005; US2006035261, опубл. 16.02.2006). ДНК фрагментируется рестриктазой, и полученные фрагменты ДНК отличаются по размеру и в совокупности формируют уникальный профиль, позволяющий идентифицировать источник происхождения ДНК. Подобный подход широко используется для идентификации клеточного материала. Для ДНК фингерпринтинга наиболее широко используют полиморфизм длины фрагментов рестрикции (RFLP) (см., например, Kanter E. et al., "Analysis of restrictionSci, 1986, v. 31, 403-408), вариабельные нуклеотидные тандемные повторы (VNTRS) (Budowle B. et al.,"Analysis of the VNTR locus D1S80 by the PCR followed by high-resolution PAGE", Am. J. Hum. Genet.,1991, v. 48, 137-144) или микросателлиты (Jeffreys A.J. et al., "Hypervariable 'minisatellite' regions in humanDNA", Nature, 1985, v. 314, 67-73). За исключением монозиготных близнецов, подобный метод позволяет точно идентифицировать принадлежность клеточного материала индивидууму. Однако метод никак не характеризует изменение качества клеточной культуры в процессе культивирования. Известен двумерный белковый электрофорез, позволяющий выявить до 2 тысяч белков (Anderson N.G.,Anderson N.L., "Twenty years of two-dimensional electrophoresis: past, present and future", Electrophoresis,1996, v. 17, 443-453). Недостатком данного способа является сложность исполнения. Способ требует последовательного проведения двух электрофоретических разделений белков, в связи с чем не применяется в качестве рутинного метода для оценки качества культур клеток. Более того, двумерный белковый электрофорез не характеризует наиболее актуальную для клеточной терапии фракцию поверхностных антигенов клеток, ввиду того, что данным способом не анализируют мембранные белки. Известно применение масс-спектрометрии для идентификации клеточных культур (Zhang X. et al.,"Identification of Mammalian Cell Lines Using MALDI-TOF and LC-ESI-MS/MS Mass Spectrometry", J. Am.Soc. Mass Spectrom., 2006, v. 17, 490-499). Быстрый и относительно простой метод профилирования белков клеток описан для клеток млекопитающих при непосредственном анализе времяпролетной (MALDITOF) и других видов масс-спектрометрии. Используя MALDI масс-спектры как уникальный фингерпринт, можно дифференцировать клеточные линии млекопитающих. Недостатком данного подхода является низкая специфичность, обуславливаемая присутствием в анализируемой пробе множества цитозольных (внутриклеточных) белков, чьи фрагменты, как правило, в массе своей не специфичны для типов клеток, засоряют масс-спектры и не позволяют провести чувствительный анализ и охарактеризовать клетки по наиболее актуальным для клеточной трансплантологии мембранным белкам. Из патента WO2006115426 ("Способ регулирования биохимических процессов и устройство для его осуществления", опубл. 02.11.2006, МПК G01R23/16; С 12 М 3/00; С 12N1/00) известен способ оценки качества культивирования клеточных культур на основе регистрации временных интервалов состояний клеток "рост-размножение" и "накопление-мутация", в котором границы интервалов определяются радиосигналами в среднечастотном и низкочастотном диапазонах. Недостатком данного способа является необходимость применения специального оборудования, а также возможность определения параметров только в результате постоянного мониторирования роста клеток, что не применимо к оценке качества готовых клеточных препаратов. Известен способ оценки свойств культуры клеток нейронов (см. патент US2004106101, опубл. 03.06.2004, МПК G01N33/487; G06Q10/00; G01N33/487) на основе измерения электрической активности клеток путем выращивания их на микроэлектродном чипе. Данный способ относится только к культуре нейронных клеток и не распространяется на другие клеточные культуры. Также известен способ сертификации культуры клеток хондроцитов (см. патент WO02095399, опубл. 28.11.2002, МПК C12Q1/42;G01N33/50; G01N33/68). Недостатком данного способа является применимость его только в регенеративной терапии хрящевых тканей. Известен способ определения качества клеточной культуры, включающий масс-спектрометрический анализ органических молекул клеток. Известный способ предусматривает применение масс-спектрометров, измеряющих массы молекул с высокой точностью за счет применения ионно-циклотронного резонанса, что позволяет увеличивать количество информации, получаемой с проб клеток (US6974702,опубл. 02.06.2005, МПК G01N27/62; G01N33/15; G01N33/483). Недостатком данного метода является, с одной стороны, загрязненность получаемых спектров неинформативными цитозольными белками и другими биополимерами, т.к. для анализа используют целые клетки, и, во вторых, использование определенного и дорогостоящего масс-спектрометра, позволяющего с высокой точностью определять массы молекул. В связи с этим данный подход не получил распространение в качестве рутинного метода анализа качества культур. Наиболее близким аналогом заявленного изобретения является способ, основанный на масс-спект-3 009326 рометрическом анализе именно поверхностных белков клеток, раскрытый в патенте "Preparation ofC07K16/28), в котором описан способ определения качества клеточной культуры, включающий массспектрометрический анализ предварительного выделенных мембранных белков. Недостатком данного способа является необходимость использования специфичных для мембранных белков антител или их антигенсвязывающих фрагментов для формирования комплексов с белками мембраны для последующего их выделения и очистки. Подобная многостадийность не позволяет применять данный подход в качестве рутинного метода анализа качества культивируемых клеток. В настоящем изобретении была поставлена задача разработки нового способа определения качества клеточной культуры, ориентированного на анализ клеточных препаратов, отличительными чертами которого являются быстрота исполнения (не более 2 ч), что позволит использовать его для оценки качества готовых клеточных препаратов перед их применением, учитывая малый срок их годности с момента изготовления(несколько часов); чувствительность, позволяющая определять потерю качества клетками в процессе культивирования; чувствительность, позволяющая дифференцировать морфофункционально идентичные клетки от одного донора, но обладающие при применении различными полезными свойствами; ориентация на анализ поверхностных белков клеток, определение сохранности которых в процессе культивирования наиболее актуально; интегрируемость в культивирование клеток, что подразумевает отсутствие специального оборудования и сложных манипуляций для подготовки проб для анализа; относительная дешевизна, чтобы цена анализа была несопоставимо меньше стоимости клеточного препарата; минимальное или отсутствие потребления клеток, что позволит многократно проводить анализ культивируемых клеток без их расхода; возможность численного выражения результатов анализа, что необходимо для реализации стандарта GMP, исключающего человеческий фактор при проведении оценки качества культуры клеток. Технический результат, достигаемый при использовании патентуемого изобретения, заключается в повышении объективности (точности) идентификации культивируемых in vitro клеток для отбора качественных (с ожидаемыми полезными свойствами) клеток при снижении временных и материальных затрат. Указанный технический результат обеспечивается при реализации способа определения качества клеточной культуры, включающего масс-спектрометрический анализ поверхностных клеточных белков. Согласно настоящему изобретению предварительно промытые живые клетки исследуемой клеточной культуры подвергают витальному воздействию протеазы, отбирают отщепленные фрагменты поверхностных белков и масс-спектрометрически определяют их массы, контролируют наличие качественных характеристик у исследуемой культуры клеток путем сравнения совокупности полученных масс с совокупностью масс-спектрометрически определенных масс фрагментов поверхностных белков живых клеток с известными качественными характеристиками. В предпочтительном варианте реализации изобретения в качестве протеазы используют трипсин. Для идентификации отношения клеточной культуры к определенной группе клеточных препаратов с полезными свойствами контролируют наличие качественных характеристик, определяющих источник клеток. В предпочтительном варианте реализации изобретения контролируют наличие качественных характеристик, определяющих пригодность для проведения противоопухолевой иммунотерапии. Для установления сохранности полезных свойств клетками контролируют наличие качественных характеристик, свидетельствующих об отсутствии изменений фенотипа клеток исследуемой клеточной культуры в процессе культивирования. В качестве живых клеток с известными качественными характеристиками может быть использована первичная культура клеток. В качестве живых клеток с известными качественными характеристиками могут быть использованы клетки, не претерпевшие изменений в фенотипе в процессе хранения и культивирования. Отщепленные фрагменты поверхностных белков перед масс-спектрометрическим анализом могут быть дегликозилированы. Обработка первичной культуры клеток витальным воздействием трипсина приводит к отщеплению с поверхности клеток фрагментов белков, состав которых специфичен для конкретных культур клеток. Таким образом, согласно данному изобретению действие трипсина, как и других протеаз, приводит к высвобождению в раствор специфичных для культивируемых клеток фрагментов поверхностных белков,совокупность измеренных масс которых является характеристической для культуры клеток. Для подобных характеризующих культивируемые клетки совокупностей масс был введен термин протеомный футпринт (белковый отпечаток). Клетки при обработке витальным воздействием протеазы не погибают, что дает возможность избежать загрязнения анализируемых проб мажорными белками цитоплазмы клетки и избежать расхода кле-4 009326 точного материала при анализе. Далее изобретение поясняется конкретными примерами реализации изобретения и прилагаемыми фигурами, на которых изображено следующее: на фиг. 1 - схема получения согласно данному изобретению протеомного футпринта культивируемых клеток; на фиг. 2 - протеомные футпринты фибробластов из различных тканей человека, классифицированные иерархическим кластерным анализом; на фиг. 3 - масс-спектр фрагментов поверхностных белков и соответствующий ему футпринт, полученный согласно второму примеру реализации изобретения со свежеинициированной первичной культуры опухолевых клеток человека (3 А); масс-спектр фрагментов поверхностных белков и соответствующий ему футпринт, полученный с той же культуры клеток после непродолжительного их культивирования (3 Б); масс-спектр и соответствующий ему футпринт полученный с той же культуры клеток после более длительного культивирования клеток (3B). Пример 1. На фибробластах человека. Морфологически все типы фибробластов практически идентичны (имеют веретенообразную форму). Однако фибробласты, полученные из различных источников, существенно отличаются по своим свойствам и, соответственно, имеют различные показания к применению в клеточной терапии. В частности, фибробласты, полученные из жировой ткани человека, отличаются плюрипатентностью подобно стволовым клеткам (см., например, Zuk P.A. et al., "Human adipose tissue is a source of multipotentstem cells", Mol. Biol. Cell., 2002, v. 13, 4279-4295). Фибробласты кожи человека обладают слабым потенциалом к размножению, но пригодны для мезотерапии большими дозами размноженных клеток самого пациента. Эмбриональные фибробласты кожи человека обладают хорошим потенциалом к размножению и пригодны для аллогенной клеточной трансплантации (Сухих Г.Т., "Трансплантация фетальных клеток в медицине: настоящее и будущее", Бюлл. Эксп. Биол. Мед., 1998, 126, прил. 1, 3-13). Фибробласты дермального сосочка волосяного фолликула обладают трихогенными свойствами и могут использоваться в клеточной терапии алопеций (см., например, патент "Биотрансплантант, способ его получения (варианты) и способ лечения алопеции", заявка: 2004125092/15, опубл. 18.08.2004). Ниже приведен пример определения согласно данному изобретению качественных характеристик тестируемой культуры фибробластов путем установления идентичности ее протеомного футпринта полученным аналогичным образом футпринтам культур фибробластов известного происхождения и с установленными полезными свойствами. Сорок две первичные культуры кожных, адипогенных, фетальных фибробластов и фибробластов дермального сосочка волосяного фолликула получали из соответствующих источников согласно описанным ранее методикам. Первичные культуры кожных фибробластов получали согласно методике Rittie иFisher ("Isolation and culture of skin fibroblasts", Methods Mol. Med., 2005, v. 117, 83-98). Первичные культуры адипогенных фибробластов получали согласно методике Zuk и соавт. ("Multilineage cells from humanadipose tissue: implications for cell-based therapies", Tissue Eng., 2001, v. 7, 211-288). Первичные культуры фибробластов дермального сосочка волосяного фолликула получали согласно методике Zhong-fa и соавт.("Biological characterization of cultured dermal papilla cells and hair follicle regeneration in vitro and in vivo",Chinese Medical Journal, 2006, v. 119, 275-281). Первичные культуры фетальных фибробластов человека получали из абортивного материала согласно методике Salvatori и соавт. ("Retroviral vector-mediated genetransfer into human primary myogenic cells leads to expression in muscle fibers in vivo", Hum. Gene Ther.,1993, v. 4, 713-723). Культивирование первичных культур проводили в идентичных условиях (ростовая среда ДМЕМ, 5% СО 2, 37C, 10% фетальной бычьей сыворотки). На 20-25 день после инициации культур делали стерильный клеточный препарат (1 млн фибробластов в 1 мл физиологического раствора), который анализировали по следующему протоколу. 1. Клеточный препарат, содержащий тестируемые фибробласты, в стерильных условиях выливают в культуральный флакон. Во флакон доливают ростовой среды (ДМЕМ с 10% фетальной бычьей сыворотки) и инкубируют при 37C в СО 2-инкубаторе в течение 30-45 мин. 2. Удаляют ростовую среду из флакона и трижды промывают прикрепившиеся ко дну флакона клетки стерильным физиологическим раствором, используя объем, равный половине ростовой среды. 3. Добавляют к клеткам 0,0001% раствор трипсина, используя 1 мл раствора на 25 см поверхности культурального флакона. 4. Инкубируют флакон при 37C. Между 5-й и 7-й минутами инкубации отбирают из флакона раствор трипсина, содержащий отщепленные от клеток фрагменты белков. 5. Раствор трипсина, отобранный от клеток, используют для масс-спектрометрического определения совокупности масс фрагментов поверхностных белков, соответствующей анализируемым клеткам. 6. Измеренную совокупность масс фрагментов поверхностных белков анализируемых клеток сравнивают с полученной аналогичным способом совокупностью масс фрагментов поверхностных белков клеточных культур с известными качественными характеристиками. Масс-спектрометрический анализ проводят следующим образом. Пробы, полученные в процессе-5 009326 инкубации клеток с трипсином (см. п.4 протокола), обессоливают, применяя наконечники для автоматических пипеток с обращенной фазой ZipTipC18 (Millipore Corp., США), в соответствии с протоколом производителя. Массы пептидных фрагментов, содержащиеся в пробе, измеряют методом времяпролетной(MALDI-TOF) масс-спектрометрии. 2 мкл обессоленного раствора смешивают на масс-спектрометрической мишени в соотношении 1:1 с насыщенным раствором -циано-4-гидроксисинаминовой кислоты,содержащей 50% ацетонитрила и 0,5% трифторуксусной кислоты. Полученные на мишени капли проб высушивают на воздухе и проводят масс-спектрометрический анализ в диапазоне масс пептидов от 600 до 4000 Да. Полученные масс-спектры, соответствующие разным клеточным линиям, предварительно обрабатывают для последующей классификации иерархическим кластерным анализом. Список масс пептидов переводят в бинарный код ("1"- есть определенная масса пептида в спектре и, соответственно, "0"- отсутствие массы пептида), генерируя таким образом протеомный футпринт клеточной культуры. Классификацию (разбиение на группы) футпринтов проводят кластеризацией по методу Варда с использованием квадратов евклидовых расстояний для расчета матрицы дистанций. Из фиг. 2 видно, что футпринты 42 препаратов фибробластов из различных источников, таких как дермального сосочка волосяного фолликула, жировой клетчатки, кожи предплечья взрослого человека и фетальной кожи, четко классифицируются по четырем группам соответственно происхождению фибробластов (1, 2, 3 и 4 группы на фиг. 2, соответственно). Таким образом, имея тестируемый клеточный препарат фибробластов, можно точно установить его происхождение по принадлежности его футпринта к тому или иному кластеру. К примеру, если тестируемому клеточному препарату соответствует отмеченный звездочкойна фиг. 2 футпринт, то достоверно можно утверждать, что фибробласты тестируемого препарата были выделены из дермального сосочка волосяного фолликула, размножены соответствующим образом и в процессе культивирования не были утрачены качественные характеристики, позволяющие отнести данные фибробласты к фибробластам с трихогенными свойствами. В случае, если тестируемая культура клеток не будет принадлежать ни одному из кластеров (см.,например, футпринт адипогенных фибробластов в кластере 2' на фиг. 2), можно утверждать, что клетки не принадлежат ни одному из определяемых источников, либо в процессе культивирования их фенотип изменился и ассоциировать их с качественными клеточными препаратами установленного происхождения и с известными свойствами уже нельзя. Из приведенного примера видно, что совокупность (набор) молекулярных масс фрагментов поверхностных белков, т.н. протеомный футпринт, является своеобразным "штрих-кодом", характеризующим клетки на предмет отношения к фибробластам с определенными, представляющими интерес для клеточной терапии, свойствами. Следует отметить, что забор раствора трипсина, содержащего отщепленные от клеток фрагменты поверхностных белков, желательно осуществлять до момента открепления клеток от дна культурального флакона под воздействием трипсина, что позволит предотвратить попадание клеток в пробу и избежать дополнительной стадии очистки пробы. Условия обработки протеазой клеток определяют экспериментально для каждого типа клеток и активности используемой протеазы, и они могут существенно варьировать от 0,00001 до 0,05% для концентрации протеазы и от 30 с до 10 мин для времени обработки клеток. В случае использования трипсина с другой активностью концентрация его меняется прямо пропорционально увеличению или уменьшению активности. В других вариантах реализации изобретения используют любой другой вариант масс-спектрометрии. Раствор трипсина можно готовить как на стерильном физиологическом растворе, так и на любом подходящем для этого солевом или буферном растворе. Вместо трипсина могут быть использованы другие протеазы, например химотрипсин, протеиназа K и т.д. Отщепленные фрагменты поверхностных белков могут перед масс-спектрометрическим анализом быть дегликозилированы, например, проназой. Вместо трипсина может быть использована комбинация протеаз. В случае использования суспензионной культуры клеток необходимо перед забором пробы клетки осадить на дно, например, центрифугированием или использовать любой другой подходящий способ для удаления клеток из тестируемой пробы. Обессоливание и концентрирование пептидов пробы для масс-спектрометрического анализа можно осуществлять любым подходящим для этого способом. В других вариантах реализации изобретения, если применяемый протокол масс-спектрометрического анализа не требует обессоливания и/или концентрирования анализируемой пробы, содержащей фрагменты поверхностных белков, обессоливание и/или концентрирование не проводится. В случае использования трипсина для снятия клеток прикрепленной культуры с подложки при получении клеточного препарата необходимо перед анализом провести дополнительное инкубирование клеток в соответствующих условиях 18-20 ч для репарации клетками поверхностных белков. В других вариантах реализации изобретения используют для формирования характеристической-6 009326 совокупности масс не появление той или иной массы фрагмента поверхностного белка, а изменение его интенсивности в масс-спектре, что соответствует изменению его концентрации в анализируемой пробе. В других вариантах реализации изобретения используется любая подходящая математическая обработка измеренных масс белковых фрагментов, позволяющая корректно классифицировать клеточный материал по интересующим свойствам, к примеру, применив регрессионный анализ, k-means кластеризацию, нейросети, PCA, SVM, SOM и т.д., а также их комбинации. Патентуемый способ может применяться к любым типам клеточных препаратов, в частности к суспензии клеток, смешанным культурам, органотипным культурам и клеточным агрегатам (гранулы, сфероиды), а также к свежевыделенным клеткам и тканевым фрагментам. Пример 2. На опухолевых клетках человека. Далее изобретение поясняется вторым примером оценки качества культуры опухолевых клеток рака толстого кишечника человека на предмет пригодности использования их для противоопухолевой вакцинации. Выделенные из опухоли больного, культивируемые и впоследствии используемые для противоопухолевой вакцинации клетки должны быть идентичны опухолевым клеткам больного. Однако культивирование клеток существенно искажает фенотип первичной культуры по причине невозможности искусственного воссоздания in vitro условий, при которых опухолевые клетки росли в организме больного. Таким образом, качество используемых для вакцинации культивированных опухолевых клеток подлежит обязательному контролю и выражается в степени их соответствия клеткам опухоли больного. Протокол установления подобного соответствия представлен ниже. 1. Из флакона с культивируемыми опухолевыми клетками удаляют ростовую среду и трижды промывают клетки 0,9% раствором хлорида натрия или фосфатным буфером силана, используя каждый раз объем, равный не менее половины объема заливаемой в культуральный флакон ростовой среды. В результате промывки клеток должны быть удалены следы сыворотки, содержащейся в ростовой среде. 2. К клеткам добавляют 0,0001% раствор трипсина (активность 3000 Ед/мг), используя 1 мл раствора на 25 см 2 поверхности культурального флакона. 3. Инкубируют флакон при 37C. Между 5-й и 7-й минутами инкубации отбирают из флакона раствор, содержащий отщепленные от клеток фрагменты поверхностных белков. Опухолевые клетки в момент отбора раствора должны быть прикреплены к дну культурального флакона. Если под воздействием трипсина часть клеток открепилась и стала свободно плавать, то ростовую среду надо отцентрифугировать при 400 g в течение 5 мин и использовать супернатант, свободный от примеси клеток. 4. Для инактивации остатков трипсина в культуральном флаконе добавляют свежеприготовленную культуральную среду, содержащую фетальную бычью сыворотку, и продолжают культивирование клеток при 37C и 5% CO2. 5. Раствор, полученный в п.3, анализируют масс-спектрометрически и сравнивают со спектром, полученным аналогичным образом (пп.1-4), но ранее для свежевыделенных опухолевых клеток. Масс-спектрометрический анализ проводят по протоколу масс-спектрометрии гликозилированных пептидов (Tajiri M. et al., "Differential analysis of site-specific glycans on plasma and cellular fibronectins:application of a hydrophilic affinity method for glycopeptide enrichment", Glycobiology, 2005, v. 15, 13321340). Это объясняется, с одной стороны, тем, что внеклеточные фрагменты белков, как правило, гликозилированы, с другой стороны, именно гликозилированные фрагменты поверхностных белков опухолевых клеток наиболее иммуногенны и являются вероятными антигенами вакцины (см., например, Franco A.,"CTL-Based Cancer Preventive/Therapeutic Vaccines for Carcinomas: Role of Tumour-Associated CarbohydrateAntigens", Scand. J. Immunol., 2005, v. 61, 391-397). 140 мкл анализируемого раствора фрагментов поверхностных белков смешивают со 140 мкл этанола, 720 мкл бутанола и добавляют 15 мкл сефарозы CL4B. Инкубируют при медленном перемешивании 45 мин. После инкубации сефарозу дважды промывают раствором с тем же содержанием спирта и бутанола и инкубируют 30 мин в 50% растворе этанола. Раствор этанола отбирают от сефарозы и высушивают на роторном испарителе. Полученный осадок растворяют в 10 мкл воды и анализируют времяпролетной (MALDI-TOF) масс-спектрометрией. 2 мкл анализируемого раствора смешивают на масс-спектрометрической мишени в соотношении 1:1 с насыщенным раствором 2,5-дигидроксибензойной кислоты,содержащей 50% ацетонитрила и 0,5% трифторуксусной кислоты. Полученные на мишени капли проб высушивают на воздухе и проводят масс-спектрометрический анализ в диапазоне масс пептидов от 1000 до 4000 Да. Согласно полученным данным при повторном (контрольном) масс-спектрометрическом анализе культуры клеток воспроизводится не менее 95 мас.% фрагментов белков, что можно считать критерием идентичности двух сравниваемых клеточных препаратов. Предлагается оценивать пригодность клеточного препарата для вакцинации больного на основе идентичности не менее 90% общих масс фрагментов белков у анализируемых клеток и свежевыделенных опухолевых клеток донора. На фиг. 3 А показаны времяпролетный спектр белковых фрагментов и соответствующий футпринт,полученные согласно второму варианту реализации изобретения со свежевыделенных опухолевых кле-7 009326 ток рака толстого кишечника человека. На фиг. 3 Б показаны масс-спектр и соответствующий футпринт тех же самых клеток, размноженных культивированием (1-й пассаж) и пригодных для противоопухолевой вакцинации. Снятый с них спектр идентичен исходному спектру, полученному со свежевыделенных опухолевых клеток. На фиг. 3 В представлен масс-спектр тех же самых клеток, размноженных культивированием (2-й пассаж), но уже не пригодных для противоопухолевой вакцинации. В процессе культивирования произошли существенные изменения в поверхностных белках клеток (см., например, область 1800-2000 Да футпринта на фиг. 3 В), что позволило считать их неидентичными клеткам исходной опухоли донора. В случае использования протеазы для диссоциации ткани опухоли с целью высвобождения опухолевых клеток необходимо проводить масс-спектрометрический анализ для получения образца футпринта исходной (неизмененной) культуры клеток не раньше чем через сутки после инициации опухолевой культуры, чтобы клетки успели восстановить поврежденные при выделении поверхностные белки. Совокупность масс фрагментов поверхностных белков является своеобразным "штрих-кодом", т.е. показателем, наиболее объективно характеризующим клетки. Поэтому контроль наличия качественных характеристик у исследуемой клеточной культуры путем сравнения совокупности полученных масс фрагментов поверхностных белков ее клеток с совокупностью масс-спектрометрически определенных масс фрагментов поверхностных белков живых клеток с известными качественными характеристиками дает возможность наиболее точно произвести отбор качественных (с ожидаемыми полезными свойствами) клеток. Применение при реализации способа масс-спектрометрического анализа позволяет определять качество клеточной культуры достаточно быстро - в течение не более 2 ч. Это позволит использовать его для оценки качества готовых клеточных препаратов перед их применением, учитывая малый срок их годности с момента изготовления (несколько часов). Кроме этого, полученные масс-спектры могут быть преобразованы с возможностью численного выражения результатов анализа, что необходимо для реализации стандарта GMP, исключающего человеческий фактор при проведении оценки качества культуры клеток, и позволит обеспечить необходимую объективность результатов. Точность определения наличия качественных характеристик у исследуемой культуры клеток при реализации патентуемого способа обеспечивается также за счет использования живых клеток исследуемой клеточной культуры, которые подвергают витальному воздействию протеазы. Клетки при обработке витальным воздействием протеазы не погибают, что дает возможность избежать загрязнения анализируемых проб мажорными белками цитоплазмы клетки и значительно уменьшить расход клеточного материала при анализе культуры клеток. Загрязнения анализируемых проб позволяет избежать также предварительная промывка клеток, которая необходима для удаления следов сыворотки, содержащейся в ростовой среде. Таким образом, патентуемый способ позволяет охарактеризовать клетки по наиболее актуальным, в том числе и для клеточной трансплантологии, поверхностным белкам. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ определения качества клеточной культуры, включающий масс-спектрометрический анализ поверхностных клеточных белков, отличающийся тем, что предварительно промытые живые клетки исследуемой клеточной культуры подвергают витальному воздействию протеазы, отбирают отщепленные фрагменты поверхностных белков и масс-спектрометрически определяют их массы, контролируют наличие качественных характеристик у исследуемой культуры клеток путем сравнения совокупности полученных масс с совокупностью масс-спектрометрически определенных масс фрагментов поверхностных белков живых клеток с известными качественными характеристиками. 2. Способ по п.1, отличающийся тем, что в качестве протеазы используют трипсин. 3. Способ по п.1, отличающийся тем, что контролируют наличие качественных характеристик, определяющих источник клеток. 4. Способ по п.1, отличающийся тем, что контролируют наличие качественных характеристик, определяющих пригодность для проведения противоопухолевой иммунотерапии. 5. Способ по п.1, отличающийся тем, что контролируют наличие качественных характеристик, свидетельствующих об отсутствии изменений фенотипа клеток исследуемой клеточной культуры в процессе культивирования. 6. Способ по п.1, отличающийся тем, что в качестве живых клеток с известными качественными характеристиками используют первичную культуру клеток. 7. Способ по п.1, отличающийся тем, что в качестве живых клеток с известными качественными характеристиками используют клетки, не претерпевшие изменений в фенотипе. 8. Способ по п.1, отличающийся тем, что отщепленные фрагменты поверхностных белков перед масс-спектрометрическим анализом дегликозилируют.
МПК / Метки
МПК: G01N 30/72, C12Q 1/25
Метки: качества, культуры, определения, способ, клеточной
Код ссылки
<a href="https://eas.patents.su/10-9326-sposob-opredeleniya-kachestva-kletochnojj-kultury.html" rel="bookmark" title="База патентов Евразийского Союза">Способ определения качества клеточной культуры</a>