Способ и устройство для введения действующего вещества в виде аэрозоля в легкие пациента
Формула / Реферат
1. Способ введения действующего вещества в легкие пациента, предусматривающий введение действующего вещества в виде аэрозоля при сопротивлении потоку в начальный период времени ингаляции, составляющем от 0,4 до 2 (см H2O)1/2/SLM, соответствующем скорости потока 15 л/мин и менее.
2. Способ по п.1, отличающийся тем, что указанный начальный период времени составляет менее 10 с.
3. Способ по п.1 или 2, отличающийся тем, что сопротивление потоку по истечении указанного начального периода времени уменьшают до величин, соответствующих скорости потока от 15 до 80 л/мин.
4. Устройство для введения действующего вещества в легкие пациента в виде аэрозоля, отличающееся тем, что оно включает в себя модулятор сопротивления потоку аэрозольного состава действующего вещества, который выполнен с возможностью создания начального сопротивления потоку, составляющего от 0,4 до 2 (см H2O)1/2/SLM.
Текст
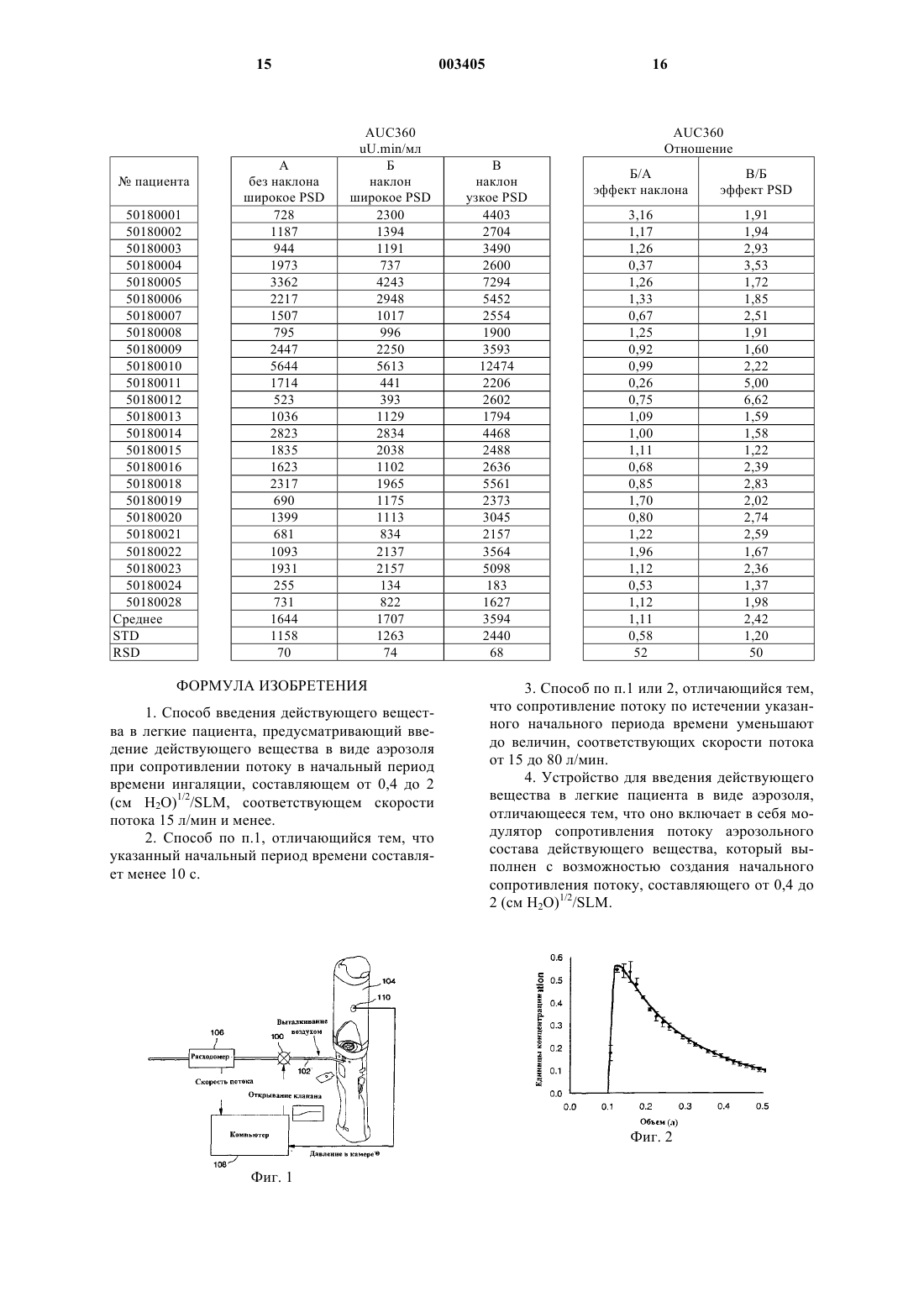
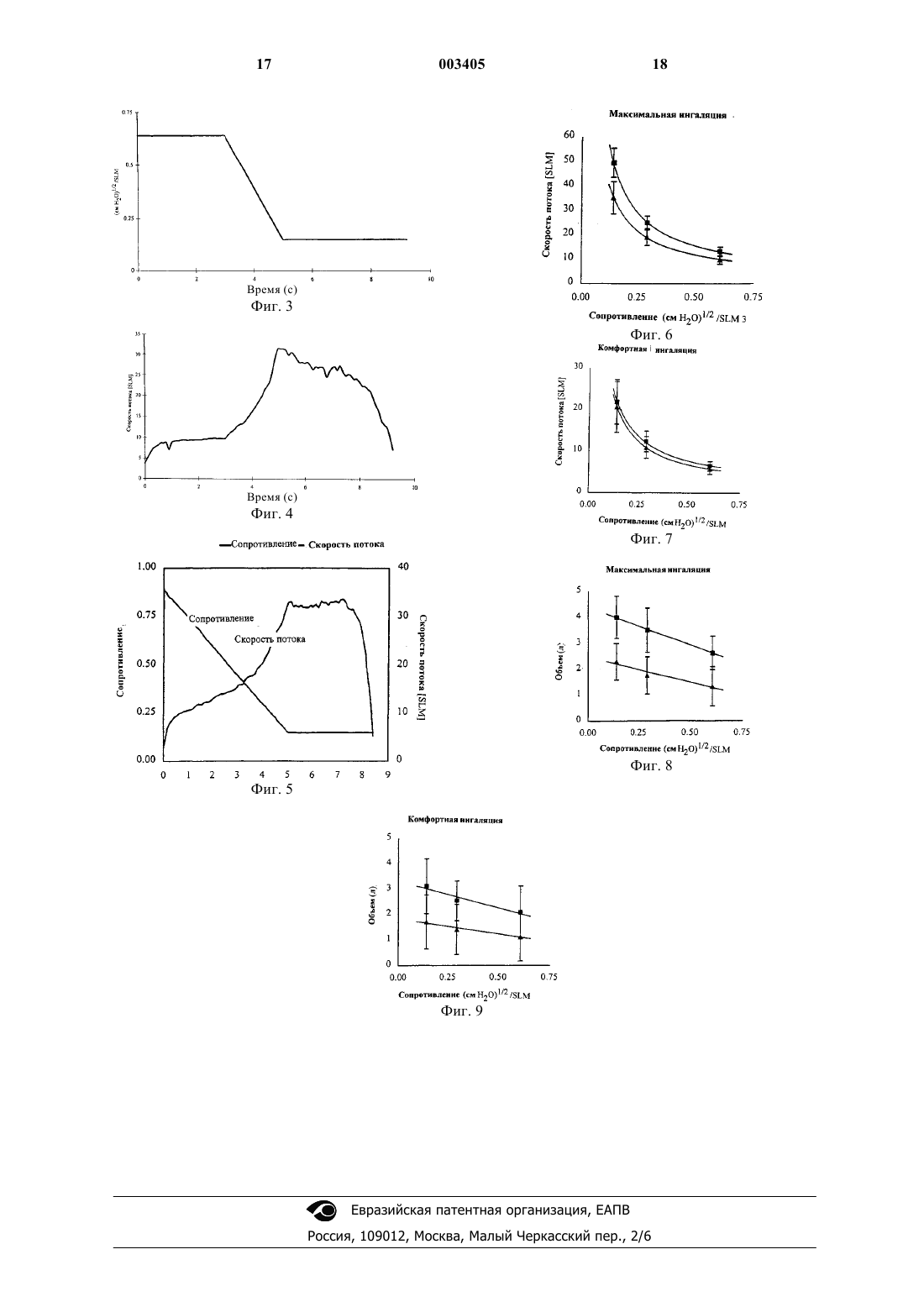
1 Настоящее изобретение имеет отношение к введению состава действующего вещества в легкие пациента, а более конкретно к способу и устройству для введению состава действующего вещества в легкие пациента, предназначенным для увеличения соматического бионакопления действующего вещества за счет поглощения в глубоких легких. Бионакопление увеличивают путем модулирования скорости потока действующего вещества таким образом, что оно не зависит от команд пациента и от текущего контроля скорости. Эффективное введение лекарственного средства пациенту является критическим аспектом любой успешной лекарственной терапии. Существуют различные пути введения лекарственного средства, каждый из которых имеет свои собственные преимущества и недостатки. Введение лекарственного средства перорально в виде таблеток, капсул, эликсиров и т.п. представляет собой, возможно, самый удобный способ введения, однако, многие лекарственные средства деградируют в пищеварительном тракте ранее момента их абсорбции (поглощения). Подкожные инъекции часто являются эффективным путем для соматического введения лекарственного средства, в том числе и для введения протеинов, однако, такой метод введения плохо переносится пациентами. Так как инъекции лекарственных средств, таких как инсулин,проводимые ежедневно или несколько раз в день, часто могут быть источником раздражения пациента, уже предложен целый ряд альтернативных путей введения лекарственных средств,в том числе трансдермальных, интраназальных,интраректальных, интравагинальных и легочных. Особый интерес представляет введение лекарственного средства в легкие пациента, основанное на вдыхании пациентом состава действующего вещества, таким образом, чтобы содержащееся в дисперсии действующее вещество могло достигать дистальных (альвеолярных) областей легких. Это может быть осуществлено с использованием устройства, приводимого в действие пациентом, в котором превращение в аэрозоль действующего вещества происходит за счет дыхательного потока, а также с использованием лекарственной дисперсии или аэрозольного устройства, в которых применен сжатый газ или газ-вытеснитель для аэрозолизации состава действующего вещества и его введения пациенту. Было обнаружено, что некоторые лекарственные средства легко абсорбируются через альвеолярную область (легких) непосредственно в кровообращение. Введение лекарственного средства в легкие является особенно многообещающим для протеинов и полипептидов, которые трудно вводить при помощи других путей назначения лекарственного средства. Указанное введение лекарственного средства в легкие яв 003405 2 ляется эффективным для лечения легочных заболеваний как на соматическом, так и на местном уровне. В публикации Elliot et al., Aust. Paediatr. J.(1987) 23:293-297, описано введение с распылением полусинтетического инсулина человека в дыхательный тракт шести детей, страдающих диабетом; сделан вывод о том, что можно контролировать диабет у этих детей, несмотря на то, что эффективность абсорбции была низкой(20-25%) по сравнению с подкожными инъекциями. В патенте США 5,320,094, отмечая приведенную выше и ряд других публикаций,подчеркивают, что, несмотря на то, что инсулин и был введен в легкие, ни для одного из пациентов легочная терапия инсулином не оказалась достаточной для понижения уровней глюкозы в крови до нормальных значений. В указанном патенте выдвинута гипотеза о том, что эта проблема связана с потерей лекарственного средства в системе доставки и/или в ротовой части глотки за счет примененного метода введения, и о том, что увеличение до максимального значения отложения (осаждения) лекарственного средства в легких должно улучшить управление уровнями глюкозы в крови. Для достижения максимума введения лекарственного средства в указанном патенте предложено управлять скоростью инспираторного потока (скоростью вдоха) в момент аэрозольной ингаляции и устанавливать ее ниже 30 л/мин, а преимущественно около 17 л/мин. Система введения (доставки) включает в себя камеру для инсулина, имеющую выпускное отверстие, через которое выпускают инсулин, а также отверстие ограничения скорости, позволяющее ограничивать скорость инспираторного потока. В заявке на патент США 60/078,212 приведена проверка упомянутой выше гипотезы и отмечено, что легочное введение инсулина при расходах менее 17 л/мин обеспечивает достижение увеличенных уровней инсулина в крови за более короткое время, чем при более высоких скоростях инспираторного потока. В патентах США 5,364,838 и 5,672,581 описано введение измеренного количества инсулина в виде аэрозоля. Инсулин автоматически вводится в тракт инспираторного потока при поступлении информации относительно скорости инспираторного потока и относительно инспираторного объема (объема вдоха) пациента. Устройство для текущего контроля (монитор) непрерывно направляет информацию на микропроцессор, который определяет оптимальную точку респираторного цикла и при ее достижении открывает клапан, позволяющий вводить инсулин (пациенту). Расход инспираторного потока лежит в диапазоне ориентировочно от 0,1 до 2,0 л/с, а инспираторный объем лежит в диапазоне ориентировочно от 0,1 до 0,8 л. В публикации WO 97/40819 указано, что медленные скорости инспираторного потока 3 при легочной доставке играют ключевую роль в увеличении эффективности доставки лекарственного средства и его отложения в легких. Для получения заданных расходов инспираторного потока (15-60 л/мин), выбирают сопротивление потоку устройства в диапазоне от 0,12 до 0,21(см водяного столба (Н 2 О 1/2. В публикации ЕРО 692990 В 1 описаны дезагломераторы для респираторов (ингаляторов) сухого порошка и отмечается, что желательно понизить зависимость введенной дозы и/или вдыхаемой фракции порошкового аэрозоля от расхода воздушного потока. При увеличении скорости потока в дезагломераторе изменяется геометрия канала,через который проходит порошок в воздухе, что приводит к меньшему увеличению падения давления, чем при отсутствии переменной геометрии; это обеспечивает более эффективную дезагломерацию в диапазоне скоростей потока. Таким образом, из изложенного следует,что для обеспечения эффективного введения действующего вещества в легкие удобным и воспроизводимым образом желательно поддерживать низкую начальную скорость потока, с последующим периодом более высокой скорости потока. В соответствии с первым аспектом настоящего изобретения в нем предлагается устройство для введения аэрозольного состава действующего вещества в легкие пациента. Это устройство содержит модулятор сопротивления потоку, который модулирует сопротивление потоку аэрозольного состава действующего вещества для получения заданной начальной скорости потока аэрозольного состава действующего вещества. Модулятор сопротивления потоку модулирует указанное сопротивление таким образом, что это сопротивление не зависит от текущего контроля расхода и от команд пациента. В соответствии с другим аспектом настоящего изобретения в нем предлагается способ введения аэрозольного состава действующего вещества в легкие пациента. Способ предусматривает получение аэрозольного состава действующего вещества с высоким сопротивлением потоку в течение начального периода, и с более низким сопротивлением потоку в течение последующего периода. На фиг. 1 показан схематично первый вариант устройства для введения состава действующего вещества в виде сухого порошка в соответствии с настоящим изобретением. На фиг. 2 показан график концентрации аэрозоля, введенного при помощи устройства,показанного на фиг. 1. На фиг. 3 показан график сопротивления модулятора сопротивления потоку в функции времени для устройства, показанного на фиг. 1. На фиг. 4 показан график скорости для сопротивления, показанного на фиг. 3. 4 На фиг. 5 показаны совмещенные графики сопротивления модулятора скорости потока в соответствии с настоящим изобретением и скорости потока связанного с модулятором устройства. На фиг. 6 показан график скоростей ингаляции пациентов с использованием устройства,показанного на фиг. 1, при различных сопротивлениях потоку, если использовать максимальное усилие ингаляции. На фиг. 7 показан график объемов ингаляции пациентов с использованием устройства,показанного на фиг. 1, при различных сопротивлениях потоку, если использовать максимальное усилие ингаляции. На фиг. 8 показан график комфортных скоростей ингаляции пациентов с использованием устройства, показанного на фиг. 1, при различных сопротивлениях потоку. На фиг. 9 показан график объемов ингаляции пациентов с использованием устройства,показанного на фиг. 1, при различных сопротивлениях потоку, если использовать комфортные скорости ингаляции. В соответствии с настоящим изобретением предлагается способ и устройство для введения в легкие пациента состава действующего вещества, причем при указанном введении изменяется во времени сопротивление потоку состава действующего вещества. Настоящее изобретение удивительным образом позволяет увеличить уровни действующего вещества в крови удобным и воспроизводимым образом. Определения Термин "действующее вещество" включает в себя вещество, лекарственное средство, соединение, композицию вещества или смесь, которая обеспечивает некоторые фармакологические и часто благотворные эффекты. Этот термин включает в себя пищу, добавки к пище,питательные вещества, лекарственные средства,вакцины, витамины и другие вещества, имеющие благотворные свойства. Используемый в тексте описания термин дополнительно включает в себя любое физиологически или фармакологически активное вещество, которое обеспечивает местное или общее (соматическое) положительное воздействие на пациента. Действующее вещество, которое предназначено для введения, включает в себя антибиотики, антивирусные средства, анэпилептики, анальгетики,противовоспалительные средства и бронхолитические средства. В качестве действующего вещества может быть использовано неорганическое или органическое соединение, в том числе,но без ограничения, лекарственные вещества,которые воздействуют на периферические нервы, на адренорецепторы, холинорецепторы, скелетные мышцы, на сердечно-сосудистую систему, гладкие мышцы, на систему кровообращения, на синоптические центры, на нейроэффекторные синапсные (соединительные) центры, на 5 эндокринную и гормональную системы, на иммунную систему, систему репродукции, скелетную систему, автокоидную систему, систему питания и экскреторную систему, а также на гистаминную систему центральной нервной системы. Подходящие действующие вещества могут быть выбраны, например, среди полисахаридов, стероидных веществ, гипнотических и успокоительных средств, антидепрессантов,транквилизаторов, антиконвульсивных средств,миорелаксантов и миоконтрактантов, средств антипаркинсонизма, анальгетиков, противовоспалительных средств, антимикробных и антималярийных средств; гормональных средств, в том числе противозачаточных средств; симпатомиметических средств, полипептидов и протеинов, способных вызывать физиологические эффекты, мочегонных средств, средств регуляции липидов, антиандрогенных средств, антипаразитных средств, опухолевых и противоопухолевых средств, средств против гипогликемии,питательных и пищевых добавок, добавок роста,жиров, антиэнтеритных средств, электролитов,вакцин и диагностических средств. Среди примеров действующих веществ,подходящих для использования в соответствии с настоящим изобретением, можно указать, но без ограничения, кальцитонин, эритропоэтин(ЕРО), Фактор VIII, Фактор IX, цередазу, церезим, циклоспорин, стимулирующий фактор колонии гранулоцита (GCSF), ингибитор альфа-1 протеиназы, элькатонин, стимулирующий фактор колонии макрофага гранулоцита (GMCSF),гормон роста, гормон роста человека (HGH); гормон, освобождающий гормон роста (GHRH); гепарин, гепарин с низким молекулярным весом(FSH), подобный инсулину фактор роста, инсулинтропин, антагонист рецептора интерлейкина-1, интерлейкин-3, интерлейкин-4, интерлейкин-6, стимулирующий фактор колонии макрофага (M-CSF), фактор роста нерва, паратироидный гормон (РТН), тимозин альфа 1, ингибиторIIb/IIIа, альфа-1 антитрипсин, респираторное синцитиальное вирусное антитело, ген цистного фиброзного трансмембранного регулятора(CFTR), деоксирибонуклеаза (Dnase), бактерицидный протеин увеличения проницаемости(BPI), анти-CMV антитело, рецептор интерлейкина-1, 13-cis ретиноевая кислота, пентамидин изетиоуат, альбутерол сульфат, метапротеранол сульфат, беклометазон дипрепионат, триамцилонон ацетамид, будесонид ацетонид, ипратропиум бромид, флунисолид, кромолин натрий,эрготамин тартрат, а также их аналоги, агонисты и антагонисты. Кроме того, действующие вещества могут дополнительно содержать нук 003405 6 леиновые кислоты, присутствующие в виде простых молекул нуклеиновой кислоты, вирусных векторов, взаимодействующих вирусных частиц; в виде нуклеиновых кислот, объединенных с липидами или с материалом, содержащим липиды (или встроенных в них); в виде плазмида ДНК или РНК или же в виде других конструкций нуклеиновых кислот такого типа, который подходит для трансфекции или трансформации клеток, в особенности клеток альвеолярной области легких. Действующие вещества могут иметь различные формы, такие как растворимые и нерастворимые в воде, насыщенные и ненасыщенные молекулы, а также компоненты комплексов молекул или фармакологически приемлемых солей. Действующие вещества могут иметь вид встречающихся в природе молекул,или же они могут быть получены за счет рекомбинации, или же они могут иметь вид встречающихся в природе или полученных за счет рекомбинации действующих веществ, с одной или несколькими добавленными или удаленными аминокислотами. Более того, действующие вещества могут содержать убитые вирусы или вирусы с ослабленной жизнедеятельностью,подходящие для использования в качестве вакцин. Термин "aэрозольный состав действующего вещества" относится к определенному выше составу действующего вещества, который подходит для введения в легкие. Аэрозольный состав действующего вещества может быть в виде сухого порошка, а также в виде предназначенных для распыления раствора, суспензии или взвеси. Этот состав также может быть перемешан с подходящим газом-вытеснителем, который имеет низкую точку кипения и высокую летучесть. Следует иметь в виду, что в аэрозольный состав действующего вещества может быть введено несколько действующих веществ,причем использование термина "вещество" не исключает применения двух или больше таких веществ. Под "скоростью инспираторного потока" понимают скорость, при которой производится введение состава действующего вещества. Количество действующего вещества в аэрозольном составе действующего вещества должно быть достаточным для подачи терапевтически эффективного количества действующего вещества, позволяющего получить желательный результат. На практике это количество широко варьирует в зависимости от вида действующего вещества и тяжести заболевания, а также от желательного терапевтического эффекта. Однако устройство обычно используют для введения действующих веществ в дозах от 0,001 до 100 мг в день, а преимущественно от 0,01 до 50 мг в день. Настоящее изобретение основано, по меньшей мере, частично, на том неожиданном наблюдении, что когда действующее вещество 7 вводят пациенту при более низкой начальной скорости инспираторного потока, то бионакопление действующего вещества возрастает по сравнению с тем случаем, когда действующее вещество вводят пациенту при постоянной, но более высокой скорости инспираторного потока. Составы действующего вещества, подходящие для использования в соответствии с настоящим изобретением, содержат сухие порошки, предназначенные для распыления растворы,суспензии или взвеси, а также частицы, суспендированные или растворенные в газевытеснителе. Среди действующих веществ в виде сухих порошков, которые подходят для использования в соответствии с настоящим изобретением, можно указать аморфные действующее вещества, кристаллические действующее вещества и смеси аморфных и кристаллических действующих веществ. Действующее вещества в виде сухих порошков имеют размер частиц, который позволяет им проникать в альвеолы легких, причем "cредний диаметр частиц по массе", или "MMD", составляет преимущественно 10 мкм, предпочтительно менее 7,5 мкм, а еще лучше менее 5 мкм, а обычно лежит в диапазоне от 0,1 до 5 мкм. Эффективность введенной дозы (DDE) для указанных порошков составляет 30%, обычно 40%, преимущественно 50% и часто 60%, причем "cредний аэродинамический диаметр частиц по массе", или"MMAD", распределения аэрозольных частиц по размерам составляет от 1,0 до 5,0 мкм, обычно от 1,5 до 4,5 мкм, а преимущественно от 1,5 до 4,0 мкм. Указанные действующее вещества в виде сухих порошков имеют содержание влаги ориентировочно ниже 10 вес.%, обычно ориентировочно ниже 5 вес.%, а преимущественно ориентировочно ниже 3 вес.%. Указанные действующее вещества в виде сухих порошков описаны в публикациях WO 95/24183 и WO 96/32149, которые включены в данное описание в качестве ссылки. Однако можно также производить введение пациенту и более крупных частиц, например таких, которые имеют MMD от 10 до 30 мкм, а также таких частиц, которые имеют MMAD менее 5 мкм. Указанные частицы описаны, например, в РСТ публикациях WO 97/44013 и WO 98/31346. Составы действующего вещества в виде сухого порошка преимущественно готовят при помощи распылительной сушки, в условиях,при которых получают, главным образом,аморфный порошок. Массу действующего вещества, находящуюся обычно в кристаллическом виде, растворяют в физиологически приемлемом водном буферном растворе, а обычно в нитратном буфере, рН которого лежит в диапазоне ориентировочно от 2 до 9. Результирующие растворы, как правило, содержат действующее вещество в концентрации от 0,01 до 1 вес.%, а обычно от 0,1 до 0,2 вес.%. После этого прово 003405 8 дят распылительную сушку растворов в обычной подходящей распылительной сушилке, например в такой, которая может быть закуплена на фирмах Niro A/S (Нидерланды), Buchi(Швейцария), или в другой подобной, в результате чего получают, главным образом, аморфный порошок. Альтернативно такие аморфные порошки могут быть приготовлены при помощи лиофильной сушки, вакуумной сушки или сушки выпариванием соответствующего раствора действующего вещества, при таких условиях,которые позволяют получать аморфную структуру. Полученные указанным образом аморфные составы действующего вещества могут быть размолоты или измельчены для получения частиц с желательным распределением по размерам. Действующее вещество в виде сухого порошка может также иметь кристаллическую форму. Кристаллические сухие порошки могут быть приготовлены путем размалывания или струйного дробления массы кристаллического действующего вещества. Порошки действующего вещества в соответствии с настоящим изобретением могут содержать фармацевтические носители или наполнители, пригодные для респираторного и легочного назначения. Такие носители просто могут выполнять роль балласта, когда желательно снизить концентрацию действующего вещества в порошке, который вводится пациенту. Однако носители также могут служить для дополнительного улучшения дисперсности порошка в устройстве для его распыления, что позволяет обеспечивать более эффективное и воспроизводимое введение действующего вещества и улучшает характеристики действующего вещества (например, сыпучесть и консистенцию), что облегчает приготовление порошка и заполнение им устройства для распыления. Указанные наполнители включают в себя (но без ограничения) (а) углеводороды, например моносахариды, такие как фруктоза, галактоза, глюкоза, D-манноза, сорбоза и тому подобное; дисахариды, такие как лактоза, трегалоза, целлобиоза и тому подобное; циклодекстрины, такие как 2-гидроксипропилциклодекстрин; и полисахариды, такие как рафиноза, мальтодекстрины,декстраны и тому подобное; (b) аминокислоты,такие как глицин, аргинин, аспарагиновая кислота, глутаминовая кислота, цистеин, лизин и тому подобное; (с) соли органических кислот,приготовленные из органических кислот и оснований (щелочей), такие как цитрат натрия,аскорбат натрия, глюконат магния, глюконат натрия, трометамин гидрохлорид и тому подобное; (d) пептиды и протеины, такие как аспартам, сывороточный альбумин человека, желатин и тому подобное; и (е) альдиты, такие как маннитол, ксилитол и тому подобное. Предпочтительная группа носителей включает в себя лактозу, трегалозу, рафинозу, мальтодекстрины, 9 глицин, цитрат натрия, сывороточный альбумин человека и маннитол. Составы действующего вещества в виде сухих порошков могут быть введены с использованием ингалятора для сухого порошка, входящего в Ингаляционные Терапевтические Системы, описанные в публикации WO 96/09085,которая включена в данное описание в качестве ссылки, однако, указанный ингалятор должен быть приспособлен для обеспечения возможности управления сопротивлением потоку, как это описано здесь далее. Сухие порошки могут быть также введены с использованием ингалятора отмеренной дозы, описанного в патенте США 5,320,094, или при помощи устройства, приводимого в действие пациентом, такого как описанное в патенте США 4,338,931. Распыляемые растворы могут быть приготовлены при помощи аэрозолизации имеющихся в продаже растворов составов действующего вещества. Такие растворы могут быть введены при помощи дозатора, такого как распылитель,который подает аэрозоль в виде управляемой дозы, например такого, как распылитель типаRaindrop, производимый фирмой Puritan Bennett,применение которого описано в патенте США 5,320,094. Другие способы введения растворов, суспензий и взвесей описаны в патенте США 5,672,581. Устройство, в котором использован вибрирующий пьезоэлектрический элемент, описано в патенте США 5,586,550. Системы с газом-вытеснителем могут иметь действующее вещество, растворенное в газе-вытеснителе, или частицы, суспендированные (взвешенные) в газе-вытеснителе. Оба указанных типа составов описаны в патенте США 5,672,581. Для получения повышенных бионакоплений действующего вещества описанные здесь выше устройства должны быть модифицированы таким образом, чтобы ограничивать начальную скорость инспираторного потока состава действующего вещества. По окончании начального периода низкой скорости инспираторного потока указанное ограничение снимается и допускается более высокая скорость инспираторного потока. Если не устанавливать более высокую скорость инспираторного потока, то пациент испытывает фрустрацию и перестает вдыхать лекарственное средство. В соответствии с настоящим изобретением предлагается устанавливать скорость потока ориентировочно менее чем 15 л/мин, преимущественно менее 10 л/мин, часто ориентировочно от 5 до 10 л/мин, в течение периода ориентировочно менее чем 10 с, преимущественно менее 5 с и часто ориентировочно от 3 до 5 с. После указанного начального периода ограниченной скорости инспираторного потока указанное ограничение снимается и допускается нормальная(более высокая) скорость инспираторного потока пациента. Эта скорость потока составляет 10 ориентировочно от 15 до 80 л/мин, обычно ориентировочно от 15 до 60 л/мин и часто ориентировочно от 15 до 30 л/мин. Для обеспечения указанного в устройство должен быть встроен модулятор сопротивления потоку. Предусмотренный в устройстве датчик давления определяет момент начала ингаляции. Модулятор сопротивления потоку должен быть установлен на высокое сопротивление, составляющее ориентировочно от 0,4 до 2 (см Н 2 О)1/2/SLM (где SLM это литры в минуту при стандартных температуре и давлении), обычно ориентировочно от 0,4 до 1,5 (см Н 2 О)1/2/SLM и часто ориентировочно от 0,5 до 1,0 (см Н 2 О)1/2/SLM, что позволяет получить указанные здесь выше скорости потока. Сразу по истечении начального периода ограничения скорости потока, что определяют по показаниям датчика давления и за счет предварительной установки заданного периода, модулятор сопротивления потоку устанавливают в такое состояние, при котором он оказывает малое сопротивление потоку или совсем не оказывает сопротивления. Указанное сопротивление составляет ориентировочно от 0 до 0,3 (см Н 2 О)1/2/SLM, обычно от 0 до 0,25 (см Н 2 О)1/2/SLM и часто от 0 до 0,2 (см H2O)1/2/SLM. При этом будет устанавливаться нормальная комфортная скорость инспираторного потока пациента. Примерная система для модуляции скорости потока показана на фиг. 1. В этой системе модулятором скорости потока является клапан (100), установленный во впускном воздушном коллекторе (102) устройства (104) для управления скоростью потока всасываемого воздуха. Расходомер (106) и компьютер (108) используются только в исследовательских целях для оценки состояния пациента в ответ на ограничение потока. Датчик давления (110) определяет момент начала ингаляции и переключает размер отверстия клапана (100). Несмотря на то,что в данном случае в качестве модулятора скорости потока показан клапан, управляемый при помощи компьютера, с равным успехом может быть использована простая механическая клапанная система. Более того, для определения момента начала ингаляции может быть использован как датчик потока, так и датчик давления. В соответствии с дополнительной характеристикой настоящего изобретения соударение(застревание) в горле пациента частиц пропорционально скорости потока и квадрату среднего аэродинамического диаметра частиц по массеI=kd2Q,где I = число частиц, сталкивающихся в горле,k = коэффициент пропорциональности,d = MMAD частиц,Q = скорость потока. В соответствии с этим уравнением имеется возможность введения крупных частиц с использованием низких начальных скоростей потока в соответствии с настоящим изобретением, 11 без увеличения числа частиц, застревающих в горле, что позволяет вводить большую часть действующего вещества в течение периода существования низкой скорости потока. Следовательно, первоначально, когда скорость потока является низкой и концентрация аэрозоля высокая, число частиц аэрозоля достигает своего пика, причем частицы преимущественно вводятся в глубокие легкие, а не соударяются (не застревают) в горле, при этом бионакопление действующего вещества будет возрастать. Концентрация аэрозоля на выходе из устройства фиг. 1 показана на фиг. 2. График показывает, что из 0,5 л аэрозоля концентрация первых 0,1-0,2 л является самой высокой, после чего концентрация уменьшается. Поэтому важно производить введение начальной порции аэрозоля при низкой скорости, чтобы избежать застревания в горле и увеличить бионакопление(в легких). Профиль сопротивления модулятора скорости потока, который позволяет выполнять указанное, показан на фиг. 3. Сопротивление является высоким (0,65 (см Н 2 О)1/2/SLM) в течение начального периода времени 3 с, после чего открывается клапан и сопротивление возвращается к нормальному сопротивлению устройства(в данном случае становится равным 0,15 (см Н 2 О)1/2/SLM). Как это можно видеть из показанных на фиг. 4 скоростей потока, скорость инспираторного потока в течение начального периода времени составляет около 10 SLM и затем постепенно достигает значений около 25-30SLM. Профиль сопротивления другого модулятора скорости потока в соответствии с настоящим изобретением и соответствующий профиль скорости потока устройства показаны на фиг. 5. Переход сопротивления от высокого значения к низкому значению (от 0,9 до 0,20 (см Н 2 О)1/2/SLM) происходит в течение начального периода времени 5 с. Как это можно видеть из показанных на фиг. 5 скоростей потока, скорость инспираторного потока в течение начального периода времени 3 с составляет менее 20SLM и затем постепенно достигает значений около 30 SLM. В обоих случаях, так как концентрация для первых 0,1-0,2 л является наибольшей, то большая часть действующего вещества вводится в течение начального периода времени 3 с. Это увеличивает введение (поступление) действующего вещества в глубокие легкие и,следовательно, увеличивает бионакопление действующего вещества. Приведенные далее примеры служат исключительно для пояснения настоящего изобретения и не имеют ограничительного характера,причем в них могут быть внесены изменения и дополнения, понятные специалистами в данной области после ознакомления с описанием, чертежами и формулой настоящего изобретения. 12 Примеры Пример 1. Для определения взаимосвязи сопротивления потоку и скорости потока были проведены клинические испытания на 10 добровольцах (5 женщин и 5 мужчин), которые вдыхали (лекарственное средство) при трех различных сопротивлениях, причем они получили инструкции производить как максимальное вдыхание, так и вдыхание при комфортной скорости. Полученные результаты показаны на фиг. 6-9. На фиг. 6 и 7 показаны результаты при максимальной и комфортной скоростях ингаляции (вдыхания) для мужчин и для женщин. На фиг. 8 и 9 показаны объемы введенного при ингаляции аэрозоля для максимальной и комфортной скоростей ингаляции при указанных здесь выше сопротивлениях. Сопротивление для обеспечения комфортного поддержания скорости потока 10 л/мин составляет ориентировочно 0,3 (см H2O)1/2/SLM. Более того, падает инспираторный объем аэрозоля, вводимого при более высоких сопротивлениях потоку, так как вдыхание становится все более затрудненным и менее комфортным при возрастании сопротивления. В действительности, если сопротивление падает после начального периода введения аэрозоля при высоком сопротивлении, то инспираторный объем не будет существенно уменьшаться по сравнению с объемом, вводимым при постоянном низком сопротивлении потоку. Пример 2. Материалы и методики. Материалы Использовали кристаллический цинковый инсулин, 26,3 и/мг, полученный на фирме EliLilly and Company, Indianapolis, IN, который имеет чистоту 99% при измерении при помощи жидкостной хроматографии высокого разрешения (ВЭЖХ) обратной фазы. USP маннитол был получен на фирме Roquette Corporation(Gurnee, IL). Глицин был закуплен на фирмеSigma Chemical Company (St. Louis, Missouri). Цитрат дигидрат натрия, USP, был закуплен на фирме J. Т. Baker (Phillipsburg, NJ). Приготовление порошков Порошки инсулина готовят путем растворения массы кристаллического инсулина в буферном растворе цитрата натрия, содержащем маннитол и глицин, с получением окончательной концентрации твердых веществ 7,5 мг/мл и рН 6,70,3. Распылительная сушилка работала при температуре на впуске от 110 до 120 С при скорости подачи жидкости 5 мл/мин, что дает результирующую температуру на выпуске от 70 до 80 С. После этого была проведена фильтрация растворов через фильтр 0,22 мкм и распылительная сушка в сушилке Buchi Spray Dryer,что позволило получать мелкий белый аморфный порошок. Полученные порошки хранили в плотно укупоренных контейнерах в сухой среде 13 Анализ порошков Распределение частиц по размерам для порошков находили при помощи жидкой центробежной седиментации, проводимой в анализаторе распределения частиц по размерам типаHoriba САРА-700, с последующим диспергированием порошков при помощи устройстваSedisperse A-11 (фирма Micrometrics, США,Norcross, GA). Содержание влаги в порошках измеряли по методике Карла Фишера с использованием гигрометра типа Mitsubishi CA-06Moisture Meter. Распределение аэрозольных частиц по размерам находили при помощи каскадной молотковой дробилки (фирма Graseby Andersen, Smyrna, GA). Оценку эффективности введенной дозы (DDE) проводили с использованием аэрозольных устройств Терапевтических Систем Ингаляции, аналогичных описанным в публикации WO 96/09085. DDE определяли в виде процента номинальной дозы, содержащейся в блистерной упаковке, который (процент) выходит из мундштука аэрозольного устройства и улавливается на стекловолоконном фильтре(типа Gelman, диаметр 47 мм), к которому прикладывают вакуум (30 л/мин) в течение 2,5 с после срабатывания устройства. DDE вычисляют делением массы собранного на фильтре порошка на массу порошка в блистерной упаковке. Сохранность (целостность) инсулина перед обработкой порошка и после нее определяют при помощи сравнения с эталонным стандартом инсулина человека путем повторного растворения взвешенных порций порошка в дистиллированной воде и сравнения полученного раствора с исходным раствором, введенным в распылительную сушилку. Полученные при помощи хроматографии (ВЭЖХ) время удерживания и площадь под пиком хроматограммы используют для определения вероятности химического изменения или деградации молекулы инсулина в ходе процесса. УФ-поглощение используют для определения концентрации инсулина (на 278 нм) и наличия или отсутствия нерастворимых агрегатов (на 400 нм). Кроме того, производят измерение величин рН для исходного и восстановленного растворов. Аморфную природу порошка инсулина проверяют при помощи микроскопии в поляризованном свете. Испытания на людях Для исследования воздействия изменений скорости ингаляции на бионакопление введенного инсулина 24 пациента получали дозы с 2 мг инсулина при помощи показанной на фиг. 1 системы. Каждый сеанс приема лекарственного средства включает в себя 2 ингаляции по 1 мг с использованием ингаляторов Терапевтических 14 Систем Ингаляции (San Carlos, CA), описанных в патенте США 5,740,794, который включен в данное описание в качестве ссылки. Прием лекарственного средства производили следующим образом. А. Введение за счет ингаляции инсулина с размером частиц 3,6 мкм MMAD (широкое PSD(распределение частиц по размерам, с использованием стандартной методики ингаляции и стандартного ингалятора (график без наклона). Б. Введение за счет ингаляции инсулина с размером частиц 3,6 мкм MMAD (широкоеPSD), с ограничением скорости ингаляции на величине ориентировочно 10 л/мин при помощи показанной на фиг. 1 системы (график с наклоном). В. Введение за счет ингаляции инсулина с размером частиц 2,6 мкм MMAD (узкое PSD), с ограничением скорости ингаляции на величине ориентировочно 10 л/мин при помощи показанной на фиг. 1 системы (график с наклоном). Составы сухих порошков инсулина имеют средний диаметр частиц менее 5 мкм. Ингалятор диспергирует порошок и создает облако аэрозоля лекарственного средства, которое удерживается в камере объемом около 240 мл. Объем удерживающей камеры является незначительной фракцией глубокого инспираторного вздоха (2 л). Камера устроена таким образом,что в ходе ингаляции облака аэрозоля окружающий воздух втягивается в камеру, и выталкивает из нее аэрозоль, и направляет глубоко в легкие. У 24 пациентов производили забор крови,достаточный для получения минимум 1 мл плазмы. Забор производили в гепаринизированные трубки за 30 и 15 мин до ввода инсулина и непосредственно в момент (0) ввода инсулина, а также через 5, 10, 20, 30, 45, 60, 90, 120, 180,240, 300 и 360 мин после начала ингаляции. Бионакопления инсулина для проб, полученных через 360 мин, показаны в таблице какuU.min/мл (микроединицы инсулина на мл плазмы крови). Полученные величины показывают, что низкая исходная скорость потока с последующей более высокой скоростью потока обеспечивает более высокое бионакопление инсулина, чем постоянная более высокая скорость потока (увеличение составляет в среднем 11% для случая Б по сравнению со случаем А). Комбинация низкой исходной скорости потока с малым размером частиц дополнительно повышает бионакопление (увеличение составляет в среднем 242% для случая В по сравнению со случаем Б). А без наклона широкое PSD 728 1187 944 1973 3362 2217 1507 795 2447 5644 1714 523 1036 2823 1835 1623 2317 690 1399 681 1093 1931 255 731 1644 1158 70 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ введения действующего вещества в легкие пациента, предусматривающий введение действующего вещества в виде аэрозоля при сопротивлении потоку в начальный период времени ингаляции, составляющем от 0,4 до 2(см Н 2 О)1/2/SLM, соответствующем скорости потока 15 л/мин и менее. 2. Способ по п.1, отличающийся тем, что указанный начальный период времени составляет менее 10 с. 3. Способ по п.1 или 2, отличающийся тем,что сопротивление потоку по истечении указанного начального периода времени уменьшают до величин, соответствующих скорости потока от 15 до 80 л/мин. 4. Устройство для введения действующего вещества в легкие пациента в виде аэрозоля,отличающееся тем, что оно включает в себя модулятор сопротивления потоку аэрозольного состава действующего вещества, который выполнен с возможностью создания начального сопротивления потоку, составляющего от 0,4 до 2 (см Н 2 О)1/2/SLM.
МПК / Метки
МПК: A61M 15/00
Метки: действующего, устройство, вещества, способ, виде, введения, пациента, легкие, аэрозоля
Код ссылки
<a href="https://eas.patents.su/10-3405-sposob-i-ustrojjstvo-dlya-vvedeniya-dejjstvuyushhego-veshhestva-v-vide-aerozolya-v-legkie-pacienta.html" rel="bookmark" title="База патентов Евразийского Союза">Способ и устройство для введения действующего вещества в виде аэрозоля в легкие пациента</a>
Предыдущий патент: Способ получения гранулированных моющих составов
Случайный патент: Вещества, связывающие ядерные рецепторы