Способ получения липосомальной формы цитохрома с
Номер патента: 22183
Опубликовано: 30.11.2015
Авторы: Балабаньян Вадим Юрьевич, Тарасов Вадим Владимирович, Швец Виталий Иванович, Кацай Алексей Григорьевич, Краснопольский Юрий Михайлович, Ульянов Андрей Михайлович, Натыкан Алексей Андреевич, Шоболов Дмитрий Львович
Формула / Реферат
Способ получения липосомального препарата для офтальмологии, включающий высушивание смеси липидов, ее эмульгирование в водной среде, содержащей Цитохром C, гомогенизацию, добавление в процессе гомогенизации криопротектора при перемешивании до полного растворения и стерилизующую фильтрацию, отличающийся тем, что в качестве липидов используют дипальмитоилфосфатидилглицерин и фосфатидилхолин в соотношении 1:1,2-4,0 соответственно, диспергирование в водной среде, содержащей Цитохром C, ведут при соотношении Цитохром C:липиды - 1:(29,33-66,66) соответственно, гомогенизацию проводят при давлении 600-1200 атм, в качестве криопротектора используют лактозу, а соотношение фосфолипидов и криопротектора в препарате находится в пределах 1:3,0-5,5 соответственно.
Текст
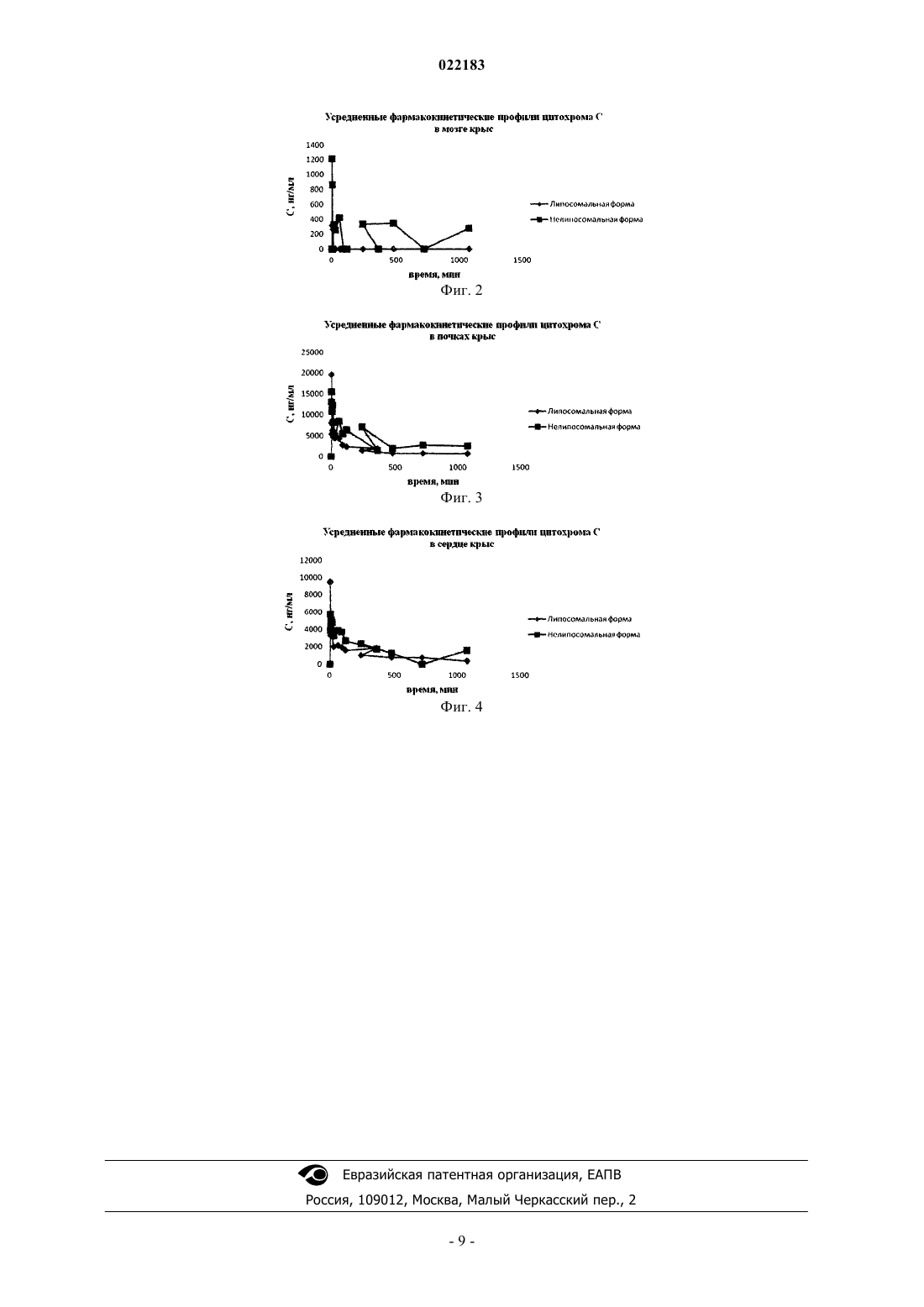
СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМАЛЬНОЙ ФОРМЫ ЦИТОХРОМА С Изобретение относится к фармацевтике и касается способа получения липосомального средства с фармакологическим действием, которое содержит в составе физиологически активное вещество- Цитохром C. Способ предусматривает высушивание смеси липидов, ее эмульгирование в водной среде, содержащей Цитохром C, гомогенизацию, добавление в процессе гомогенизации криопротектора при перемешивании до полного растворения и стерилизующую фильтрацию. Результатом является стандартность и стабильность полученного препарата содержащих ЦитохромC липосом (размер липосом представлен в узком диапазоне), высокая инкапсуляция Цитохрома С в липосомы (не менее 90%), стабильность липосом в процессе хранения. Шоболов Дмитрий Львович (RU),Краснопольский Юрий Михайлович(UA), Ульянов Андрей Михайлович,Натыкан Алексей Андреевич, Тарасов Вадим Владимирович, Балабаньян Вадим Юрьевич, Швец Виталий Иванович (RU), Кацай Алексей Григорьевич (UA) Ермакова Е.А. (RU) Изобретение относится к фармацевтике и касается способа получения липосомального средства с фармакологическим действием, которое содержит в составе физиологически активное вещество - Цитохром C. Цитохром C является катализатором клеточного дыхания, стимулирующим окислительные реакции и активизирующим метаболизм в тканях, уменьшающим гипоксию ткани при различных патологических состояниях, стимулирующим процессы регенерации. Эффект наступает через несколько минут после внутривенного введения и продолжается несколько часов. Препараты на основе Цитохрома С используются при тканевой гипоксии, в том числе вследствие отравления угарным газом и наркотиками, остаточных явлений после наркоза, ишемического инсульта, хронической недостаточности мозгового кровообращения, стенокардии, инфаркта миокарда, нарушении дыхания у новорожденных. Цитохром C также используют в офтальмологии, где он проявляет высокую активность относительно свободных радикалов, связывает агрессивные молекулы оксидантов, защищает хрусталик и роговицу от повреждений; подавляет и предотвращает развитие помутнения кристаллика (катаракты), препятствует дегенерации сетчатки глаза. Вместе с тем, одной из главных трудностей, связанных с разработкой глазных капель, является факт того, что многие лекарственные средства плохо проникают в глазную ткань и при этом время их воздействия крайне ограничено. В то же время, исследования последних лет показали, что наночастицы, такие как липосомы, увеличивают время удержания лекарственного препарата на роговице. Существует мнение, что липосомы могут служить эффективной системой доставки лекарств в офтальмологии. Включение в липосомы лекарственных средств и других агентов обеспечивает различные преимущества в отношении передних и задних сегментов глаза. В отношении передних сегментов исследования липосом сосредоточились на достижении большего корнеального проникновения. Методы, применяемые в отношении задних сегментов, обеспечили более длительное время клиренса, меньшую токсичность и конкретную доставку в ретинальный пигментный эпителий. В ходе экспериментов с животными липосомальные препараты можно обнаружить в роговице, склере, сетчатой оболочке и сосудистой оболочке глаза даже спустя 7 дней после субконъюнктивального введения - подобный эффект мог бы обеспечить меньшую частоту дозирования и повышенную адаптационную способность. Показано, что отрицательно заряженные липосомы превосходят положительно заряженные липосомы и свободные лекарственные средства в отношении проницаемости роговицы и большим временем удержания препарата. Эффективность липосомальных препаратов подтверждена экспериментальными данными на животных при повреждении глазной поверхности, кератитах, увеитах, кератопластике. Показана принципиальная возможность обеспечения внутриклеточной доставки материала в передний сегмент глаза, а также в клетки региональных нервных узлов. Методы применения липосом в заднем сегменте включали субконъюнктивальные инъекции и инъекции в стекловидное тело. Результаты исследований, проводимых на животных, показали, что введение в стекловидное тело липосомальных форм лекарственных средств позволяет обеспечить более продолжительную терапевтическую концентрацию в стекловидном теле и меньшую степень токсичности по сравнению со свободными лекарственными препаратами. По-видимому, липосомы высвобождают их содержимое медленно,защищая инкапсулированное лекарственное вещество от разрушения и клиренса, а также предотвращая токсическое воздействие, связанное с высокими пиковыми концентрациями, наблюдаемыми при введении свободных форм препаратов. Сегодня в офтальмологической практике используются только четыре коммерческих липосомальных препарата: "Липофлавон" (Lipoflavon), "Визудин" (Visudyn), "Липоферон" (Lipoferon) и "Tearsagain". Визудин - липосомальная форма вертепорфирина. В состав препарата на один флакон входят вертепорфирин - 15 мг, димиристоилфосфатидилхолин - 70,5 мг, фосфатидилглицерин яичного желтка - 48,75 мг, лактоза - 690 мг, аскорбилпалмитат - 0,15 мг, гидрокситолуол бутилированный - 0,015 мг. Визудин используется в офтальмологии для лечения больных преимущественно с классической субфовеальной хороидальной неоваскуляризацией, возникшей вследствие возрастной дегенерации сетчатки или субфовеальной хороидальной неоваскуляризацией вследствие патологической миопии. Липосомальные производные бензопорфирина (вертепорфирин) являются светочувствительными красителями, проявляющими цитотоксичность за счет образования радикалов кислорода при активации (длина волны 689 нм). В составе липосом вертепорфирин ориентирован на клетки опухолевого сосуда и неоваскулярные эндотелиальные клетки. Визудин приводит к образованию цитотоксинов только при активации светом в присутствии кислорода. В результате образуется нестойкий с коротким периодом жизни синглетный кислород с высокой реакционной способностью. Синглетный кислород приводит к разрушению биологических структур, что, в свою очередь, способствует локальной окклюзии сосудов, разрушению клеток и их гибели. Липофлавон - липосомальная форма кверцетина. В состав препарата на один флакон входят кверцетин - 0,75 мг, фосфатидилхолин яичного желтка - 27,5 мг, лактоза - 27,5 мг. Препарат выпускают в лиофилизированном виде. Липофлавон в форме глазных капель применяется при поражении роговицы (про-1 022183 никающие и не проникающие); послеоперационных ранах роговицы (после экстракции катаракты); кератитах различного генеза; воспалительных состояниях глаз. Действие препарата основано на противовоспалительных, ранозаживляющих, ангиопротекторных эффектах кверцетина в липосомальной форме. Кверцетин обладает антиоксидантным и противовирусным действием, снижает синтез лейкотриенов и патологически повышенную сосудисто-тканевую проницаемость и способствует нормализации тканевой трофики. Липосомальная структура Липофлавона обеспечивает растворимость и офтальмобиодоступность при инстилляциях в форме глазных капель."TEARS AGAIN" - липосомальный аэрозоль, содержащий в своем составе природные фосфолипиды. Используется при слабоумеренном синдроме сухого глаза с нарушением липидного слоя напылением на закрытые веки больного. Действует в качестве герметика для образования собственных слез больного. Обнаружено также снижение температуры век у пациентов с синдромом сухого глаза (гиперсекреторный сухой кератоконъюнктивит). Известны также способы получения инъекционных препаратов Цитохрома С: раствор Цитохрома С для инъекций, 0,25%; Цито-мак и Катахром. Данные способы основаны на растворении субстанции Цитохрома С в водном растворе, содержащем вспомогательные вещества (аденозин, никотинамид, сорбит,натрия хлорид и др.), стерилизующей фильтрации, розлива в первичную упаковку. Однако водорастворимая форма Цитохрома С имеет ряд существенных недостатков: Цитохром C незначительно проникает через биологические мембраны в клетки, достаточно быстро выводится из организма, что способствует крайне низкой биодоступности фермента. Указанные недостатки известных препаратов - капель на основе водных растворов Цитохрома С обуславливают снижение биодоступности и требуют частых введений растворов фермента. Для устранения указанных недостатков целесообразным является создание глазных капель Цитохрома С в липосомальной форме. В литературе последних лет появляются сообщения о возможности создания липосомального препарата с включенным Цитохромом С. Известен способ получения липосомальной композиции на основе природных фосфолипидов, холестерина и Цитохрома С, который обладает фармакологической активностью. Способ выбран наиболее близким аналогом по сумме признаков, а именно сутью и последовательностью выполнения основных операций и приемов, химической природой фосфолипида и Цитохрома С, липосомальной организацией целевого продукта и близостью его фармакотерапевтических проявлений. Известный способ предусматривает смешивание соевого фосфатидилхолина, холестерина, отрицательно заряженного комплекса фосфолипидов сои и витамина Е в хлороформных растворах, высушивание смеси, эмульгирование в водной среде, содержащей 0,3% Цитохрома С, диспергирование эмульсии при помощи ультразвука при 22 кГц в течение 10 мин при температуре 0C, стерилизующую фильтрацию, при массовом соотношении фосфатидилхолин:холестерин:отрицательно заряженный комплекс фосфолипидов сои:витамин Е в пределах 55:25:10:1 соответственно. Соотношение липиды:Цитохром C составляет 8:1. Степень включения Цитохрома С в липосомы составляет 55-65% от исходного. Однако способ предусматривает операции и методы, которые затрудняют его реализацию и способствуют снижению качества липосомального продукта. Во-первых, включение в состав препарата холестерина, придающего жесткость липосомальной мембране, затрудняет проведение стерилизующей фильтрации; во-вторых, сам способ и получаемый с помощью него состав обеспечивают низкое включение Цитохрома С в липосомы - не более 55-60%, что приводит к появлению в препарате свободной формы Цитохрома С (практически 1/2 от взятого фермента); в-третьих, использование для получения липосом метода диспергирования при помощи ультразвука не позволяет получать стандартный препарат в производственных условиях; кроме того, в составе препарата присутствуют не только фосфолипидные примеси, т.к. в отрицательно заряженном комплексе фосфолипидов сои фосфор составляет только 1,7-1,8%,т.е. более 50% вещества представлено балластными примесями. Все это снижает эффективность способа-прототипа в процессе его воспроизводства, а также стабильность и стандартность целевого продукта как лекарственного средства. Задачей заявленного способа является упрощение процесса получения и повышение качества липосомального препарата по показателям стабильности липосомальной структуры после лиофилизации продукта, увеличение включенного в липосомы фермента, что, в свою очередь, обеспечивает фармакологическую активность. Результат, полученный при решении поставленной задачи, состоит в стандартности и стабильности полученного препарата содержащих Цитохром C липосом (размер липосом представлен в узком диапазоне), высокой инкапсуляции Цитохрома С в липосомы (не менее 90%), стабильности липосом в процессе хранения, возможности стерилизующей фильтрации. Для достижения поставленного результата предлагается способ получения липосомальной композиции на основе фосфатидилхолина, дипальмитоилфосфатидилглицерина (ДПФГ) и Цитохрома С. Способ предусматривает растворение фосфатидилхолина и ДПФГ по отдельности или их смеси в органическом растворителе или растворителях, при необходимости объединение растворов фосфатидилхолина и ДПФГ, удаление растворителя упариванием в вакууме, диспергирование полученной массы в водной среде, содержащей Цитохром C, гомогенизацию полученной эмульсии при давлении 600-1200 атм до получения многослойных липосом размером 150-180 нм с последующим добавлением криопротектора при перемешивании до получения липосом размером 80-140 нм, стерилизующую фильтрацию полученной липосомальной эмульсии, разлив во флаконы, лиофилизацию и герметизацию в атмосфере инертного газа (или азота). Способ иллюстрируется графиками фармакокинетических профилей Цитохрома С в печени, мозге,почках и сердце крыс (фиг. 1-4 соответственно). Эффективность заявляемого способа по качественной и количественной идентификации в готовом продукте липидного компонента - фосфатидилхолина и ДПФГ, оценивали методом тонкослойной хроматографии на пластинках "Silufol" по хроматограмме раствора целевого продукта в метанол:хлороформ:метанол (при соотношении 65:25:4), на которой два основных пятна желтого цвета находятся на уровне пятен растворов стандартных образцов фосфатидилхолина и ДПФГ; индекс окисленности липидов проводили УФ-спектроскопией при двух длинах волн: 233 и 215 нм. Эффективность заявляемого способа по качественной и количественной идентификации в готовом продукте Цитохрома С оценивали методом высокоэффективной жидкостной гель-хроматографии, которую проводили для количественного определения включенного в липосомы фермента. Использовали хроматограф Shimadzu "Nexera", колонка хроматографическая размером Tricorn 5/200 column (Ge Healthcare), заполненную сорбентом "superosel2", подвижная фаза: 4,515 г/л KH2PO4 pH до 6,0 2 М NaOH; скорость подвижной фазы 0,5 мл/мин; детектирование при длине волны 409 нм; температура колонки 25C. Физико-химические свойства полученного липосомального препарата оценивали определением величины частиц липосом на наносайзере "Zetasizer Nano ZS" методом фотонной корреляционной спектроскопии. Размер частиц измеряли при помощи полупроводникового лазера при длине волны 375 нм. Нижеследующие конкретные примеры иллюстрируют процесс получения липосомальной композиции согласно заявленному способу (примеры 1-4) и способу согласно прототипу (пример 9). Пример 1 (по предлагаемому способу). Лактозу в количестве 20,0 г растворили в фосфатной буферной смеси (pH 6,5-6,8) в объеме 50 мл(концентрация 400 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Точную навеску Цитохрома С в количестве 75,0 мг (в пересчете на 100% вещество) растворяют в фосфатной буферной смеси (pH 6,5-6,8) в объеме 75,0 мл (концентрация 1,0 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Фосфатидилхолин в количестве 1,2 г и ДПФГ в количестве 1,0 г растворяют в 150 мл смеси хлороформа и этилового спирта (соотношение 4:1) и перемешивают. Растворы ДПФГ и фосфатидилхолина объединяют и фильтруют через мембраны с размером пор 0,22 мкм. Стерильные растворы переносят в колбу ротационного испарителя. Раствор упаривают при 41-45C до получения тонкой пленки. Пленку обрабатывают газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимают смесью растворов: 135 мл стерильного раствора Цитохрома С (с концентрацией 1 мг/мл) и 35,0 стерильного фосфатного буферного раствора (pH 6,5-6,8). Колбу с раствором перемешивают в течение 2 ч до полного растворения пленки. Эмульсию переносят в гомогенизатор высокого давления и проводят гомогенизацию при температуре 38-44C. Создают давление 900 атм и продолжают гомогенизацию до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляют стерильный раствор лактозы 30 мл (12,0 г). Объем эмульсии 200 мл. Гомогенизацию продолжают до размера частиц не более 130-150 нм. Полученную эмульсию фильтруют через каскад фильтров с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 182 мл. Размер частиц после стерилизующей фильтрации 132,6 нм - 93,1%, 47,8 нм - 6,9%. Включение Цитохрома С в липосомы после стерилизующей фильтрации(определение методом ВЭЖХ) - 95,88%. Эмульсию разливают во флаконы, лиофилизируют и герметизируют в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 145 нм - 92,0%,75 нм - 8%; pH - 6,75. Включение Цитохрома С в липосомы не менее 95,2%. Соотношение компонентов в препарате: ДПФГ:фосфатидилхолин - (1:1,2); соотношение Цитохром C:фосфолипиды - (1:29,33); соотношение фосфолипиды:лактоза (1:5,45). Пример 2 (по предлагаемому способу). Лактозу в количестве 20,0 г растворили в фосфатной буферной смеси (pH 6,5-6,8) в объеме 50 мл(концентрация 400 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Точную навеску Цитохрома С в количестве 75,0 мг (в пересчете на 100% вещество) растворяют в фосфатной буферной смеси (pH 6,5-6,8) в объеме 75,0 мл (концентрация 1,0 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Фосфатидилхолин в количестве 2,4 г и ДПФГ в количестве 1,0 г растворяют в 150 мл смеси хлороформа и этилового спирта (соотношение 4:1) и перемешивают. Растворы ДПФГ и фосфатидилхолина объединяют и фильтруют через мембраны с размером пор 0,22 мкм. Стерильные растворы переносят в колбу ротационного испарителя. Раствор упаривают при 41-45C до получения тонкой пленки. Пленку обрабатывают газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимают смесью растворов: 135 мл стерильного раствора Цитохрома С (с концентрацией 1 мг/мл) и 35,0 стерильного фосфатного буферного раствора (pH 6,5-6,8). Колбу с раствором перемешивают в течение 2 ч до полного растворения пленки. Эмульсию переносят в гомогенизатор высокого давления и проводят гомогенизацию при температуре 38-44C. Создают давление 900 атм и продолжают гомогенизацию до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляют стерильный раствор лактозы 30 мл (12,0 г). Объем эмульсии 200 мл. Гомогенизацию проводят до размера частиц не более 130-150 нм. Эмульсию фильтруют через каскад фильтров с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 182 мл. Размер частиц после стерилизующей фильтрации 138,2 нм - 92,1%,37,8 нм - 7,9%. Включение Цитохрома С в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 94,88%. Полученную эмульсию разливают во флаконы, лиофилизируют и герметизируют в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 145 нм - 97%,75 нм - 3%; pH - 6,75. Включение Цитохрома С в липосомы не менее 94,32%. Соотношение компонентов в препарате: ДПФГ:фосфатидилхолин - (1: 2,4); соотношение Цитохром C:фосфолипиды - (1:45,33); соотношение фосфолипиды:лактоза (1:3,53). Пример 3 (по предлагаемому способу). Лактозу в количестве 20,0 г растворили в фосфатной буферной смеси (pH 6,5-6,8) в объеме 50 мл(концентрация 400 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Точную навеску Цитохрома С в количестве 75,0 мг (в пересчете на 100% вещество) растворяют в фосфатной буферной смеси (pH 6,5-6,8) в объеме 75,0 мл (концентрация 1,0 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Фосфатидилхолин в количестве 3,6 г и ДПФГ в количестве 1,0 г растворяют в 150 мл смеси хлороформа и этилового спирта (соотношение 4:1) и перемешивают. Растворы ДПФГ и фосфатидилхолина объединяют и фильтруют через мембраны с размером пор 0,22 мкм. Стерильные растворы переносят в колбу ротационного испарителя. Раствор упаривают при 41-45C до получения тонкой пленки. Пленку обрабатывают газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимают смесью растворов: 135 мл стерильного раствора Цитохрома С (с концентрацией 1 мг/мл) и 30,0 стерильного фосфатного буферного раствора (pH 6,5-6,8). Колбу с раствором перемешивают в течение 2 ч до полного растворения пленки. Эмульсию переносят в гомогенизатор высокого давления и проводят гомогенизацию при температуре 38-44C. Создают давление 900 атм и продолжают гомогенизацию до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляют стерильный раствор лактозы 35 мл (14,0 г). Объем эмульсии 200 мл. Гомогенизацию проводят до размера частиц не более 130-150 нм. Эмульсию фильтруют через каскад фильтров с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 180 мл. Размер частиц после стерилизующей фильтрации 147,2 нм - 90,1%,30,8 нм - 9,9%. Включение Цитохрома С в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 89,88%. Эмульсию разливают во флаконы, лиофилизируют и герметизируют в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 155 нм - 94,5%, 65 нм 5,5%; pH - 6,75. Включение Цитохрома С в липосомы не менее 88,2%. Соотношение компонентов в препарате: ДПФГ:фосфатидилхолин - (1:3,6); соотношение Цитохром C:фосфолипиды - (1:61,33); соотношение фосфолипиды:лактоза (1:3,00). Пример 4 (по предлагаемому способу). Лактозу в количестве 20,0 г растворили в фосфатной буферной смеси (pH 6,5-6,8) в объеме 50 мл(концентрация 400 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Точную навеску Цитохрома С в количестве 75,0 мг (в пересчете на 100% вещество) растворяют в фосфатной буферной смеси (pH 6,5-6,8) в объеме 75,0 мл (концентрация 1,0 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Фосфатидилхолин в количестве 4,0 г и ДПФГ в количестве 1,0 г растворяют в 150 мл смеси хлороформа и этилового спирта (соотношение 4:1) и перемешивают. Растворы ДПФГ и фосфатидилхолина объединяют и фильтруют через мембраны с размером пор 0,22 мкм. Стерильные растворы переносят в колбу ротационного испарителя. Раствор упаривают при 41-45C до получения тонкой пленки. Пленку обрабатывают газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимают смесью растворов: 135 мл стерильного раствора Цитохрома С (с концентрацией 1 мг/мл) и 27,5 стерильного фосфатного буферного раствора (pH 6,5-6,8). Колбу с раствором перемешивают в течение 2 ч до полного растворения пленки. Эмульсию переносят в гомогенизатор высокого давления и проводят гомогенизацию при температуре 38-44 С. Создают давление 900 атм и продолжают гомогенизацию до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляют стерильный раствор лактозы 37,5 мл (15,0 г). Объем эмульсии 200 мл. Гомогенизацию проводят до размера частиц не более 130-150 нм. Эмульсию фильтруют через каскад фильтров с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 182 мл. Размер частиц после стерилизующей фильтрации 133,2 нм - 93,1%,47,8 нм - 6,9%. Включение Цитохрома С в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 81,58%. Эмульсию разливают во флаконы, лиофилизируют и герметизируют в атмо-4 022183 сфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 140 нм - 95,2%, 35,% нм 4,8%; pH - 6,75. Включение Цитохрома С в липосомы не менее 81,2%. Соотношение компонентов в препарате: ДПФГ:фосфатидилхолин - (1:4,0); соотношение Цитохром C:фосфолипиды - (1:66,66); соотношение фосфолипиды:лактоза (1:3,0). Пример 5. Лактозу в количестве 20,0 г растворили в фосфатной буферной смеси (pH 6,5-6,8) в объеме 50 мл(концентрация 400 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Точную навеску Цитохрома С в количестве 75,0 мг (в пересчете на 100% вещество) растворяют в фосфатной буферной смеси (pH 6,5-6,8) в объеме 75,0 мл (концентрация 1,0 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Фосфатидилхолин в количестве 5,0 г и ДПФГ в количестве 1,0 г растворяют в 150 мл смеси хлороформа и этилового спирта (соотношение 4:1) и перемешивают. Растворы ДПФГ и фосфатидилхолина объединяют и фильтруют через мембраны с размером пор 0,22 мкм. Стерильные растворы переносят в колбу ротационного испарителя. Раствор упаривают при 41-45 С до получения тонкой пленки. Пленку обрабатывают газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимают смесью растворов: 135 мл стерильного раствора Цитохрома С (с концентрацией 1 мг/мл) и 27,5 стерильного фосфатного буферного раствора (pH 6,5-6,8). Колбу с раствором перемешивают в течение 2 ч до полного растворения пленки. Эмульсию переносят в гомогенизатор высокого давления и проводят гомогенизацию при температуре 38-44C. Создают давление 900 атм и продолжают гомогенизацию до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляют стерильный раствор лактозы 37,5 мл (15,0 г). Объем эмульсии 200 мл. Гомогенизацию проводят до размера частиц не более 130-150 нм. Эмульсию фильтруют через каскад фильтров с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 182 мл. Размер частиц после стерилизующей фильтрации 138,2 нм - 92,1%,37,8 нм - 7,9%. Включение Цитохрома С в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 68,78%. Эмульсию разливают во флаконы, лиофилизируют и герметизируют в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 145 нм - 97%, 75 нм - 3%;pH - 6,75. Включение Цитохрома С в липосомы не менее 65,2%. Соотношение компонентов в препарате: ДПФГ:фосфатидилхолин - (1:5,0); соотношение Цитохром C:фосфолипиды - (1:80,0); соотношение фосфолипиды:лактоза (1:2,5). В данном примере показано, что при увеличении соотношении между фосфатидилхолином и ДПФГ до величины 5:1 количество включенного в липосомы Цитохрома С уменьшается. Пример 6. Лактозу в количестве 20,0 г растворили в фосфатной буферной смеси (pH 6,5-6,8) в объеме 50 мл(концентрация 400 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Точную навеску Цитохрома С в количестве 75,0 мг (в пересчете на 100% вещество) растворяют в фосфатной буферной смеси (pH 6,5-6,8) в объеме 75,0 мл (концентрация 1,0 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Фосфатидилхолин в количестве 2,4 г и ДПФГ в количестве 0,6 г растворяют в 150 мл смеси хлороформа и этилового спирта (соотношение 4:1) и перемешивают. Растворы ДПФГ и фосфатидилхолина объединяют и фильтруют через мембраны с размером пор 0,22 мкм. Стерильные растворы переносят в колбу ротационного испарителя. Раствор упаривают при 41-45C до получения тонкой пленки. Пленку обрабатывают газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимают смесью растворов: 135 мл стерильного раствора Цитохрома С (с концентрацией 1 мг/мл) и 35,0 стерильного фосфатного буферного раствора (pH 6,5-6,8). Колбу с раствором перемешивают в течение 2 ч до полного растворения пленки. Эмульсию переносят в гомогенизатор высокого давления и проводят гомогенизацию при температуре 38-44C. Создают давление 900 атм и продолжают гомогенизацию до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляют стерильный раствор лактозы 30 мл (12,0 г). Объем эмульсии 200 мл. Гомогенизацию проводят до размера частиц не более 130-150 нм. Эмульсию фильтруют через каскад фильтров с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 186 мл. Размер частиц после стерилизующей фильтрации 130,2 нм - 87,1%,47,8 нм - 12,9%. Включение Цитохрома С в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 71,5%. Эмульсию разливают во флаконы, лиофилизируют и герметизируют в атмосфере инертного газа (азота). По результатам контроля продукта полученного по предлагаемому способу после лиофилизации установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 145 нм - 90,4%, 50,5 нм - 9,6%;pH - 6,7. Включение Цитохрома С в липосомы не менее 67,2%. Соотношение компонентов в препарате: ДПФГ:фосфатидилхолин - (0,6:1,0); соотношение Цитохром C:фосфолипиды - (1:21,33); соотношение фосфолипиды:лактоза (1:4). В данном примере использовано меньшее количество ДПФГ (соотношение ДПФГ:фосфатидилхолин 0,6:1,0), что привело к снижению включения Цитохрома С в липосомы. Пример 7. Лактозу в количестве 20,0 г растворили в фосфатной буферной смеси (pH 6,5-6,8) в объеме 50 мл(концентрация 400 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Точную навеску Цитохрома С в количестве 75,0 мг (в пересчете на 100% вещество) растворяют в фосфатной буферной смеси (pH 6,5-6,8) в объеме 75,0 мл (концентрация 1,0 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Фосфатидилхолин в количестве 3,6 г и ДПФГ в количестве 1,0 г растворяют в 150 мл смеси хлороформа и этилового спирта (соотношение 4:1) и перемешивают. Растворы ДПФГ и фосфатидилхолина объединяют и фильтруют через мембраны с размером пор 0,22 мкм. Стерильные растворы переносят в колбу ротационного испарителя. Раствор упаривают при 41-45 С до получения тонкой пленки. Пленку обрабатывают газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимают смесью растворов: 135 мл стерильного раствора Цитохрома С (с концентрацией 1 мг/мл) и 45,0 стерильного фосфатного буферного раствора (pH 6,5-6,8). Колбу с раствором перемешивают в течение 2 ч до полного растворения пленки. Эмульсию переносят в гомогенизатор высокого давления и проводят гомогенизацию при температуре 38-44C. Создают давление 900 атм и продолжают гомогенизацию до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляют стерильный раствор лактозы 20 мл (8,0 г). Объем эмульсии 200 мл. Гомогенизацию проводят до размера частиц не более 130-150 нм. Эмульсию фильтруют через каскад фильтров с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 180 мл. Размер частиц после стерилизующей фильтрации 141,6 нм - 93,1%,34,8 нм - 6,9%. Включение Цитохрома С в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 88,88%. Эмульсию разливают во флаконы, лиофилизируют и герметизируют в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 311 нм - 14,5%, 186,7 80,0% , 65 нм - 5,5%; pH - 6,8. Включение Цитохрома С в липосомы не менее 91,2%. Соотношение компонентов в препарате: ДПФГ:фосфатидилхолин - (1 : 3,6); соотношение Цитохром C:фосфолипиды (1:61,33); соотношение фосфолипиды:лактоза (1:1,74). В данном примере показано, что снижение криопротектора лактозы (при соотношении фосфолипиды:лактоза - 1:1,74) приводит к увеличению размера липосом после лиофилизации и гетерогенности продукта. Пример 8. Лактозу в количестве 20,0 г растворили в фосфатной буферной смеси (pH 6,5-6,8) в объеме 50 мл(концентрация 400 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Точную навеску Цитохрома С в количестве 75,0 мг (в пересчете на 100% вещество) растворяют в фосфатной буферной смеси (pH 6,5-6,8) в объеме 75,0 мл (концентрация 1,0 мг/мл). Раствор фильтруют через мембраны с размером пор 0,22 мкм. Фосфатидилхолин в количестве 2,4 г и ДПФГ в количестве 1,0 г растворяют в 150 мл смеси хлороформа и этилового спирта (соотношение 4:1) и перемешивают. Растворы ДПФГ и фосфатидилхолина объединяют и фильтруют через мембраны с размером пор 0,22 мкм. Стерильные растворы переносят в колбу ротационного испарителя. Раствор упаривают при 41-45C до получения тонкой пленки. Пленку обрабатывают газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимают смесью растворов: 135 мл стерильного раствора Цитохрома С (с концентрацией 1 мг/мл) и 10,0 стерильного фосфатного буферного раствора (pH 6,5-6,8). Колбу с раствором перемешивают в течение 2 ч до полного растворения пленки. Эмульсию переносят в гомогенизатор высокого давления и проводят гомогенизацию при температуре 38-44C. Создают давление 900 атм и продолжают гомогенизацию до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляют стерильный раствор лактозы 55 мл (22,0 г). Объем эмульсии 200 мл. Гомогенизацию проводят до размера частиц не более 130-150 нм. Эмульсию фильтруют через каскад фильтров с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 180 мл. Размер частиц после стерилизующей фильтрации 147,2 нм - 90,1%,30,8 нм - 9,9%. Включение Цитохрома С в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 79,48%. Эмульсию разливают во флаконы, лиофилизируют и герметизируют в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 145 нм - 92,5%, 35 нм 7,5%; pH - 6,65. Включение Цитохрома С в липосомы не менее 78,2%. Соотношение компонентов в препарате: ДПФГ:фосфатидилхолин - (1:2,4); соотношение Цитохром C:фосфолипиды - (1:45,33); соотношение фосфолипиды:лактоза (1:6,47). В данном примере показано, что повышение количества криопротектора лактозы (при соотношении фосфолипиды:лактоза - 1:6,47) приводит к снижению включения Цитохрома С в липосомы. Пример 9 (по способу прототипа). Для воспроизводства образцов по методу прототипа первоначально был получен отрицательно заряженный комплекс, выделенный из сои. Получали 100 мл эмульсии липосом. Лецитин сои (1,45 г), холестерин (0,66 г), комплекс отрицательно заряженных липидов (0,264 г) и витамин Е (0,0264 г) в соотношении 55:25:10:1 растворяли в хлороформе. Раствор переносят в колбу ротационного испарителя и упаривают при 41-45C до получения тонкой пленки (2,4 г липидов). Пленку обрабатывают газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимают 100 мл стерильного раствора Цитохрома С (с концентрацией 3 мг/мл). Колбу с раствором перемешивают в течение 2 ч до полного растворения пленки. Соотношение липиды:Цитохром C - 8:1. Затем проводят образование липосом при 22 КГц в течение 10 мин при 0 С. Полученную эмульсию липосом фильтруют. Размер частиц после стерилизующей фильтрации: 196 нм - 91,7%, 68 нм - 8,3%. Включение Цитохрома С в липосомы составляло 52,27%. Пример 10. Исследование фармакокинетики липосомального и нелипосомального Цитохрома С. При однократном инъекционном введении крысам наблюдается быстрое выведение Цитохрома С из плазмы крови с максимальной концентрацией около 96-170 мкг/мл, что согласуется с данными инструкции по медицинскому применению оригинального препарата Цитохрома С. Уровни концентраций в плазме липосомального и нелипосомального Цитохрома С существенно не различались. Наблюдались различия при определении Цитохрома С в печени крыс. Cmax для липосомальной формы составляла около 14,1 мкг/г (Tmax - 1 мин), для нелипосомальной - около 37,9 мкг/г (Tmax - 90 мин). Липосомальный Цитохром С практически полностью выводился из печени к 18 ч в отличие от нелипосомального, который сохраняется в печени к 18 ч после введения на уровне 31,2 мкг/г. Также различия наблюдались для мозга - липосомальный Цитохром С практически не проникал через ГЭБ и обнаруживался в небольших (до 1500 нг/г) не позднее 10 мин после введения. Нелипосомальный Цитохром С обнаруживался в мозге крыс даже спустя 18 ч после введения в диапазоне концентраций 250-3500 нг/г). Схожие фармакокинетические профили наблюдались для почек: для липосомального Цитохрома СCmax составила около 21,6 мкг/г, для нелипосомального - 16,8 мкг/г (Tmax - 1 мин в обоих случаях). Аналогичная, как и для почек, картина наблюдалась и для сердца. Для липосомального Цитохрома С Cmax составила около 10,1 мкг/г, для нелипосомального - 6,3 мкг/г (Tmax - 1 мин в обоих случаях). Таким образом, результаты физико-химических исследований свидетельствуют о том, что продукт,полученный согласно заявленному способу, в составе липидов использует ДПФГ и фосфатидилхолин в соотношении (1:1,2-4,0), эмульгирование проводят в водной среде, содержащей Цитохром C при соотношении фосфолипиды:Цитохром C (29,33-66,66):1, гомогенизацию проводят при давлении 800 атм, добавление криопротектора - лактозы, при соотношении компонентов в препарате: фосфолипиды:криопротектор - (1:3,0-5,5) (см. примеры 1-4), обеспечивают стабильность композиции липосом с включенным в них Цитохромом С. Воспроизведение заявленного способа при изменении параметров(см. примеры 5-8), а также способ согласно прототипу (пример 9) влечет трудности в реализации собственно способа и снижение качества целевого продукта, а именно показано, что оптимальным является соотношение ДПФГ:фосфатидилхолин (1:1,2-4,0); увеличение соотношения до 1:5 (пример 5), как и уменьшение соотношения 0,6:1,0 (пример 6) приводит к значительному снижению включения Цитохрома С в липосомы, размера и неоднородности дисперсионного состава липосом (пример 6); показано, что оптимальным является соотношение фосфолипиды:криопротектор - (1:3,0-5,5); увеличение соотношения фосфолипиды:криопротектор до 1:6,47 (пример 8) приводит к снижению включения Цитохрома С в липосомы; уменьшение соотношения фосфолипиды:криопротектор до 1:1,74 (пример 7) приводит к увеличению размера и неоднородности дисперсионного состава липосом, уменьшению включения Цитохрома С в липосомы и нестабильности размеров липосом (примеры 5-9). Список литературы. 1. Ковалев В.Б., Ковган В.В., Колчина Е.Ю. Механизмы лечебного действия биофлавоноида кверцетина (обзор литературы)// Украшський медичний альманах, 1999, т. 2,4, с. 176-184. 2. Колокольцев А.А. Реаферон ЕС-Липинт липосомальный препарат в терапии больных гриппом и другими острыми респираторными заболеваниями, 2004,1, с. 45-51. 3. Компендиум// Лекарственные препараты. В двух томах. - Морион, 2012. 4. Пасечникова Н.В., Горшкова Р.А., Гайдамака Т.Б. Предварительная оценка противовоспалительного действия препарата "Липофлавон" у пациентов после экстракапсулярной экстракции катаракты// Офтальмологический журнал, 2005,3, с. 23-25. 5. Пасечникова Н.В., Горшкова Р.А. Клинико-биохимическое обоснование применения препарата"Липофлавон" у больных возрастной катарактой после операции экстракции катаракты и имплантации продуктов перекисного окисления// Украинский мед. Альманах, 2006, т. 9,1, с. 219-221. 6. Петруня A.M., Спектор А.В. Оценка эффектов применения препарата Липофлавона в комплексной терапии больных непролиферативной диабетической ретинопатии// Украинский медицинский альманах, 2006,2, с. 36-40.administration of Cytochrome С against selenite cataract formation, J. Pharmacy and Pharmacology, 2009, V. 61,9, р. 1171-1178. ФОРМУЛА ИЗОБРЕТЕНИЯ Способ получения липосомального препарата для офтальмологии, включающий высушивание смеси липидов, ее эмульгирование в водной среде, содержащей Цитохром C, гомогенизацию, добавление в процессе гомогенизации криопротектора при перемешивании до полного растворения и стерилизующую фильтрацию, отличающийся тем, что в качестве липидов используют дипальмитоилфосфатидилглицерин и фосфатидилхолин в соотношении 1:1,2-4,0 соответственно, диспергирование в водной среде, содержащей Цитохром C, ведут при соотношении Цитохром C:липиды - 1:(29,33-66,66) соответственно, гомогенизацию проводят при давлении 600-1200 атм, в качестве криопротектора используют лактозу, а соотношение фосфолипидов и криопротектора в препарате находится в пределах 1:3,0-5,5 соответственно.
МПК / Метки
МПК: A61K 9/127, A61K 47/44, A61P 27/02, A61K 38/00
Метки: липосомальной, формы, способ, получения, цитохрома
Код ссылки
<a href="https://eas.patents.su/10-22183-sposob-polucheniya-liposomalnojj-formy-citohroma-s.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения липосомальной формы цитохрома с</a>
Предыдущий патент: Способ получения липосомальной формы доцетаксела
Следующий патент: Вспениваемые виниловые ароматические полимеры и способ их получения
Случайный патент: Вращающийся асинхронный преобразователь и генераторное устройство