Комбинации, содержащие vx478, зидовудин и/или 1592u89, для применения при лечении вич
Формула / Реферат
1. Комбинация, содержащая тетрагидро-3-фураниловый эфир 3S-[3R*(1R*,2S*)]-[3-[[(4-аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил] карбаминовой кислоты или его физиологически функциональное производное, зидовудин или его физиологически функциональное производное и (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанол или его физиологически функциональное производное.
2. Комбинация по п 1, где соотношение тетрагидро-3-фураниловый эфир 3S-[3R*(1R*,2S*)]-[3-[[(4-аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил] карбаминовой кислоты : зидовудин : (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанол составляет от 1 до 20 : от 1 до 20 : от 1 до 10 по массе.
3. Комбинация по п.1 или 2 для применения в медицинской терапии.
4. Фармацевтический препарат, содержащий комбинацию по п.1 или 2 в сочетании с одним или более чем одним фармацевтически приемлемым носителем для нее.
5. Препарат по п.4 в стандартной лекарственной форме.
6. Применение тетрагидро-3-фуранилового эфира 3S-[3R*(1R*,2S*)]-[3-[[(4-аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил] карбаминовой кислоты в производстве лекарственного средства для введения либо одновременно, либо последовательно с зидовудином и (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанолом для лечения и/или профилактики ВИЧ инфекции.
7. Применение зидовудина в производстве лекарственного средства для введения одновременно или последовательно с тетрагидро-3-фураниловым эфиром 3S-[3R*(1R*,2S*)]-[3-[[(4-аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил] карбаминовой кислоты или (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанолом для лечения ВИЧ инфекции.
8. Применение (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанола в производстве лекарственного средства для введения одновременно или последовательно с тетрагидро-3-фураниловым эфиром 3S-[3R*(1R*,2S*)]-3-[[(4-аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил] карбаминовой кислоты или зидовудином для лечения ВИЧ инфекции.
9. Применение зидовудина, тетрагидро-3-фуранилового эфира 3S-[3R*(1R*,2S*)]-[3-[[(4-аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил] карбаминовой кислоты и (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанола в производстве лекарственного средства для лечения и/или профилактики ВИЧ инфекции.
10. Применение по любому из пп.6-9 для лечения ВИЧ инфекции, резистентной к нуклеозидным или ненуклеозидным ингибиторам.
11. Применение по любому из пп.6-9 при лечении СПИДа.
12. Применение по любому из пп.6-9 при лечении СПИД-ассоциированных состояний или синдрома деменции, обусловленного приобретенным иммунодефицитом.
13. Пакет пациента, содержащий, по меньшей мере, один активный ингредиент, выбранный из тетрагидро-3-фуранилового эфира 3S-[3R*(1R*,2S*)]-[3-[[(4-аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил] карбаминовой кислоты, зидовудина и (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанола, и информационный вкладыш, содержащий указания по применению, по меньшей мере, тетрагидро-3-фуранилового эфира 3S-[3R*(1R*,2S*)]-[3-[[(4-aминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил] карбаминовой кислоты и (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанола вместе в комбинации.
Текст
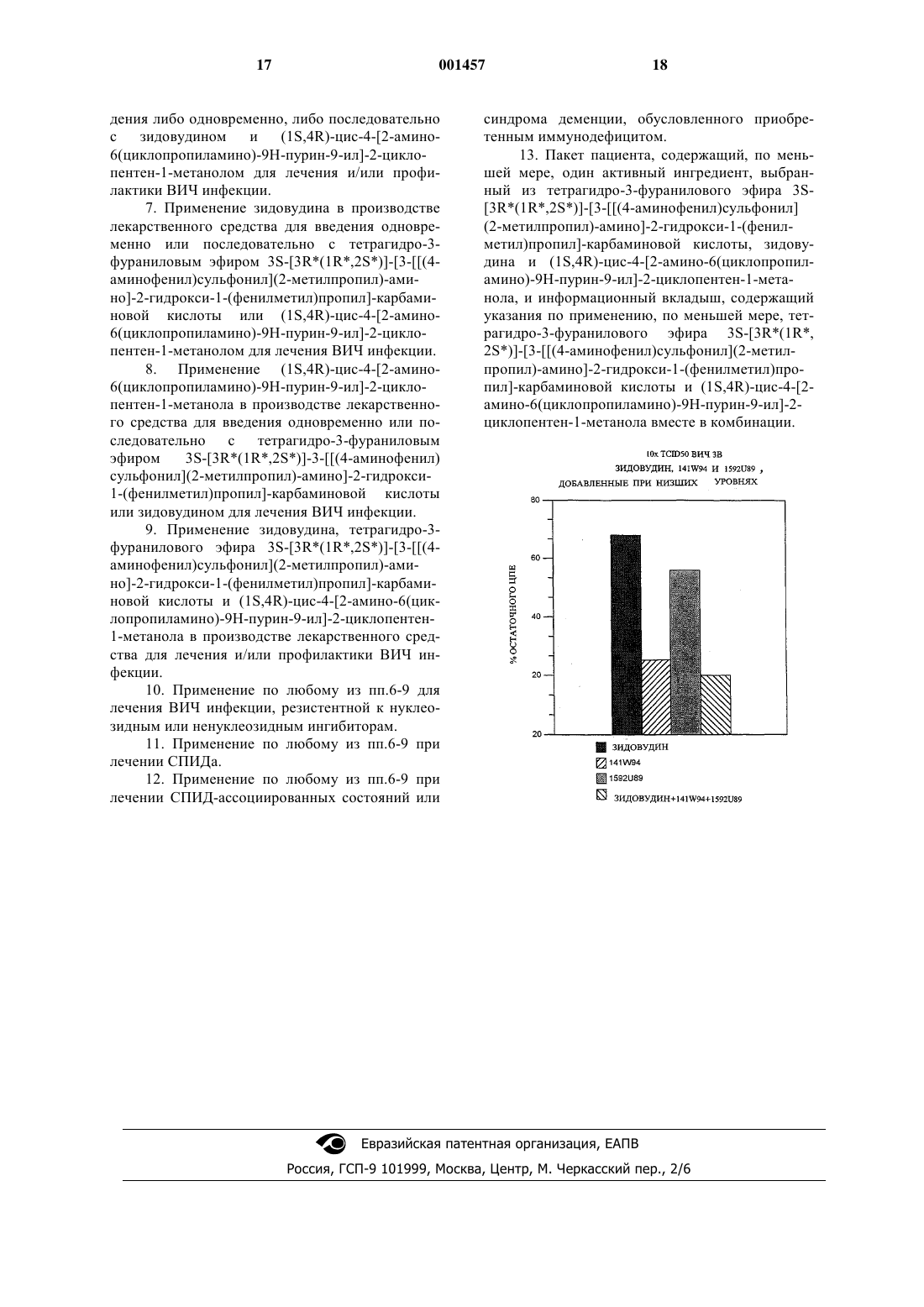
(зидовудина) и (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9 Н-пурин-9-ил]-2-циклопентен-1 метанола (1592U89), которые обладают антиВИЧ активностью. Настоящее изобретение также относится к фармацевтическим композициям,содержащим указанные комбинации, и к их применению при лечении ВИЧ инфекций, включая инфекции ВИЧ мутантов, несущих резистентность к нуклеозидным и/или ненуклеозидным ингибиторам. В настоящее время хорошо доказано, что зидовудин является важным и полезным химиотерапевтическим агентом для лечения и/или профилактики ВИЧ-инфекций, включая связанные с ними клинические состояния, такие как СПИД, пред-СПИД (ARC), синдром деменции,обусловленный приобретенным иммунодефицитом (ADC), а также для лечения пациентов, которые обладают бессимптомной ВИЧ инфекцией или которые являются анти-ВИЧ серопозитивными. Лечение зидовудином продлевает интервал, свободный от заболевания, у бессимтомных пациентов, инфицированных ВИЧ, и задерживает наступление смерти у пациентов с симптомами. В процессе широко распространенного клинического применения зидовудина при лечении таких инфекций и состояний наблюдалось,что в определенных случаях после продолжительного лечения у данного вируса может развиваться определенный уровень резистентности к зидовудину и, следовательно, потеря его чувствительности к лекарственному средству. Терапевтический агент 1592U89 (Описание к Европейскому патенту ЕР 0434450) является многообещающим кандидатом для химиотерапии ВИЧ (International Conference on AntiviralResearch, April 23, 1995), проявляющим сильную активность против ВИЧ, низкую цитотоксичность и отличное проникновение в мозг, что является важным для лечения СПИД и связанных с ВИЧ состояний центральной нервной системы,таких как ADC. 4-Амино-N-2 син,3S)-2-гидрокси-4-фенил 3-S)-тетрагидрофуран-3-илоксикарбониламино)-бутил)-N-изобутилбензолсульфонамид(141W94) представляет собой сульфонамид с ингибиторной активностью против аспартилпротеазы ВИЧ. 141W94 особенно хорошо подходит для ингибирования вирусов ВИЧ-1 и ВИЧ-2. Кодируемые вирусом протеазы, которые являются существенными для репликации вируса, требуются для созревания предшественников вирусных белков. Вмешательство в созревание предшественников белков ингибирует образование инфекционных вирионов. Соответственно ингибиторы вирусных протеаз можно применять для предотвращения или лечения хронических и острых вирусных инфекций. До настоящего времени лечение ВИЧ инфекции в значительной степени основывалось на монотерапии нуклеозидными ингибиторами обратной транскриптазы, такими как зидовудин,диданозин (didanosine) (ddl), залцитабин (zalcitabine) (ddC) и ставудин (stavudine) (d4T). Однако эти лекарственные средства в конечном счете становятся менее эффективными либо вследствие появления резистентных мутантов ВИЧ, либо вследствие токсичности. Следовательно необходимы новые терапии. Комбинация зидовудина либо с ddC, либо сddl показала многообещающие результаты у ВИЧ инфицированных пациентов (New Eng. J.US-B25-1). Однако следует отметить, что эти результаты являются удивительными, поскольку лекарственные средства с одним и тем же сайтом действия часто являются антагонистическими или аддитивными (Rev. Infect. Dis. 1982, 4, 255260). В настоящее время неожиданно обнаружили, что посредством комбинирования 141W94,зидовудина и 1592U89 достигается синергичный анти-ВИЧ эффект. Признаком именно данного изобретения является то, что применение данной комбинации лекарственных средств должно обеспечить синергичные антивирусные эффекты,более полную супрессию вируса, супрессию вируса в течение более длительного периода, ограничить появление резистентных к лекарственному средству мутантов ВИЧ и позволить лучше справляться с токсичностями, связанными с лекарственным средством. По одному аспекту изобретения предлагается комбинация, содержащая 141W94 или его физиологически функциональное производное,зидовудин или его физиологически функциональное производное и 1592U89 или его физиологически функциональное производное. Следует принимать во внимание, что зидовудин может существовать в кето- или енольной таутомерной форме, и применение такой таутомерной формы находится в пределах объема данного изобретения. 1592U89 в норме должен быть представлен по существу свободным от соответствующего энантиомера, т. е. должно присутствовать не более чем примерно 5% мас./мас. соответствующего энантиомера, предпочтительно не более чем примерно 2% мас./мас., конкретно менее чем 1% мас./мас. Термин "физиологически функциональное производное", как он используется здесь, включает в себя любую физиологически приемлемую соль, простой эфир, сложный эфир, соль такого сложного эфира 141W94, зидовудина или 1592U89; либо сольваты любого из них и их физиологически функциональные производные; либо любое другое соединение, которое при введении реципиенту способно давать (прямо или косвенно) такое соединение либо его антивирусно активный метаболит или остаток. Предпочтительные сложные эфиры по изобретению независимо выбраны из следующей группы: (1) эфиры карбоновой кислоты, у которых некарбонильная группировка части карбоновой кислоты эфирной группы выбрана из нормальной или разветвленной цепи алкила (например, метила, н-пропила, трет-бутила или нбутила), циклоалкила, алкоксиалкила (например,метоксиметила), аралкила (например, бензила),арилоксиалкила (например, феноксиметила),арила (например, фенила, возможно замещенного, например, галогеном, С 1-4 алкилом или С 14 алкокси) или амино; (2) эфиры сульфоновых кислот, такие как алкил- или аралкилсульфонил(4) эфиры фосфоновых кислот. У таких сложных эфиров, если не указано иначе, любая присутствующая алкильная группировка предпочтительно содержит от 1 до 18 атомов углерода, конкретно от 1 до 6 атомов углерода, более конкретно от 1 до 4 атомов углерода. Любая циклоалкильная группировка, присутствующая в таких сложных эфирах, предпочтительно содержит от 3 до 6 атомов углерода. Любая арильная группировка, присутствующая в таких сложных эфирах,предпочтительно содержит фенильную группу. Любая ссылка на любое из вышеперечисленных соединений также включает в себя ссылку на его физиологически приемлемую соль. Конкретно предпочтительные сложные эфиры представляют собой моно-, ди- и трифосфатные сложные эфиры зидовудина либо любое другое соединение, которое при введении человеку способно давать (прямо или косвенно) указанный моно-, ди- или трифосфатный сложный эфир. Предпочтительным производным 1592U89 является трифосфатный сложный эфир карбовира. Примеры физиологически приемлемых солей 141W94, зидовудина или 1592U89 и их физиологически приемлемых производных включают в себя соли, полученные из подходящего основания, такие как соли щелочного металла(например, магния), аммония или NX4+ (где X представляет собой С 1-4 алкил). Физиологически приемлемые соли атома водорода или аминогруппы включают в себя соли органических карбоновых кислот, таких как уксусная, молочная, 4 винная, яблочная, изэтионовая, лактобионовая и янтарная кислоты, органических сульфоновых кислот, таких как метансульфоновая, этансульфоновая, бензолсульфоновая и п-толуолсульфоновая кислоты, и неорганических кислот, таких как соляная, серная, фосфорная и сульфаминовая кислоты. Физиологически приемлемые соли соединения гидроксигруппы включают в себя анион указанного соединения в сочетании с подходящим катионом, таким как Na+, NH4+ иNX4+ (где X представляет собой С 1-4 алкильную группу). Для терапевтического применения соли 141W94, зидовудина и 1592U89 должны быть физиологически приемлемыми, т. е. они должны представлять собой соли, полученные из физиологически приемлемой кислоты или основания. Однако соли кислот или оснований, которые не являются физиологически приемлемыми, могут также находить применение, например, в получении или очистке физиологически приемлемого соединения. Все соли, полученные как из физиологически приемлемых, так и не из физиологически приемлемых кислот или оснований, находятся в пределах объема настоящего изобретения. Предпочтительными солями 1592U89 являются соль сукцината и соль гемисульфата. Комбинации 141W94 или его физиологически функционального производного, зидовудина или его физиологически функционального производного и 1592U89 или его физиологически функционального производного в дальнейшем относятся к комбинациям по изобретению. Далее в настоящем изобретении предлагаются комбинации по изобретению для применения при лечении ВИЧ инфекции включая инфекции ВИЧ мутантов, несущих резистентность к нуклеозидным ингибиторам, конкретно к зидовудину, ламивудину, ddl, ddC или d4T либо их комбинациям, и ненуклеозидным ингибиторам,таким как невирапин (Nevirapine) (BI-RG-587),ловирид (Loviride) (-АРА) и делавуридин (Delavuridine) (BHAP). Кроме того, комбинации по изобретению являются особенно полезными для лечения СПИД и связанных с ним клинических состояний, таких как пред-СПИД (ARC), прогрессирующая генерализованная лимфаденопатия (PGL), саркома Капоши, тромбоцитопеническая пурпура, СПИД-ассоциированные неврологические состояния, такие как синдром деменции, обусловленный приобретенным иммунодефицитом, рассеянный склероз или тропический парапарез, а также состояний, анти-ВИЧ и ВИЧсеропозитивных, включая такие состояния у бессимптомных пациентов. В другом аспекте настоящего изобретения предлагается способ лечения ВИЧ инфекции у инфицированного животного, например, у млекопитающего, включая человека, при котором указанное млекопитающее лечат терапевтически эффективным количеством комбинации 141W94, 5 зидовудина и 1592U89 или его физиологически функционального производного. Здесь ссылка на лечение распространяется на профилактику, так же как и на лечение установленных инфекций или симптомов. Следует принимать во внимание, что соединения комбинации можно вводить одновременно, либо в одном и том же фармацевтическом препарате или в различных фармацевтических препаратах, либо последовательно. Если имеет место последовательное введение, задержка во введении второго и третьего активного ингредиента не должна быть такой, чтобы потерять преимущество синергичного терапевтического эффекта комбинации активных ингредиентов. Следует также понимать, что 141W94, зидовудин и 1592U89 или физиологически функциональные производные любого из этих соединений, присутствующие одновременно или последовательно, можно вводить индивидуально или в составах, либо в любой их комбинации. 141W94, зидовудин и 1592U89 предпочтительно вводят одновременно или последовательно в отдельных фармацевтических препаратах, наиболее предпочтительно одновременно. В настоящем изобретении также предлагается применение 141W94 в производстве лекарственного средства для введения одновременно или последовательно с зидовудином и 1592U89 соответственно для лечения и/или профилактики ВИЧ инфекций и ассоциированных клинических состояний, описанных выше. Следует принимать во внимание, что 141W94, зидовудин или 1592U89, либо любую их комбинацию можно применять в производстве вышеуказанного лекарственного средства. Синергичные эффекты комбинации 141W94, зидовудина и 1592U89 или физиологически функционального производного любого из этих соединений наблюдаются в пределах соотношения, например, от 1 до 20: от 1 до 20: от 1 до 10 (по массе), предпочтительно от 1 до 10: от 1 до 10: от 1 до 5 (по массе), конкретно от 1 до 3: от 1 до 3: от 1 до 2 (по массе). Приемлемые соотношения 141W94:зидовудин:1592U89 включают в себя 1,5:1:1, 2:1:1, 3:1:1 и 4:1:1. Приемлемо использовать каждое соединение в комбинации в том количестве, в котором оно проявляет антивирусную активность при применении отдельно. Количество комбинации 141W94, зидовудина и 1592U89, которое требуется, чтобы быть эффективным в качестве анти-ВИЧ агента, разумеется, может варьировать и в конечном счете находится в ведении медицинского профессионала. Факторами, которые следует учитывать,являются путь введения и природа препарата,масса тела животного, возраст и общее состояние и природа и тяжесть заболевания, которое нужно лечить. Как правило, подходящая доза 141W94 для введения человеку может находиться в пределах от 5 до 100 мг/кг массы тела в сутки, лучше в пределах от 8 до 70 мг/кг массы тела в сутки,предпочтительно в пределах от 8 до 50 мг/кг массы тела в сутки. Подходящая доза зидовудина должна находиться в пределах от 3 до 120 мг/кг массы тела реципиента в сутки, предпочтительно в пределах от 6 до 90 мг/кг массы тела в сутки и наиболее предпочтительно в пределах от 10 до 30 мг/кг массы тела в сутки. Как правило, подходящая доза 1592U89 для введения человеку для лечения ВИЧ инфекции может находиться в пределах от 0,1 до 100 мг/кг массы тела реципиента в сутки, предпочтительно в пределах от 0,5 до 50 мг/кг массы тела в сутки и наиболее предпочтительно в пределах от 7 до 30 мг/кг массы тела в сутки. Если не указано иначе, все массы активных ингредиентов вычисляют по существу по лекарственному средству. В случае физиологически функционального производного 141W94, зидовудина, 1592U89 или сольвата любого из них цифры следует увеличить пропорционально. Желаемую дозу предпочтительно представляют как одну субдозу, две, три, четыре, пять, шесть или более чем шесть субдоз, которые вводят через соответствующие интервалы в течение суток. Эти субдозы можно вводить в виде стандартных лекарственных форм, например, содержащих от 1 до 1500 мг, предпочтительно от 5 до 1000 мг,наиболее предпочтительно от 10 до 700 мг активного ингредиента на стандартную лекарственную форму. Альтернативно, если состояние реципиента этого требует, дозу можно вводить путем непрерывной инфузии. Компоненты комбинации, которые можно отнести к активным ингредиентам, можно вводить для терапии животному, например млекопитающему, включая человека, стандартным путем. Хотя возможно вводить активные ингредиенты комбинации в виде сырых химических веществ, предпочтительно представлять их в виде фармацевтического препарата. Фармацевтические препараты по настоящему изобретению содержат комбинацию по изобретению вместе с одним или более чем одним фармацевтически приемлемым носителем или эксципиентом и возможно другими терапевтическими агентами. Носитель (носители) должен быть приемлемым в том смысле, что он должен быть совместимым с другими ингредиентами состава и не должен являться вредным для его реципиента. Когда индивидуальные компоненты комбинации вводят по отдельности, каждый из них, как правило,представляют в виде фармацевтического препарата. В дальнейшем ссылки на препараты относятся, если не указано иначе, к препаратам, содержащим либо комбинацию, либо ее компонент. Комбинацию 141W94, зидовудина и 1592U89 или физиологически функционального производного любого из них приемлемо пред 7 ставлять в виде фармацевтического препарата в стандартизированной лекарственной форме. Приемлемый препарат стандартизированной дозировки содержит активные ингредиенты в количествах от 50 мг до 3 г каждого, например, от 100 мг до 2 г. Возможно также комбинировать любые два из этих активных ингредиентов в стандартизированной лекарственной форме для одновременного или последовательного введения с третьим активным ингредиентом, например, типичная стандартизированная дозировка может содержать от 50 мг до 3 г каждого из соединений 141W94 и зидовудина, предпочтительно от 100 мг до 2 г каждого из соединений 141W94 и зидовудина, или от 50 мг до 3 г каждого из соединений 141W94 и 1592U89, предпочтительно от 100 мг до 2 г каждого из соединений 141W94 и 1592U89. Следующим представленным признаком настоящего изобретения является стандартизированная лекарственная форма, содержащая, по меньшей мере, два активных ингредиента, выбранных из 141W94, зидовудина и 1592U89 или физиологически функциональных производных любого из них и следовательно фармацевтически приемлемый носитель для них. Следует принимать во внимание, что существенной частью изобретения является введение двух активных соединений, выбранных из 141W94, зидовудина и 1592U89, предпочтительно в виде предшественника по отношению к оставшемуся третьему активному ингредиенту,который следует вводить. Комбинации 141W94 и зидовудина, и 141W94 и 1592U89 являются предпочтительными. Кроме того, авторы изобретения обнаружили, что при комбинировании вышеописанных соединений также наблюдается синергичный эффект. Фармацевтические препараты часто прописывают пациенту в виде "пакетов пациента", содержащих полный курс лечения в единой упаковке, обычно в блистерной упаковке. Пакеты пациента имеют преимущество по сравнению с традиционными рецептами, в которых фармацевт выделяет запас фармацевтического препарата для пациента из основного запаса, в том, что пациент всегда имеет доступ к вкладышу упаковки, находящемуся в пакете пациента, который обычно отсутствует в традиционных рецептах. Показано, что включение вкладыша в упаковку улучшает выполнение пациентом инструкций врача и поэтому, как правило, приводит к более успешному лечению. Следует понимать, что дополнительный желательный признак данного изобретения представляет собой назначение комбинации по изобретению посредством единого пакета пациента,либо пакетов пациента для каждого из препаратов, содержащих внутри упаковки вкладыш, ин 8 структирующий пациента по правильному применению изобретения. В дальнейшем аспекте изобретения предлагается двойной или тройной пакет, содержащий,по меньшей мере, один активный ингредиент,141W94, зидовудин или 1592U89, из комбинации по изобретению и информационный вкладыш,содержащий указания по применению комбинации по изобретению. В другом аспекте изобретения предлагается пакет пациента, содержащий в сочетании для отдельного введения 141W94 или его физиологически функциональное производное вместе с,по меньшей мере, одним из соединений, зидовудином или его физиологически функциональным производным и 1592U89 или его физиологически функциональным производным. Препараты включают в себя те, которые являются пригодными для перорального, ректального, назального, местного (включая трансдермальное, трансбуккальное и подъязычное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и внутрикожное) введения. Приемлемо представлять препараты в стандартной лекарственной форме,и их можно изготавливать любыми способами,хорошо известными специалистам в фармации. Такие способы представляют следующий признак настоящего изобретения и включают в себя стадию, на которой приводят в контакт активные ингредиенты с носителем, который составляет один или более чем один вспомогательный ингредиент. Как правило, препараты изготовляют посредством тесного и однородного приведения в контакт активных ингредиентов либо с жидкими носителями, либо с тонко измельченными твердыми носителями, либо с теми и другими, а затем, если это необходимо, посредством придания формы продукту. Препараты по настоящему изобретению,пригодные для перорального введения, можно представлять в виде дискретных единиц, таких как капсулы, каплетки, крахмальные облатки или таблетки, каждая из которых содержит предопределенное количество активных ингредиентов в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости; либо в виде жидкой эмульсии типа масло-в-воде или жидкой эмульсии типа вода-в-масле. Активный ингредиент также можно представлять в виде болюса, электуария или пасты. Таблетку можно производить посредством прессования или формования, возможно с одним или более чем одним вспомогательным ингредиентом. Прессованные таблетки можно изготовлять посредством прессования в подходящем аппарате активных ингредиентов в свободно текучей форме, такой как порошок или гранулы,возможно смешанных со связывающим веществом (например, повидоном, желатином, гидроксипропилметилцеллюлозой),смазывающим веществом, инертным разбавителем, консерван 9 том, разрыхлителем (например, крахмальным гликолятом натрия, поперечно-связанным повидоном, поперечно-связанной натрийкарбоксиметилцеллюлозой), поверхностно-активным или диспергирующим агентом. Формованные таблетки можно производить посредством формования смеси порошкообразного соединения,смоченного инертным жидким разбавителем, в подходящем аппарате. Таблетки возможно могут быть покрыты оболочкой или сделаны с маркировкой, и их можно изготовлять так, чтобы обеспечить медленное или регулируемое высвобождение активных ингредиентов при применении,например, с гидроксиметилцеллюлозой в варьирующих долях для обеспечения желаемого профиля высвобождения. Таблетки возможно могут быть снабжены энтеросолюбильной оболочкой,чтобы обеспечить высвобождение в частях кишечника, иных, чем желудок. Препараты, пригодные для местного введения в рот, включают в себя лепешки, содержащие активные ингредиенты в корригентной основе, обычно сахарозе и аравийской камеди или трагаканте; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин, или сахароза и аравийская камедь; и жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе. Препараты для ректального введения можно представлять в виде суппозитория с подходящей основой, содержащей, например, масло какао или салицилат. Местное введение можно также осуществлять посредством трансдермального ионофоретического аппарата. Препараты, пригодные для вагинального введения, можно представлять в виде пессариев, тампонов, кремов, гелей, паст, пен или аэрозольных препаратов, содержащих в дополнение к активному ингредиенту такие носители, которые по мнению специалистов являются подходящими. Фармацевтические препараты, пригодные для ректального введения, где носитель представляет собой твердое вещество, наиболее предпочтительно представлять в виде суппозиториев стандартной дозы. Подходящие носители включают в себя масло какао и другие материалы, обычно применяемые специалистами. Суппозитории приемлемо формировать посредством смешивания активной комбинации с размягченным или растопленным носителем (носителями) с последующим охлаждением и формованием в формах. Препараты, пригодные для парентерального введения, включают в себя водные и неводные изотонические стерильные растворы для инъекций,которые могут содержать антиоксиданты, буферы,бактериостатические факторы и растворенные вещества, которые делают препарат изотоничным крови реципиента, которому он предназначен; водные и неводные стерильные суспензии, которые могут включать в себя суспендирующие агенты и загущающие агенты; и липосомы или другие системы микрочастиц, которые разработаны так, чтобы доставлять соединения к компонентам крови либо к одному или более чем одному органу. Препараты можно представлять в запаянных контейнерах, содержащих однократную дозу или множественные дозы, например, в ампулах и флаконах, и можно хранить их в лиофилизированном состоянии, что требует только добавления стерильного жидкого носителя, например воды для инъекций,немедленно перед применением. Неподготовленные растворы для инъекций и суспензии можно приготовить из стерильных порошков, гранул и таблеток описанного ранее типа. Предпочтительными препаратами стандартной дозировки являются те, которые содержат суточную дозу или суточную субдозу активных ингредиентов, как описано ранее, или ее соответствующую часть. Следует понимать, что в дополнение к ингредиентам, конкретно упомянутым выше, препараты по данному изобретению могут включать в себя другие агенты, приемлемые из уровня техники, с учетом типа интересующего препарата, например, препараты, пригодные для перорального применения, могут включать в себя такие дополнительные агенты, как подсластители, загустители и корригенты. Соединения комбинации по настоящему изобретению можно получить стандартным способом. Например, зидовудин можно получить,как описано в патенте США 4724232, включенном здесь путем ссылки. Зидовудин можно также получить от Aldrich Chemical Co., Milwaukee, WI53233, USA. 141W94 можно получить, как описано в РСТ/WO 94/05639, которая включена здесь путем ссылки. 1592U89 можно получить посредством способа, описанного в описании к Европейскому патенту ЕР 0434450 или в РСТ заявке PCT/GB 4500225, которые включены здесь путем ссылки. Следующие примеры предназначены только для иллюстрации, но не предназначены, чтобы каким-либо образом ограничивать объем изобретения. "Активный ингредиент" означает 141W94, зидовудин, 1592U89 либо их составы,либо физиологически функциональное производное любого из вышеупомянутых соединений. Пример 1. Препарат в таблетках. Следующие препараты А, Б и В изготовляют посредством влажного гранулирования ингредиентов с раствором повидона с последующим добавлением стеарата магния и прессованием. Препарат А Активный ингредиент Лактоза В.Р. (Британская фармакопея) Повидон В.Р. Крахмальный гликолят натрия Препарат Б Активный ингредиент Лактоза В.Р.Avicel PH 101 Повидон В.Р. Крахмальный гликолят натрия Стеарат магния Пример 2. Препараты в форме капсул. Препарат А Препарат в форме капсул изготовляют посредством смешивания ингредиентов препарата Г из примера 1 выше и заполнения ими твердой желатиновой капсулы из двух частей. Препарат Б(ниже) изготовляют подобным способом. Препарат Б Активный ингредиент Лактоза В.Р. Крахмальный гликолят натрия Стеарат магния Активный ингредиент Лактоза В.Р. Крахмал Повидон Стеарат магния Следующие препараты Г и Д изготовляют посредством прямого прессования смешанных ингредиентов. Лактоза в препарате Д получена посредством прямого прессования (Dairy Crest"Zeparox"). Препарат Г Активный ингредиент Прежелатинизированный Активный ингредиент Лактоза В.Р. Препарат Е (препарат с регулируемым высвобождением). Препарат изготовляют посредством влажного гранулирования ингредиентов с раствором повидона с последующим добавлением стеарата магния и прессованием. Препарат Е Активный ингредиент Гидроксипропилметилцеллюлоза Высвобождение лекарственного средства имеет место в течение периода примерно в 6-8 ч и завершается через 12 ч. Капсулы препарата В изготовляют посредством плавления Macrogel 4000 В.Р., диспергирования активного ингредиента в расплаве и заполнения расплавом твердой желатиновой капсулы из двух частей. Препарат Г Активный ингредиент Лецитин Арахисовое масло Капсулы препарата Г изготовляют посредством диспергирования активного ингредиента в лецитине и арахисовом масле и заполнения дисперсией мягких, эластичных желатиновых капсул. Препарат Д Активный ингредиент Витамин Е TPGS Полиэтиленгликоль 400 NF Пропиленгликоль USPTPGS (полученного от Eastman Chemical Co.) нагревали при 50 С, пока он не становился разжиженным. К разжиженному витамину Е TPGS добавляли 2,005 кг полиэтиленгликоля 400 (ПЭГ 400) (низший альдегид, 10 млн-1, получен отUnion Carbide или Dow Chemical Co.), нагретого до 50 С, и смешивали до образования гомогенного раствора. Полученный раствор нагревали до 65 С. 1,5 кг активного ингредиента растворяли в разжиженном растворе витамина Е TPGS и ПЭГ 400. Добавляли 0,395 кг пропиленгликоля комнатной температуры и смешивали до образования гомогенного раствора. Раствор охлаждали до 28-35 С. Затем раствор дегазировали. Смесь ин 13 капсулировали предпочтительно при 28-35 С при достаточном массовом эквиваленте до 150 мг свободного от летучих веществ соединения, в продолговатые размера 12, белые непрозрачные мягкие желатиновые капсулы с использованием аппарата для заполнения капсул. Оболочки капсул высушивали до постоянной достаточной влажности 3-6% воды и твердости оболочки 7-10 Ньютон и помещали в подходящий контейнер. Препарат Е (капсула с регулируемым высвобождением). Следующий препарат в капсулах с регулируемым высвобождением изготавливали посредством экструдирования ингредиентов а, б и в с использованием экструдера с последующим приданием экструдату сферической формы и высушивания. Высушенные шарики затем покрывали мембраной, регулирующей высвобождение (г), и заполняли ими твердую желатиновую капсулу из двух частей. рами и герметизируют в стерильные 3 мл флаконы желтого стекла (тип 1). Пример 5. Сироп. Активный ингредиент 250 мг Раствор сорбита 1,50 г Глицерин 2,00 г Бензоат натрия 0,005 г Корригент Персик 17.42.3169 0,0125 мл Очищенная вода, сколько необходимо до 5,00 мл Активный ингредиент растворяют в смеси глицерина и большей части очищенной воды. Затем добавляют водный раствор бензоата натрия с последующим добавлением раствора сорбита и, наконец, корригента. Объем доводят очищенной водой и хорошо перемешивают. Пример 6. Суппозиторий. Активный ингредиент Твердый жир, В.P. (Witepsol H15Dynamit Nobel) Пример 3. Препарат для инъекций. Препарат А мг Активный ингредиент 200 Раствор соляной кислоты 0,1 М или Раствор гидроксида натрия 0,1 М,Сколько необходимо до рН от 4,0 до 7,0 Стерильная вода, сколько необходимо до 10 мл Активный ингредиент растворяют в большей части воды (35-40 С) и доводят рН до значения между 4,0 и 7,0 соляной кислотой или гидроксидом натрия соответственно. Затем объем смеси доводят водой и фильтруют через стерильный фильтр с микропорами в стерильный 10 мл флакон желтого стекла (тип 1) и герметизируют стерильными крышками и верхним изолирующим слоем. Препарат Б Активный ингредиент Стерильный апирогенный, рН 7, фосфатный буфер, сколько необходимо до Пример 4. Внутримышечная инъекция Активный ингредиент Бензиловый спирт Гликофурол 75 Вода для инъекций, сколько необходимо до Активный ингредиент растворяют в гликофуроле. Затем добавляют бензиловый спирт, растворяют и добавляют воду до 3 мл. Затем смесь фильтруют через стерильный фильтр с микропо 1770 Одну пятнадцатую Witepsol H15 плавят в котле с паровой рубашкой при максимуме 45 С. Активный ингредиент просеивают через 200 мкм сито и добавляют к расплавленной основе с перемешиванием с использованием Silverson,снабженного режущей головкой, до достижения ровной дисперсии. Поддерживая смесь при 45 С,к суспензии добавляют оставшийся Witepsol H15 и перемешивают до получения однородной смеси. Всю суспензию пропускают через 250 мкм сетку из нержавеющей стали и дают остыть до 45 С при непрерывном перемешивании. При температуре от 38 до 40 С подходящие 2 мл пластмассовые формы заполняют 2,02 г смеси. Суппозиториям дают остыть до комнатной температуры. Пример 7. Пессарии. Активный ингредиент Безводная декстроза Картофельный крахмал Стеарат магния Вышеуказанные ингредиенты смешивают непосредственно и изготавливают пессарии посредством прямого прессования полученной смеси. Результаты биологического теста. Высшие и низшие плазменные уровни. Высшие и низшие значения концентраций в микромолях, использованные в данном исследовании, взяты из определенных клинически высших и низших плазменных уровней. Эти значения должны были отражать действительные высшие и низшие плазменные уровни, достигнутые у пациентов при применении терапевтиче 15 ских доз каждого лекарства в качестве единственного агента. Антивирусная активность по отдельности и в комбинации. Анти-ВИЧ анализ. Клеточную линию МТ 4,трансформированную лимфотропным вирусом Т-клеток человека типа 1, выращивали и инфицировали штаммом 3 В или штаммом MN ВИЧ-1(Advanced Biotechnologies Inc., Columbia, Maryland) в 10-кратном количестве, необходимом,чтобы вызывать 50% снижение роста клеток МТ 4 (10 х TCID50, 2x104 колониеобразующих единиц на клетку), если не указано иначе. Готовили также ложно инфицированные клетки. После 1 ч инкубации клетки раскапывали на 96 луночные платы по 12x104 клеток на лунку. Лунки содержали различные концентрации зидовудина и высшие и низшие плазменные уровни 141W94 и 1592U89. Инфицированные Тлимфобластоидные клетки инкубировали в течение 5 дней, чтобы получить ВИЧ-1 опосредованное ингибирование роста. Затем платы обрабатывали 28 мкл 5% Nonidet P-40 (Sigma) в забуференном фосфатом физиологическом растворе (ФСБ), и 60 мкл образцы переносили в 96-луночные платы с фильтром на дне (Idexx Corp.). Платы помещали в автоматический аппарат для анализа (Idexx Screen Machine), который добавлял пропидиумиодид в каждую лунку, осуществлял серию отмывок и определял итоговую флуоресценцию (Е). Показано,что флуоресценция прямо коррелирует с количеством клеток, что позволяет вычислить ВИЧ-1 опосредованный цитопатический эффект (ЦПЕ). Определили, что неинфицированные клетки обладали 0% ЦПЕ, а инфицированные необработанные клетки обладали 100% ЦПЕ. Определяли процент ингибирования ВИЧ-1-индуцированного ЦПЕ и IC95s (95% ингибирующую концентрацию). На фиг. 1 графически показаны результаты для комбинации 141W94 (0,1 мкМ), зидовудина(0,06 мкМ) и 1592U89 (0,35 мкМ) в сравнении с 141W94, зидовудином и 1592U89 по отдельности. Двойные комбинации: 141W94 и 1592U89. Тройные in vitro матрицы доза-ответ получали с использованием МТ 2-клеток, инфицированных ВИЧ-1 штамма IIIB. Чтобы оценить эффекты связывания белков, среду для культуры ткани с 10% фетальной сывороткой теленка снабжали сывороточными белками человека - 1 кислым гликопротеином (1 мг/мл) и альбуминомII. Как проанализировали относительно модели Блисса (Bliss) независимости системы отсчета нуля, данная комбинация являлась синергичной со значениями синергичности, превышающими 100 (99% доверительный интервал). Анализ серии данных с использованием полной параметрической формы уравнения для вычисления взаимодействия с лекарством, разработанногоGreco et al., также показал синергичность. Параметры с 95% доверительными интервалами приведены ниже: ЕС 50 представляет собой половинную концентрацию максимального ответа, m - коэффициент отклонения. Альфа - коэффициент синергичности. Положительный альфа 95% Cl не включающий 0,0, демонстрирует статистически значимую синергичность. Оба способа совпадают в том, что данная комбинация является значимо синергичной. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Комбинация, содержащая тетрагидро-3 фураниловый эфир 3S-[3R(1R,2S)]-[3-(4 аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил]-карбаминовой кислоты или его физиологически функциональное производное, зидовудин или его физиологически функциональное производное и(1S,4R)-цис-4-[2-амино-6(циклопропиламино)9 Н-пурин-9-ил]-2-циклопентен-1-метанол или его физиологически функциональное производное. 2. Комбинация по п 1, где соотношение тетрагидро-3-фураниловый эфир 3S-[3R(1R,2S)]-[3-(4-аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил]-карбаминовой кислоты : зидовудин : (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9 Нпурин-9-ил]-2-циклопентен-1-метанол составляет от 1 до 20 : от 1 до 20 : от 1 до 10 по массе. 3. Комбинация по п.1 или 2 для применения в медицинской терапии. 4. Фармацевтический препарат, содержащий комбинацию по п.1 или 2 в сочетании с одним или более чем одним фармацевтически приемлемым носителем для нее. 5. Препарат по п.4 в стандартной лекарственной форме. 6. Применение тетрагидро-3-фуранилового эфира 3S-[3R(1R,2S)]-[3-(4-аминофенил) сульфонил](2-метилпропил)-амино]-2-гидрокси 1-(фенилметил)пропил]-карбаминовой кислоты в производстве лекарственного средства для вве 17 дения либо одновременно, либо последовательно с зидовудином и (1S,4R)-цис-4-[2-амино 6(циклопропиламино)-9 Н-пурин-9-ил]-2-циклопентен-1-метанолом для лечения и/или профилактики ВИЧ инфекции. 7. Применение зидовудина в производстве лекарственного средства для введения одновременно или последовательно с тетрагидро-3 фураниловым эфиром 3S-[3R(1R,2S)]-[3-(4 аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил]-карбаминовой кислоты или (1S,4R)-цис-4-[2-амино 6(циклопропиламино)-9 Н-пурин-9-ил]-2-циклопентен-1-метанолом для лечения ВИЧ инфекции. 8. Применение (1S,4R)-цис-4-[2-амино 6(циклопропиламино)-9 Н-пурин-9-ил]-2-циклопентен-1-метанола в производстве лекарственного средства для введения одновременно или последовательно с тетрагидро-3-фураниловым эфиром 3S-[3R(1R,2S)]-3-(4-аминофенил) сульфонил](2-метилпропил)-амино]-2-гидрокси 1-(фенилметил)пропил]-карбаминовой кислоты или зидовудином для лечения ВИЧ инфекции. 9. Применение зидовудина, тетрагидро-3 фуранилового эфира 3S-[3R(1R,2S)]-[3-(4 аминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил]-карбаминовой кислоты и (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9 Н-пурин-9-ил]-2-циклопентен 1-метанола в производстве лекарственного средства для лечения и/или профилактики ВИЧ инфекции. 10. Применение по любому из пп.6-9 для лечения ВИЧ инфекции, резистентной к нуклеозидным или ненуклеозидным ингибиторам. 11. Применение по любому из пп.6-9 при лечении СПИДа. 12. Применение по любому из пп.6-9 при лечении СПИД-ассоциированных состояний или(2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил]-карбаминовой кислоты, зидовудина и (1S,4R)-цис-4-[2-амино-6(циклопропиламино)-9 Н-пурин-9-ил]-2-циклопентен-1-метанола, и информационный вкладыш, содержащий указания по применению, по меньшей мере, тетрагидро-3-фуранилового эфира 3S-[3R(1R,2S)]-[3-(4-aминофенил)сульфонил](2-метилпропил)-амино]-2-гидрокси-1-(фенилметил)пропил]-карбаминовой кислоты и (1S,4R)-цис-4-[2 амино-6(циклопропиламино)-9 Н-пурин-9-ил]-2 циклопентен-1-метанола вместе в комбинации.
МПК / Метки
МПК: A61K 31/34
Метки: содержащие, лечении, применения, зидовудин, 1592u89, вич, vx478, комбинации
Код ссылки
<a href="https://eas.patents.su/10-1457-kombinacii-soderzhashhie-vx478-zidovudin-i-ili-1592u89-dlya-primeneniya-pri-lechenii-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинации, содержащие vx478, зидовудин и/или 1592u89, для применения при лечении вич</a>
Предыдущий патент: Твердые смеси циклодекстринов, полученные путем экструзии в расплаве
Следующий патент: Биопрепарат, преимущественно для очистки нефтеналивных ёмкостей, оборудования и водопочвенных экосистем от нефтезагрязнений
Случайный патент: Ценный документ, способ изготовления контрольного элемента и способ обнаружения загрязнения или истирания документа