Применение фармацевтической композиции, содержащей цинк-гиалуроновый комплекс, для предотвращения и лечения цистита, способ и набор
Номер патента: 25141
Опубликовано: 30.11.2016
Авторы: Шеньи Лайош, Форрай Габорне, Секей Акошне, Фурка Беата, Ловас Шандор, Роденне Юхас Мария
Формула / Реферат
1. Применение фармацевтической композиции, содержащей цинк-гиалуроновый комплекс для предотвращения и лечения цистита.
2. Применение по п.1 для лечения интерстициального цистита, бактериального цистита, радиационного цистита или химического цистита.
3. Применение по пп.1, 2, при котором фармацевтическая композиция находится в форме раствора.
4. Применение по п.3, при котором концентрация цинк-гиалуронового комплекса в растворе равна 0,01-5,0 мг/мл.
5. Применение цинк-гиалуронового комплекса в производстве медикамента для лечения и предотвращения цистита у млекопитающих.
6. Способ лечения и предотвращения цистита у млекопитающих путем введения фармацевтической композиции в форме раствора, содержащей цинк-гиалуроновый комплекс, в концентрации 0,01-5,0 мг/мл.
7. Способ по п.6, в котором композицию вводят внутрипузырно в мочевой пузырь, после чего осуществляют баллонное расширение пузыря, причем эта фармацевтическая композиция находится в форме раствора, где концентрация цинк-гиалуронового комплекса равна 0,01-5,0 мг/мл.
8. Набор для предотвращения и лечения цистита, содержащий фармацевтическую композицию, охарактеризованную в п.1, и катетер, пригодный для внутрипузырного введения.
9. Набор по п.8, характеризующийся тем, что он содержит баллон, предназначенный для расширения пузыря.
Текст
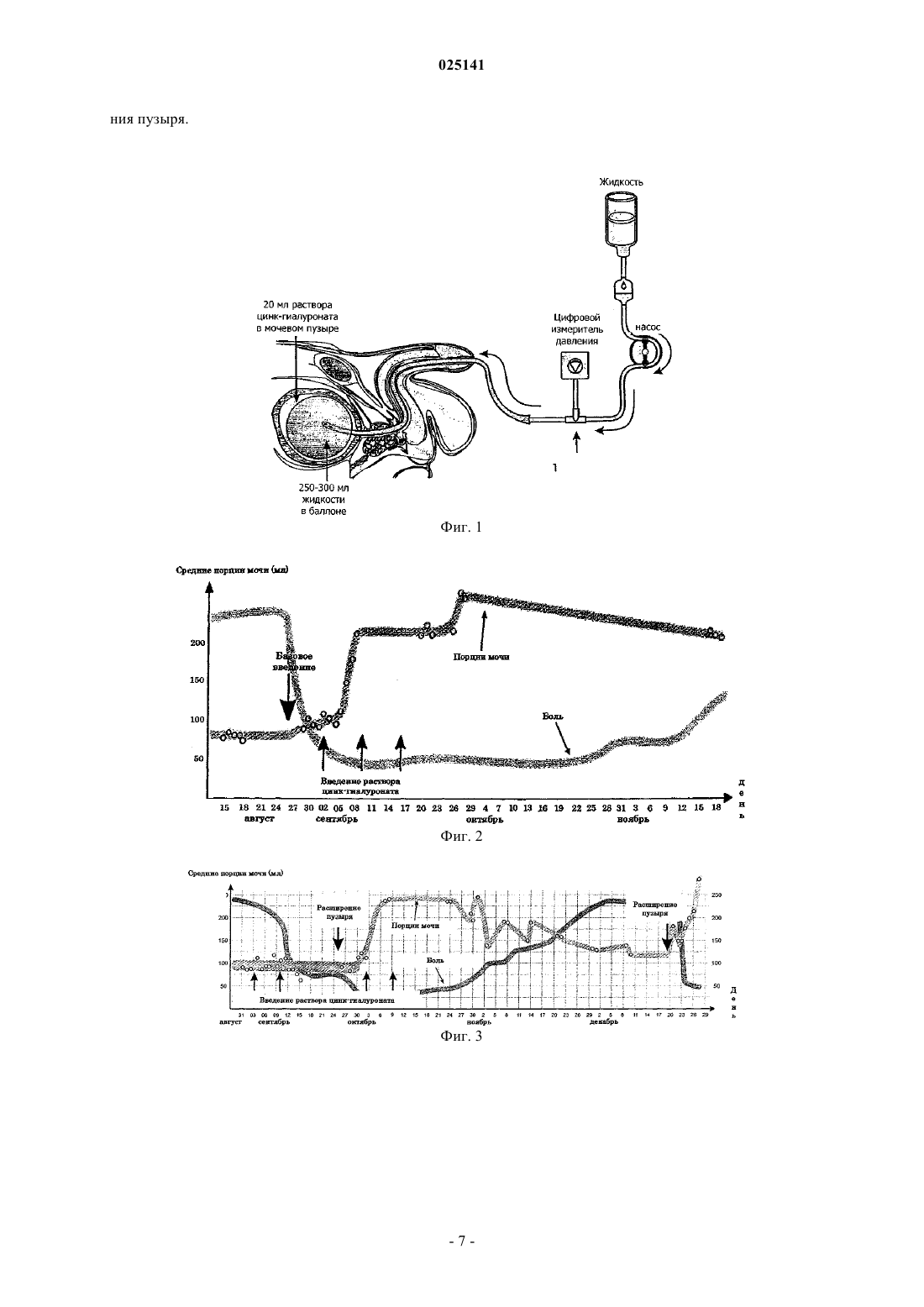
Изобретение относится к применению фармацевтической композиции, которая включает цинкгиалуроновый комплекс в качестве активного ингредиента, а также фармацевтически приемлемый переносчик и наполнитель для предотвращения и лечения цистита. В рамках изобретения находятся также терапевтическое применение указанной композиции для лечения и предотвращения цистита заболевания, связанного с аномалиями и дефицитом слоя глюкозоаминогликана в мочеполовой системе млекопитающих, и набор, содержащий раствор гиалуроната цинка, катетер, пригодный для внутрипузырного введения, и в некоторых случаях баллон для расширения мочевого пузыря. Область техники, к которой относится изобретение Изобретение относится к применению фармацевтических композиций, которые включают цинкгиалуроновый комплекс в качестве активного ингредиента, а также фармацевтически приемлемый носитель и/или наполнитель. В рамках изобретения находятся также терапевтическое применение указанных композиций для лечения и предотвращения цистита - заболевания, связанного с аномалиями и дефицитом слоя глюкозоаминогликана (GAG) в мочеполовой системе млекопитающих, и набор, содержащий раствор гиалуроната цинка, катетер, пригодный для внутрипузырного введения, и, при необходимости,баллон для расширения мочевого пузыря. Предшествующий уровень техники Гиалуроновая кислота (HA) - гомополимер типа глюкозоаминогликана, состоящий из повторяющихся единиц дисахаридов N-ацетилглюкозамин-глюкурониевой кислоты формулы (I) В HA моносахариды имеют связь (13), а дисахаридные единицы связаны через (14), образуя,таким образом, линейный полисахарид с чередующимися связями (13) и (14). В живых организмах HA находится в виде солей, обычно содержащих натрий в качестве катиона, и ее молекулярный вес может находиться в интервале от 10-20 кДа до нескольких тысяч кДа. Присутствие карбоксильной группы в глюкурониевой части HA и карбониловые и аминогруппы в N-ацетиловой группе глюкозамина, так же как присутствие гидроксильных групп, облегчает образование нескольких водородных мостиков. Благодаря этим внутримолекулярным водородным связям, образованным в результате взаимодействий между HA и присутствующей в биологических системах водой, HA имеет усложненную трехмерную структуру (С.L. Hew et al., Eur. J. Biochem. 203, 33-42 (1992); Q. Liu et al., J. Am.Chem. Soc. 118, 12276-12286 (1996). Вследствие исключительной способности связывать воду даже относительно разбавленные водные растворы HA обладают высокой вязкостью. В водных растворах ее реологические свойства сильно зависят от размера молекулы, например, в 1% водном растворе HA с молекулярным весом 1000 кДа имеет вязкость 3000 мПа, в то время как HA с молекулярным весом 4000 кДа в той же концентрации имеет вязкость 400000 мПа (H.В. Wik and О. Wik: Rheology ofHialuronan, The Chemistry, Biology and Medical Applications of Hialuronan and its Derivatives (ed. Т.С. Laurent), p. 25-32. Portland Press, London (1998. Соответственно, две важнейшие физические характеристики HA - это ее вязкость и молекулярный вес. Будучи основной компонентой внеклеточного матрикса, HA присутствует во всех частях организма. Определенные органы и ткани (соединительные ткани, кожа, синовиальная жидкость, стекловидное тело и стенки кровеносных сосудов) содержат HA в значительном количестве. Долгое время считали, что биологическая роль HA определяется ее физическими свойствами. Например, она может обеспечивать защиту связок вследствие ее реологических свойств. Благодаря исключительной способности связывать воду HA может контролировать водный баланс с помощью осмотического давления и сопротивления потоку. HA также играет важную роль, заполняя интерстициальную ткань и защищая клетки от различных физических воздействий. Последние исследования показали, что взаимодействие между HA и определенными макромолекулами в организме можно соотнести с некоторыми физиологическими процессами. Примерами таких макромолекул являются протеогликаны (агрекан, версикан, бревикани т.д.), расположенные во внеклеточном матриксе, основная задача которых заполнить пространство между клетками и облегчить транспорт материала. Макромолекулы, вступающие во взаимодействие с HA, могут быть внутриклеточными трансмембранными белками (CD44, RHAMM), а также рецепторными белками, присутствующими в цитоплазме (C1q, P-32, TSG-6 и т.д.). Для всех упомянутых выше белков HA играет важную роль в некоторых регуляторных процессах, происходящих на уровне клетки или организма. Молекулярный размер и концентрация HA в водном растворе, как и физические свойства, оказывают значительное влияние на ее биологический эффект. Так, в зависимости от размера молекулы HA может оказывать как положительный, так и отрицательный эффекты на одни и те же клеточные процессы. Аналогичное изменение эффекта наблюдалось, когда изменялась концентрация HA в растворе. Желаемый оптимальный эффект может быть очевидно достигнут, если оба параметра принимаются во внимание одновременно (Е.A. Balazs, The Chemistry, Biology and Medical Applications of Hialuronan and itsDerivatives (ed. Т.С. Laurent), p. 185-204. Portland Press, London (1998. Поскольку HA участвует в упомянутых выше физиологических процессах, она может успешно использоваться в некоторых областях терапии (заживление ран, лечение хронического воспаления, оф-1 025141 тальмическая хирургия). Область применения HA для терапии у людей, кроме вышеперечисленных, может быть расширена путем химической модификации структуры. В этом отношении известны два направления. Согласно одному из них, между двумя разделенными позициями в молекуле HA создают поперечные связи с помощью алифатического соединения (как правило, дигидразина) для образования гидрогеля. Поперечные связи вызывают увеличение вязкоэластичности химически модифицированной HA, приводя к большему сопротивлению эффектам деградации, происходящей в организме. Это способствует лечению пациентов с ревматоидным артритом, восстанавливая синовиальную жидкость, или препятствует послеоперационной адгезии. Другая важная стратегия заключается в том, что активные агенты, которые плохо адсорбируются или должны специфически доставляться к месту их действия, химически связывают с HA (например, таксол, пилокарпин, инсулин). В этих случаях HA вызывает улучшенную адсорбцию связанных с ней активных агентов и способствует их специфической доставке к желаемому месту-мишени, соответственно. Комплексы HA, образованные с цинком и кобальтом, описаны в EP 413016 (Burger et al., 1989), и из этих двух комплексов цинк-HA используют в качестве активного агента в композициях для лечения ран. Дальнейшие исследования активного агента показали, что благодаря присутствию цинка могут быть расширены возможности терапевтического применения, поскольку комплекс с цинком оказывает новые или более выраженные эффекты по сравнению с солью натрий-HA (J. Ills et al., Acta Pharm. Hung. 72,15-24 (2002. Среди прочих, такими эффектами являются повышенная антиоксидантная активность цинк-HA (Gy. Т. Balogh et al., Arch. Biochem. Biophys. 410, 76-82 (2003; ингибиторное действие на ферменты, повреждающие ткань (металлопротеиназы матрикса, особенно MMP-9), которые образуются в повышенном количестве инвазивными клетками, в то время как соль натрий-HA не оказывает такого эффекта (WO 00/53194, Ills et al., 1999). Гастропротекторный эффект (лечение пептической язвы) цинкHA описан в опубликованной международной патентной заявке WO 98/48815, антимикробный эффект активного агента цинк-HA описан в опубликованной международной патентной заявке WO 98/10773. Слой глюкозаминогликана (GAG), содержащего большое количество гиалуроновой кислоты, выстилает внутреннюю поверхность мочевого пузыря. Этот слой GAG с высокой вязкостью и высокой гидрофильностью защищает эпителий пузыря от раздражений под действием мочи, содержащей, не ограничиваясь ими, микроорганизмы, патогены, микрокристаллы, белки, кальций, мочевину и канцерогены. При повреждении слоя GAG эпителий мочевого пузыря становится проницаемым для раздражителей, содержащихся в моче. Это вызывает немедленную боль, а также является началом процессов деградации. Повреждение защитного барьера увеличивает риск развития инфекционных и опухолевых заболеваний. Деформация слоя GAG может быть доказана с помощью биопсии. Следующие заболевания могут быть связаны с повреждением слоя GAG: интерстициальный цистит,хронический рекуррентный бактериальный и небактериальный цистит,радиационный цистит и химический цистит. Интерстициальный цистит - это состояние, которое приводит к постоянно возобновляемому дискомфорту или боли в пузыре и окружающей области таза. Симптомы включают также необходимость мочеиспускания и повышенную частоту мочеиспускания. В то же время не может быть доказано бактериальное загрязнение. Индивидуумы с интерстициальным циститом могут в значительной степени терять работоспособность, а индивидуумам с прогрессирующим интерстициальным циститом для нормального функционирования может потребоваться большая операция. Хотя этиология интерстициального цистита остается необъясненной, было сделано предположение, что первичным дефектом может быть недостаток слоя GAG. Поскольку симптомы аналогичны симптомам при других заболеваниях мочевой системы, диагностика интерстициального цистита может быть очень сложной и в большинстве случаев занимает большое время (5-8 лет). Радиационный цистит и химический цистит могут возникнуть после радиационной и химической терапии опухолей в органах таза (простата, мочевой пузырь, матка, яичники, влагалище, толстая кишка,прямая кишка). Один из основных эффектов радиотерапии - повреждение эпителия мочевого пузыря. Длительность заболевания составляет обычно от 3 до 6 месяцев, но она может равняться 24 месяцам или больше. В наиболее серьезных случаях могут проявляться симптомы, изменяющие стиль жизни. Без адекватной терапии воспаление в мочевом пузыре может становиться более серьезным, и проявления могут ухудшаться. Рекуррентный бактериальный цистит определяют как рекуррантную значительную бактериурию в отсутствие патологии верхнего тракта. "Рекуррантная" - это обычно более трех случаев доказанного бактериального цистита в год. Острый бактериальный цистит - это очень распространенная инфекция у сексуально активных женщин. Он случается у 30-50% женщин в течение их жизни и может становиться рекуррентным у 25-40% этих женщин. Обычное лечение - это длительная терапия антибиотиками. В случае уретрального синдрома в моче не находят бактерий. В обоих случаях вероятно повреждение слоя GAG. Гиалуронат натрия в последнее время использовали для лечения заболеваний мочеполовой системы, особенно для лечения интерстициального цистита и радиационного цистита внутрипузырным введе-2 025141 нием с помощью уретрального катетера (Binoche WO 96/25168 и WO 00/24387). WO 96/25168 описывает применение гиалуроната натрия при лечении интерстициального цистита. Эффективность внутрипузырного введения гиалуроната натрия была доказана клиническими экспериментами. Конечные критерии изучения были связаны с улучшением симптомов, основанных на уменьшении боли и безотлагательной необходимости. Пациенты получали внутрипузырные вливания гиалуроната натрия раз в неделю в течение 4 недель, а затем поддерживающие вливания раз в 4 недели в течение 20 недель. Каждый раз пациенты получали внутрипузырное вливание 50 мл 0,08% раствора гиалуроната натрия. Композицию HA вливали в пузырь с помощью уретрального катетера. Затем пациент получал раствор HA в течение как минимум 30 мин. Обследовали 14 пациентов. В конце исследования у 5 из них отмечалось значительное улучшение симптомов. Остальные не почувствовали какого-либо улучшения или только небольшое улучшение. Сущность изобретения Изобретение относится к применению фармацевтической композиции, которая включает цинкгиалуроновый комплекс в качестве активного ингредиента и фармакологически приемлемый носитель и/или наполнитель. В рамках изобретения находятся также терапевтическое применение этих композиций для лечения и предотвращения цистита - заболевания, связанного с аномалиями и дефицитом слоя глюкозоаминогликана (GAG) в мочеполовой системе млекопитающих. Кроме того, аспектом изобретения является набор, содержащий указанную композицию, катетер для внутрипузырного введения и, при необходимости, баллон, предназначенный для расширения мочевого пузыря. Краткое описание фигур Фиг. 1. Оборудование с баллонным катетером для введения под давлением активного ингредиента. Фиг. 2. Показатели на визуальной аналоговой шкале боли и ежедневные средние порции мочи первого пациента (пример 5) как функция времени. Фиг. 3. Показатели на визуальной аналоговой шкале боли и ежедневные средние порции мочи второго пациента (пример 5) как функция времени. Фиг. 4. Баллонный катетер для расширения мочевого пузыря Подробное описание изобретения Изобретение относится к использованию цинк-гиалуронатного комплекса в производстве лекарственного средства для лечения и предотвращения заболеваний, связанных с аномалиями и недостатками слоя глюкозаминогликана (GAG) в мочеполовой системе млекопитающих. Авторами показано, что использование гиалуроната цинка для внутрипузырной терапии не только регенерирует слой GAG, но также индуцирует улучшение в более глубоких слоях эпителия мочевого пузыря. Согласно проведенным исследованиям показано, что до применения гиалуроната цинка лечение бактериальной инфекции не является необходимым. Признаки регенерации слоя GAG могут наблюдаться на образцах биопсии нелеченной бактериальной инфекции. Приведенные наблюдения являются неожиданными, поскольку перед терапией гиалуронатом натрия лечение бактериальной инфекции необходимо, так как токсины и вредные метаболиты бактерий в моче могут ингибировать процесс регенерации. Комбинированная терапия раствором гиалуроната цинка и антибиотиком может иметь синэргический эффект, она может уменьшать длительность терапии и продлевать длительность ремиссии. В одном желаемом воплощении настоящего изобретения раствор гиалуроната цинка вводили внутрипузырно. В другом желаемом воплощении внутрипузырное введение гиалуроната цинка комбинировали с расширением пузыря баллоном, особенно в случае, если больные страдали от интерстициального цистита. Раствор гиалуроната цинка вводили через катетер в мочевой пузырь, затем осуществляли гидравлическое расширение пузыря через баллон. Симптомы интерстициального цистита включают уменьшение емкости мочевого пузыря. По мере развития заболевания эластичность стенки пузыря ухудшается. Гидравлическое расширение пузыря - это обычный способ в урологии. Этот способ по настоящему изобретению содержит введение раствора гиалуроната цинка в комбинации с расширением пузыря. Раствор гиалуроната цинка помещают в пузырь,после того как баллон заполнен. Раствор остается между стенками пузыря и баллоном. Давление в пузыре препятствует проникновению мочи в мочевой пузырь, так что концентрация раствора не снижается. Дальнейшие преимущества этого способа - это то, что поверхность стенки пузыря расширяется, слизистая оболочка становится тоньше, и активный ингредиент может диффундировать в более глубокие слои слизистой оболочки. В процессе лечения катетер вводят в пузырь и после удаления оставшейся мочи вводят в пузырь раствор активного ингредиента через тот же катетер. Затем катетер удаляют и в пузырь вводят баллон, предназначенный для расширения пузыря. Заполненный баллон способствует постоянному распределению активного ингредиента по стенке пузыря. Баллонный катетер по настоящему изобретению, предназначенный для расширения пузыря, может включать пластиковый катетер и тонкий сферический (при заполнении) баллон предпочтительно длиной 5 см на конце катетера. Фармацевтическая композиция по настоящему изобретению предпочтительно - раствор, концентрация гиалуроната цинка равна 0,01-5 мг/мл. Раствор гиалуроната цинка может быть приготовлен несколькими способами. Раствор может быть приготовлен путем растворения твердого гиалуроната цинка в стерильной воде. Другие агенты (изотонические агенты, консерванты) также могут быть добавлены в раствор. Раствор может быть также приготовлен in situ из водного раствора гиалуроната цинка. Когда соответствующее соединение цинка добавлено к водному раствору гиалуроната натрия, ионы цинка замещают ионы натрия, и образуется раствор гиалуроната цинка. Упомянутые ранее агенты также могут быть добавлены в раствор. Фармацевтическая композиция по настоящему изобретению содержит комплекс гиалуроната цинка в качестве активного ингредиента в подходящем жидком носителе, например в стерильном водном растворителе. Она может содержать также водорастворимые изотонические агенты, такие как хлорид натрия или сорбит и другие агенты, например консерванты, такие как бисульфит натрия, бисульфат натрия,тиосульфат натрия, сорбат калия, метилпарабен, поливиниловый спирт, фенил этиловый спирт и забуферивающие агенты, такие как карбонат натрия, борат натрия, фосфат натрия, ацетат натрия, бикарбонат натрия. Концентрацию упомянутых выше неактивных агентов в растворе можно варьировать между 0,001 и 5 мас.%. Примеры Следующие примеры представляют собой только иллюстрации к настоящему изобретению и не должны ни в коем случае рассматриваться как ограничители рамок изобретения, поскольку множество вариаций и эквивалентов, охватываемых настоящим изобретением, будут понятны специалистам в данной области при прочтении настоящего изобретения. Пример 1. После взвешивания 0.20 мг гиалуроната натрия (Reag. Ph. Eur.) в 100 мл колбу добавляли 5,0 мл хлорида цинка в концентрации 0,10 моль/л, приготовленного на дважды дистиллированной воде (воде для инъекций, апирогенной, стерильной), затем доводили объем бидистиллятом до 50 мл. Затем добавляли 23,5 мл раствора сорбитола в концентрации 1.00 моль/л. (Раствор готовили на бидистилляте). Затем объем доводили бидистиллятом до 100 мл. Затем раствор фильтровали через мембранный фильтр. Исследования на животных моделях. Для оценки эффективности раствора гиалуроната цинка для регенерации стенки мочевого пузыря были разработаны две серии экспериментов. В первой серии экспериментальный патологический процесс служил моделью изменений, происходящих в стенке пузыря при интерстициальном цистите. Во второй серии экспериментов моделировали острый воспалительный процесс пузыря. Пример 2. Модель интерстициального цистита. Эксперименты выполняли на 20 белых самках крыс. Моделировали экспериментальный патологический процесс, аналогичный происходящему в стенке мочевого пузыря при интерстициальном цистите. В пузыре индуцировали криодеструкцию. В пузырь вводили тампон, пропитанный жидким азотом, и оставляли на 20 с, чтобы индуцировать интерстициальный цистит. Затем животных разделяли на три группы. Группа 1: крыс лечили только один раз через 48 ч после криодеструкции, 1 мл раствора гиалуроната цинка (согласно примеру 1) вводили в пузырь и оставляли на 30 мин. Группа 2: животные получали такое же лечение, как первая группа, но получали лечение три раза (3 последовательных дня). Группа 3: 3 контрольных животных не получали лечения после криодеструкции. Затем крыс забивали передозировкой тиопентала натрия и удаляли мочевые пузыри. Для гистологических исследований образцы фиксировали в 10% забуференном формалине и обрабатывали с помощью стандартной техники. Образцы окрашивали толуидиновым синим.Толуидиновый синий может окрашивать поврежденную слизистую оболочку стенки, причем метахромазия зависит от степени повреждения ткани. Гистологическое исследование контрольных животных демонстрировало изъязвление слизистой, лимфогистиоцитарную инфильтрацию полиморфоядерными лейкоцитами в перифокальной области и выраженную вазодиляцию сосудов микроциркуляции. Образцы, окрашенные толуидиновым синим, демонстрировали метахромазию соединительной ткани. Электронно-микроскопические исследования демонстрировали деструкцию коллагеновых волокон с потерей их полосатой структуры. Перечисленные морфологические изменения соответствуют картине интерстициального цистита. Согласно гистологическим исследованиям леченых животных наиболее выраженные положительные изменения развивались в соединительной ткани. Эти изменения были значительными после однократного лечения раствором гиалуроната цинка. Трехкратное введение раствора гиалуроната цинка вызывало дальнейшее развитие положительных изменений соединительной ткани. Электронно-микроскопические данные в случае однократно леченых животных демонстрируют стабилизацию коллагеновых волокон и частичное восстановление их полосатой структуры. После трех-4 025141 кратного лечения стабилизация коллагеновых волокон была более значительной, а восстановление их полосатой структуры было полным. Пример 3. Модель острого бактериального цистита. Эксперименты выполняли на 16 белых самках крыс. Острое воспаление пузыря индуцировали инъекцией (под давлением) 1,0 мл культуры E.Coli (106 CFU/мл). Затем животных разделили на три группы: Группа 1: крыс лечили только один раз через 48 ч после инъекции E.Coli, 1 мл раствора гиалуроната цинка (согласно примеру 1) вводили в пузырь и оставляли на 30 мин. Группа 2: животные получали такое же лечение, как первая группа, но получали лечение три раза (3 последовательных дня). Группа 3: 3 контрольных животных не получали лечения после криодеструкции. Затем крыс забивали передозировкой тиопентала натрия и вырезали мочевые пузыри. Для гистологических исследований образцы фиксировали в 10% забуференном формалине и обрабатывали с помощью стандартной техники. Образцы окрашивали толуидиновым синим. Гистологическое исследование контрольных животных продемонстрировало следующие изменения: заметная инфильтрация всех слоев стенки пузыря; вазодиляция сосудов микроциркуляции; отек; фокальная деструкция эпителия мочевого пузыря и соединительной ткани. Микроскопическое исследование образцов, окрашенных толуидиновым синим демонстрирует значительную метахромазию в соединительной ткани. Электронно-микроскопические данные в случае леченых животных показали, что лечение гиалуронатом цинка заметно стабилизирует коллагеновые волокна, снижает отек и уменьшает метахромазию, указывая на стабилизацию глюкозоаминогликанов. Лечение гиалуронатом Zn также оказывает положительное воздействие на процесс эпителизации в обеих моделях. После однодозового лечения экспрессия краевой эпителизации была на 14,35% выше,чем у конртрольных животных. Повторное лечение увеличивало разницу до 21,51%. Клиническое исследование. Критерии включения для этого исследования: 1. Женщины. 2. 18 лет. 3. Срочность мочеиспускания и непрекращающаяся частота мочеиспускания или боли в области таза в течение по меньшей мере 6 месяцев. 4. Мочеиспускание по меньшей мере 7 раз в день или позывы к мочеиспусканию или боли в области таза (измеренные по визуальной аналоговой шкале) 5. Гидрорастяжение под анестезией до 60-80 см водного столба с кровоточивостью и кровопотерей. 6. Стерильная моча. Критерии исключения для этого исследования: 1. Среднее количество мочи больше 150 мл. 2. Туберкулез мочеполовой системы. 3. Отказ или злокачественные опухоли мочевого пузыря. 4. Пациенты, принимающие любые медикаменты или активное лечение по поводу интерстициального цистита в течение 30 дней после зачисления в группу. 5. Пациенты, принимающие любые медикаменты, влияющие на мочевой пузырь, в течение 1 недели. 6. Беременность, лактация. 7. Рак яичников, шейки матки и влагалища. 8. Вагинальные инфекции. 9. Бактериальный цистит в течение 3 месяцев. 10. Активный герпес в течение 3 месяцев. 11. Лечение циклофосфамидом в анамнезе. 12. Радиационный цистит. 13. Нейрогенная дисфункция мочевого пузыря. 14. Воспаление мочевого пузыря в течение 3 месяцев. 15. Операция по расширению или удалению мочевого пузыря. Эффекты лечения гиалуронатом цинка оценивали с помощью визуальной аналоговой шкалы боли и измерения количества порций мочи. Пример 4. Внутрипузырное введение раствора гиалуроната цинка. Лечили 8 пациентов. Катетер вводили в мочевой пузырь, удаляли оставшуюся мочу, затем 10 мл раствора гиалуроната цинка (как в примере 1) вводили в пузырь и оставляли на 1-1,5 ч. Лечение повторяли еженедельно в продолжение 3-5 недель в зависимости от состояния пациента. У двоих пациентов не наблюдалось улучшения симптомов. У остальных шести пациентов наблюдалось улучшение симптомов необходимости мочеиспускания и повышенной частоты мочеиспускания и симптомов, не зависящих от мочеиспускания,таких как боли в тазовой области, уже через несколько часов после первого введения. Это соответствует снижению на 2-3 пункта по визуальной аналоговой шкале боли. У двоих из них наблюдалось дальнейшее снижение при последующих введениях, причем это улучшение заканчивалось через 1-2 месяца. У четверых из них наблюдалось 100% улучшение симптомов. При обработке раз в месяц их состояние оставалось стабильным. Пример 5. Комбинированная терапия: внутрипузырное введение раствора гиалуроната цинка и расширение пузыря. Введение гиалуроната цинка комбинировали с баллонным расширением мочевого пузыря. После или до лечения пациенты получали внутрипузырное введение раствора гиалуроната цинка, которое в некоторых случаях соответствует предыдущему примеру. Пузырный катетер вводили в пузырь, остаточную мочу удаляли, затем в пузырь вводили 20 мл раствора гиалуроната цинка (согласно примеру 1). Затем баллон заполняли с помощью устройства, показанного на фиг. 1. После заполнения вводили в пузырь под давлением раствор гиалуроната цинка. В результате расширения пузыря его поверхность растягивается, и активный ингредиент может пассивно диффундировать в более глубокие слои слизистой оболочки. Чтобы избежать побочных эффектов (таких как повреждение стенки пузыря), в течение всего лечения измеряли давление стенки пузыря. Давление увеличивали до 80 H2O см и оставляли на 10 мин. Описанную выше терапию применяли к 10 пациентам. Через несколько дней после комбинированной терапии пациенты сообщали о 100% улучшении боли. Через 8-9 дней после расширения пузыря значительно возрастает пузырная емкость и остается постоянной. Улучшение симптомов у двух пациентов показаны на фиг. 2, 3. Одна из кривых показывает изменение количества порций мочи. Результаты комбинированного лечения и введения раствора гиалуроната цинка отдельно представлены на диаграмме. Из диаграммы следует, что терапия гиалуронатом цинка отдельно может уменьшать боль, но не может увеличить емкость пузыря. Через 3 месяца второй пациент(фиг. 3) получал вновь комбинированное лечение. Было показано, что результаты могут быть воспроизведены. Лечение химических циститов, индуцированных внутрипузырно введенным цитостатиком. Пример 6. Лечение было таким же, как было описано в примере 5. Лечили двух пациентов, подвергнутых операции на мочевом пузыре вследствие злокачественной опухоли. После операции они получали цитостатический медикамент внутрипузырно. Их симптомы после лечения цитостатиком были очень похожи на симптомы интерстициального цистита. После первой обработки (описанной в примере 5) пациенты сообщали о почти 100% улучшении симптомов. Показатели визуальной аналоговой шкалы боли снижались на 80%, и количество средних порций мочи увеличилось на 40-50%. Эффекты лечения оставались постоянными в следующие 4-6 месяцев. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение фармацевтической композиции, содержащей цинк-гиалуроновый комплекс для предотвращения и лечения цистита. 2. Применение по п.1 для лечения интерстициального цистита, бактериального цистита, радиационного цистита или химического цистита. 3. Применение по пп.1, 2, при котором фармацевтическая композиция находится в форме раствора. 4. Применение по п.3, при котором концентрация цинк-гиалуронового комплекса в растворе равна 0,01-5,0 мг/мл. 5. Применение цинк-гиалуронового комплекса в производстве медикамента для лечения и предотвращения цистита у млекопитающих. 6. Способ лечения и предотвращения цистита у млекопитающих путем введения фармацевтической композиции в форме раствора, содержащей цинк-гиалуроновый комплекс, в концентрации 0,01-5,0 мг/мл. 7. Способ по п.6, в котором композицию вводят внутрипузырно в мочевой пузырь, после чего осуществляют баллонное расширение пузыря, причем эта фармацевтическая композиция находится в форме раствора, где концентрация цинк-гиалуронового комплекса равна 0,01-5,0 мг/мл. 8. Набор для предотвращения и лечения цистита, содержащий фармацевтическую композицию,охарактеризованную в п.1, и катетер, пригодный для внутрипузырного введения. 9. Набор по п.8, характеризующийся тем, что он содержит баллон, предназначенный для расшире-6 025141
МПК / Метки
МПК: A61K 31/728, A61K 33/30
Метки: лечения, композиции, фармацевтической, цинк-гиалуроновый, предотвращения, цистита, содержащей, комплекс, способ, применение, набор
Код ссылки
<a href="https://eas.patents.su/9-25141-primenenie-farmacevticheskojj-kompozicii-soderzhashhejj-cink-gialuronovyjj-kompleks-dlya-predotvrashheniya-i-lecheniya-cistita-sposob-i-nabor.html" rel="bookmark" title="База патентов Евразийского Союза">Применение фармацевтической композиции, содержащей цинк-гиалуроновый комплекс, для предотвращения и лечения цистита, способ и набор</a>
Предыдущий патент: Усовершенствованная компрессорная и/или насосная установка для текучей среды
Следующий патент: Способ и устройство для клеточной трансплантации
Случайный патент: Способы