Катализатор для селективного окисления соединений серы до элементарной серы, способ получения такого катализатора и способ селективного окисления соединений серы до элементарной серы
Номер патента: 1069
Опубликовано: 30.10.2000
Авторы: Терерде Роберт Йохан Андреас Мария, Гес Йохн Вильхельм
Формула / Реферат
1. Катализатор на носителе для селективного окисления серосодержащих соединений до элементарной серы, содержащий, по меньшей мере, один каталитически активный материал, который присутствует на материале носителя, где каталитически активный материал состоит, по меньшей мере, частично из смешанного оксида с оксидной решеткой, в которую включены, по меньшей мере, два металла в виде ионов.
2. Катализатор по п.1, в котором первый металл способен изменять свою валентность в условиях указанного селективного окисления.
3. Катализатор по п.2, в котором в качестве первого металла используют железо.
4. Катализатор по пп.1-3, в котором второй металл не может, или это затруднено, изменять свою валентность в условиях указанного селективного окисления.
5. Катализатор по п.4, в котором в качестве второго металла используют цинк, церий, сурьму, олово и/или германий, особенно цинк.
6. Катализатор по пп.1-5, в котором атомное отношение первого и второго металла составляет от 25/75 до 97,5/2,5, особенно от 95/5 до 50/50.
7. Катализатор по пп.1-6, имеющий удельную площадь поверхности более чем 20 м2/г, предпочтительно более чем 25 м2/г, и средний радиус пор составляет, по меньшей мере, 100 Е, при этом катализатор, по существу, не проявляет активности для реакции Клауса в реакционных условиях.
8. Катализатор по пп.1-7, отличающийся тем, что материалом носителя является SiO2.
9. Катализатор по пп.1-8, отличающийся тем, что каталитически активный материал присутствует на носителе в количестве 0,1-50 мас.%, рассчитанном на общую массу катализатора.
10. Способ получения катализатора по одному или более из пп.1-9, включающий нанесение соединений, по меньшей мере, двух металлов на поверхность материала носителя, с последующим высушиванием и кальцинированием материала носителя, при этом в ходе кальцинирования на материале носителя присутствует некоторое количество галогенида.
11. Способ по п.10, в котором материал носителя пропитывают одним или более растворами указанных соединений металла и во время пропитки или после нее на поверхность материала носителя наносят некоторое количество хлорида, например хлорида аммония.
12. Способ по п.10 или 11, в котором количество хлорида составляет от 0,1 до 20 мас.% на основе количества по массе металлов.
13. Способ селективного окисления серосодержащих соединений, в частности сероводорода, до элементарной серы, отличающийся тем, что газ, содержащий сероводород, вместе с газом, содержащим кислород, пропускают при повышенной температуре над катализатором по одному или более из пп.1-9.
14. Способ по п.13, отличающийся тем, что мольное отношение кислорода к окисляемым соединениям серы поддерживают от 0,5 до 25.
Текст
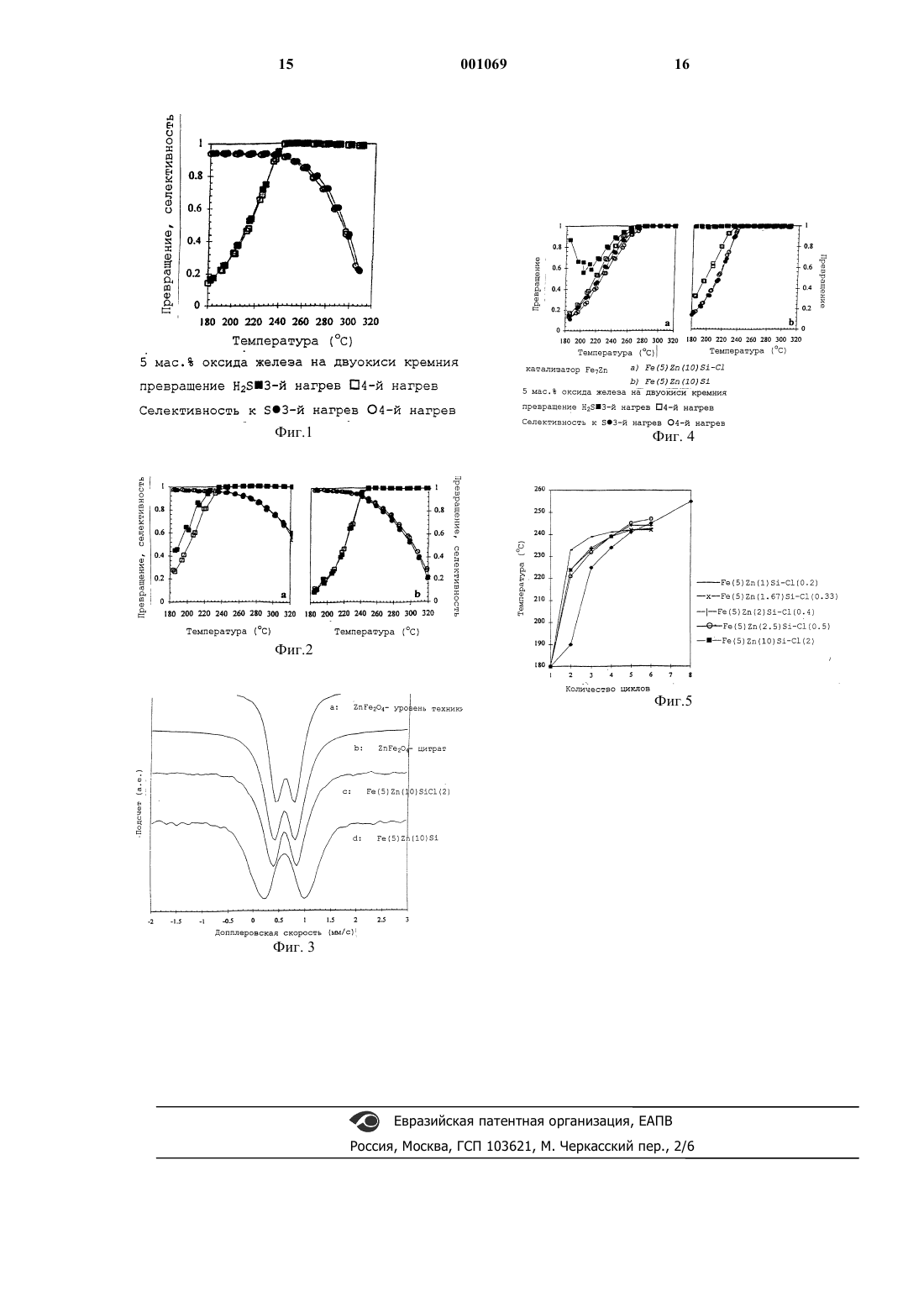
1 Настоящее изобретение относится к катализатору на носителе для селективного окисления сероводорода до элементарной серы, к способу получения такого катализатора и к способу селективного окисления окисляемых соединений серы, таких как сероводород, меркаптаны и тиофены, до элементарной серы. Общеизвестно, что газы, дополнительно полученные в ходе химических процессов, которые поставляют потребителям или выбрасывают в атмосферу, необходимо очищать от соединений серы, в частности от сероводорода,меркаптанов и тиофенов. Существует много месторождений природного газа, где он идет вместе с сероводородом. Также большие количества сероводорода выделяются при гидрировании десульфуризации нефтяных фракций,которые необязательно далее концентрируют при помощи методов абсорбции-десорбции. Один из наиболее известных способов превращения сероводорода в безвредную элементарную серу - так называемый процесс Клауса. В ходе этого процесса сначала приблизительно одну треть H2S сжигают, благодаря чему образуется SO2. Благодаря условиям сгорания большинство органических загрязнителей в потоке газа также выгорают. Оставшийся H2S взаимодействует с полученным SО 2, сначала термически, а затем в присутствии катализатора с получением воды и элементарной серы, согласно следующей реакции: 2 H2S + SO2 2 Н 2O + 3/n Sn (1) На практике каталитическая реакция проводится в ряде слоев катализатора, расположенных один за другим. Однако, несмотря на это,H2S не превращается в соответствующее количество элементарной серы в основном из-за положения термодинамического равновесия реакции. Остаточное содержание H2S и SО 2 сохраняется. На этой стадии обычно не разрешается выбрасывать остаточный газ, содержащий Н 2S,и его необходимо сжигать, посредством чего сероводород и другие серосодержащие соединения, когда элементарная сера присутствует в газовой фазе, окисляются до двуокиси серы. Изза того, что обработке подвергаются большие количества Н 2S, количества SO2, выпускаемые таким образом, все еще остаются значительными. Поскольку экологические требования ужесточаются, такая ситуация становится недопустимой из-за слишком высоких выбросов двуокиси серы. Поэтому необходимо осуществлять дальнейшую обработку остаточного газа, идущего из установок Клауса, отходящего газа, в установках отходящего газа. Предлагалось селективно окислять сероводород, присутствующий в отходящем газе, до элементарной серы, необязательно после гидрирования остаточного SO2 до H2S. Для таких 2 способов селективного окисления используются специфические катализаторы. Патент США 4,818,740, содержание которого приводится в описании в качестве ссылки,раскрывает катализатор, использование которого в значительной степени позволяет избежать побочных реакций, в то время как основная реакция идет с достаточной степенью превращения и селективностью. Катализатор, описанный в данном патенте,содержит носитель, в котором поверхность, которая может входить в контакт с газовой фазой,не обладает щелочными свойствами в условиях реакции, в то время как на этой поверхности имеется каталитически активный материал. Далее, удельная площадь поверхности этого катализатора менее чем 20 м 2/г и менее чем 10% суммарного объема пор в этом катализаторе имеет радиус поры от 5 до 500 . Усовершенствование способа, раскрытого в вышеупомянутом патенте США 4,818,740,описано в европейской патентной публикации 409,353, содержание которой приводится в качестве ссылки. Данная патентная публикация относится к катализатору для селективного окисления серосодержащих соединений до элементарной серы, содержащему, по меньшей мере, один каталитически активный материал и,необязательно, носитель, катализатор имеет удельную площадь поверхности более 20 м 2/г и средний радиус пор, по меньшей мере, 25 , в то время как катализатор, по существу, не проявляет активности в ходе реакции Клауса. Третий вариант такого катализатора описан в WO-A 95/07856. Согласно этой патентной публикации катализатор содержит, по меньшей мере, один каталитически активный материал,который нанесен на материал носителя, материал носителя, до нанесения каталитически активного материала, снабжается, по меньшей мере,одним щелочным металлом в качестве промотора. На эффективность превращения Н 2S в элементарную серу обычно могут отрицательно влиять следующие побочные реакции: 1. последующее окисление серы: 1/n Sn + O2 SO2 (2); 2. обратная (или обращаемая) равновесная реакция Клауса: 3/n Sn + 2 H2 О 2 Н 2S + SO2 (3). Полученная сера вступает в обратную реакцию с присутствующим также водяным паром до получения сероводорода и двуокиси серы. Отходящий газ обычно содержит, помимо элементарной серы, значительное количество водяного пара, количество которого может составлять от 10 до 40% по объему. Этот водяной пар очень сильно способствует обратной реакции Клауса. Тщательное удаление водяного пара имеет очевидные технические трудности,такие как необходимость дополнительной ста 3 дии охлаждения/нагревания, дополнительной стадии восстановления серы или стадии гидрирования с последующей стадией удаления воды путем резкого охлаждения. Поэтому необходим способ, при помощи которого превращение до элементарной серы почти не зависит (если совсем не зависит) от содержания воды в подаваемом газе. Еще одно важное обстоятельство состоит в том, что обычно при селективном окислении будет применяться некоторый избыток кислорода, не только для предотвращения "утечки"H2S, но и для технического управления процессом. Однако, именно этот избыток кислорода может приводить к увеличению последующего окисления образующейся элементарной серы,что снижает эффективность всего процесса. В зависимости от выбора катализатора и условий реакции можно при помощи таких катализаторов добиваться превращения соединений серы, поступающих в процесс Клауса, до примерно 99,2 мас.%. Недостатки вышеописанных катализаторов для селективного окисления соединений серы состоят в том, что после, по существу, полного превращения сероводорода увеличивается окисление полученной серы до SO2 с ростом температуры. Это показано в примерах. С технической точки зрения очень трудно точно контролировать температуру в конце слоя катализатора в реакторе. Для обработки больших потоков газа, как в случае отходящих газов из установки Клауса, на практике приемлемы только адиабатические реакторы. Поскольку реакция селективного окисления является экзотермической, то температура на входе и интенсивность превращения определяют температуру на выходе. Для достижения достаточно высокой степени превращения требуется минимальная температура на входе. С другой стороны, желательно добиться как можно более высокой степени превращения. Использование адиабатических реакторов часто приводит к тому, что конечная температура так высока, что существенно снижается селективность, например, до значения примерно 80%. Очевидно, что необходим катализатор, который меньше вызывает окисление серы до SO2, в частности, при более высоких температурах. В первых двух вышеупомянутых патентах говорилось о том, что структура пор катализатора (носителя) играет важную роль. В третьем патенте говорится о том, что хотя природа носителя оказывает влияние, было обнаружено,что при определенном выборе каталитического материала селективность может улучшаться с температурой, то есть снижение селективности происходит только при более высоких температурах. Было обнаружено, что при использовании каталитически активного материала, состоящего 4 из смешанного оксида, посредством чего по меньшей мере два металла в виде ионов включены в оксидную решетку и смешаны друг с другом на атомном уровне, получается значительно улучшенная селективность. Один из металлов должен обладать способностью легко изменять свою валентность, в то время как, по меньшей мере, один из других металлов не может, или это затруднено, изменять свою валентность в условиях селективного окисления (температуры от 180 до 350 С; O2 от 0,01 до 0,5 бар). Объяснение этого эффекта не совсем ясно. Можно предположить, что благодаря присутствию второго металла кислород, который необходим для окисления серы до SO2, становится недостаточно доступным. Настоящее изобретение, соответственно,относится главным образом к катализатору для селективного окисления серосодержащих соединений до элементарной серы, содержащему,по меньшей мере, один каталитически активный материал, который присутствует на материале носителя, причем каталитически активный материал состоит, по меньшей мере, частично из смешанного оксида с оксидной решеткой, в которую включены, по меньшей мере, два металла в виде ионов. Для определения присутствия такого смешанного оксида, который составляет, предпочтительно, по меньшей мере, 75% каталитически активного материала, и в котором металлы смешаны на атомном уровне, можно использовать метод дальней тонкой структуры рентгеновского спектра поглощения (EXAFS). Это метод, посредством которого атомные циклические структуры атомов можно определять не только в упорядоченных структурах, хотя необходимо сначала установить, что ионы металлов однородно распределены в каталитически активном материале. Это можно осуществить,например, при помощи комбинации дифракции рентгеновских лучей и восстановления при запрограммированной температуре (TPR). Картина дифракции рентгеновских лучей не может показывать никакого острого дифракционного максимума, а профиль TPR не может содержать никаких отдельных пиков для индивидуальных оксидов металлов. Наилучшим методом определения атомного смешивания является спектроскопия Мссбауэра (гамма-резонансная спектроскопия),которая может применяться, например, в отношении железа и олова. В качестве первого металла, то есть металла, который может легко изменить свою валентность, предпочтительно использовать железо и/или хром, особенно железо. В качестве второго металла, то есть металла, который не может изменить свою валентность, или изменяет ее с трудом, предпочтительно использовать олово,цинк, церий, сурьму и/или германий. Из этих металлов предпочтительным является цинк. 5 Взаимное отношение этих металлов, предпочтительно, составляет от 25/75 до 97,5/2,5,особенно 95/5 до 50/50 на атомной основе. В соответствии с предпочтительным вариантом осуществления изобретения катализатор по настоящему изобретению имеет удельную площадь поверхности более чем 20 м 2/г и средний радиус пор, по меньшей мере, 25 , причем катализатор не проявляет, по существу, активности в отношении реакции Клауса при реакционных условиях. Отмечено, что в настоящем изобретении отсутствие активности в ходе реакции Клауса определяется как отсутствие какого-либо влияния воды на селективность реакции окисленияH2S до серы в присутствии, по меньшей мере,стехиометрического количества O2 при 250 С. Более конкретно, это означает, что в присутствии 30 об.% воды селективность реакции к элементарной сере не может быть ниже более, чем на 15% по сравнению с селективностью при отсутствии воды. Это определение реакции Клауса основано на равновесной реакции Клауса 3/n Sn +2 Н 2O2 H2S + SO2 (3). Если материал является активным в условиях реакции Клауса, то присутствие воды ведет к тому, что реакция идет в направлении H2S иSO2, так что часть серы превращается обратно в Н 2S и SO2. После этого H2S окисляется присутствующим О 2 до серы и водяного пара, после чего катализатор, активный в реакции Клауса,превращает серу опять в SO2. При такой последовательности реакций катализатор с участками, активными в реакции Клауса, в присутствии воды приводит к существенному снижению селективности. В рамках настоящего изобретения под удельной площадью поверхности понимается площадь поверхности, определенная методом Браунауэра-Эммета-Теллера (BET), как описано в работе S.Brunauer et al, in J.A.C.S. 60, 309(1938). Применялась адсорбция азота при 77 К(25 С) в соответствии с так называемым трехточечным измерением. Для целей проведения вычислений площадь поверхности молекулы азота принимали равной 16,2 2. Средний радиус пор определяют на основе цилиндрической модели поры при помощи формулы: 20000 х объем пор (см 3/г) Средний радиус пор= Используемый здесь показатель объема пор определяют гравиметрически посредством пропитки водой под вакуумом. Удельный объем поры можно также определить при помощи метода ртутной порометрии под давлением до 2,000 бар. Показатели, полученные при помощи этих двух способов, хорошо согласуются. Удельная площадь поверхности катализатора по настоящему изобретению может соот 001069 6 ветствовать как показателям, приведенным в патенте США 4,818,740, так и показателям согласно Европейской патентной публикации 409,353. Точнее, удельная площадь поверхности составляет, по меньшей мере, 25 м 2/г, поскольку при таких показателях можно получить хорошую активность. Предпочтительно, удельная площадь поверхности катализатора не будет выше, чем 300 м 2/г катализатора. При более высоких значениях обычно не достигаются никакие конкретные дополнительные преимущества. Требование, касающееся среднего радиуса пор, играет важную роль вследствие природы реакции. Если существует слишком много маленьких пор, это вызывает риск того, что благодаря тому, что сера слишком длительное время находится в порах, происходит последующее окисление серы до SO2, что нежелательно. Предпочтительно, средний радиус пор составляет обычно, по меньшей мере, 100 , в то время как верхний предел составляет 2000 . Выше этого предела не удается добиться дополнительных преимуществ, а с другой стороны, могут возникнуть проблемы при получении носителя. Более конкретно, предпочтительно средний радиус пор составляет не более чем 500 . Катализатор настоящего изобретения может быть, если необходимо, промотирован одним или более промоторами. Возможно, например, промотировать носитель щелочным металлом, как описано в WO-А 95/07856. Природа и количество щелочного металла, используемого в качестве промотора, могут меняться. Что касается природы, можно заметить, что она может быть основана на обычных щелочных металлах,в частности, литии, калии и натрии, причем последний является наиболее предпочтительным. Катализатор по настоящему изобретению может содержать также один или более других промоторов. Подходящими промоторами по настоящему изобретению являются соединения фосфора. Эти соединения можно, например,наносить на катализатор с использованием пропитки растворимым соединением фосфора. Катализатор по изобретению обычно содержит 0,1-50 мас.%, основанных на общей массе катализатора, материала, который является каталитически активным в отношении селективного окисления H2S до элементарной серы. Следует подчеркнуть, что это касается активного материала, который является доступным для реакционных газов. При помощи спекания, или другого способа получения, возможно также часть активного материала, в частности, оксид металла, капсулировать, например,при помощи спекания узких пор в носителе. Однако различие между капсулированным оксидом металла и оксидом металла, присутствующим на носителе, можно легко определить при помощи TPR, восстановления при запрограммированной температуре. Подробно этот 7 способ измерения описан в работе N.W.Hurst,S.J.Gentry, A.Jones and B.D.McNicol, Catal. Rev.Sci. Eng. 24(2), 233-309 (1982). Таким образом,можно определить количество присутствующего оксида металла, доступное для газов. Катализатор состоит из материала носителя, на котором находится каталитически активный материал. Активный компонент предпочтительно присутствует на носителе в количестве от 0,1 до 40 мас.%, предпочтительно 0,1-10 мас.% на основе общей массы катализатора. Обычно в качестве носителя используется керамический материал, который не проявляет активности в ходе реакции Клауса в реакционных условиях, или инактивирован для такой активности. Подходящими материалами, в числе прочих, являются окись кремния, окись алюминия или спекшиеся металлы. Было обнаружено, что двуокись кремния,при использовании ее в качестве носителя, дала хорошие результаты и, следовательно, ее использование является предпочтительным. В принципе катализаторы по настоящему изобретению можно получить при помощи известных способов получения катализаторов на носителях. При получении катализатора является существенным, чтобы активный компонент наносили на материал носителя в виде смешанного оксида. Было обнаружено, что обычные способы, в которых перед кальцинированием кислотные остатки, такие как хлориды, удаляют, насколько возможно, путем промывки водой, не приводят к образованию смешанных оксидов с атомным смешиванием. Известный способ, такой, например, как раскрыт в патенте GB-A 2,164,867, включает растворение различных хлоридов металлов в воде, осаждение металлов,промывание осадков до тех пор, пока Сl- не исчезнут из промывной воды, с последующим образованием катализатора и его кальцинированием. При помощи такого способа получают смесь оксидов. Удаление хлоридов считают необходимым потому, что хлориды присутствующих металлов являются летучими. В ходе кальцинирования происходит перенос металлов по поверхности, что ведет к уменьшению активной поверхности (спеканию). На практике это означает, что активность уменьшается так сильно,что катализатор становится непригодным к использованию. Неожиданно было обнаружено, что путем применения контролируемого количества хлорида, например, в виде NH4Cl, спекание металлов можно успешно контролировать и в то же время способствовать образованию смешанного оксида. Предпочтительно использовать хлорид в количестве от 0,1 до 20 мас.% на основе количества ионов металла. Другими словами, используется весовое отношение ионов металла к хлориду от 4:1 до примерно 1000:1. 8 Чтобы должным образом контролировать количество хлорида, предпочтительно наносить металлы в виде других солей, кроме хлоридов. Наиболее подходящими являются соли аммония и металла, такие как цитраты. В случае железа и цинка используют цитрат аммония и железа и цитрат аммония и цинка. При совместной пропитке с помощью водных растворов этих двух соединений, к которым добавлено небольшое количество NH4Cl, после кальцинирования получают смешанный оксид, описанный в описании. Без добавления хлорида получают смесь оксидов, что показано в примерах. Чтобы привести носитель катализатора в удобную форму, можно, если необходимо, заранее подвергнуть его спеканию перед нанесением и/или после этого. Спекание можно также необязательно проводить и в отношении готового катализатора, так что микропоры спекаются. Настоящее изобретение относится также к способу селективного окисления серосодержащих соединений, в частности сероводорода, до элементарной серы, при использовании катализатора по изобретению. В соответствии с этим способом сероводород окисляют непосредственно до элементарной серы путем пропускания газа, содержащего сероводород, вместе с газом, содержащим кислород, над катализатором при повышенной температуре. Следует отметить, что достижение оптимальных результатов определяется не только природой катализатора, но также параметрами процесса. В связи с этим, в частности, выбор температуры и время контактирования играют важную роль при окислении. Поэтому при использовании катализатора по настоящему изобретению является возможным допускать избыток кислорода и/или присутствие воды в обрабатываемом газе. Окисление осуществляют путем добавления, используя известный регулятор соотношения, в газ, содержащий сероводород, кислорода или газа, содержащего кислород в таком количестве, чтобы мольное отношение кислорода к сероводороду составляло от 0,5 до 25,0 и предпочтительно от 0,5 до 1,5. Способ по настоящему изобретению можно использовать для селективного окисления всех газов, которые содержат серосодержащие соединения, в частности сероводород. Примеры способов, в которых можно использовать окисление по настоящему изобретению, - это способы, описанные в Европейской патентной заявке 91551, Европейской патентной заявке 78690 и в патенте США 4,311,683. Способ по настоящему изобретению наиболее пригоден для окисления газа, который не содержит более чем 2,5% H2S, потому что тогда можно использовать обычный реактор, работающий в адиабатическом режиме. 9 При окислении температура слоя катализатора на входе должна быть выше 150 С, и предпочтительно выше 170 С. Эта температура частично определяется требованием, что температура слоя катализатора должна быть выше точки росы образующейся серы. При использовании известных мер, максимальную температуру в слое катализатора обычно поддерживают ниже 330 С, и предпочтительно ниже 300 С. Когда содержание H2S выше 2,5% по объему, может возникнуть необходимость принять меры для того, чтобы предотвратить чрезмерное повышение температуры в реакторе окисления,как результат выделенной теплоты реакции. Такие меры включают, например, использование охлажденного реактора, например, трубчатого реактора, в котором катализатор находится в трубке, окруженной охладителем. Другой способ предполагает рециркуляцию потока газа при низкой степени превращения за один проход через реактор и охлаждение потока газа после реактора. Способ по настоящему изобретению наиболее выгодно применять для селективного окисления отходящих газов, содержащих сероводород, идущих из установки Клауса. Помимо очень высокой селективности катализатора по изобретению важное преимущество способа по изобретению состоит в том, что отпадает необходимость удаления воды перед окислением. Когда, используя способ по настоящему изобретению, отходящие газы окисляют, эти газы,предпочтительно, сначала пропускают через реактор гидрирования, в котором, например,присутствует катализатор, содержащий кобальт/молибден, и в котором происходит гидрирование всех соединений серы до сероводорода. Способ по настоящему изобретению кроме того особенно подходит для десульфуризации,например, отопительных газов, газов от нефтепереработки, биогазов, коксового газа, вентиляционных газов, поступающих из химических установок, таких как заводы по производству вискозы, или газов, которые сжигают на участках экстракции газа и/или нефти. Настоящее изобретение объясняется при помощи следующих примеров. Получение катализаторов. При получении катализаторов в качестве носителя использовали цилиндрические экструзии двуокиси кремния диаметром 2,1 мм и длиной примерно 10 мм. Двуокись кремния имела удельную площадь поверхности 45 м 2/г, объем пор 1,1 мл/г и средний диаметр пор 70 мкм. Активный компонент (компоненты) наносили путем пропитки объема пор. Предшественник,содержащий железо, представлял собой цитрат аммония и железа, при этом цинк также вводили путем пропитки в виде раствора цитрата. При необходимости в раствор для пропитки добавляли нашатырь (хлорид аммония) в различных 10 количествах. Важно отметить, что после кальцинирования катализатора в материале никакой хлорид не обнаруживался. После пропитки материал носителя высушивали, и затем кальцинировали при 500 С. В ходе кальцинирования следили за тем, чтобы температура не поднималась слишком высоко как результат окисления цитрата. Этого добивались путем регулирования потока воздуха над катализатором. Каталитические эксперименты. Поток газа, состоящий из 1% H2S, 5% O2,30% воды и азота пропускали через слой катализатора со скоростью 12 000 ч-1. На основе анализов потока газа перед реактором и после него рассчитывали конверсию (превращение) и селективность. При помощи описанных здесь измерений отбирали настолько малый слой катализатора, чтобы температура в слое была практически однородной. На фиг.1 показаны степень превращения сероводорода и селективность катализатора из оксида железа по данным уровня техники. Значения превращения и селективности нанесены как функция температуры слоя катализатора. Измерения начинали при температуре 180 С, где определяли превращение и селективность. После того, как слой катализатора стабилизировался, а это видно по тому, что показатели превращения и селективности не меняются,температура поднялась примерно на 10 С, после чего измерения повторяли таким же способом. Когда температура достигала 320 С, температуру последовательно снижали примерно на 10 С таким же способом. Полученные таким образом результаты приведены на фиг.1; незаштрихованные квадраты указывают превращение, измеренное в течение третьегоповышения температуры, а незаштрихованные кружки обозначают связанные с ними селективности. Заштрихованные (черные) квадраты и кружки показывают результаты, измеренные в течение четвертого нагревания слоя катализатора. Из результатов по фиг.1 ясно следует, что селективность каталитической реакции заметно снижается при температурах выше примерно 240 С. Для технического выполнения селективного окисления такой показатель является крайне неблагоприятным. Как говорилось выше,технически невозможно установить конечную температуру слоя катализатора при примерно 240 С. Более высокая конечная температура,которая главным образом является неизбежной,ведет к значительно более низкой селективности. Тот факт, что кривые, полученные для третьего и четвертого нагрева слоя катализатора, совпадают, показывает, что катализатор является полностью стабильным. На фиг.2, как функция температуры, изображены показатели превращения и селективности катализаторов из оксидов железа и цинка,измеренные таким же способом. Загрузка носителя из двуокиси кремния в обоих случаях со 11 ставляет 5 мас.% оксида железа и 10 мас.% оксида цинка. В случае применения катализатора,данные по которому показаны в левой части фиг.2, носитель пропитывали 2 мас.% хлорида в соответствии с настоящим изобретением. В левой части графика показаны результаты измерений для катализатора по настоящему изобретению; в правой части показаны результаты, полученные для катализатора из оксидов железа и цинка, в котором ионы железа и цинка не являются смешанными на атомном уровне. Если правый график на фиг.2 (катализатор из оксидов железа и цинка) сравнить с фиг.1 (катализатор из оксида железа), то видно, что присутствие оксида цинка в катализаторе повышает селективность при более высокой температуре только в небольшой степени. Несмотря на то, что химические составы двух катализаторов, чьи результаты отображены на фиг.2, не различаются,видно, что селективность катализатора, результаты для которого показаны в левой части фигуры, уменьшается не так быстро с температурой, чем катализатора, результаты по которому даны в правой части. В то время как в случае катализатора, чьи данные отображены в левой части фигуры, селективность при 320 С попрежнему составляет 60%, селективность катализатора, при получении которого не добавляли хлорид, составляла только примерно 20% при той же температуре. Катализатор, селективность которого снижается не так быстро при повышении температуры, позволяет намного уменьшить выбросы соединений серы из установок Клауса. Важно также продемонстрировать атомное смешение ионов железа и цинка в оксидной решетке. В случае соединений железа это можно сделать при помощи спектроскопии Мссбауэра. На фиг. 3 даны спектры Мссбауэра для"сыпучего" цинкового феррита ZnFe2O4. Приведен также спектр Мссбауэра для раствора цитрата железа и цинка, которые кальцинировали после высушивания. В обоих случаях получали характерный спектр цинкового феррита. Самый нижний спектр на фиг. 3 получили для катализатора из оксидов железа и цинка, в котором изначально ионы хлорида не присутствовали. Очевидно, что этот спектр сильно отличается от спектра для цинкового феррита. Если путем сопоставления изначально 2 мас.% хлорида присутствовало в катализаторе, то после кальцинирования это получали в катализаторе, для которого спектр Мссбауэра приведен под буквой (с) на фиг. 3. Очевидно, что последний спектр идентичен спектру феррита цинка. Поскольку оксид железа или феррит цинка, обеспеченные на носителе в виде мелких раздельных частиц, не дают четкой картины дифракции рентгеновских лучей, то к такому же выводу нельзя прийти при помощи дифракции рентгеновских лучей. 12 Из результатов на левом графике по фиг. 2 видно, что показатель преобразования после третьего нагревания катализатора выше, чем после четвертого. Это указывает на то, что катализатор теряет активность. Описанные ниже эксперименты проводили с целью установить причину такой потери активности. На фиг.4, где отображены результаты для катализатора, в котором 5 мас.% оксида железа наносили на оксид кремния, показано, какое влияние оказывает добавление ионов хлорида в катализатор перед высушиванием и кальцинированием. Слева отображены результаты для катализатора, в который перед высушиванием и кальцинированием добавили 2 мас.% ионов хлорида, а справа отображены результаты для катализатора, в котором ионы хлорида отсутствовали с самого начала. Результаты экспериментов представлены в виде измерений, произведенных в ходе первого повышения температуры (заштрихованные квадраты), второго повышения температуры(заштрихованные круги), четвертого повышения температуры (незаштрихованные круги). Хорошо видно, что катализатор, в который добавили ионы хлорида, является намного менее активным. В ходе четвертого нагревания катализатор,в котором изначально отсутствуют ионы хлорида, достигает степени превращения 100% при температуре примерно 240 С, в то время как катализатор, который первоначально содержал ионы хлорида, показал 100% превращение только при температуре примерно 280 С. Активность в ходе первого нагревания также значительно выше у катализатора, который изначально не содержал хлорида. Здесь также важно отметить, что химический состав двух катализаторов после кальцинирования является идентичным. В ходе кальцинирования образуется хлорид железа, который является летучим соединением. Благодаря переносу хлорида железа, образуются более крупные частицы оксида железа,так что активная площадь поверхности сокращается. Присутствие более крупных частиц оксида железа в кальцинированном катализаторе видно по тому, что картина дифракции рентгеновских лучей кальцинированного катализатора ясно показывает максимум -Fe2 О 3 (maghemite),в то время как катализатор, который изначально не содержал хлорида, не дает никаких четко идентифицируемых максимумов дифракции. Несмотря на то, что хлорид необходим для осуществления атомного смешивания ионов железа и цинка в оксидной решетке, катализатор должен иметь их минимальное количество, чтобы как можно меньше снижать активность катализатора. Чтобы обеспечить оптимальные количества хлорида в катализаторе перед кальцинированием и чтобы определить оптимальное соотношение железа/цинка, температуру, при которой отмечен максимальный выход серы, ис 13 пользуют в качестве меры активности и селективности при более высокой температуре. Оптимальный катализатор проявляет максимальное превращение сероводорода в элементарную серу при наиболее возможной низкой температуре. На фиг.5 вышеуказанная температура отображена в виде функции от числа нагревов катализатора до 320 С для ряда катализаторов с различным составом перед кальцинированием. Отношение железо/цинк и содержание хлорида указаны на правой стороне фигуры. Дезактивация катализатора выявляется из повышения температуры, при которой получают максимальный выход серы. Из результатов, приведенных на этой фигуре, видно, что катализатор с 5 мас.% железа, 1 мас.% цинка и изначально 0,2 мас.% хлорида дает наилучшие результаты. После четвертого нагревания температура максимального выхода серы заметно не поднимается, оставаясь по существу постоянной на уровне 240 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Катализатор на носителе для селективного окисления серосодержащих соединений до элементарной серы, содержащий, по меньшей мере, один каталитически активный материал,который присутствует на материале носителя,где каталитически активный материал состоит,по меньшей мере, частично из смешанного оксида с оксидной решеткой, в которую включены, по меньшей мере, два металла в виде ионов. 2. Катализатор по п.1, в котором первый металл способен изменять свою валентность в условиях указанного селективного окисления. 3. Катализатор по п.2, в котором в качестве первого металла используют железо. 4. Катализатор по пп.1-3, в котором второй металл не может, или это затруднено, изменять свою валентность в условиях указанного селективного окисления. 5. Катализатор по п.4, в котором в качестве второго металла используют цинк, церий, сурьму, олово и/или германий, особенно цинк. 14 6. Катализатор по пп.1-5, в котором атомное отношение первого и второго металла составляет от 25/75 до 97,5/2,5, особенно от 95/5 до 50/50. 7. Катализатор по пп.1-6, имеющий удельную площадь поверхности более чем 20 м 2/г,предпочтительно более чем 25 м 2/г, и средний радиус пор составляет, по меньшей мере, 100 ,при этом катализатор, по существу, не проявляет активности для реакции Клауса в реакционных условиях. 8. Катализатор по пп.1-7, отличающийся тем, что материалом носителя является SiO2. 9. Катализатор по пп.1-8, отличающийся тем, что каталитически активный материал присутствует на носителе в количестве 0,1-50 мас.%, рассчитанном на общую массу катализатора. 10. Способ получения катализатора по одному или более из пп.1-9, включающий нанесение соединений, по меньшей мере, двух металлов на поверхность материала носителя, с последующим высушиванием и кальцинированием материала носителя, при этом в ходе кальцинирования на материале носителя присутствует некоторое количество галогенида. 11. Способ по п.10, в котором материал носителя пропитывают одним или более растворами указанных соединений металла и во время пропитки или после нее на поверхность материала носителя наносят некоторое количество хлорида, например хлорида аммония. 12. Способ по п.10 или 11, в котором количество хлорида составляет от 0,1 до 20 мас.% на основе количества по массе металлов. 13. Способ селективного окисления серосодержащих соединений, в частности сероводорода, до элементарной серы, отличающийся тем,что газ, содержащий сероводород, вместе с газом, содержащим кислород, пропускают при повышенной температуре над катализатором по одному или более из пп.1-9. 14. Способ по п.13, отличающийся тем, что мольное отношение кислорода к окисляемым соединениям серы поддерживают от 0,5 до 25.
МПК / Метки
МПК: C01B 17/04, B01J 23/76
Метки: серы, соединений, катализатор, получения, элементарной, такого, катализатора, селективного, способ, окисления
Код ссылки
<a href="https://eas.patents.su/9-1069-katalizator-dlya-selektivnogo-okisleniya-soedinenijj-sery-do-elementarnojj-sery-sposob-polucheniya-takogo-katalizatora-i-sposob-selektivnogo-okisleniya-soedinenijj-sery-do-elementa.html" rel="bookmark" title="База патентов Евразийского Союза">Катализатор для селективного окисления соединений серы до элементарной серы, способ получения такого катализатора и способ селективного окисления соединений серы до элементарной серы</a>