Катализируемая палладием индолизация
Формула / Реферат
1. Способ получения соединения структурной формулы III
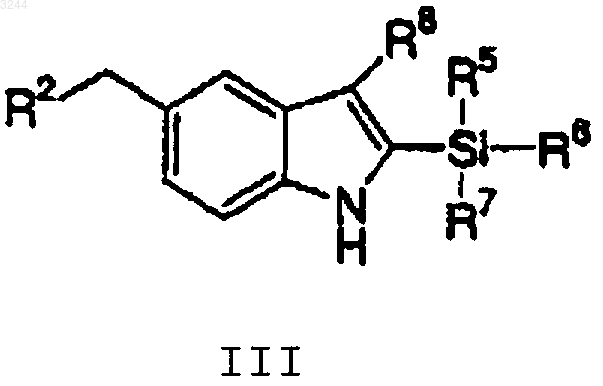
включающий в себя взаимодействие соединения структурной формулы I с ацилсиланом структурной формулы II
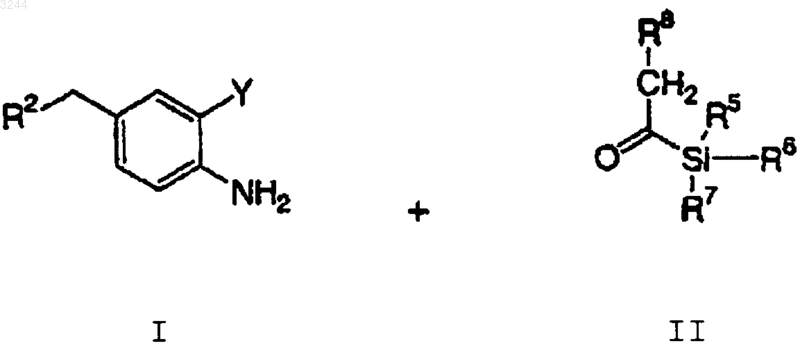
в безводном органическом растворителе, инертном по отношению к исходным веществам, в присутствии палладиевого катализатора и акцептора протонов, где
Y выбирают из Br, I и трифлата;
R2 представляет собой SO2NHMe или
R5, R6 и R7, каждый независимо, выбирают из C1-6алкила и фенила;
R8 выбирают из
-(CH2)n-OH,
-(CH2)n-OR17 и
-(CH2)n-NMe2, и
где n равен 1, 2 или 3; и
R17 выбирают из гидроксизащитной группы, которая может быть удалена гидролизом в слабокислых условиях.
2. Способ по п.1, где палладиевый катализатор выбирают из Pd (II) ацетата, Pd (II) ацетилацетоната, Pd(0)бис-дибензилиденацетона ("dba"), Pd (II) бромида, Pd (II) хлорида, Pd (II) иодида, Pd (II) сульфата, Pd (II) трифторацетата, Pd (II) Cl2(CH3CN)2, Pd2(dba)3 и Pd (II) Cl2(PhCN)2.
3. Способ по п.2, где палладиевый катализатор представляет Pd (II) ацетат.
4. Способ по п.1, где акцептор протона выбирают из
(a) 1,4-диазабицикло[2,2,2]октана,
(b) хинуклидина,
(c) трет-бутиламина,
(d) 2,2,6,6-тетраметилпиперидина и
(e) ди-трет-бутиламина.
5. Способ по п.4, где акцептор протона представляет 1,4-диазабицикло[2,2,2]октан.
6. Способ по п.1, где растворитель выбирают из
(a) ДМСО (DMSO),
(b) ДМФ (DMF),
(c) DMAC (N,N-диметилацетамид) и
(d) NMP (N-метилпирролидинон).
7. Способ по п.6, где органическим растворителем является ДМФ.
8. Способ по п.1, где взаимодействие осуществляют при температуре от 90 до 120шC.
9. Способ по п.1, дополнительно включающий стадию снятия защиты с соединения структурной формулы (III) для получения соединения структурной формулы (IV)
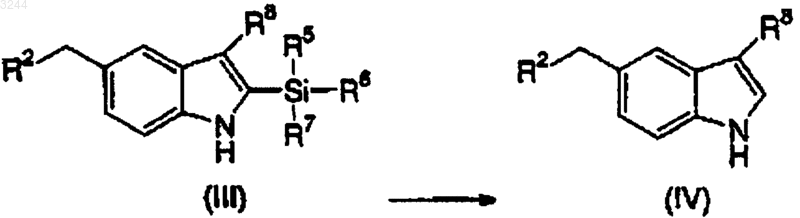
10. Способ по п.9, где снятие защиты катализируют кислотой Льюиса.
11. Способ по п.10, где соединение структурной формулы (IV) выбирают из
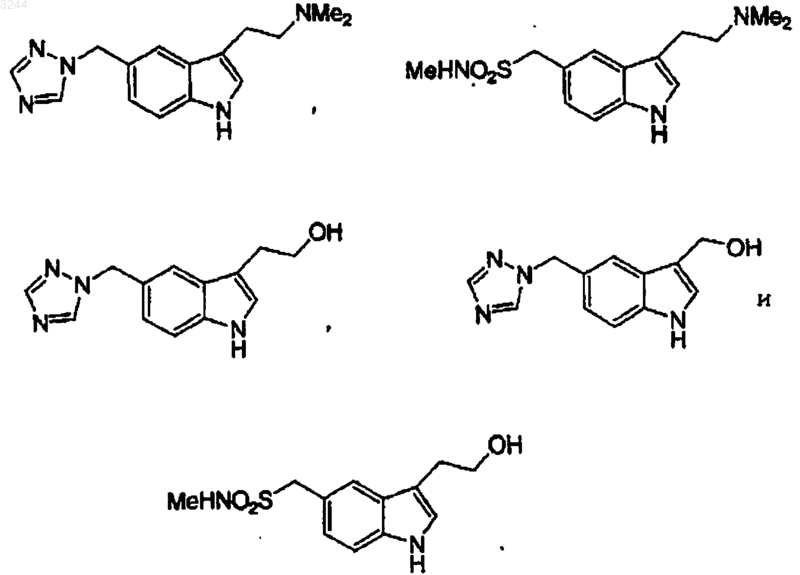
Текст
1 Область техники Данное изобретение относится к получению 2-силилзащищенных индолов с помощью катализируемой палладием реакции галогенанилинов и ацилсиланов (которые действуют как альдегидсинтоны). Эти 2-силилпроизводные,согласно данному изобретению, могут быть превращены в соответствующее производное 2 незамещенного индола. Данное изобретение, в частности, используют для получения 5 гетероциклических замещенных триптаминов,таких как 5-(1,2,4-триазол-1-ил)триптамин. Эти соединения терапевтически активны в качестве противомигреневых средств. Обычно индолы получают путем синтеза индола по реакции Фишера. Например, в публикации Chen et al., J. Org. Chem., 59:3738 (1994) раскрывается получение N,N-диметилтриптаминов из 4-замещенных гидразинов и диметиламинобутиральдегид диметилацеталя, используя 4% H2SO4. Однако выходы оказываются часто низкими, в частности для соединений, имеющих триазольное замещение. Бензилтриазолы нестабильны в условиях синтеза по реакции Фишера,которые обычно приводят к полимеризации триазольной части и получению олигомеров.(1991) показали, что взаимодействие (сочетание) образцов иоданилина с внутренним ацетиленом, используя катализ палладием, дает 2,3 дизамещенные индолы с хорошим до превосходного выходами. Это также показали Smith etal. для 4-пиримидинил и пиридинилпроизводных индол-3-илалкилпиперазинов, как это следует из опубликованной ЕРО 548 831 A1. Два других применения этой методологии были продемонстрированы в синтезах гетероконденсированных пирролов и триптофанов. См.Wensbo et al., Tetrahedron Lett., 34:6471 (1993). Однако для всех этих способов требуется трифенилфосфин, как часть каталитической системы, который представляет опасность для окружающей среды. Был разработан альтернативный способ для того, чтобы преодолеть низкий выход индола по реакции Фишера с некоторыми исходными веществами и избежать использования вредного для окружающей среды трифенилфосфина. Этот способ детально описан в РСТ публикации WO 95/32197 и включает катализируемое палладием сочетание/замыкание кольца 3-иод-4-аминобензилтриазола с подходящим образом защищенным бутинольным производным в соответствующий триптофол, с последующим превращением гидроксиэтильной части в диметиламиноэтил, как представлено ниже: причем указанный способ осуществляют в безводном инертном органическом растворителе для исходных веществ при температуре в диапазоне от приблизительно 70 до 120 С, в присутствии палладиевого катализатора, и в присутствии неорганического или органического аминного соединения, гдеX21 и Х 22 представляют независимо азот кольца или углеродные атомы; галоген представляет Вr или I;n равно целому числу 0-1; р равно целому числу 1-4;R23 представляет Н или прямой или разветвленный С 1-С 4 алкил;R21 представляет Н или радикал с функциональностями, такими как гидроксизащищающая группа, которая может быть удалена в условиях слабо-кислого гидролиза, например,путем контактирования со смесью HCl/MeOH,например, 1:1 2N HCl/MeOH при 0-30 С, и R22 представляет радикал, который функционирует как группа, защищающая концевой ацетиленовый углерод. Однако, хотя химия альтернативного способа эффективна, исходные вещества, бутинол и триэтилсилил хлорид являются относительно дорогостоящими. Данное изобретение обеспечивает экономичный способ индолизации.Iida et al., J. Org. Chem. 45:2938-2942 (1980) раскрывают внутримолекулярную циклизацию 3-2-бромарил)амино)циклогекс-2-ен-1-онов каталитическим палладием в присутствии трифенилфосфина, а также реакцию ариламинов с-дикетонами с получением соответствующего вторичного енаминона с последующим Nэтилированием, получая соответствующие третичные енаминоны, и последующую внутримолекулярную циклизацию в присутствии эквимолярного ацетата палладия.,-ненасыщенных кетонов и сложных эфиров с получением 2,3-дизамещенных индолов. В способе Sakamota et al. также используется фосфин. Данное изобретение имеет конкретное применение в синтезе агонистов 5 НТID рецептора. Эти агонисты имитируют действия нейротрансмиттера серотонина, который действует как вазоконстриктор в головном мозге. Агонисты 5 НТID рецептора проявляют полезные свойства в лечении мигрени. На протяжении последних нескольких лет предпринимаются интенсивные попытки с целью разработки N,N 3 диалкилтриптаминов как агонистов 5-НТID рецептора, чтобы достичь требуемой активности и селективности для лечения мигрени. Суматриптан является первым (представителем) из этого класса лекарственных средств, который достигал этой цели. МК-0462 (разработанный MerckCo.) описан в пат. США 5 298 520 и он является также сильнодействующим агонистом 5 НТID рецептора, который проходит клинические исследования. Таким образом, данное изобретение также обеспечивает действенный и эффективный, по стоимости, синтез 5-гетероциклилзамещенных триптаминов, полезных для лечения мигреневых головных болей. Сущность изобретения Нами обнаружено, что 2-незамещенные индолы могут быть синтезированы экономично с высоким выходом катализируемого палладием сочетания/замыкания в кольцо 2-галоген или 2 трифторметилсульфонилокси (OTf)-анилина и производного ацилсилана, с последующим снятием защиты силил-защищающих групп. Способ данного изобретения, в частности, используют для получения индолов, содержащих кислота-лабильные (неустойчивые) заместители,таких как триазол, ацетил, кеталь, циано и карбамат, или индолов, имеющих хорошо (легко) отщепляемую группу в бензильном положении. Преимущества данного способа заключаются в том, что он не требует использования трифенилфосфина или хлорида тетрабутиламмония и хлорида лития. При применении к 5-триазолилзамещенным индолам данный способ также устраняет тенденцию триазолильной полимеризации в синтезе индола по реакции Фишера. Согласно данному изобретению, обеспечивается способ, включающий стадию контактирования соединения cтруктуры I с соединениемR2 и R8 представляют, каждый, заместители, которые не мешают условиям протекания реакции (реакционным условиям), иR5, R6 и R7, каждый, представляет C1-6 алкил или фенил. В частности, данное изобретение относится к вышеупомянутой реакции, гдеR5, R6 и R7 каждый независимо выбирают из C1-6 алкила и фенила;R17 выбирают из гидроксизащитной группы, которая может быть удалена гидролизом в слабокислых условиях. Способ предпочтительно осуществляется в безводном органическом растворителе, инертном для исходных веществ, в диапазоне температур от 90 до 120 С в присутствии палладиевого катализатора и в присутствии акцептора протона, который может быть соединением неорганического или органического амина. Кроме того, данное изобретение относится к снятию защиты с соединения структурной формулы III с получением 2-незамещенного индола структурной формулы IV: где R2, R5, R6, R7 и R8 такие, как определено выше. Детальное описание изобретения Комбинации заместителей и/или переменных допустимы только, если такие комбинации приводят к стабильным соединениям. Иллюстративные примеры Si(R5) (R6) (R7) радикалов включают триметилсилил, триэтилсилил, трибутилсилил, трифенилсилил, диметил-трет-бутилсилил, диметилфенилсилил, дифенилметилсилил, триизопропилсилил и т.п.R17 действует как защищающая группа для гидроксильной группы и может иметь структуруSi (R5) (R6) (R7), как описано выше. Термин "трифталат", или "OTf", относится к трифторметансульфонилоксигруппе. В тех случаях, когда амин включен в качестве заместителя соединения в данном изобретении для того, чтобы оптимизировать условия реакции и получить лучшие выходы, амин может быть защищен, как известно в данной области, и защищающая группа может быть удалена после реакции сочетания. Используемый здесь термин "алкил", в частности выражение "C1-6 алкил," включает метильные и этильные группы и прямые цепочечные или разветвленные пропильные, бутильные,пентильные и гексильные группы. Конкретными алкильными группами являются метильная, 5 этильная, н-пропильная, изопропильная и третбутильная. Способ данного изобретения предпочтительно выполняют в безводном органическом растворителе, инертном для исходных веществ,в присутствии палладиевого катализатора и в присутствии неорганического или органического основания, которое не является "ядом для катализатора". Предпочтительно, данный способ осуществляют при повышенной температуре. В способе данного изобретения cтруктура I подвергается сочетанию со cтруктурой II с получением cтруктуры III посредством катализируемой палладием реакции в безводном инертном органическом растворителе, содержащем растворимый палладиевый катализатор, и в присутствии акцептора протона, который представляет ароматический амин, алкиламин или неорганическое основание, которое не является"ядом для катализатора", при температуре приблизительно 90-120 С. Органический растворитель, используемый в способе данного изобретения, должен представлять растворитель, в котором cтруктураI, cтруктура II и палладиевый катализатор растворимы и совместимы, и химически инертны в условиях реакции. Предпочтительны ДМСО(DMSO) (диметилсульфоксид) и амидные растворители, такие как ДМФ (DMF) (N,N-диметилформамид), ДМАС (DMAC) (N,N-диметилацетамид) и NMP (N-метилпирролидинон). Наиболее предпочтителен ДМФ (DMF). Ацилсилан структурной формулы II обычно используют в избытке, исходя из 2-галоген или 2-(ОТf)-анилина структурной формулы (I). Используемый диапазон составляет приблизительно 1,0-3-х кратный избыток, исходя из 2 галоген или 2-(ОТf)-анилина структурной формулы I. Ацилсилан может быть благоприятно использован при двукратном избытке из расчета на 2-галоген или 2-(OTf)-анилин структурной формулы I. Акцептор протона, используемый в способе данного изобретения, представляет основное соединение, которое может быть органическим или неорганическим и действует как акцептор протона и не является "ядом для катализатора". Под термином "яд для катализатора" подразумевают взаимодействие с катализатором, которое ингибирует его каталитическую активность и препятствует сочетанию/замыканию в кольцо между имеющимися структурами I и II. Подходящие классы акцепторов протонов включают алкиламины, ароматические амины, гетероциклические амины, фосфаты и т.п. Алкиламины являются предпочтительным акцептором протона в способе данного изобретения. Конкретные алкиламины, которые могут быть использованы, включают: DABCO (1,4 диазабицикло[2,2,2]октан), хинуклидин, третбутиламин, 2,2,6,6-тетраметилпиперидин и ди 003244 6 трет-бутиламин. DABCO особенно предпочтителен, поскольку он понижает появление примесей в реакции, поскольку он устойчив к окислению в амин в реакционных условиях способа данного изобретения. Акцептор протонов обычно используют в избытке, исходя из 2-галоген или 2-(OTf)анилина структурной формулы (I). Используемый диапазон составляет приблизительно 2-4-х кратный избыток, исходя из 2-галоген или 2(OTf)-анилина структурной формулы (I). Акцептор протонов может быть благоприятно использован в трехкратном избытке, исходя из 2 галоген или 2-(OTf)-анилина структурной формулы (I). Палладиевый катализатор, используемый в реакции, может быть выбран из следующих классов: Pd-алканоаты, Pd-ацетонаты, Pdгалогениды, Pd-галогенидные комплексы, Pdбензилиденацетон комплексы, а также триарилPd-фосфиновые комплесы. Иллюстративные примеры включают, но ими не ограничиваются:Pd (II) Cl2(PhCN)2. Используемым катализатором является ацетат палладия. Палладиевый катализатор используют в количестве приблизительно от 0,5 до 5 мольных процентов, из расчета на галогенанилин структурной формулы I. Используемый диапазон составляет приблизительно от 2 до 3 мольных процентов растворимого палладиевого катализатора из расчета на галогенанилин структурной формулы I. Дегидратирующее средство, такое как сульфат магния, может быть также благоприятно использовано в способе сочетания cтруктуры I соcтруктурой II с получением cтруктуры III согласно данному изобретению. Хотя для способа нет необходимости, дегидратирующее средство может способствовать образованию енамина путем удаления воды, образующейся при конденсации. Реакцию осуществляют в диапазоне температур от 90 до 120 С. Используемый диапазон температур составляет 100-105 С. Обычно реакцию осуществляют в безводной инертной атмосфере при атмосферном давлении. Можно проводить реакцию в атмосфере азота. Развитие реакции можно контролировать способом, известным в данной области, включая тонкослойную хроматографию на силикагеле (ТСХ,TLC), высокоэффективную жидкостную хроматографию (ВЭЖХ), газовую хроматографию (ГХ) и спектроскопию ядерного магнитного резонанса(ЯМР). Предпочтительно используют ВЭЖХ или ТСХ, наиболее предпочтительна ВЭЖХ. После завершения реакции, обычно через 8-72 ч, реакционную смесь охлаждают до комнатной температуры и продукт отделяют традиционным способом,например, извлекая органическим растворителем,таким как изопропилацетат, и промывая водой 7 и/или другими водными растворами. Затем продукт может быть очищен способом, известным в данной области, включая препаративную тонкослойную хроматографию на силикагеле, хроматографию на силикагеле, ВЭЖХ, кристаллизацию, и твердофазную экстракцию. Предпочтительно, продукт очищают хроматографией на силикагеле или кристаллизацией. Кроме того, данное изобретение относится к снятию защиты с соединения структурной формулы III с получением 2-незамещенного индола формулы IVSi (R5) (R6) (R7) группа может быть удалена путем снятия защиты, катализируемой кислотой Льюиса, такой как АlСl3, или водной НСl, НВr иHF. Силильную группу можно удалить, например,обработкой нуклеофильной кислотой, например,контактируя со смесью растворителя 2NHCl/MeOH, в соотношении приблизительно 1:1 по объему, при 0-30 С в течение от 1 до 24 ч до полного удаления силилзащищающих групп. Альтернативно, силильную группу можно удалить снятием защиты с помощью фторида. Эту стадию называют здесь "снятие защиты". Удаление Si(R5) (R6) (R7) группы дает 2-незамещенный индол. Предпочтительные 2-незамещенные индолы,которые можно получить согласно данному изобретению, включают Ацилсиланы, используемые в данном изобретении, обычно могут быть получены согласно нижеследующей схеме:(THF), диэтиловый эфир, трет-бутилметиловый эфир, диоксан, диэтоксиметан добавляют по каплям эквивалент основания, такого как литийдиизопропиламид, NaH, Гриньяр или алкил литий, такой как н-бутиллитий. Предпочтительно, это алкилирование проводят при пониженных температурах, наиболее предпочтительно при -78 С. После добавления смесь предпочтительно нагревают до -20 С и выдерживают при 20 С в течение 0,5 ч. После выдерживания реакционную смесь предпочтительно охлаждают до -78 С. Добавляют по каплям Br-CH2-R8 2,предпочтительно растворенный в небольшом объеме растворителя. Смесь нагревают, предпочтительно до комнатной температуры, и выдерживают, предпочтительно в течение приблизительно 12 ч. Смесь распределяют между липофильным растворителем, таким как гептан, и водой. Гептановый слой отделяют и концентрируют в вакууме, получая дитиан 3 в виде бледно-желтого масла. Это вещество может быть непосредственно использовано в следующей стадии. Смесь дитиана 3, оксида ртути и хлорида ртути в ацетонитрил-Н 2 О, (предпочтительно отношение 80:20) в апротонном растворителе,таком как этилацетат, изопропилацетат, метиленхлорид, ацетонитрил, толуол и т.п., выдерживают при комнатной температуре, предпочтительно в течение приблизительно 30 мин. Альтернативно, можно использовать иод в карбонате кальция. Полученное твердое вещество отфильтровывают и промывают, предпочтительно апротонным растворителем, таким как этилацетат, изопропилацетат, метиленхлорид,ацетонитрил, толуол и т.п. Фильтрат и промывные воды объединяют и концентрируют до масла. Это вещество можно подвегнуть хроматографированию на силикагеле, получая ацилсилан 4 в виде бледно-желтого масла. Дополнительные синтезы ацилсиланов, которые могут быть использованы для получения исходных веществ для соединений данного изобретения, описаны в нижеследующих ссылках:Letters 1966, vol. 37 (34), pp. 6113-6114. Нижеследующие примеры, как полагают,никоим образом не ограничивают настоящее изобретение. Кроме того, соединения, описанные в нижеследующих примерах, не следует истолковывать как образующие единственный 9 класс (вид), который рассматривают как изобретение, и любая комбинация соединений или их частей может сама по себе образовать класс. Специалистам в данной области легко понять, что для получения этих соединений могут быть использованы известные вариации условий и способов нижеследующих препаративных методик. Примеры Пример 1. Получение 2-триметилсилил индола. Смесь иоданилина (2,19 г, 10 ммоль), ацилсилана (2,36 г, 20 ммоль, полученный по способам сравнительного примера А), DABCO (1,4 диазабицикло[2,2,2]октана, 3,36 г, 30 ммоль) иPd(OAC)2 (112,25 мг, 0,5 ммоль) в 30 мл ДМФ дегазируют N2/вакуум и нагревают при 105 С в течение 36 ч. Смесь охлаждают до комнатной температуры,разбавляют IPAc (изопропилацетат, 100 мл) и промывают 2 х 50 мл воды. IPAc слой концентрируют в вакууме и хроматографируют на силикагеле, получая 2-триметилсилилиндол и индол. Примеры 2-8. Согласно процедурам примера 2, исходя из соответствующего замещенного 2-иоданилина и соответствующего ацилсилана, получают следующие соединения: 10 где R17 представляет гидроксизащищающую группу, которая может быть удалена при гидролизе в умеренно кислых условиях. Пример 9. Получение индола. Смесь 2-триметилсилилиндола-продукта примера 1 (0,50 г, 2,6 ммоль) в 5 мл метанола обрабатывают 2,5 N НСl (2,11 мл, 5,2 ммоль) и реакционную смесь выдерживают при комнатной температуре в течение 2 ч. Затем добавляют изопропилацетат (50 мл) и воду (10 мл). Слои разделяют и органический слой концентрируют под вакуумом. Остаточное масло хроматографируют на силикагеле, получая индол в виде белого твердого вещества. Примеры 10-16. По процедуре примера 9 и используя соответствующий 2-триметилиндол-продукт, полученный согласно методикам примеров 2-8, получают следующие 2-незамещенные индолы. где R17 представляет гидроксизащитнуую группу, которая может быть удалена гидролизом в умеренно кислых условиях. Сравнительный пример А. Получение Отрет-бутилдиметилсилил-2,2-диметил-2-силагексан-3-он-6-ола. К 5 г (25,98 ммоль) ТМС дитиана 1 в 70 мл сухого ТГФ при -78 С добавляют по каплям нбутиллитий (1,6 М, 16,25 мл, 26 ммоль). Смесь нагревают до -20 С и выдерживают при -20 С в течение 0,5 ч и охлаждают до -78 С. По каплям добавляют бромэфир 2 в 5 мл ТГФ. Смесь нагревают до комнатной температуры и выдерживают в течение 12 ч. Смесь распределяют между гептаном (250 мл) и водой (200 мл). Гептановый слой отделяют и концентрируют под вакуумом,получая дитиан 3 в виде бледно-желтого масла. Часть этого вещества непосредственно используют в следующей стадии. Смесь дитиана 3 (4,0 г, 11 ммоль), оксида ртути (8,0 г) и хлорида ртути (8,0 г) в ацетонитрил-Н 2 О (80:20, 30 мл) и этилацетата (10 мл) выдерживают при комнатной температуре в течение 0,5 ч. Твердое вещество отфильтровывают и промывают этилацетатом (40 мл). Фильтрат и промывные воды объединяют и концентрируют до масла. Это вещество хроматографируют на силикагеле, получая ацилсилан 4 в виде бледно-желтого масла. Несмотря на то, что данное изобретение описано и проиллюстрировано, ссылаясь на некоторые его конкретные варианты воплощения,специалистам в данной области очевидно, что могут быть сделаны различные изменения, модификации и замещения, не выходя за рамки существа и объема данного изобретения. В связи с чем подразумевается, что изобретение определяется объемом формулы изобретения, которая прилагается, и что такая формула изобретения интерпретируется так широко, как это целесообразно. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения структурной формулы III включающий в себя взаимодействие соединения структурной формулы I с ацилсиланом структурной формулы II в безводном органическом растворителе, инертном по отношению к исходным веществам, в присутствии палладиевого катализатора и акцептора протонов, гдеR17 выбирают из гидроксизащитной группы, которая может быть удалена гидролизом в слабокислых условиях. 2. Способ по п.1, где палладиевый катализатор выбирают из Pd (II) ацетата, Pd (II) ацетилацетоната, Pd(0)бис-дибензилиденацетона ("dba"), PdCl2(СН 3 СN)2, Pd2(dba)3 и Pd (II) Cl2(PhCN)2. 3. Способ по п.2, где палладиевый катализатор представляет Pd (II) ацетат. 4. Способ по п.1, где акцептор протона выбирают из(e) ди-трет-бутиламина. 5. Способ по п.4, где акцептор протона представляет 1,4-диазабицикло[2,2,2]октан. 6. Способ по п.1, где растворитель выбирают из(d) NMP (N-метилпирролидинон). 7. Способ по п.6, где органическим растворителем является ДМФ. 8. Способ по п.1, где взаимодействие осуществляют при температуре от 90 до 120 С. 9. Способ по п.1, дополнительно включающий стадию снятия защиты с соединения структурной формулы (III) для получения соединения структурной формулы (IV) 10. Способ по п.9, где снятие защиты катализируют кислотой Льюиса. 11. Способ по п.10, где соединение структурной формулы (IV) выбирают из
МПК / Метки
МПК: C07F 7/08, C07D 209/04
Метки: катализируемая, палладием, индолизация
Код ссылки
<a href="https://eas.patents.su/8-3244-kataliziruemaya-palladiem-indolizaciya.html" rel="bookmark" title="База патентов Евразийского Союза">Катализируемая палладием индолизация</a>
Предыдущий патент: Тестомесильная машина с дозирующим устройством
Следующий патент: Производные бензамида и фармацевтическая композиция на их основе
Случайный патент: Приводная система для уборочной машины







