Конструирование устойчивости к выходу в стрелку у сахарной свеклы с помощью трансгенной экспрессии гомолога гена ft свеклы, контролирующего время цветения
Номер патента: 24958
Опубликовано: 30.11.2016
Авторы: Ван-Рогген Петронелла-Мариа, Гилен Йоханнес Якобус Лудгерус, Пен Пьерр, Времерт-Вейк Сигне-Ирене-Элисабет
Формула / Реферат
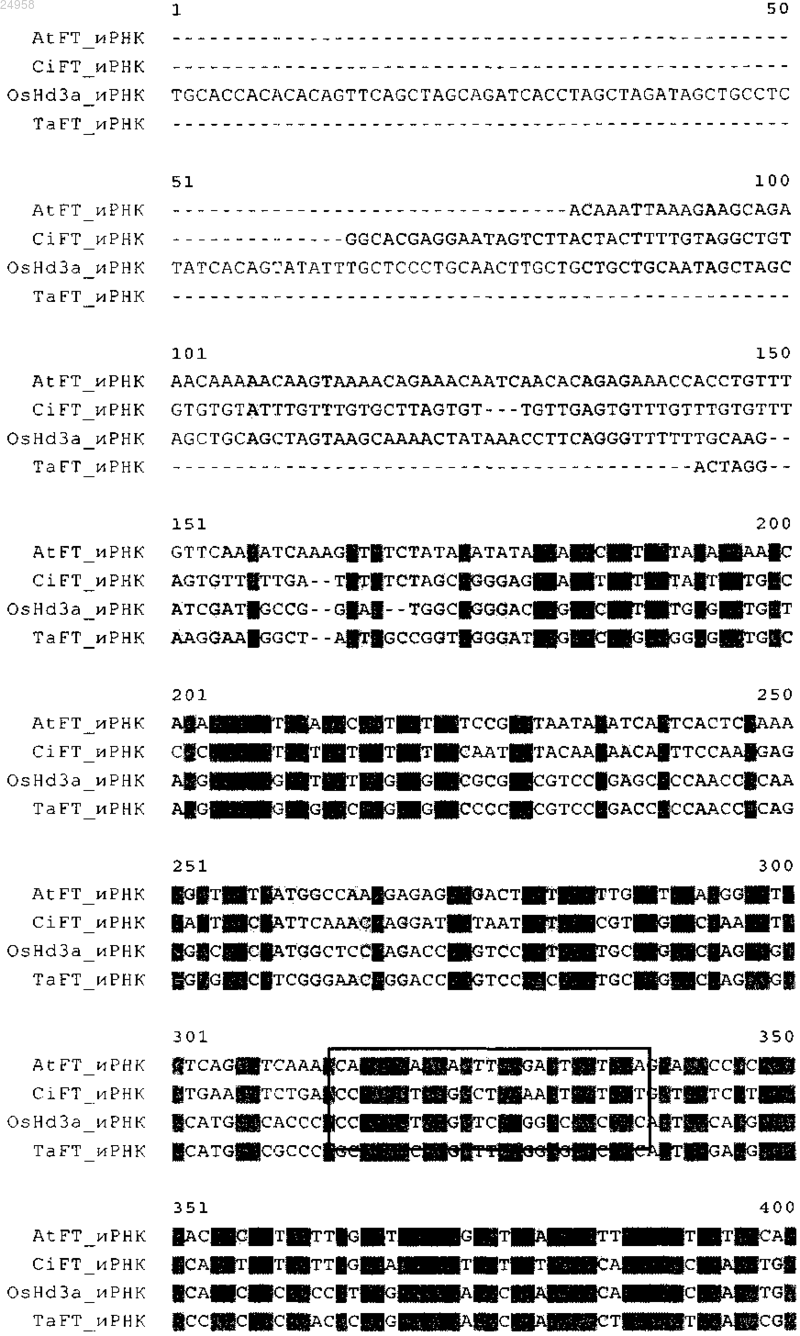
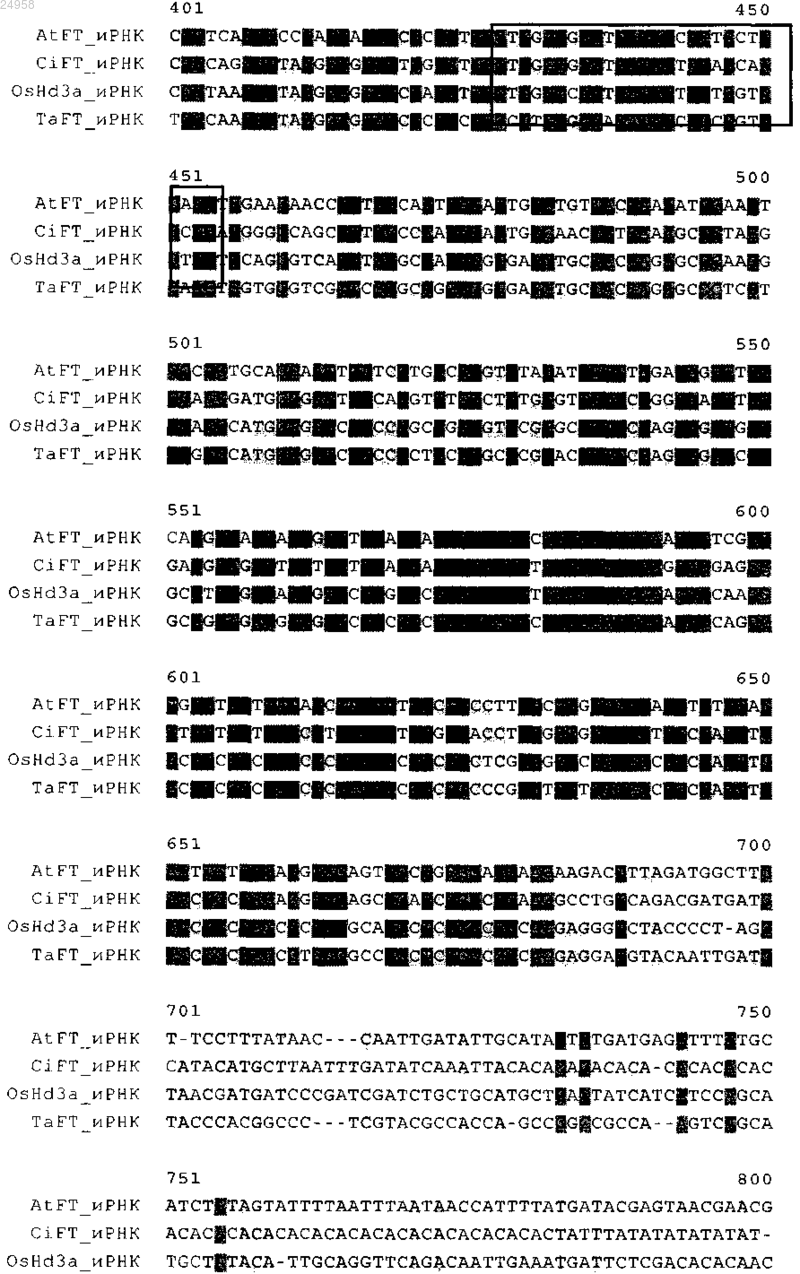
1. Химерная конструкция, отличающаяся тем, что указанная химерная конструкция включает нуклеотидную последовательность, функционально связанную с регуляторной последовательностью, где указанная нуклеотидная последовательность кодирует белок локусов цветения Т (FT) и
а) имеет последовательность, которая по меньшей мере на 70% идентична, или
б) гибридизируется в жестких условиях с нуклеотидной последовательностью SEQ ID NO: 6 или комплементарна ей и
где аминокислотная последовательность белка FT, кодируемая указанной нуклеотидной последовательностью, включает аспарагин в положении, которое соответствует положению 138 SEQ ID NO: 7, и/или глутамин в положениях, которые соответствуют положению 141 и/или 142 SEQ ID NO: 7, так, что в результате экспрессии указанной нуклеотидной последовательности в растении сахарной свеклы проявляется фенотип отложенного выхода в стрелку посредством задержки или подавления ответа на яровизацию указанной сахарной свеклы.
2. Химерная конструкция по п.1, где указанная нуклеотидная последовательность, которая функционально связана с регуляторной последовательностью, имеет нуклеотидную последовательность SEQ ID NO: 6.
3. Химерная конструкция по п.1 или 2, где химерная конструкция включает нуклеотидную последовательность с 2076 по 2615 нуклеотид SEQ ID NO: 34.
4. Химерная конструкция по п.3, где химерная конструкция имеет нуклеотидную последовательность, показанную в SEQ ID NO: 34.
5. Вектор для трансформации растений, включающий химерную конструкцию по одному из пп.1-4.
6. Вектор для трансформации растения по п.5, который является растительным вектором экспрессии, включающим химерную конструкцию по одному из пп.1-4.
7. Вектор для трансформации растений по п.6, где указанный вектор для трансформации растений включает химерную конструкцию, имеющую нуклеотидную последовательность, указанную в SEQ ID NO: 34.
8. Трансгенное растение сахарной свеклы или его часть, отличающиеся тем, что указанное трансгенное растение сахарной свеклы или его часть включают химерную конструкцию по любому из пп.1-4, где указанное трансгенное растение сахарной свеклы проявляет фенотип отложенного выхода в стрелку.
9. Трансгенное растение сахарной свеклы по п.8, где указанное трансгенное растение сахарной свеклы получается из клеток, тканей или семян, включающих химерную конструкцию по одному из пп.1-4.
10. Трансгенное растение сахарной свеклы по п.8 или 9, где указанное трансгенное растение сахарной свеклы является гибридом растения сахарной свеклы, имеющего фенотип отложенного выхода в стрелку.
11. Часть растения трансгенной сахарной свеклы по п.8, где эта часть выбрана из группы, состоящей из семян, зародышей, микроспор, пыльников, зигот, протопластов, клеток, завязей, семяпочек, пыльцы, корнеплодов, стержневых корней, семядолей, тканей, экстрактов или биологических образцов, причем указанная часть включает химерную конструкцию по любому из пп.1-4.
12. Применение химерной конструкции по любому из пп.1-4 для трансформации клеток растения сахарной свеклы, где экспрессия нуклеотидной последовательности, встроенной в эти химерные конструкции, приводит к тому, что у этого растения сахарной свеклы проявляется фенотип отложенного выхода в стрелку посредством задержки или подавления ответа на яровизацию указанного растения сахарной свеклы.
13. Способ трансформации клеток растения сахарной свеклы, где клетки растения сахарной свеклы трансформируются химерной конструкцией по одному из пп.1-4, для получения растений сахарной свеклы, имеющих фенотип отложенного выхода в стрелку.

Текст
КОНСТРУИРОВАНИЕ УСТОЙЧИВОСТИ К ВЫХОДУ В СТРЕЛКУ У САХАРНОЙ СВЕКЛЫ С ПОМОЩЬЮ ТРАНСГЕННОЙ ЭКСПРЕССИИ ГОМОЛОГА ГЕНА FT СВЕКЛЫ, КОНТРОЛИРУЮЩЕГО ВРЕМЯ ЦВЕТЕНИЯSREEKANTAN LEKHA ET AL.: "VvFT and VvMADS8, Описан контроль времени выхода в стрелку и цветения у сахарной свеклы, изобретение относится к способам и молекулам нуклеиновой кислоты, химерным конструкциям и векторам для конструирования устойчивости к выходу в стрелку у сахарной свеклы путем изменения экспрессии гомологов BvFT1 и BvFT2 гена FT у Beta vulgaris. В частности, настоящее изобретение описывает растения сахарной свеклы, имеющие фенотип устойчивости к выходу в стрелку. Ван-Рогген Петронелла Мариа (SE),Гилен Йоханнес Якобус Лудгерус (FR),Пен Пьерр, Времерт-Вейк Сигне Ирене Элисабет (SE)(71)(73) Заявитель и патентовладелец: ЗИНГЕНТА ПАРТИСИПЕЙШНС АГ (CH) Область техники, к которой относится изобретение Настоящее изобретение относится к области контроля за выходом в стрелку и цветением у сахарной свеклы, а именно к генам, обусловливающим устойчивость к выходу в стрелку, к способам конструирования контроля за выходом в стрелку сахарной свеклы и к трансгенным растениям сахарной свеклы с задержкой выхода в стрелку. В частности, настоящее изобретение относится к модификации ответа на яровизацию сахарной свеклы путем изменения экспрессии Beta гомологов BvFT1 и BvFT2 гена FT. Предпосылки создания изобретения Сахарную свеклу выращивали на протяжении тысячелетий для получения сладкого продукта, но ее использование в качестве источника сахара не было известно до 18 века. Культивируемая сахарная свекла (Beta vulgaris ssp. vulgaris L.) является двухлетним растением из семейства Chenopodiaceae. В норме ее жизненный цикл составляет два года. В первый год формируется листовая розетка и крупный сочный корень, в котором запасается энергия в форме сахарозы. В связи с этим свеклу выращивают один год. На второй год стебель удлиняется (выходит в стрелку) и после окончания периода низких температур начинается формирование цветов и семян. Если в первый год период холодов задерживается, могут начать формироваться семяносцы. Такая генетически определяемая термальная индукция приводит к феномену,называемому выходом в стрелку. Сбор урожая свеклы для экстракции сахара происходит в середине двухлетнего цикла, когда содержание сахарозы максимально. Традиционно существует два способа сбора урожая сахарной свеклы -весенний и осенний, которые применяются на юге в условиях мягкого климата, или в северных широтах, соответственно. Оба способа зависят от разных степеней природной устойчивости к выходу в стрелку. На устойчивость к выходу в стрелку влияет температура, поэтому длительность и иррадиация ограничивают устойчивость к индукции семяносцев и являются ключевым параметром в разведении сахарной свеклы. Для полного контроля за выходом в стрелку и цветением за счет блокирования яровизации, деяровизации яровизированных растений или подавления цветения или получения жизнеспособных семян, культуру сахарной свеклы высевают осенью в северных широтах без риска выхода в стрелку и цветения в следующем сезоне. Такой сдвиг с весны на зиму позволяет сельхозпроизводителям высевать культуру осенью и собирать урожай на следующее лето. Сравнение урожая зимних вариантов с урожаем весенних вариантов, например,пшеницы и масличного рапса, показало, что урожаи зимних вариантов постоянно выше, чем зимних. Результатом может быть улучшение экономической жизнеспособности и доходности культуры. Другим преимуществом может быть возможность комбинировать культивирование весенних и зимних культур,что может привести к продлению периода сбора урожая, начиная на 2-3 месяца раньше, таким образом,осуществляя улучшенную капитализацию инвестиций в оборудование и инфраструктуру, требуемую для сбора урожая сахарной свеклы, транспорт и переработку. Такое продление периода переработки сахарной свеклы отвечает одной из потребностей отрасли промышленности по производству сахара. Яровизация холодом в качестве непременной части полного жизненного цикла сахарной свеклы индуцирует выход в стрелку растений. Яровизация и ее воздействие на двухлетний цикл сахарной свеклы подробно описаны (например, Jaggard и др., 1983). Сахарная свекла реагирует на температуру 3-12 С. Несколько недель при температуре от 3 до 12 С необходимы, чтобы свекла начала выходить в стрелку. Модель выхода в стрелку ITB показывает, что во Франции яровизация занимает до 90 суток (13 недель) после посева. Семнадцать суток при 7 С составляют принципиально важный показатель на протяжении этих 90 суток для инициации выхода в стрелку. Вероятность выхода в стрелку повышается в зависимости от числа суток, на протяжении которых максимальная температура не превышает 12 С. Это может привести к потере урожая в случае раннего сева, поскольку при выходе в стрелку 1% растений в культуре происходит снижение получаемого сахара на 0,4-0,7%. Знания о том, что ответ на яровизацию представляет наиболее важным фактором индукции цветения, привели к развитию устойчивости к созданию различных сортов сахарной свеклы, устойчивых к выходу в стрелку, которыми могут пользоваться фермеры, выравнивающие сахарную свеклу. Однако, в настоящее время невозможно культивирование современных сортов сахарной свеклы в центральной Европе в течение зимы (т.е. в качестве озимой культуры), которое соответствовало бы потребности, имеющейся в отрасли промышленности по производству сахара. Даже культивирование озимых сортов сахарной свеклы с повышенной продуктивностью по прежнему серьезно осложнено из-за случаев выхода в стрелку. Яровизация, вызванная воздействием холодной температуры во время зимы, по прежнему приводит к выходу в стрелку и к потере урожая, поскольку в настоящее время нет растений или способов,которые гарантированно задерживают яровизацию сахарной свеклы. По указанным выше причинам весьма желательно создать сорт сахарной свеклы, не дающий выхода в стрелку, в котором конструируют устойчивость к выходу в стрелку, например, трансгенными методами, для модулирования ответа на яровизацию для придания устойчивости против выхода в стрелку или для существенной задержки выхода в стрелку после индукции холодом. Таким образом, нужны нуклеотидные последовательности генов, участвующих в ответе на яровизацию, и трансгенные средства, позволяющие использовать указанные генные последовательности для модуляции ответа на яровизацию у сахарной свеклы. Настоящее изобретение предоставляет такие нуклеотидные последовательности и такие трансгенные средства. Функциональный анализ модельного организма Arabidopsis thaliana позволил выделить четыре разных метаболических пути цветения (Levy и Dean, 1998). Эти четыре метаболических пути могут быть установлены по стимулам внешней среды, например, метаболические пути по фотопериодизму и по яровизации, или врожденные сигналы к развитию, например, метаболические пути автономного активирования и подавления цветения. У некоторых видов на время цветения сначала влияют факторы внешней среды, например, фотопериодизм, качество/количество света, яровизация и доступность воды или питания. На другие виды влияют в меньшей степени экзогенные сигналы и в большей степени эндогенные,например, размер растения или количество узлов. Одним из исследуемых локусов является локус цветения (FLOWERING LOCUS T - FT), обнаруженный у природных экотипов арабидопсиса с поздним цветением (Koorneef и др., 1991). FT является низкомолекулярным белком с массой 23 кДа и гомологом фосфатидилэтаноламин-связывающих белков,также называемых белками ингибитора RAF киназы (Kardailsky и др., 1999; Kobayashi и др., 1999). В настоящем изобретении идентифицированы ортологи генов FT в сахарной свекле. Конструирование экспрессии этих генов приводит к модуляции ответа на яровизацию у сахарной свеклы и к получению растений сахарной свеклы, у которых ответ на яровизацию отсрочен или подавлен. Краткое описание изобретения Настоящее изобретение включает нуклеотидные последовательности из генов FT сахарной свеклы и способы модулирования ответа на яровизацию сахарной свеклы путем подавления или повышения регуляции экспрессии таких генов FT в сахарной свекле. Один из объектов настоящего изобретения относится к последовательностям нуклеиновой кислоты,предпочтительно к выделенным последовательностям нуклеиновой кислоты, последовательность которых идентична по меньшей мере на 70% последовательности нуклеиновой кислоты, выбранной из группы последовательностей нуклеиновой кислоты, представленных ниже в виде одной из последовательностей SEQ ID NO: 5, 6, 8 или 9, или комплементарной им последовательности, которая включает по меньшей мере 15 последовательных нуклеотидов последовательности нуклеиновой кислоты, выбранной из группы последовательностей нуклеиновых кислот, представленных ниже в виде одной из последовательностей SEQ ID NO: 5, 6, 8 или 9, или комплементарной им последовательности, или к нуклеиновым кислотам, которые гидридизируются в жестких условиях с последовательностью нуклеиновой кислоты,выбранной из группы последовательностей нуклеиновой кислоты, приведенных ниже в виде одной из последовательностей SEQ ID NO: 5, 6, 8 или 9, или комплементарной им последовательности. В предпочтительном варианте осуществления настоящего изобретения последовательность нуклеиновой кислоты по настоящему изобретению включает последовательность нуклеиновой кислоты, приведенную ниже, в виде одной из последовательностей SEQ ID NO: 5, 6, 8 или 9. В другом объекте настоящего изобретения также предусмотрены полипептиды, предпочтительно выделенные полипептиды, которые кодируются последовательностями нуклеиновой кислоты по настоящему изобретению, описанными выше. В предпочтительном варианте осуществления настоящего изобретения полипептид по настоящему изобретению имеет аминокислотную последовательность, выбранную из группы аминокислотных последовательностей, представленных в виде SEQ ID NO: 7 или 10. В еще одном объекте настоящего изобретения предусмотрены химерные конструкции, которые включают последовательность нуклеиновой кислоты по настоящему изобретению, описанную выше, под контролем регуляторных элементов, предпочтительно под контролем регуляторных элементов, функционирующих в растениях. В одном из предпочтительных вариантов осуществления настоящего изобретения химерная конструкция по настоящему изобретению дополнительно включает ген селективного маркера, который позволяет отличить трансформированный и нетрансформированный растительный материал в процессе отбора. В другом предпочтительном варианте осуществления настоящего изобретения предусмотрена химерная конструкция по настоящему изобретению, или для трансгенного снижения регуляции, или для подавления экспрессии эндогенного гена BvFT2 в сахарной свекле, или для трансгенного повышения регуляции экспрессии эндогенного гена BvFT1 в сахарной свекле. Один из объектов настоящего изобретения связан с химерными конструкциями, предусмотренными для трансгенной пониженной регуляции или для подавления экспрессии эндогенного гена BvFT2 в сахарной свекле. В предпочтительном варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению является химерной конструкцией, с помощью которой пониженная регуляция или подавление достигается с помощью средств, выбранных из дцРНК, антисмысловой супрессии или совместной супрессии. В еще одном предпочтительном варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению включает гетерологичную ДНК, которая кодирует первую цепь РНК и вторую цепь РНК, и которая при транскрипции дает первую нуклеотидную последовательность РНК и вторую нуклеотидную последовательность РНК, причем указанная первая цепь РНК в значительной степени комплементарна по меньшей мере части цепи РНК эндогенного гена BvFT2 у сахарной свеклы для гибридизации или отжига с цепью РНК, сформированной указанным эндогенным геном BvFT2 таким образом, что вызывает снижение регуляции или супрессию экспрессии эндогенного гена BvFT2, и в котором указанная первая нуклеотидная последовательность РНК и указанная вторая нуклеотидная последовательность РНК формируют двухцепочечную РНК, причем двухцепочечная РНК при экспрессии в растении сахарной свеклы участвует в РНК интерференции экспрессии указанного эндогенного генаBvFT2, тем самым, вызывая снижение регуляции или подавление экспрессии эндогенного гена BvFT2. В еще одном предпочтительном варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению, описанная выше, включает инвертированный повтор, предпочтительно оперативно связанный с конститутивным промотором, который затем транскрибируется, формирует молекулу двухцепочечной РНК в растении сахарной свеклы, включая указанные первую и вторую цепи РНК, причем указанная молекула двухцепочечной РНК индуцирует сайленсинг BvFT2. В другом предпочтительном варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению включает гетерологичную ДНК, кодирующую последовательность нуклеиновой кислоты, которая или идентична по меньшей мере на 70% последовательности нуклеиновой кислоты по настоящему изобретению, представленной выше в виде последовательности SEQ ID NO: 8 или 9, или включающей по меньшей мере 15 последовательных нуклеотидов последовательности по настоящему изобретению, представленной ниже в виде последовательностей SEQ ID NO: 8 или 9, или гибридизируется в жестких условиях с последовательностью нуклеиновой кислоты по настоящему изобретению, представленной ниже в виде последовательностей SEQ ID NO: 8 или 9. В одном из вариантов осуществления настоящего изобретения химерная конструкция по настоящему изобретению включает гетерологичную ДНК, получаемую из фрагмента кДНК размером 0,27 т.н.,состоящего из экзона 4 гена BvFT2, в реакции ПЦР, используя прямой праймер HiNK6382 с нуклеотидной последовательностью 5'-CTATGGATCCGCATTTAATAAAATCTCTTTCAATG-3' (SEQ ID NO: 44) и обратный праймер HiNK6384 с нуклеотидной последовательностью 5'-GTAGAAGCAGAAACTTACCTGCCAAGAAGTTGTCTGCTATG-3' (SEQ ID NO: 45). В другом варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению включает гетерологичную ДНК, ограниченную нуклеотидами от 8747 до 9046 в последовательности SEQ ID NO: 33. В еще одном из вариантов осуществления настоящего изобретения гетерологичная ДНК, включенная в химерная конструкция по настоящему изобретению, инсертирована между промотором и терминатором, причем указанную гетерологичную ДНК получают следующим образом: а) амплификацией фрагмента кДНК размером 0,27 т.н., производного от экзона 4 гена BvFT2, в реакции ПЦР, используя прямой праймер HiNK6382 с нуклеотидной последовательностью 5'-CTATTCTGCTATG-3' (SEQ ID NO: 45), а также кДНК сахарной свеклы в качестве матрицы, причем кДНК сахарной свеклы получают из суммарной РНК, экстрагированной из листьев сахарной свеклы в реакции обратной транскриптазы, используя 3' RACE адаптер с нуклеотидной последовательностью 5'GCGAGCACAGAATTAATACGACTCACTATAGGT12VN-3' (SEQ ID NO: 35) в качестве праймера; б) амплификацией фрагмента кДНК размером 0,19 т.н., включающего интрон ST-LS1 и фланкирующий сайты сплайсинга, используя прямой праймер HiNK6383 с нуклеотидной последовательностью 5'-CATAGCAGACAACTTCTTGGCAGGTAAGTTTCTGCTTCTAC-3' (SEQ ID NO: 46) и обратный праймер HiNK529 с нуклеотидной последовательностью 5'-ATCCAACCGCGGACCTGCACATCAACAA-3'(SEQ ID NO: 40), а также ДНК картофеля, содержащую интрон картофеля St-LS1 в качестве матрицы; в) гибридизацией продуктов амплификации, полученных на стадиях а) и б), друг с другом с помощью второго круга ПЦР, используя праймеры HiNK6382 и HiNK529 и используя смесь обоих продуктов амплификации в качестве матрицы, получая продукт гибридизации длиной 0,47 т.н.; г) амплификацией фрагмента BvFT2 размером 0,27 т.н., используя прямой праймер HiNK6385 с нуклеотидной последовательностью 5'-TAAATCCGCGGGCCAAGAAGTTGTCTGCTATG-3' (SEQ IDCGACGCATTTAATAAAATCTCTTTC-3' (SEQ ID NO: 48) и кДНК сахарной свеклы, полученной согласно указанному выше подпункту а), в качестве матрицы; д) гибридизацией обоих фрагментов по сайтам рестрикции Sac II для создания инвертированного повтора последовательности BvFT2, отделенного интроном от гена картофеля ST-LS1. В другом варианте осуществления настоящего изобретения объектом является химерная конструкция по настоящему изобретению, которая включает последовательность, представленную ниже в виде нуклеотидной последовательности SEQ ID NO: 332. Другой объект по настоящему изобретению связан с химерными конструкциями, созданными для трансгенного повышения регуляции экспрессии эндогенного гена BvFT1 в сахарной свекле. В другом варианте осуществления настоящего изобретения объектом является химерная конструкция по настоящему изобретению для трансгенного повышения регуляции экспрессии эндогенного гена указанная нуклеотидная последовательность, кодирующая ген BvFT1 или его части, имеет нуклеотидную последовательность, которая или идентична по меньшей мере на 70%, или гибридизируется в жестких условиях с последовательностью нуклеиновой кислоты по настоящему изобретению, представленной ниже в виде последовательностей SEQ ID NO: 5 или 6, причем указанная нуклеотидная последовательность, кодирующая ген BvFT1 или его части, оперативно связана с регуляторными последовательностями таким образом, что при экспрессии в растении индуцируется повышенная регуляция экспрессии эндогенного гена BvFT1. В другом предпочтительном варианте осуществления настоящего изобретения нуклеотидную последовательность, кодирующую ген BvFT1 и включенная в химерная конструкция по настоящему изобретению, имеет нуклеотидную последовательность, указанную ниже в виде последовательности SEQ IDNO: 6. В другом предпочтительном варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению, описанная выше, включает нуклеотидную последовательность, представленную нуклеотидами от 2076 до 2615 в последовательности SEQ ID NO: 34. В еще одном предпочтительном варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению, описанная выше, включает нуклеотидную последовательность,представленную в последовательности SEQ ID NO: 34. В другом предпочтительном варианте осуществления настоящего изобретения гетерологичная ДНК, включенная в химерную конструкцию по настоящему изобретению, оперативно связана с конститутивном промотором, предпочтительно промотором Ubi3 из Arabidopsis. Другой объект по настоящему изобретению относится к вектору для трансформации растения и/или к растительному вектору экспрессии, включающему химерную конструкцию по настоящему изобретению, описанную выше. В одном из предпочтительных вариантов осуществления настоящего изобретения вектор для трансформации растений по настоящему изобретению является вектором экспрессии РНКи, включающим химерную конструкцию по настоящему изобретению, описанную выше, и/или вектором экспрессии растений, включающим химерную конструкцию по настоящему изобретению. В другом предпочтительном варианте осуществления настоящего изобретения вектор экспрессии РНКи по настоящему изобретению включает химерную конструкцию, имеющую нуклеотидную последовательность SEQ ID NO: 33, представленную ниже. В еще одном предпочтительном варианте осуществления настоящего изобретения вектор экспрессии по настоящему изобретению включает химерную конструкцию с нуклеотидной последовательностью SEQ ID NO: 34, представленной ниже. В другом предпочтительном варианте осуществления настоящего изобретения предусмотрено трансгенное растение сахарной свеклы, в котором модулируют экспрессию эндогенного гена BvFT1 и/или гена BvFT2, или его клетки, ткани или семена, причем понижена регуляция или супрессирована экспрессии эндогенного гена BvFT2 в указанном трансгенном растении сахарной свеклы, и/или повышена регуляция экспрессии эндогенного гена BvFT1 в указанном трансгенном растении сахарной свеклы. В одном предпочтительном варианте осуществления настоящего изобретения предусмотрено трансгенное растение, или клетки, или семена сахарной свеклы, в которых понижена регуляция или супрессирована экспрессия эндогенного гена BvFT2 способом, выбранным из группы, состоящей из дцРНК, антисмысловой супрессией или совместной супрессии. В еще одном предпочтительном варианте осуществления настоящего изобретения трансгенное растение сахарной свеклы по настоящему изобретению, или его клетки, ткани или семена, включают химерную конструкцию по настоящему изобретению или последовательность нуклеиновой кислоты по настоящему изобретению, причем указанное трансгенное растение сахарной свеклы, или его клетки, ткани или семена, экспрессирующие дцРНК, устойчивы к выходу в стрелку и проявляют фенотип отсроченного выхода в стрелку, предпочтительно фенотип отсутствия выхода в стрелку. В другом предпочтительном варианте осуществления настоящего изобретения трансгенное растение сахарной свеклы, или его клетки, ткани или семена по настоящему изобретению содержат химерную конструкцию по настоящему изобретению или последовательность нуклеиновой кислоты по настоящему изобретению, причем в указанном трансгенном растении сахарной свеклы эндогенный BvFT1 сверхэкспрессируется и растение проявляет фенотип отложенного выхода в стрелку, предпочтительно фенотип отсутствия выхода в стрелку. В другом предпочтительном варианте осуществления настоящего изобретения трансгенное растение сахарной свеклы получают из клеток, тканей или семян по настоящему изобретению, согласно описанному выше. Другой предпочтительный вариант осуществления настоящего изобретения относится к корню или к потомству трансгенного растения сахарной свеклы по настоящему изобретению. Другой объект по настоящему изобретению относится к способу получения гибридных семян, из которых могут быть выращены растения сахарной свеклы с фенотипом устойчивости к выходу в стрелку,причем указанный способ включает следующие стадии:a) получения линии сахарной свеклы с фенотипом устойчивости к выходу в стрелку, особенно трансгенного растения сахарной свеклы по настоящему изобретению, описанного выше, в качестве первой родительской линии,б) получения в качестве второй родительской линии линию сахарной свеклы с генотипом, отличным от генотипа линии сахарной свеклы, полученной на стадии а); причем одной из родительских линий, полученных на стадии а) или стадии б), является линия ЦМС с мужской стерильностью, а другой родительской линией -линия с мужской фертильностью, и в) опыления растениями родительской фертильной мужской линии цветов растений родительской линии с мужской стерильностью, что приводит к получению семян, и сбора семян,причем собранные гибридные семена являются семенами растения сахарной свеклы с фенотипом отложенного выхода в стрелку, предпочтительно с фенотипом устойчивости к выходу в стрелку. В одном из вариантов осуществления настоящего изобретения предусмотрен способ получения гибридных семян сахарной свеклы по настоящему изобретению, в котором мужская стерильная родительская линия ЦМС сахарной свеклы является инбредной линией сахарной свеклы, включающей химерную конструкцию по настоящему изобретению, описанную выше. Еще один предпочтительный вариант осуществления настоящего изобретения относится к гибридным семенам растения сахарной свеклы с фенотипом отложенного выхода в стрелку, предпочтительно с фенотипом отсутствия выхода в стрелку. В другом предпочтительном варианте осуществления настоящего изобретения гибридные семена по настоящему изобретению получают способом получения гибридных семян сахарной свеклы по настоящему изобретению, описанным выше. В еще одном предпочтительном варианте осуществления настоящего изобретения гибридные растения сахарной свеклы с фенотипом отложенного выхода в стрелку, предпочтительно с фенотипом отсутствия выхода в стрелку, получают выращиванием гибридных семян по настоящему изобретению,описанным выше. Другой объект по настоящему изобретению относится к частям растений, выбранных из группы,состоящей из семян, зародышей, микроспор, пыльников, зигот, протопластов, клеток, завязей, семяпочек,пыльцы, корнеплодов, семядолей, экстрактов или биологических образцов, причем указанные части растений получены из растения или клеток, тканей или семян трансгенной сахарной свеклы по настоящему изобретению, описанной выше, или из гибридных семян по настоящему изобретению, описанных выше,или из гибридных растений сахарной свеклы по настоящему изобретению, описанных выше. Еще один объект настоящего изобретения относится к применению последовательности нуклеиновой кислоты, или химерной конструкции по настоящему изобретению, описанной выше, или их фрагментов для трансформации клеток сахарной свеклы. В другом варианте осуществления настоящего изобретения предусмотрен способ трансформации клеток сахарной свеклы, включающий применение последовательности нуклеиновой кислоты по настоящему изобретению, описанной выше, или химерной конструкции по настоящему изобретению, или вектора по настоящему изобретению, описанного выше. Другой вариант осуществления настоящего изобретения относится к применению трансгенного растения сахарной свеклы по настоящему изобретению, гибридного растения сахарной свеклы по настоящему изобретению или частей растений по настоящему изобретению в способе, выбранном из группы, включающей способы получения сахара, способы аэробной ферментации и способы анаэробной ферментации, особенно в способе получения сахара. В предпочтительном варианте осуществления настоящего изобретения предусмотрен способ получения сахара, в котором растения, клетки или ткани сахарной свеклы по настоящему изобретению, описанные выше, перерабатывают для получения сахара. Еще один объект по настоящему изобретению относится к сахару, полученному из растений, клеток или тканей сахарной свеклы по настоящему изобретению. Краткое описание фигур и последовательностей Фиг. 1 представляет выравнивание последовательностей иРНК ортологов FT из Arabidopsis (AtFT,номер в каталоге NM105222), Citrus (CiFT, номер в каталоге АВ 027456), пшеницы (TaFT, номер в каталоге AY705794) и риса (OsHd3a, номер в каталоге NM001063395). Положение вырожденных праймеровHiNK581 (SEQ ID No. 1) и HiNK860 (SEQ ID No. 2) выделены рамками. Фиг. 2 схематически представляет структуру гена BvFT1. Фиг. 3 схематически представляет структуру гена BvFT2. Фиг. 4 представляет сравнение аминокислотных последовательностей белков BvFT1 и AtFT. Консервативные аминокислоты отмечены темно-серым цветом, близкие - серым, отличающиеся - белым. Фиг. 5 представляет сравнение аминокислотных последовательностей белков BvFT2 и AtFT. Консервативные аминокислоты отмечены темно-серым цветом, близкие - серым, отличающиеся - белым. Фиг. 6 представляет филогенетический анализ множества представителей семейства гена FT от разных видов растений, включая гомологи FT из сахарной свеклы. Филогенетическое дерево построено методом Neighbor-Joining, используя гены Beta vulgaris BvFT1 и BvFT2, Arabidopsis thaliana (FT, номер вBAD01612; PnFT2, номер в каталоге BAD01561; PnFT3, номер в каталоге BAD02371; и PnFT4, номер в каталоге BAG12904). Бескорневые дендрограммы получают из выравнивания аминокислотных последовательностей, используя программу ClustalW, и филогенетическое дерево представляют с помощью программного пакета MEGA4 (Tamura и др., 2007). Величины бутстрапов для повторных выборок в 1000 образцов показаны на каждой ветви. Шкала показывает среднее число замещений на сайт. Гомологи Betavulgaris FT отмечены треугольником. Фиг. 7 представляет генетические карты хромосом сахарной свеклы IX и IV. Маркеры приведены справа от хромосомы; совокупное генетическое расстояние показано слева. Генетические карты строят,используя программу JoinMap 3.0. Генетические положения BvFT1 и BvFT2, соответственно, подчеркивают. Фиг. 8 представляет относительную экспрессию генов BvFT1 и BvFT2 в разных органах растений двухлетней сахарной свеклы. Образцы отбирают у двухлетних растений сахарной свеклы, выращенных в условиях 16 ч света/8 ч темноты при температуре 18 С. Уровни выявленных ампликонов нормализуют по продуктам амплификации, которые соответствуют гену бета-изоцитратдегидрогеназы (beta isocitratedehydrogenase - BvICDH). Базовые координаты представляют средние величины трех биологических повторов. Фиг. 9 представляет относительные уровни генной экспрессии BvFT1 и BvFT2 на разных стадиях развития двухлетней и однолетней сахарной свеклы. Затененная полоса представляет период яровизации. Уровни выявляемых ампликонов для BvFT1 и BvFT2 нормализуют по продуктам амплификации, соответствующим гену бета-изоцитратдегидрогеназы (beta isocitrate dehydrogenase - BvICDH), который используют в качестве внутренних генов калибровки (см. пример 3). Базовые координаты представляют среднюю величину двух биологических повторов. Фиг. 10 представляет суточное колебание генов BvFT1 и BvFT2 у однолетних, двухлетних и яровизированных двухлетних растений. Транскрипты из тканей листьев, собиравшиеся каждые 2 ч на протяжении 24 ч, оценивают количественно с помощью количественной ПЦР. Проводят три независимых эксперимента в условиях короткого дня (КД) (10 ч света/14 ч темноты), или в условиях длинного дня (ДД)(16 ч света/8 ч темноты), или в условиях КДДД, причем растения выращивают одну неделю в условиях КД, а затем переносят в условия ДД. Уровни выявленных ампликонов нормализуют по продуктам амплификации, соответствующим гену BvICDH1, который используют в качестве внутреннего гена калибровки. Базовые координаты представляют среднюю величину трех биологических повторов. Фиг. 11 представляет время выхода в стрелку у однолетних, двухлетних и яровизированных двухлетних растений, выращенных в разных условиях фотопериодизма. Условия КД означают 10 ч света/14 ч темноты. Условия ДД означают 16 ч света/8 ч темноты. Время выхода в стрелку измеряют, основываясь на общем числе листьев от 6 независимых растений. Фиг. 12 представляет относительную экспрессию BvFT1 и BvFT2 у однолетних растений на протяжении 72 ч. Первые 24 ч состоят из 10 ч света/14 ч темноты, затем на протяжении 48 ч освещение меняют на 16 ч света/8 ч темноты. Уровни выявляемых ампликонов нормализуют по для амплификации продуктов, которые соответствуют гену BvICDH. Базовые координаты представляют среднюю величину трех биологических повторов. Фиг. 13 представляет воздействие эктопической экспрессии генов BvFT1 и BvFT2 на время цветения у Arabidopsis, (A) - фенотип 30-суточных растений Arabidopsis дикого типа (Col-0) и трансгенных растений Arabidopsis, экспрессирующих BvFT1 и BvFT2, выращенных в условиях ДД. (Б) - фенотип 20 суточных мутантов ft-10 и трансгенных мутантов ft-10, экспрессирующих BvFT2, выращенных в условиях ДД (16 ч света/8 ч темноты). Фиг. 14 представляет картирование специфического действия BvFT1 и BvFT2 на сегмент В экзона 4, который кодирует внешнюю петлю белков РЕВР. (А) - структура разных химер, используемых в настоящем исследовании, и их воздействие на время цветения у Arabidopsis. Экзонные части генов BvFT1 иBvFT2E4B1 (SEQ ID No. 32) представляют химеру, основанную на BvFT2, в которой сегмент В экзона 4 происходит из BvFT1. (Б) - время цветения растений Arabidopsis, экспрессирующих BvFT1, BvFT2 или химеры BvFT1/BvFT2. Растения Т 1 выращивают в условиях ДД. Число листьев представлено в виде средней величины по меньшей мере из 15 независимых растений T1 стандартное отклонение. Фиг. 15 представляет плазмидную карту бинарного вектора pHiNK525 (SEQ ID No. 33), несущего РНКи генную кассету для BvFT2 под контролем конститутивного промотора UBQ3 из Arabidopsis в комбинации с селективным маркером PMI. Фиг. 16 представляет влияние супрессии гена BvFT2 на время выхода в стрелку у однолетней сахарной свеклы Т 0, выращенной в условиях индукции выхода в стрелку (18 С; 18 ч света/6 ч темноты).(А) - фенотип нетрансгенной однолетней линии и трансгенного однолетнего растения BvFT2 дцРНКi.(Б) - фенотип отсутствия выхода в стрелку, однолетнее трансгенное растение BvFT2 дцРНКи в возрасте 400 суток. Фиг. 17 представляет влияние супрессии гена BvFT2 на время выхода в стрелку у однолетней сахарной свеклы Т 1, выращенной в условиях индукции выхода в стрелку (18 С; 18 ч света/6 ч темноты). Три растения с выходом в стрелку слева не являются трансгенными растениями (НТ), а три растения без выхода в стрелку являются растениями BvFT2 дцРНКи (событие 2 А). Фотография сделана на 36 сутки эксперимента. Фиг. 18 представляет плазмидную карту бинарного вектора Ubi3BvFT1 (SEQ ID No. 34), несущего генную кассету Ubi3BvFT1 для BvFT1 в комбинации с геном селективного маркера PMI под контролем промотора superMAS. Фиг. 19 представляет относительную экспрессию BvFT1 в корнях PMI-положительного растенияT0, несущего генную кассету Ubi3BvFT1. Уровни выявленных ампликонов нормализуют по продуктам амплификации, которые соответствуют гену BvICDH. Данные по нетрансгенному контрольному растению T0 представляют среднюю величину трех биологических повторов. Фиг. 20 представляет плазмидную карту бинарного вектора pHiNK498 (SEQ ID No. 53), несущего ген селективного маркера PMI вниз по цепи от промотора pOp6 и объединенного с генной кассетой для конститутивной экспрессии LhG4Ato под контролем промотора Ubi3 из Arabidopsis. Фиг. 21 представляет плазмидную карту бинарного вектора (SEQ ID No. 54), несущего инвертированный повтор, также присутствующий у pHiNK525 (см. пример 7), вниз по цепи от фрагмента промотора pOp6 и объединенный с геном селективного маркера PMI под контролем промотора SuperMAS. Фиг. 22 представляет плазмидную карту бинарного вектора (SEQ ID No. 55), несущего кодирующую область полной длины BvFT1 вниз по цепи от фрагмента промотора pOp6 и объединенный с геном селективного маркера PMI под контролем промотора SuperMAS. ПоследовательностиSEQ ID No: 1 представляет нуклеотидную последовательность вырожденного праймера HiNK581.SEQ ID No: 2 представляет нуклеотидную последовательность вырожденного праймера HiNK860.SEQ ID No: 3 представляет фрагмент гена FT1 сахарной свеклы (называемый фрагментом BvFT1),полученный в реакции ПЦР, используя вырожденные праймеры согласно описанию в примере 1.SEQ ID No: 4 представляет фрагмент гена FT 2 сахарной свеклы (называемый фрагментом BvFT2),полученный в реакции ПЦР, используя вырожденные праймеры согласно описанию в примере 1.SEQ ID No: 5 представляет геномную последовательность гена FT1 сахарной свеклы, полученную секвенированием ВАС SBA066-G04.SEQ ID No: 6 представляет соответствующую кодирующую последовательность гена FT1 сахарной свеклы, показанную в SEQ ID No: 5.SEQ ID No: 7 представляет белковую последовательность белка, кодируемого кодирующей последовательностью сахарной свеклы FT1, представленной в виде SEQ ID NO: 6.SEQ ID No: 8 представляет геномную последовательность гена FT2 сахарной свеклы, полученную секвенированием ВАС SBA077-N02.SEQ ID No: 9 представляет соответствующую кодирующую последовательность гена FT2 сахарной свеклы, показанную в SEQ ID No: 8.SEQ ID No: 10 представляет последовательность белка, кодируемого последовательностью гена FT2 сахарной свеклы, представленной в виде SEQ ID NO: 9.SEQ ID No: 11 представляет нуклеотидную последовательность прямого праймера SELA3770 дляSEQ ID No: 12 представляет нуклеотидную последовательность обратного праймера SELA3771 дляSEQ ID No: 13 представляет нуклеотидную последовательность прямого праймера SELA3776 дляSEQ ID No: 14 представляет нуклеотидную последовательность обратного праймера SELA3777 дляSEQ ID No: 15 представляет нуклеотидную последовательность прямого праймера SELA 4259 дляSEQ ID No: 16 представляет нуклеотидную последовательность обратного праймера SELA4260 дляSEQ ID No: 17 представляет нуклеотидную последовательность SELA4261 зонда 1 для FT1(T1).SEQ ID No: 18 представляет нуклеотидную последовательность SELA4262 зонда 2 для FT1(T1).SEQ ID No: 19 представляет нуклеотидную последовательность прямого праймера SELA4263 дляSEQ ID No: 20 представляет нуклеотидную последовательность обратного праймера SELA4264 дляSEQ ID No: 21 представляет нуклеотидную последовательность SELA4265 зонда 1 для FT2(T1).SEQ ID No: 22 представляет нуклеотидную последовательность SELA4266 зонда 2 для FT2(T1).SEQ ID No: 23 представляет нуклеотидную последовательность прямого праймера SELA3730 дляSEQ ID No: 24 представляет нуклеотидную последовательность обратного праймера SELA3731 дляSEQ ID No: 25 представляет нуклеотидную последовательность прямого праймера SELA3732 дляSEQ ID No: 26 представляет нуклеотидную последовательность обратного праймера SELA3733 дляSEQ ID No: 27 представляет нуклеотидную последовательность прямого праймера SELA3724 для гена бета-изоцитратдегидрогеназы BvICDH1.SEQ ID No: 28 представляет нуклеотидную последовательность обратного праймера SELA3725 для гена бета-изоцитратдегидрогеназы BvICDH1.SEQ ID No: 29 представляет последовательность химерного гена, обозначаемого BvFT1112.SEQ ID No: 30 представляет последовательность генной химеры, обозначаемой BvFT2221.SEQ ID No: 31 представляет последовательность генной химеры, обозначаемой BvFT1E4B2.SEQ ID No: 32 представляет последовательность генной химеры, обозначаемой BvFT2E4B1.SEQ ID No: 33 представляет нуклеотидную последовательность бинарного вектора pHiNK525, который несет кассету экспрессии, включающую инвертированный повтор экзона 4 гена BvFT2.SEQ ID No: 34 представляет нуклеотидную последовательность бинарного вектора 17602(Ubi3BvFT1), который несет кассету экспрессии, включающую кодирующую последовательностьBvFT1 под контролем конститутивного промотора.SEQ ID No: 35 представляет нуклеотидную последовательность 3' RACE адаптера, используемого в реакции обратной транскриптазы.SEQ ID No: 36 представляет нуклеотидную последовательность 3' RACE внешний праймер.SEQ ID No: 37 представляет нуклеотидную последовательность 3' RACE внутренний праймер.SEQ ID No: 38 представляет нуклеотидную последовательность прямого праймера HiNK6371 дляSEQ ID No: 39 представляет нуклеотидную последовательность обратного праймера HiNK6372 дляSEQ ID No: 40 представляет нуклеотидную последовательность праймера HiNK529.SEQ ID No: 41 представляет нуклеотидную последовательность праймера HiNK6373 для BvFT1.SEQ ID No: 42 представляет нуклеотидную последовательность праймера HiNK6374 для BvFT1.SEQ ID No: 43 представляет нуклеотидную последовательность праймера HiNK6375 для BvFT1.SEQ ID No: 44 представляет нуклеотидную последовательность праймера HiNK6382 для BvFT2.SEQ ID No: 45 представляет нуклеотидную последовательность праймера HiNK6384 для BvFT2.SEQ ID No: 46 представляет нуклеотидную последовательность праймера HiNK6383 для BvFT2.SEQ ID No: 47 представляет нуклеотидную последовательность праймера HiNK6385 для BvFT2.SEQ ID No: 48 представляет нуклеотидную последовательность праймера HiNK6386 для BvFT2.SEQ ID No: 49 представляет аминокислотную последовательность аминокислотного мотиваSEQ ID No: 50 представляет аминокислотную последовательность аминокислотного мотива"LVTDIPATT" (аминокислотные остатки с 89 по 98) в экзоне 3 сразу вниз по цепи от сайта сплайсирования интрона 2 гена FT Arabidopsis.SEQ ID No: 51 представляет нуклеотидную последовательность праймера SELA267 для PMI.SEQ ID No: 52 представляет нуклеотидную последовательность праймера SELA 268 для PMI.SEQ ID No: 53 представляет нуклеотидную последовательность бинарного вектора pHiNK498, который несет кассету экспрессии, включающую ген селективного маркера PMI вниз по цепи от промотораpOp6 и объединенный с генной кассетой для конститутивной экспрессии LhG4Ato под контролем промотора Ubi3 из Arabidopsis.SEQ ID No: 54 представляет нуклеотидную последовательность бинарного вектора, который несет кассету экспрессии, включающую инвертированный повтор, также присутствующий у pHiNK525 (см. пример 7) вниз по цепи от фрагмента промотора pOp6 и объединенный с геном селективного маркераPMI под контролем промотора SuperMAS.SEQ ID No: 55 представляет нуклеотидную последовательность бинарного вектора, который несет кассету экспрессии, включающую кодирующую область полной длины гена BvFT1 вниз по цепи от фрагмента промотора pOp6 и объединенную с геном селективного маркера PMI под контролем промотора SuperMAS. Определения Технические термины и выражения, используемые в рамках настоящего изобретения, в целом,имеют значение, обычно применяемые в области растениеводства, если в настоящем изобретении ниже не указано иначе. В настоящем описании и в формуле изобретения подразумевается, что понятия в форме единственного числа также означают множественное число, если из контекста настоящего изобретения четко не следует иное. Например, понятие "растение" относится к одному или нескольким растениям, а понятие"клетка" включает смесь клеток, тканей и т.д. Понятие "сахарная свекла" относится ко всем видам и подвидам рода Beta, а также ко всем типам культивируемых представителей вида Beta vulgaris. Культивируемую свеклу разделяют на четыре группы: листовую свеклу, садовую свеклу, кормовую свеклу и сахарную свеклу. "Сахарная свекла" также относится ко всем культивируемым типам свеклы, включая выращенную для других целей свеклу, а не для получения сахара, например, для получения этанола, пластика или других промышленных продуктов. В частности, понятие "сахарная свекла" относится к кормовой свекле и к сахарной свекле, но особенно к сахарной свекле. Этот термин также включает растения сахарной свеклы, адаптированные для роста в тропических или субтропических регионах. Понятие "двухлетняя сахарная свекла" относится к растению сахарной свеклы, у которого полный биологический жизненный цикл составляет два года. Понятие "однолетняя сахарная свекла" относится к растению сахарной свеклы, которое прорастает, цветет и погибает за один год. Понятие "выхода в стрелку" относится к переходу от стадии вегетативной розетки к стадии цветения и репродуктивного роста. Понятие "создание устойчивости к выходу в стрелку" в контексте настоящего изобретению относится к модулированию экспрессии генов FT Beta vulgaris в сахарной свекле методами генной инженерии. Такие сконструированные растения сахарной свеклы показывают фенотип устойчивости к выходу в стрелку, у которого реакция выхода в стрелку в ответ на яровизацию задерживается или полностью подавляется. У растений сахарной свеклы с устойчивостью к выходу в стрелку также отсутствует цветение(т.е. у них проявляется устойчивость к цветению), поскольку без выхода в стрелку в норме не формируются цветки. Понятие "задержка реакции выхода в стрелку" или в кратком выражении "задержка выхода в стрелку" в контексте настоящего изобретения означает модулирование природной реакции выхода в стрелку у растений сахарной свеклы в ответ на яровизацию. У растений сахарной свеклы с задержкой выхода в стрелку (т.е. растения с устойчивостью к выходу в стрелку), удлинение стебля, служащее показателем первой видимой стадии выхода в стрелку, начинается позже, чем у растений дикого типа. Реакция выхода в стрелку может быть отложена всего лишь на несколько суток (т.е., например, на 5, 6, 7, 8, 9, 10, 11,12, 13 или 14 суток) и до нескольких недель (т.е. на 2, 3, 4, 5, 6, 7 или 8 недель) или нескольких месяцев(т.е. 1, 2, 3, 5 или 6 месяцев). Задержка выхода в стрелку также может привести к полному подавлению ответа в виде выхода в стрелку; такие растения не выходят в стрелку после яровизации и проявляют фенотип отсутствия выхода в стрелку, при котором продолжается вегетативный рост. Понятие "яровизация" относится к процессу, с помощью которого индукция цветения у некоторых растений индуцируется путем воздействия на растения холода на протяжении определенного периода времени. В контексте настоящего изобретения понятие "фенотипическая особенность" относится к внешнему признаку или иной выявляемой характеристике индивидуума, возникающей из взаимодействия его генома с окружающей средой. Понятие "фенотип" в контексте настоящего изобретения относится к отличительному свойству(свойствам) генетически контролируемого признака. Понятие "кодирующая последовательность" означает последовательность нуклеиновой кислоты,которая транскрибируется в РНК, например, иРНК, рРНК, тРНК, малые ядерные РНК (мяРНК), смысловую РНК или антисмысловую РНК. Предпочтительно РНК затем транслируется в организме для выработки белка. Она может составлять "непрерывную кодирующую последовательность", т.е. утратить интрон, например, в кДНК, или она может включать один или несколько интронов, связанных сплайсированных соединений. Понятие "интрон" означает последовательность РНК, которая содержится в первичном транскрипте, но которая удаляется путем расщепления и повторного лигирования РНК в клетке для создания зрелой иРНК, которая может быть транслирована в белок. Понятие "ген" означает область, локализованную в геноме, которая за исключением вышеупомянутой кодирующей последовательности нуклеиновой кислоты включает другие первоначально регуляторные последовательности нуклеиновой кислоты, ответственные за контроль экспрессии, иначе говоря,транскрипции и трансляции кодирующей части. Ген также может включать другие 5' и 3' нетранслируемые последовательности и концевые последовательности. Также могут присутствовать дополнительные элементы, например, интроны. Понятие "исследуемый ген" относится к какому-либо гену, который при переносе в растение придает ему требуемое свойство или фенотип, например, устойчивость к антибиотику, устойчивость к вирусу, устойчивость к насекомым, устойчивость к болезням или устойчивость к другим вредителям, переносимость гербицидов, улучшенные пищевые свойства, улучшенные эксплуатационные качества при производственной деятельности или измененную репродуктивную способность. Понятие "генотип" в контексте настоящего изобретения относится к генетическому материалу, унаследованному от родительских растений сахарной свеклы, который не в полной мере может экспрессироваться в последующих поколениях растений сахарной свеклы. Генотип относится к гетерологическому генетическому материалу, фланкированному инсертированной последовательностью. Понятие "полинуклеотидный" таким образом относится к полимеру ДНК или РНА. Понятие "нуклеиновая кислота" относится к дезоксирибонуклеотидам и рибонуклеотидам и их полимерам, которые могут быть одно- и двухцепочечными, необязательно содержащими синтетические, неприродные или измененные нуклеотидные основания, которые могут быть инкорпорированы в полимеры ДНК или РНК,состоящие из мономеров (нуклеотидов), содержащих сахар, фосфат и основание, которое является пурином или пиримидином. Несмотря на специфические ограничения, понятие охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые обладают схожими связывающими свойствами с контрольной нуклеиновой кислотой и метаболизируются сходным образом с природными нуклеотидами. Если не указано иначе, определенная последовательность нуклеиновой кислоты также полностью охватывает ее консервативно модифицированные варианты (например, замещения вырожденных кодонов), комплементарные последовательности и четко указанные последовательности. Конкретно вырожденные замещения кодонов могут быть достигнуты путем выработки последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов замещено смешанным основанием и/или дезоксиинозиновыми остатками (Batzer и др., 1991; Ohtsuka и др., 1985; Rossolini и др., 1994). Понятие "фрагмент нуклеиновой кислоты" является фракцией данной молекулой нуклеиновой кислоты. У высших растений дезоксирибонуклеиновая кислота (ДНК) является генетическим материалом, хотя рибонуклеиновая кислота (РНК) вовлечена в перенос информации, содержащей в ДНК,на белки. Понятие "нуклеотидная последовательность" или "последовательность нуклеиновой кислоты" относится к полимеру ДНК или РНК, которые могут быть одноцепочечным или двухцепочечным, необязательно содержащими синтетические, неприродные или измененные нуклеотидные основания, способные инкорпорироваться в полимеры ДНК или РНК. Понятия "нуклеиновая кислота" или "последовательность нуклеиновой кислоты" также могут применяться взаимозаменяемо с геном, кДНК, ДНК и РНК,кодируемой геном. Понятия "выделенная", используемое в контексте молекул нуклеиновых кислот по настоящему изобретению, относится к последовательности нуклеиновой кислоты, которую идентифицировали и выделили/отделили от окружающей последовательности хромосомальной нуклеиновойкислоты в соответствующем организме-источнике. Выделенная нуклеиновая кислота не является той нуклеиновой кислотой,которая существует в природе, если она имеет природный аналог. Напротив, невыделенными нуклеиновыми кислотами являются нуклеиновые кислоты, например, ДНК и РНК, которые обнаружены в том состоянии, в котором они существуют в природе. Например, данная последовательность ДНК (например,ген) обнаружена в хромосоме клетки-хозяина рядом с соседними генами. Последовательность выделенной нуклеиновой кислоты может быть в одноцепочечной или двухцепочечной форме. В другом варианте она может содержать и смысловую, и антисмысловую цепь (т.е. последовательность нуклеиновой кислоты может быть двухцепочечной). В предпочтительном варианте осуществления настоящего изобретения подразумевается, что молекулы нуклеиновой кислоты по настоящему изобретению являются выделенными. Понятие "гетерологичный" применительно к гену или нуклеиновой кислоте означает ген, кодирующий фактор, который находится в неестественной для него среде (т.е. изменен усилиями человека). Например, гетерологичный ген может включать ген одного вида, внедренный в другой вид. Гетерологичный ген также может включать ген, нативный для организма, который был изменен некоторым образом (например, мутирован, добавлен в виде многих копий, связан с промотором, не являющимся нативным, или с энхансерной последовательностью и т.д.). Гетерологичные гены дополнительно могут включать последовательности гена растения, которые включают формы кДНК гена растения; последовательности кДНК могут экспрессироваться в смысловой (для получения иРНК) или в антисмысловой ориентации (для получения транскрипта антисмысловой РНК, комплементарного транскрипту иРНК). В одном из объектов настоящего изобретения гетерологичные гены отличаются от эндогенных генов растений тем, что последовательности гетерологичного гена обычно соединены с нуклеотидными последователь- 10024958 ностями, включая регуляторные элементы, например, промоторы, которые в природе не обнаружены ассоциированными с геном белка, кодируемого гетерологичным геном или с последовательностями генов растений в хромосоме, или ассоциированными с частями хромосомы, не найденными в природе (например, гены, экспрессируемые в локусах, в которых гены в норме не экспрессируются). Кроме того,"гетерологичная" нуклеотидная последовательность является нуклеотидной последовательностью, которая естественным образом не ассоциирована с клеткой-хозяином, в которую она интродуцирована,включая неприродные множественные копии природных последовательностей нуклеиновой кислоты. Понятие "гомологичная" нуклеотидная последовательность означает нуклеотидную последовательность, в норме связанную с клеткой-хозяином, в которую она интродуцирована. Понятие "химерная конструкция" в контексте настоящего изобретения относится к конструкции двух или нескольких последовательностей нуклеиновой кислоты разного происхождения, собранных в одну молекулу нуклеиновой кислоты. Понятие "химерная конструкция" относится к какой-либо конструкции, которая содержит (1) последовательности ДНК, включая регуляторные и кодирующие последовательности, которые не встречаются вместе в природе (т.е. по меньшей мере одна из нуклеотидных последовательностей гетерологична относительно по меньшей мере одной из других нуклеотидных последовательностей), или (2) последовательности, кодирующие части белков, которые в природе не граничат друг с другом, или (3) части промоторов, которые в природе не граничат друг с другом. Кроме того, химерная конструкция может включать регуляторные последовательности и кодирующие последовательности, которые происходят из разных источников, или включать регуляторные последовательности и кодирующие последовательности, происходящие из одного источника, но собранные иным образом, отличным от природного. В предпочтительном объекте по настоящему изобретению химерная конструкция включает кассету экспрессии, содержащую последовательность нуклеиновой кислоты по настоящему изобретению под контролем регуляторных элементов, в частности под контролем регуляторных элементов, функционирующих в растениях. Понятие "кассета экспрессии" в контексте настоящего изобретения означает молекулу нуклеиновой кислоты, способную направлять экспрессию определенной нуклеотидной последовательности или последовательностей в соответствующей клетке-хозяине, включающую промотор, оперативно связанный с нуклеотидными последовательностями или исследуемыми последовательностями, которые оперативно связаны с сигналами терминации. Кассета экспрессии обычно включает последовательности, необходимые для должной трансляции нуклеотидной последовательности (последовательностей). Кассета экспрессии также может включать последовательности, не являющиеся необходимыми для прямой экспрессии исследуемой нуклеотидной последовательности, но которые содержатся по соответствующим сайтам рестрикции для удаления кассеты из вектора экспрессии. Кассета экспрессии, включающая исследуемую нуклеотидную последовательность (последовательности), может быть химерной,что означает, что по меньшей мере один из ее компонентов является гетерологичным в отношении по меньшей мере одного из других компонентов. Кассета экспрессии также может быть природной, но полученной в рекомбинантной форме, пригодной для гетерологичной экспрессии. Однако обычно кассета экспрессии гетерологична по отношению к хозяину, т.е. определенная последовательность нуклеиновой кислоты кассеты экспрессии не содержится естественным образом в клетке-хозяине и должна быть интродуцирована в клетку-хозяина или к клетку-предшественницу клетки-хозяина с помощью процесса трансформации, известного в данной области. Экспрессия нуклеотидной последовательности (последовательностей) в кассете экспрессии обычно находится под контролем промотора. В случае многоклеточного организма, например, растения, промотор может быть также специфичным для определенной ткани или органа, или стадии развития. Кассета экспрессии или ее фрагмент также может быть названа "инсертированной последовательностью" или "последовательностью инсерции" после трансформации в растение. Понятия "белок", "пептид" и "полипептид" в настоящем изобретении используются взаимозаменяемо. Понятие "промотор" относится к нуклеотидной последовательности, обычно расположенной выше по цепи (5') его кодирующей последовательности, которая контролирует экспрессию кодирующей последовательности, обеспечивая распознавание для РНКполимеразы и других факторов, требуемых для правильной транскрипции. Понятие "конститутивный промотор" относится к промотору, который может экспрессировать открытую рамку считывания (open reading frame - ORF), которую он контролирует во всех или почти во всех растительных тканях на протяжении всех или почти всех стадий развития растения (так называемая"конститутивная экспрессия"). Каждый из элементов активации транскрипции не проявляет абсолютной тканеспецифичности, но опосредует активацию транскрипции в большинстве частей растения на уровне 1% от уровня, достигаемого в той части растения, в которой транскрипция наиболее активна. Понятие "регулируемый промотор" относится к промоторам, которые направляют генную экспрессию не конститутивно, а временно- и/или пространственно-регулируемым образом, и включает и тканеспецифичные, и индуцибельные промоторы. К ним относятся и природные, и синтетические последовательности, а также последовательности, которые могут сочетать в себе синтетические и природные по- 11024958 следовательности. Разные промоторы могут направлять экспрессию гена в разных типах тканей или клеток, или на разных стадиях развития, или в ответ на разные условия внешней среды. Понятие "тканеспецифичный промотор" относится к регулируемым промоторам, которые не экспрессируются в клетках растений, а только в одном или нескольких типах клеток в определенных органах (например, в листьях или семенах), определенных тканях (например, эмбриональных или в тканях семядолей), или в определенных типах клеток (например, в паренхиме листьев или в запасающих клетках семян). К ним также относятся промоторы, которые регулируются временно, например, в раннем или позднем эмбриогенезе, при созревании фруктов при развитии семян или фруктов, в полностью сформированных листьях или в начале старения. Понятие "индуцибельный промотор" относится к тем регулируемым промоторам, которые могут быть задействованы в клетках одного или нескольких типов под воздействием внешних стимулов, например, химических стимулов, света, гормона, стресса или патогенна. Понятие "оперативно связанные" относится к ассоциации последовательностей нуклеиновых кислот в одном фрагменте нуклеиновой кислоты таким образом, что функция одной влияет на функцию другой. Например, промотор, оперативно связанный с кодирующей последовательностью или функциональной РНК, если он может влиять на экспрессию этой кодирующей последовательности или функциональной РНК (т.е. что кодирующая последовательность или функциональная РНК находятся под контролем транскрипции промотором). Кодирующие последовательности в смысловой или антисмысловой ориентации могут быть оперативно связаны с регуляторными последовательностями. Понятие "праймеры" в контексте настоящего изобретения относится к выделенным нуклеиновым кислотам, способным выравниваться с комплементарной цепью ДНК-мишени путем гибридизации нуклеиновой кислоты для формирования гибрида между праймером и цепью ДНК-мишени, затем становится протяженным по цепи ДНК-мишени полимеразой, например, ДНКполимеразой. Пары праймеров или их совокупности могут применяться для амплификации молекулы нуклеиновой кислоты, например, путем полимеразной цепной реакции (ПЦР), или с помощью других методов амплификации молекулы нуклеиновой кислоты. В контексте настоящего изобретения понятие "полимеразная цепная реакция (ПЦР)" относится к способу получения относительно больших количеств специфических областей ДНК, тем самым делая осуществимым проведения различных анализов, основанных на этих областях. Понятие "праймер ПЦР" или "праймер" в контексте настоящего изобретения относится к коротким фрагментам выделенной одноцепочечной ДНК, используемой в ПЦР амплификации специфических областей ДНК. Их отжигают с комплементарной цепью ДНК-мишени путем гибридизации нуклеиновой кислоты для формирования гибрида между праймером и цепью ДНК-мишени, и протягивают по цепи ДНК-мишени полимеразой, например, ДНКполимеразой. Пары праймеров или их совокупности могут применяться для амплификации молекулы нуклеиновой кислоты, например, в полимеразной цепной реакции (ПЦР) или с помощью других известных методов амплификации нуклеиновых кислот. Праймеры обычно содержат от 10 до 15 нуклеотидов или более в длину. Праймеры также могут иметь в длину по меньшей мере 20 нуклеотидов или более, или по меньшей мере 25 нуклеотидов или более, или по меньшей мере 30 нуклеотидов или более. Такие праймеры гибридизируются специфически с целевой последовательностью в условиях гибридизации высокой жесткости. Праймеры по настоящему изобретению могут иметь последовательность, полностью комплементарную целевой последовательности. Следует учитывать, что длина праймеров по настоящему изобретению может быть каким-нибудь численным значением, выбранным из значений, описанных в настоящем изобретении. Таким образом, праймеры обычно содержат от 10 до 15 нуклеотидов или более в длину, включая праймеры длиной 10, 11, 12, 13, 14 или 15 нуклеотидов, поскольку экспрессия "по меньшей мере 20 нуклеотидов" дополнительно включает праймер длиной в 16, 17, 18, 19 или более нуклеотидов. То же применимо для экспрессии "по меньшей мере 25 нуклеотидов или более" и "по меньшей мере 30 нуклеотидов или более в длину". В контексте настоящего изобретения понятие "амплифицированный" означает конструкцию из множества копий молекулы нуклеиновой кислоты или множества копий комплементарной молекулы нуклеиновой кислоты, используя по меньшей мере одну из молекул нуклеиновой кислоты в качестве матрицы. Системы амплификации включают систему полимеразной цепной реакции (ПЦР), систему лигазной цепной реакции (ЛЦР), амплификацию на основе последовательности нуклеиновой кислоты (nucleic acid based sequence amplification - NASBA, фирма Cangene, Mississauga, Онтарио), системы Q-бета репликазы, систему амплификации на основе транскрипции (transcription-based amplification system TAS) и амплификацию путем вытеснения цепи (strand displacement amplification - SDA). См., например,кн.: "Diagnostic Molecular Microbiology: Principles and Applications", Persing и др., 1993, изд-во AmericanSociety for Microbiology, Вашингтон, округ Колумбия. Продукт амплификации называется ампликоном. Понятие "зонд" означает выделенную нуклеиновую кислоту, к которой присоединена обычная выявляемая метка или репортерная молекула, например, радиоактивный изотоп, лиганд, хемилюминесцентный агент или фермент. Такой зонд комплементарен цепи целевой нуклеиновой кислоты. Зонды по настоящему изобретению включают не только дезоксирибонуклеиновую или рибонуклеиновую кислоты,но также полиамиды и другие материалы зондов, которые специфически связываются с последователь- 12024958 ностью-мишенью ДНК и могут применяться для выявления наличия такой последовательности-мишени ДНК. Праймеры и зонды обычно содержат в длину 10-15 нуклеотидов или более. Праймеры и зонды также могут быть в длину по меньшей мере из 20 нуклеотидов или более, или по меньшей мере 25 нуклеотидов или более, или по меньшей мере 30 нуклеотидов или более. Такие праймеры и зонды гибридизируются специфически с последовательностью-мишенью в жестких условиях гибридизации. Праймеры и зонды по настоящему изобретению могут иметь полную последовательность, комплементарную последовательности-мишени, хотя зонды, отличающиеся от последовательности-мишени и сохраняющие способность гибридизироваться с последовательностями-мишенями, могут быть сконструированы традиционными методами. Следует учитывать, что длина праймеров и зондов по настоящему изобретению может быть какой-либо величиной из числа величин, указанных в настоящем изобретении. Таким образом,праймеры и зонды, обычно состоящие в длину из 10-15 нуклеотидов или более, включают праймер и зонды, длиной 10, 11, 12, 13, 14 или 15 нуклеотидов, причем экспрессия "по меньшей мере 20 нуклеотидов" дополнительно включает праймер и зонды длиной 16, 17, 18, 19 или более нуклеотидов. То же применимо к экспрессиям "по меньшей мере 25 нуклеотидов или более" и "по меньшей мере 30 нуклеотидов или более в длину". Существенная идентичность или гомология в контексте двух последовательностей нуклеиновой кислоты или белка относится к двум или более последовательностям или субпоследовательностям, которые идентичны по меньшей мере на 60%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, еще более предпочтительно по меньшей мере на 95%, и наиболее предпочтительно по меньшей мере на 99% нуклеотидную или аминокислотных остатков, при сравнении и выравнивании на максимальное соответствие, которое определяют, используя один из приведенных ниже алгоритмов сравнения последовательностей, или путем визуального анализа. В частности, прочная идентичность существует на протяжении областей последовательностей, состоящих по меньшей мере примерно из 50 остатков в длину, более прочная идентичность существует на протяжении областей последовательностей, состоящих по меньшей мере примерно из 100 остатков, и особенно последовательности в высокой степени идентичны на протяжении по меньшей мере примерно 150 остатков. В конкретном варианте осуществления настоящего изобретения последовательности в существенной степени идентичны по всей длине кодирующих областей. Более того, в значительной степени идентичные последовательности нуклеиновой кислоты или белка проявляют в значительной степени ту же функцию. Для сравнения последовательностей одна последовательность обычно действует в качестве контрольной последовательности, с которой сравнивают исследуемые последовательности. При использовании алгоритма сравнения последовательностей исследуемую и контрольную последовательности вводят в компьютер, координаты субпоследовательности при необходимости устанавливают и также устанавливают параметры программы алгоритма последовательности. С помощью алгоритма сравнения последовательностей затем рассчитывают процент идентичности последовательностей для исследуемой последовательности (последовательностей) относительно контрольной последовательности, основываясь на установленных параметрах программы. Оптимальное выравнивание последовательностей для сравнения может быть проведено, например,с помощью алгоритма локальной гомологии SmithWaterman (1981), алгоритма выравнивания гомологии NeedlemanWunsch (1970), метода поиска сходства PearsonLipman (1988), путем компьютерной реализации этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package,Genetics Computer Group, 575 Science Dr., Мэдисон, Висконсин), или визуальным контролем (см. Ausubel и др., ниже). Одним из примеров алгоритма, который может быть использован для определения процента идентичности последовательностей и сходства последовательностей, является алгоритм BLAST, который описан Altschul и др. (1990). Другой показатель существенной идентичности последовательностей двух нуклеиновых кислот заключается в том, что две молекулы гибридизируются друг с другом в жестких условиях гибридизации. Понятие "жесткие условия гибридизации" и "жесткие условия гибридизации с промывкой" в контексте экспериментов по гибридизации нуклеиновых кислот, например, саузерн- и норзен-гибридизации,зависят от последовательностей и различаются при разных внешних параметрах. Более длинные последовательности гибридизируются специфически при повышенных температурах. Подробное руководство по гибридизации нуклеиновых кислот приводится в работе Tijssen (1993). В контексте настоящего изобретения понятие "гибридизировать" относится к традиционным условиям гибридизации, предпочтительно к условиям гибридизации, при которых используют 5SSPE, 1% SDS, 1 раствор Денхарда в качестве раствора и/или температуру для гибридизации от 35 С до 70 С, предпочтительно 65 С. После гибридизации предпочтительно проводят промывку сначала с помощью 2SSC, 1% SDS и затем с помощью 0,2SSC при температуре от 35 С до 75 С, особенно от 45 С до 65 С, но особенно при 59 С (в зависимости от SSPE, SSC и раствора Денхарда; см. Sambrook и др.). Условия гибридизации, особенно высокой жесткости, например, описанные Sambrook и др., см. выше, особенно предпочтительны. Особенно предпочтительны жесткие условия гибридизации, например, если гибридизацию и промывку проводят при 65 С, согласно указанному выше. Нежесткие условия гибридизации, например, с гибридизацией и промывкой, проводимые при 45 С, являются менее предпочтительными, а при 35 С еще менее предпочтительными. Другой показатель существенной идентичности последовательностей двух нуклеиновых кислот или белков заключается в том, что белок, кодируемый первой нуклеиновой кислотой, иммунологически перекрестно реактивен или специфически связывается с белком, кодируемым второй нуклеиновой кислотой. Таким образом, белок обычно в значительной степени идентичен второму белку, например, если два белка отличаются только консервативным замещениями. Понятие "трансформация" означает процесс интродукции гетерологичной нуклеиновой кислоты в клетку-хозяина или в организм. В частности, понятие "трансформация" означает стабильную интеграцию молекулы ДНК в геном исследуемого организма. Понятие "трансформированный/трансгенный/рекомбинантный" относится к организму хозяина, например, бактерии или растению, в который гетерологичная молекула нуклеиновой кислоты была интродуцирована. Молекула нуклеиновой кислоты может быть стабильно интегрированной в геном хозяина или в молекулу нуклеиновой кислоты, а также может быть представлена в качестве внехромосомной молекулы. Такая внехромосомная молекула может быть самореплицирующейся. К трансформированным клеткам, тканям или растениям также относятся не только конечные продукты процесса трансформации,но и их потомство. Понятие "нетрансформированного", "нетрансгенного" или "нерекомбинантного" хозяина относится к организму дикого типа, например, к бактерии или растению, который не содержит молекулы гетерогенной нуклеиновой кислоты. Понятие трансгенное "событие" относится к рекомбинантному растению, полученному трансформацией и регенерацией одной растительной клетки гетерологичной ДНК, например, кассетой экспрессии, которая включает исследуемый ген. Понятие "событие" относится к первоначальному трансформанту и/или потомству трансформанта, которые включают гетерологичную ДНК. Понятие "событие" также относится к потомству, полученному в результате полового ауткросса между трансформантом и другой линией сахарной свеклы. Даже после повторного обратного скрещивания с возвратным родителем инсертированная ДНК и фланкирующая ДНК из трансформированного родителя присутствует у потомков этого скрещивания при той же хромосомной локализации. В норме трансформация растительной ткани приводит к множеству событий, каждое из которых представляет инсерцию конструкции ДНК в разной локализации в геном растительной клетки. Основываясь на экспрессии трансгена или на других требуемых свойствах, выбирают определенное событие. Понятие "трансген" относится к гену, интродуцированному в геном организма путем генетической манипуляции для изменения этого генотипа. Трансгены могут включать, например, гены, которые или гетерологичны, или гомологичны генам конкретного растения, подвергаемого трансформации. Кроме того, трансгены могут включать нативные гены, инсертированные в организм, не являющийся нативным,или химерные гены. В контексте настоящего изобретения понятие стекинга гена или признака означает комбинирование нужных генов или признаков в одной линии трансгенного растения. Селекционеры собирают вместе трансгенные признаки путем скрещиваний между родителями, из которых каждый несет требуемый признак, и последующей идентификации потомства, имеющего оба требуемых признака (так называемое"складирование признаков скрещиванием"). Другой способ стекинга генов заключается в переносе двух или более генов в ядро клетки растения одновременно во время трансформации. Другой способ стекинга генов заключается в повторной трансформации трансгенного растения другим целевым геном. Например, стекинг генов может применяться для комбинирования двух разных признаков устойчивости к насекомым и устойчивости к заболеваниям или устойчивости к гербицидам (например, Bt11). Применение селективного маркера помимо целевого гена также можно рассматривать в качестве генного стекинга. Понятие "трансгенное растение" относится к какому-либо растению с одной или несколькими растительными клетками, содержащими вектор экспрессии. Понятие "растение" относится к какому-либо растению или какой-либо стадии развития, особенно к семенному растению. Понятие "культивируемые" относится к растениям определенных видов, которые выращивают на коммерческой основе из-за их полезных свойств. Понятие культивируемые растения включает те растения, которые были введены в культуру и которые селективно размножают для выращивания. К культивируемым растениям относятся те виды дикого типа, которые включают признак по настоящему изобретению в качестве природного признака и/или части их природных генетических свойств. Понятие "растительная клетка" является структурной и физиологической единицей растения, включающей протопласт и клеточную стенку. Растительная клетка может быть в форме выделенной одной клетки или культивируемой клетки, или может быть частью более высоко организованной структуры,например, растительной ткани, органа растения или целого растения. Понятие "культура клеток растений" означает культуры единиц растений, например, протопластов,клеток культур клеток, клеток в растительных тканях, пыльцу, пыльцевые трубки, семяпочки, оболочки зародышевого мешка, зиготы и зародыши на разных стадиях развития. Понятие "растительный материал" относится к листьям, стеблям, корням, цветам или частям цветов, фруктам, пыльце, яйцеклеткам, пыльникам, семяпочкам, зиготам, семенам, покровам, клеткам и культурам ткани, или каким-либо другим частям или продуктам растения. Это понятие также включает каллюс или каллюсную ткань, а также экстракты (например, экстракты корнеплодов) или образцы. Обычно понятие "растительный материал" относится к относительно необработанному растительному материалу, содержащему интактные растительные клетки. Понятие "орган растения" означает определенную и зрительно структурированную и дифференцированную часть растения, например, корень, стебель, лист, бутон или зародыш. Понятие "ткань растения" в контексте настоящего изобретения означает группу растительных клеток, организованных в структурную и функциональную единицу. К этому понятию относится какая-либо ткань растения внутри растения или в культуре. Это понятие также включает, но ими не ограничивается,целые растения, органы растений, семена растений, культуры тканей и какие-либо группы растительных клеток, организованных в структурные и/или функциональные единицы. Применение такого термина вместе с упоминанием какого-либо специфического типа растительной ткани, указанной выше, или без такого совместного упоминания, или, по-другому, охваченной этим определением, не является исключительным для какого-либо другого типа растительных тканей. Понятия "информационная РНК" или "иРНК" относится к РНК, которая не содержит интронов и с которой в результате трансляции в клетке может быть получен белок. Понятие "кДНК" относится к одноцепочечной или двухцепочечной ДНК, которая комплементарна иРНК и получена с нее. Понятие "экспрессия" применительно к последовательности нуклеиновой кислоты, например, к гену, ORF или их части, или к трансгенному растению, относится к процессу конверсии генетической информации, закодированной в гене и в РНК (например, иРНК, рРНК, тРНК или оцРНК), через "транскрипцию" гена (т.е. через ферментативное действие РНКполимеразы) в белок, где это применимо (например, если ген кодирует белок), через "трансляцию" иРНК. Генная экспрессия может регулироваться на многих стадиях процесса. Например, в случае антисмысловых или дцРНК конструкций, соответственно, экспрессия может относиться к транскрипции только антисмысловой РНК или только дцРНК. Кроме того, экспрессия относится к транскрипции и стабильному накоплению смысловой (иРНК) или функциональной РНК. Экспрессия также может относится к получению белка. Понятие "снижение регуляции" относится к уровню экспрессии в трансгенных клетках или организмах, который ниже уровней экспрессии в нормальных или нетрансформированных (нетрансгенных) клетках или организмах. В частности, "снижение регуляции" относится к снижению уровня белка и/или продукта иРНК от гена-мишени в диапазоне 20-100%, особенно 40-80%, более предпочтительно 50-90%,еще более предпочтительно 60-95%, но особенно предпочтительно 75-100%. Понятие "супрессия" относится к отсутствию белка и/или продукта иРНК от гена-мишени (т.е. полное снижение регуляции экспрессии гена-мишени). Последствие супрессии может быть подтверждено анализом внешних свойств клетки или организма или методами биохимического анализа и выявления генной экспрессии, известными специалистам в данной области. Например, снижение регуляции и/или супрессия экспрессии гена FT проявляется по отсутствию или отсрочке ответа на яровизацию у растущего растения сахарной свеклы. Понятия "сверхэкспрессия" или "повышенная регуляция" относятся к уровню экспрессии в трансгенных клетках или организмах, которые превышают уровни экспрессии в нормальных или нетрансформированных (нетрансгенных) клетках или организмах. В частности, понятия "сверхэкспрессии" или "повышенной регуляции" относятся к повышению уровня белка и/или продукта иРНК с гена-мишени на 20100%, особенно на 40-80%, более предпочтительно на 50-90%, еще более предпочтительно на 60-95 %,но особенно на 75-98% и до 100%. Понятие "совместная супрессия" относится к трансгенному подходу для сайленсинга генной экспрессии, также называемому "снижением регуляции смысловой последовательности". При таком подходе экспрессия целевого гена подавляется экспрессией трансгенной последовательности, гомологичной целевому гену через взаимодействие нативной и трансгенной иРНК. Понятие "тиллинга" (или TILLING - Targeting-Induced Local Lesions IN Genomes - индуцированное нацеливанием локальное повреждение генома) относится к нетрансгенному подходу для формирования недействующих или нокаутных аллелей определенного целевого гена (McCallum и др., 2000). Понятие "антисмысловое подавление" относится к формированию антисмысловых транскриптов РНК, способных подавлять экспрессию белка эндогенного гена или трансгена. Понятие "генный сайленсинг" относится к зависящей от гомологии супрессии генов, трансгенов,или эндогенных генов ядра. Генный сайленсинг может быть транскрипциональным, если супрессия происходит из-за пониженной транскрипции пораженных генов, или пост-транскрипциональным, если супрессия происходит из-за повышенного обмена (разрушения) видов РНК, гомологичных поражаемым генам. Генный сайленсинг включает индуцированный вирусом генный сайленсинг. Понятие "РНК интерференции (РНКи)" относится к процессу специфичного в отношении последовательности посттранскрипционального сайленсинга генов у растений и животных, опосредованному малыми интерферирующими РНК (миРНК), включая дцРНК. Различные важные понятия, например,- 15024958 миРНК, молекула РНК-мишени, фермент дайсер или рибонуклеаза III, известны специалистам в данной области и полное описание этих понятий и других представлений, применимых для РНКи, могут быть обнаружены в литературе. Для сравнения, несколько понятий, применимых для РНКи, описаны ниже. Однако очевидно, что какая-либо определенная гипотеза, описывающая механизмы РНКи, не является необходимой для осуществления настоящего изобретения. Понятие "двухцепочечной РНК (дцРНК)" означает РНК с двумя комплементарными цепями, которая направляет специфическое для последовательности разрушение иРНК в ходе процесса, называемого РНК интерференцией (РНКи). Молекула дцРНК нарезается на молекулы малой интерферирующейРНК(миРНК), интерферирующие с экспрессией определенного гена. Понятие "инвертированный повтор" относится к нуклеотидной последовательности, имеющейся в двух местах одной и той же последовательности нуклеиновой кислоты, но в противоположной ориентации. Аббревиатура "миРНК" означает малые интерферирующие РНК. В некоторых вариантах осуществления настоящего изобретения миРНК включают дуплекс - двухцепочечную область, длиной примерно в 21-23 нуклеотида; часто миРНК содержат примерно от двух до четырех непарных нуклеотидов с 3' конца каждой цепи. По меньшей мере одна цепь дуплекса, или двуцепочечной области миРНК, в существенной степени гомологична или в существенной степени комплементарна целевой молекуле РНК. Цепь, комплементарная молекуле целевой РНК, является "антисмысловой цепью"; цепь, гомологичная молекуле целевой РНК, является "смысловой цепью" и комплементарна антисмысловой цепи миРНК. Молекулы миРНК также могут содержать дополнительные последовательности; к неограничительным примерам таких последовательностей относятся связывающие последовательности, или петли, а также стволовые и другие подвергшиеся укладке структуры. Молекулы миРНК проявляются по действию в качестве ключевых интермедиантов в индукции РНК интерференции у беспозвоночных и позвоночных, и в индукции специфического по последовательности разрушения РНК на протяжении посттранскрипционного генного сайленсинга у растений. Понятие "целевая молекула РНК (молекула-мишень)" относится к молекуле РНК, по отношению к которой по меньшей мере одна цепь короткой двухцепочечной области миРНК является гомологичной или комплементарной. Обычно если такая гомология и комплементарность составляет примерно 100%,миРНК способна заглушить или подавить экспрессию целевой молекулы РНК. Хотя считают, что процессированная иРНК является мишенью для миРНК, настоящее изобретение не ограничивается какойлибо определенной гипотезой, и такие гипотезы не являются необходимыми в практике настоящего изобретения. Таким образом, высказывают предположение о том, что другие молекулы РНК могут также быть мишенями для миРНК. Такие молекулы РНК включают непроцессированную иРНК, рибосомальную РНК и геномы РНК вирусов. Не является обходимым, чтобы было 100% гомологии между молекулой целевой РНК и дцРНК по всей длине дцРНК, но шпильки дцРНК могут включать отрезки по меньшей мере из 21 нуклеотида, предпочтительно по меньшей мере из 23 нуклеотидов, более предпочтительно по меньшей мере из 50 нуклеотидов, еще более предпочтительно по меньшей мере из 500 нуклеотидов, наиболее предпочтительно по меньшей мере из 700 нуклеотидов, и до 1000 нуклеотидов, имеющих по меньшей мере 95%, предпочтительно 100% гомологию с целевой молекулой РНК. Понятие "РНК-индуцирующий комплекс сайленсинга (RNA-inducing silencing complex - RISC)" опосредует одноцепочечную РНК с последовательностью, комплементарной антисмысловым цепям дуплекса миРНК. Расщепление целевой РНК происходит в середине области, комплементарной к антисмысловой цепи дуплекса миРНК (Elbashir и др., 2001). Понятие "в существенной степени комплементарна" означает, что первая и вторая цепи последовательности РНК, интродуцированной в клетки растения, способны в существенной степени гибридизироваться или отжигать РНК, образуемую на гене-мишени (иРНК), в условиях, обнаруженных в цитоплазме указанных клеток растений, таким образом, что индуцируется подавление экспрессии гена-мишени. Например, последовательность первой или второй цепи последовательности РНК, которая связывается с иРНК, образованной на гене-мишени, по меньшей мере на 50% идентична последовательности соответствующей иРНК гена-мишени, предпочтительнее идентична по меньшей мере на 70%, еще более желательно идентична по меньшей мере на 90% и еще более желательно идентична по меньшей мере на 95%. Следует учесть, что процент идентичности между последовательностями первой и второй цепей РНК и иРНК, образуемой на гене-мишени, находится в диапазоне между по меньшей мере 70% идентичности и по меньшей мере 95% идентичности и может быть какой-либо величиной в указанном диапазоне. Понятие "ферментация" в контексте настоящего изобретения относится к процессу трансформации органической молекулы в другую молекулу, используя микроорганизм. Если не указано иначе, к понятию "ферментация" относятся анаэробная и аэробная ферментации. Понятие "биотопливо" в контексте настоящего изобретения относится к какому-либо топливу, вырабатываемому анаэробной или аэробной ферментацией растительного материала. Примером биотоплива, полученного путем аэробной ферментации, является биоэтанол, и этот пример не единственный. Разные виды биотоплива могут быть получены анаэробной ферментацией, включая, но ими не ограничива- 16024958 ясь, биогаз и/или биодизель. Способы аэробной и/или анаэробной ферментации известны специалистам в данной области. Понятие "сахар" относится к подверженным ферментации моносахаридам, дисахаридам и трисахаридам, особенно к моно- и дисахаридам. Таким образом, сахара по настоящему изобретению включают,но ими не ограничиваются, сахарозу, фруктозу, глюкозу, галактозу, мальтозу, лактозу и маннозу. Понятие "биопластик" относится к пластику, получаемому из биологического источника. "Биологическим источником" в этом контексте являются и пластики, получаемые непосредственно в трансгенных растениях, и пластики, получаемые из биомассы, например, растительного масла, крахмала или сахара с помощью химического процесса, или на химических заводах, или в микроорганизмах. К понятию "биопластик" относятся, но ими перечень не ограничивается, пластики на основе крахмала, полимасляной кислоты (ПМК), поли-3-гидробутирата (ПГБ), полиамида 11 (ПА 11), био-производного полиэтилена и биопластики, получаемые из генетически модифицированных организмов (например, бактерий или растений). Подробное описание изобретения Настоящее изобретение описывает нуклеотидные последовательности генов FT сахарной свеклы(также называемых генами Beta FT), вовлеченными в ответ сахарной свеклы на яровизацию, а также трансгенных растений сахарной свеклы, и способы модуляции устойчивости сахарной свеклы к выходу в стрелку путем супрессии экспрессии гена FT у сахарной свеклы. Культивируемая сахарная свекла (Beta vulgaris ssp. vulgaris L.) является двухлетним растением,формирующим корнеплод и листовую розетку в первый год. Удлинение побега (выход в стрелку) и формирование цветка начинается после периода низкой температуры. Такая индуцированная холодом яровизация, приводящая растения к выходу в стрелку, является непременной частью полного жизненного цикла сахарной свеклы. Подробности яровизации и ее воздействия на двухлетнюю сахарную свеклу описаны в литературе (например, Jaggard и др., 1983). Однако детали генетической основы ответа на яровизацию и выхода в стрелку у сахарной свеклы все еще в основном остаются неустановленными. В частности, гены, являющиеся ключевыми факторами ответа на яровизацию у сахарной свеклы, до сих пор не идентифицированы. Функциональный анализ, выполненный на модельном организме Arabidopsis thaliana, позволил выделить четыре разных метаболических пути цветения (LevyDean, 1998). Эти четыре метаболических пути могут быть определены по факторам окружающей среды, например, метаболический путь фотопериодизма и метаболический путь активирования выхода в стрелку, или по врожденным сигналам развития, например, метаболический путь автономной индукции и метаболический путь подавления цветения. У некоторых видов на сроки цветения в основном влияют внешние факторы, например, фотопериодизм,количество/качество света, яровизация и наличие воды или питательных веществ. Один исследуемый локус, идентифицированный у растения Arabidopsis, называется локусом цветения (FLOWERING LOCUS T - FT). Этот локус был открыт у природных экопитов позднего цветения растения Arabidopsis(Koorneef и др., 1991). FT является низкомолекулярным белком с массой 23 кДа и гомологом фосфатидилэтаноламин-связывающих белков, также называемых белками ингибиторами RAF-киназы (Kardailsky и др., 1999; Kobayashi и др., 1999). Для идентификации генов, вовлеченных в выход в стрелку у сахарной свеклы в ответ на яровизацию, настоящее изобретение было сосредоточено на идентификации ортолога гена FT из Arabidopsis у сахарной свеклы. Консервативные нуклеотидные последовательности в последовательностях кДНК ортологов FT Arabidopsis (AtFT), Citrus (CiFT), пшеницы (TaFT) и риса (OsHd3a) идентифицируют путем выравнивания этих последовательностей (фиг. 1). Используя вырожденные праймеры, нацеливающие консервативный мотив аминокислотной последовательности "KPRVEIGG", локализованной в экзоне 1(аминокислотные остатки с 51 по 58), по последовательности белка FT из Arabidopsis, а также в экзоне 3 сразу вниз по цепи от сайта сплайсинга интрона 2, нацеливая мотив аминокислотной последовательности"LVTDIPATT" (аминокислотные остатки с 89 по 98), амплифицируют два нуклеотидных фрагмента в реакции ПЦР, используя общую РНК, экстрагированную из листьев сахарной свеклы, в качестве матрицы (см. пример 1). Последующий анализ последовательностей амплифицированных фрагментов выявил два гомолога BvFT, имеющих разные последовательности. Эти гомологи обозначены фрагментом BvFT1(SEQ ID NO: 3) и фрагментом BvFT2 (SEQ ID NO: 4) соответственно. Оба в высокой степени гомологичны последовательности белка FT из Arabidopsis (фиг. 4 и 5). Основываясь на обоих фрагментах, фрагменте BvFT1 и фрагменте BvFT2, соответственно, идентифицируют клоны ВАС, включающие эти последовательности и секвенируют (см. пример 1). Основываясь на выравнивании геномных последовательностей к обоим фрагментам кДНК и на гомологии последовательности к гену FT из Arabidopsis, прогнозируют предполагаемую структуру генов Beta FT, включающих интроны и экзоны (фиг. 2 и 3). Кодирующая последовательность и аминокислотная последовательность BvFT1 показаны в виде SEQ ID NO: 6 и 7 соответственно. Кодирующая последовательность и аминокислотная последовательность BvFT2 представлены ниже в виде последовательностей SEQ ID NO: 9 и 10, соответственно. Выравнивание аминокислотных последовательностей BvFT1 и BvFT2 полной длины с белковой последовательностью FT из Arabidopsis дополнительно подтверждает строгую гомоло- 17024958 гию последовательности с идентичностью 72% и схожестью 82% (для BvFT1) и с идентичностью 75% и схожестью 88% (для BvFT2) соответственно (фиг. 4 и 5; пример 1). Анализ экспрессии неожиданно показал противоположные варианты экспрессии этих двух генов в листьях сахарной свеклы на протяжении разных стадий развития двухлетних и однолетних растений сахарной свеклы (см. пример 3). Транскрипты BvFT1 легко обнаружить в листьях на ранних вегетативных стадиях у двухлетних растений, но уровни экспрессии падают после яровизации и остаются низкими при переходе от вегетативной стадии к стадиям репродуктивным, причем экспрессия гена BvFT2 резко повышается перед проявлением первых визуальных признаков выхода в стрелку. Такое повышение экспрессии BvFT2, наблюдаемое перед цветением, очень напоминает профиль экспрессии гена FT у Arabidopsis, следовательно, ген BvFT2 действительно является ортологом гена FT сахарной свеклы из Arabidopsis. Анализ экспрессии этих генов на протяжении суточного цикла с разными фотопериодами (см. пример 4) также подтверждает это предположение. С другой стороны исследования экспрессии в растениях Arabidopsis, сверхэкспрессирующих кодирующие области BvFT1 (см. пример 5), неожиданно показали, что BvFT1 дополнительно действует наподобие AtTFL1 (Ratcliffe и др., 1998) - ингибитора цветения у Arabidopsis. Это показывает, что BvFT1 неожиданно действует в большей степени подобно репрессору, чем промотору цветения, несмотря на его кластерирование в FT-подобным кладом филогенетического древа семейства генов FT (фиг. 6). Эктопическая экспрессия BvFT2 у Arabidopsis, с другой стороны, приводит к фенотипу чрезвычайно раннего цветения. Такие указанные противоположные функции BvFT1 и BvFT2, т.е. репрессия цветения, обусловленной геном BvFT1, против индукции цветения, обусловленной геном BvFT2, согласуется с их противоположными профилями экспрессии, неожиданно обнаруженными у сахарной свеклы, согласно описанному выше. В настоящем изобретении показано, что оба гена FT у сахарной свеклы имеют профили экспрессии,которые активно регулируются в зависимости от стадии развития растения с высокой степени противоположными профилями экспрессии и дополнительно играют ключевую роль в ответе сахарной свеклы на яровизацию. Таким образом, оба гена используют для конструирования устойчивости к выходу в стрелку у растений сахарной свеклы путем задержки или подавления ответа на яровизацию. Первый объект настоящего изобретения относится к последовательностям нуклеиновой кислоты генов FT из Beta vulgaris, которые по идентичности по меньшей мере на 70% совпадают с последовательностью нуклеиновой кислоты, выбранной из группы последовательностей нуклеиновых кислот,представленных ниже в виде SEQ ID NO: 5, 6, 8 или 9, или которые включают по меньшей мере 15 последовательных нуклеотидов последовательности нуклеиновой кислоты, выбранной из группы последовательностей нуклеиновых кислот, представленных ниже в виде SEQ ID NO: 5, 6, 8 или 9, или которые гибридизируются в жестких условиях с последовательностью нуклеиновой кислоты, выбранной из группы последовательностей нуклеиновых кислот, представленных ниже в виде SEQ ID NO: 5, 6, 8 или 9. Предпочтительно последовательность нуклеиновой кислоты по настоящему изобретению является выделенной нуклеиновой кислотой. В предпочтительном варианте осуществления настоящего изобретения последовательности нуклеиновой кислоты по настоящему изобретению обладают идентичностью по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90%, еще более предпочтительно по меньшей мере на 95% и наиболее предпочтительно по меньшей мере на 98% с последовательностью нуклеиновой кислоты, выбранной из группы последовательностей нуклеиновых кислот, представленных ниже в виде SEQ ID NO: 5, 6, 8 или 9. По поводу идентичности последовательностей очевидно, что в настоящем изобретении все отдельные численные значения, попадающие в заявленные диапазоны, также могут быть отражены в настоящем изобретении. Например, экспрессия "по меньшей мере на 70%", указанная выше, означает также экспрессию на 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79% ,80%, 81%, 82%, 83%, 84%, 85%, 86%,87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, а экспрессия "по меньшей мере на 80%", указанная выше, означает также экспрессию на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%,90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%. Тот же подход применим к обозначению экспрессии "по меньшей мере на 85%", "по меньшей мере на 90%", "по меньшей мере на 95%" и "по меньшей мере на 98%". В предпочтительном варианте осуществления настоящего изобретения последовательности нуклеиновых кислот по настоящему изобретению включают по меньшей мере 20, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35, еще более предпочтительно по меньшей мере 50, еще более предпочтительно по меньшей мере 75, и наиболее предпочтительно по меньшей мере 100 соприкасающихся нуклеотидов в последовательности какой-либо нуклеиновой кислоты, выбранной из группы последовательностей нуклеиновой кислоты, представленных ниже в виде SEQ ID NO: 5, 6, 8 или 9. Следует учитывать, что в настоящем изобретении понятие "по меньшей мере из х нуклеотидов" охватывает молекулы нуклеиновой кислоты, имеющие какое-либо численное значение, начиная с х и выше. Например, понятие "по меньшей мере из 15 нуклеотидов" означает молекулы нуклеиновой кислоты, со- 18024958 держащие 15, 16, 17, 18, 19, 20 и более нуклеотидов в какой-либо из нуклеотидных последовательностей,представленных ниже в виде SEQ ID NO: 5, 6, 8 или 9. Сходным образом понятие "по меньшей мере из 20 нуклеотидов" относится к молекулам нуклеиновой кислоты, состоящим из 21, 22, 23, 24, 25, 26 и более нуклеотидов, имеющихся в последовательности нуклеиновой кислоты, представленных ниже в видеSEQ ID NO: 5, 6, 8 или 9. Тот же подход применим к другим диапазонам, указанным выше. В другом предпочтительном варианте осуществления настоящего изобретения последовательность нуклеиновой кислоты по настоящему изобретению, описанная выше, гибридизируется в жестких условиях, более предпочтительно в высокой степени жестких условиях, с какой-либо последовательностью нуклеиновой кислоты, выбранной из группы последовательностей нуклеиновых кислот SEQ ID NO: 5, 6,8 или 9. В другом предпочтительном варианте осуществления настоящего изобретения нуклеиновая кислота по настоящему изобретению представляет одну из указанных ниже последовательностей SEQ ID NO: 5,6, 8 или 9 и комплементарные им последовательности. Последовательности нуклеиновых кислот по настоящему изобретению, включая какие-либо соответствующие антисмысловые конструкции, могут быть оперативно связаны с каким-либо промотором,который функционирует в растении-хозяине, включая промоторные последовательности, описанные в настоящем изобретении ниже или их мутанты. В настоящем изобретении дополнительно предусмотрены полипептиды, кодируемые последовательностями нуклеиновых кислот по настоящему изобретению, описанными выше. В предпочтительном варианте осуществления настоящего изобретения полипептид по настоящему изобретению имеет аминокислотную последовательность, выбранную из представленной ниже группы аминокислотных последовательностей SEQ ID NO: 7 или 10. Модуляция экспрессии нуклеиновых кислот по настоящему изобретению приводит к устойчивости к выходу в стрелку у сахарной свеклы, особенно при экспрессии в трансгенном растении, например, в трансгенном растении сахарной свеклы (см., например, примеры 7 и 8). В другом объекте нуклеотидные последовательности по настоящему изобретению могут таким образом использоваться для трансгенного подхода к получению трансгенных растений сахарной свеклы,включающих указанные полинуклеотиды, стабильно интегрированные в геном сахарной свеклы. В частности, при экспрессии генома продукт экспрессии может применяться для создания устойчивости к выходу в стрелку путем модулирования ответа на яровизацию растения сахарной свеклы. Основываясь на противоположных профилях экспрессии, указанных выше, это может быть достигнуто или подавлением,или снижением регуляции экспрессии гена BvFT2 или путем повышения экспрессии гена BvFT1, или комбинацией обоих. В другом объекте нуклеотидные последовательности по настоящему изобретению собраны в химерные конструкции, которые содержат последовательность нуклеиновой кислоты для экспрессии в трансгенном растении под контролем регуляторных элементов, предпочтительно под контролем регуляторных элементов, функционирующих в растениях. Способы сборки таких химерных конструкций известны специалистам в данной области. Химерные конструкции по настоящему изобретению являются последовательностью нуклеиновой кислоты, способной к прямой экспрессии определенной нуклеотидной последовательности (т.е. нуклеотидных последовательностей по настоящему изобретению) в соответствующих клетках-хозяевах, например, растительных клетках. Экспрессия нуклеотидных последовательностей, включенных в химерные конструкции по настоящему изобретению, приводят у сахарной свеклы к модуляции экспрессии BvFT1 и/или BvFT2, таким образом подтверждая устойчивость к выходу в стрелку за счет отсрочки или супрессии ответа на яровизацию. В химерных конструкциях по настоящему изобретению нуклеиновые кислоты предпочтительно включены в кассеты экспрессии, включающие регуляторные элементы для экспрессии нуклеотидных последовательностей в клетках-хозяевах, способных экспрессировать нуклеотидные последовательности. К таким регуляторным элементам обычно относятся промотор и сигналы терминации, а также предпочтительно элементы, допускающие эффективную трансляцию полипептидов, кодируемых нуклеиновыми кислотами по настоящему изобретению. Химерные конструкции по настоящему изобретению, включающие нуклеиновые кислоты по настоящему изобретению, способны реплицироваться в определенных клетках-хозяевах, предпочтительно в качестве внехромосомных молекул, и поэтому их используют для амплификации нуклеиновых кислот по настоящему изобретению в клетках-хозяевах. В еще одном варианте осуществления настоящего изобретения такие химерные конструкции являются вирусными векторами и используются для репликации нуклеотидных последовательностей в определенных клетках-хозяевах, например, в клетках растений. Рекомбинантные векторы также используют для трансформации нуклеотидных последовательностей по настоящему изобретению в клетках-хозяевах, в результате чего нуклеотидные последовательности являются стабильно интегрированными в ДНК трансгенного хозяина. В одном их предпочтительных вариантов осуществления настоящего изобретения химерная конструкция по настоящему изобретению дополнительно включает ген селективного маркера, который позво- 19024958 ляет проводить разграничение между трансформированным и нетрансформированным растительным материалом в процессе отбора. Гены маркеров, которые можно использовать для отбора, и их применение известны специалистам в данной области. Предусмотрена химерная конструкция в качестве одного из объектов по настоящему изобретению для трансгенного снижения регуляции или подавления экспрессии эндогенного гена BvFT2 у сахарной свеклы. Снижение регуляции или подавление экспрессии BvFT2 приводит к задержке ответа на яровизацию у растущего растения сахарной свеклы или вызывает у растения сахарной свеклы формирование фенотипа с отсутствием выхода в стрелку, что означает, что растение сахарной свеклы больше не отвечает на период обычной яровизации длительностью 18 недель выходом в стрелку и последующим цветением, а напротив продолжает вегетативный рост (без выхода в стрелку) и развитие нормального корнеплода. Растения, экспрессирующие указанный отсроченный ответ на яровизацию или указанный фенотип без выхода в стрелку, могут быть легко идентифицированы и выбраны путем применения эксперимента по фенотипическому анализу, в котором используют стандартизированные условия роста. Настоящее изобретение включает различные подходы к снижению экспрессии, количества, активности и/или функции эндогенного гена BvFT2 у сахарной свеклы. Специалисту в данной области очевидно, что может быть применим ряд различных методов для воздействия на экспрессию, количество,активность и/или функцию генов у растения требуемым образом. В качестве примеров, которыми перечень не ограничивается, могут быть указаны следующие:"Смысловая" супрессия Изменения экспрессии гена у растения (т.е. гена BvFT2 у сахарной свеклы), предпочтительно снижения его экспрессии, добиваются "смысловой" супрессией (описанной, например, Jorgensen и др., PlantMol. Biol. 31, 1996, сс. 957-973). В этом случае вся или часть нуклеотидной последовательности по настоящему изобретению включена в молекулу ДНК. Молекула ДНК предпочтительно оперативно связана с функцией промотора в клетке, включающей целевой ген, предпочтительно клетке растения, и интродуцирована в клетку, в которой нуклеотидная последовательность может экспрессироваться. Нуклеотидная последовательность инсертирована в молекулу ДНК в "смысловой" ориентации, поэтому кодирующая цепь нуклеотидной последовательности может транскрибироваться. В предпочтительном варианте осуществления настоящего изобретения нуклеотидная последовательность может транслироваться полностью и вся генетическая информация, включенная в нуклеотидную последовательность, или ее часть,транслируется в полипептид. В другом предпочтительном варианте осуществления настоящего изобретения нуклеотидную последовательность может транслироваться частично и короткий пептид транслируется. В предпочтительном варианте осуществления настоящего изобретения это достигается инсерцией по меньшей мере одного преждевременного стоп-кодона в нуклеотидной последовательности, который приводит к трансляции наполовину. В другом более предпочтительном варианте осуществления настоящего изобретения нуклеотидную последовательность транскрибируется, но продукт трансляции не образуется. Это обычно достигается удалением стартового кодона, например, "ATG", в полипептиде,кодируемом нуклеотидной последовательностью. В другом предпочтительном варианте осуществления настоящего изобретения молекула ДНК, представляющая нуклеотидную последовательность, или ее часть, которая стабильно интегрирована в геном растительной клетки. В другом предпочтительном варианте осуществления настоящего изобретения молекула ДНК, представляющая нуклеотидную последовательность, или ее часть, включена в молекулу, реплицирующуюся внехромосомально. У трансгенных растений, содержащих одну из молекул ДНК, описанных непосредственно выше,экспрессия нуклеотидной последовательности, соответствующей нуклеотидной последовательности,включенной в молекулу ДНК, предпочтительно снижена. Предпочтительно нуклеотидная последовательность в молекуле ДНК по меньшей мере на 80% идентична нуклеотидной последовательности, экспрессия которой снижена, более предпочтительно идентична по меньшей мере на 90%, еще более предпочтительно идентична по меньшей мере на 95% и наиболее предпочтительно идентична по меньшей мере на 99%."Антисмысловая" супрессия В другом предпочтительном варианте осуществления настоящего изобретения изменение экспрессии гена у растения (т.е. гена BvFT2 у сахарной свеклы), предпочтительно снижение его экспрессии, получают путем "антисмысловой" супрессии. Вся или часть нуклеотидной последовательности по настоящему изобретению включена в молекулу ДНК. Молекула ДНК предпочтительно оперативно связана с промоторной функцией в растительной клетке и внедряется в растительную клетку, в которой экспрессируется нуклеотидная последовательность. Нуклеотидную последовательность инсертируют в молекулу ДНК "в антисмысловой ориентации", что означает, что обратная комплементарная последовательность(также иногда называемая некодирующей цепью) к нуклеотидной последовательности может быть транскрибирована. В предпочтительном варианте осуществления настоящего изобретения молекула ДНК, включающая нуклеотидную последовательность, или ее часть, стабильно интегрирована в геном растительной клетки. В другом предпочтительном варианте осуществления настоящего изобретения молекула ДНК, включающая нуклеотидную последовательность, или ее часть включена в экстрахромасо- 20024958 мально реплицируемую молекулу. Несколько публикаций, описывающих такой подход, приводятся для дополнительного пояснения (Green и др., Ann. Rev. Biochem. 55, 1986, сс. 569-597; van der Krol и др., Antisense Nuc. AcidsProteins, 1991, cc. 125-141; Abel и др., Proc. Natl. Acad. Sci. USA 86, 1989, сс. 69496952; Ecker и др., Proc. Natl. Acad. Sci. USA 83, 1986, cc. 5372-5376). В трансгенных растениях, содержащих одну из описанных выше молекул ДНК, экспрессия нуклеотидной последовательности, соответствующей нуклеотидной последовательности, включенной в молекулу ДНК, предпочтительно снижена. Предпочтительно нуклеотидная последовательность в молекуле ДНК по меньшей мере на 80% идентична нуклеотидной последовательности, экспрессия которой снижена, более предпочтительно она по меньшей мере на 90% идентична, еще более предпочтительно по меньшей мере на 95% идентична, и наиболее предпочтительно по меньшей мере на 99% идентична. Гомологичная рекомбинация В другом предпочтительном варианте осуществления настоящего изобретения по меньшей мере одна геномная копия, соответствующая нуклеотидной последовательности по настоящему изобретению,модифицирована в геноме растения путем гомологичной рекомбинации, описанной в качестве примера в работе Paszkowski и др., EMBO Journal 7, 1988, сс. 4021-4026. В этом методе используют свойство гомологичных последовательностей распознавать друг друга и обмениваться нуклеотидными последовательностями между собой в ходе процесса, называемого гомологичной рекомбинацией. Гомологичная рекомбинация может происходить между хромосомальной копией нуклеотидной последовательности в клетке и поступившей копией нуклеотидной последовательности, внедренной в клетку в результате трансформации. Определенные модификации таким образом безошибочно интродуцируют в хромосомальную копию нуклеотидной последовательности. В одном из вариантов осуществления настоящего изобретения регуляторные элементы гена соответствующего растения (т.е. гена BvFT2 сахарной свеклы) модифицированы. Такие регуляторные элементы могут быть легко получены скринингом геномной библиотеки, используя нуклеотидную последовательность по настоящему изобретению или ее часть в качестве зонда. Имеющиеся регуляторные элементы замещают на другие регуляторные элементы, таким образом изменяя экспрессию нуклеотидной последовательности, или они мутированы или делетированы,таким образом отменяя экспрессию нуклеотидной последовательности. В другом варианте осуществления настоящего изобретения нуклеотидную последовательность модифицируют делецией части нуклеотидной последовательности, или целой нуклеотидной последовательности, или мутацией. В настоящем изобретении также рассматривают экспрессию мутантного полипептида в растительных клетках. Были описаны предшествующие усовершенствования этого метода для разрушения эндогенных генов растений (Kempin и др., Nature 389, 1997, сс. 802-803, и MiaoLam, Plant J., 7, 1995, сс. 359-365). Специалистам известны многочисленные возможные способы модификации геномных последовательностей направленным образом. К ним относятся в частности, например, процессы выработки мутаций типа нокаут путем направленной гомологичной рекомбинации, например, созданием стоп-кодонов, перемещениями в рамке считывания и др. (HohnPuchta, Proc Natl Acad Sci USA 96, 1999, сс. 8321-8323) или направленной делецией или инверсией последовательностей с помощью, например, рекомбиназ или нуклеаз, специфичных по последовательностям. В другом предпочтительном варианте осуществления настоящего изобретения мутация в хромосомальной копии нуклеотидной последовательности интродуцируется путем трансформации клетки химерным олигонуклеотидом, содержащим непрерывный отрезок остатков РНК и ДНК в дуплексной конформации с двойными шпильками по концам. Дополнительным свойством олигонуклеотида является, например, наличие 2'-О-метилирования по остаткам РНК. Последовательность РНК/ДНК конструируют для выравнивания с последовательностью хромосомальной копии нуклеотидной последовательности по настоящему изобретению и для включения требуемого нуклеотидного изменения. Например, этот метод дополнительно описан в US 5501967 и Zhu и др., Proc. Natl. Acad. Sci.USA 96, 1999, сс. 8768-8773. Рибозимы В другом варианте осуществления настоящего изобретения РНК, кодирующая полипептид по настоящему изобретению, расщепляется каталитической РНК, или рибозимом, специфичным в отношении такой РНК. Рибозим экспрессируется в трансгенных растениях и приводит к пониженным количествам РНК, кодирующей полипептид по настоящему изобретению в клетках растений, таким образом приводя к пониженным количествам полипептида, накапливаемого в клетках. Этот метод дополнительно описан в US 4987071. Доминантные отрицательные мутанты В другом предпочтительном варианте осуществления настоящего изобретения действие полипептида, кодируемого нуклеотидными последовательностями по настоящему изобретению, изменено. Это изменение достигается экспрессией доминантных отрицательных мутаций у белков в трансгенных растениях, приводя к утрате активности эндогенного белка. Аптамеры В другом варианте осуществления настоящего изобретения действие полипептида по настоящему изобретению подавляется экспрессией в трансгенных растениях лигандов нуклеиновых кислот, так называемых аптамеров, которые специфически связываются с белком. Аптамеры в основном получают методом SELEX (Systematic Evolution of Ligands by Exponential Enrichment - системной эволюцией лигандов путем экспоненциального обогащения). В методе SELEX исследуемая смесь одноцепочечных нуклеиновых кислот, имеющих области рандомизированной последовательности, контактирует с белком и те нуклеиновые кислоты, которые имеют повышенное сродство с мишенью, отделяют от оставшихся в исследуемой смеси. Отделенные нуклеиновые кислоты амплифицируются для получения обогащенной лигандами смеси. Через несколько повторов получают нуклеиновую кислоту с оптимальным сродством к полипептиду и используют для экспрессии в трансгенных растениях. Этот способ дополнительно описан в US 5270163. Белки - цинковые пальцы Белок типа цинкового пальца, который связывает нуклеотидную последовательность по настоящему изобретению или его регуляторную область, также используют для изменения экспрессии нуклеотидной последовательности. Предпочтительно транскрипцию нуклеотидной последовательности снижают или увеличивают. Белки - цинковые пальцы описаны, например, в работах BEERLI и др., PNAS 95, 1998,сс. 14628-14633, или в WO 95/19431, WO 98/54311 или WO 96/06166, которые все включены в настоящее изобретение в виде ссылок на их сущность. В предпочтительном варианте осуществления настоящего изобретения трансгенная пониженная регуляция или супрессия экспрессии эндогенного гена BvFT2 сахарной свеклы достигается способом, выбранным из дцРНК, антисмысловой супрессии или совместной супрессии. Изменение экспрессии целевого гена растения (например, BvFT2 у сахарной свеклы) также получают методом дцРНК интерференции (РНКи). Процесс генной регуляции с помощью двухцепочечной РНК (двухцепочечной РНК интерференция - дцРНКи) был много раз описан для животных и растений(например, Matzke и др., Plant Mol Biol 43, 2000, сс. 401-415; Fire и др., Nature 391, 1998, сс. 806-811; WO 99/32619; WO 99/53050; WO 00/68374; WO 00/44914; WO 00/44895; WO 00/49035; WO 00/63364; все указанные публикации включены в настоящее изобретение в виде ссылок). Процессы и методы, описанные в цитируемых источниках, приводятся исключительно в виде ссылок. Способы с применением дцРНКи основаны на феномене, заключающемся в том, что одновременная интродукция комплементарной цепи и контурной цепи транскрипта гена супрессирует экспрессию соответствующего гена высоко эффективным образом. В настоящее время установлено, что дцРНК процессируется ферментом дайсер путем нарезания дцРНК на короткие интерферирующие РНК (миРНК). Предпочтительно полученный фенотип весьма схож с фенотипом соответствующего нокаутного мутанта (WATERHOUSE И др., Proc Natl Acad SciUSA 95, 1998, сс. 13959-13964). Процесс дцРНКи подтвердил свою особую эффективность и полезность в снижении экспрессии маркерного белка. Интерферируя с иРНК гена BvFT2 сахарной свеклы, генная экспрессия приводит к супрессии или отсрочке ответа на яровизацию сахарной свеклы. Отсрочка ответа на яровизацию приводит к растению сахарной свеклы, продолжающему вегетативный рост, и к развитию нормального корнеплода. В рамках охвата настоящего изобретения молекула двухцепочечной РНК (дцРНК) означает предпочтительно одну или более последовательностей рибонуклеиновых кислот, которые благодаря комплементарным последовательностям, теоретически (например, в соответствии с правилом оснований Уотсона и Крика) и/или в действительности (например, из-за экспериментов по гибридизации in vitro и/или invivo) способны формировать структуры двухцепочечной РНК. Специалист в данной области осведомлен о том, что формирование структур двухцепочечной РНК находится в состоянии равновесия. Предпочтительно соотношение двухцепочечных молекул к соответствующим диссоциированным формам составляет по меньшей мере 1:10, предпочтительно 1:1, особенно предпочтительно 5:1, наиболее предпочтительно 10:1. Один из объектов настоящего изобретения относится к молекулам двухцепочечной РНК, которые при интродукции в растение сахарной свеклы (или в клетки, ткани, органы или в размноженный материал из них) вызывают снижение экспрессии по меньшей мере эндогенного BvFT2. Двухцепочечная молекула РНК для снижения экспрессии по меньшей мере эндогенного BvFT2 в настоящем изобретении предпочтительно включает (а) цепочку смысловой РНК, включающей по меньшей мере одну рибонуклеотидную последовательность, которая в значительной степени идентична по меньшей мере части транскрипта "смысловой" РНК по меньшей мере из эндогенного BvFT2, и (б) цепочку "антисмысловой" РНК,которая в значительной степени, предпочтительно полностью, комплементарна цепочке "смысловой" РНК по пункту (а). Понятие "в существенной степени идентична" означает, что последовательность дцРНК также может иметь инсерции, делеции и отдельные точечные мутации при сравнении с последовательностью гена-мишени и тем не менее вызывает существенное снижение экспрессии. Гомология (определяемая в настоящем изобретении ниже) между "смысловой" цепью ингибирующей дцРНК и по меньшей мере одной частью транскрипта "смысловой" РНК последовательности нуклеиновой кислоты гена-мишени (или между "антисмысловой" цепью комплементарной цепи последовательности нуклеиновой кислоты генамишени) предпочтительно составляет по меньшей мере 75%, предпочтительно по меньшей мере 80%,особенно предпочтительно по меньшей мере 90%, наиболее предпочтительно 100%. 100% идентичность последовательностей между дцРНК и транскриптом гена маркера не является абсолютно необходимой для индукции эффективного снижения экспрессии гена-мишени. Поэтому процесс преимущественно устойчив к отклонениям в последовательностях, которые могут быть из-за генетических мутаций, полиморфизмов или эволюционной дивергенции. Таким образом, можно, например,используя дцРНК, которая была получена, начиная с последовательности гена-мишени первого организма, для подавления экспрессии гена-мишени у второго организма. Для этой цели дцРНК предпочтительно включает области последовательности транскриптов гена-мишени, которые соответствуют консервативным областям. Указанные консервативные области могут быть легко определены при сравнении последовательностей. В другом варианте понятие "в существенной степени идентичная" дцРНК также может быть применено к последовательности нуклеиновой кислоты, способной гибридизироваться с частью транскрипта гена-мишени. Понятие "в значительной степени комплементарная" означает, что "антисмысловая" цепь РНК может также иметь инсерции, делеции и отдельные точечные мутации по сравнению с комплементарной"смысловой" цепью РНК. Гомология между цепью "антисмысловой" РНК и цепью "смысловой" РНК предпочтительно составляет по меньшей мере 80%, предпочтительно по меньшей мере 90%, особенно предпочтительно по меньшей мере 95%, наиболее предпочтительно 100%. Понятие "части транскрипта "смысловой" РНК" последовательности нуклеиновой кислоты генамишени означает фрагменты РНК или иРНК, транскрибированные или транскрибируемые с последовательности нуклеиновой кислоты гена-мишени. В связи с этим фрагменты имеют длину последовательности, состоящую предпочтительно по меньшей мере из 20 оснований, предпочтительно по меньшей мере из 50 оснований, особенно предпочтительно по меньшей мере из 100 оснований, весьма предпочтительно по меньшей мере из 200 оснований, наиболее предпочтительно по меньшей мере из 500 оснований. Полностью транскрибируемые РНК или иРНК также включены. Включенными также являются последовательности, например, те, которые могут транскрибироваться в искусственных условиях с областей генамишени, которые с другой стороны в природных условиях, не транскрибируются, например, промоторные области. Молекула дцРНК может состоять из одной или нескольких цепей полирибонуклеотидов. Естественным образом для достижения той же цели также можно интродуцировать множество отдельных молекул дцРНК, которые включают в каждом случае одну из указанных выше деталей рибонуклеотидных последовательностей в клетки или организмы. Структура двухцепочечной РНК (дцРНК) может быть сформирована, начиная с двух комплементарных отдельных цепей РНК, или предпочтительно начиная с единственной ауто-комплементарной цепи РНК. В этом случае "смысловая" цепьРНК и "антисмысловая" цепь РНК предпочтительно ковалентно соединены друг с другом в форме инвертированного "повтора". Согласно описанию в WO 99/53050, например, дцРНК может также включать структуру шпильки путем соединения "смысловой" и "антисмысловой" цепей путем соединения последовательности ("линкер"; например, интрон). Предпочтение имеют ауто-комплементарные структуры дцРНК, поскольку они требуют только экспрессии последовательности РНК и всегда включают комплементарные цепи РНК в эквимолярном соотношении. Соединяемая последовательность предпочтительно может быть интроном(например, интроном гена картофеля ST-LS1; Vancanneyt и др. (1990. Последовательность нуклеиновой кислоты, кодирующая дцРНК, может включать дополнительные элементы, например, сигналы терминации транскрипции или сигналы полиаденилирования. Взятые вместе, когда это делают специально, две цепи дцРНК в клетке или в растении могут быть получены, например, следующим путем: (а) трансформацией клетки или растения вектором, включающим обе кассеты экспрессии, (б) совместной трансформацией клеток или растения двумя векторами,один из которых включает кассеты экспрессии, содержащие "смысловую" цепь, а другой включает кассеты экспрессии, содержащие "антисмысловую" цепь. Формирование дуплекса РНК может быть инициировано или внутри клетки, или вне клетки. Молекула дцРНК может быть синтезирована или in vivo, или in vitro. Для этого последовательность ДНК, кодирующая дцРНК, может быть инсертирована в кассету экспрессии под контролем по меньшей мере одного генетического контрольного элемента (например, промотора). Полиаденилирование не является необходимым и не нуждается в каких-либо элементах для инициации трансляции. Предпочтение отдается кассете экспрессии для нацеливания дцРНК на ген-мишень, имеющийся в конструкции для трансформации или векторе для трансформации. Для этой цели кассеты экспрессии, кодирующие "антисмысловую" цепь и/или "смысловую" цепь дцРНК, нацеливающиеся на ген-мишень или аутокомплементарную цепь дцРНК, предпочтительно инсертированы в вектор трансформации и интродуцированы в растительную клетку, используя способ, описанный ниже. Стабильная инсерция в геном может быть полезной для способа настоящего изобретения, но не является безусловно необходимой. Поскольку дцРНК вызывает длительный эффект, кратковременная экспрессия также во многих случаях является достаточ- 23024958 ной. Молекула дцРНК также может быть частью РНК, экспрессируемой последовательностью нуклеиновой кислоты, инсертированной путем слияния, например, с 3'-нетранслируемой части указанной РНК. Молекула дцРНК может быть интродуцирована в количестве, которое делает возможным наличие по меньшей мере одной копии на клетку. Повышенные количества (например, по меньшей мере 5, 10,100, 500 или 1000 копий на клетку) может, при необходимости, вызвать более эффективное снижение. В предпочтительном варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению включает гетерологичную ДНК, которая кодирует первую цепь РНК и вторую цепь РНК, и которая при транскрипции производит первую нуклеотидную последовательность РНК и вторую нуклеотидную последовательность РНК, причем указанная первая цепь РНК в значительной степени комплементарна по меньшей мере части цепи РНК эндогенного гена BvFT2 у сахарной свеклы для гибридизации или выравнивания с цепью РНК, формируемой указанным эндогенным геном BvFT2 таким образом, что вызывают снижение регуляции или супрессию экспрессии эндогенного гена BvFT2, и указанная первая нуклеотидная последовательность РНК и указанная вторая нуклеотидную последовательность РНК формируют двухцепочечную РНК, причем двухцепочечная РНК при экспрессии в растении сахарной свеклы участвует в РНК интерференции экспрессии указанного эндогенного гена BvFT2,тем самым вызывая снижение регуляции или супрессию экспрессии эндогенного гена BvFT2. В одном из вариантов осуществления настоящего изобретения предусмотрена химерная конструкция, включающая инвертированный повтор, который при транскрипции в клетках сахарной свеклы формирует молекулу двухцепочечной РНК в указанных клетках растения сахарной свеклы, включая указанные первую и вторую цепи РНК, причем указанная молекула двухцепочечной РНК индуцирует сайленсинг BvFT2. В другом предпочтительном варианте осуществления настоящего изобретения инвертированный повтор предпочтительно оперативно связан с конститутивным промотором. В другом предпочтительном варианте осуществления настоящего изобретения последовательности первой и второй цепей РНК, кодируемые гетерологичной ДНК, включенной в химерную конструкцию по настоящему изобретению, являются в существенной степени комплементарными или идентичными нуклеотидной последовательности РНК, выработанной геном BvFT2, для индукции сайленсинга РНК. Понятие в достаточной степени комплементарная означает, что последовательности первой и второй цепей РНК могут гибридизироваться или выравниваться существенным образом по РНК, полученной эндогенным геном BvFT2 (иРНК) в условиях, обнаруженных в цитоплазме, таким образом, что РНКи индуцируется и приводит к подавлению экспрессии эндогенного гена BvFT2, Такая супрессия гена BvFT2 вызывает у растения сахарной свеклы фенотип, при котором отсутствует выход в стрелку, что означает, что растение сахарной свеклы больше не отвечает на типичный период яровизации длительностью 18 недель выходом в стрелку и последующим цветениям, а напротив, продолжает вегетативный рост (без выхода в стрелку) и формирование нормального корнеплода. В другом варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению включает гетерологичную ДНК, кодирующую цепь нуклеиновой кислоты, которая в достаточной мере комплементарна или идентична по меньшей мере части гена BvFT2. Известно, что если цепь миРНК идентична, целевая иРНК нарезается на непригодные фрагменты РНК. Однако, если спаривание нельзя считать идентичным, комплекс RISC связывается с иРНК и может блокировать движение рибосомы вдоль нативной иРНК, но не может нарезать иРНК на малые фрагменты. Тем не менее, в каждом случае экспрессия гена, с которого транскрибируется иРНК, является молчащим и поэтому не формируется белок, кодируемый геном-мишенью (например, BvFT2). Настоящее изобретение, следовательно, дополнительно включает одну цепь миРНК, которая в существенной степени комплементарна или идентична соответствующей последовательности иРНК, транскрибированной с эндогенного гена BvFT2, экспрессия которого изменена. Например, цепь миРНК, которая связывается с иРНК, предпочтительно по меньшей мере на 50% идентична последовательности иРНК эндогенного гена BvFT2, более предпочтительно по меньшей мере на 70% идентична, еще более предпочтительно по меньшей мере на 80% идентична, еще более предпочтительно по меньшей мере на 90% идентична и наиболее предпочтительно по меньшей мере на 95% идентична. Следует учитывать, что процент идентичности между цепью миРНК, которая в существенной степени комплементарна или идентична соответствующей последовательности иРНК, транскрибированной с эндогенного гена BvFT2, чья экспрессия изменена, и иРНК, вырабатываемой эндогенным геном BvFT2,который находится в интервале идентичности по меньшей мере от 50% идентичности и по меньшей мере до 95% идентичности, может быть какой-либо численной величиной в этом диапазоне. Известно, что последовательности РНК с инсерциями, делениями и точечными мутациями относительно целевой последовательности также эффективны в супрессии экспрессии гена-мишени. Идентичность последовательностей молекул миРНК и продукта транскрипции гена-мишени (например, иРНК гена-мишени) может быть оптимизирована путем алгоритмов выравнивания, известных в данной области и подсчета процента схожести нуклеотидных последовательностей. В другом варианте молекула миРНК по настоящему изобретению может быть идентифицирована не по близости ее последовательности с молекулой-мишенью, но по ее способности гибридизироваться и прекращать экспрессию целевой последовательности. В другом предпочтительном варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению включает гетерологичную ДНК, которая кодирует последовательность нуклеиновой кислоты с идентичностью, составляющей по меньшей мере 70% с последовательностью нуклеиновой кислоты по настоящему изобретению, представленную ниже в виде последовательностейSEQ ID NO: 8 или 9, или включающая по меньшей мере 15 последовательных нуклеотидов последовательности нуклеиновой кислоты по настоящему изобретению, представленную ниже в виде последовательностей SEQ ID NO: 8 или 9, или гибридизируется в жестких условиях с последовательностью нуклеиновой кислоты по настоящему изобретению, представленную ниже в виде последовательностей SEQID NO: 8 или 9. В других вариантах осуществления настоящего изобретения идентичность последовательностей нуклеиновой кислоты, кодирующей гетерологичную ДНК, включенную в химерную конструкцию по настоящему изобретению, предпочтительно по меньшей мере на 80%, еще более предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90% идентична и наиболее предпочтительно по меньшей мере на 95%. В одном из вариантов осуществления настоящего изобретения химерная конструкция включает гетерологичную ДНК, кодирующую первую нуклеотидную последовательность РНК, имеющую 18-30 нуклеотидов в длину, и вторую нуклеотидную последовательность РНК, которая гибридизируется с первой последовательностью в биологических условиях, например, таких условиях, которые имеются в клетке, особенно в цитоплазме и/или ядре клетки. Указанная первая молекула РНК обладает степенью комплементарности к части РНК эндогенного гена BvFT2 сахарной свеклы, что позволяет указанной первой цепи РНК гибридизироваться или выравниваться с частью указанного гена BvFT2, например,приводя к супрессии экспрессии эндогенного гена BvFT2. В еще одном из вариантов осуществления настоящего изобретения химерная конструкция включает гетерологичную ДНК, кодирующую первую нуклеотидную последовательность РНК, которая состоит из 21-25 нуклеотидов в длину, и вторую цепь РНК, которая гибридизируется с первой последовательностью в биологических условиях, например, таких условиях, которые имеются в клетке, особенно в цитоплазме и/или ядре клетки. Указанная первая молекула РНК обладает степенью комплементарности к части РНК эндогенного гена BvFT2 сахарной свеклы, что позволяет указанной первой цепи РНК гибридизироваться или выравниваться с частью указанного гена BvFT2, например, приводя к супрессии экспрессии эндогенного гена BvFT2. В еще одном из вариантов осуществления настоящего изобретения химерная конструкция включает гетерологичную ДНК, кодирующую нуклеотидную последовательность первой РНК, которая имеет 2123 нуклеотида в длина, и цепь второй РНК, которая гибридизируется с первой последовательностью в биологических условиях, например, таких условиях, которые имеются в клетке, особенно в цитоплазме и/или ядре клетки. Указанная первая молекула РНК имеет степень комплементарности к части РНК эндогенного гена BvFT2 сахарной свеклы, которая позволяет указанной первой цепи РНК гибридизироваться или выравниваться с частью указанного гена BvFT2, например, приводя к супрессии экспрессии эндогенного гена BvFT2. Обычно настоящее изобретение включает химерные конструкции какой-либо длины при условии,что гетерологичная ДНК, включенная в химерные конструкции, играет роль в запуске РНК интерференции (иRNА) гена сахарной свеклы BvFT2. В другом варианте осуществления настоящее изобретение относится к химерной конструкции, описанной в настоящем изобретении выше, включающей гетерологичную ДНК, получаемую из фрагмента кДНК размером 0,27 т.н., состоящего из экзона 4 гена BvFT2, согласно приведенному выше описанию, в реакции ПЦР, используя прямой праймер HiNK6382 с нуклеотидной последовательностью 5'CTATGGATCCGCATTTAATAAAATCTCTTTCAATG-3' (SEQ ID NO: 44) и обратный праймерTTGTCTGCTATG-3' (SEQ ID NO: 45). Этот вариант дополнительно описан в примере 7. В одном из вариантов осуществления настоящего изобретения химерная конструкция предпочтительно включает а гетерологичную ДНК, представленную нуклеотидами с 8747 по 9046 в последовательности SEQ ID NO: 33. В другом варианте осуществления настоящее изобретение относится к химерной конструкции по настоящему изобретению, описанной в настоящем изобретении выше для гена BvFT2, причем указанная гетерологичная ДНК, включенная в указанную химерную конструкцию, инсертирована между промотором и терминатором, причем указанную гетерологичную ДНК получают следующим образом:a) амплифицируют фрагмент кДНК размером 0,27 т.н., происходящий от экзона 4 гена BvFT2 в реакции ПЦР, используя прямой праймер HiNK6382 с нуклеотидной последовательностью 5'CTATGGATCCGCATTTAATAAAATCTCTTTCAATG-3' (SEQ ID NO: 44) и обратный праймерTTGTCTGCTATG-3' (SEQ ID NO: 45), а также кДНК сахарной свеклы в качестве матрицы, причем кДНК сахарной свеклы получают из суммарной РНК, экстрагированной из листьев сахарной свеклы в реакции обратной транскриптазы, используя 3' RACE адаптер с нуклеотидной последовательностью 5'- 25024958GCGAGCACAGAATTAATACGACTCACTATAGGT12VN-3' (SEQ ID NO: 33) в качестве праймера; б) амплифицируют фрагмент кДНК размером 0,19 т.н., включая интрон ST-LS1 и фланкируя сайты сплайсирования, используя прямой праймер HiNK6383 с нуклеотидной последовательностью 5'CATAGCAGACAACTTCTTGGCAGGTAAGTTTCTGCTTCTAC-3' (SEQ ID NO: 46) и обратный праймерID NO: 40) и ДНК картофеля, содержащую интрон картофеля St-LS1 в качестве матрицы; в) гибридизируют продукты амплификации, полученные на стадиях а) и б), друг с другом с помощью второго цикла ПЦР, используя праймеры HiNK6382 и HiNK529 и используя смесь обоих продуктов амплификации в качестве матрицы, получая продукт гибридизации размером 0,47 т.н. в длину; г) амплифицируют фрагмент BvFT2 размером 0,27 т.н. второй раз, используя прямой праймер(SEQ ID NO: 47) и обратный праймер HiNK6386 с нуклеотидной последовательностью 5'CTATTTGTCGACGCATTTAATAAAATCTCTTTC-3' (SEQ ID NO: 48) и кДНК сахарной свеклы, полученной выше в подразделе а) в качестве матрицы; д) гибридизируют оба фрагмента по сайтам рестрикции Sac II для создания инвертированного повтора для последовательности BvFT2, отделенной интроном от гена картофеля ST-LS1. Подробности сборки предпочтительного варианта осуществления настоящего изобретения приведены ниже в примере 7. Последовательность интрона гена ST-LS1 можно легко получить из ДНК картофеля методами, известными специалистам в данной области. Сайты рестрикции Sac II, используемые для сборки гетерологичной ДНК, внедряют, используя специфические праймеры, описанные выше. В одном из вариантов осуществления настоящего изобретения предусмотрена химерная конструкция по настоящему изобретению для сайленсинга BvFT2, включающая нуклеотидную последовательность, представленную в SEQ ID NO: 33. В других специфических вариантах осуществления настоящего изобретения инвертированный повтор, включенный в химерную конструкцию, оперативно связан с конститутивным промотором, особенно промотором CaMV. Помимо применения кодирующих последовательностей для подавления генной экспрессии с помощью пост-трансляционного генного сплайсинга (post-transcriptional gene silencing - PTGS) или РНКи,описанных выше, применение некодирующей последовательности, особенно промоторных последовательностей, описано для снижения регуляции генной экспрессии. Трансгенная экспрессия дцРНК, содержащей промоторные последовательности, индуцирует de novo метилирование области целевого промотора и сопутствующий сайленсинг промотора; способ также называется транскрипционным подавлением экспрессии генов (transcriptional gene silencing - TGS) (Mette и др., 2000; Sijen и др., 2001; Heilersig и др., 2006). Сборка фрагментов промотора в генные кассеты для их антисмысловой, смысловой или дцРНК экспрессии показала эффективность в снижении регуляции транскрипции родственного гена у нескольких видов растений. Специалистам в данной области очевидно, что последовательности промоторных областей обоих генов BvFT1 и BvFT2, представленных в виде последовательностей SEQ ID No: 5 и SEQ ID No: 8, соответственно, могут также использоваться для конструирования химер и последующего транскрипционного сайленсинга гена соответствующего гомолога BvFT. Другой стратегией подавления экспрессии гена BvFT2 является применение искусственной микроРНК, первоначально описанной SCHWAB И др. (2006) и Alvarez и др., (2006). Искусственные молекулы микроРНК являются одноцепочечными РНК из 21 мономера, которые в норме не обнаруживаются у растений и которые получают из эндогенных предшественников микроРНК. Их последовательности конструируют по детерминантам отбора растительных целевых микроРНК таким образом, что цепь из 21 мономера обеспечивает специфический сайленсинг определенного гена-мишени, т.е. BvFT2 в настоящем изобретении. Более подробно применение и конструирование искусственной микроРНК в качестве инструмента, например, для супрессии гена BvFT2 в сахарной свеклы, описаны Ossowski и др., (2008) со ссылкой на вебсайт Web MicroRNA Designer (http://wmd3.weigelworld.org/cgi-bin/webapp.cgi). Другими примерами (которыми перечень не ограничивается) стратегий снижения экспрессии, количества, активности и/или функции эндогенного гена BvFT2 у сахарной свеклы, относящимися к настоящему изобретению, являются следующие. Инсерция молекулы ДНК (инсерционный мутагенез) В другом предпочтительном варианте осуществления настоящего изобретения молекула ДНК инсертирована в хромосомальную копию нуклеотидной последовательности по настоящему изобретению или в ее регуляторную область. Предпочтительно такая молекула ДНК включает подвижный генетический элемент, способный к перемещению в растительную клетку, например, Ac/Ds, Em/Spm, мутатор. В другом варианте молекула включает край Т-ДНК из Т-ДНК Agrobacterium. Молекула ДНК также может включать сайт распознавания рекомбиназы или интегразы, который может применяться для удаления части молекулы ДНК из хромосомы растительной клетки. Также охватываются методы инсерционного мутагенеза, использующие Т-ДНК, транспозоны, олигонуклеотиды, или другие методы, известные специалистам в данной области. Методы применения Т-ДНК и транспозона для инсерционного мутагенеза описаны в работах Winkler и др., Methods Mol. Biol. 82, 1989, сс. 129-136, и Martienssen, PNAS 95, 1998,- 26024958 сс. 2021-2026, сущность которых включена в настоящее изобретение в виде ссылок. Другим соответствующим методом является интродукция нонсенс мутаций в эндогенные гены-мишени, например, с помощью интродукции олигонуклеотидов РНК/ДНК в растение (Zhu и др., Nat Biotechnol 18(5), 2000, сс. 555-558). Точечные мутации также могут быть получены с помощью гибридов ДНК-РНА, которые называются "химеропластикой" (Cole-Strauss и др., Nucl Acids Res 27(5), 1999, сс. 1323-1330; Kmiec (1999)Gene therapy American Scientist 87(3), 1999, cc. 240-247). Делеционный мутагенез В еще одном варианте осуществления настоящего изобретения мутация молекулы нуклеиновой кислоты по настоящему изобретению создается в геномной копии последовательности в клетке или растении путем делеции части нуклеотидной последовательности или регуляторной последовательности. Способы делеционного мутагенеза известны специалистам в данной области. См., например, Miao и др.(1995) Plant J. 7, 1995, с. 359. Активность или интенсивность экспрессии гена-мишени также может быть снижена направленной делецией в гене-мишени, например, путем специфической в отношении последовательностей индукцией двухцепочечных разрывов ДНК в последовательности распознавания для специфической индукции двухцепочечных разрывов ДНК в последовательности нуклеиновой кислоты генамишени или рядом с ней. В еще одном варианте осуществления настоящего изобретения такие делеции создают случайным образом в большой популяции растений химическим мутагенезом или облучением, и растение с делецией в гене по настоящему изобретению выделяют прямой или обратной генетической стратегией. Известно, что облучение быстрыми нейтронами или гамма-лучами вызывает мутации по типу делеции у растений (Silverstone и др., Plant Cell, 10, 1998, cc. 155-169; Bruggeiviann и др., Plant J., 10, 1996, cc. 755-760;RedeiKoncz в кн.: "Methods in Arabidopsis Research", 1992, изд-во World Scientific Press, cc. 16-82). Мутации по типу делений в гене по настоящему изобретению могут быть восстановлены путем генетической стратегии реверсии, используя ПЦР с объединенными наборами молекул геномной ДНК, что было показано у С. elegans (Liu и др., Genome Research, 9, 1999, cc. 859-867). Прямая генетическая стратегия может включать мутагенез линии, проявляющей PTGS, с последующим скринингом потомства М 2 на отсутствие PTGS. Можно ожидать, что среди таких мутантов могут быть мутанты с нарушенным геном по настоящему изобретению. Это можно оценить саузерн-блоттингом или ПЦР для гена по настоящему изобретению с геномной ДНК из этих мутантов. Помимо процессов интродукции мутаций, указанных выше, специалистам в данной области известно, что многочисленные методы мутагенеза доступны для получения нулевых или нокаутных аллелей для определенного гена. Методы могут быть разделены на категории по физическим свойствам и по их мутагенному проявлению. Гамма-радиация и быстрые нейтроны вызывают хромосомные разрывы,часто приводящие к транслокациям и делециям, хотя этилметансульфонат (ЭМС) с высокой интенсивностью индуцирует транзиции путем алкилирования оснований гуанина. Стратегия TILLING (TargetingInduced Local Lesions IN Genomes - TILLING) основывается на крупных популяциях обработанных мутагеном растений, подвергаемых скринингу на точечные мутации в данной последовательности (McCallum и др., 2000). За последние годы были успешно начаты программы TILLING для нескольких основных сельскохозяйственных культур, включая сахарную свеклу (Hohmann и др., 2005). При клонировании и анализе последовательности исследуемого гена (например, генов BvFT2 по настоящему изобретению),подходы направленного мутагенеза, например, TILLING, в настоящее время становятся реально выполнимыми в качестве источника мутантных аллелей этих генов. В еще одном варианте осуществления настоящего изобретения экспрессию нуклеотидной последовательности по настоящему изобретению изменяют в каждой клетке растения. Это достигается, например, гомологичной рекомбинацией или инсерцией в хромосоме. Это также достигается, например, экспрессией смысловой или антисмысловой РНК, белка цинковый палец или рибозима под контролем промотора, способного экспрессировать смысловую или антисмысловую РНК, белка цинковый палец или рибозима в каждой клетке растения. Конструкции для экспрессии смысловой или антисмысловой РНК,белка цинковый палец или рибозима, или для сверхэкспрессии нуклеотидной последовательности по настоящему изобретению, получают и трансформируют в клетки растений по способам настоящего изобретения, например, описанным ниже. Также возможно комбинированное применение. Другие методы известны специалистам и могут включать задержку или остановку процессинга гена-мишени, транспорта белка, кодируемого геноммишенью, или его иРНК, ингибирование присоединения к рибосоме, ингибирование сплайсинга РНК,индукцию ферментативного разрушения РНК гена-мишени и/или ингибирование элонгации трансляции или терминации. В одном из объектов по настоящему изобретению предусмотрена химерная конструкция для повышенной регуляции экспрессии трансгенного эндогенного гена BvFT1 у сахарной свеклы. Повышенная регуляция экспрессии эндогенного гена BvFT1 приводит к отсрочке ответа на яровизацию у растущего растения сахарной свеклы или вызывает у растения сахарной свеклы развитие фенотипа отсутствия выхода в стрелку, что означает, что растение сахарной свеклы больше не отвечает на типичный период яровизации длительностью 18 недель путем выхода в стрелку и последующего цвете- 27024958 ния, но напротив продолжают вегетативный рост (без выхода в стрелку) и формирование нормального корнеплода. Растения, экспрессирующие указанный отсроченный ответ на яровизацию или указанный фенотип отсутствия выхода в стрелку, могут быть легко идентифицированы и выбраны путем применения эксперименты по фенотипическому анализу, используя стандартизированные условия роста. Настоящее изобретение содержит различные стратегии повышения экспрессии, количества, действия и/или функции эндогенного гена BvFT1 у сахарной свеклы. Специалисту очевидно, что ряд различных методов может применяться для повышения регуляции экспрессии гена-мишени у растений или,иначе говоря, может влиять на количество, действие и/или функцию генов у растения требуемым образом. В этом контексте следует отметить, что понятие повышенная регуляция подразумевает включение сверхэкспрессии. В одном варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению для трансгенной повышенной регуляции экспрессии эндогенного гена BvFT1 включает нуклеотидную последовательность, кодирующую ген BvFT1 или его частями, причем указанная нуклеотидная последовательность, кодирующая ген BvFT1 или его части, имеет последовательность, идентичную по меньшей мере на 70% последовательности нуклеиновой кислоты по настоящему изобретению,представленную ниже в виде последовательностей SEQ ID NO: 5 или 6, или гибридизируется с ней в жестких условиях с указанной нуклеотидной последовательностью, кодируемой геном BvFT1 или его частями, оперативно связанными с регуляторными последовательностями таким образом, что при экспрессии в растении вызывает повышенную экспрессию эндогенного гена BvFT1. В других вариантах осуществления настоящего изобретения идентичность последовательности нуклеиновой кислоты, кодирующей ген BvFT1 или его части, включенной в химерную конструкцию по настоящему изобретению, и последовательности нуклеиновой кислоты по настоящему изобретению,представленной ниже в виде последовательностей SEQ ID NO: 5 или 6, предпочтительно составляет по меньшей мере 80%, еще более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95%. В другом предпочтительном варианте осуществления настоящего изобретения кодирующей последовательности гена BvFT1 сахарной свеклы является последовательность, представленная ниже в видеSEQ ID NO: 6. Указанная нуклеотидная последовательность, кодирующая ген BvFT1, включенная в химерную конструкцию, также представлена нуклеотидами с 2076 по 2615 в последовательности SEQ IDNO: 34. В еще одном варианте осуществления настоящего изобретения химерная конструкция по настоящему изобретению для трансгенной повышенной регуляции экспрессии эндогенного гена BvFT1, описанного в настоящем изобретении выше, включает нуклеотидную последовательность, представленную в виде SEQ ID NO: 34. Предпочтительно гетерологичную ДНК, включенную в химерную конструкцию по настоящему изобретению для трансгенной повышенной регуляции экспрессии эндогенного гена BvFT1, оперативно связанного с конститутивным промотором, предпочтительно промотором Ubi3 из Arabidopsis. Получение значительных уровней трансгенной экспрессии в соответствующих растительных тканях является важным объектом в получении генетически сконструированных сельскохозяйственных растений. Экспрессия последовательностей гетерологичной ДНК у растения-хозяина зависит от наличия оперативно связанного промотора, функционирующего в растении-хозяине. Выбор последовательности промотора может определить где и когда в организме экспрессируется последовательность гетерологичной ДНК. Разные промоторы могут направлять экспрессию гена в разных тканях или типах клеток, или на разных стадиях развития, или в ответ на разные условия внешней среды. Новые промоторы разных типов, применимые в растительных клетках, постоянно обнаруживают и многочисленные примеры могут быть обнаружены в компиляции Okamuro и др. (1989). К типичным регулируемым промоторам, используемым в растениях, но ими перечень не ограничивается, относятся индуцируемые сафенер промоторы,промоторы, производные от тетрациклин-индуцируемой системы, промоторы, производные от индуцируемых салицилатом системах, промоторы, производные от индуцируемых спиртом систем, промоторы,производные от индуцируемой глюкокортикоидом системы, промоторы, производные от индуцируемых патогенном систем, и промоторы, производные от индуцируемых экдизоном систем. Например, может быть применен фрагмент растительного промотора, который может направлять экспрессию гена во всех тканях полученного растения. Такие промоторы в контексте настоящего изобретения называются конститутивными промоторами и действуют в большинстве условий внешней среды и на большинстве стадий развития и клеточной дифференциации. К примерам конститутивных промоторов относятся область инициации транскрипции 35S вируса мозаики цветной капусты (cauliflower mosaic virus - CaMV), 1'- или 2'-промотор, производный от Т-ДНК Agrobacterium tumefaciens, и другие области инициации транскрипции из генов разных растений, известных специалистам в данной области. К таким генам относятся, например, ген АР 2, ACT11 из Arabidopsis (Huang и др. (1996) Plant Mol. Biol. 33, 1996, сс. 125-139), Cat3 изArabidopsis (GenBank No. U43147, Zhong и др., Mol. Gen. Genet. 251, 1996, cc. 196-203), ген, кодирующий стеарил-ацил переносящего белка десатуразы из Brassica napus (Genbank No. X74782, Solocombe И др.,- 28024958Biol 208, 1989, cc. 551-565) и Gpc2 из кукурузы (GenBank No. U45855, Manjunath и др., Plant Mol. Biol. 33,1997, cc. 97-112). В другом варианте промотор растений может направлять экспрессию молекул нуклеиновой кислоты или химерных конструкций по настоящему изобретению в определенной ткани или может быть иным образом под более точным контролем внешней среды или стадий развития. К примерам условий окружающей среды, которые могут влиять на транскрипцию через нндуцибельные промоторы, относятся анаэробные условия, повышенная температура или наличие света. Такие промоторы в контексте настоящего изобретения называются "индуцибельными" или "тканеспецифичными" промоторами. Специалист может определить, что тканеспецифичный промотор может стимулировать экспрессию оперативно связанных последовательностей в тканях, отличных от тканей-мишеней. Таким образом, в контексте настоящего изобретения тканеспецифичным является промотор, который стимулирует экспрессию преимущественно в ткани-мишени, но также может вызвать некоторую экспрессию в других тканях. К примерам промоторов, находящихся под контролем стадий развития, относятся промоторы, инициирующие транскрипцию только (или первоначально только) в определенных тканях, например, фруктах, семяпочках, семенах или цветах. В контексте настоящего изобретения специфичным для семян или предпочтительным является промотор, который направляет экспрессию специфически или предпочтительно в тканях семян; такие промоторы могут быть, например, специфичными для семяпочек, зародышей, эндосперма, интегумента, оболочки семени или некоторых их комбинаций. Примеры включают промотор из специфичного для семяпочек гена BEL1, описанного Reiser и др. (Cell 83, 1995, сс. 735-742;GenBank No. U39944). Другие соответствующие специфические промоторы производны от следующих генов: MAC1 из кукурузы (Sheridan и др. Генетическая 142, 1996, сс. 1009-1020), Cat3 из кукурузы (GenBank No. L05934, Abler и др., Plant Mol. Biol. 22, 1993, cc. 10131-10138, гена олеозина массой 18 кДа из кукурузы (GenBank No, J05212, Lee и др., Plant Mol. Biol. 26, 1994, cc. 1981-1987), vivparous-1 из Arabidopsis (Genbank No. U93215), гена олеозина из Arabidopsis (Genbank No. Z17657), Atmycl из Arabidopsis(Urao и др., Plant Mol. Biol. 32, 1996, cc. 571-576, генов семейства запасных белков, семян класса 2s изArabidopsis (Conceicao и др., Plant 5, 1994, сс. 493-505), гена олеозина массой 20 кДа из Brassica napus(GenBank No. M63985), napA из Brassica napus (GenBank No. J02798, Josefsson и др. (1987) JBL 26:121961301), генов семейства напина из Brassica napus (Sjodahl и др., Planta 197, 1995, сс. 264-271), гена, кодирующего запасной белок класса 2S из Brassica napus (Dasgupta и др., Gene 133, 1993, се. 301-302), генов олеозина A (Genbank No. U09118) и олеизина В (Genbank No. U09119) из сои и гена, кодирующего низкомолекулярный белок с высоким содержанием серы, из сои (Choi и др., Mol Gen, Genet. 246, 1995, сс. 266-268). Понятие "промотор" также включает минимальный промотор, который представляет короткую последовательность ДНК, включающую ТАТА-бокс и другие последовательности, которые служат для точного определения сайта инициации транскрипции, к которому добавляют регуляторные элементы для контроля экспрессии. Понятие "промотор" также относится к нуклеотидной последовательности, которая включает минимальный промотор плюс регуляторные элементы, способные контролировать экспрессию кодирующей последовательности или функциональной РНК. Такой тип промоторной последовательности состоит из проксимальных и более удаленных выше по цепи элементов; такие элементы часто называют энхансерами. Таким образом, понятие "энхансер" означает последовательность ДНК, которая может стимулировать действие промотора и может быть природным элементом промотора или гетерологичным элементом, инсертированным для повышения уровня или тканеспецифичности промотора. Он способен действовать в обеих ориентациях (нормальной или перевернутой), и способен действовать даже после перемещения или вверх, или вниз по цепи от промотора. И энхансеры, и другие расположенные выше по цепи элементы промотора связывают последовательность-специфичные ДНК-связывающие белки, которые опосредуют их действия. Промоторы могут быть целиком производными от нативного гена, или могут состоять из разных элементов, производных от разных промоторов, обнаруженных в природе, или даже состоящих из синтетических сегментов ДНК. Промотор также может содержать последовательности ДНК, которые вовлечены в связывание белковых факторов, контролирующих эффективность инициации транскрипции в ответ на физиологические условия или условия развития. Понятие"сайт инициации" означает положение, занимаемое ближайшим первым нуклеотидом, который представляет часть транскрибированной последовательности, которая также обозначается в виде "положения+1". Относительно этого сайта все другие последовательности гена и его контролирующие области нумеруются. Расположенные ниже по цепи последовательности (т.е. другие кодирующие белки последовательности в направлении 3') называются положительными, а расположенные выше по цепи последовательности (по большей части контролирующих областей в направлении 5') называются отрицательными. Промоторные элементы, в частности элемент ТАТА, неактивные или с сильно сниженной промоторной активностью в отсутствие активирования выше по цепи, называются "минимальными или коровыми промоторами". При наличии соответствующего фактора транскрипции действие минимального промотора направлено на осуществление транскрипции. "Минимальный или коровый промотор", таким образом,состоит только из основных элементов, необходимых для инициации транскрипции, например, ТАТА- 29
МПК / Метки
МПК: A01H 5/00, C12N 15/82
Метки: гена, цветения, сахарной, время, конструирование, гомолога, устойчивости, свеклы, трансгенной, экспрессии, выходу, помощью, контролирующего, стрелку
Код ссылки
<a href="https://eas.patents.su/30-24958-konstruirovanie-ustojjchivosti-k-vyhodu-v-strelku-u-saharnojj-svekly-s-pomoshhyu-transgennojj-ekspressii-gomologa-gena-ft-svekly-kontroliruyushhego-vremya-cveteniya.html" rel="bookmark" title="База патентов Евразийского Союза">Конструирование устойчивости к выходу в стрелку у сахарной свеклы с помощью трансгенной экспрессии гомолога гена ft свеклы, контролирующего время цветения</a>
Предыдущий патент: Способ обработки древесной плиты
Следующий патент: Переработка биомассы
Случайный патент: Способ предварительной обработки интегрированной катализаторной суспензии без подложки


































