Генетически модифицированная клетка и способ использования упомянутой клетки
Номер патента: 23764
Опубликовано: 29.07.2016
Авторы: Виркс Ник Йоханнес Петрус, Кюйпер Сипко Мартен, Элинк Схюрман Том Даниель, Рёйссенарс Харалд Йохан
Формула / Реферат
1. Генетически модифицированная клетка, содержащая:
(i) первую последовательность нуклеотидов, кодирующую первый полипептид, содержащий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 1, 2, 3 или 4; и
(ii) вторую последовательность нуклеотидов, кодирующую второй полипептид, обладающий активностью по превращению 5-(гидроксиметил)фуран-2-карбоновой кислоты (ГМФ-кислоты),
отличающаяся тем, что упомянутая клетка является генетически модифицированной путем функционального введения, по меньшей мере, первой последовательности нуклеотидов и предпочтительно путем функционального введения как первой, так и второй последовательностей нуклеотидов.
2. Генетически модифицированная клетка по п.1, в которой вторым полипептидом является оксидоредуктаза 5-(гидроксиметил)фуран-2-карбоновой кислоты, предпочтительно полипептид, имеющий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 5 или 6.
3. Генетически модифицированная клетка по любому из пп.1, 2, в которой первая последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 7, 8, 9 или 10.
4. Генетически модифицированная клетка по любому из пп.1-3, в которой вторая последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 11 или 12.
5. Генетически модифицированная клетка по любому из пп.1-4, содержащая третью последовательность полинуклеотидов, кодирующую третий полипептид, содержащий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 19, 20, 21, 22, 23, 24 или 25.
6. Генетически модифицированная клетка по любому из пп.1-5, в которой третья последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 26, 27, 28, 29, 30, 31 или 32.
7. Генетически модифицированная клетка по любому из пп.1-6, в которой клеткой является прокариотическая клетка, такая как бактериальная клетка или эукариотическая клетка, такая как дрожжевая клетка, грибная клетка, растительная клетка или животная клетка.
8. Генетически модифицированная клетка по любому из пп.1-7, в которой клеткой является прокариотическая клетка, предпочтительно бактериальная клетка, отобранная из родов Escherichia, Anabaena, Caulobacter, Gluconobacter, Rhodobacter, Pseudomonas, Paracoccus, Bacillus, Brevibacterium, Corynebacterium, Rhizobium (Sinorhizobium), Bradyrhizobium, Flavobacterium, Klebsiella, Enterobacter, Lactobacillus, Lactococcus, Methylobacterium, Staphylococcus, Streptomyces, Zymomonas, Acetobacter, Streptococcus, Bacteroides, Selenomonas, Megasphaera, Burkholderia, Cupriavidus, Ralstonia, Methylobacterium, Methylovorus, Rhodopseudomonas, Acidiphilium, Dinoroseobacter, Agrobacterium, Sulfolobus или Sphingomonas, более предпочтительно отобранная из группы, состоящей из Bacillus subtilis, Bacillus amyloliquefaciens, Bacillus licheniformis, Bacillus puntis, Bacillus megaterium, Bacillus halodurans, Bacillus pumilus, Gluconobacter oxydans, Caulobacter crescentus, Methylobacterium extorquens, Methylobacterium radiotolerans, Methylobacterium nodulans, Rhodobacter sphaeroides, Pseudomonas zeaxanthinifaciens, Pseudomonas putida, Pseudomonas putida S12, Paracoccus denitrificans, Escherichia coli, Corynebacterium glutamicum, Staphylococcus carnosus, Streptomyces lividans, Sinorhizobium meliloti, Bradyrhizobium japonicum, Rhizobium radiobacter, Rhizobium leguminosarum, Rhizobium leguminosarum bv. trifolii, Agrobacterium radiobacter, Cupriavidus basilensis, Cupriavidus necator (Ralstonia eutropha), Ralstonia pickettii, Burkholderia phytofirmans, Burkholderia phymatum, Burkholderia xenovorans, Burkholderia graminis, Rhodopseudomonas palustris, Acidiphilium cryptum, Dinoroseobacter shibae, Sulfolobus addocaldarius, Sulfolobus islandicus, Sulfolobus solfataricus, Sulfolobus tokodaii.
9. Генетически модифицированная клетка по любому из пп.1-8, в которой клеткой является эукариотическая клетка-хозяин, например клетка млекопитающего, насекомого, растения, гриба или водоросли, такая как клетка млекопитающего, отобранная из клеточных линий яйцеклеток китайского хомячка (СНО), COS, 293, PerC6 или гибридом, клетка насекомого, отобранная из клеток Sf9 или Sf21 или производных от них, предпочтительно эукариотическая клетка, отобранная из грибных или дрожжевых клеток таких видов, как Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia, с большим предпочтением эукариотических клеток, отобранных из Kluyveromyces lactis, Saccharomyces cerevisiae, Hansenula polymorpha, Yarrowia lipolytica, Pichia stipitis или Pichia pastoris, или клеток мицелиальных грибов, отобранных из подотдела Eumycota и Oomycota или в качестве варианта видов из родов Acremonium, Agaricus, Aspergillus, Aureobasidium, Chrysosporium, Coprinus, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Piromyces, Phanerochaete, Pleurotus, Schizophyllum, Talaromyces, Thermoascus, Thielavia, Tolypocladium или Trichoderma, таких как Aspergillus niger, Aspergillus awamori, Aspergillus foetidus, Aspergillus sojae, Aspergillus fumigatus, Talaromyces emersonii, Aspergillus oryzae, Chrysosporium lucknowense, Trichoderma reesei или Penicillium chrysogenum.
10. Генетически модифицированная клетка по любому из пп.1-9, в которой первая и вторая последовательности нуклеотидов расположены в одном векторе, необязательно, вектор, кроме того, содержит третью последовательность нуклеотидов.
11. Вектор, содержащий:
(i) первую последовательность нуклеотидов, кодирующую первый полипептид, содержащий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 1, 2, 3 или 4; и
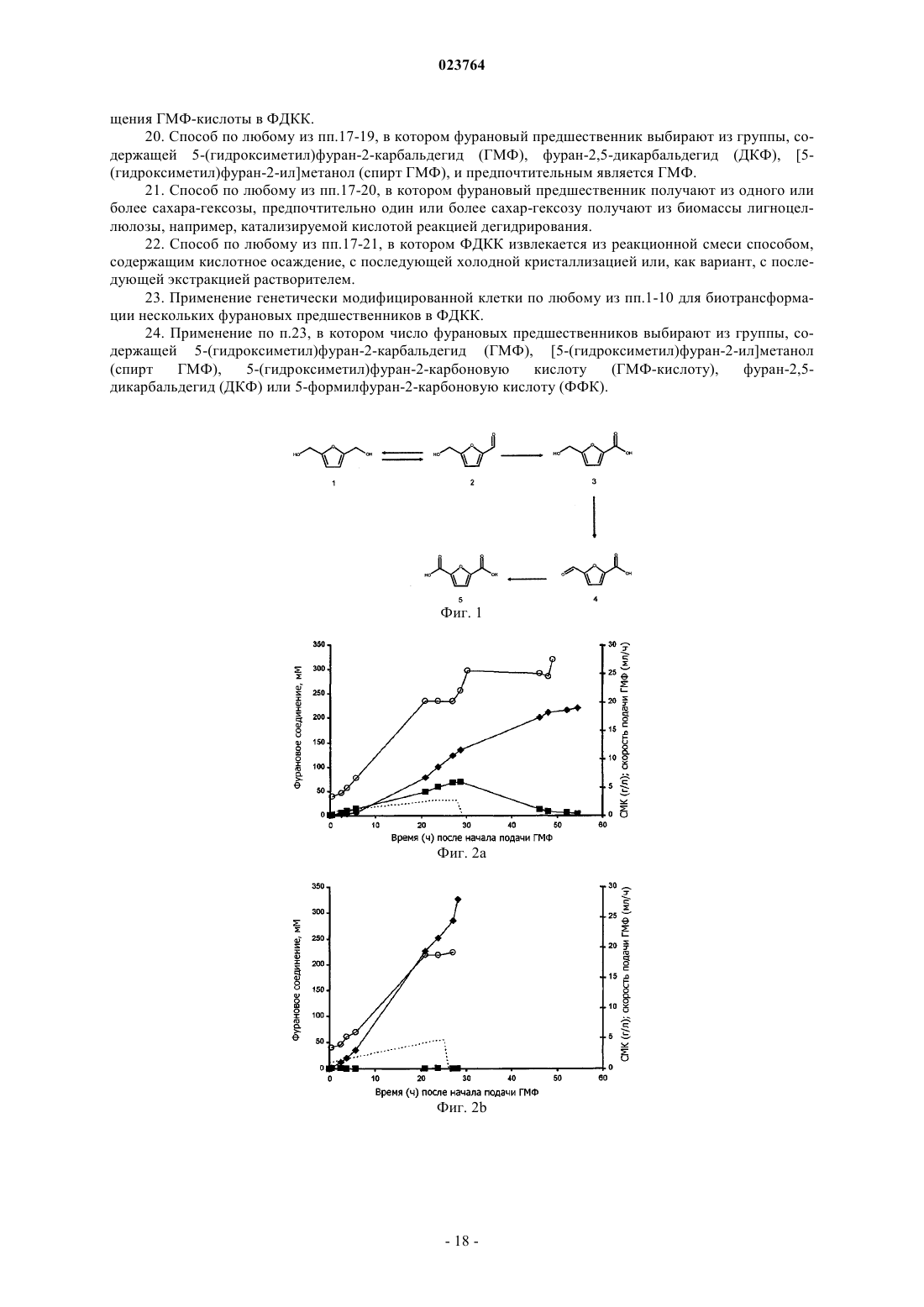
(ii) вторую последовательность нуклеотидов, кодирующую второй полипептид, обладающий активностью по превращению 5-(гидроксиметил)фуран-2-карбоновой кислоты (ГМФ-кислоты).
12. Вектор по п.11, в котором вторым полипептидом является оксидоредуктаза 5-(гидроксиметил)фуранкарбоновой кислоты, предпочтительно полипептид, имеющий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 5 или 6.
13. Вектор по любому из пп.11, 12, в котором первая последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 7, 8, 9 или 10.
14. Вектор по любому из пп.11-13, в котором вторая последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 11 или 12.
15. Вектор по любому из пп.11-14, содержащий третью последовательность полинуклеотидов, кодирующую третий полипептид, содержащий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 19, 20, 21, 22, 23, 24 или 25.
16. Вектор по любому из пп.11-15, в котором третья последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 26, 27, 28, 29, 30, 31 или 32.
17. Способ превращения 5-(гидроксиметил)фуран-2-карбоновой кислоты (ГМФ-кислоты), включающий инкубацию клетки по любому из пп.1-10 в присутствии ГМФ-кислоты в условиях, подходящих для превращения ГМФ-кислоты упомянутой клеткой.
18. Способ по п.17, в котором ГМФ-кислоты образуется in situ из одного или более фурановых предшественников ГМФ-кислоты в условиях, подходящих для превращения упомянутой клеткой одного или более предшественников ГМФ-кислоты.
19. Способ по любому из пп.17, 18, в котором второй полипептид клетки является оксидоредуктазой ГМФ-кислоты и, кроме того, содержащий размещение клетки в условиях, подходящих для превращения ГМФ-кислоты в ФДКК.
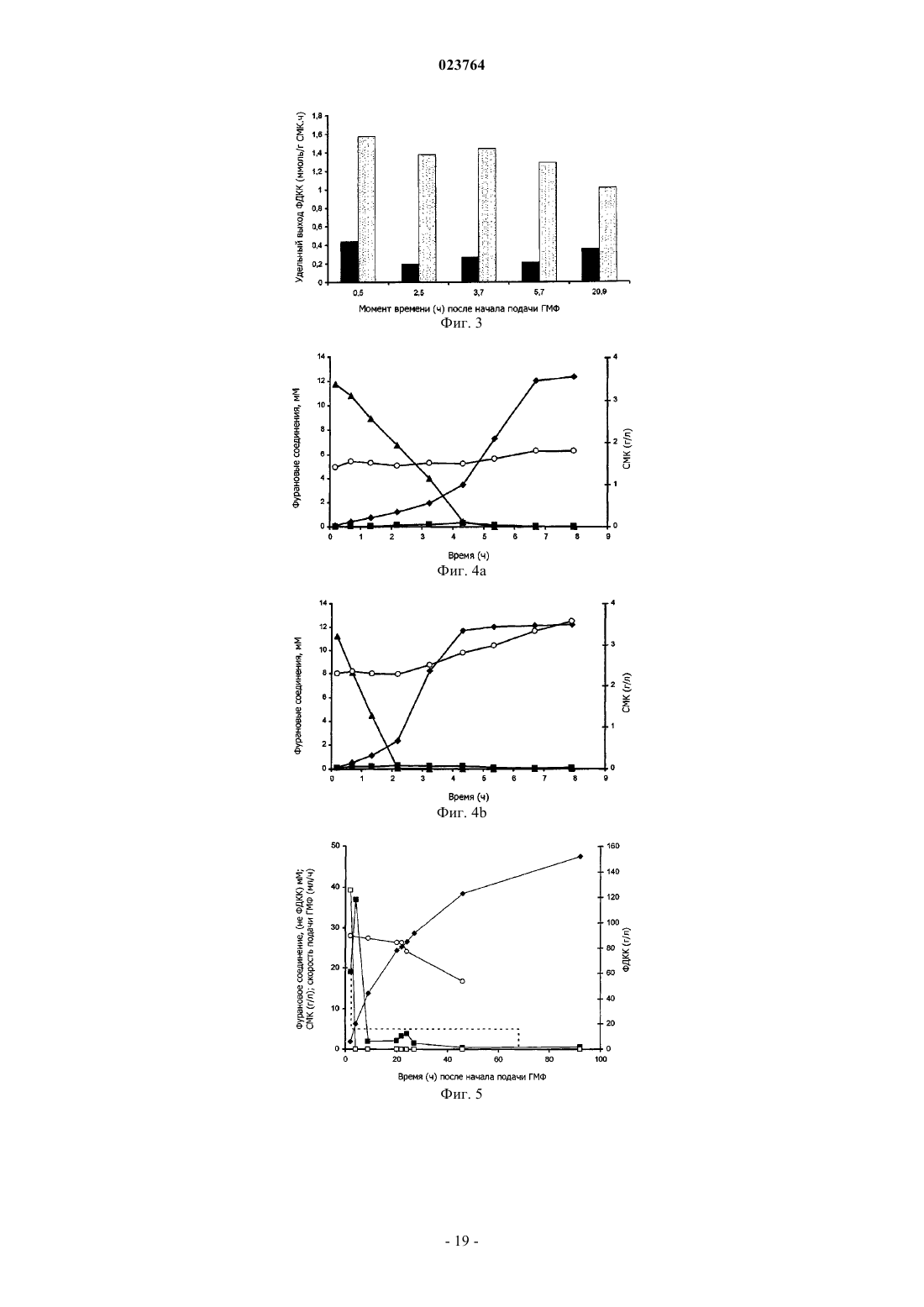
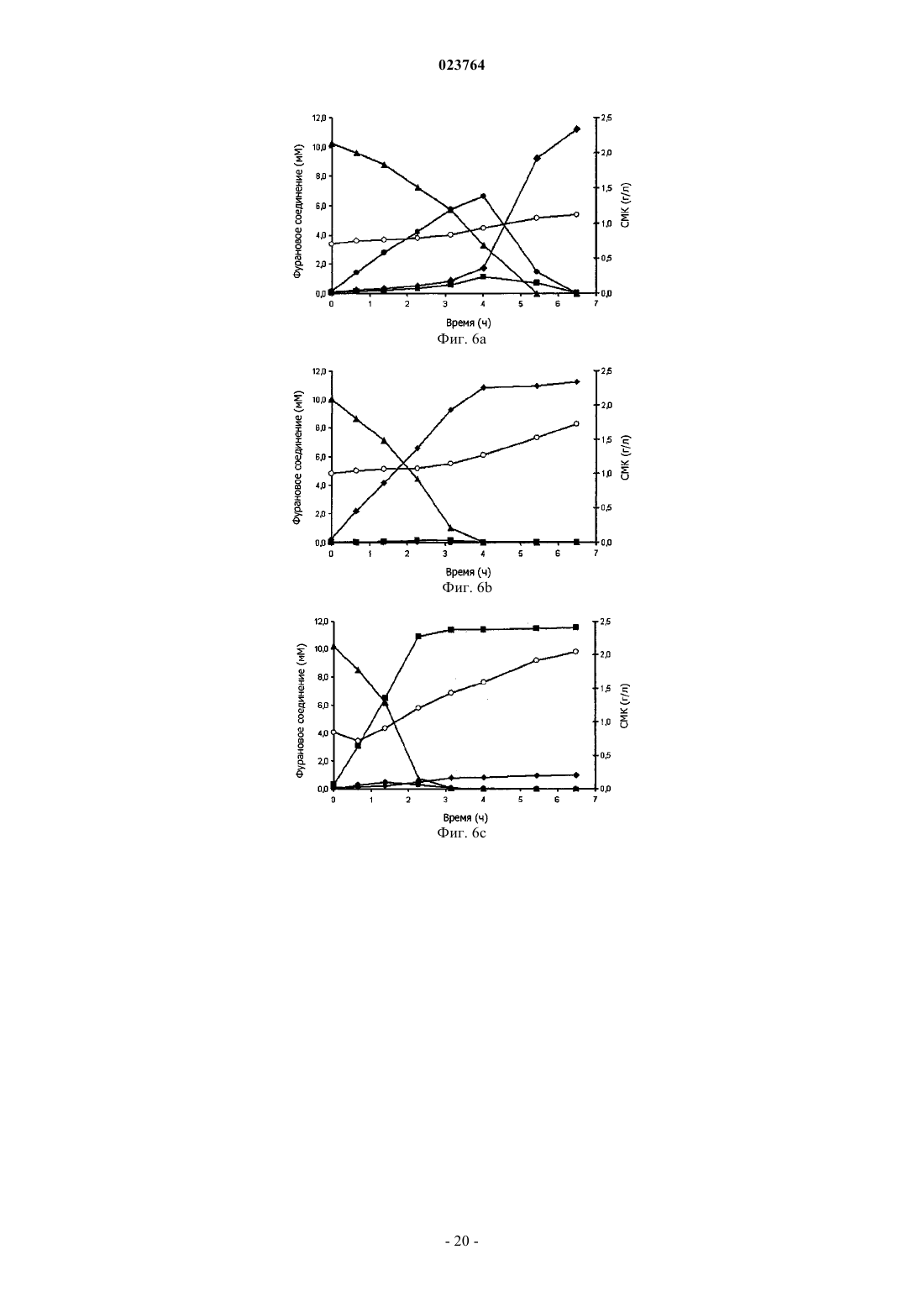
20. Способ по любому из пп.17-19, в котором фурановый предшественник выбирают из группы, содержащей 5-(гидроксиметил)фуран-2-карбальдегид (ГМФ), фуран-2,5-дикарбальдегид (ДКФ), [5-(гидроксиметил)фуран-2-ил]метанол (спирт ГМФ), и предпочтительным является ГМФ.
21. Способ по любому из пп.17-20, в котором фурановый предшественник получают из одного или более сахара-гексозы, предпочтительно один или более сахар-гексозу получают из биомассы лигноцеллюлозы, например, катализируемой кислотой реакцией дегидрирования.
22. Способ по любому из пп.17-21, в котором ФДКК извлекается из реакционной смеси способом, содержащим кислотное осаждение, с последующей холодной кристаллизацией или, как вариант, с последующей экстракцией растворителем.
23. Применение генетически модифицированной клетки по любому из пп.1-10 для биотрансформации нескольких фурановых предшественников в ФДКК.
24. Применение по п.23, в котором число фурановых предшественников выбирают из группы, содержащей 5-(гидроксиметил)фуран-2-карбальдегид (ГМФ), [5-(гидроксиметил)фуран-2-ил]метанол (спирт ГМФ), 5-(гидроксиметил)фуран-2-карбоновую кислоту (ГМФ-кислоту), фуран-2,5-дикарбальдегид (ДКФ) или 5-формилфуран-2-карбоновую кислоту (ФФК).
Текст
ИСПРАВЛЕННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ 2012.03.07 ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННАЯ КЛЕТКА И СПОСОБ ИСПОЛЬЗОВАНИЯ УПОМЯНУТОЙ КЛЕТКИ Виркс Ник Йоханнес Петрус, Элинк Схюрман Том Даниель, Кюйпер Сипко Мартен, Рйссенарс Харалд Йохан (NL) Бадаева Т.Н. (RU) Изобретение относится к области биотрансформации фурановых соединений. Более конкретно,изобретение относится к новым генетически модифицированным клеткам с улучшенными характеристиками для биокаталитической трансформации фурановых соединений и к вектору,пригодному для генетической модификации клетки-хозяина. Другой объект изобретения нацелен на способы биотрансформации 5-(гидроксиметил)фуран-2-карбоновой кислоты (ГМФ-кислоты) и ее предшественников с использованием клеток изобретения. Примечание: библиография отражает состояние при переиздании Область техники Настоящее изобретение в целом относится к области биотрансформации фурановых соединений. Такие биотрансформации находят применение в производстве фуран-2,5-дикарбоновой кислоты (ФДКК) и переработке материалов, содержащих лигноцеллюлозу, например, для производства биотоплива и биохимикатов. Конкретнее, настоящее изобретение относится к новым генетически модифицированным клеткам с улучшенными характеристиками для биокаталитической трансформации фурановых соединений. Еще один объект изобретения относится к вектору, пригодному для генетической модификации клетки-хозяина, чтобы улучшить ее характеристики в отношении биотрансформации фурановых соединений. Другой объект изобретения относится к способам биотрансформации 5-(гидроксиметил)фуран-2 карбоновой кислоты (ГМФ-кислоты) и ее предшественников с использованием клетки по изобретению. Уровень техники Биотрансформация фурановых соединений все чаще привлекает повышенное внимание. Это справедливо как в отношении биопроизводства фуран-2,5-дикарбоновой кислоты (ФДКК), которая является перспективным химикатом с высокой добавленной стоимостью, получаемым из биомассы (Werpy et al.(2004, так и в отношении ее отрицательной роли в ферментативном производстве биотоплива и биохимикатов из материалов, содержащих лигноцеллюлозу (Almeida et al. (2009. Недавно был выделен организм Cupriavidus basilensis HMF14, утилизирующий фурановые соединения (Koopman et al. (2010 а). Этот организм способен метаболизировать фурфураль и 5(гидроксиметил)фуран-2-карбальдегид (ГМФ). Метаболический путь разложения фурфураля и ГМФ был открыт Koopman et al. (2010a) вместе с участвующими в нем генами. Функциональное введение гена hmJH из Cupriavidus basilensis HMF14 в Pseudomonas putida S12 было показано Koopman et al. (2010b). Полученный штамм обладал высокой способностью продуцировать ФДКК, используя ГМФ в качестве субстрата. Однако наблюдаемое накопление 5-(гидроксиметил)фуран 2-карбоновой кислоты (ГМФ-кислоты) потребовало бы долгой продолжительности процесса или применения мер по удалению этого побочного продукта. Достаточное удаление побочного продукта ГМФкислоты желательно для многих процессов, в которых может быть получена ФДКК, а иногда это просто необходимо. В поиске решения проблемы накопления ГМФ-кислоты авторы настоящего изобретения неожиданно обнаружили, что экспрессия некоторых полипептидов в системе продуцирования ФДКК бактериямиPseudomonas putida S12 эффективно уменьшает накопление ГМФ-кислоты. Сущность изобретения Настоящие результаты исследований автора изобретения привели к созданию обобщенной концепции, что экспрессия в клетке-хозяине полипептида, имеющего последовательность аминокислот SEQ IDNO: 1 или 2 или ее аналоги/гомологи, такие как SEQ ID NO: 3 или 4, вместе с одним или более полипептидом, способным к превращению 5-(гидроксиметил)фуран-2-карбоновой кислоты (ГМФ-кислоты), приводит к эффективной биоконверсии ГМФ-кислоты. Улучшенная биоконверсия ГМФ-кислоты благоприятна для удаления ГМФ-кислоты и ее фурановых предшественников из сырья, в котором фурановые соединения рассматриваются как нежелательные, такого как сырье для спиртового брожения для получения, например, биотоплива, или для брожения в целях биологического производства химикатов. В других процессах улучшенная биоконверсия ГМФ-кислоты будет улучшать биопроизводство химикатов,если ГМФ-кислота является исходным материалом или промежуточным продуктом, таких как биопроизводство ФДКК. Первым объектом изобретения является генетически модифицированная клетка, содержащая первую последовательность полинуклеотидов, кодирующую первый полипептид, имеющий последовательность аминокислот SEQ ID NO: 1, 2, 3 или 4 или ее аналоги/гомологи, и вторую последовательность полинуклеотидов, кодирующую второй полипептид, проявляющий активность в отношении превращения ГМФ-кислоты. Полипептид, превращающий ГМФ-кислоту, может быть оксидоредуктазой, закодированной геном hmfH бактерии Cupriavidus basilensis HMF14, описанным ранее (Koopman et al. 2010a и Koopman et al. 2010b). В некоторых вариантах реализации предпочтительно, что генетически модифицированная клетка содержит третью последовательность полинуклеотидов, кодирующую третий полипептид,имеющий последовательность аминокислот SEQ ID NO: 19, 20, 21, 22, 23, 24, 25 или ее аналоги/гомологи. Функциональная активность третьей последовательности аминокислот приводит к дегидрогеназной активности, делающей возможным превращение фурановых альдегидов. Если второй полипептид является оксидоредуктазой, совместная экспрессия первого полипептида одновременно с оксидоредуктазой может также улучшить качество цельноклеточного биокатализатора,содержащего оксидоредуктазу, в отношении биокаталитического продуцирования ФДКК. Клетка изобретения является генетически модифицированной путем функционального введения, по меньшей мере, первой последовательности полинуклеотидов. Предпочтительно клетка является генетически модифицированной путем функционального введения как первой, так и второй последовательности полинуклеотидов. Функциональное введение всех трех, первого, второго и третьего полинуклеотидов, является дополнительным вариантом. Еще один объект изобретения относится к вектору, подходящему для генетической модификации клетки-хозяина. Вектор содержит первую последовательность полинуклеотидов, кодирующую первый полипептид, имеющий последовательность аминокислот SEQ ID NO: 1, 2, 3 или 4 или ее аналоги/гомологи, и вторую последовательность полинуклеотидов, кодирующую второй полипептид, обладающий активностью в отношении превращения 5-(гидроксиметил)фуран-2-карбоновой кислоты (ГМФкислоты). В качестве варианта вектор может содержать третью последовательность полинуклеотидов,кодирующую третий полипептид, имеющий последовательность аминокислот SEQ ID NO: 19, 20, 21, 22,23, 24, 25 или ее аналоги/гомологи. Такой вектор подходит для получения генетически модифицированной клетки изобретения. Другой объект изобретения относится к способу превращения 5-(гидроксиметил)фуран-2 карбоновой кислоты (ГМФ-кислоты). Способ предусматривает использование клетки изобретения. В предпочтительном варианте реализации этот способ подходит для продуцирования ФДКК. Еще один объект изобретения направлен на применение генетически модифицированной клетки изобретения для биотрансформации фурановых предшественников ФДКК. Краткое описание фигур Фиг. 1 показывает схематическое представление окислительных реакций превращения фурановых соединений в 2,5-фурандикарбоновую кислоту. Представлены следующие фурановые соединения: 1,ГМФ-спирт; 2, ГМФ; 3, ГМФ-кислота; 4, ФФК; 5, ФДКК. Фиг. 2 показывает продуцирование ФДКК и накопление ГМФ-кислоты в снабжаемой ГМФ культуре P. putida S122642 (фиг. 2 а) и В 38 (фиг. 2b) (, ФДКК (мМ); , ГМФ-кислота (мМ); , сухая масса клеток (СМК; г/л); пунктир: скорость подачи ГМФ (мл, 4 М раствора/ч. Фиг. 3 показывает удельный выход ФДКК в различные моменты времени во время периодических процессов, представленных на фиг. 2 (темный: P. putida S122642; светлый: P. putida S12B38). Фиг. 4 показывает продуцирование ФДКК и накопление ГМФ-кислоты в опытах на качалке с P.putida S12B38 (фиг. 4 а) и В 51 (фиг. 4b) ( , ГМФ (мМ); , ФДКК (мМ); , ГМФ-кислота (мМ); , сухая масса клеток (СМК; г/л. Фиг. 5 показывает продуцирование ФДКК и накопление ГМФ-кислоты в подпитываемой ГМФ культуре P. putida S12B38 с высокой плотностью клеток, начиная с высокой плотности клеток ( , ГМФ;, ФДКК (мМ); , ГМФ-кислота (мМ); , сухая масса клеток (СМК; г/л); пунктир: ГМФ скорость подачи(мл 4 М раствора/ч. Фиг. 6 показывает накопление ФДКК, ФФК и ГМФ-кислоты в содержащей ГМФ культуре P. putidaS12B38, поддерживаемой на качалке (совместно экспрессируются HmfH и HmfT1; A); S12B97 (совместно экспрессируются HmfH, HmfT1 и альдегиддегидрогеназа; В) и S12B101 (совместно экспрессируются HmfH и альдегиддегидрогеназа; С). , ГМФ (мМ); , ФДКК (мМ); , ГМФ-кислота (мМ); , ФФК(мМ); , сухая масса клеток (СМК; г/л). Краткое описание последовательностей В SEQ ID NO: 1 представлена последовательность аминокислот HmfT1 из Cupriavidus basilensisHMF14. Последовательность имеет учетный номер GenBank ADE20411.1. В SEQ ID NO: 2 представлена последовательность аминокислот HmfT2 из Cupriavidus basilensisHMF14. Последовательность имеет учетный номер GenBank ADE20404.1. В SEQ ID NO: 3 представлена последовательность аминокислот белкового продукта гена с меткой локуса mrad28314728 из Methylobacterium radiotolerans JCM 2831 (= АТСС 27329 = DSM 1819). Последовательность имеет учетный номер GenBank АСВ 26689.1. В SEQ ID NO: 4 представлена последовательность аминокислот белкового продукта гена saci2058 из Sulfolobus acidocaldarius DSM 639. Последовательность имеет учетный номер GenBank AAY81352.1. В SEQ ID NO: 5 представлена последовательность аминокислот HmfH из Cupriavidus basilensisHMF14. Последовательность имеет учетный номер GenBank ADE20408.1. В SEQ ID NO: 6 представлена последовательность аминокислот белкового продукта гена blr0367 изBradyrhizobium japonicum USDA 110. Последовательность имеет учетный номер GenBank BAC45632.1. В SEQ ID NO: 7 представлена кодирующая последовательность hmfT1 из Cupriavidus basilensisHMF14. В SEQ ID NO: 8 представлена кодирующая последовательность hmfT2 из Cupriavidus basilensisHMF14. В SEQ ID NO: 9 представлена кодирующая последовательность гена с меткой локусаmrad28314728 из Methylobacterium radiotolerans JCM 2831 (= АТСС 27329 = DSM 1819). В SEQ ID NO: 10 представлена кодирующая последовательность гена saci2058 из Sulfolobus acidocaldarius DSM 639. В SEQ ID NO: 11 представлена кодирующая последовательность hmfH из Cupriavidus basilensisHMF14. В SEQ ID NO: 12 представлена кодирующая последовательность гена blr0367 из Bradyrhizobium japonicum USDA 110. В SEQ ID NO: 13-18 представлены последовательности различных синтетических праймеров. Места(курсивом) и предполагаемые сайты связывания рибосомы (нижний регистр) указаны. Праймер FN23 разработан именно в 3'-5' направлении относительно инициирующего кодона hmfH. В SEQ ID NO: 13 представлена нуклеотидная последовательность синтетического ДНК-праймераhmfT1 (f) 5'-ACGAATTCAAaggagACAACAATGGAAG-3'. В SEQ ID NO: 14 представлена нуклеотидная последовательность синтетического ДНК-праймераhmfT1 (r) 5'-AAGCTAGCTGAGCAGTCACCCTCACTC-3'. В SEQ ID NO: 15 представлена нуклеотидная последовательность синтетического ДНК-праймераFN23 5'-CGGAATTCCACATGACAagggagACCG-3'. В SEQ ID NO: 16 представлена нуклеотидная последовательность синтетического ДНК-праймераFN24 5'-CGGAATTCGCTTCGGTCTTCAACTCGGATG-3'. В SEQ ID NO: 17 представлена нуклеотидная последовательность синтетического ДНК-праймераmrad (f) 5'-ACGAATTCggaggAAATCTATGCAGACC-3'. В SEQ ID NO: 18 представлена нуклеотидная последовательность синтетического ДНК-праймераmrad (r) 5'-AAGCTAGCGCAGAACCGTATCGTCAG-3'. В SEQ ID NO: 19 представлена последовательность аминокислот альдегиддегирогеназы Adh из Cupriavidus basilensis HMF14. В SEQ ID NO: 20 представлена последовательность аминокислот, имеющую учетный номер Genbank: YP003609156.1. В SEQ ID NO: 21 представлена последовательность аминокислот, имеющую учетный номер Genbank: ZP02881557.1. В SEQ ID NO: 22 представлена последовательность аминокислот, имеющую учетный номер Genbank: YP003451184.1. В SEQ ID NO: 23 представлена последовательность аминокислот, имеющую учетный номер Genbank: ACA09737.1. В SEQ ID NO: 24 представлена последовательность аминокислот, имеющую учетный номер Genbank: YP530742.1. В SEQ ID NO: 25 представлена последовательность аминокислот, имеющую учетный номер Genbank: YP001541929.1. В SEQ ID NO: 26 представлена последовательность полинуклеотидов adh, кодирующую альдегиддегидрогеназу Adh из Cupriavidus basilensis HMF14. В SEQ ID NO: 27 представлена последовательность полинуклеотидов, кодирующую последовательность аминокислот, имеющую учетный номер Genbank: YP003609156.1. В SEQ ID NO: 28 представлена последовательность полинуклеотидов, кодирующую последовательность аминокислот, имеющую учетный номер Genbank: ZP02881557.1. В SEQ ID NO: 29 представлена последовательность полинуклеотидов, кодирующую последовательность аминокислот, имеющую учетный номер Genbank: YP003451184.1. В SEQ ID NO: 30 представлена последовательность полинуклеотидов, кодирующую последовательность аминокислот, имеющую учетный номер Genbank: АСА 09737.1. В SEQ ID NO: 31 представлена последовательность полинуклеотидов, кодирующую последовательность аминокислот, имеющую учетный номер Genbank: YP530742.1. В SEQ ID NO: 32 представлена последовательность полинуклеотидов, кодирующую последовательность аминокислот, имеющую учетный номер Genbank: YP001541929.1. В SEQ ID NO: 33 представлена нуклеотидную последовательность синтетического ДНК-праймераFN13: 5'-ATGCGGCCGCAACAaggagAAGATGGAATGAACG-3' (подчеркнута последовательность сайта рестрикции NotI; инициирующий кодон (ATG) гена, кодирующего альдегиддегидрогеназу, выделен курсивом; предполагаемый сайт связывания рибосомы (ССР) в нижнем регистре). В SEQ ID NO: 34 представлена нуклеотидная последовательность синтетического ДНК-праймераFN14: 5'-ATGCGGCCGCGCGTCGGGGTCGGTGCTA-3' (подчеркнута последовательность сайта рестрикции NotI; терминирующий кодон (обратно комплементарная цепь) выделен курсивом). Подробное описание изобретения Основные понятия. В настоящем подробном описании и прилагаемой формуле изобретения слова "содержать" и"включать" и их варианты, такие как "содержит", "содержащий", "включает" и "включающий" следует интерпретировать включительно. То есть, эти слова предназначены передавать возможное включение других элементов или целых чисел, не перечисленных конкретно, там, где это позволяет контекст. В данном документе слова, употребляемые в единственном числе, также включают и множественное число. Например, элемент может означать один элемент или более чем один элемент. Термин "несколько" следовало бы понимать, как имеющий значение "один или более". Под фурановыми соединениями здесь следует понимать любое соединение, имеющее фурановое кольцо. Предпочтительно фурановым соединением является соединение, которое может быть окислено до 2,5-фурандикарбоновой кислоты. Фурановые соединения, значимые в контексте данного изобретения("ГМФ-спирт"),5-(гидроксиметил)фуран-2 карбальдегид ("ГМФ"), 5-(гидроксиметил)фуран-2-карбоновую кислоту ("ГМФ-кислоту"), 5 формилфуран-2-карбоновую кислоту ("ФФК"), фуран-2,5-дикарбальдегид ("ДКФ") и фуран-2,5 дикарбоновую кислоту ("ФДКК"). Фурановое кольцо или любая из его замещаемых групп могут быть замещены, например, на ОН, С 1-С 10-алкил, алкил, аллил, арил или RO-эфирную функциональную группу, включая циклические группы, на любой доступной позиции в фурановом кольце. Химическая структура нескольких релевантных фурановых соединений представлена ниже. Термин "полинуклеотид" включает полидезоксирибонуклеиновые кислоты (ДНК) и полирибонуклеиновые кислоты (РНК), и термин может относиться или к ДНК, или к РНК. Специалисты будут осведомлены о различиях в стабильности молекул ДНК и РНК. Таким образом, специалисты будут в состоянии понять из контекста использования термина "полинуклеотид", которая из форм нуклеотида (ДНК или РНК) подходит. Термин "сходство" последовательностей, как он использован здесь, относится к степени, до которой индивидуальные полинуклеотидные или белковые последовательности похожи. Степень сходства между двумя последовательностями основывается на степени идентичности в сочетании с количеством консервативных замен. Процентом "сходства последовательностей" является процент аминокислот или нуклеотидов, которые или идентичны, или консервативно заменены, т.е. "сходство последовательностей"= (% идентичности последовательностей) + (% консервативных замен). Для целей настоящего изобретения "консервативные замены" и "идентичность" рассматриваются как виды более широкого термина "сходство". Таким образом, когда бы ни использовался термин "сходство" последовательностей, он включает в себя "сходство" последовательностей и "консервативные замены". Термин "идентичность последовательностей" известен специалистам. Чтобы определить степень идентичности двух последовательностей аминокислот или двух последовательностей нуклеиновых кислот, последовательности выравниваются для целей оптимального сравнения (например, в первую аминокислотную или нуклеотидную последовательность могут быть внесены разрывы для оптимального выравнивания со второй амино- или нуклеиновокислотной последовательностью). Такое выравнивание может быть проведено на полную длину сравниваемых последовательностей. В качестве варианта выравнивание может быть проведено на более коротком участке сравнения, например на около 20, около 50, около 100 или более нуклеиновых кислот/оснований или аминокислот. Аминокислотные остатки или нуклеотиды в соответствующих положениях аминокислот или нуклеотидов затем сравниваются. Если положение в первой последовательности занято таким же аминокислотным остатком или нуклеотидом, что и в соответствующем положении во второй последовательности,то молекулы идентичны в этом положении. Степень идентичности, разделяемая последовательностями,обычно выражается в проценте идентичности между двумя последовательностями и является функцией количества идентичных положений, занимаемых идентичными остатками в последовательностях (т.е. % идентичности = количество идентичных остатков в соответствующих положениях/общее количество положений 100). Предпочтительно две сравниваемые последовательности имеют такую же или в значительной степени такую же длину. Процент "консервативных замен" может быть определен так же, как процент идентичности последовательностей. Однако, в этом случае замены в специфическом участке последовательности аминокислот или нуклеотидов, пригодные для сохранения функциональных свойств исходного остатка, засчитываются, как если бы замены не происходило. Для последовательностей аминокислот релевантными функциональными свойствами являются физико-химические свойства аминокислот. Консервативная замена одной аминокислоты в полипептиде изобретения может быть выбрана из других членов класса, к которому принадлежит данная аминокислота. Например, в области биохимии белков хорошо известно, что аминокислота, принадлежащая к группировке аминокислот, имеющих определенный размер или свойство (такое, как заряд, гидрофобность или гидрофильность) может быть заменена на другую аминокислоту без изменения активности белка,особенно в части молекулы белка, которая не напрямую связана с биологической активностью. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин,фенилаланин, триптофан и тирозин. Полярные нейтральные аминокислоты включают глицин, серин,треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин. Отрицательно заряженные (кислотные) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Консервативные замены включают, например, Lys наArg и наоборот, чтобы поддержать положительный заряд; Glu на Asp и наоборот, чтобы поддержать отрицательный заряд; Ser на Thr, так что поддерживается свободный -ОН; и Gin на Asn, чтобы поддержать свободный -NH2. Для нуклеотидной последовательности релевантным функциональным свойством является в основном биологическая информация, которую несет определенный нуклеотид внутри открытой рамки считывания последовательности в отношении механизма транскрипции и/или трансляции. Общеизвестно, что генетический код является вырожденным (или избыточным), и что различные кодоны могут нести одну и ту же информацию в отношении аминокислоты, которую они кодируют. Например, у некоторых видов аминокислота лейцин кодируется кодонами UUA, UUG, CUU, CUC, CUA, CUG (или ТТА, TTG, СТТ,СТС, СТА, CTG для ДНК), и аминокислота серин определяется кодонами UCA, UCG, UCC, UCU, AGU,AGC (или ТСА, TCG, ТСС, ТСТ, AGT, AGC для ДНК). Замены нуклеотидов, которые не изменяют транслируемую информацию, рассматриваются как консервативные замены. Специалисты будут осведомлены о факте, что несколько различных компьютерных программ, используя различные математические алгоритмы, в состоянии определить идентичность между двумя последовательностями. Например, можно использовать компьютерную программу, задействующую алгоритм Нидлмана и Вунша (Needleman et al. (1970. По реализации компьютерная программа являетсяGAP-программой в пакете программ Accelrys GCG (Accelrys Inc., San Diego U.S.A). Матрицы замены,которые могут быть использованы, являются, например, матрицей BLOSUM 62 или матрицей РАМ 250 со значениями "штрафа за открытие пробела" (gap weight) 16, 14, 12, 10, 8, 6 или 4 и со значениями"штрафа за продолжение пробела" (length weight) 1, 2, 3, 4, 5 или 6. Специалисты примут во внимание,что все эти различные параметры приведут лишь к слабым различиям в результатах, но что общий процент идентичности двух последовательностей не значительно изменится, если использовать различные алгоритмы. Согласно воплощению изобретения процент идентичности двух нуклеотидных последовательностей определяют, используя GAP-программу из пакета программ Accelrys GCG (Accelrys Inc., San DiegoU.S.A). Используют матрицу NWSgapdna CMP со значениями " штрафа за открытие пробела " (gapweight) 40, 50, 60, 70 или 80 и со значениями " штрафа за продолжение пробела" (length weight) 1, 2, 3, 4,5 или 6. В другом воплощении процент идентичности двух последовательностей аминокислот или нуклеотидов определяют, используя алгоритм Е. Meyers и W. Miller (Meyers et al. (1989, который встроен в программу ALIGN (версия 2.0) (доступно на ALIGN Query using sequence data of the Genestream serverIGH Montpellier France http://vega.igh.ctirs.fr/bin/align-guess.cgi), используя таблицу масс остатков РАМ 120, значения штрафа за продолжение пробела (gap length penalty) 12 и за открытие пробела (gappenalty) 4. Для настоящего изобретения наиболее предпочтительно использовать BLAST (Basic Local Alignment Tool) для определения процента идентичности и/или сходства последовательностей аминокислот или нуклеотидов. Запросы, использующие BLASTn, BLASTp, BLASTx, tBLASTn и tBLASTx программы Altschul et al.(1990) могут быть отправлены через on-line версию BLAST, доступную на http://www.ncbi.nlm.nih.gov/. В качестве варианта может быть использована автономная версия (например, версия 2.2.24 (вышедшая 23 августа 2010 г., также доступная для загрузки через интернет-сайт NCBI. Предпочтительно запросыBLAST составляют со следующими параметрами. Для определения процента идентичности и/или сходства последовательностей аминокислот: algorithm: blastp; word size: 3; scoring matrix: BLOSUM62; gapcosts: Existence: 11, Extension: 1; compositional adjustments: conditional compositional score matrix adjustment; filter: off; mask: off. Для определения процента идентичности и/или сходства последовательностей нуклеотидов: algorithm: blastn; word size: 11; max matches in query range: 0; match/mismatch scores: 2, -3;gap costs: Existence: 5, Extension: 2; filter: low complexity regions; mask: mask for lookup table only. Процент "консервативных замен" может быть определен так же, как процент идентичности последовательностей, с помощью указанных алгоритмов и компьютерных программ. Некоторые компьютерные программы, например BLASTp, представляют количество/процент совпадений (=сходства) и количество/процент идентичности. Процент консервативных замен может быть выведен также путем вычитания процента идентичности из процента сходства (процент консервативных замен = процента сходства процент идентичности). Общепринятые молекулярно-биологические методики, такие как гибридизация, ПЦР, расщепление ферментами рестрикции, трансформация хозяев и т.д. могут быть осуществлены по стандартной методике, известной специалистам, как описано в Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual,Cold Spring Harbor Press, N.Y.; and Ausubel et al. (eds.), 1995, Current Protocols in Molecular Biology (John Первый полинуклеотид и полипептид. Генетически модифицированная клетка изобретения содержит первый полинуклеотид, кодирующий первый полипептид. Первый полипептид содержит последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот с SEQ ID NO: 1, 2, 3 или 4. В качестве варианта сходство последовательности может быть выражено по меньшей мере как 45,50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или по меньшей мере 99% сходства. Согласно воплощению указанные проценты сходства могут быть процентами идентичности. В особом воплощении первый полипептид содержит последовательность аминокислот, установленную в любом из SEQ ID NO: 1, 2, 3 или 4. Такой полипептид в состоянии обеспечить улучшение в отношении биоконверсии ГМФ-кислоты. Не желая быть связанными какой-либо теорией, авторы предполагают, что такой полипептид обладает способностью к транспорту ГМФ-кислоты. Путем транспортировки ГМФ-кислоты в клетку первым полипептидом она становится более доступна для внутриклеточного превращения. Таким образом, биоконверсия ГМФ-кислоты может быть улучшена. Такое улучшение биоконверсии ГМФ-кислоты показано в примерах для HmfT1 (SEQ ID NO: 1) и белкового продукта гена с меткой локуса mrad28314728 из Methylobacterium radiotolerans JCM 2831(= АТСС 27329 = DSM 1819) (SEQ ID NO: 3). На основе степени сходства/идентичности последовательностей с этими последовательностями обоснованно ожидать, что HmfT2 (SEQ ID NO: 2) и белковый продукт из гена Saci2058 из Sulfolobus acidocaldarius DSM 639 будет обладать подобными эффектами.HmfT2 (SEQ ID NO: 2) имеет более 90% сходства с HmfT1 (SEQ ID NO: 1). Степень идентичности составляет 87%. Сходную функциональность белкового продукта гена saci2058 из Sulfolobus acidocaldarius DSM 639 (SEQ ID NO: 4) можно ожидать, основываясь на выравнивании последовательности с транспортными белками из различных функциональных семейств. Транспортный белок Sulfolobus образует кластер сHmfT1 (SEQ ID NO: 1) и Mrad28314728 (SEQ ID NO: 3). Более того, анализ генома S. acidocaldarius показал, что ген транспортного белка saci2058 фланкирован геном, который кодирует такие же функции,как кластер генов hmf соответственно, тип активностей, которые ожидаются при распаде ГМФ(-подобных соединений). Примеры: Saci2057, алкогольдегидрогеназа; Saci2059/2060, диоксигеназа ароматического кольца; Saci2062, синтетаза ацил-СоА (функционально сравнимая с hmfD); Saci2063,гидратаза эноил-СоА (функционально сравнимая с hmfE); Saci2064, альдегидоксидаза / ксантиндегидрогеназа (функционально сравнимая с hmfABC). На основе данного анализа обоснованно ожидать, что белковый продукт гена Saci2058 из Sulfolobus acidocaldarius DSM 639 (SEQ ID NO: 4) будет иметь такой же эффект, как HmfT1 (SEQ ID NO: 1) и/или белковый продукт гена с меткой локуса mrad28314728 изMethylobacterium radiotolerans JCM 2831 (= АТСС 27329 = DSM 1819) (SEQ ID NO: 3). Первый полипептид может быть кодирован первой полинуклеотидной последовательностью, имеющей по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%,более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью полинуклеотидов, установленной в SEQID NO: 7, 8, 9 или 10. Приемлемой альтернативной степенью сходства первого полинуклеотида с последовательностью, установленной в SEQ ID NO: 7, 8, 9 или 10 может быть по меньшей мере 66, 70, 75, 80,85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или по меньшей мере 99% сходства. Согласно воплощению указанные проценты сходства могут быть процентами идентичности. В особом воплощении первый полипептид может быть кодирован полинуклеотидной последовательностью, установленной в любом из SEQ ID NO: 7, 8, 9 или 10. Первый полипептид или полинуклеотид, кодирующий первый полипептид, может быть выделен из организма, предпочтительно микроорганизма, который экспрессирует первый полипептид в определенных условиях роста. Микроорганизм может быть в состоянии использовать ГМФ-кислоту или родственные фурановые вещества, такие как ГМФ или ГМФ-спирт, в качестве источника углерода, но это не является обязательным. При типичном подходе могут быть просмотрены генные библиотеки, чтобы выделить альтернативные подходящие полинуклеотиды. Библиотеки могут быть сконструированы из микроорганизмов из надцарства Bacteria. Эти микроорганизмы могут принадлежать к типу Proteobacteria, более точно к классу Alphaproteobacteria или Betaproteobacteria. Alphaproteobacteria могут принадлежать к порядку Rhizobiales, к семейству Bradyrhizobiaceae или Methylobacteriaceae. Bradyrhizobiaceae могут принадлежать к родуBurkholderiaceae. Они могут принадлежать к роду Cupriavidus, например Cupriavidus basilensis; или к роду Ralstonia, например Ralstonia eutropha; или к роду Burkholderia, например Burkholderia phymatum,Burkholderia phytofirmans, Burkholderia xenovorans, или Burkholderia graminis. Бактерии могут также принадлежать к типу Firmicutes, более точно к классу Bacilli, более точно к порядку Bacillales. Bacillales могут принадлежать к семейству Bacillaceae, более точно к роду Geobacillus,например Geobacillus kaustophilus. Как вариант, микроорганизмы могут принадлежать к надцарству Archaea, более точно к типу Euryarchaeota или к типу Crenarchaeota. Euryarchaeota могут принадлежать к неклассифицированному роду, например Cand. Parvarchaeum acidiphilum, или к классу Thermoplasmata,более точно к порядку Thermoplasmatales. Thermoplasmatales могут принадлежать к семейству Thermoplasmataceae, более точно к роду Thermoplasma, например Thermoplasma acidophilum или Thermoplasmavolcanium. The Crenarchaeota могут принадлежать к классу Thermoprotei, более точно к порядку Sulfolobales. Sulfolobales могут принадлежать к семейству Sulfolobaceae, более точно к роду Sulfolobus, например Sulfolobus acidocaldarius, Sulfolobus islandicus, Sulfolobus solfataricus, или Sulfolobus tokodaii; или к роду Metallosphaera, например Metallosphaera sedula. Thermoprotei могут также принадлежать к порядкуThermoproteales, семейству Thermoproteaceae. Thermoproteaceae могут принадлежать к роду Vulcanisaeta,например Vulcanisaeta distributa; или к роду Caldivirga, например Caldivirga maquilingensis. Предпочтительно первый полипептид и/или первый полинуклеотд, кодирующий первый полипептид, выделяют из Cupriavidus basilensis HMF14 (Wierckx et al. 2010). В альтернативном варианте воплощения первый полипептид и/или первый полинуклеотд, кодирующий первый полипептид, может быть выделен из Methylobacterium radiotolerans. Основываясь на последовательности аминокислот, предоставленной в SEQ ID NO: 1, 2, 3 или 4,и/или последовательности нуклеотидов, предоставленной в SEQ ID NO: 7, 8, 9 или 10, специалисты будут в состоянии сконструировать подходящие зонды и/или праймеры, чтобы выделить последовательность нуклеотидов, кодирующую первый полипептид. В качестве варианта, основываясь на последовательности аминокислот, предоставленной в SEQ IDNO: 1, 2, 3 или 4, и/или последовательности нуклеотидов, предоставленной в SEQ ID NO: 7, 8, 9 или 10,специалисты могут получить синтезированные последовательности, кодирующие первый полипептид, из коммерческих источников, так как синтез генов все больше и больше становится доступным. Синтезированные последовательности могут быть, например, куплены в Geneart A.G. (Regensburg, Germany) или вGenscript USA Inc. (Piscataway, NJ, USA), если приводить только некоторые из возможных примеров. Клетка изобретения является генетически модифицированной функциональным введением первого полинуклеотида. Под функциональным введением полинуклеотида подразумевается введение упомянутого полинуклеотида в клетку так, что упомянутая клетка приобретает возможность экспрессировать функциональный полипептидный продукт полинуклеотида. Способы и методики функционального введения полинуклеотидов в клетки-хозяева находятся в пределах обычных знаний специалистов. Полипептид, превращающий ГМФ-кислоту. Генетически модифицированная клетка изобретения содержит второй полинуклеотид, кодирующий второй полипептид. Второй полипептид обладает ГМФ-превращающей активностью и может быть отобран из любых полипептидов, способных превращать ГМФ-кислоту в продукт. Изобретатели наблюдали,что биоконверсия ГМФ-кислоты вторым полипептидом, превращающим ГМФ-кислоту, эффективно улучшается путем экспрессии первого полипептида в клетке. Второй полинуклеотид, кодирующий второй полипептид, может быть натуральным компонентом клетки изобретения, а именно клетки, не нуждающейся в генетической модификации в отношении второго полинуклеотида. Однако в определенных воплощениях изобретения клетка изобретения является генетически модифицированной в отношении второго полинуклеотида путем функционального введения второго полинуклеотида. Термин "функциональное введение" уже был объяснен выше в связи с первым полипептидом и первым полинуклеотидом. В предпочтительном варианте воплощения изобретения второй полипептид является оксидоредуктазой, превращающей ГМФ-кислоту. Эта оксидоредуктаза, превращающая ГМФ-кислоту, может содержать последовательность аминокислот, установленную в SEQ ID NO: 5 или 6, или вариант этого полипептида, имеющий по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью полинуклеотидов, установленной в SEQ ID NO: 5 или 6. В качестве варианта сходство последовательности может быть выражено по меньшей мере как 45,50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или по меньшей мере 99% сходства. Согласно воплощению указанные проценты сходства могут быть процентами идентичности. В особом воплощении второй полипептид может содержать последовательность аминокислот, установленную в любом из SEQID NO: 5 или 6. Оксидоредуктаза, превращающая ГМФ-кислоту, с SEQ ID NO: 5 была ранее открыта Koopman et al.(2010 а) и Koopman et al. (2010b) и названа HmfH. Оксидоредуктаза, превращающая ГМФ-кислоту, с SEQ ID NO: 6 может быть выделена из Bradyrhizobium japonicum USDA 110 и соответствует транслируемому белковому продукту гена blr0367. В. japonicum USDA 110 содержит гомологи всех генов утилизации ГМФ/фурфураля из С. basilensis HMF14 в ее геноме (Koopman et al. 2010a). Транслируемый продукт гена blr0367 является белком В. japonicumUSDA 110, который показывает самую высокую гомологию с HmfH из С. basilensis HMF14. Имея в виду факт, что В. japonicum USDA 110, как было показано, использует ГМФ как единственный источник углерода (Koopman et al. 2010a), он должен иметь функциональный гомолог HmfH. Поэтому обоснованно ожидать, что сходная активность HmfH возрастает от blr0367. Хотя изобретение сопровождается примерами со ссылками на несколько оксидоредуктаз, превращающих ГМФ-кислоту, следует учитывать, что в изобретении явно допускается, что второй полипептид может являться другой оксидоредуктазой, превращающей ГМФ-кислоту, или даже другим полипептидом, превращающим ГМФ-кислоту, не имеющим оксидоредуктазной активности. Второй полипептид может быть кодирован второй полинуклеотидной последовательностью, имеющей по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%,более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью полинуклеотидов, установленной в SEQID NO: 11 или 12. Приемлемой альтернативной степенью сходства второго полинуклеотида с последовательностью, установленной в SEQ ID NO: 11 или 12 может быть по меньшей мере 66, 70, 75, 80, 85, 90,91, 92, 93, 94, 95, 96, 97, 98 или по меньшей мере 99% сходства. Согласно воплощению указанные проценты сходства могут быть процентами идентичности. В особом воплощении второй полипептид может быть кодирован полинуклеотидной последовательностью, установленной в любом из SEQ ID NO: 11 или 12. Выделение подходящего полинуклеотида, кодирующего второй полипептид, обладающий оксидоредуктазной активностью, раскрыто в Koopman et al. (2010a). Этот ген назван hmfH. В подходе к выделению второго полинуклеотида могут быть просмотрены генные библиотеки, чтобы выделить подходящие полинуклеотиды. Библиотеки могут быть сконструированы из микроорганизмов из надцарства Bacteria. Эти микроорганизмы могут принадлежать к типу Proteobacteria, более точно к классу Alphaproteobacteria, Betaproteobacteria или Gammaproteobacteria. Alphaproteobacteria могут принадлежать к порядку Rhizobiales, или к порядку Sphingomonadales. Rhizobiales могут принадлежать к семейству Methylobacteriaceae, например организм из рода Methylobacterium, такой как М. nodulans или М.radiotolerans, или организм из семейства Rhizobiaceae. Rhizobiaceae могут принадлежать к группе Rhizobium/Agrobacterium, более точно к роду Rhizobium, такие как R. leguminosarum или R. leguminosarum bv.trifolii. Они могут также принадлежать к роду Agrobacterium, такие как A. radiobacter. Rhizobiaceae могут также принадлежать к семейству Bradyrhizobiaceae, более точно к роду Bradyrhizobium, такие как В. japonicum. Sphingomonedales могут принадлежать к семейству Sphingomonadaceae, более точно к родуSphingomonas, такие как S. wittichii или S. chlorophenolicum. Betaproteobacteria могут принадлежать к порядку Methylophilales, или к порядку Burkholderiales. The Methylophilales могут принадлежать к семейству Methylophilaceae, например организм из рода Methylovorus. Burkholderiales могут принадлежать к семейству Burkholderiaceae, например организм из рода Cupriavidus, такой как Cupriavidus basilensis. Они могут также принадлежать к роду Burkholderia, такие как Burkholderia phytofirmans, В. phymatum, В.Yersinia, такая как Yersinia ruckeri. Кроме того, микроорганизмы могут принадлежать к типу Actinobacteria, классу Actinobacteria, подклассу Actinobacteridae, порядку Actinomycetales. Actinomycetales могут принадлежать к подпорядкам Streptomycineae, Pseudonocardineae или Micromonosporineae. Streptomycineae могут принадлежать к семейству Streptomycetaceae, более точно к роду Streptomyces, такие как S.Pseudonocardiaceae, более точно к роду Saccharopolyspora, такой как S. erythraea; или к семейству Actinosynnemataceae, более точно к роду Saccharothrix, такие как S. mutabilis или S. mutabilis subsp. capreolus,или к роду Actinosynnema, такая как A. mirum. Micromonosporineae могут принадлежать к семейству Micromonosporaceae, более точно к роду Micromonospora. Основываясь на последовательности аминокислот, предоставленной в SEQ ID NO: 5 или 6, и/или последовательности нуклеотидов, предоставленной в SEQ ID NO: 11 или 12, специалисты будут в состоянии сконструировать пригодные зонды и/или праймеры, чтобы выделить последовательность нуклеотидов, кодирующую второй полипептид. В качестве варианта, основываясь на последовательности аминокислот, предоставленной в SEQ IDNO: 5 или 6, и/или последовательности нуклеотидов, предоставленной в SEQ ID NO: 11 или 12, специалисты могут получить синтезированные последовательности, кодирующие второй полипептид, как уже показано в разделе, обсуждающем первый полипептид. Третий полинуклеотид и полипептид. В одном из вариантов воплощения генетически модифицированная клетка изобретения содержит третий полинуклеотид, кодирующий третий полипептид. Третий полипептид содержит последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью полинуклеотидов,установленной в SEQ ID NO: 19, 20, 21, 22, 23, 24 или 25. В качестве варианта сходство последовательностей может быть выражено по меньшей мере 45, 50,55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или по меньшей мере 99% сходства. Согласно воплощению указанные проценты сходства могут быть процентами идентичности. В особом воплощении третий полипептид может содержать последовательность аминокислот, установленную в любом из SEQID NO: 19, 20, 21, 22, 23, 24 или 25. Последовательность аминокислот с SEQ ID NO: 19 является предпочтительным выбором третьего полипептида. Эта последовательность аминокислот была недавно опубликована в международном патенте WO2011/026906 (SEQ ID NO: 15). Функциональная экспрессия такого полипептида, как третий, приводит к альдегиддегидрогензаной активности (Adh), способной превращать фурановые альдегиды, и предоставляет возможность дальнейшего улучшения в отношении биоконверсии ГМФ-кислоты и/или продуцирования ФДКК. Эффекты, связанные с экспрессией третьего полипептида, показаны на примерах для последовательности аминокислот SEQ ID NO: 19. На основе степени сходства/идентичности следует ожидать, что полипептиды с SEQ ID 20-25 и их аналоги/гомологи будут оказывать сходное действие. Третий полипептид может быть кодирован третьей последовательностью полинуклеотидов, имеющей по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%,более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью полинуклеотидов, установленной в SEQID NO: 26, 27, 28, 29, 30, 31 или 32. Предпочтительно третий полипептид кодируется последовательностью полинуклеотидов установленной в SEQ ID NO: 26 или гомологом, имеющим указанное сходство последовательностей с последовательностью полинуклеотидов, установленной в SEQ ID NO: 26. Последовательность полинуклеотидов SEQ ID NO: 26 была недавно опубликована в международном патентеWO2011/026906 (SEQ ID NO: 16). Приемлемой альтернативной степенью сходства третьего полинуклеотида с последовательностью, установленной в SEQ ID NO: 26, 27, 28, 29, 30, 31 или 32, может быть по меньшей мере 66, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или по меньшей мере 99% сходства. Согласно воплощению указанные проценты сходства могут быть процентами идентичности. В особом воплощении третий полипептид может быть кодирован полинуклеотидной последовательностью, установленной в SEQ ID NO: 26, 27, 28, 29, 30, 31 или 32. Выделение и дальнейшие манипуляции с третьим полипептидом и соответствующим третьим полинуклеотидом могут быть осуществлены в основном так, как это обсуждается выше и ниже для первого полипептида и соответствующего первого полинуклеотида. Векторы. Другой объект изобретения относится к векторам, включая клонирующий и экспрессирующий векторы, содержащие первый и второй полинуклеотиды или их функциональный эквивалент, и способам репликации, трансформации и трансфекции таких векторов в подходящей клетке-хозяине, например, в условиях, в которых происходит экспрессия полипептида изобретения. При использовании здесь термин"вектор" относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она соединена. Первый и второй полинуклеотиды и, при желании, третий полинуклеотид могут быть встроены в рекомбинантый реплицируемый вектор, например клонирующий вектор или экспрессирующий вектор. Вектор может быть использован для репликации нуклеиновой кислоты в совместимой клетке-хозяине. Таким образом, в следующем воплощении изобретение предоставляет способ изготовления полинуклеотидов изобретения путем введения полинуклеотида изобретения в реплицируемый вектор, введения вектора в совместимую клетку-хозяин и рост клетки-хозяина в условиях, которые способствуют репликации вектора. Вектор может быть выделен из клетки-хозяина. Подходящие клетки-хозяева описываются ниже. Вектором, в который вставляют экспрессионную кассету или полинуклеотид изобретения, может быть обычно подвергнут процедуре рекомбинации ДНК, и выбор вектора часто зависит от клеткихозяина, в которую он будет введен. Вектором изобретения может быть автономно реплицирующийся вектор, например вектор, который существует как внехромосомное образование, репликация которого не зависима от репликации хромосомы, например плазмида. Как вариант, вектор может быть одним из них, когда вводится в клеткухозяин, интегрируется в геном клетки-хозяина и реплицируется вместе с хромосомой (мами), в которую он встроен. Одним типом вектора является "плазмида", которая относится к кольцеобразной двунитевой петле ДНК, в которую может быть встроен дополнительный сегмент ДНК. Другим типом вектора является вирусный вектор, в котором дополнительный сегмент ДНК может быть встроен в вирусный геном. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальное происхождение репликации, и эписомальные векторы млекопитающих). Другие векторы, (например, неэписомальные векторы млекопитающих) при введении в клетку-хозяин интегрируются в геном клетки-хозяина и поэтому реплицируются вместе с геномом хозяина. Кроме того, определенные векторы способны к регулированию экспрессии генов, с которыми они функционально соединены. Такие векторы упоминаются здесь как "экспрессионные векторы". В основном, экспрессионные векторы, используемые в методиках рекомбинации ДНК, имеют форму плазмиды. Термины "плазмида" и "вектор" могут быть использованы здесь взаимозаменяемо, так как плазмида является наиболее часто используемой формой вектора. Однако изобретение предназначено для включения других форм экспрессионных векторов, таких как космиды, вирусные векторы (например, ретровирусы с дефективной репликацией, аденовирусы и аденоассоциированные вирусы), фаговые векторы и транспозоны и пласпозоны, которые выполняют эквивалентные функции. Специалисты будут в состоянии сконструировать векторы изобретения, основываясь на предоставленных последовательностях аминокилот и полинуклеотидов, своих знаниях в данной области и коммерчески доступных средствах. В предпочтительном варианте реализации первая и вторая последовательности полинуклеотидов размещены на одном векторе. Это вектор по желанию, кроме того, содержит третью последовательность полинуклеотидов. Как поймут специалисты, использование одного вектора, содержащего первую и вторую последовательности полинуклеотидов, существенно упрощает конструирование генетически модифицированных клеток, функционально экспрессирующих первый и второй полипептиды (при желании вмете с третьим полипептидом). Однако, как также поймут специалисты, генетически модифицированные клетки могут быть получены по различным другим схемам трансформации, вовлекающим альтернативные векторы. В этом отношении следует заметить, что в определенных воплощениях функциональное введение второй последовательности полинуклеотидов не требуется. Также в некоторых других альтернативных воплощениях функциональное введение третьей последовательности полинуклеотидов не требуется. Клетка-хозяин. Генетически модифицированная клетка изобретения может быть сконструирована из любой подходящей клетки-хозяина. Клетка-хозяин может быть немодифицированной клеткой или может быть уже генетически модифицированной. Клетка может быть прокариотической клеткой, эукариотической клеткой, растительной клеткой или животной клеткой. В такой клетке один или более генов может быть удален, выключен или разрушен полностью или частично, где один или несколько из этих генов необязательно кодируют протеазу. В одном варианте воплощения клетка-хозяин изобретения является эукариотической клеткой-хозяином. Предпочтительно эукариотическая клетка является клеткой млекопитающего, насекомого, растения, гриба или водоросли, Предпочтительные клетки млекопитающих включают,например, клетки культуры линий яичников китайского хомячка (СНО), клетки линий COS, 293, PerC6 или гибридом. Предпочтительные клетки насекомых включают, например, клетки линий Sf9 и Sf21 или производных от них. Наиболее предпочтительно эукариотической клеткой является грибная клетка, например дрожжевая клетка, штаммов таких видов, как Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia. Наиболее предпочтительно эукариотической клеткой является клетка Kluyveromyces lactis, Saccharomyces cerevisiae, Hansenula polymorpha, Yarrowia lipolytica,Pichia stipitis и Pichia pastoris или клетка гифомицетов. В некоторых воплощениях эукариотической клеткой является клетка мицелиальных грибов."Мицелиальные грибы" включают все нитеобразные формы подотдела Eumycota и Oomycota (как определено Hawksworth et ah, (1995. Мицелиальные грибы характеризуются стенкой мицелия, состоящей из хитина, селлюлозы, глюкана, хитозана, маннана и других комплексных полисахаридов. Вегетативный рост выражается в удлинении гифов, и углеводный обмен строго аэробный. Штаммы гифомицетов включают, но не исчерпываются этим, штаммы Acremonium, Agaricus, Aspergillus, Aureobasidium,Chrysosporium, Coprinus, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Piromyces, Phanerochaete, Pleurotus,Schizophyllum, Talaromyces, Thermoascus, Thielavia, Tolypocladium и Trichoderma. Предпочтительная клетка гифомицета принадлежит к видам родов Aspergillus, Chrysosporium, Penicillium, Talaromyces, или Trichoderma и наиболее подходящие виды отобраны из Aspergillus niger, Aspergillus awamori, Aspergillus foetidus, Aspergillus sojae, Aspergillus fumigatus, Talaromyces emersonii, Aspergillus oryzae, Chrysosporium lucknowense, Trichoderma reesei или Penicillium chrysogenum. В другом варианте воплощения клетка-хозяин изобретения является прокариотической клеткой. Предпочтительно прокариотической клеткой-хозяином является бактериальная клетка. Термин "бактериальная клетка" включает как грам-положительные, так и грам-отрицательные микроорганизмы. Подходящие бактерии могут быть отобраны, например, из родов Escherichia, Anabaena, Caulobacter, Gluconobacter, Rhodobacter, Pseudomonas, Paracoccus, Bacillus, Brevibacterium, Corynebacterium, Rhizobium (Sinorhizobium), Bradyrhizobium, Flavobacterium, Klebsiella, Enterobacter, Lactobacillus, Lactococcus, Methylobacterium, Staphylococcus, Streptomyces, Zymomonas, Acetobacter, Streptococcus, Bacteroides, Selenomonas,Megasphaera, Burkholderia, Cupriavidus, Ralstonia, Methylobacterium, Methylovorus, Rhodopseudomonas,Acidiphilium, Dinoroseobacter, Agrobacterium, Sulfolobus или Sphingomonas. Предпочтительно бактериальную клетку отбирают из группы, состоящей из Bacillus subtilis, Bacillus amyloliquefaciens, Bacillus licheniformis, Bacillus puntis, Bacillus megaterium, Bacillus halodurans, Bacillus pumilus, Gluconobacter oxydans, Caulobacter crescentus, Methylobacterium extorquens, Methylobacterium radiotolerans, Methylobacteriumleguminosarum, Rhizobium leguminosarum bv. trifolii, Agrobacterium radiobacter, Cupriavidus basilensis, Cupriavidus necator (Ralstonia eutropha), Ralstonia pickettii, Burkholderia phytofirmans, Burkholderia phymatum,Burkholderia xenovorans, Burkholderia graminis, Rhodopseudomonas palustris, Acidiphilium cryptum, Dinoroseobacter shibae, Sulfolobus acidocaldarius, Sulfolobus islandicus, Sulfolobus solfataricus, Sulfolobus tokodaii. Весьма предпочтительной клеткой-хозяином является Pseudomonas putida S12. У этого штамма функциональная экспрессия гена hmfH из Cupriavidus basilensis HMF14 обладает доказанной эффективностью в отношении введения способности к окислению ГМФ, приводящей к получению ФДКК из этого субстрата. Для специфического использования клетки изобретения выбор клетки-хозина может быть сделан сообразно такому использованию. Особенно предпочтительными являются такие хозяева, которые пригодны для конверсии лигноцеллюлозного сырья и которые устойчивы к условиям, оптимальным для продуцирования фурановых соединений, таких как ФДКК. Специалисты будут располагать доступными подходящими средствами и способами для функционального ведения первого и, при желании, второго полинуклеотида в любую из упомянутых клеток-хозяев. Биотрансформация ГМФ-кислоты. Генетически сконструированая клетка изобретения обладает улучшенной биотрансформацией ГМФ-кислоты. Улучшенная биоконверсия ГМФ-кислоты благоприятна для удаления ГМФ-кислоты и ее фурановых предшественников из сырья, в котором фурановые соединения рассматриваются как нежелательные, такого как сырье для спиртового брожения для получения биотоплива и биохимикатов. В других приложениях улучшенная биоконверсия ГМФ-кислоты будет улучшать биопроизводство химикатов,в которых ГМФ-кислота является исходным материалом или промежуточным продуктом, таких как биопроизводство ФДКК. Если фермент, превращающий ГМФ-кислоту, является оксидоредуктазой, превращающей ГМФкислоту, клетка изобретения будет в состоянии осуществить реакцию биологического окисления. Реакцией окисления здесь является одна или более реакция между окислителем и ГМФ-кислотой в присутствии оксидоредуктазы. Предпочтительной реакцией окисления является продуцирование ФДКК, в котором ГМФ-кислота превращается в ФДКК путем реакции с окисдантом в присутствии оксидоредуктазы, превращающей ГМФ-кислоту. Процессы биоконверсии фурановых соединений в ФДКК, в которых ГМФ-кислота является промежуточным продуктом, были открыты в предыдущих работах, например использование ГМФ как исходного материала (см. Koopman et al. 2010a и Koopman et al. 2010b). Такая биоконверсия может быть улучшена, если она осуществляется клеткой изобретения. ГМФ-кислота может генерироваться in situ из одного или более фурановых предшественников клеткой изобретения или любой другой имеющейся клеткой. Под генерацией in situ понимается, что ГМФ-кислоту не добавляют в систему извне. Вместо этого ГМФ-кислота генерируется внутри системы посредством одного или нескольких процессов биоконверсии, которые превращают фурановые предшественники в ГМФ-кислоту. Фурановые предшественники ГМФ-кислоты могут быть выбраны из группы, состоящей из 5(гидроксиметил)фуран-2-карбальдегида (ГМФ), фуран-2,5-дикарбальдегида (ДКФ) и [5-(гидроксиметил)фуран-2-ил]метанола (ГМФ-спирт) и предпочтительно фурановым предшественником является ГМФ. ГМФ может быть получена из одного или более сахаров-гексоз реакцией дегидрирования, катализируемой кислотой, как известно в данной области. Сахара-гексозы могут быть получены из биомассы,предпочтительно из лигноцеллюлозной биомассы. Реакция окисления может содержать несколько последовательных этапов реакции окисления в продукт, например окисление ГМФ-кислоты до ФФК и далее окисление ФФК до ФДКК. Примеры реакций окисления приведены на фиг. 1. Реакции окисления предпочтительно проводят при относительно умеренной температуре, т.е. 1080 С, более предпочтительно 20-45 С, наиболее предпочтительно около 25-40 С. Предпочтительно проводить реакцию при таком рН, когда ФДКК находится или в нейтральной форме или в полностью диссоциированной форме, так, чтобы образование соли можно было контролировать. Учитывая присутствие двух кислотных мотивов в ФДКК, имеется два отдельных предпочтительных интервала рН. Во время реакции рН может быть от 1 до 6, предпочтительно от 1 до 4, наиболее предпочтительно от 1 до 3. В качестве варианта рН во время реакции может быть от 5 до 9, предпочтительно от 5 до 8, наиболее предпочтительно от 5 до 7. Специалисты поймут, что потребности клетки-хозяина будут также влиять на выбор приемлемого значения рН процесса. Выбор значения рН, которое подходит для различных клетокхозяев, которые пригодны в пределах настоящего изобретения, находятся в сфере знаний специалистов и могут быть почерпнуты из любого стандартного учебника. Для Pseudomonas putida, включая Pseudomonas putida S12, предпочтительный интервал значений рН составляет от 5 до 7. Продолжительность реакции может составлять 6-150 ч, с добавлением кислорода из источника ки- 11023764 слорода, такого как молекулярный кислород, или вода, или различные источники кислорода, зависящие от свойств окисляющего фуран фермента. Обычно как источник молекулярного кислорода может быть использован воздух. Реактором может служить любой пригодный (аэрируемый) биореактор. Это может быть реактор периодического, непрерывного или смешанного принципа действия. После биотрансформации клетки могут быть отделены от бульона установленными методами и использованы повторно. Продукты окисления, такие как ФДКК, ГМФ-кислота и т.д., могут быть извлечены из реакционной смеси (кислым) осаждением и последующей кристаллизацией охлаждением, и отделением кристализованного продукта окисления, например кристализованной ФДКК. Однако подходят и другие способы извлечения, не ограниченные кислым осаждением и экстракцией растворителями, как известно в данной области. Для многих приложений, таких как удаление ГМФ-кислоты из лигноцеллюлозного сырья, точный способ ГМФ-конверсии не существенен. Важным является то, что ГМФ-кислота эффективно превращается для удаления ее как таковой или для предотвращения ее накопления, если она образуется из фурановых предшественников. Для таких приложений полипептид, превращающий ГМФ-кислоту, может быть любым полипептидом, обладающим активностью, превращающей ГМФ-кислоту, известным в настоящее время или еще подлежащим открытию. Еще один объект изобретения нацелен на использование генетически модифицированной клетки изобретения для биотрансформации фурановых предшественников в ФДКК. Фурановые предшественники могут, в частности, быть отобраны из 5-(гидроксиметил)фуран-2-карбальдегида (ГМФ), [5(гидроксиметил)фуран-2-ил]метанола(ДКФ),5(гидроксиметил)фуран-2-карбоновой кислоты (ГМФ-кислота) или 5-формилфуран-2-карбоновой кислоты (ФФК). Предпочтительно ГМФ является выбранным фурановым предшественником. ГМФ-кислота может быть промежуточным продуктом биоконверсии ГМФ в ФДКК. Далее изобретение будет проиллюстрировано со ссылками на следующие примеры. Примеры Общая методология. Штамы и плазмиды Pseudomonas putida S12 (АТСС 700801) были использованы как хозяева для экспрессии генов из Cupriavidus basilensis HMF14 (Wierckx et al., 2010; Koopman et al. 2010a) и Methylobacterium radiotolerans JCM 2831 (= ATCC 27329 = DSM 1819; последовательность генома доступна наhttp://genome.jgi-psf.org/metra/metra.home.html). Штаммы Escherichia coli DH5 или ТОР 10 (Invitrogen) были использованы в целях общего клонирования. Для эписомальной экспрессии генов С. basilensis или М. radiotolerans были использованы либо производные от pUCP22 pJT'mcs (Koopman et al., 2010a), либо pJNNmcs(t) (Wierckx et al., 2008), либо производные от pBBR1MCS pBT'mcs (Koopman et al., 2010a). В pJT'mcs и pBT'mcs экспрессия целевого гена управлялась конститутивным tac-промотором. В pJNNmcs(t) экспрессия управлялась салицилатиндуцируемой экспрессионной кассетой NagR/PnagAa. Условия культивирования. Минеральная солевая среда (МСС) была использована как определенная среда. МСС содержала следующее (на 1 л деминерализованной воды): 3,88 г K2HPO4, 1,63 г NaH2PO4, 2,0 г (NH4)2SO4, 0,1 гMgCl26H2O, 10 мг EDTA, 2 мг ZnSO47H20,1 мг СаС 122H2O, 5 мг FeSO47H2O, 0,2 мг Na2MoO42H2O, 0,2 мг CuSO45H2O,0,4 мг CoCl26H2O и 1 мг MnCl2 Н 2 О, и была обогащена источником углерода, как указано. Бульон Луриа (L-бульон: 10 г/л бактотриптона (Difco), 5 г/л экстракта дрожжей (Difco), 5 г/л NaCl) был использован как полная среда для размножения P. putida S12 и производных штаммов, С. basilensis,M. radiotolerans и Е. coli DH5 и производных. Для культивирования в чашках L-бульон отверждали 1,5%-ным (мас./об.) агаром (Difco). Ампициллин (Amp) добавляли в среду до 100 мкг/мл для отбора трансформантов Е. coli, несущих плазмиды pJT'mcs или производные от pJNNmcs(t). Гентамицин (Gm) добавляли до 30 мкг/мл в бульон Луриа и 10 мкг/мл в минеральную солевую среду для отбора трансформантов P. putida S12 несущих плазмиды pJT'mcs или производные от pJNNmcs(t). Для отбора трансформантов либо Е. coli, либо P. putida SI2, несущих плазмиды, производные от pBT'mcs, в среду добавляли 50 мкг/мл канамицина (Km). Антибиотики покупали у Sigma-Aldrich. P. putida, С. basilensis и М. radiotolerans культивировали при 30 С; Е. coli культивировали при 37 С. Эксперименты с периодическим добавлением субстрата на штамме, производном от P. putida S12,осуществляли в 2-литровых сосудах, контролируемых либо биореакторной системой Labfors 4 (InforsBenelux BV), либо контроллером BioFlo110 (New Brunswick Scientific). Сжатый воздух или чистый кислород подавали либо в пространство под крышкой, либо орошали бульон. Поддерживалась температура 30 С и рН 7,0 посредством автоматического добавления NH4OH, NaOH или KOH. Периодическую фазу проводили в двойной МСС, дополненной штамм-специфичными антибиотиками и 40 г/л глицерина. Для культур с повышенной плотностью клеток среду для периодической фазы, кроме того, дополняли 10 г/л дрожжевого экстракта (YE). После израсходования начального глицерина начинали подавать сырье (4 или 8 М глицерина в 100 мМ MgCl2, дополненное, если требуется 1 мМ салицилата Na) и контролирова- 12023764 ли, чтобы обеспечить рост во время поддержания глицерина как лимитирующего субстрата в культуре. ГМФ (4 М в деминерализованной воде) подавали через отдельный подающий насос; скорость подачи регулировали в зависимости от задействованного штамма и изученных условий. Давление растворенного кислорода (DO) постоянно отслеживали и регулировали скорость перемешивания, чтобы поддерживать достаточную аэрацию. Измерения и аналитические методы. Измерение сухой массы клеток ("СМК: содержание СМК бактериальных культур определяли, измеряя оптическую плотность при 600 нм (OD600), используя измеритель плотности клеток Biowave (WPALtd) или универсальный микропланшетный спектрофотометр Quant MQX200 (Biotek), использующий плоскодонные 96-луночные микропланшеты (Greiner). Значение 1,0 при OD600 соответствует 0,56 г СМК/л (Biowave) или 1,4 г СМК/л (Quant) для P. putida. ВЭЖХ. Фурановые соединения (ФДКК, ГМФ, ГМФ-спирт, ГМФ-кислота и ФФК) анализировали ОФВЭЖХ, как описано Koopman et al. (2010a). Сахара, спирты и органические кислоты также анализиорвали ВЭЖХ (Agilent 1100 system), используя рефрактометрический (RI) детектор. Использовали колонкуBio-Rad Aminex HPX-87H (3007,8 мм, водородная форма, размер частиц 9 мкм, 8% поперечных связей,рН в интервале 1-3) с 5 мМ H2SO4 как элюент при скорости потока 0,6 мл/мин. Реактивы. ГМФ покупали или у Sigma, Eurolabs Ltd. (Poynton, Великобритания) или у Yore Chemipharm Co.Ltd. (Ningbo, Китай). Аналитические стандарты ФДКК и 5-гидроксиметилфурановой кислоты (ГМФкислоты) покупали у Immunosource B.V. (Halle-Zoersel, Бельгия), соответственно Matrix Scientific (Columbia SC, США). Все другие реактивы покупали у Sigma-Aldrich Chemie B.V. (Zwijndrecht, Нидерланды). Молекулярно-генетические методики. Геномную ДНК выделяли из С. basilensis HMF14 и М. radiotolerans JCM 2831, используя наборDNeasy tissue kit (QIAGEN). Плазмидную ДНК выделяли набором QIAprep spin miniprep kit (QIAGEN). Заключенные в агарозу фрагменты ДНК выделяли набором для гелевой экстракции QIAEXII gel extraction kit (QIAGEN). ПЦР проводили с полимеразой Accuprime Pfx (Invitrogen) согласно инструкциям производителя. Олигонуклеотидные праймеры (указанные в примерах) синтезировали с помощью MWG Biotech AG(Germany). Плазмидную ДНК вводили в электрокомпетентные клетки, используя прибор для электропорации Gene Pulser (BioRad). Другие стандартные молекулярно-генетические методики осуществляли поSambrook и Russell (2001). Пример 1. Одновременная экспрессия HmfH и HmfT1 улучшает продуцирование ФДКК в P. putidaS12. Ген hmjT1 (ранее названный mfs1 (Koopman et al., 2010a); SEQ ID NO: 7) амплифицировали из геномной ДНК Cupriavidus basilensis HMFH путем ПЦР, используя праймеры hmfT1(f) (SEQ ID NO: 13) иhmfT1(r) (SEQ ID NO: 14). Продукт ПЦР вводили как фрагмент 1359-bp EcoRI-NheI в pJNNmcs(t), получая pJNNhmfT1(t). Ген hmfH (SEQ ID NO: 11), включающий свой нативный сайт связывания рибосомы(RBS), амплифицировали ПЦР из геномной ДНК С. basilensis HMF14, используя праймеры FN23 (SEQID NO: 15) и FN24 (SEQ ID NO: 16). Продукт ПЦР клонировали как фрагмент 1777-bp EcoRI в pBT'mcs,получая плазмиду pBT'hmfH. Плазмиды pBT'hmfH и pJNNhmfTl(t) были успешно введены в P. putidaP. putida S12B38 культивировали с подпиткой, как описано в разделе общей методологии. В периодическую фазу плотность клеток, составляющая приблизительно 3 г СМК/л, была достигнута после того, как началась подача глицерина и ГМФ. В контролируемом периодическом режиме культивировали штамм P. putida S122642 (подобный P. putida S12hmfH (Koopman et al., 2010b, который не экспрессирует HmfT1. На фиг. 2 показаны концентрации ФДКК и ГМФ-кислоты в подпитываемой ГМФ культуре P.S122642. Напротив, накопление ГМФ-кислоты в культуре Р. putida S12B38 пренебрежимо мало. Кроме того, пониженное накопление ГМФ-кислоты позволяло поддерживать высокую скорость подачи ГМФ,что привело к более высокому титру ФДКК за значительно более короткое время процесса. Это также ясно отражалось в удельном выходе ФДКК для тестируемых штаммов (фиг. 3). Пример 2. Одновременная экспрессия HmfH и полипептида Methylobacterium radiotolerans JCM 2831 улучшает продуцирование ФДКК в P. putida S12 Ген с идентификатором mrad28314728 (SEQ ID: 9) амплифицировали из геномной ДНК Methylobacterium radiotolerans JCM2831 с помощью ПНР, используя праймеры Mrad(f) (SEQ ID NO: 17) и Mrad(r)(SEQ ID NO: 18). Продукт ПЦР вводили как фрагмент 1381-bp EcoRI-NheI в pJNNmcs(t), получаяpJNNMrad(t). Плазмиды pBT'hmfH (см. пример 1) и pJNNMrad(t) были успешно введены в P. putidaP. putidaB5l культивировали на качалке на минеральной солевой среде (4-кратная буферная сила),дополненной 1 г/л дрожжевого экстракта, 80 мМ глицерина, 2 мМ глюкозы, 100 мкМ салицилата Na, 50 мкг/мл канамицина и 10 мкг/мл гентамицина. В качестве контрольного использовали штамм P. putidaS12B38 (см. пример 1). После культивирования в течение ночи в культуру добавляли 80 мМ глицерина и 100 мкМ салицилата Na. Позднее добавляли приблизительно 10 мМ ГМФ и оценивали продуцирование ФДКК. На фиг. 4 показано, что накопление ГМФ-кислоты во время продуцирования ФДКК пренебрежимо мало для обоих штаммов, подтверждая, что полипептиды HmfT1 и the Mrad28314728 проявляют схожую функциональность. Для P. putida S12B38 продуцирование ФДКК показывало длинную лаг-фазу и до некоторой степени низкую интенсивность, которая могла бы быть отнесена на счет более низкой начальной плотности биомассы (фиг. 4 А). Удельный максимум продуцирования ФДКК, однако, был одинаков для обоих штаммов, т.е. 2,36 ммоль ФДКК/(г СМК.ч), показывая, что полипептиды Mrad28314728 и HmfT1 равно эффективны в минимизации накопления ГМФ-кислоты и максимизации продуцирования ФДКК. Пример 3. Высокая способность к превращению ГМФ-кислоты штамма P. putida S12, одновременно экспрессирующего HmfH и HmfT1. Как продемонстрировано в примере 1, одновременная экспрессия HmfH и HmfT1 в P. putida S12 значительно улучшала удельную производительность окисления ГМФ до ФДКК. Чтобы оптимизировать эту улучшенную способность, осуществили эксперимент с периодическим культивированием P. putidaS12B38, начав при высокой плотности биомассы. Подачу ГМФ начали с высокой скорости (20 мл/ч; 4 М раствор ГМФ), чтобы насытить окислительную способность P. putida S12B38 и спровоцировать накопление ГМФ-кислоты (фиг. 5). Когда концентрация ГМФ-кислоты возросла примерно до 20 мМ, скорость подачи ГМФ снизили до 5 мл/ч и стали отслеживать концентрацию фурановых соединений. Сначала концентрация ГМФ-кислоты повышалась приблизительно до 37 мМ вследствие окисления остаточного накопленного ГМФ, после чего она падала до менее 2 мМ за 5 ч при скорости подачи ГМФ 0,72 ммоль/(г СМКч). Данные результаты ясно демонстрируют, что окислительная способность ГМФ-кислоты улучшается одновременной экспрессией HmfH и HmfT1. Результаты Koopman et al. (2010b) показывают, что Р.putida S12hmfH (у которого отсутствует HmfT1) требуется свыше 50 ч, чтобы уменьшить концентрацию ГМФ-кислоты приблизительно с 50 мМ до менее 5 мМ, при гораздо более низкой скорости подачи ГМФ(0,09 ммоль/(г СМКч. Улучшенная окислительная способность ГМФ-кислоты приводила к гораздо более высокому конечному титру ФДКК (152 г/л против 30,1 г/л у Koopman et al. (2010b, который, кроме того, был достигнут за более короткое время процесса (94 ч против 115 ч у Koopman et al. (2010b. Пример 4. Одновременная экспрессия HmfH, HmfT1 и альдегиддегидрогеназы из С. basilensis HMF 14 улучшает ФДКК продуцирование в P. putida S12. Ген, кодирующий альдегиддегидрогеназу (SEQ ID 26; транслируемая последовательность аминокислот: SEQ ID 19), связанный с опероном разложения ГМФ в Cupriavidus basilensis HMF14 (Wierckx etal., 2011), амплифицировали ПЦР, используя праймеры FN13 (SEQ ID 33) и FN14 (SEQ ID 34). Продукт ПЦР вводили как фрагмент 1543-по NotI в усваиваемый Bsp120I (совместимый с NotI) pBT'hmfH (см. пример 1), получая pBT'hmfH-adh. Варианты плазмиды, в которых ген, кодирующий альдегиддегидрогеназу, был представлен в передней (f) ориентации (pBT'hmfH-adh(f и pJNNhmfT1(t) (см. пример 1), были успешно введены в P. putida S12. Результирующий штамм, P. putida S12B97, одновременно экспрессировал HmfH, HmfT1 и альдегидцегидрогеназу. В качестве контрольного штамма для одновременной эксперссии HmfH оксидоредуктазы и альдегиддегидрогеназы (т.е. без транспортного белка ГМФ-кислотыHmfT1) конструировали P. putida S12B101, который содержал только pBT'hmfH-adh(f). P. putidaS12B38 (см. пример 1) использовали как контрольный штамм для одновременной экспрессии HmfT1 иHmfH без альдегиддегидрогеназы. Штаммы P. putida S12B38, S12B97 и S12JB101 культивировали на качалке на минеральной солевой среде (4-кратная буферная сила), дополненной 1 г/л дрожжевого экстракта, 80 мМ глицерина, 2 мМ глюкозы, 50 мкг/мл канамицина и 10 мкг/мл гентамицина (примечание: для штамма В 101 добавляли только канамицин). Салицилат Na (1 мкМ) добавляли для индукции hmjT1 только на этапе предварительного кульивирования. После добавления приблизительно 10 мМ ГМФ оценивали накопление ФДКК и ГМФ-кислоты. В штамме, который одновременно экспрессирует HmfH (оксидоредуктазу) и HmfT1 (белок, транспортирующий ГМФ-кислоту) (штамм S12B38; фиг. 6 А), продуцирование ФДКК начинается только после того, как ФФК накопится в значительном количестве. ГМФ-кислота временно накапливается в небольшом количестве, как наблюдали заранее (см. пример 2). Когда альдегиддегидрогеназа экспрессировалась одновременно с HmfH и HmfT1 (штамм S12B97; фиг. 6 В), образование ФДКК начиналось без задержки, и как ФФК, так и ГМФ-кислота наблюдались только в следовых количествах. Одновременная экспрессия альдегиддегидрогеназы и HmfH без HmfT1 (штамм S12B101; фиг. 6 С) приводила к экстенсивному накоплению ГМФ-кислоты, в то время как ФФК и ФДКК продуцировались лишь в малых коли- 14023764 чествах. Результаты продемонстрировали, что окисление ГМФ до ГМФ-кислоты значительно усиливается экспрессией альдегиддегидрогеназы. Однако HmfT1 должен быть экспрессирован одновременно, чтобы дать возможность эффективной биотрансформации продуцируемой ГМФ-кислоты. Кроме того, альдегиддегидрогеназа улучшила окисление промежуточного продукта ФФК до ФДКК. Таким образом, одновременная экспрессия альдегиддегидрогеназы и HmfT1 значительно улучшает общий потенциал и скорость окисления ГМФ через ГМФ-кислоту до конечного продукта. Ссылки.(i) первую последовательность нуклеотидов, кодирующую первый полипептид, содержащий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%,такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 1, 2, 3 или 4; и(ii) вторую последовательность нуклеотидов, кодирующую второй полипептид, обладающий активностью по превращению 5-(гидроксиметил)фуран-2-карбоновой кислоты (ГМФ-кислоты),отличающаяся тем, что упомянутая клетка является генетически модифицированной путем функционального введения, по меньшей мере, первой последовательности нуклеотидов и предпочтительно путем функционального введения как первой, так и второй последовательностей нуклеотидов. 2. Генетически модифицированная клетка по п.1, в которой вторым полипептидом является оксидоредуктаза 5-(гидроксиметил)фуран-2-карбоновой кислоты, предпочтительно полипептид, имеющий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%,наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 5 или 6. 3. Генетически модифицированная клетка по любому из пп.1, 2, в которой первая последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%,предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 7, 8, 9 или 10. 4. Генетически модифицированная клетка по любому из пп.1-3, в которой вторая последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%,предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 11 или 12. 5. Генетически модифицированная клетка по любому из пп.1-4, содержащая третью последовательность полинуклеотидов, кодирующую третий полипептид, содержащий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующейSEQ ID NO: 19, 20, 21, 22, 23, 24 или 25. 6. Генетически модифицированная клетка по любому из пп.1-5, в которой третья последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%,предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 26, 27, 28, 29, 30, 31 или 32. 7. Генетически модифицированная клетка по любому из пп.1-6, в которой клеткой является прокариотическая клетка, такая как бактериальная клетка или эукариотическая клетка, такая как дрожжевая клетка, грибная клетка, растительная клетка или животная клетка. 8. Генетически модифицированная клетка по любому из пп.1-7, в которой клеткой является прокариотическая клетка, предпочтительно бактериальная клетка, отобранная из родов Escherichia, Anabaena,Caulobacter, Gluconobacter, Rhodobacter, Pseudomonas, Paracoccus, Bacillus, Brevibacterium, Corynebacterium, Rhizobium (Sinorhizobium), Bradyrhizobium, Flavobacterium, Klebsiella, Enterobacter, Lactobacillus,Lactococcus, Methylobacterium, Staphylococcus, Streptomyces, Zymomonas, Acetobacter, Streptococcus, Bacteroides, Selenomonas, Megasphaera, Burkholderia, Cupriavidus, Ralstonia, Methylobacterium, Methylovorus,Rhodopseudomonas, Acidiphilium, Dinoroseobacter, Agrobacterium, Sulfolobus или Sphingomonas, более предпочтительно отобранная из группы, состоящей из Bacillus subtilis, Bacillus amyloliquefaciens, Bacillusdaii. 9. Генетически модифицированная клетка по любому из пп.1-8, в которой клеткой является эукариотическая клетка-хозяин, например клетка млекопитающего, насекомого, растения, гриба или водоросли, такая как клетка млекопитающего, отобранная из клеточных линий яичников китайского хомячка(СНО), COS, 293, PerC6 или гибридом, клетка насекомого, отобранная из клеток Sf9 или Sf21 или производных от них, предпочтительно эукариотическая клетка, отобранная из грибных или дрожжевых клеток таких видов, как Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia, с большим предпочтением эукариотических клеток, отобранных из Kluyveromyces lactis, Saccharomyces cerevisiae, Hansenula polymorpha, Yarrowia lipolytica, Pichia stipitis или Pichia pastoris, или клеток мицелиальных грибов, отобранных из подотдела Eumycota и Oomycota или в качестве варианта видов из родов Acremonium, Agaricus, Aspergillus, Aureobasidium, Chrysosporium, Coprinus, Cryptococcus,Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora,Paecilomyces, Penicillium, Piromyces, Phanerochaete, Pleurotus, Schizophyllum, Talaromyces, Thermoascus,Thielavia, Tolypocladium или Trichoderma, таких как Aspergillus niger, Aspergillus awamori, Aspergilluslucknowense, Trichoderma reesei или Penicillium chrysogenum. 10. Генетически модифицированная клетка по любому из пп.1-9, в которой первая и вторая последовательности нуклеотидов расположены в одном векторе, необязательно, вектор, кроме того, содержит третью последовательность нуклеотидов. 11. Вектор, содержащий:(i) первую последовательность нуклеотидов, кодирующую первый полипептид, содержащий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%,такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 1, 2, 3 или 4; и(ii) вторую последовательность нуклеотидов, кодирующую второй полипептид, обладающий активностью по превращению 5-(гидроксиметил)фуран-2-карбоновой кислоты (ГМФ-кислоты). 12. Вектор по п.11, в котором вторым полипептидом является оксидоредуктаза 5(гидроксиметил)фуранкарбоновой кислоты, предпочтительно полипептид, имеющий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 5 или 6. 13. Вектор по любому из пп.11, 12, в котором первая последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 7, 8, 9 или 10. 14. Вектор по любому из пп.11-13, в котором вторая последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 11 или 12. 15. Вектор по любому из пп.11-14, содержащий третью последовательность полинуклеотидов, кодирующую третий полипептид, содержащий последовательность аминокислот, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью аминокислот, соответствующей SEQ ID NO: 19, 20, 21, 22,23, 24 или 25. 16. Вектор по любому из пп.11-15, в котором третья последовательность полинуклеотидов содержит последовательность нуклеотидов, имеющую по меньшей мере 45%, предпочтительно по меньшей мере 60%, такую как по меньшей мере 70%, более предпочтительно по меньшей мере 80%, такую как 90%, наиболее предпочтительно по меньшей мере 95% сходства последовательности с последовательностью нуклеотидов, соответствующей SEQ ID NO: 26, 27, 28, 29, 30, 31 или 32. 17. Способ превращения 5-(гидроксиметил)фуран-2-карбоновой кислоты (ГМФ-кислоты), включающий инкубацию клетки по любому из пп.1-10 в присутствии ГМФ-кислоты в условиях, подходящих для превращения ГМФ-кислоты упомянутой клеткой. 18. Способ по п.17, в котором ГМФ-кислоты образуется in situ из одного или более фурановых предшественников ГМФ-кислоты в условиях, подходящих для превращения упомянутой клеткой одного или более предшественников ГМФ-кислоты. 19. Способ по любому из пп.17, 18, в котором второй полипептид клетки является оксидоредуктазой ГМФ-кислоты и, кроме того, содержащий размещение клетки в условиях, подходящих для превра- 17023764 щения ГМФ-кислоты в ФДКК. 20. Способ по любому из пп.17-19, в котором фурановый предшественник выбирают из группы, содержащей 5-(гидроксиметил)фуран-2-карбальдегид (ГМФ), фуран-2,5-дикарбальдегид (ДКФ), [5(гидроксиметил)фуран-2-ил]метанол (спирт ГМФ), и предпочтительным является ГМФ. 21. Способ по любому из пп.17-20, в котором фурановый предшественник получают из одного или более сахара-гексозы, предпочтительно один или более сахар-гексозу получают из биомассы лигноцеллюлозы, например, катализируемой кислотой реакцией дегидрирования. 22. Способ по любому из пп.17-21, в котором ФДКК извлекается из реакционной смеси способом,содержащим кислотное осаждение, с последующей холодной кристаллизацией или, как вариант, с последующей экстракцией растворителем. 23. Применение генетически модифицированной клетки по любому из пп.1-10 для биотрансформации нескольких фурановых предшественников в ФДКК. 24. Применение по п.23, в котором число фурановых предшественников выбирают из группы, содержащей 5-(гидроксиметил)фуран-2-карбальдегид (ГМФ), [5-(гидроксиметил)фуран-2-ил]метанол
МПК / Метки
МПК: C12N 1/21, C12P 17/04, C12N 5/10, C12N 9/02, C12N 9/00, C12N 1/15
Метки: способ, модифицированная, клетки, клетка, упомянутой, использования, генетически
Код ссылки
<a href="https://eas.patents.su/30-23764-geneticheski-modificirovannaya-kletka-i-sposob-ispolzovaniya-upomyanutojj-kletki.html" rel="bookmark" title="База патентов Евразийского Союза">Генетически модифицированная клетка и способ использования упомянутой клетки</a>
Предыдущий патент: Производные пиримидина и их применение в качестве пестицидов
Следующий патент: Гербицидные соединения
Случайный патент: Регулирование отношения этилена к пропилену, получаемых в процессе превращения кислородсодержащего вещества в олефины