Ацилированные аналоги глюкагона
Номер патента: 22816
Опубликовано: 31.03.2016
Авторы: Даугаард Йенс Росенгрен, Толборг Якоб Линд, Рибер Дитте, Бэк Камилла Эртеберг, Кампен Гита, Мейер Эдди, Сковгаард Мари
Формула / Реферат
1. Соединение, имеющее формулу
где R1 представляет собой Н, С1-4 алкил, ацетил, формил, бензоил или трифторацетил;
R2 представляет собой ОН или NH2;
Z представляет собой пептид согласно формуле I
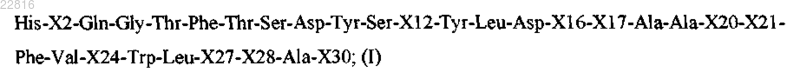
где
Х2 выбран из Aib и Ser;
X12 выбран из Lys, Arg или Leu;
X16 выбран из Arg и X;
X17 выбран из Arg и X;
Х20 выбран из Arg, His и X;
Х21 выбран из Asp и Glu;
Х24 выбран из Ala и X;
Х27 выбран из Leu и X;
Х28 выбран из Arg и X;
Х30 представляет собой X или отсутствует;
причем по меньшей мере один из X16, Х17, Х20, Х24, Х27, Х28 и Х30 представляет собой X;
и при этом каждый остаток X независимым образом выбран из группы, состоящей из Glu, Lys, Ser, Cys, Dbu, Dpr и Orn;
при этом боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:
(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или
(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2;
при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (гексадеканоил-γ-Glu)-AAHDFVEWLLRA.
2. Соединение по п.1, в котором один или более указанных остатков X независимым образом выбран из Lys, Glu и Cys.
3. Соединение по п.1 или 2, в котором
X16 выбран из Glu, Lys и Ser;
X17 выбран из Lys и Cys;
Х20 выбран из His, Lys, Arg и Cys;
Х24 выбран из Lys, Glu и Ala;
Х27 выбран из Leu и Lys и/или
Х28 выбран из Ser, Arg и Lys.
4. Соединение по любому из пп.1-3, в котором указанный пептид формулы I содержит одну из следующих комбинаций остатков:
Х2 представляет собой Aib, и X17 представляет собой Lys;
Х2 представляет собой Aib, и X17 представляет собой Cys;
Х2 представляет собой Aib, и Х20 представляет собой Cys;
Х2 представляет собой Aib, и Х28 представляет собой Lys;
Х12 представляет собой Arg, и Х17 представляет собой Lys;
Х12 представляет собой Leu, и Х17 представляет собой Lys;
Х12 представляет собой Lys, и Х20 представляет собой Lys;
Х12 представляет собой Lys, и X17 представляет собой Lys;
Х16 представляет собой Lys, и Х17 представляет собой Lys;
X16 представляет собой Ser, и X17 представляет собой Lys;
X17 представляет собой Lys, и Х20 представляет собой Lys;
Х17 представляет собой Lys, и Х21 представляет собой Asp;
X17 представляет собой Lys, и Х24 представляет собой Glu;
X17 представляет собой Lys, и Х27 представляет собой Leu;
X17 представляет собой Lys, и Х27 представляет собой Lys;
X17 представляет собой Lys, и Х28 представляет собой Sen
X17 представляет собой Lys, и Х28 представляет собой Arg;
Х20 представляет собой Lys, и Х27 представляет собой Leu;
Х21 представляет собой Asp, и Х27 представляет собой Leu;
Х2 представляет собой Aib, X12 представляет собой Lys, и X16 представляет собой Ser;
Х12 представляет собой Lys, X17 представляет собой Lys, и Х16 представляет собой Ser;
Х12 представляет собой Arg, X17 представляет собой Lys, и Х16 представляет собой Glu;
Х16 представляет собой Glu, X17 представляет собой Lys, и Х20 представляет собой Lys;
Х16 представляет собой Ser, X21 представляет собой Asp, и Х24 представляет собой Glu;
X17 представляет собой Lys, X24 представляет собой Glu, и Х28 представляет собой Arg;
X17 представляет собой Lys, X24 представляет собой Glu, и Х28 представляет собой Lys;
X17 представляет собой Lys, X27 представляет собой Leu, и Х28 представляет собой Ser;
X17 представляет собой Lys, X27 представляет собой Leu, и Х28 представляет собой Arg;
Х20 представляет собой Lys, X24 представляет собой Glu, и Х27 представляет собой Leu;
Х20 представляет собой Lys, X27 представляет собой Leu, и Х28 представляет собой Ser;
Х20 представляет собой Lys, X27 представляет собой Leu, и Х28 представляет собой Arg;
X16 представляет собой Ser, X20 представляет собой His, X24 представляет собой Glu, и Х27 представляет собой Leu;
X17 представляет собой Lys, X20 представляет собой His, X24 представляет собой Glu, и Х28 представляет собой Ser;
X17 представляет собой Lys, X20 представляет собой Lys, X24 представляет собой Glu, и Х27 представляет собой Leu; или
X17 представляет собой Cys, X20 представляет собой Lys, X24 представляет собой Glu, и Х27 представляет собой Leu.
5. Соединение по любому из предыдущих пунктов, в котором указанный пептид формулы I содержит только одну аминокислоту указанного типа, конъюгированную с липофильным заместителем.
6. Соединение по п.5, в котором указанный пептид содержит только один остаток Lys, только один остаток Cys или только один остаток Glu, и при этом указанный лиофильный заместитель конъюгирован с этим остатком.
7. Соединение по любому из предыдущих пунктов, в котором указанная последовательность пептида формулы I содержит один или более внутримолекулярных мостиков.
8. Соединение по п.7, в котором указанный внутримолекулярный мостик образован между боковыми цепями двух аминокислотных остатков, которые разделены тремя аминокислотами в линейной аминокислотной последовательности формулы I.
9. Соединение по п.8, в котором указанный внутримолекулярный мостик образован между боковыми цепями пар остатков 16 и 20, 17 и 21, 20 и 24 или 24 и 28.
10. Соединение по любому из пп.7-9, в котором указанный внутримолекулярный мостик представляет собой соляной мостик или лактамное кольцо.
11. Соединение по любому из пп.7-10, в котором указанный внутримолекулярный мостик включает пару остатков, где
X16 представляет собой Glu, и Х20 представляет собой Lys;
X16 представляет собой Glu, и Х20 представляет собой Arg;
X16 представляет собой Lys, и Х20 представляет собой Glu; или
X16 представляет собой Arg, и Х20 представляет собой Glu;
X17 представляет собой Arg, и Х21 представляет собой Glu;
X17 представляет собой Lys, и Х21 представляет собой Glu;
X17 представляет собой Arg, и Х21 представляет собой Asp; или
X17 представляет собой Lys, и Х21 представляет собой Asp;
Х20 представляет собой Glu, и X24 представляет собой Lys;
Х20 представляет собой Glu, и Х24 представляет собой Arg;
Х20 представляет собой Lys, и Х24 представляет собой Glu; или
Х20 представляет собой Arg, и Х24 представляет собой Glu;
Х24 представляет собой Glu, и Х28 представляет собой Lys;
Х24 представляет собой Glu, и Х28 представляет собой Arg;
Х24 представляет собой Lys, и Х28 представляет собой Glu; или
Х24 представляет собой Arg, и Х28 представляет собой Glu.
12. Соединение по любому из предыдущих пунктов, в котором по меньшей мере один из Х16, Х17, Х20 и Х28 конъюгирован с липофильным заместителем.
13. Соединение по любому из пп.1-10, в котором Х30 отсутствует.
14. Соединение по любому из пп.1-10, в котором Х30 присутствует и конъюгирован с липофильным заместителем.
15. Соединение по любому из предыдущих пунктов, в котором указанное соединение содержит только один липофильный заместитель в положении 16, 17, 20, 24, 27, 28 или 30, предпочтительно в положении 16, 17 или 20, в частности в положении 17.
16. Соединение по любому из пп.1-14, в котором указанное соединение содержит точно два липофильных заместителя, каждый в одном из положений 16, 17, 20, 24, 27, 28 или 30.
17. Соединение по п.16, в котором указанное соединение содержит липофильные заместители в положениях 16 и 17, 16 и 20, 16 и 24, 16 и 27, 16 и 28 или 16 и 30; в положениях 17 и 20, 17 и 24, 17 и 27, 17 и 28 или 17 и 30; в положениях 20 и 24, 20 и 27, 20 и 28 или 20 и 30; в положениях 24 и 27, 24 и 28 или 24 и 30; в положениях 27 и 28 или 27 и 30; или в положениях 28 и 30.
18. Соединение по п.1, имеющее формулу
где R1 представляет собой Н, С1-4 алкил, ацетил, формил, бензоил или трифторацетил;
R2 представляет собой ОН или NH2;
Z представляет собой пептид согласно формуле IIa
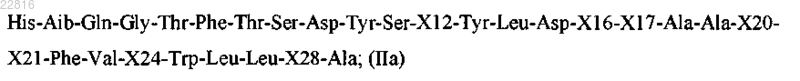
где X12 выбран из Lys, Arg и Leu;
Х16 выбран из Ser и X;
X17 представляет собой X;
Х20 выбран из His и X;
Х21 выбран из Asp и Glu;
Х24 выбран из Ala и Glu;
Х28 выбран из Ser, Lys и Arg;
и при этом каждый остаток X независимым образом выбран из группы, состоящей из Glu, Lys и Cys;
причем боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:
(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или
(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2.
19. Соединение по п.1, имеющее формулу
где R1 представляет собой Н, С1-4 алкил, ацетил, формил, бензоил или трифторацетил;
R2 представляет собой ОН или NH2;
и Z представляет собой пептид согласно формуле IIb
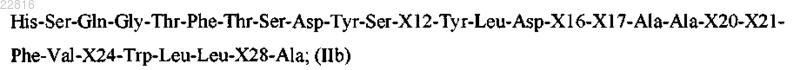
где Х12 выбран из Lys, Arg и Leu;
XI6 выбран из Ser и X;
XI7 представляет собой X;
Х20 выбран из His и X;
Х21 выбран из Asp и Glu;
Х24 выбран из Ala и Glu;
Х28 выбран из Ser, Lys и Arg;
и при этом каждый остаток X независимым образом выбран из группы, состоящей из Glu, Lys и Cys;
причем боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:
(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или
(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2;
при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (гексадеканоил-γ-Glu))-AAHDFVEWLLRA.
20. Соединение по п.18, имеющее формулу
где R1 представляет собой Н, С1-4 алкил, ацетил, формил, бензоил или трифторацетил;
R2 представляет собой ОН или NH2;
Z представляет собой пептид согласно формуле IIIa
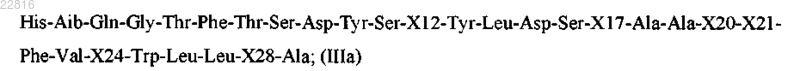
где
Х12 выбран из Lys и Arg;
X17 представляет собой X;
Х20 выбран из His и X;
Х21 выбран из Asp и Glu;
Х24 выбран из Ala и Glu;
Х28 выбран из Ser, Lys и Arg;
и при этом каждый остаток X независимым образом выбран из Glu, Lys и Cys;
причем боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:
(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или
(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2.
21. Соединение по п.19, имеющее формулу
где R1 представляет собой Н, С1-4 алкил, ацетил, формил, бензоил или трифторацетил;
R2 представляет собой ОН или NH2;
и Z представляет собой пептид согласно формуле IIIb
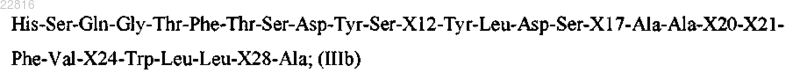
где X12 выбран из Lys и Arg;
X17 представляет собой X;
Х20 выбран из His и X;
Х21 выбран из Asp и Glu;
Х24 выбран из Ala и Glu;
Х28 выбран из Ser, Lys и Arg;
и при этом каждый остаток X независимым образом выбран из Glu, Lys и Cys;
причем боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:
(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или
(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2;
при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (Гексадеканоил-γ-Glu))-AAHDFVEWLLRA.
22. Соединение по п.20, имеющее формулу
R1-Z-R2
где R1 представляет собой Н, С1-4 алкил, ацетил, формил, бензил или трифторацетил;
R2 представляет собой ОН или NH2;
Z представляет собой пептид согласно формуле IVa

где Х12 выбран из Lys и Arg;
X17 представляет собой X;
Х21 выбран из Asp и Glu;
Х24 выбран из Ala и Glu;
Х28 выбран из Ser, Lys и Arg;
причем X выбран из группы, состоящей из Glu, Lys и Cys;
и при этом боковая цепь X конъюгирована с липофильным заместителем, имеющим формулу:
(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или
(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2.
23. Соединение по п.21, имеющее формулу
где R1 представляет собой Н, С1-4 алкил, ацетил, формил, бензоил или трифторацетил;
R2 представляет собой ОН или NH2;
Z представляет собой пептид согласно формуле IVb
где X12 выбран из Lys и Arg;
X17 представляет собой X;
Х21 выбран из Asp и Glu;
Х24 выбран из Ala и Glu;
Х28 выбран из Ser, Lys и Arg;
причем X выбран из группы, состоящей из Glu, Lys и Cys;
и при этом боковая цепь X конъюгирована с липофильным заместителем, имеющим формулу:
(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или
(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2;
при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (Гексадеканоил-γ-Glu))-AAHDFVEWLLRA.
24. Соединение по любому из предыдущих пунктов, в котором указанный пептид формулы I имеет последовательность


25. Соединение по любому из предыдущих пунктов, которое содержит пептид формулы I, имеющий указанную последовательность


26. Соединение по любому из предыдущих пунктов, в котором Z1 содержит углеводородную цепь, включающую 10-24 атомов С, 10-22 атомов С или 10-20 атомов С.
27. Соединение по п.26, в котором Z1 представляет собой группу додеканоила, 2-бутилоктаноила, тетрадеканоила, гексадеканоила, гептадеканоила, октадеканоила или эйкозаноила.
28. Соединение по любому из предыдущих пунктов, в котором Z2 представляет собой или содержит один или более аминокислотных остатков.
29. Соединение по п.28, в котором Z2 представляет собой остаток γ-Glu, Glu, β-Ala или e-Lys или группу 3-аминопропаноила, 4-аминобутаноила, 8-аминооктаноила или 8-амино-3,6-диоктаноила.
30. Соединение по п.29, в котором указанный лиофильный заместитель выбран из группы, состоящей из додеканоил-γ-Glu, гексадеканоил-γ-Glu, гексадеканоил-Glu, гексадеканоил-[3-аминопропаноила], гексадеканоил-[8-аминооктаноила], гексадеканоил-e-Lys, 2-бутилоктаноил-γ-Glu, октадеканоил-γ-Glu и гексадеканоил-[4-аминобутаноила].
31. Соединение по п.30, в котором Z имеет формулу

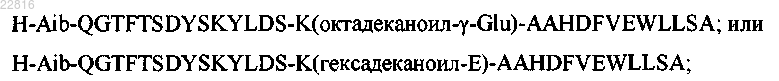
где остатки, обозначенные "()" участвуют в образовании внутримолекулярной связи.
32. Соединение по п.30, в котором Z имеет формулу

33. Соединение, имеющее формулу
где R1 представляет собой Н, С1-4 алкил, ацетил, формил, бензоил или трифторацетил;
R2 представляет собой ОН или NH2;
Z представляет собой пептид согласно формуле V
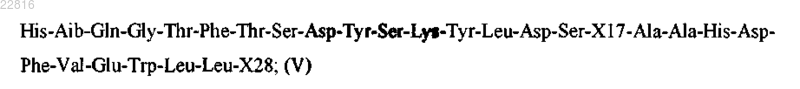
где
X17 представляет собой X;
Х28 представляет собой Ser или отсутствует;
причем X выбран из группы, состоящей из Glu, Lys и Cys;
и при этом боковая цепь X конъюгирована с липофильным заместителем, имеющим формулу:
(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или
(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2.
34. Соединение по п.33, в котором Z имеет формулу: H-Aib-QGTFTSDYSKYLDS-K (гексадеканоил-изо-Glu)-AAHDFVEWLLS; H-Aib-QGTFTSDYSKYLDS-K (гексадеканоил-изо-Glu)-AAHDFVEWLL.
35. Соединение, имеющее формулу
где R1 представляет собой Н, С1-4 алкил, ацетил, формил, бензоил или трифторацетил;
R2 представляет собой ОН или NH2;
и Z представляет собой пептид согласно формуле VI

где X17 представляет собой X;
причем X выбран из группы, состоящей из Glu, Lys и Cys;
и при этом боковая цепь X конъюгирована с липофильным заместителем, имеющим формулу:
(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или
(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2.
36. Соединение по п.35, где Z имеет формулу: H-Aib-EGTFTSDYSKYLDS-K (гексадеканоил-изо-Glu)-AAHDFVEWLLSA.
37. Композиция, содержащая соединение по любому из пп.1-36 или его соль или производное в виде смеси с носителем.
38. Композиция по п.37, отличающаяся тем, что указанная композиция представляет собой фармацевтически приемлемую композицию и указанный носитель представляет собой фармацевтически приемлемый носитель.
39. Применение соединения по любому из пп.1-36 для предотвращения увеличения массы тела или обеспечения снижения массы тела у нуждающегося в этом индивидуума.
40. Применение соединения по любому из пп.1-36 в способе нормализации уровня глюкозы в крови, переносимости глюкозы и/или уровня холестерина в крови, снижения уровня LDL в крови и/или увеличения соотношения HDL/LDL у индивидуума, нуждающегося в этом.
41. Применение соединения по любому из пп.1-37 в способе лечения заболевания, вызванного избыточной массой тела или для которого характерна избыточная масса тела, например лечения и/или предотвращения ожирения, тяжелой формы ожирения, воспаления, вызванного ожирением, заболевания желчного пузыря, вызванного ожирением, апноэ сна, вызванного ожирением, метаболического синдрома, преддиабетических состояний, устойчивости к инсулину, непереносимости глюкозы, диабета 2 типа, диабета 1 типа, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца, болезни периферических артерий, инсульта или заболевания мелких сосудов у индивидуума, нуждающегося в этом.
42. Применение по любому из пп.39-41, согласно которому соединение вводят в виде компонента комплексного лечения вместе со средством для лечения диабета, ожирения, дислипидемии или гипертензии.
43. Применение по п.42, отличающееся тем, что указанное средство для лечения диабета представляет собой метформин, сульфонилмочевину, глинид, ингибитор DPP-IV, глитазон, инсулин или аналог инсулина.
44. Применение по п.42, отличающееся тем, что указанное средство для лечения ожирения представляет собой агонист рецептора глюкагоноподобного пептида 1, пептид YY или его аналог, антагонист рецептора каннабиноида 1, ингибитор липазы, агонист рецептора меланокортина 4 или антагонист рецептора меланин концентрирующего гормона 1.
45. Применение по п.42, отличающееся тем, что указанное средство для лечения гипертензии представляет собой ингибитор ангиотензин-конвертирующего фермента, блокатор рецептора к ангиотензину II, диуретик, бета-блокатор или блокатор кальциевых каналов.
46. Применение по п.42, отличающееся тем, что указанное средство для лечения дислипидемии представляет собой статин, фибрат, ниацин и/или ингибитор всасывания холестерина.
47. Способ предотвращения увеличения массы тела или обеспечения снижения массы тела у нуждающегося в этом индивидуума, который включает введение указанному индивидууму терапевтически эффективного количества соединения согласно любому из пп.1-36.
48. Способ нормализации уровня глюкозы в крови, переносимости глюкозы и/или уровня холестерина в крови, снижения уровня LDL в крови и/или увеличения соотношения HDL/LDL у нуждающегося в этом индивидуума, который включает введение указанному индивидууму терапевтически эффективного количества соединения согласно любому из пп.1-36.
49. Способ лечения заболевания, вызванного избыточной массой тела или для которого характерна избыточная масса тела, например лечения и/или предотвращения ожирения, тяжелой формы ожирения, воспаления, вызванного ожирением, заболевания желчного пузыря, вызванного ожирением, апноэ сна, вызванного ожирением, метаболического синдрома, преддиабетических состояний, устойчивости к инсулину, непереносимости глюкозы, диабета 2 типа, диабета 1 типа, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца, болезни периферических артерий, инсульта или заболевания мелких сосудов у нуждающегося в этом индивидуума, который включает введение указанному индивидууму терапевтически эффективного количества соединения согласно любому из пп.1-37.
50. Способ по любому из пп.47-49, отличающийся тем, что указанное соединение вводят в виде компонента комплексного лечения вместе со средством для лечения диабета, ожирения, дислипидемии или гипертензии.
51. Способ по п.50, отличающийся тем, что указанное средство для лечения диабета представляет собой метформин, сульфонилмочевину, глинид, ингибитор DPP-IV, глитазон, инсулин или аналог инсулина.
52. Способ по п.50, отличающийся тем, что указанное средство для лечения ожирения представляет собой агонист рецептора глюкагоноподобного пептида 1, пептид YY или его аналог, антагонист рецептора каннабиноида 1, ингибитор липазы, агонист рецептора меланокортина 4 или антагонист рецептора меланин концентрирующего гормона 1.
53. Способ по п.50, отличающийся тем, что указанное средство для лечения гипертензии представляет собой ингибитор ангиотензин-конвертирующего фермента, блокатор рецептора к ангиотензину II, диуретик, бета-блокатор или блокатор кальциевых каналов.
54. Способ по п.50, отличающийся тем, что указанное средство для лечения дислипидемии представляет собой статин, фибрат, ниацин и/или ингибитор всасывания холестерина.
Текст
Настоящее изобретение обеспечивает вещества и способы для снижения массы тела или предотвращения увеличения массы тела и лечения диабета и связанных с ним метаболических нарушений. В частности, настоящее изобретение обеспечивает новые ацилированные пептиды,которые представляют собой аналоги глюкагона, эффективные в указанных способах. Указанные пептиды могут оказывать свое действие посредством повышенной избирательности по отношению к рецептору GLP-1 по сравнению с глюкагоном человека. Рибер Дитте, Мейер Эдди, Даугаард Йенс Росенгрен, Сковгаард Мари,Толборг Якоб Линд, Кампен Гита, Бэк Камилла Эртеберг (DK) Нилова М.И. (RU) Область техники Настоящее изобретение относится к ацилированным аналогам глюкагона и их применению в медицине, например, для лечения ожирения и сахарного диабета. Уровень техники Ожирение и сахарный диабет представляют собой растущие проблемы мирового здравоохранения и связаны с различными заболеваниями, в частности, сердечно-сосудистыми заболеваниями, обструктивным апноэ сна, инсультом, болезнью периферических артерий, нарушением микроциркуляции и остеоартритом. В мире существует 246 млн больных диабетом и по прогнозам к 2025 г. 380 млн людей будут больны диабетом. У многих из них есть дополнительные факторы риска развития сердечно-сосудистых заболеваний, включая высокий/нарушенный уровень LDL (липопротеины низкой плотности) и триглицеридов и низкий уровень HDL (липопротеины высокой плотности). Сердечно-сосудистые заболевания являются причиной 50% смертей пациентов с диабетом, и уровень заболеваемости и смертности от ожирения и диабета подчеркивает необходимость в эффективных способах лечения. Препроглюкагон представляет собой полипептид-предшественник длиной 158 аминокислот, который подвергается дифференциальному процессингу в тканях и образует несколько структурно родственных пептидов, происходящих из проглюкагона, включая глюкагон (Glu), глюкагоноподобный пептид-1(GLP-1), глюкагоноподобный пептид-2 (GLP-2) и оксинтомодулин (ОХМ). Указанные молекулы выполняют различные физиологические функции, включая гомеостаз глюкозы, секрецию инсулина, опорожнение желудка и рост кишечника, а также регуляцию потребления пищи. Глюкагон представляет собой пептид из 29 аминокислот, который соответствует аминокислотам 53-81 препроглюкагона и имеет последовательность Оксинтомодулин (ОХМ) представляет собой пептид длиной 37 аминокислот, который включает полную последовательность из 29 аминокислот глюкагона и на С-конце удлинение из 8 аминокислот(аминокислоты 82 - 89 препроглюкагона, имеющие последовательность Lys-Arg-Asn-Arg-Asn-Asn-lle-Ala и обозначаемые термином "промежуточный пептид 1" или IP-1; таким образом, полная последовательность оксинтомодулина человека представляет собой His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-LysTyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Lys-Arg-Asn-Arg-Asn-Asn-lleAla). Основной биологически активный фрагмент GLP-1 синтезируется в виде амидированного по Сконцу пептида из 30 аминокислот, который соответствует аминокислотам 98-127 препроглюкагона. Глюкагон способствует поддержанию постоянного уровня глюкозы в крови посредством связывания с рецепторами глюкагона на гепатоцитах, вызывая высвобождение глюкозы из печени, запасенной в виде гликогена, в процессе глюкогенолиза. Когда эти запасы уменьшаются, глюкагон стимулирует синтез дополнительной глюкозы печенью в ходе глюконеогенеза. Эта глюкоза высвобождается в кровоток,предотвращая развитие гипогликемии. Также было показано, что глюкагон усиливает липолиз и уменьшает массу тела.GLP-1 снижает повышенный уровень глюкозы в крови благодаря улучшению секреции инсулина,вызванной глюкозой, и способствует уменьшению массы тела в основном из-за снижения потребления пищи. Оксинтомодулин поступает в кровь в ответ на потребление пищи пропорционально количеству калорий в пище. Механизм действия оксинтомодулина еще не достаточно хорошо известен. В частности неизвестно, опосредуется ли действие этого гормона исключительно рецептором глюкагона и рецептором GLP-1 или одним или более до сих пор не обнаруженными рецепторами. Было показано, что другие пептиды связывают и активируют рецептор глюкагона и рецептор GLP-1(Hjort et al., Journal of Biological Chemistry, 269, 30121-30124,1994) и подавляют увеличение массы тела и снижают потребление пищи (WO 2006/134340; WO 2007/100535; WO 2008/101017, WO 2008/152403, WO 2009/155257 и WO 2009/155258). Было показано, что стабилизация пептидов обеспечивает лучший фармакокинетический профиль некоторых лекарственных средств. В частности, показано, что добавление одной или более группы полиэтиленгликоля (PEG) или ацильной группы, продлевает период полувыведения пептидов, таких как GLP-1 и других пептидов с непродолжительной стабильностью в плазме. В публикациях WO 00/55184 А 1 и WO 00/55119 описаны способы ацилирования некоторых пептидов, в частности GLP-1. В публикации Madsen et al. (J. Med. Chem. 2007, 50, 6126-6132) описан ацилированный в положении 20 GLP-1 (Лираглутид) и представлены данные о его стабильности. В публикациях WO2007/100535, WO08/071972 и Endocrinology 2009, 150(4), 1712-1721 Druce М. R. и др. показано, что стабилизация ОХМ благодаря пегилированию и ацилированию С-конца улучшает фармакокинетический профиль секретируемых аналогов. Недавно было показано, что пегилирование аналогов глюкагона оказывает сильное влияние на фармакокинетический профиль исследованных соединений (WO 2008/101017), но нарушает активность указанных соединений. Краткое описание изобретения Настоящее изобретение обеспечивает соединение, имеющее формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2 и Z представляет собой пептид, имеющий формулу I где Х 2 выбран из Aib или Ser; Х 12 выбран из Lys, Arg и Leu; Х 16 выбран из Arg и X; Х 17 выбран из Arg и X; Х 20 выбран из Arg, His и X; Х 21 выбран из Asp и Glu; Х 24 выбран из Ala и X; Х 27 выбран из Leu и X; Х 28 выбран из Arg и X; Х 30 представляет собой X или отсутствует; причм по меньшей мере один из Х 16, Х 17, Х 20, Х 24, Х 27, Х 28 и Х 30 представляет собой X; и при этом каждый остаток X независимо выбран из группы, состоящей из Glu, Lys, Ser, Cys, Dbu,Dpr и Orn; причм боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, конъюгированную непосредственно с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер,и Z1 конъюгирована с боковой цепью X через Z2; при условии, что Z не является HSQGTFTSDYSKYLDS-K(гексадеканоилGlu)-AAHDFVEWLLRA. Х 30 может присутствовать или отсутствовать. Согласно вариантам реализации, в которых Х 30 присутствует, он может предпочтительно представлять собой Lys. Согласно некоторым вариантам реализации любой остаток X, и особенно любой остаток X, который конъюгирован с липофильным заместителем, независимо выбран из Lys, Glu или Cys. Согласно некоторым вариантам реализации Х 16 выбран из Glu, Lys и Ser; Х 17 выбран из Lys и Cys; Х 20 выбран из His, Lys, Arg и Cys; Х 24 выбран из Lys, Glu и Ala; Х 27 выбран из Leu и Lys; и/или Х 28 выбран из Ser, Arg и Lys. Определенные комбинации остатков, которые могут присутствовать в пептиде формулы I, включают следующие: Х 2 представляет собой Aib, и Х 17 представляет собой Lys; Х 2 представляет собой Aib, и Х 17 представляет собой Cys; Х 2 представляет собой Aib, и Х 20 представляет собой Cys; Х 2 представляет собой Aib, и Х 28 представляет собой Lys; Х 12 представляет собой Arg, и Х 17 представляет собой Lys; Х 12 представляет собой Leu, и Х 17 представляет собой Lys; Х 12 представляет собой Lys, и Х 20 представляет собой Lys; Х 12 представляет собой Lys, и Х 17 представляет собой Lys; Х 16 представляет собой Lys, и Х 17 представляет собой Lys; Х 16 представляет собой Ser, и Х 17 представляет собой Lys; Х 17 представляет собой Lys, и Х 20 представляет собой Lys; Х 17 представляет собой Lys, и Х 21 представляет собой Asp; Х 17 представляет собой Lys, и Х 24 представляет собой Glu; Х 17 представляет собой Lys, и Х 27 представляет собой Leu; Х 17 представляет собой Lys, и Х 27 представляет собой Lys; Х 17 представляет собой Lys, и Х 28 представляет собой Ser; Х 17 представляет собой Lys, и Х 28 представляет собой Arg; Х 20 представляет собой Lys, и Х 27 представляет собой Leu; Х 21 представляет собой Asp, и Х 27 представляет собой Leu; Х 2 представляет собой Aib, X12 представляет собой Lys, и Х 16 представляет собой Ser; Х 12 представляет собой Lys, X17 представляет собой Lys, и Х 16 представляет собой Ser; Х 12 представляет собой Arg, X17 представляет собой Lys, и Х 16 представляет собой Glu; Х 16 представляет собой Glu, X17 представляет собой Lys, и Х 20 представляет собой Lys; Х 16 представляет собой Ser, X21 представляет собой Asp, и Х 24 представляет собой Glu; Х 17 представляет собой Lys, X24 представляет собой Glu, и Х 28 представляет собой Arg; Х 17 представляет собой Lys, X24 представляет собой Glu, и Х 28 представляет собой Lys; Х 17 представляет собой Lys, X27 представляет собой Leu, и Х 28 представляет собой Ser; Х 17 представляет собой Lys, X27 представляет собой Leu, и Х 28 представляет собой Arg; Х 20 представляет собой Lys, X24 представляет собой Glu, и Х 27 представляет собой Leu; Х 20 представляет собой Lys, X27 представляет собой Leu, и Х 28 представляет собой Ser; Х 20 представляет собой Lys, X27 представляет собой Leu, и Х 28 представляет собой Arg; Х 16 представляет собой Ser, X20 представляет собой His, X24 представляет собой Glu, и Х 27 представляет собой Leu; Х 17 представляет собой Lys, X20 представляет собой His, X24 представляет собой Glu, и Х 28 представляет собой Ser; Х 17 представляет собой Lys, X20 представляет собой Lys, X24 представляет собой Glu, и Х 27 представляет собой Leu; или Х 17 представляет собой Cys, X20 представляет собой Lys, X24 представляет собой Glu, и Х 27 представляет собой Leu. Может быть желательным, чтобы пептид формулы I содержал только одну аминокислоту того типа,который необходимо модифицировать посредством добавления липофильного заместителя. Например,указанный пептид может содержать только один остаток Lys, только один остаток Cys или только один остаток Glu для осуществления конъюгации липофильного заместителя с указанным остатком. Соединения согласно настоящему изобретению могут иметь один или более внутримолекулярных мостиков в пределах последовательности пептида формулы I. Каждый указанный мостик образуется между боковыми цепями двух аминокислотных остатков формулы I, которые обычно разделены тремя аминокислотами в линейной последовательности аминокислот (т.е. между аминокислотой А и аминокислотой А+4). В частности, указанный мостик может быть образован между боковыми цепями пар остатков в положениях 16 и 20, 17 и 21, 20 и 24 или 24 и 28. Указанные боковые цепи могут быть связаны с другой цепью посредством ионных взаимодействий или ковалентных связей. Таким образом, указанные пары остатков могут содержать противоположно заряженные боковые цепи для образования соляного мостика посредством ионных взаимодействий. Например, один из остатков может представлять собой Glu илиAsp, тогда как другой может представлять собой Lys или Arg. Образование пар Lys и Glu и Lys и Asp также может обеспечивать взаимодействие с образованием лактамного кольца. Примеры подходящих пар остатков в положениях 16 и 20 включают: Х 16 представляет собой Glu, и Х 20 представляет собой Lys; Х 16 представляет собой Glu, и Х 20 представляет собой Arg; Х 16 представляет собой Lys, и Х 20 представляет собой Glu; и Х 16 представляет собой Arg, и Х 20 представляет собойGlu. Примеры подходящих пар остатков в положениях 17 и 21 включают: Х 17 представляет собой Arg, и Х 21 представляет собой Glu; Х 17 представляет собой Lys, и Х 21 представляет собой Glu; Х 17 представляет собой Arg, и Х 21 представляет собой Asp; и Х 17 представляет собой Lys, и Х 21 представляет собойAsp. Примеры подходящих пар остатков в положениях 20 и 24 включают: Х 20 представляет собой Gluand X24 представляет собой Lys; Х 20 представляет собой Glu, и Х 24 представляет собой Arg; Х 20 представляет собой Lys, и Х 24 представляет собой Glu; и Х 20 представляет собой Arg, и Х 24 представляет собой Glu. Примеры подходящих пар остатков в положениях 24 и 28 включают: Х 24 представляет собой Glu, и Х 28 представляет собой Lys; Х 24 представляет собой Glu, и Х 28 представляет собой Arg; Х 24 представляет собой Lys, и Х 28 представляет собой Glu; и Х 24 представляет собой Arg, и Х 28 представляет собойGlu. Образование пары Lys и Glu, например, для образования лактамного кольца, может быть особенно желательным, особенно между положениями 24 и 28. Очевидно, что остатки, участвующие в образовании внутримолекулярного мостика, нельзя подвергать дериватизации с липофильным заместителем. Таким образом, если один из остатков X участвует в образовании внутримолекулярного мостика, по меньшей мере один из других остатков X конъюгирован с липофильным заместителем или заместителями. Считается, что такие внутримолекулярные мостики стабилизируют альфа-спиральную структуру молекулы и благодаря этому повышают ее активность и/или избирательность в отношении рецептораGLP-1 и возможно также рецептора глюкагона. Указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IIa где Х 12 выбран из Lys, Arg и Leu; Х 16 выбран из Ser и X; Х 17 представляет собой X; Х 20 выбран из His и X; Х 21 выбран из Asp и Glu; Х 24 выбран из Ala и Glu; Х 28 выбран из Ser, Lys и Arg; и при этом каждый остаток X независимым образом выбран из группы, состоящей из Glu, Lys иCys; причм боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2. В качестве альтернативы указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IIb где Х 12 выбран из Lys, Arg и Leu; Х 16 выбран из Ser и X; Х 17 представляет собой X; Х 20 выбран из His и X; Х 21 выбран из Asp и Glu; Х 24 выбран из Ala и Glu; Х 28 выбран из Ser, Lys и Arg; и при этом каждый остаток X независимым образом выбран из группы, состоящей из Glu, Lys иCys; причм боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофилыную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер,и Z1 конъюгирована с боковой цепью X через Z2; при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (ГексадеканоилGluAAHDFVEWLLRA. Указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IIIa Х 24 выбран из Ala и Glu; Х 28 выбран из Ser, Lys и Arg; и при этом каждый остаток X независимым образом выбран из Glu, Lys и Cys; причм боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1 где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2. В качестве альтернативы, указанное соединение может иметь следующую формулу: где R1 представляет собой Н, C1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IIIб где Х 12 выбран из Lys или Arg; Х 17 представляет собой X; Х 20 выбран из His и X; Х 21 выбран из Asp и Glu; Х 24 выбран из Ala и Glu; Х 28 выбран из Ser, Lys и Arg; и при этом каждый остаток X независимым образом выбран из Glu, Lys и Cys; причм боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2; при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (ГексадеканоилGluAAHDFVEWLLRA. Указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IVa где Х 12 выбран из Lys и Arg; Х 17 представляет собой X; Х 21 выбран из Asp и Glu; Х 24 выбран из Ala и Glu; Х 28 выбран из Ser, Lys и Arg; где X выбран из группы, состоящей из Glu, Lys и Cys; и при этом боковая цепь X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2. В качестве альтернативы указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IVб где Х 12 выбран из Lys и Arg; Х 17 представляет собой X; Х 21 выбран из Asp и Glu; Х 24 выбран из Ala и Glu Х 28 выбран из Ser, Lys и Arg; где X выбран из группы, состоящей из Glu, Lys и Cys; и при этом боковая цепь X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2; при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (ГексадеканоилGluAAHDFVEWLLRA. В качестве альтернативы указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу V где Х 28 представляет собой Ser или отсутствует; Х 17 представляет собой X,где X выбран из группы, состоящей из Glu, Lys и Cys; и при этом боковая цепь X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2; Согласно некоторым вариантам реализации настоящего изобретения пептид, имеющий формулу I,может иметь последовательность: Согласно некоторым вариантам реализации указанные пептиды могут содержать липофильный заместитель в положениях, обозначенных , например: Остатки, обозначенные с помощью , участвуют в образовании внутримолекулярной связи, например лактамного кольца. Боковая цепь (цепи) одного или более остатков X конъюгирована с липофильным заместителем. Например, одна боковая цепь остатка X может быть конъюгирована с липофильным заместителем. В качестве альтернативы две или даже более двух боковых цепей остатков X могут быть конъюгированы с липофильным заместителем. Например, по меньшей мере один из Х 16, Х 17, Х 20 и Х 28 может быть конъюгирован с липофильным заместителем. В таких случаях Х 30 может отсутствовать. Если Х 30 присутствует, он обычно конъюгирован с липофильным заместителем. Таким образом, соединение может содержать по меньшей мере один липофильный заместитель в положении 16, 17, 20, 24, 27, 28 или 30, предпочтительно в положении 16, 17 или 20, в частности в положении 17. В качестве альтернативы указанное соединение может содержать точно два липофильных заместителя, каждый в одном из положений 16, 17, 20, 24, 27, 28 или 30. Предпочтительно в одном из положений 16, 17 или 20 расположен один или оба липофильных заместителя. Таким образом, указанное соединение может содержать липофильные заместителя в положениях 16 и 17, 16 и 20, 16 и 24, 16 и 27, 16 и 28 или 16 и 30; в положениях 17 и 20, 17 и 24, 17 и 27, 17 и 28 или 17 и 30; в положениях 20 и 24, 20 и 27, 20 и 28 или 20 и 30; в положениях 24 и 27, 24 и 28 или 24 и 30; в положениях 27 и 28 или 27 и 30; или в положениях 28 и 30. Также согласно другим вариантам реализации указанное соединение может дополнительно содержать один или более липофильных заместителей (в общей сложности три или более) в других положениях, выбранных из положений 16, 17, 20, 24, 27, 28 или 30. Однако может быть желательно, чтобы не бо-8 022816 лее двух положений были изменены таким образом.Z1 может содержать углеводородную цепь, включающую 10-24 атома углерода, например 10-22 атома углерода, например 10-20 атомов углерода. Она может включать по меньшей мере 11 атомов углерода и/или 18 атомов углерода или меньше. Например, указанная углеводородная цепь может содержать 12, 13, 14, 15, 16, 17 или 18 атомов углерода. Таким образом, Z1 может представлять собой группу додеканоила, 2-бутилоктаноила, тетрадеканоила, гексадеканоила, гептадеканоила, октадеканоила или эйкозаноила. Независимым образом, если присутствует, Z2 может представлять собой или содержать один или более аминокислотных остатков. Например, Z2 может представлять собой остаток -Glu, Glu, -Ala или-Lys или группу 4-аминобутаноила, 8-аминооктаноила или 8-амино-3,6-диоксаоктаноила. Определенные сочетания Z1 и Z2 включают додеканоилGlu, гексадеканоилGlu, гексадеканоилGlu, гексадеканоил-[3-аминопропаноил], гексадеканоил-[8-аминооктаноил], гексадеканоилLys, 2 бутилоктаноилGlu, октадеканоилGlu и гексадеканоил-[4-аминобутаноил]. Согласно некоторым вариантам реализации Z имеет формулу: Остатки, обозначенные с помощью , участвуют в образовании внутримолекулярной связи, например лактамного кольца. Согласно другим вариантам реализации Z имеет формулу: Согласно другому аспекту Z имеет формулу: Согласно ещ одному аспекту Z имеет формулу: H-Aib-EGTFTSDYSKYLDS-K (Гексадеканоил-изоGlu)-AAHDFVEWLLSA; Настоящее изобретение обеспечивает соединение, имеющее формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу I где Х 2 представляет собой Aib или Ser; Х 12 выбран из Lys, Arg или Leu; Х 16 представляет собой Arg или X; Х 17 представляет собой Arg или X; Х 20 представляет собой Arg, His или X; Х 21 представляет собой Asp или Glu; Х 24 представляет собой Ala или X; Х 27 представляет собой Leu или X; Х 28 представляет собой Arg или X; Х 30 представляет собой X или отсутствует; и при этом каждый остаток X независимым образом выбран из группы, состоящей из Glu, Lys, Ser,Cys, Dbu, Dpr и Orn; причм боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2; при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (ГексадеканоилGlu)AAHDFVEWLLRA. Х 30 может присутствовать или отсутствовать. Согласно тем вариантам реализации, в которых Х 30 присутствует, желательно, чтобы он представлял собой Lys. Согласно определенным вариантам реализации любой остаток X, и особенно любой остаток X, который конъюгирован с липофильным заместителем, независимым образом выбран из Lys, Glu или Cys. Указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IIa Х 20 представляет собой His или X; Х 21 представляет собой Asp или Glu; Х 24 представляет собой Ala или Glu; Х 28 представляет собой Ser, Lys или Arg; и при этом каждый остаток X независимым образом выбран из группы, состоящей из Glu, Lys илиCys; причм боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2. В качестве альтернативы указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IIб где Х 12 выбран из Lys, Arg или Leu; Х 16 представляет собой Ser или X; Х 17 представляет собой X; Х 20 представляет собой His или X; Х 21 представляет собой Asp или Glu; Х 24 представляет собой Ala или Glu; Х 28 представляет собой Ser, Lys или Arg; и при этом каждый остаток X независимым образом выбран из группы, состоящей из Glu, Lys илиCys; причм боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(и) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2; при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (ГексадеканоилGluAAHDFVEWLLRA. Указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IIIa где Х 12 выбран из Lys или Arg; Х 17 представляет собой X; Х 20 представляет собой His или X; Х 21 представляет собой Asp или Glu; Х 24 представляет собой Ala или Glu; Х 28 представляет собой Ser, Lys или Arg; и при этом каждый остаток X независимым образом выбран из Glu, Lys или Cys; причм боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2. В качестве альтернативы указанное соединение может иметь следующую формулу:R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IIIб где Х 12 выбран из Lys или Arg; Х 17 представляет собой X; Х 20 представляет собой His или X; Х 21 представляет собой Asp или Glu; Х 24 представляет собой Ala или Glu; Х 28 представляет собой Ser, Lys или Arg; и при этом каждый остаток X независимым образом выбран из Glu, Lys или Cys; причм боковая цепь по меньшей мере одного остатка X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2; при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (ГексадеканоилGluAAHDFVEWLLRA. Указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IVa где Х 12 выбран из Lys или Arg; Х 17 представляет собой X; Х 21 представляет собой Asp или Glu; Х 24 представляет собой Ala или Glu; Х 28 представляет собой Ser, Lys или Arg; где X выбран из группы, состоящей из Glu, Lys или Cys; и при этом указанная боковая цепь X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боковой цепью X; или(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2. В качестве альтернативы указанное соединение может иметь следующую формулу: где R1 представляет собой Н, С 1-4 алкил, ацетил, формил, бензоил или трифторацетил;R2 представляет собой ОН или NH2; и Z представляет собой пептид, имеющий формулу IVб где Х 12 выбран из Lys или Arg; Х 17 представляет собой X; Х 21 представляет собой Asp или Glu; Х 24 представляет собой Ala или Glu Х 28 представляет собой Ser, Lys или Arg; где X выбран из группы, состоящей из Glu, Lys или Cys; и при этом указанная боковая цепь X конъюгирована с липофильным заместителем, имеющим формулу:(i) Z1, где Z1 представляет собой липофильную группу, непосредственно конъюгированную с боко- 12022816(ii) Z1Z2, где Z1 представляет собой липофильную группу, Z2 представляет собой спейсер, и Z1 конъюгирована с боковой цепью X через Z2; при условии, что Z не представляет собой HSQGTFTSDYSKYLDS-K (ГексадеканоилGluAAHDFVEWLLRA. Согласно другому варианту реализации настоящее изобретение обеспечивает композицию, содержащую соединение согласно настоящему изобретению или его соль или производное в виде смеси с носителем. Согласно предпочтительным вариантам реализации указанная композиция представляет собой фармацевтически приемлемую композицию, и указанный носитель представляет собой фармацевтически приемлемый носитель. Указанная соль может представлять собой фармацевтически приемлемую кислотно-аддитивную соль указанного соединения, например, ацетат или хлорид. Соединения согласно настоящему описанию будут применяться для предотвращения увеличения массы тела или обеспечения потери массы тела. Термин "предотвращение" обозначает подавление или снижение увеличения массы по сравнению с отсутствием лечения и необязательно означает полное прекращение увеличения массы тела. Указанные пептиды могут вызывать уменьшение потребления пищи и/или повышенное расходование энергии, приводящее к наблюдаемому влиянию на массу тела. Вне зависимости от их действия на массу тела указанные соединения согласно настоящему изобретению могут оказывать благоприятное влияние на уровень глюкозы в крови, переносимость глюкозы и/или уровень холестерина в крови, т.к. они могут понижать уровень LDL в крови и повышать соотношение HDL/LDL. Указанные соединения согласно настоящему изобретению можно применять в направленной или опосредованной терапии любого заболевания, вызванного или характеризуемого чрезмерной массой тела,например, для лечения и/или предотвращения ожирения, тяжелой формы ожирения, воспаления, вызванного ожирением, заболевания желчного пузыря, вызванного ожирением, апноэ сна, вызванного ожирением. Также они могут применяться при лечении преддиабетических состояний, устойчивости к инсулину, непереносимости глюкозы, диабета 2 типа, диабета 1 типа, гипертензии или атерогенной дислипидемии (или сочетания двух или более указанных метаболических факторов риска), атеросклероза, артериосклероза, ишемической болезни сердца, болезни периферических артерий, инсульта и болезни мелких кровеносных сосудов. Их действие на указанные заболевания может быть результатом или может быть связано с их влиянием на массу тела, или может не зависеть от них. Таким образом, настоящее изобретение обеспечивает применение соединения согласно настоящему изобретению при лечении заболевания согласно описанию выше у индивидуума, нуждающегося в таком лечении. Также настоящее изобретение обеспечивает соединение для применения в способе лечения, в частности в способе лечения заболевания согласно описанию выше. Также настоящее изобретение обеспечивает применение соединения согласно настоящему изобретению в изготовлении лекарственного средства для лечения состояния согласно описанию выше. Указанное соединение согласно настоящему изобретению можно вводить в виде компонента комбинированной терапии с агентом для лечения диабета, ожирения, дислипидемии или гипертензии. В таких случаях указанные два активных агента можно вводить совместно или по-отдельности и в виде части той же лекарственной формы или в виде отдельных лекарственных форм. Таким образом, соединения согласно настоящему изобретению (или их соли) можно использовать в сочетании с противодиабетическим агентом, включая, но не ограничиваясь ими, метформин, сульфонилмочевину, глинид, ингибитор DPP-IV, глитазон или инсулин. Согласно предпочтительному варианту реализации указанное вещество или его соль применяют в сочетании с инсулином, ингибитором DPP-IV,сульфонилмочевиной или метформином, в частности сульфонилмочевиной или метформином, для получения соответствующего контроля гликемии. Согласно более предпочтительному варианту реализации указанное соединение или его соль применяют в сочетании с метформином, сульфонилмочевиной, инсулином или аналогом инсулина для достижения соответствующего контроля гликемии. Примеры аналогов инсулина включают, но не ограничиваются ими, Лантус, Новорапид, Хумалог, Новомикс, Актрафан НМ,Левемир и Апидра. Также указанное соединение или его соль можно применять в сочетании со средством против ожирения, включая, но не ограничиваясь ими, агонист рецепторов глюкагоноподобного пептида-1, пептидYY или его аналог, антагонист рецептора каннабиноидов 1, ингибитор липазы, агонист рецептора меланокортина 4 или антагонист рецептора меланин-концентрирующего гормона 1. Также указанное соединение или его соль можно применять в сочетании со средством против гипертензии, включая, но не ограничиваясь ими, ингибитор ангиотензинконвертирующего фермента, блокатор рецептора ангиотензина II, диуретик, бета-блокатор или блокатор кальциевых каналов. Указанное соединение или его соль можно применять в сочетании со средством против дислипидемии, включая, но не ограничиваясь ими, статин, фибрат, ниацин или ингибитор адсорбции холестерина. Описание фигур На фиг. 1 изображен фармакокинетический профиль соединения 13 после подкожного (s.c.) введения мышам в дозе 100 нМоль/кг. На фиг. 2 изображено влияние подкожного введения соединения 11 в течение 21 дня (10 нМоль/кг) на переносимость пероральной глюкозы мышами линии C57BL/6J, содержавшихся в течение длительного периода времени на высокожировой диете. Данные представлены в виде среднееСОС. На фиг. 3. Мышам, больным диабетом (db/db), вводили носитель или соединение 7 (12,7 нмоль/кг) в течение 4 недель и определяли уровень HbA1c (Cobas примечания по применению: А 1 С-2) в образцах цельной крови (20 мкл), полученных от обработанных мышей. HbA1c (%) определяли у каждой мыши,вычитая из HbA1c (%) через 4 недели HbA1c (%) в начальный момент времени. HbA1c (%) мышейdb/db, которым в течение 4 недель вводили носитель, = 100%.(Р = 0,03, Т-критерий Стьюдента). На фиг. 4. изображено влияние подкожного введения соединения 11 в течение 21 дня на масу тела мышей линии C57BL/6J, содержавшихся в течение длительного периода времени на высокожировой диете. Данные представлены в виде среднееСОС. На фиг. 5. Мышам модели ожирения, вызванного питанием (DIO), вводили носитель или соединение 7 (12,7 нмоль/кг) в течение 4 недель и получали плазму из забранных образцов крови. В каждом образце плазмы определяли общий холестерин (Cobas примечания по применению: CHOL2)(Р 0.0001, Т-критерий Стьюдента). Данные представлены в виде среднееСОС. На фиг. 6. Мышам модели ожирения, вызванного питанием (DIO), вводили носитель или соединение 7 (12,7 нмоль/кг) в течение 4 недель и получали плазму из забранных образцов крови. В каждом образце плазмы определяли уровнь LDL и HDL (Cobas; примечания по применению HDLC3 и LDLC).(Р 0.0001, Т-критерий Стьюдента). Данные представлены в виде среднееСОС. На фиг. 7 изображено влияние введения s.c. агонистов GluGLP-1 на увеличение массы тела у мышей линии C57BL/6J, которых содержали на высокожировой диете. Данные представлены в виде среднееСОС. Черная линия: носитель (PBS), серая линия: небольшая дозв (0,5 нмоль/кг), пунктир: большая доза (5 нмоль/кг). На фиг. 8. изображено влияние острого введения s.c. соединения 7 на переносимость пероральной глюкозы через 2, 4, 6, 8, 10 и 12 ч после введения дозы на на мышах линии C57BL/6J, которых содержали на высокожировой диете. Данные представлены в виде среднееСОС. На фиг. 9. изображено влияние введения s.c. соединения 7 и эксендина-4 на потребление пищи/массу тела у молодых худых мышей линии C57BL/6J. Данные представлены в виде среднееСОС.=р 0.05 по сравнению с молодыми худыми мышами, которым вводили носитель. Данные представлены в виде среднееСОС. На фиг. 10 изображено влияние введения s.c. соединения 7 и эксендина-4 на общее потребление пищи/массу тела у старых мышей с ожирением линии C57BL/6J. Данные представлены в виде среднееСОС. =р 0.05 по сравнению со старыми мышами с ожирением, которым вводили носитель. На фиг. 11 изображено влияние s.c. введения носители, эксендина-4 (10 нмоль/кг) и соединения 11(10 нмоль/кг) на концентрацию липидов в плазме у старых мышей с ожирением линии C57BL/6J. Данные представлены в виде среднееСОС. На фиг. 12. Мышам вводили два раза в сутки соединение 1 и соединение 11 (в двух дозах 0,5 и 5 нмоль/кг) или носитель в течение 2 недель. В день умерщвления забирали печень и взвешивали ее. Соединение 1 в высокой дозе приводило к существенному увеличению соотношения "масса печени/масса тела". Соединение 11 не влияло на соотношение "масса печени/масса тела" в обеих дозах (0,5 и 5 нмоль/кг). Соединение 1 является неацилированным двойным агонистом GluGLP-1, и соединение 11 является ацилированными двойным агонистом GluGLP-1 длительного действия (фиг. 12). На фиг. 13. Мышам, больным диабетом (db/db), вводили носитель или соединение 11 (12,7 нмоль/кг) в течение 4 недель, и определяли уровень HbA1c (Cobas примечание по применению: А 1 С-2) в образцах цельной крови (20 мкл), полученных от обработанных мышей. Значение HbA1 с (%) рассчитывали для каждой мыши, вычитая из HbA1 с (%) мыши через 4 недели HbA1 с (%) в начальный момент времени. HbA1 с (%) мышей db/db, которым в течение 4 недель вводили носитель= 100%.(Р = 0.03, Ткритерий Стьюдента). Подробное описание изобретения В настоящем описании используются однозначные и трехзначные обозначения природных аминокислот, а также принятые трехзначные обозначения других аминокислот, включая Aib (-аминомасляная кислота), Orn (орнитин), Dbu (2,4-диаминомасляная кислота) и Dpr (2,3-диаминопропановая кислота). Термин нативный глюкагон обозначает природный глюкагон человека, имеющий последовательность H-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-ValGln-Trp-Leu-Met-Asn-Thr-OH. Пептидные последовательности соединений согласно настоящему изобретению отличаются от нативного глюкагона по меньшей мере в положениях 18, 20, 24, 27, 28 и 29. Также они могут отличаться от нативного глюкагона в одном или более из положений 12, 16 и 17. Нативный глюкагон содержит Arg в положении 18. Соединение согласно настоящему изобретению содержат небольшой гидрофобный остаток Ala в положении 18, который, как считают, повышает его активность в отношении рецепторов глюкагона и GLP-1, но в особенности рецептора GLP-1. По-видимому, остатки в положениях 27, 28 и 29 нативного глюкагона обеспечивают значительную избирательность по отношению к рецептору глюкагона. Замены в этих положениях в нативной последовательности глюкагона, в частности Ala в положении 29, могут повышать активность и/или избирательность в отношении рецептора GLP-1, вероятно без значительного снижения активности в отношении рецептора глюкагона. Другие примеры, которые могут быть включены в соединения согласно настоящему изобретению, содержат Leu в положении 27 и Arg в положении 28. Более того, Arg в положении 28 может быть особенно предпочтительным, если присутствует Glu в положении 24, с которым он может образовать внутримолекулярный мостик, т.к. это может усилить его влияние на активность в отношении рецептора GLP-1. Замена природного остатка Met в положении 27 (например, на Leu, Lys или Glu) также снижает риск окисления, повышая, таким образом, химическую стабильность указанных соединений. Замена природного остатка Asn в положении 28 (например, на Arg или Ser) также снижает риск дезаминирования в кислом растворе, повышая, таким образом, химическую стабильность указанных соединений. Активность и/или избирательность в отношении рецептора GLP-1 без риска значительной потери активности в отношении рецептора глюкагона, также можно повысить посредством введения остатков,которые способствуют стабилизации структуры альфа-спирали в С-концевой части пептида. Может быть желательно, но не необходимо, чтобы указанная спиральная часть молекулы имела амфипатические свойства. Этому может помочь введение таких остатков, как Leu в положении 12 и/или Ala в положении 24. В качестве дополнения или альтернативы можно вводить заряженные остатки в одно или более из положений 16, 20, 24 или 28. Таким образом, все остатки в положениях 24 и 28 могут быть заряжены, все остатки в положениях 20, 24 и 28 могут быть заряжены, или все остатки в положениях 16, 20, 24 и 28 могут быть заряжены. Например, остаток в положении 20 может представлять собой His или Arg, в частности His. Остаток в положении 24 может представлять собой Glu, Lys или Arg, в частности Glu. Остаток в положении 28 может представлять собой Arg. Введение внутримолекулярного мостика в указанной части молекулы, согласно описанию выше, также может способствовать стабилизации спиральной структуры, например, между положениями 24 и 28. Замена одного или обоих природных остатков Gln в положениях 20 и 24 также снижает риск дезаминирования в кислом растворе, повышая, таким образом, химическую стабильность указанных соединений. Замена в нативной последовательности глюкагона в положении 12 (т.е. Arg или Leu) может повышать активность в отношении обоих рецепторов и/или избирательность в отношении рецептора GLP-1. Укорочение С-конца пептида не снижает активность в отношении обоих рецепторов и/или избирательность в отношении рецептора GLP-1. В частности укорочение в положении 29 или в обоих положениях 28 и 29 не снижает активность ни в отношении одного, ни другого рецептора. Боковая цепь из одного или остатков, обозначенная X (т.е. положения 16, 17, 20, 24, 27 и 28 и/или 30 при наличии) конъюгирована с липофильным заместителем. Подразумевается, что конъюгация липофильного заместителя с конкретной боковой цепью может влиять на (например, снижать) определенные преимущества, которые может обеспечивать неконъюгированная боковая цепь в этом положении. Авторы изобретения обнаружили, что соединения согласно настоящему изобретению обеспечивают равновесие между преимуществами, которые дат ацилирование и преимуществами определенных замен в природной последовательности глюкагона. Композиции согласно настоящему изобретению также могут находиться в смеси или быть соединены, например, посредством ковалентных, гидрофобных или электростатических взаимодействий, с носителем лекарственного средства, системой для доставки лекарственных средств и усовершенствованной системой для доставки лекарственных средств для дальнейшего повышения стабильности соединения,повышения биодоступности, растворимости, снижения побочных эффектов, соблюдения хронотерапии,известной специалистам в данной области техники, и повышения соблюдения пациентами режима приема препарата, или их сочетания. Примеры носителей, систем для доставки лекарственных средств и усовершенствованных систем для доставки лекарственных средств включают, но не ограничиваются ими,полимеры, например, целлюлозу и ее производные, полисахариды, например, декстран и его производные, крахмал и его производные, поливиниловый спирт, полимеры акрилата и метакрилата, полимолочную и полигликолевую кислоту и их блочные сополимеры, полиэтиленгликоли, белки-носители, например, альбумин, гели, например, термогели, например, блочные сополимерные системы, известные специалистам в данной области техники, мицеллы, липосомы, микросферы, наночастицы, жидкие кристаллы и их дисперсии, L2 фазу и их дисперсии, известные специалистам в области техники распределения фаз в системе жидкость-вода, полимерные мицеллы, различные эмульсии, самоэмульгирующиеся, самомикроэмульгирующиеся агенты, циклодекстрины и их производные и дендромеры. Другие группы исследователей пытались увеличить период полувыведения двойного агонистаGluGLP-1 посредством получения его производного с PEG (WO 2008/101017). Однако, оказалось, что более эффективно получать указанное производное по С-концу молекулы, чем производное центральной части каркаса пептида, и активность указанных соединений по-прежнему остается сниженной по сравнению с активностью соответствующего неизмененного пептида. В отличие от этого, соединения согласно настоящему изобретению сохраняют высокую активность в отношении рецепторов глюкагона и GLP-1, имея длительный фармакокинетический профиль по сравнению с соответствующими неизмененными пептидами. Нативный глюкагон содержит Ser в положении 16. Было показано, что его замена на Ala, Gly илиThr значительно снижает активацию аденилатциклазы рецептором глюкагона (Unson et al. Proc. Natl.Acad. Sci. 1994, 91, 454-458). Таким образом, нельзя было ожидать, что получение производного с заменой на липофильную группу в положении 16 позволит получить соединения, сохраняющие активность в отношении рецептора глюкагона, что неожиданно показано на примере соединений согласно настоящему описанию. В публикации WO 2008/101017 обнаружено, что для наименьшей потери активности желательно наличие отрицательно заряженного остатка в положении 16. Традиционно считается, что наличие основных аминокислот в положениях 17 и 18 необходимо для полной активации рецептора глюкагона (Unson et al. J. Biol. Chem. 1998, 273, 10308-10312). Авторы настоящего изобретения обнаружили, что если в положении 18 находится аланин, замена на гидрофобную аминокислоту в положении 17 все-таки позволяет получать высоко активное соединение. Даже соединения, в которых аминокислота в положении 17 заменена на липофильный заменитель, почти полностью сохраняют активность в отношении рецепторов глюкагона и GLP-1, а также демонстрируют существенно более длительный фармакокинетический профиль. Это справедливо даже, если произошло преобразование лизина в положении 17, что превращает боковую цепь из основного амина в нейтральную амидную группу. Также авторы настоящего изобретения обнаружили, что соединения, ацилированные в положении 20, по-прежнему являются высоко активными двойными агонистами, несмотря на результаты других исследований, согласно которым в положении 20 должна быть замена на основную аминокислоту, имеющую в боковой цепи 4-6 атомов, для усиления активности в отношении рецептора GLP-1 по сравнению с активностью в отношении рецептора глюкагона (WO 2008/101017). Соединения согласно настоящему описанию обладают активностью в отношении рецептора к GLP-1 и глюкагона, если в положении 20 произошла замена на лизин и ацилирование. Синтез пептидов Пептидный компонент соединений согласно настоящему изобретению можно получить с помощью стандартных способов синтеза, систем экспрессии рекомбинатных генов или любого другого подходящего способа. Таким образом, указанный пептид можно синтезировать различными способами, включая,например, способ, который включает:(а) синтезирование указанного пептида способами твердофазного или жидкофазного синтеза пептидов поэтапно или посредством сборки фрагментов и выделение и очистку конечного пептидного продукта;(б) экспрессию конструкции нуклеиновой кислоты, которая кодирует указанный пептид в клетке хозяина, и выделение продукта экспрессии из культуры клеток хозяина; или(в) осуществление экспрессии конструкции нуклеиновой кислоты, которая кодирует указанный продукт, in vitro в бесклеточной системе и выделение продукта экспрессии; или любое сочетание указанных способов (а), (б) и (в) для получения фрагментов указанного пептида с последующим лигированием фрагментов для получения указанного пептида и его выделение. Может являться предпочтительным синтез аналогов согласно настоящему описанию способом твердофазного или жидкофазного синтеза пептидов. В связи с этим приводится ссылка на публикациюWO 98/11125 и среди прочих Fields, GB et al., 2002, "Principles and practice of solid-phase peptide synthesis" в Synthetic Peptides (2 издание) и примеры в публикации. Липофильный заместитель Одна или более боковых цепей аминокислот соединения согласно настоящему изобретению конъюгированы с липофильным заместителем Z1. Считается, что указанный липофильный заместитель связывает альбумин в кровотоке, защищая таким образом соединения согласно настоящему изобретению от разрушения ферментами, что может увеличить период полувыведения указанных соединений. Также он способен изменять активность указанного соединения, например, в отношении рецептора глюкагона и/или рецептора GLP-1. Согласно некоторым вариантам реализации боковая цепь только одной аминокислоты конъюгирована с липофильным заместителем. Согласно другим вариантам реализации каждая из боковых цепей двух аминокислот конъюгирована с липофильным заместителем. Согласно другим вариантам реализации каждая из боковых цепей трех или более аминокислот конъюгирована с липофильным заместителем. Если соединение содержит два или более липофильных заместителя, они могут быть одинаковыми или различными. Липофильный заместитель Z1 может быть ковалентно связан с атомом в боковой цепи аминокислоты или в качестве альтернативы может быть конъюгирован с боковой цепью аминокислоты с помощью спейсера Z2. Термин "конъюгирован" в настоящем описании используют для описания физического прикрепления одной определенной химической группы к другой и структурных взаимодействий между указанными группами. Это не требует использования какого-то определенного способа синтеза. Если он присутствует, спейсер Z2 используют для создания промежутка между соединением и липофильной группой. Липофильный заместитель может быть присоединен к боковой цепи аминокислоты или спейсеру посредством эфира, сульфонового эфира, тиоэфира, амида или сульфониламида. Также следует понимать, что указанный липофильный заместитель включает ацильную группу, сульфонильную группу,атом азота, атом кислорода или атом серы, которые образуют часть указанного эфира, сульфонового эфира, тиоэфира, амида или сульфониламида. Предпочтительно ацильная группа указанного липофильного заместителя образует часть амида или эфира с боковой цепью аминокислоты или спейсера. Указанный липофильный заместитель может включать углеводородную цепь, содержащую 10-24 атома углерода, например 10-22 атомов углерода, например 10-2 атомов углерода. Предпочтительно она содержит по меньшей мере 11 атомов углерода, предпочтительно она содержит 18 атомов углерода или меньше. Например, указанная углеводородная цепь может содержать 12, 13, 14, 15, 16, 17 или 18 атомов углерода. Указанная углеводородная цепь может быть линейной или разветвленной и может быть насыщенной или ненасыщенной. Из обсуждения выше будет понятно, что указанная углеводородная цепь предпочтительно замещена на группу, которая образует часть прикрепления к боковой цепи аминокислоты или спейсер, например ацильную группу, атом азота, кислорода или серы. Наиболее предпочтительно указанная углеводородная цепь замещена на ацил и поэтому указанная углеводородная цепь может быть частью алканоиловой группы, например, группой додеканоил, 2-бутилоктаноил, тетрадеканоил,Гексадеканоил, гептадеканоил, октадеканоил или эйкозаноил. Как уже упоминалось выше, липофильный заместитель Z1 может быть конъюгирован с боковой цепью аминокислоты с помощью спейсера Z2. Если он присутствует, указанный спейсер присоединен к указанному липофильному заместителю и указанной боковой цепи аминокислоты. Указанный спейсер может быть прикреплен к указанному липофильному заместителю и указанной боковой цепи аминокислоты независимо в виде эфира, сульфонового эфира, тиоэфира, амида или сульфонамида. Соответственно он может содержать две функциональные группы, независимо выбранные из ацила, сульфонила, атома азота, атома кислорода или атома серы. Указанный спейсер может состоять из линейной углеводородной цепочки С 1-10 или более предпочтительно линейной углеводородной цепочки C1-5. Более того указанный спейсер может быть иметь один или более заместителей, выбранных из C1-6 алкила, С 1-6 аминоалкила, С 1-6 гидроксиалкила и C1-6 карбоксиалкила. Указанный спейсер может представлять собой, например, остаток природной или искусственной аминокислоты. Например, указанный спейсер может представлять собой остаток Gly, Pro, Ala, Val, Leu,He, Met, Cys, Phe, Tyr, Trp, His, Lys, Arg, Gin, Asn, -Glu, -Glu, -Lys, Asp, Ser, Thr, Gaba, Aib, -Ala (т.е. 3-аминопропаноил), 4-аминобутаноила, 5-аминопентаноила, 6-аминогексаноила, 7-аминогептаноила, 8 аминооктаноила, 9-аминононаноила, 10-аминодеканоила или 8-амино-3,6-диоктаноила. Согласно некоторым вариантам реализации указанный спейсер представляет собой остаток Glu, -Glu, -Lys, -Ala (т.е. 3-аминопропаноил), 4-аминобутаноила, 8-аминооктаноила или 8-амино-3,6-диоксаоктаноила. Согласно настоящему изобретению -Glu и изo-Glu используются взаимозаменяемо. Указанная боковая цепь аминокислоты, с которой конъюгирован указанный липофильный заместитель, представляет собой боковую цепь остатка Glu, Lys, Ser, Cys, Dbu, Dpr или Orn. Например, она может представлять собой боковую цепь остатка Lys, Glu или Cys. Если две или более боковых цепей имеют липофильный заместитель, их можно независимым образом выбирать из указанных остатков. Таким образом, указанная боковая цепь аминокислоты включает карбоксильную, гидроксильную, тиоловую,амидную или аминогруппу, для образования эфира, сульфонильного эфира, тоэфира, амида или сульнамида со спейсером или липофильным заместителем. Пример липофильного заместителя, включающего липофильную группу Z1 и спейсер Z2, представлен на формуле ниже: Согласно настоящему описанию указанная боковая цепь остатка Lys из пептида согласно формуле I ковалентно соединена со спейсером -Glu (Z2) посредством амидной связи. Гексадеканоиловая группа(Z1) ковалентно соединена со спейсером -Glu посредством амидной связи. Указанное сочетание липофильной группы и спейсера, конъюгированного с остатком Lys, можно обозначать с помощью сокращения K (ГексадеканоилGlu), например, в формулах определенных соединений. -Glu также можно обо- 17022816 значать как изо-Glu, И гексадеканоиловую группу можно обозначать как пальмитоиловую группу. Таким образом, будет очевидно, что обозначение (ГексадеканоилGlu) равносильно обозначениям (изоGlu(Palm или (изо-Glu(пальмитоил, например, в публикации PCT/GB 2008/004121. Специалисту в данной области техники будут известны подходящие способы получения соединений согласно настоящему изобретению. Примеры способов представлены в публикациях WO98/08871,WO 00/55184, WO 00/55119, Madsen et al (J. Med. Chem. 2007, 50, 6126-32) и Knudsen et al. 2000 (J. MedChem. 43, 1664-1669). Пегилированные и/или ацилированные соединения имеют короткий период полувыведения (Т 1/2),что приводит к резкому повышению концентраций агониста GluGLP-1. Таким образом, рецептор глюкагона подвергается интенсивному воздействию агониста глюкагона один раз (или два раза) в сутки ежедневно в течение периода лечения. Без связи с какой-либо теорией, по-видимому, повторное внезапное действие агонистов глюкагона на GluR нарушает перенос липидов и свободных жирных кислот между печенью и жировой тканью, что приводит к накоплению жира в печени. Постоянное действие на GluR агонистов глюкагона блокирует накопление жира в печени. Было обнаружено, что повторная обработка глюкагоном или двойными агонистами короткого действия GluGLP-1 приводит к увеличению печени за счет отложения жира и гликогена (Chan et al., 1984.Exp. Mol. Path. 40, 320-327). Повторная обработка ацилированными двойными агонистами GluGLP-1 длительного действия не приводит к изменению размера печени (увеличению или уменьшению) у пациентов с нормальным весом,но нормализует уровень липидов в печени (Day et al., 2009; Nat. Chem. Biol. 5, 749-57). Эффективность Связывание соответствующих соединений с рецепторами GLP-1 или глюкагона (Glu) можно использовать в качестве показателя активности агониста, но обычно предпочитают использовать биологический способ анализа, в котором измеряют передачу сигнала внутри клетки, вызванную связыванием указанного соединения с соответствующим рецептором. Например, активация рецептора глюкагона агонистом глюкагона будет стимулировать образование циклического АМФ (цАМФ) в клетке. Также активация рецептора GLP-1 агонистом GLP-1 будет стимулировать образование цАМФ. Таким образом, образование цАМФ в соответствующих клетках, экспрессирующих один из указанных рецепторов, можно использовать для наблюдения за активностью рецептора, представляющего интерес. Поэтому для определения активности агониста в отношении обоих типов рецепторов можно использовать соответствующую пару типов клеток, каждый из которых экспрессирует только один из рецепторов. Специалисту в данной области техники известны соответствующие типы анализов, а их примеры представлены ниже. Рецептор GLP-1 и/или глюкагона могут иметь последовательность рецепторов согласно описанию в примерах. Например, при анализе можно использовать рецептор глюкагона человека(Glucagon-R), имеющий первичный номер доступа GI: 4503947 (NP000151.1), и/или рецептор глюкагоноподобного рецептора человека 1 (GLP-1R), имеющий первичный номер доступа Gl:166795283(NP002053.3). (Если ссылаются на последовательности белков-предшественников, следует, конечно,понимать, что в анализах может быть использован зрелый белок, не содержащий сигнальную последовательность). Значения ЕС 50 можно использовать в качестве количественной меры активности агониста в отношении данного рецептора. Значение ЕС 50 представляет собой концентрацию соединения, необходимую для проявления активности соединения, равной половине максимальной активности, в данном анализе. Таким образом, например, можно считать, что соединение, ЕС 50 [GLP-1R] которого ниже, чем ЕС 50[GLP-1R] нативного глюкагона по результатам определенного анализа, обладает большей активностью в отношении GLP-1R, чем глюкагон. Соединения согласно настоящему описанию в большинстве случаев представляют собой двойные агонисты Glu-GLP-1, т.е. они могут стимулировать образование цАМФ как рецептором глюкагона, так и рецептором GLP-1. Стимуляцию каждого рецептора можно измерить в независимых анализах и после этого сравнить друг с другом. Сравнивая значение ЕС 50 для рецептора глюкагона (EC50 [Glucagon-R]) со значением ЕС 50 для рецептора GLP-1 (EC50 [GLP-1R]), можно определить относительную избирательность данного соединения в отношении рецептора глюкагона (%). Таким же образом можно определить относительную избирательность в отношении GLP-1R: Относительная избирательность соединения позволяет непосредственно сравнивать его действие на рецептор GLP-1 или рецептор глюкагона с его действием на другой рецептор. Например, чем больше относительная избирательность соединения в отношении GLP-1, тем более эффективным является соединение в отношении рецептора GLP-1 по сравнению с рецептором глюкагона. С помощью способов анализов описанных ниже авторы обнаружили, что относительная избирательность рецептора GLP-1 в отношении глюкагона человека составляет приблизительно 5%. Соединения согласно настоящему изобретению имеют более высокую относительную избирательность в отношении GLP-1R, чем глюкагон человека. Таким образом, при определенном уровне активности агониста рецептора глюкагона человека указанное соединение будет проявлять повышенный уровень активности агониста GLP-1R (т.е. большую активность в отношении рецептора GLP-1), чем глюкагон. Следует понимать, что абсолютная активность конкретного соединения в отношении рецепторов глюкагона и GLP-1 может быть выше, ниже или приблизительно равна активности нативного глюкагона человека, если соединение имеет соответствующую относительную избирательность в отношении GLP-1R. Однако у указанных соединений согласно настоящему описанию значение ЕС 50 [GLP-1R] может быть меньше, чем у глюкагона человека. Указанные соединения могут иметь меньшее значение ЕС 50[GLP-1R], чем глюкагон человека, при сохранении значения ЕС 50 [Glucagon-R], которое не больше, чем в 10 раз выше ЕС 5 о [Glucagon-R] глюкагона человека, которое не больше, чем в 5 раз выше ЕС 50 [Glucagon-R] глюкагона человека, или которое не больше, чем в 2 раза выше EC50 [Glucagon-R] глюкагона человека. Желательно, чтобы ЕС 50 любого данного соединения как для рецептора глюкагона человека (Glucagon-R), так и для GLP-1R была меньше 1 нМ. Соединения согласно настоящему изобретению могут иметь ЕС 50 [Glucagon-R] не больше, чем в 2 раза выше, чем глюкагон. Соединения согласно настоящему изобретению могут иметь ЕС 50 [Glucagon-R] не больше, чем в 2 раза выше, чем глюкагон, и иметь ЕС 50 [GLP-1R] не больше, чем половина, одна пятая или одна десятая ЕС 50 [GLP-1R] глюкагона человека. Относительная избирательность указанных соединений в отношении рецептора GLP-1 может быть больше 5% и меньше 95%. Например, указанные соединения могут иметь относительную избирательность 5-20%, 10-30%, 20-50%, 30-70% или 50-80% или 30-50%, 40-60%, 50-70% или 75-95%. Терапевтическое применение Соединения согласно настоящему изобретению могут обеспечивать привлекательный способ лечения нарушений метаболизма, включая ожирение и сахарный диабет. Диабет включает группу метаболических заболеваний, для которых характерна гипергликемия, возникающая в результате нарушения секреции инсулина и/или действия инсулина. Острые признаки диабета включают обильную выработку мочи, приводящую к компенсаторной жажде и избыточному потреблению пищи, ухудшение зрения, беспричинную потерю веса, вялость и изменения энергетического метаболизма. Хроническая гипергликемия при диабете вызывает продолжительное разрушение, дисфункцию и отказ различных органов, в частности глаз, почек, нервов, сердца и кровеносных сосудов. Диабет классифицируют на диабет 1 типа,диабет 2 типа и гестационный сахарный диабет в зависимости от патогенетических особенностей. Диабет 1 типа составляет 5-10% все случаев диабета и вызывается аутоиммунным разрушением инсулин-секретирующих бета-клеток поджелудочной железы. На долю диабета 2 типа приходится 90-95% случаев заболевания диабетом, и он является результатом целого набора нарушений метаболизма. Диабет 2 типа является следствием того, что собственная выработка инсулина становится недостаточной для поддержания уровня глюкозы в плазме ниже порогового. Термин гестационный диабет обозначает любую степень непереносимости глюкозы, обнаруженную во время беременности. Преддиабетические состояния включают нарушенный уровень глюкозы натощак и нарушенную переносимость глюкозы, и обозначают те состояния, которые возникают, если уровень глюкозы в крови повышен, но ниже уровня, которые установлены для диагностики диабета. Большая часть людей, страдающих от диабета 2 типа и преддиабетических состояний, имеет повышенный риск заболеваемости и смертности из-за высокого распространения дополнительных метаболических факторов риска, включая центральное ожирение (избыточная жировая ткань вокруг внутренних органов живота), атерогенную дислипидемию (нарушения уровня жира в крови, включая высокий уровень триглицеридов, низкий уровень HDL холестерина и/или высокий уровень LDL холестерина, которые способствуют отложению бляшек в стенке артерий), повышенное давление (гипертензия), склонность к тромбообразованию (например, высокий уровень фибриногена или ингибитора активатора плазминогена-1 в крови) и провоспалительное состояние (например, повышенный уровень С-реактивного белка в крови). В свою очередь, ожирение увеличивает риск развития преддиабетических состояний, диабета 2 типа, а также некоторых типов рака, обструктивного апноэ сна и болезни желчного пузыря. Дислипидемия повышает риск развития сердцечно-сосудистых заболеваний. Липопротеины высокой плотности (HDL) имеют клиническое значение, т.к. существует обратная зависимость между концентрацией HDL в плазме и риском развития атеросклероза. Большая часть холестерина, отложенного в атеросклеротических бляшках, происходит от LDL, и поэтому повышенные концентрации липопротеинов низкой плотности (LDL) в большой степени связаны с атеросклерозом. Соотношение HDL/LDL является показателем риска развития атеросклероза и, в частности атеросклероза коронарных сосудов. Без связи с определенной теорией, считают, что указанные соединения согласно настоящему изобретению действуют как двойные агонисты GluGLP-1. Двойные агонисты могут сочетать действие глюкагона, например, на обмен жиров, с действием GLP-1, например, на уровень глюкозы в крови и потребление пищи. Поэтому они могут ускорять устранение лишней жировой ткани, вызывать устойчивую потерю веса и улучшать гликемический контроль. Также двойные агонисты GluGLP-1 могут влиять на снижение факторов риска развития сердечнососудистых заболеваний, таких как высокий уровень холестерина и LDL-холестерина. Таким образом, соединения согласно настоящему описанию можно использовать в качестве фармацевтических агентов для предотвращения увеличения массы тела, обеспечения потери веса, снижения избыточной массы тела или лечения ожирения (например, благодаря контролю аппетита, кормления,потребления пищи, потребления калорий и/или расхода энергии), включая патологическое ожирение, а также сопутствующие заболевания и состояния, включая, но не ограничиваясь ими, воспаление, вызванное ожирением, заболевание желчного пузыря, вызванное ожирением, и апноэ сна, вызванное ожирением. Также соединения согласно настоящему изобретению можно использовать для лечения устойчивости к инсулину, переносимости глюкозы, преддиабетических состояний, повышенного уровня глюкозы в крови натощак, диабета 2 типа, гипертензии, дислипидемии (или сочетания указанных метаболических факторов риска), атеросклероза, артериосклероза, ишемической болезни сердца, заболевания периферических артерий и инсульта. Представлены все состояния, которые могут быть вызваны ожирением. Однако действия соединений согласно настоящему изобретению на указанные состояния могут осуществляться в целом или частично посредством влияния на массу тела или могут не зависеть от этого. Фармацевтические композиции Соединения согласно настоящему изобретению или их соли, могут быть приготовлены в виде фармацевтических композиций, подготовленных для хранения или введения, которые обычно содержат терапевтически эффективное количество соединения согласно настоящему изобретению или его соли в фармацевтически приемлемом носителе. Терапевтически эффективное количество соединения согласно настоящему изобретению будет зависеть от способа введения, вида млекопитающего, которое лечат, и физических особенностей конкретного рассматриваемого млекопитающего. Перечисленные факторы и их роль в определении указанного количества известны специалистам в области медицины. Это количество и способ введения могут быть адаптированы для достижения оптимальной эффективности, а также могут зависеть от таких факторов, как вес, питание, сопутствующее лечение, и других факторов, хорошо известных специалистам в области медицины. Размеры доз и режим дозирования наиболее подходящий для человека, могут быть определены по результатам, полученными с помощью настоящего изобретения,и могут быть подтверждены надлежащим образом спланированными клиническими испытаниями. Эффективную дозу и протокол лечения можно определить традиционными способами, начиная с низких доз на лабораторных животных, а затем увеличивая дозу при наблюдении действия, а также систематически изменяя режим дозирования. Многочисленные факторы могут быть приняты во внимание врачом при определении оптимальной дозы для данного пациента. Такие факторы известны специалистам в данной области науки. Термин "фармацевтически приемлемый носитель" включает любые стандартные фармацевтические носители. Фармацевтически приемлемые носители для терапевтического использования хорошо известны в данной области техники и описаны в Remington's Pharmaceutical Sciences, Mack Publishing Co. (A. R.Gennaro edit. 1985). Например, могут быть использованы стерильный физиологический раствор и фосфатный солевой буфер, имеющие слабокислый или физиологический рН. Буферные агенты могут преставлять собой фосфат, цитрат, ацетат, трис/гидроксиметил аминометан (TRIS), N-трис (гидроксиметил) метил-3-аминопропансульфоновую кислоту (TAPS), бикарбонат аммония, диэтаноламин, гистидин, который является предпочтительным буфером, аргинин, лизин или ацетат или их смеси. Термин также включает любые агенты, перечисленные в Фармакопее США для применения для животных, включая человека. Термин "фармацевтически приемлемая соль" относится к соли этих соединений. Соли включают фармацевтически приемлемые соли, такие как кислотно-аддитивные соли и основные соли. Примеры аддитивных солей включают соли хлористо-водородной кислоты, соли лимонной кислоты и соли уксусной кислоты. Примеры основных солей включают соли, в которых катион выбран из катионов щелочных металлов, таких как натрий и калий, щелочно-земельных металлов, таких как кальций и ионы аммонияN(R3)3(R4), где R3 и R4 независимо обозначает необязательно замещенный C1-6-алкил, необязательно замещенный С 2-6-алкенил, необязательно замещенный арил или необязательно замещенный гетероарил. Другие примеры фармацевтически приемлемых солей описаны в публикации "Remington's PharmaceuticalSciences", 17 издание Ed. Alfonso R. Gennaro (Ed.), Mark Publishing Company, Easton, PA, U.S.A., 1985 и более поздних изданиях и в Энциклопедии Фармацевтической Технологии. Термин "лечение" обозначает подход, направленный на достижение благоприятных или желаемых клинических результатов. В целях настоящего изобретения, благоприятные или желаемые клинические результаты включают, но не ограничиваются ими, облегчение симптомов, уменьшение степени развития заболевания, стабилизированное (т.е. не ухудшающееся) состояние заболевания, задержку или замедление развития заболевания, улучшение или ослабление болезненного состояния и ремиссию (как частичную, так и полную), как заметные, так и незаметные. Термин "лечение" также может означать продленное выживания по сравнению с ожидаемым выживанием в отсутствии лечения. Термин лечение означает вмешательство, осуществляемое с целью предупреждения развития или изменения патологии заболевания. Соответственно термин "лечение" относится как к терапевтическому лечению и предотвращению, так и профилактическим мерам. Те, кто нуждается в лечении, включают тех, кто уже страдает от заболевания, а также тех, у которых заболевание должно быть предотвращено. Под лечением понимают ингибирование или снижения роста патологии или симптомов (например, увеличение массы тела, гипергликемия) по сравнению с отсутствием лечения, и не обязательно полное прекращение соответствующего заболевания. Фармацевтические композиции могут находиться в виде дозированной лекарственной формы. В таком виде композиция разделена на отдельные дозы, содержащие соответствующее количество активного компонента. Дозированная лекарственная форма может представлять собой упакованное лекарственное средство, при этом упаковка содержит определенные количества препаратов, например упакованные таблетки, капсулы и порошки во флаконах или ампулах. Дозированная лекарственная форма также может представлять собой капсулу, облатку или таблетку, или же она может представлять собой необходимое количество любой из этих упакованных форм. Она может быть представлена в виде одноразовой дозы для инъекций, например, в виде ручки. Композиции могут быть сформулированы для любого подходящего пути и способа введения. Фармацевтически приемлемые носители или разбавители включают носители или разбавители, которые используются в лекарственных формах, подходящих для перорального, ректального, назального или парентерального (включая подкожное, внутримышечное, внутривенное, внутрикожное и трансдермальное) введения. Композиции могут быть удобно представлены в виде дозированной лекарственной формы и могут быть получены любым из способов, хорошо известных в области фармацевтики. Подкожный или трансдермальный способы введения могут быть особенно подходящими для соединения согласно настоящему описанию. Комбинированная терапия Указанные соединения согласно настоящему изобретению можно вводить в качестве компонента комбинированной терапии со средством для лечения диабета, ожирения, дислипидемии или гипертензии. В таких случаях два активных агента можно вводить совместно или по-отдельности и в качестве компонента одного лекарственного средства или в виде отдельного лекарственного средства. Таким образом, соединение согласно настоящему изобретению (или его соль) можно применять в сочетании с антидиабетическими средствами, включая, но не ограничиваясь ими, метформин, сульфонилмочевину, глинид, ингибитор DPP-IV глитазон или инсулин. Согласно предпочтительному варианту реализации соединение или его соль применяют в сочетании с инсулином, ингибитором DPP-IV, сульфонилмочевиной или метформином, в частности с сульфонилмочевиной или метформином, для достижения адекватного контроля гликемии. Согласно более предпочтительному варианту реализации указанное соединение или его соль используется в сочетании с инсулином или аналогом инсулина для достижения адекватного контроля гликемии. Примеры аналогов инсулина, включают, но не ограничиваются ими, препараты Лантус, Новорапид, Хумалог, НовоМикс,Актрафан НМ, Левемир и Апидра. Указанное соединение или его соль можно в дальнейшем применять в сочетании со средством против ожирения, включая, но не ограничиваясь ими, агонист рецептора глюкагон-подобного пептида 1,пептид YY или его аналог, антагонист рецептора каннабиноидов 1, ингибитор липазы, агонист рецептора меланокортина 4 или антагонист рецептора меланин концентрирующего гормона 1. Соединение или его соль можно в дальнейшем применять в сочетании со средством против гипертензии, включая, но не ограничиваясь ими, ингибитор ангиотензинпревращающего фермента, блокатор рецептора ангиотензина II, диуретики, бета-блокаторы или блокаторы кальциевых каналов. Указанное соединение или его соль можно в дальнейшем применять в сочетании со средством против дислипидемии, включая, но не ограничиваясь ими, статин, фибрат, ниацин и/или ингибитор всасывания холестерина. Методы Схема синтеза ацилированных аналогов глюкагона: Твердофазный Fmoc-синтез пептидов осуществляли с помощью системы для синтеза пептидов СЕМ Liberty. Перед использованием смолу TentaGel S Ram (1 г; 0,25 ммоль/г) размачивали в NMP (10 мл) и наносили между пробиркой и химическим реактором с использованием DCM и NMP. Сопряжение:Fmoc-аминокислоту в NMP/DMF/DCM (1:1:1; 0,2 М; 5 мл) добавляли к смоле в микроволновой ячейке СЕМ Discover вместе с HATU/NMP (0.5 М; 2 мл) и DIPEA/NMP (2.0 М; 1 мл). Реакционную смесь нагревали до 75 С в течение 5 мин, при этом азот в виде пузырей проходил через смесь. Затем смолу промывали NMP (410 мл). Отщепление защитных групп: Пиперидин/NMP (20%; 10 мл) добавляли в смесь для начального отщепления защитных групп и указанную смесь нагревали с помощью микроволнового излучения (30 с; 40 С). Осушали химический реактор и вносили вторую часть пиперидин/NMP (20%; 10 мл) и повторно нагревали (75 С; 3 мин). Затем смолу промывали NMP (6 х 10 мл). Ацилирование боковой цепи:Fmoc-Lys(ivDde)-OH или другую аминокислоту с ортогональной защитной группой боковой цепи вводили в положение ацилирования. Затем проводили Вос-защиту на N-конце каркаса пептида с использованием Вос 2 О или в качестве альтернативы с использованием Вос-защищенной аминокислоты при последнем сопряжении. Пока пептид оставался иммобилизованным на смоле, ортогональную защитную группу боковой цепи селективно отщепляли с использованием свежеприготовленного раствора гидразин гидрата (2-4%) в NMP два раза по 15 мин. Незащищенную боковую цепь лизина сопрягали с Fmoc-GluOtBu или другой аминокислотой спейсера, защиту которой снимали с помощью пиперидина, и которую ацилировали с помощью липофильной группы с использованием способа сопряжения пептидов согласно описанию выше. Использовали следующие сокращения:TIS: триизопропилсилан Расщепление: Смолу промывали EtOH (310 мл) и Et2O (310 мл) и высушивали до постоянного веса при комнатной температуре (r.t.). Неочищенный пептид отщепляли от смолы с помощью TFA/TIS/вода (95/2.5/2.5; 40 мл, 2 ч; r.t.). Большую часть TFA удаляли при пониженном давлении, осаждали неочищенный пептид,промывали три раза диэтиленом и высушивали до постоянного веса при комнатной температуре. Очистка способом ВЭЖХ неочищенного пептида: Неочищенный пептид очищали до степени более 90% с помощью препаративной обращенофазовой ВЭЖХ с использованием PerSeptive Biosystems VISION Workstation, оборудованной колонкой С-18 (5 см, 10 мкм), и коллектора фракций и пропускали со скоростью 35 мл/мин при градиенте буфера А (0.1% TFA, вода) и буфера Б (0.1% TFA, 90% MeCN, вода). Фракции анализировали способом аналитической ВЭЖХ м МС и соответствующие фракции накапливали и лиофилизировали. Конечный продукт подвергали ВЭЖХ и МС. Получение линий клеток, экспрессирующих рецепторы глюкагона и GLP-1 человека кДНК, кодирующие рецептор глюкагона человека (Glucagon-R) (основной номер доступа Р 47871) или рецептор глюкагоноподобного пептида-1 человека (GLP-1R) (основной номер доступа Р 43220) были клонированы из библиотеки кДНК ВС 104854 (MGC: 132514/Image: 8143857) или ВС 112126 (MGC: 138331/IMAGE: 8327594), соответственно. ДНК, кодирующую рецептор глюкагона человека или GLP-1R, амплифицировали методом ПЦР с использованием праймеров, кодирующих терминальные сайты рестрикции для субклонирования. Праймеры 5'-конца дополнительно кодировали консенсусную последовательность Козак для обеспечения эффективной трансляции. Точность ДНК, кодирующих рецептор глюкагона человека(Glucagon -R) и GLP-1R, подтверждали с помощью секвенирования ДНК. ПЦР-продукты, кодирующие рецептор глюкагона человека или GLP-1R, субклонировали в вектор экспрессии млекопитающих, содержащий маркер устойчивости к неомицин (G418). Векторами экспрессии млекопитающих, кодирующими рецептор глюкагона человека или GLP-1R,трансфицировали клетки НЕК 293 с использованием стандартного кальций-фосфатного метода трансфекции. Через 48 ч после трансфекции клетки высевали для проведения клонирования методом серийных разведений, и отбирали клоны, добавляя в культуральную среду 1 мг/мл G418. Три недели спустя были отобраны 12 выживших колоний клеток, экспрессирующих рецептор глюкагона человека и GLP-1R, их культивировали и проводили анализ эффективности в отношении рецептора глюкагона человека и GLP1R согласно описанию ниже. Для профилирования соединений отобрали один клон, экспрессирующий рецептор глюкагона человека, и один клон, экспрессирующий GLP-1R. Анализы эффективности в отношении рецептора глюкагона и рецептора GLP-1 Клетки HEK293, экспрессирующие рецептор глюкагона человека или GLP-1R человека, сеяли при плотности 40,000 клеток/лунка в 96-луночные микротитровальные планшеты, покрытые 0,01% поли-Lлизином и культивировали в течение суток в 100 мкл питатльной среды. В день проведения анализа кондиционированную среду удаляли и клетки промывали 200 мкл раствора Тирода. Клетки инкубировали в 100 мкл раствора Тирода, содержавшего возрастающие концентрации исследуемых пептидов, 100 мкМIBMX и 6 мМ глюкозы в течение 15 мин при 37 С. Реакцию останавливали добавлением 25 мкл 0,5 МHCI и выдерживали на льду в течение 0 мин. Количество цАМФ определяли с помощью набора FlashPlate cAMP Perkin-Elmer. EC50 и относительные эффективности по сравнению с контрольными соединениями (глюкагон и GLP-1) определяли с помощью автоматического построения кривой. Биоаналитический способ анализа для количественного опредления агонистов пептида Glu-GLP1 в плазме мышей после подкожного введения Мышам вводили подкожно (s.c.) 100 нмоль/кг агонистов. Мышей забивали и получали кровь в следующие моменты времени; 0,5, 2, 4, 6, 16 и 24 ч. Образцы плазмы исследовали методом осаждения белков с последующей твердофазной экстракцией (SPE) и жидкой хроматографией и масс-спектрометрией(LC-MS). Тест на переносимость пероральной глюкозы (OGTT), уровень липидов и масса тела у нормальных мышей линии C57BI/6J, длительно содержавшихся на высокожировой диете, и HbA1 с у мышей db/db Самцы мышей (линии C57BI/6J, длительно содержавшихся на высокожировой диете, линииC57BI/6J, кратковременно содержавшихся на высокожировой диете, и db/db) адаптировались к условиям и имели свободный доступ к пище и воде. Их содержали группами по 5-6 мышей в помещении с контролируемым освещеним, температурой и влажностью (цикл 12 ч свет: 12 ч темнота, свет включали/выключали в 20.00/8.00; 24 С; 50% относительная влажность). Животным вводили s.c. 100 мкл контроля (раз в сутки) в течение 3 дней для адаптации животных к условиям содержания и инъекциям. Образцы крови получали из глаз или кончика хвоста. Перед началом лечения животных случайным образом распределяли по группам. Два раза в день мышам вводили s.c. агонист GluGLP-1 или носитель (объем для введения = 2,5 мл/кг). Во время исследования ежедневно регистрировали массу тела и использовали ее для введения дозы пептида, подобранной в зависимости от массы тела. Растворы пептидов готовили непосредственно перед введением дозы. Тесты на переносимость пероральной глюкозы (OGTT) проводили после небольшой голодовки животных. Для предотвращения искажающего действия приема пищи животных подвергали голоданию в течение всех OGTT. После введения дозы пептида проводили забор начальных образцов крови. После этого перорально вводили дозу глюкозы (1 г/кг), растворенной в фосфатном буфере (рН = 7.4) (5 мл/кг),и животных возвращали в домашние клетки (t = 0). Уровень глюкозы в цельной крови (BG) определяли в моменты времени t=15 мин, t=30 мин, t=60 мин, t=90 мин и t=120 мин. Концентрации BG определяли глюкозооксидазным методом в капле крови ( 5 мкл; Elite Autoanalyser, Bayer, Дания) согласно инструкциям изготовителя. Определение HbA1 с Можно оценивать долгосрочное действие соединения на уровень глюкозы у пациента по определению уровня гемоглобина А 1 С (HbA1c). HbA1 с представляет собой гликозилированный гемоглобин, уровень которого в клетке отражает средний уровень глюкозы, которая действует на клетку в течение ее жизни. У мышей HbA1 с является биологическим маркером среднего уровня глюкозы в течение предшествующих 4 недель, т.к. превращение гемоглобина в HbA1 с ограничено продолжительностью жизни эритроцитов в течение 47 дней (AbbrechtLittell, 1972; J. Appl. Physiol. 32, 443-445). Определение HbA1 с основано на Turbidimetric INhibition ImmunoAssay (TINIA), в ходе которогоHbA1 с в образце взаимодействует с антителами к HbA1c с образованием растворимых комплексов антиген-антитело. При добавлении полигаптенов они взаимодействуют с лишними антителами к HbA1 с с образованием нерастворимого комплекса антитело-гаптен, который можно определить методами турбидиметрии. Свободный гемоглобин в гемолизированном образце превращается в производное, имеющее определенный спектр поглощения, который можно измерить бихроматически во время фазы предварительной инкубации. Конечный результат выражается в виде относительного содержания HbA1c в общем гемоглобине (Cobas указание по применению А 1 С-2). Определение уровня холестерина Указанный анализ представляет собой ферментативный колориметрический метод. В присутствии ионов магния декстран сульфан избирательно образует водорастворимые комплексы с LDL, VLDLA и хиломикронами, которые устойчивы к PEG-модифицированным ферментам. HDL холестерин определяется ферментативно с помощью холестерин-эстеразы и холестерин-оксидазы, сопряженными с PEG через аминогруппы. Эфиры холестерина распадаются ферментативно до свободного холестерина и жирных кислот. Холестерин HDL ферментативно окисляется до холест-4-ен-3-она и Н 2 О 2, и образованная Н 2 О 2 определяется колориметрически (Cobas; указание по применению HDLC3). При прямом определении LDL используется избирательная мицеллярная растворимость LDL под действием неионного детергента и взаимодействие сахара и липопротеинов (VLDL и хиломикронов). Сочетание сахара и детергента позволяет избирательно определять LDL в плазме. Принцип анализа такой же, как в случае холестерина и HDL, но из-за сахара и детергента только эфиры LDL-холестерин распадаются до свободного холестерина и жирных кислот. Свободный холестерин затем окисляется и образованная Н 2 О 2 определяется колориметрически (Указание по применению LDLC, Cobas). Увеличение массы тела на мышах линии C57BL/6J, содержавшихся на высокожировой диете Самцов мышей C57BI/6J в возрасте 6 недель адаптировали к новым условиям с трехразовым кормлением по высокожировой диете (D12492, Research Diet Inc., New Brunswick, USA) и доступом к воде. Животным вводили инъекции s.c. 100 мкл носителя в течение 3 дней для адаптации животных к условиям и инъекциям. Животным вводили два раза в сутки эксендин-4, соединение 3, соединение 6, соединение 7, соединение 8, соединение 11 и соединение 12 или носитель. На протяжении исследования ежедневно записывали массу тела и использовали это для введения дозы пептида в зависимости от массы тела. Всех животных умерщвляли в один день методом цервикальной дислокации. Переносимость пероральной глюкозы через 2, 4, 6, 8, 10 и 12 ч после введения дозы средств на мышах линии C57BL/6J, содержавшихся на высокожировой диете Самцов мышей C57BI/6J в возрасте 6 недель адаптировали к новым условиям с трехразовым кормлением по высокожировой диете (D12492, Research Diet Inc., New Brunswick, USA) и доступом к воде. Животным вводили инъекции носителя s.c. в течение 3 дней для адаптации животных к условиям и инъекциям. Из конца хвоста забирали образцы крови и определяли уровень глюкозы. Концентрацию глюкозы (мМ) определяли глюкозооксидазным методом в капле крови ( 5 мкл; Contour Autoanalyser, Bayer,Denmark) согласно инструкции производителя. Через 4 недели соблюдения высокожировой диеты животных взвешивали и использовали массу тела для введения дозы пептида в зависимости от массы тела. Тест на переносимость пероральной глюкозы (OGTT) проводили после подвергания животных голоданию в течение 4 ч. Через 2, 4, 6, 8, 10 и 12 ч после введения дозы пептида или носителя забирали начальный образец крови (t=-0 мин). Сразу после этого вводили пероральную дозу глюкозы (1 г/кг) и животных возвращали в их домашние клетки (t = 0). Уровни BG определяли через t=15 мин, t=30 мин, t=60 мин иt=90 мин. Непосредственно после забора крови всех животных умерщвляли под действием анестезии СО 2 методом цервикальной дислокации. Потребление пищи молодыми худыми мышами линии C57BL/6J и старыми мышами с ожирением линии C57BL/6J Мышей линии C57BL/6J содержали на высокожировой диете в течение 11 дней и мышей линииC57BL/6J содержали на высокожировой диете в течение 52 недель. За три дня до начала исследования мышей помещали в отдельные клетки и взвешивали. За 4 дня до начала исследования их адаптировали к обращению и введению средств с помощью ежедневных инъекций s.c. За день до начала исследования пищу забирали в 20:00. В день исследования мышей взвешивали и вводили им инъекции s.c. эксендина 4, соединения 7 или носителя в момент времени t=0 ч (8:00) и t=12 ч (20:00). Непосредственно после введения средств (t=0) мышам давали предварительно взвешенную пищу и определяли общее потребление пищи, взвешивая оставшуюся пищу через t=1, 2, 4, 8, 12 и 24 ч. После взвешивания пищи и животных в момент времени t=24 ч мышей умерщвляли посредством цервикальной дислокации. Образование цАМФ в гепатоцитах Методика Первичные гепатоциты человека, полученные от Lonza Walkersvill, Inc., аккуратно промывали буфером ТВ и инкубировали при 37 С с пептидами, растворенными в буфере ТВ, в который добавляли 100 мкМ IBMX и 0,1% казеин в течение 15 мин. Перед добавлением к клеткам указанные растворы пептидов нагревали до 37 С. Реакцию останавливали добавлением 25 мкл ледяного 0,5 М HCI и клетки инкубировали на льду в течение 60 мин. Содержание цАМФ в лунках определяли, добавляя 25 мкл кислых вытяжек лунок в 75 мкл раствора буфера ацетата натрия, рН 6,2, в 96-луночные микротитровальные планшеты "FlashPlates", покрытые сцинтиллятором и антителами к цАМФ. После добавления 100 мкл раствора 10 Ci [125I]цАМФ в каждую лунку, планшеты инкубировали в течение ночи при 4 С, опустошали их и количество [125I]цАМФ, связавшегося с планшетами FlashPlates, определяли с помощью программы"[125I]сАМР flashplate 10 min" на TopCount NXT. Пептиды исследовали в концентрациях в пределах 0,11000 нМ. Анализ данных и статистика Количество цАМФ, образованного в клетках, определяли по стандартной кривой, построенной по данным о количестве цАМФ. Значения ЕС 50 определяли, подставляя данные количества цАМФ в формулу ниже с использованием Sigma Plot: Приведенные ниже примеры представлены для иллюстрации настоящего изобретения. Масса печени/масса тела мышей линии C57BL/6J Два раза в сутки мышам вводили s.c. соединение 1 и соединение 11 (в двух дозах: 0,5 и 5 нмоль/кг) или носитель в течение 2 недель. Во время проведения исследования ежедневно записывали массу тела и использовали это для введения доз пептида в зависимости от массы тела. В день, когда животных умерщвляли, изымали печень и определяли ее вес. Примеры Пример 1. Синтез соединений и свойства пептидов Пример синтеза: Соединение 9 синтезировали методом твердофазного Fmoc-синтеза с помощью синтезатора СЕМLiberty с использованием смолы TentaGel S Ram (1,17 г; 0,23 ммоль/г) согласно описанию выше. В положении 17 использовали Fmoc-Lys(ivDde)-OH и для каркаса пептида использовали псевдопролины FmocPhe-Thr (Psi. Me, Me про)-ОН и Fmoc-Asp(OtBu)-Ser (.Psi., Me, Me про)-ОН. После синтеза каркаса пептида на смоле ручным способом отщепляли N-концевую Fmoc-группу с последующей Вос-защитой с использованием Вос 2 О (226 мг) и DIEA (54 мкл) в DCM. Затем с помощью свежеприготовленного раствора гидразин-гидрата/NMP (4%; 215 мин) отщепляли группу ivDde. После этого на синтезаторе СЕМLiberty оставшиеся два элементарных блока Fmoc-Glu-OtBu и гексадекановую кислоту добавляли к незащищенной боковой цепи лизина. Пептид отщепляли от смолы согласно описанию выше и осуществляли его очистку на колонкеGemini-NX (5 см, 10 мкм, С 18) при пропускании смеси буфера А (0,1% TFA, вода) и буфера Б (0,1% TFA,90% MeCN, вода). Проводили элюцию продукта градиентом 25-65% буфера Б в течение 47 мин и фракции (9 мл) собирали с помощью коллектора фракций. Проводили аналитическую ВЭЖХ и МС соответствующих, и фракции с чистотой выше 95% собирали и лиофилизировали с получением белого порошка. Выход продукта весом 72 мг имел чистоту 97% по результатам аналитической ВЭЖХ и молекулярную массу 3697,05 Да по результатам МС (3696,97 Да). Пример 2. Эффективность в отношении рецепторов к GLP-1 и глюкагону Эффективность агонистов GluGLP-1 определяли посредством действия на клетки, экспрессирующие рецептор глюкагона человека (hGlucagonR) и hGLP-1R, возрастающих концентраций ацилированных соединений из списка и измерения образованного цАМФ согласно описанию в Методах. Результаты представлены в табл. 1. Таблица 1. Значения ЕС 50 ацилированных соединений для рецептора GLP-1 и рецептора глюкагона Остатки, обозначенные с помощью , образуют внутримолекулярное лактамное кольцо. Таблица 1 а. Значения EC50 дополнительных соединений согласно настоящему изобретению В случае соединения 28 H-H-Aib-QGTFTSDYSKYLDS-K (Гексадеканоил-E)-AAHDFVEWLLSANH2 также может быть записано как H-H-Aib-QGTFTSDYSKYLDS-K (Гексадеканоил-Glu)AAHDFVEWLLSA-NH2 Пример 3. Исследование фармакокинетики Определили фармакокинетические профили различных ацилированных соединений. Вычисленные значения Т 1/2 представлены в табл. 2 по сравнению с неацилированным соединением 1.: Только две временные точки использовали для вычисления ТА Все ацилированные соединения имели улучшенный Т 1/2 по сравнению с соединением 1. Пример фармакокинетического профиля для соединения 13 представлен на фиг. 1. Пример 4. Тест на переносимость пероральной глюкозы на мышах DIO Исследовали влияние s.c. введения в течение 21 дней соединения 11 (10 нмоль/кг) на переносимость пероральной глюкозы на мышах линии C57BL/6J, которых в течение длительного периода времени содержали на высокожировой диете. Мышей, которых содержали на высокожировой диете, подвергали голоданию и забирали первичные образцы крови для определения уровня глюкозы в крови натощак(t=0). Затем перорально вводили глюкозу (1 г/кг из расчета 5 мл/кг) и определяли уровень глюкозы в крови через t=30 мин, t=60 мин и t=120 мин. Соединение 11 существенно повышало переносимость глюкозы (двухфакторный дисперсионный анализ). Данные представлены в виде среднееСОС (стандартная ошибка среднего). Пример 5. HbA1 с у мышей db/db через 28 дней Мышам, больным диабетом (db/db), вводили носитель или соединение 7 в течение 4 недель и определяли уровень HbA1c (Cobas примечания по применению: А 1 С-2) в образцах цельной крови (20 мкл),полученных от обработанных мышей. Результаты представлены на фиг. 3. Значение HbA1c (%) определяли для каждой мыши, вычитая из HbA1 с (%) через 4 недели HbA1c (%) в начальный момент времени. Обработка соединением 7 существенно снижала HbA1c (%) (Р = 0,03; Т-критерий Стьюдента) по сравнению с носителем. Пример 6. Сниженная масса тела Определяли влияние s.c. введения соединения 11 в течение 21 дней на массу тела в отделенном периоде на мышах линии C57BI/6J, которых в течение длительного периода времени содержали на высокожировой диете. Самцам мышей C57BI/6J, содержавшихся на высокожировой диете (HFD), вводили(b.i.d.; s.c.) соединение 11 (10 нмоль/кг) или носитель. Ежедневно записывали массу тела и учитывали ее при введении дозы пептида, подобранной в зависимости от массы тела на протяжении исследования. Данные представлены в виде среднееСОС на фиг. 4. Соединение 11 заметно снижало массу тела(р 0.05). Пример 7. Общий холестерин и соотношение HDL/LDL Мышам модели ожирения, вызванного питанием (DIO), вводили носитель или соединение 7 в течение 4 недель и получали плазму из забранных образцов крови. В каждом образце плазмы определяли общий холестерин, LDL и HDL (Cobas примечания по применению: CHOL2, HDLC3 и LDLC). Результаты представлены на фигурах 5 и 6. Обработка соединением 7 существенно (Р 0.0001, Т-критерий Стьюдента) снижала концентрации общего холестерина (на фиг. 5) и существенно (Р 0.0001, Ткритерий Стьюдента) увеличивало соотношение HDL/LDL (на фиг. 6). Пример 8. Увеличение массы тела у мышей линии C57BL/6J, содержавшихся на высокожировой диете. Исследовали влияние s.c. введения в течение 10 дней эксендина-4, соединения 8, соединения 3, соединения 7, соединения 11, соединения 12 и соединения 6 на мышей линии C57BL/6J, содержавшихся в течение короткого периода времени на высокожировой диете. Самцам мышей C57BI/6J, содержавшихся на высококалорийной диете (HFD), вводили пептид (b.i.d.; s.c.) (0,5 и 5 нмоль/кг) или носитель. Ежедневно записывали массу тела и учитывали ее при введении дозы пептида, подобранной в зависимости от массы тела. Данные представлены на фиг. 7 в виде среднееСОС. Контрольный пептид (эксендин-4) так же, как соединение 8, приводил к существенному снижению увеличение массы тела в обеих дозах (0,5 и 5 нмоль/кг). Соединение 3, соединение 7, соединение 11 и соединение 12 существенно снижали увеличение массы тела в большой дозе (5 нмоль/кг), но не в малой дозе (0,5 нмоль/кг) (фиг. 7). Соединение 6 существенно снижало увеличение массы тела только в небольшой дозе (0,5 нмоль/кг). Пример 9. Переносимость пероральной глюкозы через 2, 4, 6, 8, 10 и 12 ч после введения дозы на мышах линии C57BL/6J, содержавшихся на высокожировой диете. После голодания в течения 4 ч на животных проводили тест на переносимость пероральной глюкозы (OGTT). Через 2, 4, 6, 8, 10 и 12 ч после введения дозы соединения 7 или носителя забирали начальный образец крови (t=-0 мин). Непосредственно после этого вводили перорально дозу глюкозы (1 г/кг). Уровень глюкозы в крови определяли через t=15 мин, t=30 мин, t=60 мин и t=90 мин. Непосредственно после забора образца крови животных умерщвляли под действием анестезии СО 2 методом цервикальной дислокации. Исследование показало, что подкожное введение соединения 7 (10 нмоль/кг) существенно улучшает переносимость глюкозы (по результатам сниженного AUC во время теста на переносимость пероральной глюкозы) через 2, 4, 6, 8, 10 и 12 ч после введения дозы мышам линии C57BL/6J, содержавшимся на высококалорийной диете. Пример 10. Потребление пищи молодыми худыми мышами линии C57BL/6J и старыми мышами с ожирением линии C57BL/6J Мышей C57BL/6J содержали на высокожировой диете в течение 11 дней, и мышей C57BL/6J содержали на высокожировой диете в течение 52 недель. В день проведения эксперимента мышей взвешивали и вводили s.c. в виде инъекций эксендрин-4,соединение 7 или носитель в момент времени t=0 ч (8:00) и t=12 ч (20:00). Непосредственно после введения (t=0) мышам вводили взвешенное количество пищи и определяли общее потребление пищи посредством взвешивания остатков пищи через t=1, 2, 4, 8, 12 и 24 ч. У молодых худых мышей соединение 7 статистически значимо (р 0,05) снижало потребление пищи в течение периодов времени 0-4, 0-8, 0-12 и 0-24. Эксендин-4 статистически значимо (р 0.05) снижал потребление пищи в течение периодов времени 0-2, 0-4, 0-8, 0-12 и 0-24.
МПК / Метки
МПК: A61P 5/48, A61K 38/26, C07K 14/605
Метки: ацилированные, аналоги, глюкагона
Код ссылки
<a href="https://eas.patents.su/30-22816-acilirovannye-analogi-glyukagona.html" rel="bookmark" title="База патентов Евразийского Союза">Ацилированные аналоги глюкагона</a>
Предыдущий патент: Антагонист рецептора cgrp
Следующий патент: Лечение желудочно-кишечных расстройств
Случайный патент: Способ производства очищенного природного газа из природного газа, содержащего воду и диоксид углерода












