Противопаразитарные пиразолы
Формула / Реферат
1. Соединение формулы (I)
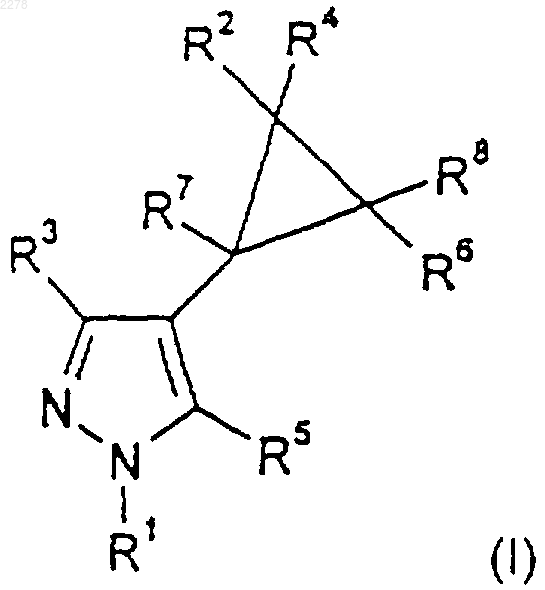
либо его приемлемая в фармацевтике, ветеринарии или сельском хозяйстве соль, либо приемлемый в фармацевтике, ветеринарии или сельском хозяйстве сольват каждого из них, где
R1 представляет собой 2,4,6-трехзамещенный фенил, где 2- и 6-заместители, каждый независимо, выбраны из галогена-, а 4-заместитель выбран из С1-C4алкила, возможно замещенного одним или более чем одним галогеном-, С1-C4алкокси, возможно замещенного одним или более чем одним галогеном-, S(O)nС1-С4алкила, возможно замещенного одним или более чем одним галогеном-, галогена- и пентафтортио; или 3,5-двузамещенный пиридин-2-ил, где 3-заместителем является галоген-, а 5-заместитель выбран из С1-C4алкила, возможно замещенного одним или более чем одним галогеном-, С1-C4алкокси, возможно замещенного одним или более чем одним галогеном-, S(O)nС1-С4алкила, возможно замещенного одним или более чем одним галогеном-, галогена- и пентафтортио;
R3 представляет собой С1-С4-алкил, возможно замещенный гидрокси или одним или более чем одним галогеном-; циано, C1-C5-алканоил или фенил;
R5 представляет собой водород, С1-С4-алкил, амино или галоген-;
R2 и R4, каждый независимо, выбраны из водорода, С1-C4алкила, фтора-, хлора- и брома-, либо вместе с атомом углерода, к которому они присоединены, образуют С3-С6циклоалкильную группу;
R6 и R8, каждый независимо, выбраны из водорода, С1-С4алкила, фтора-, хлора- и брома-; либо, когда R2 и R4 не образуют часть циклоалкильной группы, R2 и R6 вместе с атомами углерода, к которым они присоединены, могут образовывать С5-С7циклоалкильную группу;
R7 представляет собой водород, С1-C4 алкил, возможно замещенный одним или более чем одним галогеном-, или С1-С4алкокси; и
n равно 0, 1 или 2.
2. Соединение по п.1, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил, 2,6-дихлор-4-пентафтортиофенил, 2,4,6-трихлорфенил или 3-хлор-5-трифторметилпиридин-2-ил; R3 представляет собой метил, этил, проп-2-ил, 1-гидроксиэтил, 2-гидроксипроп-2-ил, дифторметил, дихлорметил, трифторметил, циано, формил, ацетил или фенил; R5 представляет собой водород, метил, амино или хлор-; R2 и R4, каждый независимо, выбраны из водорода, метила, фтора-, хлора- и брома-, либо вместе с атомом углерода, к которому они присоединены, образуют циклопропильную, циклобутильную или циклопентильную группу; R6 и R8, каждый независимо, выбраны из водорода, метила, хлора- и брома-; либо, когда R2 и R4 не образуют часть циклоалкильной группы, R2 и R6 вместе с атомами углерода, к которым они присоединены, могут образовывать циклопентановую или циклогексановую группу; и R7 представляет собой водород, метил, этил, трифторметил, хлордифторметил, пентафторэтил, гептафторпропил или метокси.
3. Соединение по п.2, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил, 2,6-дихлор-4-пентафтортиофенил или 3-хлор-5-трифторметилпиридин-2-ил; R3 представляет собой циано; R5 представляет собой водород или амино; R2 и R4 являются одинаковыми и представляют собой водород, хлор- или бром-; R6 и R8 представляют собой водород; и R7 представляет собой водород, трифторметил или хлордифторметил.
4. Соединение по п.3, где соединение формулы (I) выбрано из
3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразола;
(-)-3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразола;
3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(1-трифторметилциклопропил)пиразола;
3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-пентафтортиофенил)пиразола;
3-циано-4-(2,2-дихлорциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразола;
4-(1-хлордифторметилциклопропил)-3-циано-1-(2,6-дихлор-4-трифторметилфенил) пиразола;
1-[(3-хлор-5-трифторметил)пиридин-2-ил]-3-циано-4-(2,2-дибромциклопропил)пиразола;
5-амино-3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразола;
5-амино-3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-пентафтортиофенил)пиразола;
5-амино-3-циано-4-(2,2-дихлорциклопропил)-1-(2,6-дихлор-4-пентафтортиофенил)пиразола; и
5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(1-трифторметилциклопропил)пиразола.
5. Фармацевтический состав, содержащий соединение формулы (I), либо его приемлемую в фармацевтике соль, либо приемлемый в фармацевтике сольват каждого из них по любому из пп.1-4, вместе с фармацевтически приемлемым разбавителем или носителем.
6. Фармацевтический состав по п.5, который адаптирован для местного введения.
7. Ветеринарный или сельскохозяйственный препарат, содержащий соединение формулы (I), либо его приемлемую в ветеринарии или сельском хозяйстве соль, либо приемлемый в ветеринарии или сельском хозяйстве сольват каждого из них по любому из пп.1-4, вместе с приемлемым в ветеринарии или сельском хозяйстве разбавителем или носителем.
8. Ветеринарный или сельскохозяйственный препарат по п.7, который адаптирован для местного введения.
9. Применение соединения формулы (I), либо его приемлемой в фармацевтике соли, либо приемлемого в фармацевтике сольвата каждого из них по любому из пп.1-4 в качестве лекарства.
10. Применение соединения формулы (I), либо его приемлемой в ветеринарии или сельском хозяйстве соли, либо приемлемого в ветеринарии или сельском хозяйстве сольвата каждого из них по любому из пп.1-4 в качестве паразитицида.
11. Применение фармацевтического состава по п.5 или 6 в качестве лекарства.
12. Применение ветеринарного или сельскохозяйственного препарата по п.7 или 8 в качестве паразитицида.
13. Применение соединения формулы (I), либо его приемлемой в фармацевтике или ветеринарии соли, либо приемлемого в фармацевтике или ветеринарии сольвата каждого из них по любому из пп.1-4 для производства противопаразитарного лекарства для человека или животного.
14. Применение фармацевтического состава по п.5 или 6 для производства противопаразитарного лекарства для человека.
15. Применение ветеринарного препарата по п.7 или 8 для производства противопаразитарного лекарства для животного.
16. Соединение формулы (VII)
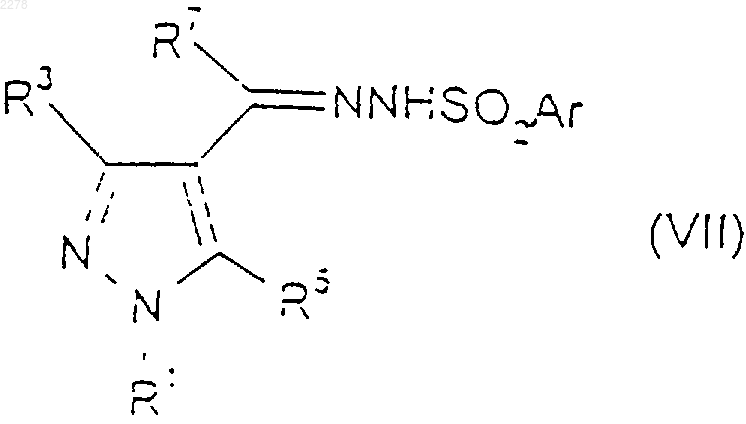
где Аr представляет собой фенил или нафтил, каждый из которых возможно замещен С1-C4 алкилом, С1-С4-алкокси или галогеном-; R5 представляет собой водород, С1-С4алкил или галоген-; R7 представляет собой водород или С1-С4алкил, возможно замещенный одним или более чем одним галогеном-; a R1 и R3 такие, как определено в п.1.
17. Соединение по п.16, где Аr представляет собой 4-метилфенил.
18. Способ лечения паразитарной инвазии у животного (включая человека), при котором указанное животное обрабатывают эффективным количеством соединения формулы (I), либо его приемлемой в фармацевтике или ветеринарии соли, либо приемлемого в фармацевтике или ветеринарии сольвата каждого из них по любому из пп.1-4, либо фармацевтического состава по п.5 или 6 или ветеринарного препарата по п.7 или 8, содержащих любое из вышеупомянутого.
19. Способ обработки паразитарной инвазии в месте локализации, при котором указанное место локализации обрабатывают эффективным количеством соединения формулы (I), либо его приемлеьющ в ветеринарии или сельском хозяйстве соли, либо приемлемого в ветеринарии или сельском хозяйстве сольвата каждого из них по любому из пп.1-4, либо ветеринарного или сельскохозяйственного препарата, содержащего любое из вышеупомянутого, по п.7 или 8.
20. Способ по п.19, где местом локализации является шкура или мех животного, либо поверхность растения, либо почва вокруг этого растения, которые должны быть обработаны.
21. Способ получения соединения по п.1, где R2 и R4 являются оба хлором- либо оба бромом-, при котором соединение формулы (II)
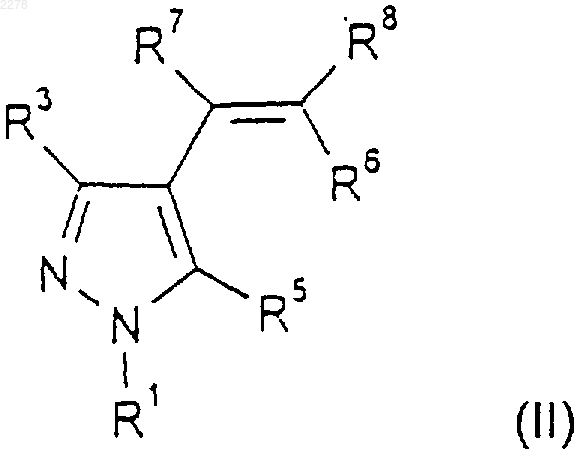
где R1, R3, R5, R6, R7 и R8 такие, как определено в п.1, обрабатывают хлороформом или бромоформом в присутствии основания;
возможно с последующим образованием приемлемой в фармацевтике, ветеринарии или сельском хозяйстве соли целевого продукта или приемлемого в фармацевтике, ветеринарии или сельском хозяйстве сольвата каждого из них.
22. Способ по п.21, где основание представляет собой концентрированный водный раствор гидроксида щелочного металла и взаимодействие проводят в условиях катализа фазового переноса с использованием в качестве катализатора четвертичной аммониевой соли в подходящем растворителе при температуре от примерно комнатной температуры до примерно температуры дефлегмации реакционной среды.
23. Способ по п.22, где основание представляет собой концентрированный водный раствор гидроксида натрия, катализатором является бензилтриэтиламмонийхлорид, а растворителем является дихлорметан, возможно в присутствии небольшого количества этанола.
24. Способ по любому из пп.21-23, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил, 2,6-дихлор-4-пентафтортиофенил или 2,4,6-трихлорфенил; R3 представляет собой этил, проп-2-ил, 1-гидроксиэтил, 2-гидроксипроп-2-ил, дифторметил, дихлорметил, трифторметил, циано, формил, ацетил или фенил; R5 представляет собой водород, метил, амино или хлор;
каждый из R2 и R4 выбран из хлора- и брома-; каждый из R6 и R8 выбран из водорода; и R7 представляет собой водород.
25. Способ по п.24, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил или 2,6-дихлор-4-пентафтортиофенил; R3 представляет собой циано; R5 представляет собой водород или амино; R2 и R4 являются одинаковыми и представляют собой хлор- или бром-; R6 и R8 представляют собой водород; и R7 представляет собой водород.
26. Способ по п.25, где получаемое соединение по п.1 выбрано из
3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразола;
(-)-3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразола;
3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-пентафтортиофенил)пиразола;
3-циано-4-(2,2-дихлорциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразола;
5-амино-3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразола;
5-амино-3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-пентафтортиофенил)пиразола; и
5-амино-3-циано-4-(2,2-дихлорциклопропил)-1-(2,6-дихлор-4-пентафтортиофенил)пиразола.
27. Способ получения соединения по п.1, где R2 и R4 являются оба хлором- либо оба бромом-, при котором соединение формулы (II)
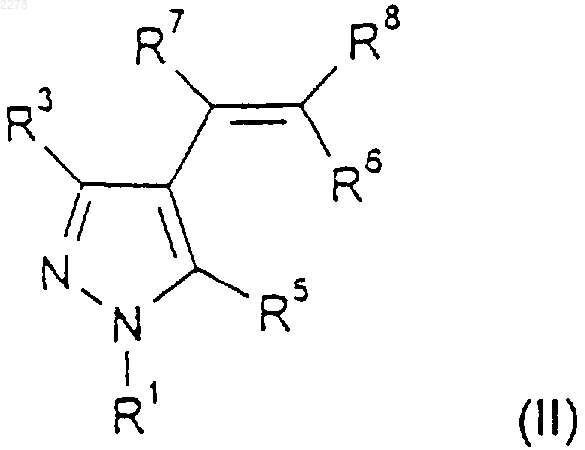
где R1, R3, R5, R6, R7 и R8 такие, как определено в п.1, обрабатывают арилтрихлорметильным или арилтрибромметильным производным ртути в условиях термолиза;
возможно с последующим образованием приемлемой в фармацевтике, ветеринарии или сельском хозяйстве соли целевого продукта или приемлемого в фармацевтике, ветеринарии или сельском хозяйстве сольвата каждого из них.
28. Способ по п.27, где реагент представляет собой либо фенилтрихлорметилртуть, либо фенилтрибромметилртуть и взаимодействие проводят в подходящем растворителе при температуре от примерно 60шС до примерно 75шС.
29. Способ по п.28, где растворителем является толуол, ксилол или их смесь.
30. Способ по любому из пп.27-29, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил или 3-хлор-5-трифторметилпиридин-2-ил; R3 представляет собой циано; R5 представляет собой водород; каждый из R2 и R4 представляет собой бром-; R6 и R8, каждый независимо, выбраны из водорода и метила, предпочтительно из водорода; и R7 представляет собой водород, метил, этил или метокси, предпочтительно водород.
31. Способ по п.30, где получаемое соединение по п.1 представляет собой 1-[(3-хлор-5-трифторметил)пиридин-2-ил]-3-циано-4-(2,2-дибромциклопропил)пиразола.
32. Способ получения соединения по п.1, где R2 и R4, каждый независимо, являются водородом или С1-C4алкилом, при котором соединение формулы (II)
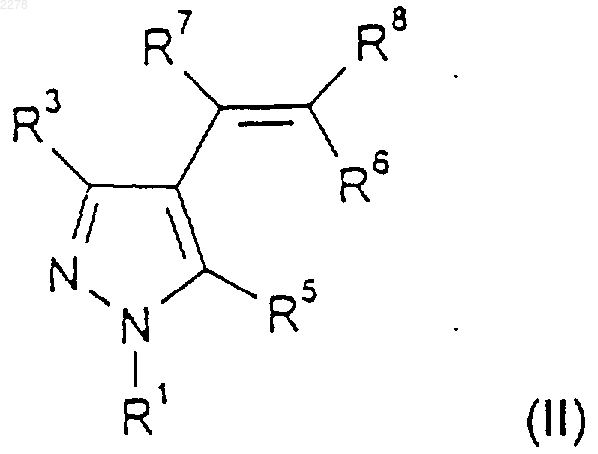
где R1, R3, R5, R6, R7 и R8 такие, как определено в п.1, обрабатывают соответствующим диазоалканом в присутствии катализатора на основе переходного металла;
возможно с последующим образованием приемлемой в фармацевтике, ветеринарии или сельском хозяйстве соли целевого продукта или приемлемого в фармацевтике, ветеринарии или сельском хозяйстве сольвата каждого из них.
33. Способ по п.32, где, когда R2 и R4 оба являются водородом, диазоалкан представляет собой диазометан, катализатором является ацетат палладия (II) и взаимодействие проводят в подходящем растворителе при примерно комнатной температуре.
34. Способ по п. 33, где растворителем является эфир.
35. Способ по любому из пп.32-34, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил; R3 представляет собой циано; R5 представляет собой водород; каждый из R2 и R4 представляет собой водород; каждый из R6 и R8 представляет собой водород; и R7 представляет собой водород, метил или этил.
36. Способ по п.35, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил; R3 представляет собой циано; R5 представляет собой водород; R2 и R4 являются одинаковыми и представляют собой водород; R6 и R8 представляют собой водород; и R7 представляет собой водород.
37. Способ получения соединения по п.1, где R2 и R4, каждый независимо, являются водородом или С1-C4алкилом, при котором соединение формулы (II)

где R1, R3, R5, R6, R7 и R8 такие, как определено в п.1, обрабатывают на первой стадии соответствующим диазоалканом в отсутствие катализатора на основе переходного металла с последующим, на второй стадии, термолизом промежуточного пиразолина;
возможно с последующим образованием приемлемой в фармацевтике, ветеринарии или сельском хозяйстве соли целевого продукта или приемлемого в фармацевтике, ветеринарии или сельском хозяйстве сольвата каждого из них.
38. Способ по п.37, где, когда R2 и R4 оба являются водородом, на первой стадии диазоалкан представляет собой диазометан и взаимодействие проводят в подходящем растворителе при примерно комнатной температуре, а на второй стадии термолиз выделенного пиразолина проводят в подходящем растворителе при температуре от примерно 135шС до примерно 145шС.
39. Способ по п.38, где растворителем на первой стадии является эфир, а на второй стадии ксилол.
40. Способ по любому из пп.37-39, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил; R3 представляет собой циано; R5 представляет собой водород или амино; R2 и R4 оба представляют собой водород; R6 и R8 представляют собой водород; и R7 представляет собой трифторметил, хлордифторметил, пентафторэтил или гептафторпропил.
41. Способ по п.40, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил; R3 представляет собой циано; R5 представляет собой водород или амино; R2 и R4 являются одинаковыми и представляют собой водород; R6 и R8 представляют собой водород; и R7 представляет собой трифторметил или хлордифторметил.
42. Способ по п.41, где получаемое соединение по п.1 выбрано из
3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(1-трифторметилциклопропил)пиразола;
4-(1-хлордифторметилциклопропил)-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразола; и
5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(1-трифторметилциклопропил)пиразола.
43. Способ получения соединения по п.1, при котором осуществляют термолиз соли щелочного металла соединения формулы (VII)
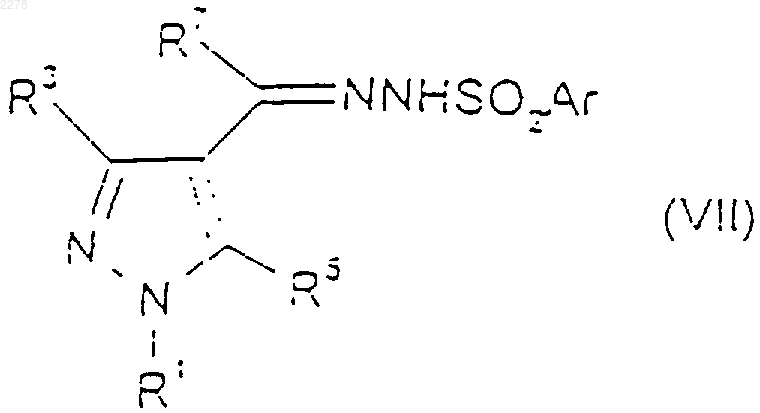
где Аr представляет собой фенил или нафтил, каждый из которых возможно замещен С1-С4 алкилом, С1-C4алкокси или галогеном-; R5 представляет собой водород, С1-С4алкил или галоген-; R7 представляет собой водород или C1-С4алкил, возможно замещенный одним или более чем одним галогеном-; а R1 и R3 такие, как определено в п.1, в присутствии соединения формулы (VIII)
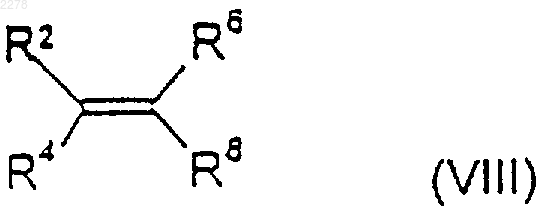
где R2, R4, R6 и R8 такие, как определено в п.1, в присутствии катализатора на основе переходного металла, возможно в подходящем растворителе, возможно под давлением;
возможно с последующим образованием приемлемой в фармацевтике, ветеринарии или сельском хозяйстве соли целевого продукта или приемлемого в фармацевтике, ветеринарии или сельском хозяйстве сольвата каждого из них.
44. Способ по п.43, где катализатором на основе переходного металла является ацетат родия (II), растворителем является дихлорметан и взаимодействие проводят при давлении от примерно 101 кПа (14,7 фунта на квадратный дюйм) до 2757 кПа (400 фунтов на квадратный дюйм) и при температуре от примерно комнатной температуры до примерно 80шС.
45. Способ по любому одному из пп.43 и 44, где Аr представляет собой 4-метилфенил.
46. Способ по любому одному из пп.43-45, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил; R3 представляет собой циано; R5 представляет собой водород; R2 и R4, каждый независимо, выбраны из метила, фтора-, хлора- и брома-, либо вместе с атомом углерода, к которому они присоединены, образуют циклопропильную, циклобутильную или циклопентильную группу; R6 и R8, каждый независимо, выбраны из водорода, метила, хлора- и брома-; либо, когда R2 и R4 не образуют часть циклоалкильной группы, R2 и R6 вместе с атомами углерода, к которым они присоединены, могут образовывать циклопентановую или циклогексановую группу; и R7 представляет собой водород или метил.
47. Способ по п.46, где R1 представляет собой 2,6-дихлор-4-трифторметилфенил; R3 представляет собой циано; R5 представляет собой водород; R2 и R4 являются одинаковыми и представляют собой хлор или бром; R6 и R8 представляют собой водород; и R7 представляет собой водород.
Текст
1 Настоящее изобретение относится к производным пиразола, имеющим противопаразитарные свойства. В частности, оно относится к 1-арил-4-циклопропилпиразолам. Некоторые производные пиразола, обладающие, inter alia, противопаразитарной активностью, уже известны. Например, в ЕР-А 0234119 раскрыты 1-арилпиразолы для борьбы с членистоногими, нематодами растений и гельминтами-паразитами. 1-Арилпиразолы также раскрыты в ЕР-А-0295117; в дополнение к наличию членистоногицидной, нематоцидной и антигельминтной активности, сообщается, что эти соединения демонстрируют антипротозойные свойства. Аналогичные профили активности также демонстрируют 1-арилпиразолы, раскрытые в ЕР-А-0295118. Кроме этого, в ЕР-А-0280991 раскрыты некоторые 1-арилпиразолы, обладающие инсектицидной активностью, в WO-A-97/07102 описаны другие 1-арилпиразолы с противопаразитарными свойствами, и ЕР-А-0780378 относится к 1-арилпиразолам и 1-гетероарилпиразолам и к их применению в качестве пестицидов. Настоящее изобретение относится к соединению формулы (I) либо его приемлемой в фармацевтике, ветеринарии или сельском хозяйстве соли, либо приемлемому в фармацевтике, ветеринарии или сельском хозяйстве сольвату каждого из них,гдеR1 представляет собой 2,4,6 трехзамещенный фенил, где 2- и 6-заместители,каждый независимо, выбраны из галогена-, а 4 заместитель выбран из С 1-C4 алкила, возможно замещенного одним или более чем одним галогеном-, С 1-С 4 алкокси, возможно замещенного одним или более чем одним галогеном-,S(O)nС 1-С 4 алкила, возможно замещенного одним или более чем одним галогеном-, галогенаи пентафтортио; или 3,5-двузамещенный пиридин-2-ил, где 3-заместителем является галоген-,а 5-заместитель выбран из C1-С 4 алкила, возможно замещенного одним или более чем одним галогеном-, С 1-С 4 алкокси, возможно замещенного одним или более чем одним галогеном-,S(O)nС 1-С 4 алкила, возможно замещенного одним или более чем одним галогеном-, галогенаи пентафтортио;R3 представляет собой С 1-С 4-алкил, возможно замещенный гидрокси или одним или более чем одним галогеном-; циано, С 1-С 5 алканоил или фенил;R6 и R8, каждый независимо, выбраны из водорода, С 1-C4 алкила, фтора-, хлора- и брома-; либо, когда R2 и R4 не образуют часть циклоалкильной группы, R2 и R6 вместе с атомами углерода, к которым они присоединены, могут образовывать С 5-С 7 циклоалкильную группу;R7 представляет собой водород, С 1-С 4 алкил, возможно замещенный одним или более чем одним галогеном-, или С 1-С 4 алкокси; иn равно 0, 1 или 2. В вышеприведенном определении, если не указано иначе, алкильные и алкоксигруппы,имеющие три или более чем три атома углерода,и алканоильные группы, имеющие четыре или более чем четыре атома углерода, могут быть нормальными или разветвленными; галогенозначает фтор-, хлор-, бром- или иод-. Соединения формулы (I) могут содержать один или более чем один хиральный центр и,следовательно, существовать в виде стереоизомеров, т.е. в виде энантиомеров или диастереоизомеров, а также в виде их смесей. Изобретение включает в себя и индивидуальные стереоизомеры соединений формулы (1) и их смеси. Разделение диастереоизомеров может быть осуществлено обычными методами, например фракционной кристаллизацией или хроматографией(включая ВЭЖХ) смеси диастереоизомеров соединения формулы (I), либо его подходящей соли или производного. Индивидуальный энантиомер соединения формулы (I) может быть получен из соответствующего оптически чистого промежуточного соединения либо разделением, либо ВЭЖХ рацемата с использованием подходящего хирального носителя, либо, где подходит, фракционной кристаллизацией диастереоизомерных солей, образованных взаимодействием рацемата с подходящей оптически активной кислотой. Изобретение также охватывает радиоизотопные производные соединений формулы (I),которые пригодны для биологических исследований. Приемлемыми в фармацевтике, ветеринарии или сельском хозяйстве солями соединений формулы (I) являются, например, нетоксичные соли присоединения кислоты, образованные с неорганическими кислотами, такими как соляная, бромисто-водородная, серная и фосфорная кислота, и с органическими карбоновыми кислотами или с органическими сульфоновыми кислотами. Обзор подходящих солей см. в J.Pharm. Sci., 1977, 66, 1. Предпочтительную группу соединений формулы (I) составляют те из них, в которых R1 представляет собой 2,6-дихлор-4-трифторметилфенил, 2,6-дихлор-4-пентафтортиофенил, 2,4,6 3 трихлорфенил или 3-хлор-5-трифторметилпиридин-2-ил; R3 представляет собой метил, этил,проп-2-ил, 1-гидроксиэтил, 2-гидроксипроп-2 ил, дифторметил, дихлорметил, трифторметил,циано, формил, ацетил или фенил; R5 представляет собой водород, метил, амино или хлор-; R2 и R4, каждый независимо, выбраны из водорода,метила, фтора-, хлора- и брома-, либо вместе с атомом углерода, к которому они присоединены, образуют циклопропильную, циклобутильную или циклопентильную группу; R6 и R8, каждый независимо, выбраны из водорода, метила, хлора- и брома-; либо, когда R2 и R4 не образуют часть циклоалкильной группы, R2 и R6 вместе с атомами углерода, к которым они присоединены, могут образовывать циклопентановую или циклогексановую группу; и R7 представляет собой водород, метил, этил, трифторметил, хлордифторметил, пентафторэтил, гептафторпропил или метокси. Более предпочтительную группу соединений формулы (I) составляют те из них, в которых R1 представляет собой 2,6-дихлор-4 трифторметилфенил, 2,6-дихлор-4-пентафтортиофенил- или 3-хлор-5-трифторметилпиридин 2-ил; R3 представляет собой циано; R5 представляет собой водород или амино; R2 и R4 являются одинаковыми и представляют собой водород,хлор- или бром-; R6 и R8 представляют собой водород; и R7 представляет собой водород,трифторметил или хлордифторметил. Особенно предпочтительные индивидуальные соединения по изобретению включают в себя 3-циано-4-(2,2-дибромциклопропил)-1(2,6-дихлор-4-трифторметилфенил)пиразол; 4 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(1-трифторметилциклопропил) пиразол. В следующем аспекте настоящего изобретения предложены способы получения соединения формулы (I), либо его приемлемой в фармацевтике, ветеринарии или сельском хозяйстве соли, либо приемлемого в фармацевтике, ветеринарии или сельском хозяйстве сольвата(включая гидраты) каждого из них, как показано ниже. Для специалистов в данной области будет очевидно, что в рамках определенных описанных способов порядок стадий синтеза может быть изменен, и что он будет зависеть, inter alia,от таких факторов, как природа других функциональных групп, присутствующих в конкретном субстрате, доступность ключевых промежуточных соединений и от принятой стратегии защиты групп (при ее наличии). Очевидно, что такие факторы будут также влиять на выбор реагентов для использования на указанных стадиях синтеза. Следует также понимать, что различные стандартные взаимные превращения и преобразования заместителей или функциональных групп в рамках определенных соединений формулы (I) будут обеспечивать получение других соединений формулы (I). Примерами являются деаминирование соединения формулы (I), где R5 представляет собой аминогруппу, отщепление одного атома брома от соединения формулы (I),где R2 и R4 представляют собой бром-, и превращение соединения формулы (I), где R3 представляет собой цианогруппу, в соединение формулы (I), где R3 представляет собой С 1 С 5aлканоил, превращение соединения формулы(I), где R3 представляет собой С 1-С 4 алканоил в соединение формулы (I), где R3 представляет собой C1-С 4 алкил, замещенный гидроксилом или дигалогеном-, и превращение соединения формулы (I), где R3 представляет собой С 1 С 4 алкил, замещенный гидроксилом, в соединение формулы (I), где R3 представляет собой С 1C4 алкил или С 1-C4 алкил, однозамещенный галогеном-. Так, нижеприведенные способы иллюстрируют общие процедуры синтеза, которые могут быть выбраны для того, чтобы получать соединения по изобретению. 1. Соединение формулы (I) может быть получено циклопропанированием алкена формулы (II) где R1, R3, R5, R6, R7 и R8 такие, как определено ранее для формулы (I). Этого можно достичь посредством образования in situ требуемых карбеноидных разновидностей в присутствии (II) соответствующим способом. Такие способы 5 включают в себя обработку хлороформа или бромоформа основанием, предпочтительно в условиях катализа фазового переноса, термолиз подходящего металлоорганического предшественника, такого как арилтрихлорметильное или трибромметилртутное производное, обработка диазоалканом в присутствии катализатора на основе переходного металла и обработка диазоалканом в отсутствие катализатора на основе переходного металла с последующим термолизом промежуточного пиразолина. Например, при первом способе для получения соединения формулы (I), где R2 и R4 представляют собой либо оба хлор-, либо оба бром-, хлороформ или бромоформ, соответственно, обрабатывают концентрированным водным раствором гидроксида щелочного металла в присутствии (II) и четвертичной аммониевой соли в подходящем растворителе при от примерно комнатной температуры до примерно температуры дефлегмации реакционной среды. Предпочтительно реагентами являются гидроксид натрия и бензилтриэтиламмонийхлорид,соответственно, в то же время растворителем предпочтительно является дихлорметан, возможно в присутствии небольшого количества этанола. При втором способе, например, для получения соединения формулы (I), где R2 и R4 представляют собой либо оба хлор-, либо оба бром-, смесь (II) и либо фенилтрихлорметилртути, либо фенилтрибромметилртути, соответственно, нагревают при температуре от примерно 60 С до примерно 75 С в подходящем растворителе, предпочтительно в толуоле, ксилоле или их смеси. Третий способ характеризуется обработкой (II) эфирным раствором диазометана в присутствии ацетата палладия (II) при примерно комнатной температуре в подходящем растворителе, предпочтительно в эфире, что обеспечивает получение соединения формулы (I), где иR2 и R4 представляют собой водород. Альтернативный вариант получения соединения формулы (I), где R2 и R4 представляют собой водород, осуществляют через пиразолиновое промежуточное, образованное по предыдущему способу в отсутствие ацетата палладия(II). При последующем термолизе выделенного пиразолина в подходящем растворителе,предпочтительно в ксилоле, при температуре от примерно 135 С до примерно 145 С, получают целевое соединение. Соединение формулы (II) может быть получено из соединения формулы (III) 6 где Х представляет собой бром- или иод-, a R1,R3, и R5 такие, как определено ранее для формулы (II) при условии, что R5 не является бромомили иодом-. Предпочтительно X представляет собой йод-. Преобразование может быть осуществлено по катализируемой переходным металлом реакции перекрестного сочетания соединения (III) с соответствующим винилирующим реагентом в подходящем, возможно дегазированном, растворителе. Предпочтительно переходным металлом является палладий, а винилирующим реагентом является оловоорганическое производное. Например, (III) обрабатывают три-нбутил(винил)оловом в присутствии тетракис(трифенилфосфин)палладия(0) в диметилформамиде при температуре от примерно комнатной до примерно 80 С с получением соединения формулы (II), где R7, R6, и R8 представляют собой водород. Альтернативно, соединение формулы (II),где R5 представляет собой водород, С 1-С 4 алкил или галоген-, может быть получено с использованием конверсионной технологии Виттига взаимодействием соединения формулы (V) где R7 представляет собой водород или С 1C4 алкил, возможно замещенный одним или более чем одним галогеном-, R5 представляет собой водород, C1-C4 алкил или галоген-, а R1 и R3 такие, как определено ранее для формулы (II), с соответствующим образованным из алкилфосфониевой соли илидом фосфора. Например, обработка метилтрифенилфосфонийгалогенида сильным основанием в подходящем растворителе с последующим добавлением (V) будет обеспечивать получение соединение формулы (II), где R6 и R8 являются водородом. Предпочтительно реагентом-основанием является раствор н-бутиллития в гексане, растворителем является либо эфир, либо тетрагидрофуран, и реакцию проводят при температуре от примерно комнатной до примерно 35 С. Для соединения формулы (II), где R7 представляет собой С 1-С 4 алкокси, R6 и R8 являются водородом, R5 является водородом, С 1-С 4 алкилом или галогеном-, а R1 и R3 такие, как определено ранее для формулы (II), особенно удобно использовать последовательность взаимных превращений алкенов, посредством которой соединение формулы (II), где R7, R6 и R8 представляют собой водород, R5 является водородом, С 1-С 4 алкилом или галогеном-, а R1 и R3 такие, как определено ранее для формулы (II),обрабатывают йодом в подходящем С 1-C4 спирте в присутствии соли ртути(II) с получением про 7 межуточного-алкоксииодэтилпиразола,который, в свою очередь, дегидройодинируют соответствующим основанием, возможно в подходящем растворителе. Например, когда R7 представляет собой метокси, первую стадию проводят с использованием оксида ртути и йода в метаноле при температуре дефлегмации реакционной среды, тогда как вторая стадия может быть осуществлена с использованием третичноаминного основания, такого как 1,8-диазобицикло[5.4.0]ундец-7-ен (ДБУ) в толуоле при комнатной температуре. Соединение формулы (III), где R5 представляет собой водород или галоген-, может быть получено из соединения формулы (III), гдеR5 представляет собой аминогруппу, стандартными процедурами деаминирования или деаминирования-галогенирования,соответственно. Когда R5 является водородом, приемлемая процедура включает в себя обработку амина третбутилнитритом в тетрагидрофуране в качестве растворителя при температуре от примерно комнатной до примерно 70 С. Когда R5 является например хлором-, раствор амина в подходящем растворителе, таком как ацетонитрил, может быть обработан раствором нитрозилхлорида в дихлорметане при температуре примерно 0 С с последующим нагреванием до температуры дефлегмации реакционной смеси. Аналогичным способом соединение формулы (V), где R5 представляет собой водород или галоген-, может быть получено из соединения формулы (V), где R5 представляет собой аминогруппу. Последнее, в свою очередь, может быть получено из соединения формулы (IV), гдеR5 является аминогруппой, а R1 и R3 такие, как определено ранее для формулы (III), стандартным ацилированием. Соединение формулы (III), где R5 представляет собой С 1-C4 алкил или аминогруппу,может быть также получено из соединения формулы (IV) где R5 представляет собой С 1-С 4 алкил или аминогруппу, а R1 и R3 такие, как определено ранее для формулы (III), стандартными методами бромирования или йодирования. Например, когда Х представляет собой йод-, (IV) обрабатывают N-йодсукцинимидом в подходящем растворителе, таком как ацетонитрил, при температуре от примерно комнатной до примерно 85 С. Соединение формулы (V), где R7 представляет собой водород, удобно может быть получено из соединения формулы (II), где R7, R6 и R8 представляют собой водород, R5 представляет собой водород, C1-C4 алкил или галоген-, а R1 иR3 такие, как определено ранее для формулы(II), окислением винильной группы любым из множества стандартных методов. Например, 002278 8 один из таких методов включает в себя обработку алкена тетроксидом осмия в присутствии 4-метилморфолин-N-оксида в подходящем растворителе с последующей обработкой реакционной смеси метапериодатом натрия. Предпочтительно тетраоксид осмия вводят в виде раствора в трет-бутаноле, реакционный растворитель представляет собой 90% водный раствор ацетона, и взаимодействие проводят при комнатной температуре. Очевидно, по аналогии, что этот подход окисления может быть также использован для получения соединения формулы (V), где R7 представляет собой С 1-С 4 алкил, возможно замещенный одним или более чем одним галогеном-, из соответствующего алкена. Однако когда R7 представляет собой метил, альтернативным путем получения (V) является путь через гидратацию соединения формулы (VI) где R9 представляет собой водород, a R1, R3 и R5 такие, как определено ранее для для формулы(V). Преимущественно, этот способ может быть также использован, когда R5 является аминогруппой. Так, обработка алкина (VI) кислотой в подходящем растворителе при примерно комнатной температуре обеспечивает получение соответствующего 4-ацетилпиразольного производного. Предпочтительно кислота представляет собой п-толуолсульфоновую кислоту, а растворитель представляет собой ацетонитрил. В свою очередь, (VI) может быть получен из соответствующего защищенного предшественника, например из соединения формулы (VI),где R9 представляет собой триметилсилил. В этом случае удаление защитной группы может быть осуществлено с использованием слабого основания, такого как карбонат калия, в подходящем растворителе, таком как метанол. Когда R5 не является бромом- или йодом-,удобно получать защищенный алкин из соединения формулы (III) через катализируемое переходным металлом поперечное сочетание триметилсилилацетилена в присутствии избытка третичного основания в подходящем растворителе. Предпочтительно переходный металл представляет собой палладий. Так например, (III) обрабатывают триметилсилилацетиленом в присутствии бис(трифенилфосфин)палладий(II)хлорида, йодида меди и триэтиламина в диметилформамиде при температуре от примерно 45 С до примерно 65 С. 2. Соединение формулы (I) также может быть получено альтернативным примом циклопропанирования, посредством которого тре 9 буемые карбеноидные разновидности образуются из пиразол-содержащего предшественника в присутствии соответствующего алкена. Одним из таких предшественников является арилсульфонилгидразоновое производное соединения формулы (V), то есть соединение формулы (VII) где Аr представляет собой фенил или нафтил,каждый из которых возможно замещен С 1-С 4 алкилом, С 1-C4 алкокси или галогеном-, a R1, R3,R5 и R7 такие, как определено ранее для формулы (V). Предпочтительно Аr представляет собой 4-метилфенил(п-толил). Так (VII) в форме соли щелочного металла,предпочтительно литиевой соли, которую легко получают из (VII) с использованием раствора нбутиллития в гексане в подходящем растворителе, таком как тетрагидрофуран, при температуре от примерно -78 С до примерно комнатной температуры, подвергают термическому разложению в присутствии катализатора на основе переходного металла и алкена формулы (VIII) где R2, R4, R6 и R8 такие, как определено ранее для для формулы (I), возможно в подходящем растворителе, таком как дихлорметан, и возможно под давлением. Эта взаимодействие обычно проводят с использованием большого избытка (VIII) при температуре от примерно комнатной до примерно 80 С и давлении от примерно 101 кПа (14,7 фунт/кв.дюйм) до 2757 кПа (400 фунт/кв.дюйм). Очевидно, что при повышенном давлении, применение которого является предпочтительным для слабореактивных алкенов, потребуется использовать сосуд высокого давления (бомбу). Предпочтительно катализатором на основе переходного металла является родий (II) в форме подходящей соли, например ацетата родия (II). Типичная методика включает в себя нагревание смеси литиевой соли соединения формулы (VII), где Аr представляет собой 4-метилфенил, a R1, R3, R5 и R7 такие, как определено ранее для формулы (VII), (VIII) и димера ацетата родия (II) в безводном дихлорметане при температуре от примерно 50 С до примерно 70 С. Промежуточные соединения формулы (IV) и (VII), если они не описаны ниже, могут быть получены либо по аналогии со способами, описанными в разделе "Подготовительные примеры", либо обычными методами синтеза из имеющихся в продаже исходных материалов,используя подходящие реактивы и реакционные условия, в соответствии со стандартными руко 002278 10 водствами по органической химии или прецедентом из литературы. Более того, специалисты в данной области техники осведомлены о возможных вариантах тех способов и альтернативах тем способам,описанным ниже в разделах "Примеры" и "Подготовительные примеры", которые позволят получать соединения, определенные формулой(I). Приемлемые в фармацевтике, ветеринарии и сельском хозяйстве соли присоединения кислот определенных соединений формулы (I),могут также быть получены стандартным образом. Например, раствор свободного основания обрабатывают соответствующей кислотой, либо чистой кислотой, либо в подходящем растворителе, и полученную соль выделяют либо фильтрацией, либо выпариванием растворителя реакционной смеси при пониженном давлении. Соединения по настоящему изобретению,то есть соединения формулы (I), обладают противопаразитарной активностью у людей, животных и растений. Они особенно полезны при обработке эктопаразитов. Относительно применения соединений по изобретению у людей предложены противопаразитарный фармацевтический состав, содержащий соединение формулы (I), либо его фармацевтически приемлемую соль, либо фармацевтически приемлемый сольват каждого из них, вместе с фармацевтически приемлемым разбавителем или носителем, который можно применять для местного введения; соединение формулы (I), либо его фармацевтически приемлемая соль, либо фармацевтически приемлемый сольват каждого из них, либо фармацевтический состав, содержащий любое из вышеупомянутого, для применения в качестве лекарства; применение соединения формулы (I), либо его фармацевтически приемлемой соли, либо фармацевтически приемлемого сольвата каждого из них, либо фармацевтического состава, содержащего любое из вышеупомянутое, для производства лекарства для лечения паразитарной инвазии; и способ лечения паразитарной инвазии у человека, при котором указанного человека обрабатывают эффективным количеством соединения формулы (I), либо его фармацевтически приемлемой соли, либо фармацевтически приемлемого сольвата каждого из них, либо фармацевтического состава, содержащего любое из вышеупомянутого. В отношени их применения у животных(исключая человека), данные соединения можно вводить сами по себе или в составе препарата,подходящего для предусмотренного конкретного применения, для конкретных видов животного-хозяина, которого нужно лечить, и для участвующих паразитов. Способы введения соединений включают в себя пероральное введение по 11 средством капсулы, пилюли, таблетки или дозы лекарства для вливания в ротовую полость животного, местное введение в форме препарата для обливания, препарата для нанесения на отдельные участки, препарата для окунания, препарата для распрыскивания, пены, шампуня или порошкового препарата, либо, альтернативно,их можно вводить посредством инъекции (например подкожно, внутримышечно или внутривенно) или в форме имплантата. Такие препараты готовят общепринятым способом в соответствии со стандартной ветеринарной практикой. Так, капсулы, пилюли или таблетки могут быть приготовлены смешиванием активного ингредиента с подходящим тонко измельченным разбавителем или носителем,дополнительно содержащим разрыхляющий агент и/или связующее, такие как крахмал, лактоза, тальк или стеарат магния и т.д. Пероральные дозы лекарства для животных готовят растворением или суспендированием активного ингредиента в подходящей среде. Препараты для обливания или нанесения на отдельные участки могут быть получены растворением активного ингредиента в подходящем жидком носителе-наполнителе, таком как бутилдигол, вазелиновое масло или нелетучий сложный эфир,возможно с добавлением летучего компонента,такого как пропан-2-ол. Альтернативно, препараты для обливания, обработки отдельных участков или распрыскивания могут быть получены инкапсулированием, чтобы остаток активного агента оставался на поверхности тела животного. Инъекционные препараты могут быть приготовлены в форме стерильного раствора,который может содержать другие вещества, например достаточное количество солей или глюкозы, чтобы сделать раствор изотоническим с кровью. Приемлемые жидкие носители включают в себя растительные масла, такие как кунжутное масло, глицериды, такие как триацетин,сложные эфиры, такие как бензилбензоат, изопропилмиристат и производные жирных кислот пропиленгликоля, а также органические растворители, такие как пирролидин-2-он и глицерина формиат. Эти препараты готовят растворением или суспендированием активного ингредиента в жидком носителе таким образом, чтобы конечный препарат содержал от 0,01 до 10 мас.% активного ингредиента. Эти препараты будут варьировать относительно веса содержащегося в них активного соединения в зависимости от вида животногохозяина, которого нужно лечить, тяжести и типа инфекции, и веса тела хозяина. Для парентерального, местного и перорального введения типичные диапазоны доз активного ингредиента составляют от 0,01 до 100 мг на кг веса тела животного. Предпочтительно диапазон составляет от 0,1 до 10 мг на кг. В качестве альтернативы соединения можно вводить с кормом для животных, и с этой 12 целью для смешивания с обычным кормом можно приготовить концентрированную кормовую добавку или премикс. Соединения по изобретению находят применение в борьбе с членистоногими сельскохозяйственными вредителями. Их можно, в частности, использовать в области ветеринарной медицины, в животноводстве и в здравоохранении: против членистоногих, которые паразитируют внутри или снаружи на позвоночных животных, особенно теплокровных позвоночных животных, включая человека и домашних животных, таких как крупный рогатый скот, овцы,козы, лошади, свиньи, домашняя птица, собаки,кошки и рыба, например против Acarina, включая клещей (например Ixodes spp., BoophilusDictyoptera (например Periplaneta spp.,Blatella spp.) и Hymenoptera (например Monomorium pharaonis); для защиты хранящихся продуктов, например зерновых, включая зерно и муку, арахиса, кормов для животных, древесины и предметов домашнего обихода, например ковров и текстиля, от нападения членистоногих, в частности жуков, включая долгоносиков, моли и клещей, например Ephestia spp. (огнвки мельничные), Anthrenus spp. (музейные жуки),Трubоlium spp. (хрущаки мучные), Sitophilus(клещи); для борьбы с тараканами, муравьями и термитами и подобными членистоногими вредителями в зараженных жилых и промышленных помещениях; для борьбы с личинками москитов в канавах, колодцах, водохранилищах или в других водоемах с проточной или стоячей водой; для обработки фундаментов, конструкций и почвы для предотвращения повреждения строений термитами, например Reticulitermes spp.,Heterotermes spp., Coptotermes spp.; в сельском хозяйстве против взрослых особей, личинок и яиц Lepidoptera (бабочки и моль), например Heliothis spp., такой как Heliothis virescens (табачная листовртка-почкоед), Heliothis armioera иxylostella (моль капустная); против взрослых особей и личинок Coleoptera (жуков), напримерForficula spp. (уховертки), а также против других членистоногих сельскохозяйственных вредителей, таких как Acari (клещи), напримерspp. (ракообразные). Соединения по изобретению также имеют применение в борьбе с членистоногими вредителями растений. Активное соединение обычно наносят на участок, где требуется ликвидировать инвазию членистоногих, с расходом при 002278 14 близительно от 0,005 кг до 25 кг активного соединения на гектар (га) обрабатываемой площади, предпочтительно от 0,02 до 2 кг/га. При благоприятных условиях, в зависимости от вида вредителя, с которым ведется борьба, адекватную защиту можно обеспечить при меньшем расходе. С другой стороны, неблагоприятные погодные условия и другие факторы могут потребовать использования активного ингредиента в более высоких соотношениях. Для нанесения на листья расход может составлять от 0,01 до 1 кг/га. Если вредитель является почвенным, препарат, содержащий активное соединение, равномерно распределяют по площади, которая должна быть обработана, любым приемлемым способом. При желании, нанесение можно осуществлять на поле или на посевную площадь обычным образом или в непосредственной близости от семян или растений, которые защищают от нападения. Активное соединение может быть внесено в почву путем опрыскивания с водой этой площади, или может быть оставлено на поверхности до естественного воздействия атмосферных осадков. При желании, во время или после нанесения препарат может быть распределен в почве механически, например вспашкой или дискованием. Нанесение можно производить до посадки, во время посадки, после посадки, но до прорастания, либо после прорастания. Соединения по изобретению имеют значение для борьбы с вредителями, которые питаются частями растения, удаленными от места нанесения, например листогрызущие насекомые могут быть уничтожены внесением заявленных соединений под корень. Кроме того, данные соединения могут уменьшать нападения на растения посредством отпугивающего или репеллентного эффектов. Соединения по изобретению имеют особое значение для защиты полевых, кормовых, плантационных, тепличных, садовых и виноградных культур или декоративных растений, а также деревьев плантаций и леса, например злаковых растений (таких как кукуруза, пшеница, рис,сорго), хлопчатника, табака, овощей и салатов(листопадных и вечнозеленых) в лесах, плантациях и питомниках. Они также имеют значение для защиты древесины (стоящей, срубленной, обработанной, хранящейся или строительной) от нападения пилильщиков (например Urocerus), жуков(например Reticulitermes spp., Heterotermes spp.,Coptotermes spp.). Более того, они имеют значение для защиты хранящихся продуктов, таких как зерно,плоды, орехи, специи и табак, будь они цельные, молотые или переработанные в готовые продукты, от нападения моли, жучков и клещей. Защищаются также хранящиеся изделия животного происхождения, такие как шкуры, волос,шерсть и перо в естественной или переработанной форме (например в виде ковров или текстиля) от повреждения молью и жучками, а также мясо и рыба от нападения жучков, клещей и мух. Соединения по изобретению имеют значение для борьбы с членистоногими, которые наносят вред человеку и домашним животным,распространяются или действуют как переносчики заболеваний у них, например, с членистоногими, которые были упомянуты выше, особенно для борьбы с клещами, клещиками, вшами, блохами, мошкой и жалящими насекомыми,досаждающими и миазными летающими насекомыми. Эти соединения особенно полезны для борьбы с членистоногими, которые имеются внутри домашних животных-хозяев или которые питаются в или на шкуре или сосут кровь животного, и для этой цели их можно вводить перорально, парентерально, черескожно или местно. Таким образом, согласно следующему аспекту изобретения предложен ветеринарный или сельскохозяйственный препарат, содержащий соединение формулы (I), либо его приемлемую в ветеринарии или сельском хозяйстве соль, либо приемлемый в ветеринарии или сельском хозяйстве сольват каждого из них, вместе с приемлемым в ветеринарии или сельском хозяйстве разбавителем или носителем. Предпочтительно, препарат применяют для местного введения. Далее, согласно изобретению предложено соединение формулы (I), либо его приемлемая в ветеринарии или сельском хозяйстве соль, либо приемлемый в ветеринарии или сельском хозяйстве сольват каждого из них, либо приемлемый в ветеринарии или сельском хозяйстве препарат,содержащий любое из вышеупомянутого, для применения в качестве паразитицида. Предложен также способ обработки паразитарной инвазии в месте локализации, при котором место локализации обрабатывают эффективным количеством соединения формулы (I),либо его приемлемой в ветеринарии или сель 002278 16 ском хозяйстве соли, либо приемлемого в ветеринарии или сельском хозяйстве сольвата каждого из них, либо приемлемого в ветеринарии или сельском хозяйстве препарата, содержащего любое из вышеупомянутого. Предпочтительно, местом локализации является шкура или мех животного, либо поверхность растения, либо почва вокруг растения,которые г должны быть обработаны. Следует понимать, что ссылка на лечение включает в себя профилактику, а также ослабление и/или излечение установленных симптомов паразитарной инфекции. Тест на инсектицидную активность Взрослых мух (Stomoxys calcitrans) собирают и анестезируют, используя СО 2. Раствор ацетона (1 мкл), содержащий тестируемое соединение, наносят непосредственно на торакс каждой мухи, а затем этих мух осторожно помещают в пробирку емкостью 50 мл, покрытую влажной марлей, чтобы они пришли в себя после воздействия СО 2. На отрицательные контроли наносят ацетон (1 мкл). Смертность оценивают через 24 ч после дозирования. Таблица 1 иллюстрирует активность in vitro выбранных соединений по изобретению против взрослых особей Stomoxys calcitrans. Дозировки, требуемые для достижения 100% смертности, приведены в последней графе в мкг/муху. Таблица 1 Примермкг/муху 3 А 0,05 7 0,05 19 0,05 27 0,05 47 0,05 Тест на акарицидную активность Дозу 10 мкг/см 2 создают равномерным капанием из пипетки 0,5 мл раствора 1 мг/мл тестируемого соединения в подходящем растворителе, таком как ацетон или этанол, на фильтровальную бумагу Whatman No.1 (торговая марка) размером 8 х 6,25 см. После высыхания, бумагу складывают пополам, плотно закрывают с двух сторон, используя скрепляющее устройство, и помещают в склянку Килнера, содержащую ватную прокладку, смоченную водой. Склянку затем закрывают и оставляют стоять при температуре 25 С в течение 24 ч. Далее приблизительно 50 личинок Boophilus microplus помещают в обработанный бумажный конверт, который затем складывают по третьей стороне так, чтобы он был полностью закрыт. Этот бумажный конверт вновь помещают в склянку Килнера, которую закупоривают и оставляют стоять при температуре 25 С в течение последующих 48 ч. Затем бумагу удаляют и оценивают смертность. Отрицательные контроли выполняют, обрабатывая соответствующим образом нарезанную фильтровальную бумагу 0,5 мл чистого раство 17 рителя и, следуя далее по тому же методу. Активность при других дозах определяют, изменяя концентрацию тестируемого раствора. Таблица 2 иллюстрирует активность in vitro выбранных соединений по изобретению против личинок Boophilus microplus. В последней графе приведены дозировки в мкг/см 2, требуемые для обеспечения 100% смертности. Таблица 2 Примермкг/см 2 3 А 0,05 7 0,05 19 0,05 47 0,05 Синтез соединений по изобретению и промежуточных продуктов для использования в синтезе иллюстрируется следующими примерами и подготовительными примерами. Температуры плавления были определены с использованием прибора для определения температуры плавления Gallenkamp и не корректировались. Спектральные данные ядерного магнитного резонанса (ЯМР) были получены с использованием спектрометра Bruker AC300 или АМ 300,причем наблюдаемые химические сдвигисоответствуют предложенным структурам. Данные масс-спектрометрии (МС) были получены на спектрометре Finnigan Mat. TSQ 7000 или на Fisons Instrument Trio 1000. Приведенные вычисленные и наблюдаемые ионы относятся к изотопной смеси с самой низкой массой. ВЭЖХ означает высокоэффективная жидкостная хроматография. Комнатная температура означает температуру от 20 до 25 С. Пример 1. 5-Амино-3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлоро-4-трифторметилфенил)пиразол. Энергично перемешиваемую смесь соединения, указанного в заголовке подготовительного примера 2, (1,0 г), бромоформа (13 мл), бензилтриэтиламмонийхлорида (0,075 г), 60% водного раствора гидроксида натрия (2 мл), дихлорметана (12 мл) и этилового спирта (0,5 мл) нагревали с обратным холодильником в течение 10 дней, затем оставляли охлаждаться и разбавляли водой. Отделенную органическую фазу подавали в колонку с силикагелем (10 г) и осуществляли элюирование дихлорметаном. Неочищенный продукт, полученный из соответствующих фракций, очищали ВЭЖХ с обращенной фазой на силикагеле С 18, используя в качестве элюента смесь ацетонитрил: вода: метанол(50:40:10), с получением указанного в заголовке соединения в виде не совсем белого твердого вещества, температура плавления 178-179 С.(CDCl3 ): 2.28 (d, 2H), 2.61 (t, 1H), 3.80C14H7Br2Cl2F3N4+H требует 516,84. Пример 2. 3-Циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-трифторметилфенил) пиразол. Этанол (0,1 мл) и раствор гидроксида натрия (0,29 г) в воде (0,5 мл) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 4, (0,6 г) и бромоформу (1,83 г) в дихлорметане (2 мл) с последующим добавлением бензилтриэтиламмонийхлорида (0,01 г). Реакционную смесь перемешивали последовательно при комнатной температуре в течение 18 ч, при 50 С в течение 5 ч, при комнатной температуре в течение 48 ч,при 50 С в течение 4 ч и при комнатной температуре в течение 18 ч, затем распределяли между дихлорметаном (100 мл) и водой (100 мл). Органическую фазу отделяли, высушивали(MgSO4) и выпаривали при пониженном давлении с получением масла, которое очищали колоночной хроматографией на силикагеле (10 г),используя в качестве элюента смесь гексан: дихлорметан (3:7), с последующей кристаллизацией целевого вещества из гексана. Указанное в заголовке соединение было,таким образом, получено в виде белого твердого вещества, температура плавления 121-123 С.(СDСl3): 2,02 (t, 1 Н), 2,34 (dd, 1 Н), 2,88(+)-3-циано-4-(2,2 дибромциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Соединение, указанное в заголовке примера 2, (28,5 мг), разделяли хиральной ВЭЖХ на колонке Chiralpak (торговая марка) AD (25 см х 2 см), используя в качестве элюента смесь гексан:пропан-2-ол (93:7) при скорости элюирования 9 мл/мин. Первым элюировался (-)-энантиомер (А),который был получен в виде белого твердого вещества, температура плавления 132,5-135 С.[]25D - 42,54 (с=1,5 мг/мл, метанол). Вторым элюировался (+)-энантиомер (В),который был получен в виде белого кристаллического вещества, температура плавления 132,5134 С. []25D+44,02 (с=3,5 мг/мл, метанол). Рентгеноструктурным анализом было установлено, что этот последний энантиомер обладает R-конфигурацией. Пример 4. 3-Циано-4-(2,2-дихлорциклопропил-1-(2,6-дихлор-4-трифторметилфенил) пиразол. Бензилтриэтиламмонийхлорид (0,01 г) и этиловый спирт (0,015 мл) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 4, (0,46 г) в хлороформе (0,66 мл). Затем добавляли 50% 19 водный раствор гидроксида натрия (0,25 мл), и реакционную смесь перемешивали при температуре 60 С в течение 1 месяца. Полученную смесь распределяли между дихлорметаном и водой, затем отделяли органическую фазу, сушили (МgSO4) и выпаривали при пониженном давлении. Полученную таким образом коричневую смолу очищали колоночной хроматографией на силикагеле (10 г), используя в качестве элюента дихлорметан, с последующей ВЭЖХ с обращенной фазой на силикагеле С 18 с использованием в качестве элюента смеси ацетонитрил: вода: метанол (50:40:10). В результате кристаллизации требуемого вещества из гексана, получили указанное в заголовке соединение в виде бесцветных чешуек, температура плавления 123-126 С.(СDСl3): 1,84 (t, 1H), 2,20 (dd, 1H), 2,85C14H6Cl4F3N3+NH4 требует 430,96. Пример 5. 5-Амино-3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-пентафтортиофенил)пиразол. Бромоформ (6,4 мл), затем этанол (0,1 мл) и раствор гидроксида натрия (0,29 г) в воде (0,5 мл) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 6, (0,35 г) в дихлорметане (2 мл). Далее добавляли бензилтриэтиламмонийхлорид (0,01 г), и реакционную смесь перемешивали при 50 С в течение 13 дней, затем оставляли охлаждаться. Полученную смесь выпаривали при пониженном давлении, и остаток распределяли между дихлорметаном и водой. Органическую фазу отделяли и объединяли с этилацетатными экстрактами водной фазы, затем объединенные органические растворы промывали рассолом, высушивали и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента дихлорметан, с последующей ВЭЖХ с обращенной фазой на силикагеле С 18 с использованием в качестве элюента смеси ацетонитрил: вода: метанол(60:30:10), с получением указанного в заголовке соединения в виде белого твердого вещества,температура плавления 178-180 С.(СDСl3): 2,29 (d, 2H), 2,60 (t, 1H), 3,89(br.s, 2H), 7,93 (d, 2H). МС (терморазбрызгивание): M/Z [М+Н] 574,7; С 13 Н 7 Вr2 Сl2F5N4S+Н требует 574,81. Пример 6. 3-Циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-пентафтортиофенил) пиразол. Получали в виде белой пены из соединения, указанного в заголовке подготовительного примера 8, по аналогии с примером 5, но с использованием на первоначальной стадии очист 002278 20 ки колоночной хроматографией в качестве элюента смеси гексан:дихлорметан (1:1).(СDСl3): 2,01 (t, 1 Н), 2,34 (dd, 1 Н), 2,88C13H6Br2Cl2F5N3S+NH4 требует 576,83. Пример 7. 3-Циано-4-циклопропил-1-(2,6 дихлор-4-трифторметилфенил)пиразол. 0,2 М раствор диазометана в эфире (25 мл) на протяжении 25 мин добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 4 (0,332 г),а также ацетата палладия(II) (0,01 г) в эфире(10 мл), и смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь обрабатывали дополнительным количеством эфирного раствора диазометана (25 мл) и ацетата палладия(II) (0,01 г), перемешивали в течение 24 ч, далее обрабатывали эфирным раствором диазометана (50 мл) и ацетатом палладия(II)(0,01 г), перемешивали еще 24 ч, затем выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (5 г), используя в качестве элюента дихлорметан, с последующей ВЭЖХ с обращенной фазой на силикагеле С 18 с использованием в качестве элюента смеси ацетонитрил: вода: метанол (50:45:5), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 124 С.(СDСl3): 0,77 (m, 2H), 1,07 (m, 2H), 1,89(m, 1H), 7,29 (s, 1H), 7,74 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 362,8; С 14 Н 8 Сl2F3N3+NН 4 требует 363,04. Пример 8. 3-Циано-(2,2-дибром-3,3-диметилциклопропил-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Раствор соединения, указанного в заголовке подготовительного примера 10, (0,15 г) и фенилтрибромметилртути (0,44 г) в толуоле (2 мл) нагревали при температуре 70 С в течение 5 ч,оставляли охлаждаться и выпаривали при пониженном давлении. Остаток очищали ВЭЖХ с обращенной фазой на силикагеле С 18, используя в качестве элюента смесь ацетонитрил: вода: метанол (60:30:10), с получением указанного в заголовке соединения в виде не совсем белого твердого вещества, температура плавления 146148 С.(CDCl3): 1,31 (s, 3H), 1,70 (s, 3 Н), 2,52 (s,1H), 7,78 (s, 2 Н), 7,79 (s, 1H). MC (терморазбрызгивание): M/Z [M+NH4] 546,7; С 16 Н 10 Вr2 Сl2F3N3+NН 4 требует 546,89. Пример 9. 3-Циано-4-(2,2-дибром-1-метилциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 15, по аналогии с примером 8, но используя время реакции 4 ч, с последующей фильтрацией реакционной смеси, и первоначальной очисткой коло 21 ночной хроматографией на силикагеле, используя в качестве элюента смесь гексан: дихлорметан (1:1), в виде белого твердого вещества, температура плавления 133-134 С.(СDСl3): 1,83 (s, 3 Н), 1,92 (d, 1H), 2,28 (d,1H), 7,59 (s, 1H), 7,78 (s, 2H). MC (терморазбрызгивание): M/Z [M+NH4] 533,0; С 15 Н 8 Вr2 Сl2F3N3+NН 4 требует 532,88. Пример 10. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(1-метилциклопропил)пиразол. 0,007 М раствор диазометана в эфире (20 мл) добавляли двумя равными порциями к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 15,(0,346 г) и ацетата палладия(II) (0,01 г) в эфире(10 мл), смесь перемешивали при комнатной температуре в течение 48 ч, а затем фильтровали. Реакционную смесь обрабатывали дополнительными количествами эфирного раствора диазометана (20 мл) и ацетата палладия(II) (0,01 г),перемешивали в течение 24 ч и фильтровали,затем этот цикл повторяли. Затем реакционную смесь обрабатывали эфирным раствором диазометана (20 мл) и ацетатом палладия(II) (0,01 г),перемешивали в течение 5 дней, фильтровали и выпаривали при пониженном давлении. Кристаллизация остатка из циклогексана дала указанное в заголовке соединение в виде желтого твердого вещества, температура плавления 138139 С.(CDCl3): 0,86 (m, 2H), 1,04 (m, 2 Н), 1,50(s, 3 Н), 7,41 (s, 1 Н), 7,74 (s, 2H). MC (терморазбрызгивание): M/Z [М+Н] 359,8; С 15 Н 10 Сl2F3N3+Н требует 360,03. Пример 11. 3-Циано-4-(2,2-дибром-1-метоксициклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Раствор соединения, указанного в заголовке подготовительного примера 17, (0,4 г) и фенилтрибромметилртути (0,76 г) в толуоле (1 мл) нагревали при 60 С в течение 4 ч, оставляли охлаждаться и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:дихлорметан (1:1), с получением соединения, указанного в заголовке, в виде белого твердого вещества, температура плавления 117-118 С.(CDCl3): 2,22 (d, 1H),2,40 (d, 1H), 3,43 (s, 3 Н), 7,80 (s, 2H), 7,84 (s,1H). MC (терморазбрызгивание): M/Z [M+H] 532,1; С 15 Н 8 Вr2 Сl2F3N3O+H требует 531,84. Пример 12. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(2,2,3,3-тетраметилциклопропил)пиразол. Раствор соединения, указанного в заголовке подготовительного примера 18, (0,04 г), 2,3 диметилбут-2-ена (1,08 мл) и димера ацетата родия(II) (0,001 г) в дихлорметане (0,3 мл) нагревали до 70 С в течение 30 мин и выдерживали при этой температуре в течение последую 002278 22 щих 30 мин. К реакционной смеси добавляли дихлорметан (0,3 мл), а затем ее нагревали в течение последующего 1 ч, оставляли охлаждаться и распределяли между дихлорметаном (5 мл) и водой (2 мл). Органическую фазу отделяли, высушивали (Nа 2SО 4) и выпаривали при пониженном давлении, затем очищали остаток колоночной хроматографией на силикагеле (1 г), используя в качестве элюента дихлорметан, с получением соединения, указанного в заголовке, в виде белого кристаллического вещества,температура плавления 158-159 С.(CDCl3: 1,05 (s, 6H), 1,33 (s, 6 Н), 1,55 (s,1H), 7,38 (s, 1 Н), 7,75 (s, 2 Н). МС (терморазбрызгивание): M/Z [M+NH4] 419,6;C18H16Cl2F3N3+NH4 требует 419,1. Пример 13. 3-Циано-4-(t-2, t-3-дихлор-r-1 циклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Раствор соединения, указанного в заголовке подготовительного примера 18, (0,254 г), цис 1,2-дихлорэтилена (7,0 г) и димера ацетата родия(II) (0,045 г) в безводном дихлорметане (7,5 мл) нагревали при 60 С в течение 4,5 ч, а затем оставляли при комнатной температуре на 18 ч. Полученную смесь очищали колоночной хроматографией на силикагеле (50 г), используя в качестве элюента дихлорметан, с получением соединения, указанного в заголовке, в виде белого твердого вещества, температура плавления 138139 С.(CDCl3: 2,80 (t, 1H), 3,80 (d, 2 Н), 7,75 (s,1H), 7,80 (s, 2H). МС (терморазбрызгивание):C14H6Cl4F3N3+NH4 требует 430,96. Пример 14. 3-Циано-4-(t-2,t-3-дибром-r-1 циклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 18, и 1,2 дибромэтилена по аналогии с примером 13, но нагревание реакционной смеси осуществляли при температуре 55 С в течение 4 ч, а в конце осуществляли сублимационную сушку остатка,полученного после стадии хроматографической очистки из трет-бутанола, в виде светложелтого твердого вещества, температура плавления 106-108 С.(СDСl3): 2,76 (t, 1H), 3,80 (d, 2H), 7,78 (s,2H), 7,80 (s, 1H). МС (терморазбрызгивание):M/Z [M+H] 502,0; С 14 Н 6 Вr2 Сl4F3N3+Н требует 501,83. Пример 15. 3-Циано-4-(бицикло[3.1.0]гексан-6-ил)-1-(2,6-дихлор-4-трифторметилфенил) пиразол. Получали из соединения, указанного в заголовке подготовительного примера 18, и циклопентена по аналогии с примером 13, но нагревание реакционной смеси осуществляли при температуре 55 С в течение 4 ч, в виде белого[M+NH4] 403,4; С 17 Н 12 Сl2F3+NН 4 требует 403,07. Пример 16. 3-Циано-4(бицикло[4.1.0]гептан-7-ил)-1-(2,6-дихлор-4-трифторметилфенил) пиразол. Получали из соединения, указанного в заголовке подготовительного примера 18, и циклогексена по аналогии с примером 15, в виде белого твердого вещества, температура плавления 113-114 С.(m, 2H), 1,59 (m, 2H), 1,78 (t, 1 Н), 2,04 (m, 2H),7,52 (s, 1H), 7,77 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 417,0. С 18 Н 14 Сl12F3N3+NН 4 требует 417,09. Пример 17. 3-Циано-1-(2.6-дихлор-4-трифторметилфенил)-4-(2,2-диметилциклопропил) пиразол. Раствор соединения, указанного в заголовке подготовительного примера 18, (0,507 г) и димера ацетата родия(II) (0,045 г) в безводном дихлорметане (7 мл) помещали в эмалированную бомбу (емкостью 50 мл), которую затем дважды продували азотом. В реакционный сосуд помещали 2-метилпропен, и реакционную смесь нагревали при температуре 55 С в течение 2 ч, затем оставляли при комнатной температуре на 18 ч. Полученную смесь очищали колоночной хроматографией на силикагеле (50 г),используя в качестве элюента дихлорметан, с получением указанного в заголовке соединения в виде желтоватого твердого вещества, температура плавления 122-123 С.(СDCl3): 0,70 (m, 1H), 0,96 (s, 3 Н), 1,00[M+NH4] 390,7; С 16 Н 12 Сl2F3N3+NН 4 требует 391,07. Пример 18. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(спиро[2.4]гептан-1-ил) пиразол. Получали из соединения, указанного в заголовке подготовительного примера 18, и метилепециклопентана по аналогии с примером 15,но нагревая реакционную смесь лишь в течение 3 ч, в виде светло-желтого твердого вещества,температура плавления 117-118 С.(СDСl3): 0,88 (Т, 1H), 1,22 (dd, 1H), 1,37 (m, 2H), 1,74 (m,6H), 1,92 (dd, 1H), 7,27 (s, 1H), 7,74 (s, 2H). МСC18H14Cl2F3N3+NH4 требует 417,09. Пример 19. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(2,2-дифторциклопропил) пиразол. Получали из соединения, указанного в заголовке подготовительного примера 18, и 1,1 дифторэтилена по аналогии с примером 17, но 24 нагревая реакционную смесь при 50 С и 2068 кПа (300 фунтов на квадратный дюйм) в течение 24 ч. Этот продукт далее очищали повторной ВЭЖХ с обращенной фазой на силикагеле С 18, используя в качестве элюента смесь ацетонитрил:вода (55:45), с получением указанного в заголовке соединения в виде белого аморфного вещества.(СDСl3): 1, 58 (m, 1H), 2,16 (m, 1H),2,76 (m, 1H), 7,50 (s, 1H), 7,78 (s, 2H). МСC14H6Cl2F5N3+H требует 381,99. Пример 20. 3-Циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(спиро[2.3]гексан-1-ил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 18, и метиленциклобутана по аналогии с примером 15, но нагревая реакционную смесь с обратным холодильником в течение 4 ч и после этого не оставляя на ночь при комнатной температуре, с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 108-110 С.(СDСl3): 0,79 (m, 1H), 1,24 (m, 1H), 1,862,39 (m, 7H), 7,08 (s, 1 Н), 7,76 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 403,0; С 17 Н 12 Сl2F3N3+ NH4 требует 403,07. Пример 21. 3-Циано-1-(2,6-дихлор-4 трифторметилфенил)-4-(спиро[2.2]пентан-2-ил) пиразол. Перемешиваемый раствор соединения,указанного в заголовке подготовительного примера 18, (0,507 г), метиленциклопропана (5 мл) и димера ацетата родия(II) (0,045 г) в безводном дихлорметане (7 мл) нагревали при 55 С в течение 24 ч в закрытой толстостенной стеклянной емкости, а затем оставляли охлаждаться. Полученную смесь очищали как в примере 13 с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 108-110 С.(СDСl3): 0,81 (m, 1H), 0,91 (m, 1 Н), 0,991,18 (m, 3H), 1,66 (dd, 1H), 2,21 (dd, 1H), 7,29 (s,1H), 7,74 (s, 2H). МС (терморазбрызгивание):C16H10Cl2F3N3+NH4 требует 389,05. Пример 22. 4-(2,2-Дибромциклопропил-1(2,6-дихлор-4-трифторметилфенил)-3-метил) пиразол. Бромоформ (1,08 мл), затем раствор гидроксида натрия (0,495 г) в воде (1 мл) и этанол (0,1 мл) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 22, (0,993 г) в дихлорметане(4 мл). Затем добавляли бензилтриэтиламмонийхлорид (0,222 г), и реакционную смесь нагревали при 50 С в течение 6 дней. Затем вновь добавляли бромоформ, водный раствор гидроксида натрия и этанол в тех же количествах и продолжали перемешивание при 50 С в течение 5 дней. Охлажденную реакционную смесь рас 25 пределяли между эфиром и водой, затем отделяли водную фазу и экстрагировали эфиром (х 2). Объединенные органические растворы высушивали (Nа 2SО 4) и выпаривали при пониженном давлении, затем остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексакдихлорометан(3:2), растирали с холодным гексаном, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества, температура плавления 66,8-68,2 С.(СDСl3): 1,87 (t,1H), 2,19 (dd, 1H), 2,47 (s,3H), 2,64 (dd, 1H), 7,22 (s, 1H), 7,80 (s, 2 Н). МСC14H9Br2Cl2F3N2+H требует 490,85. Пример 23. 4-(2,2-Дибромциклопропил)-1(2,6-дихлор-4-трифторметилфенил-3,5-диметил) пиразол. Бромоформ (1,1 г), затем раствор гидроксида натрия (0,175 г) в воде (0,5 мл) и этанол(0,1 мл) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 25 (0,368 г) в дихлорметане(2 мл). Затем добавляли бензилтриэтиламмонийхлорид (0,01 г), и реакционную смесь нагревали с обратным холодильником в течение 4 дней. Далее вновь добавляли бромоформ, водный раствор гидроксида натрия и этанол в тех же количествах, и продолжали перемешивание с обратным холодильником в течение 9 дней. Охлажденную реакционную смесь разбавляли дихлорометаном (20 мл), затем эту смесь последовательно промывали водой (3 х 15 мл) и рассолом (10 мл), высушивали (MgSO4) и выпаривали под давлением. Остаток очищали колоночной хроматографией на силикагеле (30 г), используя в качестве элюента гексан, а затем смесь гексан:эфир:дихлорметан (8:1:1), с последующей ВЭЖХ с обращенной фазой на силикагеле С 18,используя в качестве элюента смесь ацетонитрил: вода: метанол (60:30:10), с получением указанного в заголовке соединения в виде масла.(CDCl3): 1,93 (t, 1H), 2,10 (s, 3 Н), 2,19 (dd,1H), 2,36 (s, 3 Н), 2,60 (dd, 1H), 7,73 (s, 2 Н). МС(терморазбрызгивание): M/Z [М+Н] 504,9; С 15 Н 11 Вr2 Сl2F3N2 + Н требует 504,87. Пример 24. 4-(2,2-Дибромциклопропил)-3 метил-1-(2,4,6-трихлорфенил)пиразол. Раствор гидроксида натрия (0,64 г) в воде(1 мл) и этанол (0,1 мл) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 28, (1,0 г),бромоформа (2 мл) и бензилтриэтиламмонийхлорида (0,04 г) в дихлорометане (2 мл), реакционную смесь нагревали с обратным холодильником в течение 16 ч, затем оставляли охлаждаться. Полученную смесь распределяли между дихлорометаном и водой, затем отделяли органическую фазу, последовательно промывали водой и рассолом, высушивали (Na2SO4) и выпаривали при пониженном давлении. Остаток 26 очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан: этилацетат (50:1), и получали желтое масло,которое далее очищали аналогичным образом,используя в качестве элюента смесь гексан: этилацетат (19:1), с последующим растиранием с пропан-2-олом, с получением указанного в заголовке соединения в виде желтого твердого вещества, температура плавления 84-86 С.(СDСl3): 1,79 (t, 1H), 2,19 (dd, 1H), 2,44 (s,3H), 2,63 (dd, 1 Н), 7,18 (s, 1H), 7,44 (s, 2H). МС(терморазбрызгивание): M/Z [М+Н] 456,8; С 13 Н 9 Вr2 Сl3N2+Н требует 456,83. Пример 25. 4-(2,2-Дихлорциклопропил-3 метил-1-(2,4,6-трихлорфенил)пиразол. 50% водный раствор гидроксида натрия (2 мл) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 28 (1,0 г), хлороформа (7 мл) и бензилтриэтиламмонийхлорида (0,08 г) в смеси с этанолом (0,2 мл) и дихлорметаном (2 мл),далее реакционную смесь нагревали с обратным холодильником в течение 16 ч. Затем вновь добавляли хлороформ (3 мл), бензилтриэтиламмонийхлорид (0,04 г) и раствор (1 мл) гидроксида натрия, далее эту смесь перемешивали с обратным холодильником в течение 16 ч, оставляли охлаждаться и распределяли между дихлорметаном и водой. Органическую фазу отделяли,последовательно промывали водой и рассолом,высушивали (Na2SO4) и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат(19:1), с получением желтого масла, которое далее очищали ВЭЖХ с обращенной фазой на силикагеле С 18, используя в качестве элюента смесь ацетонитрил: вода: метанол (60:30:10), с получением указанного в заголовке соединения в виде бесцветного масла.(CDCl3): 1,61 (t, 1H), 2,02 (dd, 1H), 2,42 (s,3H), 2,63 (dd, 1H), 7,20 (s, 1H), 7,47 (s, 2H). МСC13H9Cl5N2+H требует 368,93. Примеры 26 А и 26 В. А. 4-(с-2-Бром-r-1-циклопропил-3-циано-1(2,6-дилор-4-трифторметилфенил)пиразол. В. 4-(t-2-Бром-r-1-циклопропил-3-циано-1(2,6-дилор-4-трифторметилфенил)пиразол. Три-н-бутилтингидрид (0,9 г) по каплям через шприц добавляли к перемешиваемому раствору соединения примера 2 (0,504 г) в толуоле (10 мл) при температуре -10 С. Реакционную смесь оставляли нагреваться до комнатной температуры, перемешивали в течение 5 ч, выдерживали при температуре -20 С в течение 3 дней, вновь оставляли нагреваться до комнатной температуры, а затем вновь обрабатывали три-н-бутилтингидридом (0,9 г). Эту смесь перемешивали в течение последующих 24 ч, обрабатывали водой, а затем, через 30 мин, отделяли 27 водную фазу и осуществляли экстракцию дихлорметаном. Объединенные органические фазы высушивали и выпаривали при пониженном давлении, с получением коричневого масла,которое очищали колоночной хроматографией на силикагеле, используя в качестве элюентов смесь гексан:дихлорметан (4:1), а затем дихлорметан, с последующей кристаллизацией требуемого вещества из дипроп-2-илового эфира, и получали изомер А в виде серовато-белого твердого вещества, температура плавления 120,5-121 С.(СDСl3): 1,22 (m, 1H), 1,82 (m, 1H), 2,29(m, 1H), 3,40 (m, 1H), 7,47 (s, 1H), 7,78 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 441,0; С 14 Н 7 ВrСl2F3N3+NН 4 требует 440,95. Очистка маточного раствора от кристаллизации посредством ВЭЖХ с обращенной фазой на силикагеле С 18 с использованием в качестве элюента смеси ацетонитрил:вода: метанол(m, 1H), 3,14 (m, 1H). 7,39 (s, 1H), 7,78 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 441,4; С 14 Н 7 ВrСl2F3N3+NH4 требует 440,95. Пример 27. 3-Циано-1-(2,6-дихлортрифторметилфенил)-4-(трифторметилциклопропил)пиразол. Раствор соединения, указанного в заголовке подготовительного примера 31, (27 г) в ксилоле (250 мл) осторожно нагревали под обратным холодильником в течение 16 ч, затем растворитель удаляли выпариванием при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (1 кг), используя в качестве элюентов гексан, а затем смесь гексан:эфир (8:1), с последующей кристаллизацией из циклогексана, с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 141 С.(СDСl3): 1,24 (m, 2 Н), 1,52 (m, 2 Н), 7,72M/Z [M+NH4] 431,3; C15H7Cl2F6N3+NH4 требует 431,0. Пример 28. 5-Хлор-3-циано-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразол. К перемешиваемому раствору соединения,указанного в заголовке подготовительного примера 33, (0,288 г) в дихлорметане (1 мл) добавляли бромоформ (0,275 мл), а затем раствор гидроксида натрия (0,126 г) в воде (0,25 мл) и этанол (0,05 мл). Далее добавляли бензилтриэтиламмонийхлорид (0,006 г), и реакционную смесь энергично перемешивали при комнатной температуре в течение 48 ч, нагревали при 50 С в течение 7 ч, а затем перемешивали при ком 002278 28 натной температуре в течение 24 ч. После дальнейшего нагревания при 50 С в течение 24 ч добавляли бромоформ (0,275 мл), раствор гидроксида натрия (0,126 г) в воде (0,25 мл) и этанол (0,05 мл), и нагревание продолжали в течение 72 ч. Реакционную смесь охлаждали, распределяли между эфиром и водой, отделяли и экстрагировали водную фазу эфиром (х 2). Объединенные экстракты промывали рассолом, высушивали (Na2SO4) и выпаривали при пониженном давлении, затем остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:дихлорметан(3:2), с последующей перекристаллизацией из гексана, с получением указанного в заголовке соединения в виде белого твердого вещества,температура плавления 103,5-104,2 С.(СDСl3): 2,31 (dd, 1 Н), 2,42 (t, 1H), 2,78(dd, 1H), 7,80 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 552,9; С 14 Н 5 Вr2 Сl3F3N3+NН 4 требует 552,82. Пример 29. 4-(2,2-Дибромциклопропил)-1(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол. К перемешиваемому раствору соединения,указанного в заголовке подготовительного примера 36, (0,530 г) в дихлорметане (3 мл) добавляли бромоформ (0,49 мл), затем раствор гидроксида натрия (0,226 г) в воде (1 мл) и этанол (0,1 мл). Далее добавляли бензилтриэтиламмонийхлорид (0,01 г), и реакционную смесь нагревали при 50 С в течение 3 дней. Далее добавляли бромоформ (0,49 мл), раствор гидроксида натрия (0,226 г) в воде (1 мл), этанол (0,1 мл), и продолжали нагревание в течение 5 дней. Реакционную смесь оставляли охлаждаться, распределяли между эфиром и водой, отделяли водную фазу и экстрагировали эфиром (х 2). Объединенные органические экстракты промывали рассолом, высушивали (Na2SO4) и выпаривали при пониженном давлении, затем остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:эфир:дихлорметан (1:1:2), с последующей ВЭЖХ с обращенной фазой на силикагеле С 18,используя в качестве элюента смесь ацетонитрил: вода: метанол (60:30:10), с получением указанного в заголовке соединения в виде зеленовато-желтой смолы.(СDСl3):1,87 (t, 1H), 2,28 (dd, 1H), 2,84C14H6Br2Cl2F6N2+H требует 544,83. Пример 30. 4-(2,2-Дибромциклопропил)-1(2,6-дихлор-4-трифторметилфенилметилфенил)3-фенилпиразол. К перемешиваемому раствору соединения,указанного в заголовке подготовительного примера 40, (0,3 г) в дихлорметане (4 мл) добавляли бромоформ (1 мл), затем раствор гидроксида(0,022 г), и реакционную смесь нагревали при 50 С в течение 5 дней, оставляли охлаждаться и распределяли в дихлорметане (10 мл) и воде (10 мл). Органическую фазу отделяли, промывали водой, высушивали (MgSO4) и выпаривали при пониженном давлении, затем остаток очищали колоночной хроматографией на силикагеле (70 г) с градиентным элюированием смесью гексан:эфир (100:0, 95:5, 90:10, 0:100), и далее ВЭЖХ с обращенной фазой на силикагеле С 18,используя в качестве элюента смесь ацетонитрил: вода: метанол (60:30:10). Требуемые фракции из колонки ВЭЖХ концентрировали и экстрагировали дихлорметаном (3 х 20 мл). После лиофильной сушки объединенных экстрактов получали указанное в заголовке соединение в виде не совсем белого твердого вещества, температура плавления 47-48 С.(CDCl3): 1,86 (t, 1H), 2,22 (dd, 1H), 2,80M/Z [М+Н] 553,5; С 19 Н 11 Вr2 Сl2F3N2+Н требует 552,87. Пример 31. 4-(1-Хлордифторметилциклопропил)-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 44, по аналогии с примером 27, но нагревая в течение 4 часов, используя в качестве хроматографического элюента смесь гексан:эфир (8:1), и не производя далее кристаллизации, в виде белого твердого вещества, температура плавления 124125 С.(СDСl3): 1,24 (m, 2H), 1,58 (m, 2H), 7,74M/Z [М+NН 4] 446,9; С 15 Н 7 Сl3F5N3+NН 4 требует 447.0. Пример 32. 3-Циано-1-(2,6-дихлор-4 трифторметилфенил)-4-(1-этилциклопропил)пиразол. 0,467 М раствор диазометана в эфире (30 мл) добавляли в течение 2 мин к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 47 (3 г) и ацетата палладия(II) (0,025 г) в эфире (5 мл), и полученную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь фильтровали, обрабатывали дополнительными порциями эфирного раствора диазометана (30 мл) и ацетата палладия(II) (0,025 г), вновь перемешивали в течение 4 ч, фильтровали, далее вновь обрабатывали эфирным раствором диазометана (30 мл) и ацетата палладия(II) (0,025 г),вновь перемешивали в течение 40 ч, фильтровали, далее вновь обрабатывали эфирным раствором диазометана (30 мл) и ацетата палладия(II)(0,025 г), вновь перемешивали в течение 88 ч,фильтровали, далее вновь обрабатывали эфир 002278 30 ным раствором диазометана (30 мл) и ацетата палладия(II) (0,025 г), вновь перемешивали в течение 2 ч, фильтровали, далее вновь обрабатывали эфирным раствором диазометана (30 мл) и ацетата палладия(II) (0,025 г), вновь перемешивали в течение 18 ч, а затем выпаривали при пониженном давлении. Остаток очищали ВЭЖХ с обращенной фазой на силикагеле С 18, используя в качестве элюента смесь ацетонитрил: вода(60:40), с получением указанного в заголовке соединения в виде белого твердого вещества,температура плавления 118-119 С.(СDСl3): 0,80 (m, 2H), 0,90 (m, 5 Н), 1,63(m, 2H), 7,44 (s, 1H), 7,77 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 390,8; С 16 Н 12 Сl2F3N3+NН 4 требует 391,1. Пример 33. 3-Циано-4-(2,2-дибром-1-этилциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Раствор соединения, указанного в заголовке подготовительного примера 47, (105 мг) и фенилтрибромметилртути (160 мг) в толуоле (4 мл) нагревали при температуре 70 С в течение 2 ч, затем добавляли раствор фенилтрибромметилртути (180 мг) в толуоле (2 мл), и смесь нагревали при температуре 70 С в течение 16 ч,далее вновь добавляли фенилтрибромметилртуть (230 мг), и смесь нагревали при температуре 70 С в течение 4 ч, далее вновь добавляли фенилтрибромметилртуть (310 мг), и смесь нагревали при температуре 70 С в течение 2 ч,далее вновь добавляли фенилтрибромметилртуть (310 мг), и смесь нагревали при температуре 70 С в течение 16 ч, затем смесь оставляли охлаждаться. Полученную смесь фильтровали через силикагель (10 г), используя в качестве элюентов гексан, а затем дихлорметан, и требуемые элюаты выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (10 г), используя в качестве элюентов смесь дихлорметан: гексан(1:4), с последующей ВЭЖХ с обращенной фазой на силикагеле С 18, используя в качестве элюента смесь ацетонитрил: вода: метанол(60:30:10), с получением указанного в заголовке соединения в виде белого твердого вещества,температура плавления 107-108 С.(СDСl3): 1,04 (t, 3 Н), 1,90 (m, 2H), 2,19C16H10Br2Cl2F3N3+H требует 529,9. Пример 34. 3-Циано-1-(2,6-дихлор-4 трифторметилфенил)-4-(1-пентафторэтилциклопропил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 50, по аналогии с примером 31, но применяя ВЭЖХ с обращенной фазой на силикагеле С 18 с использованием в качестве элюента смеси ацетонитрил:вода:метанол (60:30:10), в виде белого твер 31 дого вещества, температура плавления 105106 С.(CDCl3): 1,24 (m, 2H), 1,55 (m, 2H), 7,67(s, 1H), 7,77 (s, 2H). МС (электроразбрызгивание): M/Z [М+Н] 464,0; С 16 Н 7 Сl2F8N3+Н требует 464,0. Пример 35. 3-Циано-1-(2,6-дихлор-4 трифторметилфенил)-4-(1-гептафторпропилциклопропил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 53 по аналогии с примером 31, но нагревая в течение 3 ч и осуществляя после хроматографии кристаллизацию из циклогексана, в виде белого твердого вещества, температура плавления 95-96 С.(СDСl3): 1,23 (m, 2H), 1,54 (m, 2H), 7,65C17H7Cl2F10N3+H требует 514,0. Пример 36. 5-Амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-(1-трифторметилциклопропил)пиразол. Раствор соединения, указанного в заголовке подготовительного примера 55 (130 мг) в смеси ксилола (8 мл) и толуола (1 мл) осторожно нагревали с обратным холодильником в течение 7 ч, затем оставляли при комнатной температуре в течение 16 ч. Растворитель удаляли выпариванием при пониженном давлении, и полученный остаток очищали ВЭЖХ с обращенной фазой на силикагеле С 18, используя в качестве элюента смесь ацетонитрил: вода: метанол (45:45:10), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 178-179 С.(CDCl3): 1,13 (m, 2H), 1,48 (m, 2H), 3,91(br.s, 2H), 7,80 (s, 2H). МС (терморазбрызгивание): M/Z [М+Н] 429,1; С 15 Н 8 Сl2F6N4+Н требует 429,0. Пример 37. 1-[(3-Хлор-5-трифторметил) пиридин-2-ил]-3-циано-4-(2,2-дибромциклопропил)пиразол. Раствор соединения, указанного в заголовке подготовительного примера 58, (0,50 г) и фенилтрибромметилртути (1,0 г) в толуоле (5 мл) нагревали при 70 С в атмосфере азота в течение 1,5 ч. Затем добавляли дополнительное количество фенилтрибромметилртути (0,50 г) и продолжали нагревание в течение последующих 72 ч. Полученную смесь оставляли охлаждаться,распределяли между эфиром и водой, отделяли и экстрагировали водную фазу эфиром (х 2). Объединенные экстракты последовательно промывали водой и насыщенным рассолом, высушивали (МgSO4) и выпаривали при пониженном давлении. Неочищенный продукт (0,50 г) в виде коричневого масла очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат (9:1), с получением указанного в заголовке соединения в 32 виде желтого твердого вещества, температура плавления 81-83 С.(CDCl3): 2,05 (t, 1 Н), 2,33 (dd, 1H), 2,85(dd, 1H), 8,20 (s, 1H), 8,23 (s, 1H), 8,70 (s, 1H). МС (терморазбрызгивание): M/Z [М+Н] 467,9; С 13 Н 6 Вr2 СlF3N4+Н требует 467,9. Пример 38. 3-Ацетил-4-(2,2-дибромциклопропил)-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Раствор соединения, указанного в заголовке примера 2, (3,42 г) в эфире (25 мл) добавляли к перемешиваемой и охлаждаемой льдом смеси 3,0 М раствора метилмагниййодида в эфире(2,26 мл) и безводного эфира (25 мл) в атмосфере азота, пока не установится температура реакции ниже 2 С. Реакционную смесь оставляли для нагревания до комнатной температуры, нагревали с обратным холодильником в течение 2 ч, а затем обрабатывали дополнительным количеством (0,5 мл) 3 М эфирного раствора метилмагниййодида. Эту смесь нагревали с обратным холодильником в течение 1 ч и затем перемешивали при комнатной температуре в течение 18 ч. Затем вновь добавляли эфирный раствор метилмагниййодида (1 мл), и полученную смесь нагревали с обратным холодильником в течение 3 ч, затем эту смесь выливали в перемешиваемую смесь концентрированной соляной кислоты(х 3) с последующей промывкой объединенных экстрактов рассолом, сушки (MgSO4) и выпаривания при пониженном давлении, получали неочищенный продукт, который очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан : дихлорметан (1:1) с последующей кристаллизацией из гексана, с получением указанного в заголовке соединения в виде светло-желтого твердого вещества, температура плавления 149,5-150,3 С.(СDСl3): 1,78 (dd, 1H), 2,24 (dd, 1H), 2,69(s, 3H), 3,37 (dd, 1H), 7,34 (s, 1H), 7,78 (s, 2H),МС (терморазбрызгивание): M/Z [M+NH4] 536,3; С 15 Н 9 Вr2 Сl2F3N2O+NН 4 требует 535,88. Пример 39. 4-(2,2-Дибромциклопропил)-1(2,6-дихлор-4-трифторметилфенил)-3-(1-гидроксиэтил)пиразол. 1 М раствор комплекса боран: тетрагидрофуран в тетрагидрофуране (4,61 мл) добавляли к перемешиваемому раствору соединения, указанного в заголовке примера 38, (0,40 г) в безводном тетрагидрофуране (5 мл) при температуре примерно -50 С в атмосфере азота. Реакционную смесь оставляли нагреваться до комнатной температуры, перемешивали в течение последующих 4 ч, а затем выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан: эфир (3:1), с получением указанного в заголовке соединения в виде маслянистого белого твердого вещества.(5 мл) при температуре примерно -75 С, пока не установится температура реакции ниже -70 С. Затем добавляли диэтилэфират трифторида бора(0,17 мл), и реакционную смесь оставляли нагреваться до комнатной температуры, затем перемешивали в течение дальнейших 24 ч. Далее смесь охлаждали до температуры примерно-70 С, а затем добавляли дополнительное количество триэтилсилана (0,22 мл) и диэтилэфирата трифторида бора (0,17 мл), удаляли охлаждающую баню и продолжали перемешивание при комнатной температуре в течение 4 дней. Полученную смесь промывали разбавленной соляной кислотой и проводили водную фазой экстрагировали дихлорметаном (х 2). Объединенные органические растворы промывали рассолом, высушивали (Na2SO4) и выпаривали при пониженном давлении, затем остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:эфир (2:1), с получением указанного в заголовке соединения в виде бесцветного масла.(СDСl3): 1,45 (t, 3H), 1,80 (t, 1H), 2,20 (dd,1H), 2,65 (dd, 1H), 2,85 (q, 2 Н), 7,20 (s, 1H), 7,70C15H11Br2Cl2F3N2 + Н требует 504,87. Пример 41. 4-(2,2-Дибромциклопропил-1(2,6-дихлор-4-трифторметилфенил)-3-(2-гидроксипроп-2-ил)пиразол. Раствор соединения, указанного в заголовке примера 38, (0,30 г) в эфире (5 мл) добавляли к перемешиваемой охлаждаемой льдом смеси 3,0 М раствора метилмагниййодида (0,21 мл) и безводного эфира (5 мл) в атмосфере азота, пока не установится температура реакции ниже 2 С. Реакционную смесь оставляли нагреваться до комнатной температуры, нагревали с обратным холодильником в течение 1 ч, оставляли охлаждаться, затем выливали в перемешиваемую смесь концентрированной соляной кислоты (2 мл) и льда (10 г). После экстракции эфиром (х 3) с последующей промывкой объединенных экстрактов рассолом, сушки (MgSO4) и выпаривания при пониженном давлении получали неочищенный продукт, который кристаллизовали из толуола с получением указанного в заголовке соединения в виде белого твердого вещества,температура плавления 132,1-132,7 С.-75 С, пока не установится температура реакции ниже -70 С. Затем добавляли диэтилэфират трифторида бора (0,11 мл), и реакционную смесь оставляли при температуре приблизительно -70 С на 2,5 ч, а затем оставляли нагреваться до комнатной температуры. Через 24 ч смесь промывали разбавленной соляной кислотой, и водную фазу экстрагировали эфиром (х 2). Объединенные органические растворы промывали рассолом, высушивали (Nа 2SO4) и выпаривали при пониженном давлении с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:эфирM/Z [М+Н] 518,4; С 16 Н 13 Вr2 Сl2F3N2+ Н требует 518,89. Пример 43. 4-(2,2-Дибромциклопропил)-1(2,6-дихлор-4-трифторметилфенил)-3-формилпиразол. 1 М раствор диизобутилалюмогидрида в гексане (1,5 мл) по каплям в течение 5 мин добавляли к перемешиваемому охлаждаемому льдом раствору соединения, указанного в заголовке примера 2, (0,50 г) в безводном тетрагидрофуране (15 мл). Через 1 ч реакционную смесь обрабатывали следующей порцией (2,25 мл) раствора гидрида, перемешивали в течение 18 ч и затем выливали в подкисленный водный раствор метанола. Эту смесь экстрагировали эфиром (х 2), затем объединенные экстракты последовательно промывали водой и рассолом, высушивали (MgSO4) и выпаривали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилэтилацетат (9:1), с получением указанного в заголовке соединения в виде масла.(СDСl3): 1,80 (dd, 1 Н), 2,28 (dd, 1 Н), 3,32 35 Диэтиламиносульфида трифторид (0,13 г) добавляли к перемешиваемому раствору соединения, указанного в заголовке примера 43, (0,20 г) в дихлорметане (5 мл). После выдержки в течение 3 ч при комнатной температуре реакционную смесь разбавляли дихлорометаном, промывали водой (х 2), высушивали (MgSO4) и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат (19:1), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 99-101 С.(CDCl3): 1,85 (t, 1H), 2,25 (dd, 1H), 2,95(10 мл). После выдержки в течение 24 ч добавляли следующую порцию пентахлорида фосфора (0,17 г), и реакционную смесь перемешивали в течение дальнейших 24 ч с последующим выпариванием при пониженном давлении. Очистку остатка осуществляли колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат (19:1), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 87-89 С.(CDCl3): 1,90 (t, 1H), 2,29 (dd, 1H), 3,12C14H7Br2Cl4F3N2+H требует 558,78. Пример 46. 3-Циано-4-(2,2-дибромциклопропил)-1-(2,4,6-трихлорфенил)пиразол. Смесь соединения, указанного в заголовке подготовительного примера 61, (2,0 г), 96% бромоформа, стабилизированного 1-3% этанола(6,5 мл), гидроксида натрия (1,0 г), воды (1,0 мл), этанола (0,14 мл), дихлорометана (6,5 мл) и бензилтриэтиламмонийхлорида (80 мг) при энергичном перемешивании осторожно нагревали с обратным холодильником при температуре около 40 С в течение 6 ч, затем при комнатной температуре в течение 18 ч и вновь при температуре около 40 С в течение 6 часов. Затем вновь добавляли гидроксид натрия (0,3 г),воду (0,6 мл) и катализатор на основе четверичной аммониевой соли (130 мг), реакционную смесь энергично перемешивали при температуре около 40 С в течение 6 ч, затем при комнатной температуре в течение 18 ч. Далее вновь добавляли катализатор (100 мг), реакционную смесь перемешивали при температуре около 40 С в течение 6 ч, а затем при комнатной температуре в течение 66 ч. Далее добавляли еще 36 катализатора (100 мг) и еще дихлорометана (2,0 мл), и реакционную смесь перемешивали при температуре около 40 С в течение 6 часов, при комнатной температуре в течение 18 ч, при температуре около 40 С в течение 7 ч, при комнатной температуре около 18 ч, при температуре около 40 С в течение 7 часов, и при комнатной температуре в течение 18 ч. В заключение вновь добавляли 96% бромоформ (3,0 мл), 50% водный раствор гидроксида натрия (0,5 мл), дихлорометан (3,0 мл) и катализатор (150 мг), и полученную смесь перемешивали при комнатной температуре в течение 1 недели, затем ее распределяли в дихлорометане (100 мл) и воде (50 мл). Отделенную органическую фазу промывали водой (50 мл), высушивали (Na2SO4) и выпаривали при пониженном давлении с получением черной смолы, которую очищали колоночной хроматографией на силикагеле (100 г), используя в качестве элюентов гексан, а затем смесь гексан:эфир:дихлорметан (8:1:1), с получением указанного в заголовке соединения в виде желтоватого твердого вещества, температура плавления 164 С.(CDCl3): 2,02 (t, 1H), 2,34 (dd, 1H), 2,87(dd, 1H), 7,48 (s, 1H), 7,51 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 484,6; С 13 Н 6 Вr2 Сl3N3 + NH4 требует 484,8. Пример 47. 3-Циано-4-(2,2-дихлорциклопропил)-1-(2,4,6-трихлорфенил)пиразол. Смесь соединения, указанного в заголовке подготовительного примера 61, (2,0 г), хлороформа (6,0 мл), гидроксида натрия (1,0 г), воды(1,0 мл), этанола (0,2 мл), дихлорметана (6,5 мл) и бензилтриэтиламмонийхлорида (150 мг) быстро перемешивали при температуре около 40 С в течение 66 ч. Затем вновь добавляли гидроксид натрия (0,5 г), воду (1,0 мл), дихлорметан (4 мл) и катализатор в виде четвертичной аммониевой соли (180 мг), и реакционную смесь перемешивали при температуре примерно 40 С в течение 90 ч. Далее вновь добавляли катализатор (150 мг), дихлорметан (5,0 мл), 50%, водный раствор(0,5 мл) гидроксида натрия и хлороформ (3,0 мл), и полученную смесь перемешивали при 36 С в течение 10 дней, затем ее распределяли между дихлорметом (100 мл) и водой (50 мл). Отделенную органическую фазу промывали водой (50 мл), сушили (Na2SO4) и выпаривали при пониженном давлении с получением черной смолы, которую очищали колоночной хроматографией на силикагеле (80 г), используя в качестве элюента смесь гексан:эфир:дихлорметан 37 Пример 48. 5-Амино-3-циано-4-(2,2-дихлорциклопропил)-1-(2,6-дихлор-4-пентафтортиофенил)пиразол. Энергично перемешиваемую смесь 5-амино-3-циано-1-(2,6-дихлор-4-пентафтортиофенил)-4-этенилпиразола (WO-A-97/07102; 0,50 г),хлороформа (3,0 мл), раствора гидроксида натрия (0,25 г) в воде (0,25 мл), этанола (2 капли),дихлорметана (2,0 мл) и бензилтриэтиламмонийхлорида (25 мг) при энергичном перемешивании нагревали с обратным холодильником в течение 18 ч, затем вновь добавляли хлороформ(3,0 мл) и катализатор в виде четвертичной аммониевой соли (25 мг), и продолжали нагревание с обратным холодильником в течение 78 ч. Далее вновь добавляли хлороформ (3,0 мл) и катализатор (25 мг), и полученную смесь перемешивали с обратным холодильником в течение 4 дней, затем ее распределяли между дихлорметаном (30 мл) и водой (30 мл). Отделенную органическую фазу промывали водой (2 х 20 мл) и насыщенным рассолом (20 мл), высушивали(Na2SO4) и выпаривали при пониженном давлении с получением темно-коричневого масла. Этот неочищенный продукт очищали следующим образом:(а) предварительная абсорбция на силикагеле (1,5 г) с использованием в качестве растворителя дихлорметана с последующей колоночной хроматографией на силикагеле (20 г) с использованием в качестве элюента смеси гексан: этилацетат (7:3);(б) ВЭЖХ с обращенной фазой на силикагеле С 18 с использованием в качестве элюента смеси ацетонитрил : вода (70:30); и(в) повторная ВЭЖХ с обращенной фазой на силикагеле С 18 с использованием в качестве элюента смеси ацетонитрил : метанол : вода(50:10:40); с получением соединения, указанного в заголовке, в виде твердого вещества белого цвета с желтоватым или сероватым оттенком,температура плавления 90-95 С.(CDCl3): 2,23 (m, 2 Н), 2,56 (t, 1H), 3,84C13H7Cl4F5N4S + Н требует 486,9,Пример 49. 3-Циано-4-(2,2-дихлорциклопропил)-1-(2,6-дихлор-4-пентафтортиофенил) пиразол. Реакцию проводили по методике примера 48 с использованием в качестве исходного соединения 3-циано-1-(2,6-дихлор-4-пентафтортиофенил)-4-этенилпиразола (WO-A-97/07102). Неочищенный продукт в виде темнокоричневого масла очищали следующим образом:(а) предварительная абсорбция на силикагеле (1,5 г) с использованием в качестве растворителя дихлорметана с последующей колоночной хроматографией на силикагеле (15 г) с использованием в качестве элюента смеси гексан:этилацетат гексан:эфир:дихлорметан (8:1:1);(б) растирание полученного светложелтого масла с диизопропиловым эфиром, последующая фильтрация и выпаривание фильтрата при пониженном давлении с образованием желтого масла, которое при стоянии затвердевало;(в) ВЭЖХ с обращенной фазой на силикагеле С 18 с использованием в качестве элюента смеси ацетонитрил:вода (70:30);(г) повторная ВЭЖХ с обращенной фазой на силикагеле С 18, предварительно промытом гексаном, с использованием в качестве элюентов гексана, а затем дихлорметана; и(д) растворение полученного масла в метаноле с последующим добавлением к этому раствору воды до его помутнения при дальнейшем охлаждении; с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 78-80C.(CDCl3): 1,87 (t, 1H), 2,20 (m, 1 Н), 2,85N-Иодсукцинимид (3,52 г) порциями в течении 5 минут добавляли к перемешиваемому раствору 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-пиразола (ЕР-А-0295117; 5,0 г) в ацетонитриле (60 мл) при комнатной температуре. После перемешивания в течение 1 ч реакционную смесь выпаривали при пониженном давлении, и получали неочищенный продукт(8,2 г) который, несмотря на содержание сукцинимида, можно использовать без дальнейшей очистки. При желании, можно произвести очитку распределением неочищенного продукта между дихлорметаном и водой, отделением и сушкой(MgSO4) органической фазы и выпариванием ее при пониженном давлении, а затем растиранием полученного желтого твердого вещества с гексаном, с получением соединения, указанного в заголовке, в виде белого твердого вещества,температура плавления 213 С (разл.). Подготовительный пример 2. 5-Амино-3 циано-1-(2,6-дихлор-4-трифторметилфенил)-4 этенилпиразол. Три-н-бутил(винил)олово (4,25 г) и тетракис(трифенилфосфин)палладия(0) (0,3 г) добавляли к перемешиваемому раствору соединения,указанного в заголовке подготовительного примера 1, (2,0 г) в диметилформамиде (10 мл) при комнатной температуре, и полученную смесь нагревали при температуре 75 С в течение 1 ч,затем перемешивали при комнатной температуре в течение последующих 60 ч и разбавляли водой. Смесь экстрагировали эфиром и объединенные экстракты промывали рассолом, высушивали (MgSO4) и выпаривали при пониженном давлении с получением неочищенного продукта(6,0 г) в виде черного масла, которое очищали колоночной хроматографией на силикагеле (200 г), используя в качестве элюента смесь гексан:дихлорметан (1:1), с получением указанного в заголовке соединения в виде желтоватокоричневого вещества, температура плавления 186-187 С.(СDСl3): 3,85 (s, 2H), 5,41 (d, 1H), 5,70 (d,1H), 6,52 (dd, 1 Н), 7,80 (s, 2H). МС (терморазбрызгивание): M/Z [М+Н] 347,0;C13H7Cl2F3N4 + Н требует 347,0. Подготовительный пример 3. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-йодпиразол. Трет-бутилнитрит (144 мл) в течение 30 мин добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 1, (90 г) в тетрагидрофуране(720 мл) при температуре 65 С. После 3 ч при температуре 65 С реакционную смесь оставляли охлаждаться и выпаривали при пониженном давлении, затем остаток кристаллизовали из пропанола с получением указанного в заголовке соединения в виде белого твердого вещества,температура плавления 83-84 С.(СDСl3): 7,70 (s, 1H), 7,79 (s, 2H). МС(терморазбрызгивание): M/Z [М+NН 4] 448,8; С 11 Н 3 Сl2F3IN3+NH4 требует 448,9. Подготовительный пример 4. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-этенилпиразол. Раствор соединения, указанного в заголовке подготовительного примера 3, (58 г), три-нбутил(винил)олова (116 мл) и тетракис(трифенилфосфин)палладия(0) (3,5 г) в диметилформамиде (350 мл) перемешивали при 75 С в течение 3 ч, а затем оставляли охлаждаться. Реакционную смесь распределяли между эфиром(600 мл) и водой (600 мл), затем органическую фазу последовательно промывали водой (х 5) и рассолом, высушивали (Na2SO4) и выпаривали при пониженном давлении. Остаток кристаллизовали из пропан-2-ола с получением указанного в заголовке соединения в виде светлокоричневого твердого вещества, температура плавления 75-76 С.(СDСl3): 5,50 (d, 1 Н), 5,94 (d, 1 Н), 6,64N-Иодсукцинимид (11,5 г) четырьмя порциями в течение 5 мин добавляли к перемешиваемому раствору 5-амино-3-циано-1-(2,6 дихлор-4-пентафтортиофенил)-пиразола (WOA-93/06089; 18,95 г) в ацетонитриле (100 мл) при комнатной температуре. После следующих 15 мин реакционную смесь выпаривали при пониженном давлении, и твердый остаток обраба 002278 40 тывали смесью дихлорметана и воды. Нерастворимое вещество отделяли фильтрацией и растворяли в этилацетате, затем этот раствор высушивали (Na2SO4), выпаривали при пониженном давлении с получением указанного в заголовке соединения в виде желтоватокоричневого твердого вещества, температура плавления 253 С.(СDСl3): 3,94 (br.s, 2H), 7,92 (s, 2H). -МС(терморазбрызгивание): M/Z [M+NH4] 521,9; С 10H4 Сl2F5IN4S +NH4 требует 521,88. Подготовительный пример 6. 5-Амино-3 циано-1-(2,6-дихлор-4-пентафтортиофенил)-4 этенилпиразол. Три-н-бутил(винил)олово (4,5 мл) добавляли к перемешиваемому дегазированному раствору соединения, указанного в заголовке подготовительного примера 5, (5,05 г) и тетракис(трифенилфосфин)палладия(0) (0,175 г) в диметилформамиде (32 мл) при комнатной температуре, и полученную смесь нагревали при 70 С в течение 30 мин. Через 1 ч при температуре 70 С добавляли три-н-бутил(винил)олово(0) (0,175 г), и реакционную смесь нагревали при температуре 70 С в течение 1 ч, затем выпаривали при пониженном давлении. Остаток распределяли между эфиром и водой, затем отделенную органическую фазу объединяли с эфирными экстрактами водной фазы, промывали рассолом, высушивали (MgSO4) и выпаривали при пониженном давлении с получением коричневой пасты, которую растирали с гексаном. Полученное коричневое твердое вещество обрабатывали этилацетатом, смесь фильтровали,фильтрат выпаривали при пониженном давлении, и остаток кристаллизовали из толуола с получением указанного в заголовке соединения в виде желтовато-коричневого твердого вещества, температура плавления 227-228 С.(CDCl3): 3,86 (s, 2H), 5,41 (d, 1H), 5,68 (d,1 Н), 6,50 (dd, 1H), 7,92 (s, 2H). МС (терморазбрызгивание): M/Z [М+Н] 405,1;C12H7Cl2F5N4S+H требует 404,98. Подготовительный пример 7. 3-Циано-1(2,6-дихлор-4-пентафтортиофенил)-4-йодпиразол. Раствор трет-бутилнитрита (3,1 г) в тетрагидрофуране (15 мл) по каплям в течение 30 мин добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 5, (2,5 г) в тетрагидрофуране(35 мл), затем реакционную смесь выпаривали при пониженном давлении. В результате кристаллизации остатка из пропан-2-ола получали указанное в заголовке соединение в виде розоватого твердого вещества, температура плавления 179-180 С.(СDСl3):7,66 (S, 1H), 7,90 (s, 2H). МС 41 Подготовительный пример 8. 3-Циано-1(2,6-дихлор-4-пентафтортиофенил)-4-этенилпиразол. Три-н-бутил(винил)олово (4,2 мл) добавляли к перемешиваемому дегазированному раствору соединения, указанного в заголовке подготовительного примера 7, (1,23 г) и тетракис(трифенилфосфин)палладия(0) (0,09 г) в диметилформамиде (32 мл) при комнатной температуре, полученную смесь нагревали при 70 С в течение 1,5 ч, затем выпаривали при пониженном давлении. Остаток растирали с гексаном и полученное вещество очищали растворением в дихлорметане и колоночной хроматографией этого раствора на силикагеле (60 г), используя в качестве элюентов гексан, а затем смесь гексан:дихлорметан (80:20), с получением соединения, указанного в заголовке, в виде белого твердого вещества, температура плавления 156 С.(CDCl3): 5,50 (d, 1H), 5,95 (d, 1 Н), 6,63C12H6Cl2F5N3S+NH4 требует 406,99. Подготовительный пример 9. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-формилпиразол. Раствор соединения, указанного в заголовке подготовительного примера 4, (0,1 г), 2,5 мас.% раствора тетраоксида осмия в третбутаноле (50 мкл) и 4-метилморфолин-N-оксида(0,005 г) в 90% водном растворе ацетона (50 мл) перемешивали при комнатной температуре в течение 16 ч. Затем добавляли периодат натрия(0,005 г), и реакционную смесь перемешивали в течение последующих 16 ч, затем выпаривали при пониженном давлении. Остаток распределяли между эфиром и насыщенным водным раствором бикарбоната натрия, водную фазу отделяли, экстрагировали эфиром, затем объединенные эфирные экстракты высушивали (Na2SO4) и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (5 г), используя в качестве элюента дихлорметан, с получением указанного в заголовке соединения в виде бежевого твердого вещества, температура плавления 167,5-168,5 С.(CDCl3): 7,80 (s, 2H), 8,18 (s, 1H), 10,08 (s,1H). МС (терморазбрызгивание): M/Z [M+NH4] 351,3; С 12 Н 4 Сl2F3N3 О + NH4 требует 351,0. Подготовительный пример 10. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-(2-метилпропен-1-ил)пиразол. 2,5 М раствор н-бутиллития в гексане (0,9 мл) добавляли к перемешиваемому раствору проп-2-илтрифенилфосфониййодида (0,97 г) в безводном эфире (10 мл) при комнатной температуре с получением темно-красного раствора. Затем добавляли раствор соединения, указанного в заголовке подготовительного примера 9, 002278(0,6 г) в эфире (20 мл), и реакционную смесь перемешивали в течение 2 ч, промывали водой(20 мл), высушивали (MgSO4) и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента дихлорметан, с получением указанного в заголовке соединения в виде желтоватого-коричневатого твердого вещества,температура плавления 72-74 С.(CDCl3): 1,90 (s, 3 Н), 1,99 (s, 3 Н), 6,17 (s,1 Н), 7,60 (s, 1H), 7,77 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 360,2; С 15 Н 10 Сl2F3N3+NH4 требует 360,03. Подготовительный пример 11. 5-Амино-3 циано-1-(2,6-дихлор-4-трифторметилфенил)-4 триметилсилилэтинилпиразол. Триметилсилилацетилен (3 мл), йодид меди (150 мг) и бис(трифенилфосфин)палладий(II) хлорид (300 мг) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 1, (6,96 г) в смеси триэтилама (30 мл) и диметилформамида (6 мл) при комнатной температуре, и полученную смесь нагревали при температуре 50-60 С в течение 1 ч. Затем вновь добавляли триметилсилилацетилен (0,3 мл), и далее реакционную смесь перемешивали в течение 30 мин при температуре 50-60 С, оставляли охлаждаться и разбавляли водой (250 мл). Эту смесь экстрагировали эфиром (250 мл), используя рассол, чтобы облегчить разделение фаз, водную фазу отделяли и экстрагировали эфиром (250 мл). Объединенные эфирные экстракты высушивали(MgSO4) и выпаривали при пониженном давлении с получением смолы (4,67 г), которую очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:дихлорметан (1:1), с последующей кристаллизацией требуемого вещества из смеси гексанэфир, получая таким образом указанное в заголовке соединение в виде белого твердого вещества, температура плавления 181-182 С.(СDСl3): 0,20 (s, 9H), 4,10 (br.s, 2H), 7,70[M+NH4] 434,2; С 16 Н 13 Сl2F3N4Si+NН 4 требует 434,0. Подготовительный пример 12. 5-Амино-3 циано-1-(2,6-дихлор-4-трифторметилфенил)-4 этинилпиразол. Карбонат калия (1,0 г) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 11, (2,0 г) в метаноле (30 мл). После 10 мин при комнатной температуре реакционную смесь распределяли между эфиром (100 мл) и водой (100 мл),затем органическую фазу отделяли, промывали рассолом (100 мл), высушивали (MgSO4) и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента дихлорме 43 тан, с последующей кристаллизацией из эфира с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 215-216 С.(CDCl3): 3,49 (s, 1H), 4,20 (br.s, 2H), 7,80[M+NH4] 362,4; С 13 Н 5 Сl2F3N4+NН 4 требует 362,0. Подготовительный пример 13. 4-Ацетил-5 амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол. п-Толуолсульфоновую кислоту (0,5 г) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 12, (0,345 г) в ацетонитриле (5 мл). После 2 ч выдержки при комнатной температуре реакционную смесь распределяли между эфиром (100 мл) и водой (100 мл), затем органическую фазу отделяли, промывали последовательно насыщенным водным раствором бикарбоната натрия и рассолом, высушивали (Na2SO4) и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (40 г), используя в качестве элюента смесь гексан:дихлорметан (1:10), с получением указанного в заголовке соединения в виде белого кристаллического вещества, температура плавления 200-201 С.(СDСl3): 2,65 (s, 3 Н), 5,83 (br.s, 2H), 7,82[M+NH4] 380,4; С 13 Н 7 Сl2F3N4O+NН 4 требует 380,03. Подготовительный пример 14. 4-Ацетил-3 циано-1-(2,6-дихлор-трифторметилфенил)пиразол. Трет-бутилнитрит (0,0262 мл) по каплям добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 13, (0,4 г) в тетрагидрофуране (2 мл). Реакционную смесь нагревали с обратным холодильником в течение 30 мин, а затем подавали в колонку с силикагелем (1,0 г). Элюирование тетрагидрофураном дало указанное в заголовке соединение в виде белого твердого вещества, температура плавления 166-168 С.(СDСl3): 2,67 (s, 3 Н), 7,80 (s, 2H), 8,12 (s,1 Н). МС (терморазбрызгивание): M/Z [M+NH4] 365,0; С 13 Н 6 Сl2F3N3 О требует 365,02. Подготовительный пример 15. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-(1-метилэтенил)пиразол. 2,5 М раствор н-бутиллития в тетрагидрофуране (0,64 мл) добавляли к перемешиваемой суспензии метилтрифенилфосфонийбромида(0,565 г) в безводном эфире (10 мл) с получением желтого раствора, к которому добавляли раствор соединения, указанного в заголовке подготовительного примера 14, (0,5 г) в безводном тетрагидрофуране (10 мл). Реакционную смесь нагревали при 30 С в течение 4 ч, оставляли 44 охлаждаться и распределяли между эфиром (100 мл) и насыщенным водным раствором бикарбоната натрия (100 мл). Органическую фазу отделяли, высушивали, выпаривали при пониженном давлении, затем остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:дихлорметан(1:9), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 129-130 С.(СDСl3): 2,16 (s, 3 Н), 5,29 (s, 1 Н), 5,80 (s,1H), 7,59 (s, 1H), 7,88 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 362,9;C14H8Cl2F3N3 + NH4 требует 363,04. Подготовительный пример 16. 3-Циано-1(2,6-диxлор-4-пентафтортиoфeнил)-4-(2-иoд-1 мeтoкcиэтил)пиpaзoл. Оксид ртути (0,325 г) и йод (0,381 г) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 8, (0,5 г) в метаноле (10 мл), затем полученную смесь нагревали с обратным холодильником в течение 3 ч, оставляли охлаждаться и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента дихлорметан, с получением указанного в заголовке соединения в виде желтого твердого вещества, температура плавления 92-94 С.(СDСl3): 3,46 (s, 3 Н), 3,54 (m, 2H), 4,49 (t,1H), 7,70(s, 1H), 7,78 (s,2H). Подготовительный пример 17. 3-Циано-1(2,6-дихлор-4-пентафтортиофенил)-4-(1-метоксиэтенил)пиразол. 1,8-Диазобицикло[5.4.0]ундец-7-ен (0,064 г) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 16, (0,2 г) в толуоле (10 мл). После выдержки при комнатной температуре в течение 18 ч реакционную смесь выпаривали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюентов гексан, а затем смесь гексан:дихлорметан (1:5), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 116-118 С.(CDCl3): 3,75 (s, 3 Н), 4,45 (d, 1 Н), 4,98 (d,1H), 7,78 (s, 2H+1H). МС (терморазбрызгивание): M/Z [М+Н] 362,1;C14H8Cl2F3N3O+H требует 362,01. Подготовительный пример 18. N-[3-Циано 1-(2,6-дихлор-4-трифторметилфенил)пиразол-4 илметилиден]-N'-(4-метилфенилсульфонил)гидразин, литиевая соль. Раствор соединения, указанного в заголовке Подготовительного примера 9, (0,333 г) и птолуолсульфонилгидразина (0,186 г) в тетрагидрофуране перемешивали при комнатной температуре в течение 10 мин, а затем добавляли активированные молекулярные сита А (2 гранулы, 45 приблизительно 0,011 г). Смесь охлаждали в атмосфере азота до -78 С и в течение 3 мин добавили 2,5 М раствор н-бутиллития в гексане(0,4 мл). Реакционную смесь оставляли нагреваться до комнатной температуры, отфильтровывали, и фильтрат обрабатывали гексаном (40 мл). Полученный белый осадок собирали при помощи фильтрации, высушивали с получением указанного в заголовке соединения в виде белого твердого вещества.(ДМСО d6): 2,28 (s, 3 Н), 7,10 (d, 2H), 7,45(100 мл), затем полученный раствор обрабатывали концентрированной серной кислотой (1,0 мл) с получением белого твердого осадка. Смесь нагревали с обратным холодильником в течение 6 ч, оставляли охлаждаться и перемешивали в течение дальнейших 18 ч при комнатной температуре; этот цикл повторяли, затем вновь добавляли концентрированную серную кислоту (4 мл). Реакционную смесь нагревали при 60 С в течение 8 ч, оставляли охлаждаться, перемешивали при комнатной температуре в течение 18 ч и выпаривали при пониженном давлении. Полученное оранжевое масло распределяли между дихлорметаном (100 мл) и водой (100 мл), затем органическую фазу высушивали, оставляли стоять при комнатной температуре в течение 18 ч и фильтровали до удаления белого твердого вещества. Этот фильтрат выпаривали при пониженном давлении с получением оранжевого масла, которое растирали с горячим гексаном. В результате охлаждения из гексанового раствора осаждалось желтое масло, которое медленно кристаллизовалось с образованием соединения,указанного в заголовке, в виде белого твердого вещества, температура плавления 80-83 С. Обнаружено: С, 42,73; Н, 2,62; N, 13,58.N-Йодсукцинимид (5,5 г) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 19,(9,0 г) в ацетонитриле (200 мл) при комнатной температуре. Реакционную смесь нагревали с обратным холодильником в течение 1 ч, остав 002278 46 ляли при комнатной температуре в течение 18 ч,а затем выпаривали при пониженном давлении. Остаток экстрагировали горячим гексаном, и выпадавший из охлажденного гексанового раствора осадок собирали и высушивали с получением указанного в заголовке соединения в виде не совсем белого твердого вещества, температура плавления 116-118 С.(CDCl3): 2,24 (s, 3 Н), 3,68 (br.s, 2H), 7,74(s, 2H). МС (терморазбрызгивание): M/Z [M+H] 435,8; С 11 Н 7 Сl2F3IN3+Н требует 435,91. Подготовительный пример 21. 1-(2,6 Дихлор-4-трифторметилфенил)-4-йод-3-метилпиразол. Трет-бутилнитрит (2,33 мл) по каплям добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 20, (2,85 г) в тетрагидрофуране (35 мл) при температуре 0 С. Реакционную смесь оставляли нагреваться до комнатной температуры,нагревали с обратным холодильником в течение 1,5 ч, затем выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:дихлорметан (1:1), с получением желтого масла, которое далее очищали аналогичным способом, используя в качестве элюента смесь гексан:дихлорметан (2:1). Таким образом получали указанное в заголовке соединение в виде белого твердого вещества, температура плавления 118,5-119,4 С.(CDCl3): 2,18 (s, 3H), 7,54 (s, 1H), 7,70 (s,2H). МС (терморазбрызгивание): M/Z [М+Н] 420,5;(0,1 г) и три-н-бутил(винил)олово (2 мл) добавляли к перемешиваемому раствору соединения,указанного в заголовке подготовительного примера 21, (2,06 г) в диметилформамиде (25 мл), и реакционную смесь нагревали при температуре 70 С в течение 2 ч, затем выпаривали при пониженном давлении. Остаток распределяли между эфиром и водой, отделяли водную фазу,экстрагировали эфиром (х 2), и объединенные органические растворы промывали рассолом,высушивали (Na2SO4) и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан:эфир (9:1), с последующей ВЭЖХ с обращенной фазой на силикагеле С 18, используя в качестве элюента смесь ацетонитрил : вода : метанол (40:50:10), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 68,1-68,7 С.C13H9Cl2F3N2+H требует 321,02. Подготовительный пример 23. 1-(2,6 Дихлор-4-трифторметилфенил)-3,5-диметилпиразол. Пентан-2,4-дион (0,100 г) добавляли к перемешиваемому раствору 2,6-дихлор-4 трифторметилфенилгидразина (0,245 г) в этаноле (4,5 мл), затем добавляли ледяную уксусную кислоту (0,5 мл) при комнатной температуре. Реакционную смесь нагревали с обратным холодильником в течение 1 ч, затем выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента дихлорметан, с получением вначале бесцветного масла, которое,после удаления под вакуумом избытка растворителя, кристаллизовывалось с получением указанного в заголовке соединения (0,265 г), температура плавления 87-89 С.(CDCl3): 2,10 (s, 3 Н), 2,32 (s, 3 Н), 6,07 (s,1 Н), 7,72 (s, 2H). МС (терморазбрызгивание):M/Z [M] 309,0; C12H9Cl2F3N2 требует 309,12. Подготовительный пример 24. 1-(2,6 Дихлор-4-трифторметилфенил)-3,5-диметил-4 йодпиразол. Раствор N-йодсукцинимида (0,158 г) в ацетонитриле (3 мл) по каплям добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 23,(0,218 г) в ацетонитриле (3 мл) при комнатной температуре. Через 27 ч реакционную смесь выпаривали при пониженном давлении, остаток,очищали колоночной хроматографией на силикагеле (5 г), используя в качестве элюента дихлорметан, с получением указанного в заголовке соединения в виде желтого масла.(CDCl3): 2,11 (s, 3 Н), 2,32 (s, 3 Н), 7,73 (s,2H). МС (терморазбрызгивание): M/Z [М+Н] 435,0;C12H8Cl2F3IN2+H требует 434,91. Подготовительный пример 25. 1-(2,6 Дихлор-4-трифторметилфенил)-3,5-диметил-4 этенилпиразол. Раствор соединения, указанного в заголовке подготовительного примера 24, (1,0 г), три-нбутил(винил)олова (2 мл) и тетракис(трифенилфосфин)палладия(0) (0,1 г) в диметилформамиде (10 мл) перемешивали при температуре 75 С в течение 2 ч, а затем при комнатной температуре в течение 18 ч. Реакционную смесь последовательно перемешивали при температуре 75 С в течение 2 ч, обрабатывали три-нбутил(винил)оловом (2 мл), перемешивали при температуре 75 С в течение 2 ч, обрабатывали тетракис(трифенилфосфин)палладием(0) (0,1 г),перемешивали при температуре 75 С в течение 2 ч и выпаривали при пониженном давлении. Остаток распределяли между дихлорметаном и 48 водой, затем органическую фазу отделяли, промывали последовательно водой (х 2) и рассолом,высушивали (Na2SO4) и выпаривали при пониженном давлении. Полученный неочищенный продукт адсорбировали на силикагель (20 г), а затем очищали колоночной хроматографией на силикагеле (150 г) с градиентным элюированием смесью гексан:дихлорметан (100:0 и 0:100) с получением указанного в заголовке соединения в виде желтого масла.(СDСl3): 2,11 (s, 3 Н), 2,40 (s, 3H), 5,23 (d,1H), 5,41 (d, 1H), 6,59 (dd, 1H), 7,71 (s, 2H). МСC14H11Cl2F3N2+H требует 335,03. Подготовительный пример 26. 5-Амино-4 йод-3-метил-1-(2,4,6-трихлорфенил)пиразол. Перемешиваемый раствор 5-амино-3 метил-1-(2,4,6-трихлорофенил)пиразола (WO-A94/13643; 35 г) и N-йодсукцинимида (29 г) в ацетонитриле (450 мл) нагревали с обратным холодильником в течение 1,5 ч, затем реакционную смесь оставляли охлаждаться и выпаривали при пониженном давлении. Остаток растворяли в дихлорметане, и раствор промывали последовательно водным раствором тиосульфата натрия, водой и рассолом, затем высушивали(Na2SO4) и выпаривали при пониженном давлении. Полученное соединение с темной окраской растирали с гексаном с получением указанного в заголовке соединения в виде светлооранжевого твердого вещества, температура плавления 135-137 С.(СDСl3): 2,25 (s, 3 Н), 3,67 (br.s, 2H), 7,49(s, 2H). МС (терморазбрызгивание): M/Z [М+Н] 401,4; С 10 Н 7 Сl3F3IN3 + Н требует 401,88. Подготовительный пример 27. 4-Йод-3 метил-1-(2,4,6-трихлорфенил)пиразол. Раствор трет-бутилнитрита (12 мл) в безводном тетрагидрофуране (50 мл) по каплям добавляли к перемешиваемому, слабо дефлегмирующему раствору соединения, указанного в заголовке подготовительного примера 26, (18,11 г) в безводном тетрагидрофуране (120 мл). Реакционную смесь оставляли охлаждаться и выпаривали при пониженном давлении, затем остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюентов гексан, а затем смесь гексан : этилацетат (19:1), с получением указанного в заголовке соединения в виде оранжевого твердого вещества, температура плавления 97-99 С.(CDCl3): 2,36 (s, 3H), 7,47 (s, 2H), 7,48 (s,1H). МС (терморазбрызгивание): M/Z [М+Н] 386,9; C10H6Cl3IN2+H требует 386,87. Подготовительный пример 28. 4-Этенил-3 метил-1-(2,4,6-трихлорфенил)пиразол. Перемешиваемый раствор соединения,указанного в заголовке подготовительного примера 27, (16,62 г), три-н-бутил(винил)олова(100 мл) нагревали при температуре 75 С в течение 2,5 ч. Далее вновь добавляли тетракис(трифенилфосфин)палладий (0) (0,6 г), и реакционную смесь нагревали при температуре 75 С в течение последующих 2 ч, затем выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюентов гексан, а затем смесь гексан : этил ацетат (99:1), с получением указанного в заголовке соединения в виде светло-желтого твердого вещества, температура плавления 71-73 С.(CDCl3): 2,40 (s, 3H), 5,19 (d, 1H), 5,49 (d,1H), 6,59 (dd, 1H), 7,47 (s, 2H), 7,50 (s, 1H). МС(терморазбрызгивание): M/Z [M+NH4] 287,0; С 12 Н 9 Сl3N2+NН 4 требует 286,99. Подготовительный пример 29. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-трифторацетилпиразол. Трет-бутилнитрит (12,45 мл) по каплям добавляли к перемешиваемому раствору 5 амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторацетилпиразола(JP-A-8311036; 30 г) в тетрагидрофуране (250 мл), и смесь перемешивали при температуре 55 С в течение 16 ч. В дальнейшем количества добавляемого трет-бутил нитрита и соответствующие длительности периодов перемешивания при температуре 55 С были следующие: 9 мл/7 ч, 6 мл /16 ч, 9 мл /6 ч, 4,75 мл /16 ч, 6 мл /6 ч и 3,5 мл/22 ч. Реакционную смесь оставляли охлаждаться и выпаривали при пониженном давлении,затем остаток объединяли с остатками, которые были получены в результате трех аналогичных получении. В результате очистки колоночной хроматографией на силикагеле (1 кг) с использованием в качестве элюентов смеси гексан:дихлорметан (6:4), а затем дихлорметана было получено желтое масло, которое растирали с гексаном (3 х 50 мл) и далее с дихлорметаном (100 мл), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 124-125 С.(CDCl3): 7,83 (s, 2H), 8,30 (s, 1H). МС(терморазбрызгивание): M/Z [М+Н] 401,7; С 13 Н 3 Сl2F6N3O+NН 4+Н требует 401,96. Подготовительный пример 30. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-(3,3,3 трифторпропен-2-ил)пиразол. 2,5 М раствор н-бутиллития в гексане (0,11 мл) по каплям добавляли к перемешиваемой суспензии метилтрифенилфосфониййодида (111 мг) в тетрагидрофуране (6 мл) в атмосфере азота при комнатной температуре. Полученный красновато-коричневый раствор добавляли по каплям в атмосфере азота к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 29, (100 мг) в тетрагидрофуране (1 мл) при комнатной температуре, и реакционную смесь перемешивали в течение 30 50 мин. Затем добавляли воду (30 мл), производили экстракцию эфиром (50 мл), сушили органический экстракт (Na2SO4) и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (10 г),используя в качестве элюента смесь гексан:дихлорметан (1:1) с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 103-104 С.(СDСl3): 6,20 (s, 1H), 6,39 (s, 1H), 7,78 (s,1 Н), 7,80 (s, 2H). МС (терморазбрызгивание):(100 мл) медленно добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 30, (27 г) в эфире (150 мл) при комнатной температуре, и смесь перемешивали в течение 40 мин. Затем вновь медленно добавляли диазометан (50 ммолей) в эфире (150 мл), и реакционную смесь перемешивали в течение дальнейших 16 ч при комнатной температуре. Избыток диазометана отгоняли, а затем выпаривали растворитель при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества.(CDCl3): 2,23 (m, 1H), 2,52 (m, 1 Н), 4,90C15H7Cl2F6N5+NH4 требует 459,0. Подготовительный пример 32. 5-Хлор-3 циано-1-(2,6-дихлор-4-трифторметилфенил)-4 йодпиразол. Приблизительно 1 М раствор нитрозилхлорида в дихлорметане (2,7 мл) по каплям добавляли к перемешиваемому охлажденному льдом раствору соединения, указанного в заголовке подготовительного примера 1, (1,0 г) в ацетонитриле (15 мл), затем реакционную смесь нагревали с обратным холодильником в течение 10 мин и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюентов смесь гексан:толуол (2:1), а затем толуол,с получением указанного в заголовке соединения в виде светло-оранжевого твердого вещества, температура плавления 115,7-116,3 С.(CDCl3): 7,80 (s, 2H). MS (терморазбрызгивание): M/Z [М+Н] 466,0; С 11 Н 2 Сl3F3IN3+Н требует 465,84. Подготовительный пример 33. 5-Хлор-3 циано-1-(2,6-дихлор-4-трифторметилфенил)-4 этенилпиразол. Тетракис(трифенилфосфин)палладия(0)(0,448 г) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 32, (6,0 г) в диметилформа 51 миде (75 мл) при комнатной температуре, через 5 мин по каплям добавляли три-н-бутил (винил)олово (11,3 мл). Полученную смесь нагревали при температуре 70 С в течение 18 ч, затем выпаривали при пониженном давлении и распределяли остаток между эфиром и водой. Органическую фазу отделяли, высушивали и выпаривали при пониженном давлении, затем полученный остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюентов гексан, а затем смесь гексан:дихлорметан (2:1), с последующей кристаллизацией из гексана, с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 69,8-70,4 С.(CDCl3): 5,61 (d, 1H), 6,20 (d, 1 Н), 6,56(WO-A-87/03781) по аналогии с подготовительным примером 1 в виде не совсем белого твердого вещества, температура плавления 126 С.(CDCl3): 3,90 (br.s, 2 Н), 7,80 (s, 2H). МСC11H4Cl2F6IN3+Н требует 489,88. Подготовительный пример 35. 1-(2,6 Дихлор-4-трифторметилфенил)-4-йод-3-трифторметилпиразол. Получали из соединения, указанного в заголовке подготовительного примера 34, по аналогии с подготовительным примером 3 в виде масла, которое при стоянии затвердевает. Кристаллизация из пропан-2-ола обеспечивала получение указанного в заголовке соединения в виде желтого твердого вещества, температура плавления 109-112 С. Обнаружено: С, 27,87; Н, 0,69; N, 6,15. С 11 Н 4 Сl2F6IN3 требует С.27,82; Н.0,64; N.5,90%.(СDСl3): 7,70 (s, 1H); 7,77 (s,2H). Подготовительный пример 36. 1-(2,6 Дихлор-4-трифторметилфенил)-4-этенил-3 трифторметилпиразол. Получали из соединения, указанного в заголовке подготовительного примера 35, по аналогии с подготовительным примером 4, за исключением того, что неочищенный продукт кристаллизовали из гексана, затем осуществляли его дальнейшую очистку колоночной хроматографией на силикагеле, используя в качестве элюента эфир, с последующей ВЭЖХ с обращенной фазой на силикагеле С 18, используя в качестве элюента смесь ацетонитрил : метанол : вода (40:10:50), с последующей кристаллизацией из пропан-2-ола с получением указанного в заголовке соединения в виде светло-желтогоC13H6Cl2F6IN2+NH4 требует 392,02. Подготовительный пример 37. 5-Амино-1(2,6-дихлор-4-трифторметилфенил)-3-фенилпиразол. Раствор 2,6-дихлор-4-трифторметилфенилгидразина (0,245 г) в этаноле (2 мл) добавляли к перемешиваемому раствору бензоилацетонитрила (0,145 г) в этаноле (8 мл), и полученный раствор нагревали с обратным холодильником в течение 6 ч. Затем добавляли ледяную уксусную кислоту (1 мл), полученную смесь нагревали с обратным холодильником в течение последующих 6 часов, а затем выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (10 г), используя в качестве элюента дихлорметан, с последующей ВЭЖХ с обращенной фазой на силикагеле С 18, используя в качестве элюента смесь ацетонитрил:метанол:вода (50:10:40), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 141,5-142,5 С.(СDСl3): 3,60 (br.s, 2H), 6,08 (s, 1H), 7,307,45 (m, 3 Н), 7,80 (s, 2H), 7,80-7,85 (m, 2H). МСC16H10Cl2F3N2+H требует 372,03. Подготовительный пример 38. 5-Амино-1(2,6-дихлор-4-трифторметилфенил)-4-йод-3 фенилпиразол. Получали из соединения, указанного в заголовке подготовительного примера 37, по аналогии с подготовительным примером 1, за исключением того, что реакционную смесь перемешивали в течение 18 ч с получением желтого твердого вещества, температура плавления 162164 С.(СDСl3): 3,80 (br.s. 2H), 7,35 (m, 3 Н), 7,78C16H9Cl2F3IN3+H требует 497,93. Подготовительный пример 39. 1-(2,6-Дихлор-4-трифторметилфенил-4-йод-3-фенилпиразол. Раствор трет-бутилнитрита (3,0 г) в тетрагидрофуране (20 мл) в течение 30 мин по каплям добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 38, (2,5 г) в тетрагидрофуране(50 мл) при температуре 65 С. После выдержки в течение последующих 3 ч при температуре 65 С реакционную смесь оставляли охлаждаться, выдерживали при комнатной температуре в течение 18 ч, а затем выпаривали при пониженном давлении. Полученное масло очищали в две стадии колоночной хроматографией на силикагеле, вначале в качестве элюента использовали(95:5) и гексан:этилацетат (90:10), с получением указанного в заголовке соединения в виде кремового твердого вещества, температура плавления 88-89 С.(СDСl3): 7,45 (m, 3 Н), 7,70 (s, 1H), 7,72 (s,2H), 7,95 (m, 2H). МС (терморазбрызгивание):(0,07 г) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 39, (1,0 г) в диметилформамиде (12 мл) при комнатной температуре, 10 мин спустя добавляли три-н-бутил(винил)олово(1,8 мл). Полученную смесь нагревали при 70 С в течение 6 ч, оставляли при комнатной температуре в течение 18 ч, затем выпаривали при пониженном давлении. Остаток распределяли между дихлорометаном (50 мл) и водой (50 мл),затем органическую фазу отделяли, высушивали(МgSO4) и выпаривали при пониженном давлении. Остаток очищали в две стадии колоночной хроматографией на силикагеле, вначале используя градиент элюирования этилацетата в гексане, а затем градиент элюирования эфира в гексане, с получением указанного в заголовке соединения в виде желтого масла.(СDСl3): 5,25 (d, 1H), 5,65 (d, 1H), 6,80C18H11Cl2F3N2+H требует 383,03. Подготовительный пример 41. 5-Амино-4 хлордифторацетил-3-циано-1-(2,6-дихлор-4 трифторометилфенил)пиразол. Хлордифторуксусный ангидрид (30,37 г) добавляли по каплям к перемешиваемому охлаждаемому льдом раствору 5-амино-3-циано-1(2,6-дихлор-4-трифторметилфенил)пиразола(ЕР-А-0295117; 20,0 г) в пиридине (200 мл), затем реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Полученную смесь концентрировали удалением пиридина (150 мл) при пониженном давлении, затем ее выливали в перемешиваемую смесь вода/лед (500 мл). Добавляя по каплям при перемешивании концентрированную соляную кислоту (30 мл), рН этой смеси доводили до 1 и осуществляли экстракцию этилацетатом (2 х 500 мл). Объединенные органические экстракты промывали насыщенным водным раствором двууглекислого натрия (500 мл), высушивали(MgSO4) и выпаривали при пониженном давлении. Остаток растворяли в смеси тетрагидрофурана (200 мл) и воды (50 мл), затем раствор нагревали при 60 С в течение 16 ч, оставляли охлаждаться, и большую часть тетрагидрофурана удаляли выпариванием при пониженном давле 002278 54 нии. Далее производили экстракцию этилацетатом (2 х 300 мл), и объединенные органические экстракты промывали последовательно водой(MgSO4) и выпаривали при пониженном давлении. Полученный остаток кристаллизовали из пропан-2-ола с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 225-226 С.(СDСl3): 6,08 (br.s, 2H), 7,84 (s, 2H). МС (терморазбрызгивание): M/Z [M+NH4] 450,1; С 13 Н 4 Сl3F5N4+NH4 требует 450,0. Подготовительный пример 42. 4-Хлордифторацетил-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Трет-бутилнитрит (12,45 мл) по каплям добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 41, (13,7 г) в тетрагидрофуране (100 мл), смесь нагревали при температуре 60 С в течение 22 ч, оставляли охлаждаться и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (50 г), используя в качестве элюента дихлорметан, далее растирали с гексаном (5 х 50 мл) и кристаллизовали из дихлорметана с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 124-125 С.(СDСl3): 7,83 (s, 2H), 8,27 (s, 1H). МСC13H3Cl3F5N3O+NH4 требует 435,0. Подготовительный пример 43. 4-(3-Хлор 3,3-дифторпропен-2-ил)-3-циано-1-(2,6-дихлор 4-трифторометилфенил)пиразол. 2,5 М раствор н-бутиллития в гексане (3,8 мл) по каплям добавляли к перемешиваемой суспензии метилтрифенилфосфониййодида(3,817 г) в тетрагидрофуране (20 мл) в атмосфере азота при комнатной температуре. Полученный красновато-коричневый раствор добавляли по каплям, в атмосфере азота, к перемешиваемому раствору соединения, указанного в заголовке Подготовительного примера 42, (3,95 г) в тетрагидрофуране (30 мл) при комнатной температуре, и реакционную смесь перемешивали в течение 1 ч. Затем добавляли воду (50 мл), производили экстракцию эфиром (2 х 50 мл), и объединенные органические экстракты высушивали(Na2SO4) и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (100 г), используя в качестве элюента смесь гексан:дихлорометан (1:1),затем кристаллизовали из пропан-2-ола с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 113-114 С.(СDСl3): 6,12 (s, 1H), 6,20 (s, 1 Н), 7,75 (s,2H), 7,80 (s, 1H). МС (терморазбрызгивание):C14H5Cl3F5N3+NH4 требует 433,0. Подготовительный пример 44. 4-(3-Хлордифторметил-1-пиразолин-3-ил)-3-циано-1-(2,6 дихлор-4-трифторметилфенил)пиразол. Раствор диазометана в эфире (7,0 мл, 2,3 ммоля) медленно добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 43, (800 мг) в эфире(10 мл) при комнатной температуре, и смесь перемешивали в течение 1 ч. Избыток диазометана и растворитель выпаривали в устойчивом токе азота с получением указанного в заголовке соединения в виде белого твердого вещества.(СDСl3): 2,27 (m, 1H), 2,58 (m, 1H), 4,90(WO-A-97/07102; 2,1 г) в ацетонитриле (40 мл),и смесь перемешивали при комнатной температуре в течение 1 ч. Далее вновь добавляли ртолуолсульфоновой кислоты моногидрат (1,0), и эту смесь перемешивали при комнатной температуре в течение 16 ч. Затем вновь добавляли ацетонитрил (20 мл) и р-толуолсульфоновой кислоты моногидрат (1,0 г), и перемешивание продолжали в течение 1 ч, далее реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия (500 мл) и экстрагировали эфиром (2 х 100 мл). Объединенный органический экстракт промывали рассолом (100 мл),высушивали (Na2SO4) и выпаривали при пониженном давлении, затем остаток очищали колоночной хроматографией на силикагеле (70 г),используя в качестве элюента дихлорметан, с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества,температура плавления 167-169 С.(СDСl3): 1,26 (t, 3 Н), 3,03 (q, 2H), 5,83(br.s, 2H), 7,80 (s, 2 Н), МС (терморазбрызгивание): M/Z [М+Н] 377,2; С 14 Н 9 Сl2F3N4O+Н требует 377,0. Подготовительный пример 46. 3-циано-1(2,6-дихлор-4-трифторметилфенил)-4-пропаноилпиразол. Трет-бутил нитрит (0,66 мл) по каплям добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 45, (1,2 г) в тетрагидрофуране (30 мл),и эту смесь перемешивали при комнатной температуре в течение 1 ч. Далее вновь добавляли трет-бутилнитрит (0,3 мл), и смесь перемешивали при комнатной температуре в течение 1 ч. Затем реакционную смесь нагревали при температуре 60 С в течение 10 мин, оставляли охлаж 002278 56 даться и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (50 г), используя в качестве элюента дихлорометан, с получением указанного в заголовке соединения в виде желтоватого твердого вещества, температура плавления 143 С.(СDСl3): 1,28 (m, 3H), 3,01 (q, 2H), 7,80 (s,2H), 8,15 (s, 1H). МС (терморазбрызгивание):M/Z [M+NH4] 379,3; С 14 Н 8 Сl2F3N3 О+NH4 требует 379,0. Подготовительный пример 47. 4-(Бут-1-ен 2-ил)-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 46, по аналогии с подготовительным примером 43, но используя в качестве хроматографического элюента смесь гексан:дихлорметан (2:3) и не осуществляя последующую кристаллизацию, в виде белого твердого вещества, температура плавления 104-105 С.(СDСl3): 1,19 (t, 3H), 2,47 (q, 2H), 5,29 (s,1H), 5,74 (s, 1H), 7,60 (s, 1H), 7,79 (s, 2H). МС(электроразбрызгивание): M/Z [М+Н] 360,1; С 15 Н 10 Сl2F3N3+Н требует 360,0. Подготовительный пример 48. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-пентафторпропаноилпиразол. 2,5 М раствор н-бутиллития в гексане (2,78 мл) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 3, (3,0 г) в тетрагидрофуране(80 мл) при температуре -80 С в атмосфере азота при такой скорости, при которой температура реакционной смеси не превышала бы -73 С. Смесь перемешивали при температуре -73 С в течение 10 мин, затем добавляли раствор метилпентафторпропионата (0,89 мл) в тетрагидрофуране (5 мл) при такой скорости, при которой температура реакционной смеси не превышала бы -75 С. После завершения добавления,смесь оставляли нагреваться до комнатной температуры в течение 1,5 ч, затем добавляли воду(100 мл), и полученную смесь экстрагировали этилацетатом (2 х 80 мл). Объединенные органические слои высушивали (Na2SO4) и выпаривали при пониженном давлении, затем остаток очищали колоночной хроматографией на силикагеле (150 г), используя в качестве элюента смесь гексан:дихлорметан (1:9), после этого очищали колоночной хроматографией на силикагеле (50 г), используя в качестве элюента смесь гексан:эфир (9:1), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 120 С.(СDСl3): 7,80 (s, 2 Н), 8,25 (s, 1 Н). МС 57 Получали из соединия, указанного в заголовке подготовительного примера 48, по аналогии с подготовительным примером 43, но без какой-либо кристаллизации после хроматографии, в виде белого твердого вещества, температура плавления 107-108 С.(СDСl3): 6,23 (s, 1H), 6,43 (s, 1H), 7,73 (s,1 Н), 7,79 (s, 2 Н). МС (электроразбрызгивание):M/Z [М+Н] 450,0; С 15H5 Сl2F8N3+Н требует 450,0. Подготовительный пример 50. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-(3 пентафторэтил-1-пиразолин-3-ил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 49, по аналогии с подготовительным примером 44, в виде белого твердого вещества.(СDСl3): 2,26 (m, 1H), 2,61 (m, 1H), 4,83C16H7Cl2F8N5+H требует 492,0. Подготовительный пример 51. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-гептафторбутаноилпиразол. Получали из соединения, указанного в заголовке подготовительного примера 3, и метил гептафторбутирата по аналогии с подготовительным примером 48, но используя на первой стадии хроматографической очистки в качестве элюента смеси гексан:эфир (2:3), а на второй такой стадии - градиент элюирования смесью гексан:эфир (19:1 до 9:1), с получением светложелтого твердого вещества, температура плавления 102-103 С.(СDСl3): 7,80 (s, 2H), 8,24 (s, 1H). МС(терморазбрызгивание): M/Z [M+NH4] 518,7; С 15 Н 3 Сl2F10N3+NH4 требует 519,0. Подготовительный пример 52. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-(3,3,4,4,5,5,5-гептафторпент-1-ен-2-ил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 51, по аналогии с подготовительным примером 43, но используя на первой стадии хроматографической очистки в качестве элюента дихлорметан, а на второй такой стадии используя в качестве элюента смесь гексан:дихлорметан (1:1), без последующей перекристаллизации, с получением белого твердого вещества, температура плавления 109-110 С.(СDСl3): 6,24 (s, 1H), 6,43 (s, 1H), 7,73 (s,1H), 7,80 (s, 2H). МС (электроразбрызгивание):M/Z [М+Н] 500,0; C16H5Cl2F10N3+NH требует 500,0. Подготовительный пример 53. 3-Циано-1(2,6-дихлор-4-трифторметилфенил)-4-(3-гептафторпропил-1-пиразолин-3-ил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 52, по аналогии с подготовительным примером 44, в виде белого твердого вещества.C17H7Cl2F10N5+NH4 требует 559,0. Подготовительный пример 54. 5-Амино-3 циано-1-(2,6-дихлор-4-трифторметилфенил)-4 трифторпропен-2-ил)пиразол. Раствор комплеска 3,3,3-трифторпропен-2 илцинкбромид:N,N,N',N',-тетраметилэтилендиамин в тетрагидрофуране (J. Org. Chem., 1991 56, 7336; 4,5 мл, 5 ммолей) добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 1, (1,0 г), и тетракис(трифенилфосфин)палладия(0) (60 мг) в безводном тетрагидрофуране (1,0 мл) в атмосфере азота, реакционную смесь нагревали при температуре 55 С в течение 20 ч, оставляли охлаждаться и выливали в перемешиваемый гексан (50 мл). Полученную смесь фильтровали,фильтр промывали эфиром (50 мл), и объединенные органические растворы выпаривали при пониженном давлении. Остаток очищали двумя стадиями колоночной хроматографии на силикагеле (40 г, затем 10 г), вначале используя в качестве элюента смесь гексан : эфир : дихлорметан (4:1:1), а затем используя в качестве элюентов гексан, смесь гексан:эфир (4:1) и смесь гексан:эфир:дихлорметан (4:1:1), с получением указанного в заголовке соединение в виде светло-желтого твердого вещества, температура плавления 147-148 С.(СDСl3): 3,93 (br.s, 2 Н), 5,96 (s, 1 Н), 6,24M/Z [М+Н] 415,0; C14H6Cl2F6N4+H требует 415,0. Подготовительный пример 55. 5-Амино-3 циано-1-(2,6-дихлор-4-трифторметилфенил)-4(3-трифторметил-1-пиразолин-3-ил)пиразол. Получали из соединения, указанного в заголовке подготовительного примера 54, по аналогии с подготовительным примером 44, в виде белого твердого вещества.(СDСl3): 2,28 (m,1H), 2,60 (m, 1H), 4,77 (br.s, 2H), 4,77 (m, 1H),5,02 (m, 1H), 7,78 (s, 1H), 7,82 (s, 1H). МС (терморазбрызгивание): M/Z [М+Н] 457,0;(ЕР-А-0500209; 7,91 г) в ацетонитриле (100 мл) при комнатной температуре. Через 16 ч реакционную смесь выпаривали при пониженном давлении, твердый остаток растворяли в дихлорметане, и полученный раствор промывали последовательно водным раствором тиосульфата натрия (х 2), водой и насыщенным рассолом, высушивали (MgSO4) и выпаривали при понижен 59 ном давлении с получением указанного в заголовке соединения в виде розового твердого вещества, температура плавления 107-108 С.(СDСl3): 5,15 (br.s, 2H), 8,20 (s, 1 Н), 8,67(s, 1H). МС (терморазбрызгивание): M/Z [М+Н] 413,1; С 10 Н 4 СlF3N5+Н требует 412,9. Подготовительный пример 57. 1-[(3-Хлор 5-трифторметил)пиридин-2-ил]-3-циано-4 йодпиразол. Раствор трет-бутил нитрита (7,2 мл) в тетрагидрофуране (30 мл) добавляли по каплям к перемешиваемой смеси соединения, указанного в заголовке подготовительного примера 56,(12,5 г) в тетрагидрофуране (90 мл), при осторожном нагревании с обратным холодильником,затем реакционную смесь оставляли охлаждаться до комнатной температуры и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смеси гексан:этилацетат(4:1), с получением указанного в заголовке соединения в виде желтого твердого вещества,температура плавления 104-107 С.(СDСl3): 8,20 (s, 1H), 8,70 (s, 1H). МС(терморазбрызгивание): M/Z [М+Н] 397,8; С 10 Н 3 СlF3IN4+H требует 397,9. Подготовительный пример 58. 1-[(3-Хлор 5-трифторметил)пиридин-2-ил]-3-циано-4 этенилпиразол. Три-н-бутил(винил)олово (9,19 г) и тетракис(трифенилфосфин)палладия(0) (0,3 г) добавляли к перемешиваемому раствору соединения,указанного в заголовке подготовительного примера 57, (10,50 г) в диметилформамиде (100 мл) при комнатной температуре, в атмосфере азота,и полученную смесь нагревали при температуре 75 С в течение 16 ч, затем оставляли охлаждаться. Смесь выпаривали при пониженном давлении, остаток распределяли между дихлорметаном и водой, затем отделенную органическую фазу промывали последовательно водой(MgSO4) и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан : этилацетат (9:1), с получением указанного в заголовке соединения в виде белого твердого вещества, температура плавления 57,5-58,5 С.(СDСl3): 5,50 (d, 1 Н), 5,97 (d, 1 Н), 6,65N-Йодсукцинимид (17,67 г) порциями добавляли к перемешиваемому раствору 5-амино 3-циано-1-(2,4,6-трихлорфенил)пиразола (США 5232940; 22,5 г) в ацетонитриле (300 мл), полученную смесь перемешивали при комнатной 60 температуре в течение 1 ч, а затем выпаривали при пониженном давлении. Остаток частично очищали хроматографией на силикагеле (800 г),используя градиентное элюирование смесью дихлорметан : этилацетат (от 100:0 до 0:100), с получением светло-коричневого твердого вещества, которое далее очищали следующим образом. При растирании с гексаном (25 мл) получали остаток, который растворяли в дихлорметане(500 мл). Этот раствор промывали водой (500 мл), промывные воды вновь промывали этилацетатом (500 мл), объединенные органические растворы высушивали (Na2SO4) и выпаривали при пониженном давлении с получением указанного в заголовке соединения в виде светлокоричневого твердого вещества.(ДМСОd6): 6,28 (br.s, 2H), 7,98 (s, 2H). МС (терморазбрызгивание): M/Z [М+Н] 413,0; С 10H4Cl3IN4+Н требует 412,9. Подготовительный пример 60. 3-Циано-4 йод-1-(2,4,6-трихлорфенил)пиразол. Трет-бутилнитрит (7,13 мл) по каплям в течении 5 минут добавляли к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 59, (15,5 г) в тетрагидрофуране (400 мл), затем смесь перемешивали при комнатной температуре в течение 1 ч,нагревали при температуре 60 С в течение 40 мин, оставляли охлаждаться и выпаривали при пониженном давлении. Полученное светлокрасное твердое вещество очищали колоночной хроматографией на силикагеле (500 г), используя в качестве элюента дихлорметан, с получением указанного в заголовке соединения в виде желтоватого твердого вещества.(СDСl3): 7,52 (s, 2 Н), 7,67 (s, 1H). МС(терморазбрызгивание): M/Z [M+NH4] 414,8; С 10 Н 3 Сl3IN3 +NH4 требует 414,9. Подготовительный пример 61. 3-Циано-4 этенил-1-(2,4,6-трихлорфенил)пиразол. Смесь соединения, указанного в заголовке Подготовительного примера 60, (10,8 г), три-нбутил(винил)олова, (20 мл), тетракис(трифенилфосфин)палладия(0) (1,0 г) и диметилформамида (60 мл) перемешивали при температуре 75 С в течение 3 ч, оставляли охлаждаться и выливали в перемешиваемую воду (100 мл). Полученную смесь экстрагировали эфиром(2 х 150 мл), объединенные экстракты промывали водой (50 мл) и выпаривали при пониженном давлении. Остаток очищали растиранием с гексаном (3 х 25 мл) с последующей колоночной хроматографией на силикагеле (200 г), используя градиентное элюирование смесью гексан:этилацетат (от 100:0 до 50:50), а затем кристаллизацией из смеси гексан-дихлорметан с получением указанного в заголовке соединения в виде светло-серого твердого вещества.(СDСl3): 5,46 (d, 1H), 5,92 (d, 1H), 6,63
МПК / Метки
МПК: A61P 33/00, C07D 231/38, A01N 43/56
Метки: противопаразитарные, пиразолы
Код ссылки
<a href="https://eas.patents.su/30-2278-protivoparazitarnye-pirazoly.html" rel="bookmark" title="База патентов Евразийского Союза">Противопаразитарные пиразолы</a>
Предыдущий патент: Способ алкилирования затрудненных сульфонамидов
Следующий патент: Водорастворимые или вододиспергируемые повторно используемые смолы на основе полиэтилентерефталата или терефталатов, модифицированные сульфоарильными группами
Случайный патент: Валок каландра.





























