Кристаллическая структура сс2-lz домена nemo
Номер патента: 20189
Опубликовано: 30.09.2014
Авторы: Шиаравалли Жанне, Дюкеррой Стефан, Агу Фабрис, Фонтан Элизабет, Каминска Моника-Дорота, Кордье Флоренс, Верон Мишель, Грюбиса Оливера
Формула / Реферат
1. Кристалл CC2-LZ домена NEMO млекопитающих, имеющий аминокислотную последовательность SEQ ID NO.3 CC2-LZ домена или варианта указанной аминокислотной последовательности, отличающийся тем, что кристалл имеет следующие параметры элементарной ячейки:

и тем, что кристалл имеет пространственную группу P43212.
2. Кристалл CC2-LZ домена NEMO млекопитающих, имеющий аминокислотную последовательность SEQ ID NO.4 CC2-LZ домена или варианта указанной аминокислотной последовательности, отличающийся тем, что кристалл имеет следующие параметры элементарной ячейки:
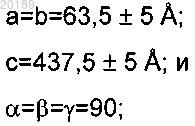
и тем, что кристалл имеет пространственную группу P43212.
3. Кристалл по п.1 или 2, отличающийся тем, что он имеет кристаллографические координаты, описанные в табл. 1.
4. Кристалл по п.1 или 2, отличающийся тем, что он включает CC2-LZ домен NEMO млекопитающих и по крайней мере один анкирин или его фрагмент, способный стабилизировать комплекс.
5. Кристалл по п.4, отличающийся тем, что он включает анкирин 1D5.
6. Кристалл по любому из пп.1-5, характеризующийся пространственной структурой, определённой при помощи дифракции рентгеновских лучей, причем указанная пространственная структура представлена на фиг. 2 и 3.
7. Кристалл по любому из пп.1-6, отличающийся тем, что CC2-LZ белок включает мутацию Val316Pro (V316P) и/или мутацию Phe305Ala (F305A).
8. Кристалл по любому из пп.2-6, отличающийся тем, что CC2-LZ белок включает мутацию Ala323Pro (A323P) и/или мутацию Phe312Ala (F312A).
9. Способ кристаллизации CC2-LZ домена NEMO млекопитающего, отличающийся тем, что способ включает следующие этапы:
инкубацию по крайней мере одного анкирина или анкиринового фрагмента и CC2-LZ домена;
сокристаллизацию комплекса анкирин или анкириновый фрагмент/СС2-LZ белок путем выращивания кристаллов с помощью диффузии паров.
10. Кристалл, полученный с помощью способа по п.9.
11. Способ определения пространственной структуры кристалла CC2-LZ домена NEMO по любому из пп.1-8, отличающийся тем, что способ включает следующие этапы:
получение кристалла или сокристалла CC2-LZ белка;
воздействие на кристалл рентгеновскими лучами;
сбор данных дифракции рентгеновских лучей;
использование этих данных для подсчета карты электронной плотности указанного кристалла;
построение и уточнение модели исходя из карты электронной плотности.
12. Пептид РН4, идентифицированный с помощью способа идентификации соединений, способных связывать CC2-LZ домена NEMO, с использованием кристаллографических координат кристалла по пп.1-5, характеризующийся аминокислотной последовательностью SEQ ID NO.6.
13. Пептид P8RD, идентифицированный с помощью способа идентификации соединений, способных связывать CC2-LZ домена NEMO, с использованием кристаллографических координат кристалла по пп.1-5, характеризующийся аминокислотной последовательностью SEQ ID NO.7.
14. Способ скрининга соединений по их способности быть вовлеченными в димеризацию NEMO или взаимодействие NEMO с цепями полиубиквитина между пептидом по любому из пп.12, 13 и CC2-LZ доменом NEMO, отличающийся тем, что он включает следующие этапы:
приведение указанного пептида и указанного CC2-LZ домена NEMO в контакт;
прибавление исследуемого соединения;
измерение флуоресцентной поляризации в присутствии исследуемого соединения;
осуществление указанного измерения при отсутствии исследуемого соединения.
Текст
КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА СС 2-LZ ДОМЕНА NEMO Кристалл CC2-LZ домена белка NEMO, пространственная структура которого была определена с помощью дифракции рентгеновских лучей при разрешении приблизительно 3,25 . Настоящее изобретение относится также к способам кристаллизации для CC2-LZ домена. КристаллыCC2-LZ и также информация, полученная из их кристаллических структур, используются для идентификации и конструирования соединений, которые вступают во взаимодействие с CC2-LZ. Настоящее изобретение относится к кристаллу CC2-LZ домена NEMO, имеющему размер и качество, достаточные для того, чтобы позволить получить структурные данные с помощью кристаллографии на основе дифракции рентгеновских лучей. Изобретение, в частности, относится к применению кристаллографических данных пространственной структуры CC2-LZ домена NEMO в идентификации, моделировании и конструировании соединений,модулирующих NF-В путь передачи сигнала.NF-В путь активируется в ответ на различные внеклеточные стимулы, такие как бактериальныеLPS, провоспалительные цитокины, такие как IL-1 и TNF (М. S. Hayden и S. Ghosh, Signaling to NFkappaB, Genes Dev 18 (2004),18, 2195-2224). Сигналы в общем случае передаются от клеточных рецепторов на IKK комплекс, центральный регулятор NF-В пути передачи сигнала. IKK комплекс состоит из двух киназ, IKK и IKK, a также регуляторного белка NEMO (основной модулятор NF-В) (S. Yamaoka и др., Complementation cloning of NEMO, a component of the IkappaB kinase complex essential forNF-kappaB activation, Cell 93 (1998),7, 1231-1240). NEMO играет принципиальную роль в интеграции сигналов, исходящих от различных стимулов, и в осуществлении активации IKK комплекса. Белок NEMO состоит в своей N-терминальной части из домена, связывающего IKK комплекс, в своей С-терминальной части - из домена олигомеризации (фиг. 1). Следует отметить, что мышиный (SEQID NO.1) и человеческий (SEQ ID NO.2) белки NEMO обладают высокой степенью гомологии последовательности, за исключением вставки, состоящей из 7 аминокислот в человеческом белке непосредственно выше от специфического домена СС 2. Активация IKK комплекса осуществляется с помощью механизма, связанного со способностью белка NEMO к олигомеризации путем трансактивации посредством I киназы путем трансавтоактивации IKK киназ. В настоящее время механизм активация IKK комплекса с помощью NEMO является выясненным не до конца, хотя многочисленные сообщения показывают, что олигомеризация и связывание с K-63 полиубиквитинами, вовлекающие минимальный CC2-LZ домен, играет существенную роль (J.NEMO is a key event in NF-kappaB activation, Nat Cell Biol 8 (2006),4, 398-406). Все мутации, которые размещаются в CC2-LZ и нарушают олигомеризацию NEMO или связывание с K-63 цепями полиубиквитина (polyUb K-63), ингибируют IKK активность в результате стимуляции цитокинов (Е. Vinolo и др., Aresults in destabilization of the oligomer и reduces lipopolysaccharide- и tumour necrosis factor-mediated NFkappaB activation, J Biol Chem 281 (2006),10, 6334-6348). Минимальный домен олигомеризации CC2-LZ NEMO (aa 251-337 у мыши, аа 258-344 у людей) состоит из двух последовательных мотивов, биспирального мотива СС 2 (аа 251-290 у мыши, аа 258-297 у людей) и мотива лейциновой застежки LZ (аа 293-337 у мыши, аа 300-344 у людей). Вариации одной или двух аминокислот могут наблюдаться на концах CC2-LZ домена в зависимости от программного обеспечения, используемого для предсказания структур СС 2 и LZ. При активации IKK комплекс фосфорилирует IВ белки, запуская, таким образом, деградацию последних с помощью 26S протеосомы и высвобождая далее NF-В факторы транскрипции, которые изолируются в цитоплазме с помощью IВ белков. Фактор транскрипции NF-В после этого мигрирует в ядро и регулирует экспрессию генов, вовлеченных в воспаление, иммунитет, апоптоз и выживание клеток. Конститутивная активация NF-В пути вовлекается в онкогенез. Это явление наблюдали в различных солидных опухолях и при лейкемиях (D. S. Basseres и A. S. Baldwin, Nuclear factor-kappaB and inhibitor of kappaB kinase pathways in oncogenic initiation и progression, Oncogene 25 (2006),51, 6817-6830)(M. S. Hayden и др., NF-kappaB and the immune response, Oncogene 25 (2006),51, 6758-6780) (J. Inoue и др., NF-kappaB activation in development and progression of cancer, Cancer Sci 98 (2007),3, 268-274). Соответственно IKK комплекс считался таким, который представляет собой весьма интересную мишень для разработки противовоспалительных и противоопухолевых соединений (М. A. Calzado и др., NFkappaB inhibitors for the treatment of inflammatory diseases and cancer, Curr Med Chem 14 (2007),3, 367376) (T. D. Gilmore и М. Herscovitch, Inhibitors of NF-kappaB signaling: 785 and counting, Oncogene 25theme in anti-inflammatory therapies, Mol Interv 2 (2002),1, 22-35). Создание соединений, которые нацеливают NEMO лучше, чем киназы, делает возможным осуществлять селективную супрессию зависимой от стимула IKK активности и, таким образом, снижать цитотоксичность указанных соединений. Кристаллическая структура IKK комплекса подвергалась изучению во время попытки определить механизмы, лежащие в основе регуляции NF-В пути передачи сигнала и, в частности, регуляторного белка NEMO. Кроме того, знание пространственной структуры представляет собой существенное преимущество в установлении сайтов взаимодействия с лигандами, полученными в результате данного скрининга. Такая пространственная структура также представляет собой источник информации в виртуальном скрининге или в подходе компьютерного моделирования эксперимента. Процесс кристаллизацииNEMO был без особого успеха изучен D.Gopaul и др., M.Delepierre и F.Cordier (не опубликовано). В частности, могут быть упомянуты безуспешные попытки кристаллизации CC2-LZ домена, несущего мотив цинковых пальцев (аа 251-412 NEMO), или не содержащего такого мотива (аа 251-388 NEMO). Таким образом, такая работа, направленная на получение кристаллов белка NEMO и CC2-LZ домена, в частности, была до сегодняшнего момента безуспешной. Настоящее изобретение, соответственно, является направленным на предложение новой стратегии для осуществления кристаллизации CC2-LZ домена белка NEMO. Эта альтернативная стратегия базируется на повышение жесткости минимального домена олигомеризации NEMO. Кристаллическая структура была разрешена путем кристаллографии на основе дифракции рентгеновских лучей при использовании разрешения 3,25 . Таким образом, кристаллическая структура была разрешена путем кристаллографии на основе дифракции рентгеновских лучей при использовании разрешения 2,9 . Настоящее изобретение также относится к способам кристаллизации CC2-LZ домена. КристаллыCC2-LZ и информацию, которая была получена при их использовании, подвергали анализу для целей идентификации или конструирования соединений, которые вступают во взаимодействие с CC2-LZ. Настоящее изобретение, соответственно, относится к кристаллу CC2-LZ домена NEMO млекопитающего, пептидный домен CC2-LZ которого обладает аминокислотной последовательностью SEQ IDNO.3 и пептидные варианты которого имеют происхождение от указанной аминокислотной последовательности. В контексте данного изобретения термины "кристалл", "кристалл CC2-LZ домена", "кристалл CC2LZ комплекса" и "сокристалл CC2-LZ домена" используются без различий и относятся к кристаллическому комплексу, включающему, по крайней мере, отдельные части, при этом одна часть кристалла в соответствии с изобретением представляет собой CC2-LZ домен или один из его вариантов. Настоящее изобретение также относится к кристаллическому комплексу СС 2-LZ домена NEMO млекопитающих, пептидный домен CC2-LZ которого обладает аминокислотной последовательностьюSEQ ID NO.4 и пептидные варианты которого имеют происхождение от указанной аминокислотной последовательности. Термин "аминокислотная последовательность" должен пониматься как пептидная последовательность, изолированная из природного источника, синтезированная химическим путем и/или очищенная и,возможно, модифицированная с помощью генетической инженерии. Термин "варианты" предполагается для понимания аминокислотных последовательностей пептидов, описанных выше в данной заявке, включающих консервативные замены или консервативные точечные мутации и обладающие существенно такими же свойствами, что и пептиды соответствующим образом кодируемые последовательностями SEQ ID NO.3 и SEQ ID NO.4 или, другими словами, обладающие способностью к олигомеризации и связыванию с K-63 полиубиквитинами. Настоящее изобретение, кроме того, относится к кристаллическому комплексу CC2-LZ доменаNEMO млекопитающего, параметры элементарной ячейки которого являются следующими: и кристалл имеет пространственную группу P43212. В соответствии с общим пониманием в контексте данного изобретения выражение "параметр элементарной ячейки" означает параметры a, b и с элементарной ячейки кристалла, которые соответствуют длинам некомпланарных базисных векторов (а, b, с) и углам ,и , образованным между векторами (а,b, с). Уголпредставляет собой угол между векторами b и с,- угол между векторами а и с, и- угол между векторами а и с. Под элементарной ячейкой понимают параллелепипед, образованный векторами(а, b, с). Операции симметрии, которые сохраняют кристалл существенно без изменений, где кристалл является бесконечным объектом, который образуется в результате повтора ограниченного мотива, представляют собой группы. Когда кристалл обладает трехмерной структурой, то таковые называются "пространственными группами". При этом понятно, что кристаллический комплекс CC2-LZ домена в соответствии с настоящим изобретением не является ограниченным нативным CC2-LZ доменом. Кристаллический комплекс в соответствии с изобретением действительно включает мутанты нативного CC2-LZ. Такие мутанты получают путем добавления, делеции или замены, по крайней мере, одной аминокислоты в полипептидной последовательности нативного CC2-LZ, и они обладают существенно такой же пространственной структурой,что и нативный CC2-LZ домен. Выражение "обладающий существенно такой же пространственной структурой" подразумевается для понимания набора координат атомной структуры, полученных из кристалла, который обладает сред-2 020189 ней величиной отклонения, меньшей или равной 5 , предпочтительно 2 , тогда, когда они накладываются на координаты атомной структуры нативного CC2-LZ, из которого был получен этот мутант, когда по крайней мере от 50 до приблизительно 100% альфа-атомов углерода нативного CC2-LZ включаются в такое накладывание. Преимущественно изобретение относится к сокристаллу, включающему CC2-LZ домен NEMO млекопитающего и по крайней мере один анкирин или его фрагмент, способный стабилизировать комплекс,образованный с участием CC2-LZ домена, параметры ячейки кристаллической решетки которого являются следующими: и сокристалл которого имеет пространственную группу Р 43212."Анкирин" понимают как такой, который относится к модулярным белкам различных размеров, вовлеченным в многочисленные белок-белковые взаимодействия. Анкирины являются генетически консервативными белками, поскольку они обнаружены у бактерий, растений, грибов и животных, и их структура основывается на повторяемых структурных единицах, состоящих из приблизительно 33 аминокислот."Анкириновый фрагмент" в соответствии с изобретением является способным к связыванию и стабилизации комплекса, образованного с участием CC2-LZ домена NEMO. Изобретение предпочтительно относится к кристаллу CC2-LZ домена белка NEMO млекопитающего и анкирина 1D5 (SEQ ID NO.5). Изобретение также относится к кристаллу CC2-LZ домена белкаNEMO млекопитающего и анкирина 2 А 1 или 2F6, как описано Wyler и др. (Inhibition of NF-kappaB activation with designed ankyrin-repeat proteins targeting the ubiquitin-binding/oligomerization domain of NEMO,Protein Sci 16 (2007),9, 2013-2022). Для того чтобы способствовать процессу образования кристаллов, CC2-LZ домен фактически комплексируют с анкирином 1D5, который связывается с CC2-LZ с высокой аффинностью и придает жесткость пептидному домену. Профиль дифракции, полученный от кристаллов CC2-LZ, комплексированных с анкирином 1D5,используется для определения пространственной структуры CC2-LZ с помощью молекулярного замещения. Анкирин или анкириновый фрагмент предпочтительно комплексируют с LZ мотивом CC2-LZ домена, в частности, для того, чтобы стабилизировать его. LZ мотив действительно является более гибким и термодинамически более нестабильным, чем СС 2 мотив CC2-LZ домена. Сокристалл CC2-LZ домена NEMO с анкириновым белком может быть получен с помощью способа кристаллизации, который включает следующие этапы: инкубацию по крайней мере одного анкирина или анкиринового фрагмента и CC2-LZ домена; сокристаллизацию комплекса анкирин или анкириновый фрагмент/СС 2-LZ белок путем выращивания кристаллов с помощью диффузии паров. В предпочтительном воплощении способ кристаллизации CC2-LZ соответствует способу, как описано в примере 1. Изобретение предпочтительно относится к кристаллическому CC2-LZ домену NEMO или сокристаллу CC2-LZ, обладающему кристаллографическими координатами, описанными в табл. 1. Предпочтительно кристалл и сокристалл CC2-LZ домена в соответствии с изобретением в каждом случае определяются их пространственной структурой, полученной с помощью дифракции рентгеновских лучей, как представлено на фиг. 2 и 3. Пространственная структура CC2-LZ образует вытянутый димер, который состоит из двух параллельныхспиралей, которые ассоциируются друг с другом с образованием биспиральной структуры(фиг. 2) (фиг. 3). CC2-LZ димер взаимодействует с двумя молекулами анкирина 1D5, при этом каждый анкирин образует контакты сспиралями на двух LZ цепях. Три остатка, которые размещаются между СС 2 мотивом и LZ мотивом (аа 291-293, нумерация в соответствии с таковым мыши), образуют псевдобиспиральную структуру. Домен связывания с цепями K-63 полиубиквитина, который описывается у Еа и др., состоит из 67 аминокислот (259-325, нумерация в соответствии с таковым мыши, 252-318, нумерация в соответствии с таковым мыши), соответствующих С-терминальному участку СС 2 и Nтерминальному участку LZ. С помощью данных перекрестной ссылки, полученных из пространственной структуры, направленного мутагенеза и из выравнивания CC2-LZ последовательности, участок, формирующий сайт связывания с убиквитинами, определяли как такой, который находится между аминокислотами 293 и 323 в полипептидной последовательности мышиного NEMO (aa 300-330, нумерация в соответствии с таковыми человека). Пространственную структуру CC2-LZ кристалла и сокристалла в соответствии с изобретением получали с помощью способа, включающего следующие этапы: получение кристалла или сокристалла CC2-LZ белка; воздействие на кристалл рентгеновскими лучами; сбор данных дифракции рентгеновских лучей; использование этих данных для подсчета карты электронной плотности указанного кристалла; построение и уточнение модели, исходя из карты электронной плотности. Предпочтительно, когда способ определения трехмерной структуры CC2-LZ соответствует способу,как описано в примере 1. Изобретение также относится, с одной стороны, к кристаллу мышиного CC2-LZ белка, включающему Val316Pro (V316P) и/или мутацию Phe305Ala (F305A) и, с другой стороны, к кристаллу человеческого CC2-LZ белка, также включающему мутацию Ala323Pro (A323P) и/или мутацию Phe312Ala(F312A). Различные мутации, полученные путем направленного мутагенеза в человеческом CC2-LZ белке,являются представленными на фиг. 4. Мутация Glu296Ala (E296A, положение 289 у мыши) размещается на С-терминальном конце СС 2 и находится вне сайта взаимодействия между убиквитинами (положение аа 259-325, нумерация в соответствии с таковыми человека, аа 252-318, нумерация в соответствии с таковыми мыши). Мутации Phe312Ala (F312A, положение 305 у мыши) и Glu315Ala (E315A, положение 308 у мыши) размещаются в рамках сайта связывания с убиквитинами. Мутации Glu315Ala и Ala323Pro(A323P, положение 316 у мыши) являются вовлеченными в две патологии человека, соответственно,врожднную ангидротическую эктодермальную дисплазию с иммунодефицитом (AED-ID) (R. Doffinger и др., Genetic heterogeneity of mendelian susceptibility to mycobacterial infection, Microbes Infect 2 (2000),13, 1553-1557) и пигментный дерматоз Блоха-Сульцбергера (IP) (A. Smahi и др., Genomic rearrangement in(L329A L336A, положения 322 и 329, соответственно, у мыши) размещается в домене лейциновой застежки CC2-LZ. Способности белка NEMO дикого типа и определенных выше мутантов белка NEMO к восстановлению активации NF-В пути в ответ на провоспалительный цитокин TNF- сравниваются и иллюстрируются на фиг. 5. С этой целью дефектные по NEMO мышиные эмбриональные фибробласты (MEF) транзиентно котрансфецировали, с одной стороны, с помощью плазмиды, кодирующей репортерный генIg-люциферазы, и, с другой стороны, с помощью плазмид, кодирующих различные белки, и потом стимулировали при использовании TNF в течение 24 ч. Белок дикого типа полностью восстанавливал NFВ путь, в то время как TNF-зависимая активация NF-В пути подвергалась воздействию со стороны мутантных белков в различной степени. Мутации А 323 Р и F312A вызывали почти в два раза более сильное ингибирование, в частности 95 и 78% ингибирование соответственно. Для мутации А 323 Р, которая является причиной пигментного дерматоза Блоха-Сульцбергера, дефект в димеризации NEMO представляет собой причину инактивации NF-В пути, результат, подобный тому, который был получен Sebban-Benin и др. (Identification of TRAF6-dependent NEMO polyubiquitination sites through analysis of a new NEMO mutation causing incontinentia pigmenti, Hum Mol Genet 16 (2007), 23, 2805-2815). Белок CC2-LZ домена NEMO, подвергшийся мутации в положение F312A, демонстрирует профиль элюирования при гель-фильтрации, который является таким же, как и такой для белка CC2-LZ дикого типа, свидетельствуя о том, что мутация не влияет на стабильность димера, а модифицирует активациюNF-B пути (фиг. 5). Изучение этого мутанта демонстрирует, что сначала дефект активации возникает не по причине ошибки димеризации сайта взаимодействия с убиквитинами, а скорее по причине ошибки взаимодействия с цепями K63 полиубиквитина, как показано Еа и др. Таким образом, эти результаты подчеркивают способность ингибирования NF-B пути либо путем модификации димеризации NEMO,либо путем ингибирования взаимодействия NEMO с цепями полиубиквитина. Настоящее изобретение делает возможным, с одной стороны, структурное обоснования путем направленного мутагенеза активной конформации NEMO и, с другой стороны, определение остатков, которые являются важными для олигомеризации белка и, как следствие этого, для активации IKK комплекса, а также как такового, который является вовлеченным в связывание с K-63 полиубиквитинами. Изобретение предпочтительно относится к способу идентификации соединений, способных к связыванию с CC2-LZ доменом NEMO, на основе данных кристаллографии, полученных в данном изобретении. Пептиды, имитирующие СС 2 или LZ последовательность, продемонстрированы как такие, которые являются способными нарушать олигомеризацию NEMO и, таким образом, супрессировать активацию NF-B пути в культуре клеток. Предпочтительно изобретение относится к разработке и идентификации соединений, препятствующих олигомеризации CC2-LZ домена, который ингибирует связывание указанного домена с K-63 полиубиквитинами. В контексте данного изобретения "соединения" понимаются как все химические молекулы, которые ингибируют димеризацию CC2-LZ домена NEMO или которые ингибируют взаимодействие CC2-LZ домена NEMO с цепями полиубиквитина. Таким образом, кристаллографические данные домена NEMO обеспечили возможность конструи-4 020189 рования пептидов, обладающих высокой аффинностью для этого белка. Взаимодействия CC2-LZ: CC2LZ которые обеспечивают возможность образования in vivo активных комплексов NEMO, вовлекают многочисленные ковалентные связи. Поскольку дестабилизация таких комплексов малыми молекулами является сложной для демонстрации высокопроизводительного скрининга, то необходимо идентифицировать пептидный зонд, который имитирует это взаимодействие на редуцированной части пептида и который обладает большей аффинностью. Такой пептидный зонд может потом подвергаться мечению с помощью флуоресцентной группы, и его ассоциация с CC2-LZ демонстрируется с помощью измерения флуоресцентной поляризации. Таким образом, такая система позволяет осуществлять процессы высокопроизводительного скрининга. Для того чтобы иметь рациональный и эффективный подход для создания такого пептидного зонда, знание пространственной структуры CC2-LZ домена является абсолютно необходимым. Уже два пептида, которые получили названия P8RD и РН 4, были сконструированы при использовании этого принципа (фиг. 11). Пептидные зонды в соответствии с изобретением предпочтительно представляют собой пептид РН 4 и пептид P8RD, которые имеют аминокислотные последовательности SEQ ID NO.6 и SEQ ID NO.7 соответственно.P8RD обладает аффинностью 60 нМ, в то время, как пептид РН 4 обладает аффинностью 170 нМ. Эти измерения осуществляются при рН 7 и при комнатной температуре в строгом буфере, соответствующем 20 мМ Трис-ацетатному MES, содержащему 200 мМ хлорида калия и 0,5% Твин 20. Они осуществляются при использовании флуоресцентной поляризации с помощью пептидов, слитых на Nтерминальном конце с флуорофорами флуоресцеином или Су 5. Для создания пептидных зондов в соответствии с изобретением пептиды могут быть слиты с любым видом флуорофора. В завершение, настоящее изобретение относится к способу идентификации соединений димеризации NEMO или взаимодействия NEMO с цепями полиубиквитина между пептидным зондом в соответствии с изобретением и CC2-LZ доменом NEMO. Этот способ HTS (высокопроизводительного скрининга) включает следующие этапы: приведение указанного пептида и указанного CC2-LZ домена NEMO в контакт; прибавление исследуемого соединения; измерение флуоресцентной поляризации в присутствии исследуемого соединения; осуществление указанного измерения при отсутствии исследуемого соединения. Взаимоотношения структура-активность этих пептидов, а также пространственная структура CC2LZ мишени NEMO будет позволять сконструировать другие пептиды, обладающие аффинностями с величиной порядка нМ, путем обеспечения предпочтения зоны взаимодействия NEMO для цепей убиквитина и/или полиубиквитина, обладающих любым из видов боковых цепей (K63, K48, K6, Nтерминальный). Модель CC2-LZ домена комплекса NEMO/убиквитин представлена на фиг. 7, 8 и 10. "Моделькомплекса" предназначена для понимания пространственной структуры комплекса СС 2-LZ/убиквитин. Модель CC2-LZ комплекса NEMO/убиквитин была построена на основе структурной информации, полученной из используемого комплекса Rabex-5 IUIM/убиквитин (Lee S. и др. Structural basis for ubiquitinrecognition and auto ubiquitination by Rabex-5. Nat Struct Mol Biol 13, 264-271, 2006). Модель комплекса СС 2-LZ/убиквитин была проверена экспериментально с помощью химических сдвигов, наблюдаемых при использовании ЯМР, взаимодействия между убиквитином и CC2-LZ доменом NEMO (фиг. 9). Пространственная структура CC2-LZ домена NEMO выводится из модели комплекса СС 2LZ/убиквитин. Такая пространственная структура CC2-LZ может использоваться для компьютерного моделирования или виртуального скрининга соединений, способных связываться с CC2-LZ доменомNEMO. Настоящее изобретение, соответственно, относится к способу конструирования соединений, способных связываться с CC2-LZ доменом NEMO, при использовании пространственной структуры CC2-LZ домена, полученной из кристаллографических координат кристалла в соответствии с изобретением. В завершение, изобретение относится к соединениям, идентифицированным с помощью указанных выше способов идентификации и конструирования. Предпочтительно эти соединения ингибируют димеризацию CC2-LZ домена NEMO или ингибируют взаимодействие CC2-LZ домена NEMO с цепями полиубиквитина. Настоящее изобретение иллюстрируется, но при отсутствии ограничений в результате этого, фигурами и примерами, которые приведены ниже: Фиг. 1: Представление NEMO белка. Фиг. 2: Пространственная структура CC2-LZ домена NEMO, комплексированного с двумя молекулами анкирина. Две субъединицы CC2-LZ представлены темно-серым цветом, в то время, как анкирины представлены светло-серым цветом. Фиг. 3: Структура CC2-LZ домена NEMO в комплексе с анкиринами 1D5. Ленточная диаграмма комплекса в боковой проекции. Спирали NEMO являются представленными уровнями серого цвета в зависимости от домена: СС 2, NOA или LZ. Цепи анкирина 1D5 представлены темно-серым цветом в положении сбоку. Фиг. 4: Расположения внутри CC2-LZ домена человека различных мутаций, полученных с помо-5 020189 щью направленного мутагенеза. Домен связывания с полиубиквитинами представлен белым цветом. Нумерация, используемая для аминокислот, соответствует таковой белка человека. Фиг. 5: Влияние различных мутаций на активацию NF-В пути. Нумерация мутаций соответствует таковой человеческого CC2-LZ белка. Фиг. 6: Модель CC2-LZ домена комплекса NEMO/убиквитин. Выравнивание последовательности между Rabex-5 (MIU/IUIM) (первая линия) и NEMO (NOA мотив) (вторая линия), с положениями структурного мотива NOA (a-g), приведенного ниже. Беспрерывные и пунктирные вертикальные линии обозначают идентичные и подобные остатки соответственно. Диагональной линией отмечены пространственно подобные остатки из аспекта структурной модели в соответствии с изобретением. Строго консервативные остатки в NOA мотиве обозначены. Фиг. 7: Вид сбоку CC2-LZ комплекса NEMO/убиквитин. Спирали NEMO окрашены так же, как и на фиг. 3. Молекулы убиквитина окрашены серым цветом в положении сбоку, а молекулы анкирина 1D5 сокристалла изображены полупрозрачным серым цветом также в положении сбоку. Фиг. 8: Крупный план границы раздела NOA/убиквитин. Остатки, вовлеченные во взаимодействие,показаны в виде модели шаростержневого типа с атомами углерода, представленными серым цветом(убиквитин) и белым цветом (NEMO). Фиг. 9: Химические сдвиги, которые наблюдаются с помощью ЯМР убиквитина, связанного с CC2LZ доменом NEMO. Средние значения отклонения в химическом сдвиге av как функция химического остатка. Элементы соответствующей вторичной структуры показаны выше как график химических сдвигов. Фиг. 10: Представление взаимодействия между убиквитином и участком NOA CC2-LZ домена. Темно-серый цвет используется для остатков, вовлеченных в сильное взаимодействие. Остатки убиквитинов являются представленными светло-серым цветом для 0,05av0,085 част. на млн. Фиг. 11: Пептидные последовательности РН 4 и P8RD, которые сконструированы с учетом кристаллографической структуры CC2-LZ домена. Подчеркнутые остатки, принадлежавшие N-кэпу или С-кэпу,обладают эффектом термодинамической стабилизацииспиралей на N- и С-терминальных концах. Пример 1. Кристаллографическая структура CC2-LZ домена 1.1 Конструирование плазмид, экспрессия и очистка анкирина 1D5 и CC2-LZ белков Получение анкирина 1D5 осуществляли с помощью рибосомного дисплея с использованием N2Cbinders selected from designed ankyrin repeat protein libraries, Nat Biotechnol 22 (2004),5, 575-582) для селекции. Результаты этого исследования, а также аминокислоты анкирина 1D5, которые отличаются от исходной модели, являются описанными в публикации Wyler и др. кДНК анкирина 1D5 клонировали в вектор pQE30 (Qiagen) в фазе с гистидиновой меткой, которая размещается на N-терминальном конце. Плазмиду pQE30-1D5 встраивали в штамм Е. coli XL-1 blue и индуцировали экспрессию 1D5 белка путем прибавления 1 мМ IPTG к культуральной среде в течение 3-3,5 ч при 37 С. Бактерии осаждали с помощью седиментации, промывали в Трис/HCl буфере 50 мМ рН 8 и подвергали лизису путем обработки ультразвуком в Трис/HCl буфере 50 мМ рН 8, NaCl 0,5 М (буфер А) в присутствии ингибиторов протеазы(полностью свободные от ЭДТА, Roche). Растворенный экстракт восстанавливали после центрифугирования и загружали в никелевую колонку, полностью уравновешенную буфером A. 1D5 белок вымывали при использовании линейного градиента имидазола. Собирали фракции, содержащие белок, и потом подвергали диализу против буфера 20 мМ Трис/HCl рН 7,6, 50 мМ KCl при использовании пакетов для диализа, которые имеют порог отсекаемых размеров 6-8 кДа (Spectra/Por). Белок концентрировали с помощью ультрафильтрации в Amicon пробирках (Millipore), которые имеют порог отсекаемых размеров 5 кДа.CC2-LZ (SEQ ID NO.3) (аа 251-337 мышиного NEMO) клонировали в плазмиду рЕТ 28 в фазе с гистидиновой меткой, которая размещается на N-терминальном конце. Этот домен соответствует остаткам 258-344 человеческого NEMO (SEQ ID NO.4). Белок экспрессировали в штамм Е. coli, BL21-gold (DE3) и очищали на никелевой колонке так, как описано для очистки анкирина 1D5. CC2-LZ белок потом очищали на катионообменной колонке Poros 20-HS (Perseptive Biosystem). Колонку предварительно уравновешивали в буфере 50 мМ MES рН 7,1, 50 мМ KCl и белки элюировали с помощью линейного градиентаKCl. Фракции, которые представляют интерес, собирали и подвергали диализу против буфера 20 мМ Трис/HCl рН 8,0, 100 мМ KCl, и потом концентрировали путем ультрафильтрации. Чистоту белка определяли как такую, которая составляет более 98% в соответствии с электрофоретическим анализом в денатурирующих условиях и начиная с Кумасси голубого. Концентрацию белка определяли методом Бредфорда и путем измерения абсорбции при 280 нм при использовании коэффициента абсорбции 2312 М-1 см-1 для CC2-LZ и 1490 М-1 см-1 для 1D5. Белки 1D5 и CC2-LZ инкубировали вместе в течение 30 мин на льду и комплекс очищали на колонке Superdex 200 HR (Pharmacia), уравновешенной в буфере 20 мМ Трис/HCl рН 8, 100 мМ KCl. Стехиометрическое связывание в комплексе составляло 1:1. Комплекс концентрировали путем ультрафильтрации с получением концентрации белка 10-13 мг/мл. 1.2 Условия кристаллизации для комплекса анкирин 1D5/CC2-LZ белок Кристаллы выращивали воспроизводимым образом при двух различных условиях (Jena BiosciencepH 7,5. Кристаллы выращивали при условиях диффузии паров в суспендированных каплях, в которые вводили затравку в виде микрокристаллов (микрозатравка). 1 мкл белкового комплекса прибавляли к 1 мкл резервуарного раствора и уравновешивали в условиях диффузии паров при температуре 18-20 С в течение более чем 36 ч. Микрокристаллы (0,1 мкл), полученные начиная от фрагментов кристаллов, вводили в каплю. После введения затравки кристаллы выращивали в течение нескольких дней до достижения размеров 30015020 мкм. Для криогенной защиты кристаллы погружали на 30 с в резервуарный раствор, который дополнительно содержал PEG 4000 и 20% С глицерина для 3 А 4 или 30% MPD для 8 В 5. Кристаллы закрепляли на нейлоновых петлях и быстро замораживали до сбора данных. 1.3 Анализ комплекса анкирин 1D5 / CC2-LZ белок Данные дифракции рентгеновских лучей (I=0,9794 ) регистрировали при использовании PX06SA пучка синхротронного излучения на SLS (Swiss Synchrotron Light Source) и Pilatus 6M гибридного пиксельного детектора (расстояние полупроводникового детектора: 640 мм и 0,5 осцилляции на этап при 100K). Наборы данных обрабатывали при использовании программного обеспечения XDS. Все кристаллы принадлежали к одной и той же пространственной группе P43212 со следующими параметрами элементарной ячейки кристалла: 1.4 Определение и уточнение кристаллографической структуры CC2-LZ домена NEMO Разрешали структуру молекулярным замещением при помощи программы AmoRe с использованием атомной модели анкирина 2JAB (Zhand и др., будет опубликовано) и теоретической модели дляNEMO спиралей. Данные между 15 и 3,5 использовали для этих вычислений. После анализа карты электронной плотности ручное построение модели осуществляли при использовании О. Уточнение с помощью TLS проводили с помощью программы Refmac. Модель уточняли, поддерживая ограничения некристаллографической симметрии для анкирина (цепи С и D) и для спиралей NEMO (остатки от 251 до 290 N-терминального участка, и остатки от 294 до 337 С-терминального участка). Заключительная модель содержала 26 молекул растворителя и одну молекулу глицерина, с разрешением R крист./R свободн. 20,8%/26,1% при 3,5 . Стереохимические данные и R коэффициенты приведены в табл. 1. Стереохимическое качество модели анализировали при использовании PRO-CHECK. 1.5 Получение модели CC2-LZ домена комплекса NEMO/убиквитин Лучшие кандидаты для моделирования комплекса СС 2-LZ/убиквитин представляли собой структуры, содержащиеспираль, такую как UIM (взаимодействующий с убиквитином мотив), и перевернутуюUIM (IUIM или MIU), полученные из Rabex-5. После сравнения последовательностей наблюдали идентичность последовательностей, составляющую приблизительно 20% между NOA мотивом CC2-LZ домена и IUIM Rabex-5 (фиг. 6). IUIM мотив Rabex-5 связывается с гидрофобным участком убиквитина, сосредоточенным на остатке Не 44. Также было продемонстрировано, что тот же остаток Не 44 является необходимым во взаимодействии между NEMO и полиубиквитином K63 (Bloor S. и др. Signal processingby its coil zipper domainn activates IKK gamma, Proc Natl Acad Sci USA 105, 1279-84, 2008), что ясно предполагает тот факт, что убиквитин связывается эквивалентным образом с NOA мотивом NEMO и с Rabex5 IUIM. Таким образом, известную пространственную структуру комплекса Rabex-5 IUIM/убиквитин использовали в качестве руководства для разработки модели комплекса СС 2-LZ/убиквитин. Для того, чтобы соблюсти симметрию, две молекулы убиквитина связывали со спиралью NEMO. Коэффициент комплементарности для комплекса CC2-LZ/убиквитин составляет 0,69, что является более высоким, чем таковое значение для комплекса СС 2-LZ/анкирин 1D5 (SC=0,65). Молекулы убиквитина связываются с гидрофобным участком NOA, сайт связывания которого частично перекрывает анкирины 1D5. Остаток D304 NOA внедрялся в центр границы раздела СС 2-LZ/убиквитин и образовывал Н связи с Н 68 остатком убиквитина. Другие основные взаимодействия вовлекали неполярные остатки, включаяAla 307, соответствующий неизмененному остатку Ala, найденному в IUIM мотиве, и остаток F305, вовлеченный во взаимодействие NEMO/полиубиквитин K63. Эти взаимодействия прикрывают гидрофобную поверхность NOA, что не является благоприятным с точки зрения энергии, от растворителя, и это вносит свой вклад в стабилизацию этого участка. Пространственную структуру модели СС 2LZ/убиквитин дополнительно проверяли с помощью различных экспериментов, таких как направленный мутагенез или химические сдвиги, наблюдаемые с помощью ЯМР (фиг. 9). Наборы данных и уточнения: а) Значения в крутых скобках приведены для разрешения наружной оболочки: 3,43-3,25 . где I представляет собой измерение интенсивности каждого отражения, а (I) представляет собой среднее значение этого отражения. с (rmsd) - Среднеквадратическое отклонение. Пример 2. Подтверждение структуры с помощью направленного мутагенеза активной конформацииNEMO 2.1 Конструирование плазмид и направленный мутагенез кДНК, кодирующую человеческий CC2-LZ домен NEMO, обозначенную как Tax CC2-LZ и удлиненную от Met 215 до Glu 362 (нумерация в соответствии с таковыми человека), получали с помощью ПЦР при использовании следующих двух нуклеотидных праймеров: NEMO 1 SEQ ID NO.8 (5'CCCCATATGGAGCGCCAGGCCGCCTC) и(5'TGAGGAAGCGGATGTCGAGTAGCTCGAGGGG). Эту ДНК вводили между рестрикционными сайтамиNdel и Xhol бактериального экспрессионного вектора pET-28b (Novagen) для получения вектора pET-NEMO.FLAG метку, соответствующую последовательности DYKDDDDK, вводили в экспрессионный вектор млекопитающих pcDNA3 между рестрикционными сайтами HindIII и EcoRI для создания плазмидыpcFLAG. кДНК, кодирующую человеческую форму NEMO, амплифицировали при использовании следующих двух нуклеотидных праймеров(5'-CATGGAGTGCATTGAGTAGCTCGAGGGG) и потом вводили в плазмиду pcFLAG между сайтами рестрикции EcoRI иXhol для создания плазмиды pcNEMO-WT. Точечные мутации Glu296Ala, Phe312Ala, Glu315Ala, Ala323Pro и двойной мутант Leu329AlaLeu336Ala вводили, с одной стороны, в бактериальный вектор pET-NEMO-WT и, с другой стороны, в вектор млекопитающих pcDNA3/NEMO-WT при использовании методики направленного мутагенеза,пропись которой является описанной в наборе "Quikchange II сайт-направленный мутагенез" от Stratagene. 2.2 Функциональная комплементация в мышиных эмбриональных фибробластах Дефектные по NEMO мышиные фибробласты (MEF) культивировали в контейнерах для культуры клеток и случайным образом трансфецировали при использовании смеси, содержащей 0,2 мкг плазмидыpEF1, кодирующей -галактозидазу, 0,5 мкг плазмиды, содержащей репортерный ген Igk-люциферазы, и 2 мкг плазмид, экспрессирующих различные варианты NEMO. Через 24 ч после трансфекции клетки активировали с помощью TNF (20 нг/мл) в течение 24 ч. Потом клетки восстанавливали и подвергали лизису в 110 мкл буфера 25 мМ Трис/фосфат рН 7,8, 8 мМ MgCl2, 1% Тритона, 1 мМ дитиотреитола, 15% глицерина, куда прибавляли смесь протеаз (Roche). Клеточный лизат центрифугировали при 13000 об./мин. в течение 20 мин при 4 С. Измеряли активность репортерного гена. 2.3 Экспрессия и очистка белка дикого типа и мутанта F312A Очистку осуществляли при использовании устройства АКТА Purifier 100 (Amersham Pharmacia Biotech). Очистку различных белков производили, начиная с 3 л культуры бактерии BL21-Gold D3 (Stratagene), трансформированной с помощью различных рЕТ 28 плазмид и в присутствии канамицина (50 мкг/мл). Экспрессию белков индуцировали при использовании 1 мМ IPTG при 37 С в течение 4 ч. После центрифугирования в течение 20 мин при 6000 g при температуре 4 С бактерии промывали в буфере Трис/HCl 100 мМ рН 8, содержащем 10 мМ MgCl2. Замораживали бактериальные осадки при -20 С. Потом осадки ресуспендировали в буфере для экстракции (Трис/HCl 50 мМ рН 8, KCl 20 мМ и глицерин 5%), содержащем смесь ингибиторов протеаз (полная свободная от ЭДТА, Roche) при концентрации 2 мл/г бактерий, а потом разрушали при использовании французского пресса под давлением 1500 фунтов на квадратный дюйм. Бактериальный лизат трижды подвергали обработке ультразвуком в течение 10 секунд при 90 В, обеспечивая таким образом, возможность снизить вязкость среды путем фрагментации ДНК. Потом лизат разводили в 2,5 раза в буфере Трис/HCl 50 мМ рН 8, NaCl 1 М и центрифугировали при 10000 g в течение 30 мин при 4 С. Супернатант потом помещали на Ni-NTA Superflow аффинную колонку на 20 мл (Qiagen), предварительно уравновешенную с помощью упомянутого выше буфера. После промывания колонки в течение всей ночи для удаления всех неабсорбированных белков, а также ДНК, белки элюировали при использовании линейного градиента (0-500 мМ) имидазола (ACS, Merck) в буфере для уравновешивания колонки. Фракции, содержащие белок, представляющий интерес, собирали и подвергали диализу против буфера HEPES 20 мМ рН 7,5, KCl 50 мМ, ЭДТА 1 мМ. Диализат, значение рН которого доводили до 6 при использовании MES 1 М, загружали в катионообменную колонку Poros 20-HS (Perseptive Biosystem), предварительно уравновешенную в буфере MES 50 мМ рН 6, KCl 50 мМ. Элюирование осуществляли с помощью линейного градиента KCl (50 мМ-1 М). Объединяли белковые фракции и потом концентрировали с помощью ультрафильтрации (Amicon-Ultra с порогом отсечения размеров 10000) и подвергали диализу против буфера Трис/HCl 20 мМ рН 8, KCl 100 мМ. Белки хранили в виде аликвот при -80 С. Чистоту различных белков определяли как 98 % в соответствии с электрофоретическим анализом в денатурирующих условиях и при окрашивании с помощью Кумасси голубого. Концентрацию белка определяли путем измерения абсорбции при 280 нм при использовании коэффициента молярной экстинкции 5960 М-1 см-1. 2.4 Гель-фильтрация белка дикого типа и мутанта F312A Эксперименты по гель-фильтрации осуществляли при температуре 4 С на колонке Superdex 75 HR 10/30 (Amersham Biosciences). Колонку уравновешивали в буфере Трис/HCl 50 мМ рН 7,5, NaCl 200 мМ,DTE 0,2 мМ при 4 С при скорости потока 0,5 мл/мин. Образец постоянного объема (200 мкл) при концентрации 0,3 мкМ вводили в колонку при скорости 0,5 мл/мин. Белки разводили в буфере для уравновешивания колонки и оставляли при 4 С в течение 2 ч перед введением для того, чтобы позволить им уравновеситься. Для определения элюирования белков RF-10 AXL спектрофлуориметр (Shimadzu) последовательно соединяли с устройством АКТА. Регистрировали собственную флуоресценцию, измеряя эмиссию флуоресценции остатков тирозина при длине волны 310 нм после возбуждения при 280 нм.
МПК / Метки
МПК: A61K 38/17, C12N 15/09, G06F 17/50, C07K 14/47
Метки: кристаллическая, сс2-lz, домена, структура
Код ссылки
<a href="https://eas.patents.su/30-20189-kristallicheskaya-struktura-ss2-lz-domena-nemo.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллическая структура сс2-lz домена nemo</a>
Предыдущий патент: Способ изготовления созревающего в упаковке сыра, упаковка для созревания сыра и сыр
Следующий патент: Непрерывный способ получения амидов жирных кислот
Случайный патент: Здание и способ возведения зданий


































