Органические соединения
Номер патента: 18863
Опубликовано: 29.11.2013
Авторы: Фэрхёрст Робин Алек, Караватти Джорджио, Гуаньано Вито, Имбах Патрисиа, Фюре Паскаль
Формула / Реферат
1. Соединение формулы (IA)
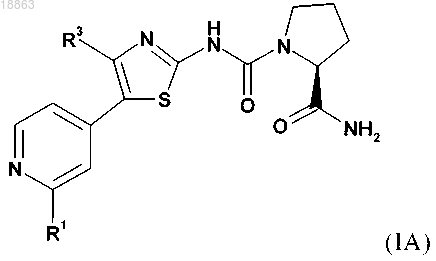
или его фармацевтически приемлемая соль,
в которой R1 обозначает один из следующих заместителей: (1) незамещенный или замещенный С1-С7-алкил, где указанные заместители независимо выбраны из 1-9 фрагментов дейтерия или фтора, или 1-2 фрагментов С3-С5-циклоалкила; (2) необязательно замещенный С3-С5-циклоалкил, где указанные заместители независимо выбраны из 1-4 следующих заместителей: дейтерий, С1-С4-алкил, фтор, цианогруппа, аминокарбонил; (3) необязательно замещенный фенил, где указанные заместители независимо выбраны из 1-2 следующих фрагментов: дейтерий, галоген, цианогруппа, С1-С7-алкил, С1-С7-алкиламиногруппа, ди(С1-С7-алкил)аминогруппа, С1-С7-алкиламинокарбонил, ди(С1-С7-алкил)аминокарбонил, С1-С7-алкоксигруппа; (4) необязательно моно- или дизамещенный амин; где указанные заместители независимо выбраны из следующих фрагментов: дейтерий, С1-С7-алкил (который является незамещенным или содержит один или более заместителей, выбранных из группы, включающей дейтерий, фтор, хлор, гидроксигруппу), фенилсульфонил (который является незамещенным или содержит один из следующих заместителей: С1-С7-алкил, С1-С7-алкоксигруппа, ди(С1-С7-алкил)амино-С1-С7-алкоксигруппа); (5) замещенный сульфонил; где указанный заместитель выбран из следующих фрагментов: С1-С7-алкил (который является незамещенным или содержит один или более заместителей, выбранных из группы, включающей дейтерий, фтор), пирролидиновую группу (которая является незамещенной или содержит один или более заместителей, выбранных из группы, включающей дейтерий, гидроксигруппу, оксогруппу); (6) фтор, хлор;
R3 обозначает (1) водород, (2) фтор, хлор, (3) необязательно замещенный метил, где указанные заместители независимо выбраны из 1-3 следующих фрагментов: дейтерий, фтор, хлор, диметиламиногруппа.
2. Соединение по п.1, в котором R1 обозначает (1) циклопропилметил или необязательно замещенный разветвленный С3-С7-алкил, где указанные заместители независимо выбраны из 1-9 фрагментов дейтерия или фтора; (2) необязательно замещенный циклопропил или циклобутил, где указанные заместители независимо выбраны из 1-4 следующих заместителей: метил, дейтерий, фтор, цианогруппа, аминокарбонил; (3) необязательно замещенный фенил, где указанные заместители независимо выбраны из 1-2 следующих фрагментов: дейтерий, галоген, цианогруппа, C1-C7-алкил, С1-С7-алкиламиногруппа, ди(С1-С7-алкил)аминогруппа, С1-С7-алкиламинокарбонил, ди(С1-С7-алкил)аминокарбонил, С1-С7-алкоксигруппа; (4) необязательно моно- или дизамещенный амин; где указанные заместители независимо выбраны из следующих фрагментов: дейтерий, С1-С7-алкил (который является незамещенным или содержит один или более заместителей, выбранных из группы, включающей дейтерий, фтор, хлор, гидроксигруппу), фенилсульфонил (который является незамещенным или содержит один из следующих заместителей: С1-С7-алкил, С1-С7-алкоксигруппа, ди(С1-С7-алкил)амино-С1-С7-алкоксигруппа); (5) замещенный сульфонил; где указанный заместитель выбран из следующих фрагментов: С1-С7-алкил (который является незамещенным или содержит один или более заместителей, выбранных из группы, включающей дейтерий, фтор), пирролидиновую группу (которая является незамещенной или содержит один или более заместителей, выбранных из группы, включающей дейтерий, гидроксигруппу, оксогруппу); (6) фтор, хлор;
R3 обозначает водород, метил, CD3, CH2Cl, CH2F, CH2N(CH3)3.
3. Соединение по п.1 или 2, в котором R1 обозначает -C(CH3)2CF3, C(CD3)3 или 1-метилциклопропил.
4. Соединение по любому из пп.1-3, в котором R3 обозначает метил.
5. Соединение в свободной форме или в форме фармацевтически приемлемой соли, выбранное из группы, включающей
2-амид,1-{[5-(2-трет-бутилпиридин-4-ил)-4-метилтиазол-2-ил]амид} (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-{[5-(2-циклопропилпиридин-4-ил)-4-метилтиазол-2-ил]амид} (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(2-фторфенил)пиридин-4-ил]-4-метилтиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-{[5-(2-циклобутилпиридин-4-ил)-4-метилтиазол-2-ил]амид} (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({4-метил-5-[2-(1-метилциклопропил)пиридин-4-ил]тиазол-2-ил)амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-([4-метил-5-[2-(1-метилциклобутил)пиридин-4-ил]тиазол-2-ил]амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-([5-(2-трет-бутилпиридин-4-ил)тиазол-2-ил]амид} (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-{[5-(2-изопропилпиридин-4-ил)-4-метилтиазол-2-ил]амид} (S)-пирролидии-1,2-дикарбоновой кислоты;
2-амид,1-{[5-(2-циклобутилпиридин-4-ил)тиазол-2-ил]амид} (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(1-метилциклопропил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(1-трифторметилциклопропил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(2,2,2-трифтор-1,1-диметилэтил)пиридин-4-ил]тиазол-2-ил)амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(1-трифторметилциклобутил)пиридин-4-ил]тиазол-2-ил)амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({4-метил-5-[2-(1-трифторметилциклопропил)пиридин-4-ил)тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({4-метил-5-[2-(1-трифторметилциклобутил)пиридин-4-ил]тиазол-2-ил)амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(1-метилциклобутил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-((5-[2-(1-цианоциклопропил)пиридин-4-ил]-4-метилтиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(1-цианоциклобутил)пиридин-4-ил]-4-метилтиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(1-карбамоилциклобутил)пиридин-4-ил]-4-метилтиазол-2-ил}амид (S)-пирролидин-1,2-дикарбоновой кислоты);
2-амид,1-({5-[2-(2-диметиламино-1,1-диметилэтил)пиридин-4-ил]-4-метилтиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-([5-(2-диэтиламинопиридин-4-ил)-4-метилтиазол-2-ил]амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-{[5-(2-диэтиламинопиридин-4-ил)тиазол-2-ил]амид} (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-[(5-{2-[1-(4-метоксифенил)-1-метилэтил]пиридин-4-ил}-4-метилтиазол-2-ил)амид] (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-[(5-{2-[1-(4-метоксифенил)-1-метилэтил]пиридин-4-ил}тиазол-2-ил)амид] (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-[(5-{2-[1-(4-метоксифенил)циклопропил]пиридин-4-ил}-4-метилтиазол-2-ил)амид] (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-[(5-{2-[1-(4-метоксифенил)циклопропил]пиридин-4-ил}тиазол-2-ил)амид] (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-{[5-(2-{1-[4-(3-диметиламинопропокси)фенил]-1-метилэтил}пиридин-4-ил)-4-метилтиазол-2-ил]амид} (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({4-метил-5-[2-(1-d3-метилциклобутил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(1-d3-метилциклобутил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({4-d3-метил-5-[2-(1-метилциклопропил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({4-d3-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({4-диметиламинометил-5-[2-(1-d3-метилциклобутил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({4-хлор-5-[2-(2,2,2-трифтор-1,1-диметилэтил)пиридин-4-ил]гиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({4-фторметил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)пиридин-4-ил]тиазол-2-ил})амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(2-фтор-1,1-диметилэтил)пиридин-4-ил]-4-метилтиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты;
2-амид,1-({5-[2-(2-фтор-1-фторметил-1-метилэтил)пиридин-4-ил]-4-мстилтиазол-2-ил}амид (S)-пирролидин-1,2-дикарбоновой кислоты.
6. Соединение 2-амид,1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты структуры
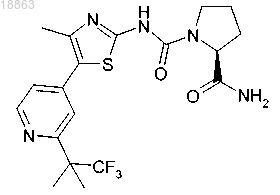
в свободной форме или в форме фармацевтически приемлемой соли.
7. Применение соединения формулы (IA) по любому из пп.1-6 в свободной форме или в форме фармацевтически приемлемой соли для приготовления лекарственного средства, предназначенного для лечения рака.
8. Применение по п.7, где рак выбран из группы, включающей саркому, рак легких, бронхов, предстательной железы, молочной железы (включая спорадические типы рака молочной железы и страдающих болезнью Коудена), поджелудочной железы, желудочно-кишечный рак, толстой кишки, прямой кишки, карциному толстой кишки, колоректальную аденому, щитовидной железы, печени, внутрипеченочного желчного протока, гепатоцеллюлярный рак, рак надпочечников, желудка, желудочно-кишечного тракта, глиому, глиобластому, эндометрия, меланому, почек, почечной лоханки, мочевого пузыря, тела матки, шейки матки, влагалища, яичников, множественную миелому, пищевода, лейкоз, острый миелолейкоз, хронический миелолейкоз, лимфолейкоз, миелолейкоз, головного мозга, карциному головного мозга, полости рта и глотки, гортани, тонкого кишечника, неходжкинскую лимфому, меланому, ворсинчатую аденому толстой кишки, неоплазию, неоплазию эпителиального характера, лимфомы, карциному молочной железы, базально-клеточную карциному, плоскоклеточную карциному, старческий кератоз, опухолевые заболевания, включая солидные опухоли; опухоли головы или шеи, истинную полицитемию, эссенциальную тромбоцитемию, миелофиброз с миелоидной метаплазией и болезнь Вальденстрема.
9. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (IA) по любому из пп.1-6 в свободной форме или в форме фармацевтически приемлемой соли и один или более фармацевтически приемлемых инертных наполнителей.
10. Фармацевтическая композиция по п.9, предназначенная для лечения рака.
11. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли для лечения рака.
12. Применение по п.11, где рак выбран из группы, включающей саркому, рак легких, бронхов, предстательной железы, молочной железы (включая спорадические типы рака молочной железы и страдающих болезнью Коудена), поджелудочной железы, желудочно-кишечный рак, толстой кишки, прямой кишки, карциному толстой кишки, колоректальную аденому, щитовидной железы, печени, внутрипеченочного желчного протока, гепатоцеллюлярный рак, рак надпочечников, желудка, желудочно-кишечного тракта, глиому, глиобластому, эндометрия, меланому, почек, почечной лоханки, мочевого пузыря, тела матки, шейки матки, влагалища, яичников, множественную миелому, пищевода, лейкоз, острый миелолейкоз, хронический миелолейкоз, лимфолейкоз, миелолейкоз, головного мозга, карциному головного мозга, полости рта и глотки, гортани, тонкого кишечника, неходжкинскую лимфому, меланому, ворсинчатую аденому толстой кишки, неоплазию, неоплазию эпителиального характера, лимфомы, карциному молочной железы, базально-клеточную карциному, плоскоклеточную карциному, старческий кератоз, опухолевые заболевания, включая солидные опухоли; опухоли головы или шеи, истинную полицитемию, эссенциальную тромбоцитемию, миелофиброз с миелоидной метаплазией и болезнь Вальденстрема.
Текст
Настоящее изобретение относится к соединениям формулы (IA) или их солям, где значения заместителей определены далее к композиции, содержащей эти соединения, и к их применению для лечения заболеваний, протекание которых облегчается путем ингибирования фосфатидилинозит-3 киназы. Караватти Джорджио (CH), Фэрхрст Робин Алек (GB), Фюре Паскаль,Гуаньано Вито, Имбах Патрисиа (CH) Веселицкая И.А., Пивницкая Н.Н.,Кузенкова Н.В., Веселицкий М.Б.,Каксис Р.А., Комарова О.М., Белоусов Ю.В. (RU) 018863 Настоящее изобретение относится к особым 2-карбоксамидциклоаминопроизводным мочевины в качестве новых ингибиторов фосфатидилинозит (PI) 3-киназы-, их фармацевтически приемлемым солям, пролекарствам и способам их получения. Настоящее изобретение также относится к композициям этих соединений по отдельности или в комбинации по меньшей мере с одним дополнительным терапевтическим средством и необязательно в комбинации с фармацевтически приемлемым носителем. Настоящее изобретение также относится к способам применения этих соединений по отдельности или в комбинации по меньшей мере с одним дополнительным терапевтическим средством для профилактики или лечения целого ряда заболеваний, предпочтительно опосредуемых аномальной активностью одного или большего количества следующих веществ: факторов роста, рецепторных тирозинкиназ, протеинсерин/треонинкиназ, связанных с белком G рецепторов и фосфолипидкиназ и фосфатаз. Фосфатидилинозит-3-киназы (PI3K) представляют собой семейство липидных киназ, которые катализируют перенос фосфата в D-3'-положение инозитсодержащих липидов с образованием фосфоинозит 3-фосфата (PIP), фосфоинозит-3,4-дифосфата (PIP2) и фосфоинозит-3,4,5-трифосфата (PIP3), которые, в свою очередь, действуют в качестве вторичных мессенджеров в каскадах передачи сигналов путем вовлечения белков, которые содержат гомологичные плекстрину FYVE, Phox и другие связывающие фосфолипиды домены, в различные передающие сигналы комплексы, которые часто присутствуют на плазматической мембране Vanhaesebroeck et al., Annu. Rev. Biochem 70:535 (2001); Katso et al., Annu. Rev.Cell Dev. Biol. 17:615 (2001. Среди PI3K, принадлежащих двум классам, которые являются подклассами класса 1, PI3K класса 1 А представляют собой гетеродимеры, состоящие из каталитической субъединицы р 110 (изоформы , , ), конститутивно ассоциированной с регуляторной субъединицей, которая может представлять собой р 85, р 55, р 50, р 85 или р 55. Подкласс, представляющий собой класс 1 В, состоит из одного представителя семейства, а именно гетеродимера, который включает каталитическую субъединицу p110, ассоциированную с двумя регуляторными субъединицами р 101 или р 84 (Fruman et al.,Annu Rev. Biochem. 67:481 (1998); Suire et al., Curr. Biol. 15:566 (2005. Модулярные домены субъединиц р 85/55/50 включают домены, гомологичные Src (SH2), которые связывают остатки фосфотирозина в контексте специфической последовательности на активированном рецепторе и цитоплазматических тирозинкиназах, что приводит к активации и локализации PI3K класса 1 А. PI3K класса 1 В активируются непосредственно сшитыми с протеином G рецепторами, с которыми связывается много разнообразных пептидных и непептидных лигандов (Stephens et al., Cell 89:105 (1997; Katso et al., Annu. Rev. Cell Dev.Biol. 17:615-675 (2001. В результате образовавшиеся фосфолипидные продукты PI3K класса I связывают рецепторы, расположенные выше в пути передачи сигнала, с расположенными ниже в пути передачи сигнала клеточными элементами, оказывающими воздействие на пролиферацию, выживание, хемотаксис, направленную миграцию клеток, подвижность, метаболизм, воспалительные и аллергические ответы, транскрипцию и трансляцию (Cantley et al., Cell 64:281 (1991); Escobedo and Williams, Nature 335:85(1988); Fantl et al., Cell 69:413 (1992. Во многих случаях PIP2 и PIP3 приводят к рекрутменту Akt, человеческого продукта, гомологичного вирусному онкогену -Akt, на плазматической мембране, где он действует в качестве узловой точки для многих внутриклеточных путей передачи сигналов, важных для роста и выживания (Fantl et al., Cell 69:413-423(1992); Bader et al., Nat Rev. Cancer 5:921 (2005); Vivanco and Sawyer, Nat. Rev. Cancer 2:489(2002. Аномальная регуляция PI3K, которая часто повышает выживание благодаря активации Akt, является одним из наиболее превалирующих явлений при раке у человека и, как установлено, происходит на нескольких уровнях. У гена-супрессора опухолей PTEN, который дефосфорилирует фосфоинозитиды в 3'-положении инозитного кольца и поэтому обладает способностью антагонизировать активность PI3K,во многих типах опухолей отсутствует функциональная активность. В других типах опухолей происходит амплификация генов, кодирующих изоформу p110, PIK3CA и Akt, и повышенный уровень экспрессии белковых продуктов этих генов был продемонстрирован при некоторых видах рака человека. Кроме того, для некоторых видов рака человека описаны мутации и транслокации субъединицы р 85, которая служит для повышающей регуляции комплекса р 85-р 110. И, наконец, установлено, что соматические миссенс-мутации PIK3CA, которые активируют пути дальнейшей передачи сигнала, достаточно часто встречаются при многих видах рака человека (Kang at el., Proc. Natl. Acad. Sci. USA 102:802 (2005);Samuels et al., Science 304:554 (2004); Samuels et al., Cancer Cell 7:561-573(2005. Эти данные свидетельствуют о том, что нарушение регуляции фосфоинозит-3-киназы и компонентов, находящихся выше и ниже в этом пути передачи сигнала, является одним из наиболее распространенных видов нарушения регуляции, ассоциированных с раком и пролиферативными заболеваниями человека (Parsons et al., Nature 436:792(2005); Hennessey at el., Nature Rev. Drug Dis. 4:988-1004 (2005. Поэтому ингибиторы PI3K- должны быть полезными для лечения пролиферативного заболевания и других нарушений. В WO 2004/096797 раскрыты некоторые производные тиазола в качестве ингибиторов PI3K- и их применение в качестве лекарственных средств, в частности, для лечения воспалительных и аллергических патологических состояний. В WO 2005/021519 также раскрыты некоторые производные тиазола в качестве ингибиторов PI3K-1 018863 и их применение в качестве лекарственных средств, в частности, для лечения воспалительных и аллергических патологических состояний. В WO 2006/051270 также раскрыты некоторые производные тиазола в качестве ингибиторов PI3Kи их применение в качестве лекарственных средств, в частности, вследствие их противоопухолевой активности. В WO 2007/129044 также раскрыты некоторые производные тиазола в качестве ингибиторов PI3Kи их применение в качестве лекарственных средств, в частности, вследствие их противоопухолевой активности. С учетом предшествующего уровня техники необходимо получение дополнительных соединений,применимых для лечения пролиферативных заболеваний, в частности соединений, обладающих улучшенной селективностью и/или большей/улучшенной активностью. Согласно изобретению было установлено, что 2-карбоксамидциклоаминопроизводные мочевины формулы (I), приведенные ниже, обладают благоприятными фармакологическими характеристиками и ингибируют, например, PI3K (фосфатидилинозит-3-киназа). В частности, по данным биохимических и/или проводимых с использованием клеток анализов эти соединения предпочтительно обладают высокой степенью селективности по отношению к PI3K- по сравнению с селективностью по отношению к подтипам , и/или , и/или . Поэтому соединения формулы I применимы, например, для лечения заболеваний, зависящих от киназ PI3 (предпочтительно PI3K-, таких как при которых наблюдаются сверхэкспрессирование или амплификация PI3K-, соматические мутации PIK3CA или мутации зародышевого типа или соматические мутации PTEN или мутации и транслокации р 85, которые обеспечивают повышающую регуляцию комплекса р 85-р 110), в особенности пролиферативных заболеваний, таких как опухолевые заболевания и лейкозы. Кроме того, эти соединения предпочтительно обладают улучшенной метаболический стабильностью и поэтому сниженным клиренсом, что приводит к улучшенным фармакокинетическим профилям. Первым объектом настоящего изобретения являются соединения формулы (IA) или их фармацевтически приемлемые соли, в которойR1 обозначает один из следующих заместителей: (1) незамещенный или замещенный С 1-С 7-алкил,где указанные заместители независимо выбраны из 1-9 фрагментов дейтерия или фтора или 1-2 фрагментов С 3-С 5-циклоалкила; (2) необязательно замещенный С 3-С 5-циклоалкил, где указанные заместители независимо выбраны из 1-4 следующих заместителей: дейтерий, С 1-С 4-алкил, фтор, цианогруппа, аминокарбонил; (3) необязательно замещенный фенил, где указанные заместители независимо выбраны из 1-2 следующих фрагментов: дейтерий, галоген, цианогруппа, С 1-С 7-алкил, С 1-С 7 алкиламиногруппа, ди(С 1 С 7-алкил)аминогруппа,С 1-С 7-алкиламинокарбонил,ди(С 1-С 7-алкил)аминокарбонил,С 1-С 7 алкоксигруппа; (4) необязательно моно- или дизамещенный амин; где указанные заместители независимо выбраны из следующих фрагментов: дейтерий, С 1-С 7-алкил (который является незамещенным или содержит один или более заместителей, выбранных из группы, включающей дейтерий, фтор, хлор, гидроксигруппу), фенилсульфонил (который является незамещенным или содержит один из следующих заместителей: С 1-С 7-алкил, С 1-С 7-алкоксигруппа, ди(С 1-С 7-алкил)амино-С 1-С 7-алкоксигруппа); (5) замещенный сульфонил; где указанный заместитель выбран из следующих фрагментов: С 1-С 7-алкил (который является незамещенным или содержит один или более заместителей, выбранных из группы, включающей дейтерий, фтор), пирролидиновую группу (которая является незамещенной или содержит один или более заместителей, выбранных из группы, включающей дейтерий, гидроксигруппу, оксогруппу); (6) фтор,хлор;R3 обозначает (1) водород, (2) фтор, хлор, (3) необязательно замещенный метил, где указанные заместители независимо выбраны из 1-3 следующих фрагментов: дейтерий, фтор, хлор, диметиламиногруппа. Настоящее изобретение можно лучше понять с помощью приведенного ниже описания, включая приведенный ниже словарь терминов и последующие примеры. Для краткости укажем, что раскрытия и публикации, цитированные в настоящем описании, включены в настоящее изобретение в качестве ссылки. При использовании в настоящем изобретении термины "включая", "содержащий" и "включающий" применяются в широком, не ограничительном смысле. Любая формула, приведенная в настоящем изобретении, предназначена для описания соединений,обладающих структурой, представленной структурной формулой, а также некоторых их вариантов и-2 018863 форм. В частности, соединения любой формулы, приведенной в настоящем изобретении, могут содержать асимметрические центры и поэтому существовать в разных энантиомерных формах. Если в соединении формулы (I) содержится по меньшей мере один асимметрический атом углерода, то такое соединение может существовать в оптически активной форме или в виде смеси оптических изомеров, например в виде рацемической смеси. Все оптические изомеры и их смеси, включая рацемические смеси, входят в объем настоящего изобретения. Таким образом, любая конкретная формула, приведенная в настоящем изобретении, означает рацемат, одну или большее количество энантиомерных форм, одну или большее количество диастереоизомерных форм, одну или большее количество атропоизомерных форм и их смесей. Кроме того, некоторые структуры могут существовать в виде геометрических изомеров (т.е. цис- и транс-изомеров), в виде таутомеров или в виде атропоизомеров. Любая формула, приведенная в настоящем изобретении, характеризует гидраты, сольваты и полиморфные формы таких соединений и их смеси. Любая формула, приведенная в настоящем изобретении, также характеризует немеченые формы, а также изотопно-меченые формы соединений. Изотопно-меченые соединения обладают структурами, описывающимися формулами, приведенными в настоящем изобретении, за исключением того, что один или большее количество атомов заменены на атомы, обладающие указанными атомными массами или массовыми числами. Примеры изотопов, которые можно вводить в соединения, предлагаемые в настоящем изобретении, включают изотопы водорода, углерода, азота, фтора, фосфора, серы, хлора и иода, такие как 2 Н, 3 Н, 11 С, 13 С, 14 С, 15N, 18F, 31P, 32P,35S, 36Cl, 125I соответственно. В объем настоящего изобретения входят различные изотопно-меченые соединения, предлагаемые в настоящем изобретении, например, в которые включены радиоактивные изотопы, такие как 3 Н, 13 С и 14 С. Такие изотопно-меченые соединения применимы для изучения метаболизма (предпочтительно содержащие 14 С), кинетики реакций (содержащие, например, 2 Н или 3 Н), в методологиях детектирования и визуализации, таких как позитронная эмиссионная томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОФЭКТ), включая исследование распределения лекарственного средства или субстрата в тканях или лучевую терапию пациентов. В частности, содержащее 18F или меченое им соединение может быть особенно предпочтительным для исследований с помощью ПЭТ или ОФЭКТ. Изотопно-меченые соединения, предлагаемые в настоящем изобретении, и их пролекарства обычно можно получить по методикам, раскрытым в схемах или в примерах и синтезах,описанных ниже, путем замены не содержащего изотопа реагента на легкодоступный изотопно-меченый реагент. Кроме того, замещение более тяжелыми изотопами, предпочтительно дейтерием (т.е. 2 Н или D),может обеспечить некоторые терапевтические преимущества, обусловленные их более высокой метаболической стабильностью, например увеличенной длительностью полувыведения in vivo или возможностью использования меньших доз, или улучшением терапевтического индекса. Следует понимать, что в этом контексте дейтерий рассматривается в качестве заместителя в соединении формулы (I). Концентрацию такого более тяжелого изотопа, в частности дейтерия, можно определить с помощью коэффициента изотопного обогащения. Термин "коэффициент изотопного обогащения" при использовании в настоящем изобретении означает отношение содержания изотопа к содержанию конкретного изотопа в природе. Если заместитель в соединении, предлагаемом в настоящем изобретении, означает дейтерий, то такое соединение характеризуется коэффициентом изотопного обогащения для каждого обозначенного атома дейтерия, равным не менее 3500 (содержание дейтерия для каждого обозначенного атома дейтерия равно 52,5%), не менее 4000 (содержание дейтерия равно 60%), не менее 4500 (содержание дейтерия равно 67,5%), не менее 5000 (содержание дейтерия равно 75%), не менее 5500 (содержание дейтерия равно 82,5%), не менее 6000 (содержание дейтерия равно 90%), не менее 6333,3 (содержание дейтерия равно 95%), не менее 6466,7 (содержание дейтерия равно 97%), не менее 6600 (содержание дейтерия равно 99%) или не менее 6633,3 (содержание дейтерия равно 99,5%). В соединениях, предлагаемых в настоящем изобретении, любой атом, специально не обозначенный, как конкретный изотоп означает любой стабильный изотоп этого атома. Если не указано иное, когда специально указано "Н" или "водород", это означает водород, обладающий природным изотопным составом. Соответственно, в соединениях, предлагаемых в настоящем изобретении, любой атом, специально обозначенный, как дейтерий (D) означает атом с содержанием дейтерия, например, в указанных выше диапазонах. Выбор значения конкретного фрагмента из перечня возможных значений при описании любой формулы, приведенной в настоящем изобретении, не означает задание значения этого фрагмента для остальной части настоящего описания. Другими словами, если переменная содержится более одного раза, то выбор ее значений из перечня значений не зависит от выбора значений этой переменной в формуле, находящейся в другой части настоящего описания (где в вариантах осуществления одно или большее количество и вплоть до всех более общих значений, охарактеризованных выше или ниже как предпочтительные, можно заменить на более предпочтительное определение и таким образом образовать соответствующий более предпочтительный вариант осуществления настоящего изобретения). Если используется множественное число (например, соединения, соли), то она включает и единственное число (например, одно соединение, одну соль). Использование термина "соединение" не исклю-3 018863 чает того, что (например, в фармацевтическом препарате) содержится больше чем одно соединение формулы (I) (или его соль). Если не указано иное, то в настоящем описании применимы указанные ниже общие определения. Галоген означает фтор, бром, хлор или йод, предпочтительно фтор, хлор. Галогензамещенные группы и фрагменты, такие как алкил, замещенный галогеном (галогеналкил), могут быть моно-, полиили пергалогенированными. Углеродсодержащие группы, фрагменты или молекулы содержат от 1 до 7, предпочтительно от 1 до 6, более предпочтительно от 1 до 4, наиболее предпочтительно 1 или 2 атома углерода. Любая нециклическая углеродсодержащая группа или фрагмент, содержащий более 1 атома углерода, обладает линейной или разветвленной цепью. Приставка "низш." или "С 1-С 7" означает радикал, содержащий максимально до 7 включительно,предпочтительно максимально до 4 включительно атомов углерода, использующиеся радикалы являются линейными или разветвленными и содержат одно или несколько разветвлений."Алкил" означает обладающую линейной или разветвленной цепью алкильную группу, предпочтительно представляет собой обладающий линейной или разветвленной цепью С 1-С 12-алкил, особенно предпочтительно представляет собой обладающий линейной или разветвленной цепью С 1-С 7-алкил, например метил, этил, н- или изопропил, н-, изо-, втор- или трет-бутил, н-пентил, н-гексил, н-гептил, ноктил, н-нонил, н-децил, н-ундецил, н-додецил, особенно предпочтительными являются метил, этил, нпропил, изопропил и н-бутил и изобутил. Алкил может быть незамещенным или замещенным. Типичные заместители включают, но не ограничиваются только ими, гидроксигруппу, алкоксигруппу, галоген и аминогруппу. Примером замещенного алкила является трифторметил. Циклоалкил также может быть заместителем алкила. Примером такого случая является фрагмент (алкил)-циклопропил или алкандиилциклопропил, например -СН 2-циклопропил. С 1-С 7-Алкил предпочтительно представляет собой алкил,содержащий от 1 включительно до 7 включительно, предпочтительно от 1 включительно до 4 включительно атомов углерода, и является линейным или разветвленным; низш. алкил предпочтительно представляет собой бутил, такой как н-бутил, втор-бутил, изобутил, трет-бутил, пропил, такой как н-пропил или изопропил, этил или предпочтительно метил. Каждый алкильный фрагмент других групп, таких как "алкоксигруппа", "алкоксиалкил", "алкоксикарбонил", "алкоксикарбонилалкил", "алкилсульфонил", "алкилсульфоксил", "алкиламиногруппа", "галогеналкил", обладает таким же значением, как указано в приведенном выше определении "алкила"."Циклоалкил" означает насыщенный или частично насыщенный моноциклический, конденсированный полициклический или спиросочлененный полициклический карбоцикл, содержащий от 3 до 12 кольцевых атомов в одном карбоцикле. Иллюстративные примеры циклоалкильных групп включают следующие фрагменты: циклопропил, циклобутил, циклопентил и циклогексил. Циклоалкил может быть незамещенным или замещенным; типичные заместители указаны в определении алкила и также включают сам алкил (например, метил). Фрагмент типа -(СН 3)циклопропил считается замещенным циклоалкилом."Лечение" включает профилактическое (предупредительное) и терапевтическое лечение, а также задержку прогрессирования заболевания или нарушения."Опосредуемые PI3 киназой заболевания" (предпочтительно опосредуемые PI3K- заболевания и заболевания, опосредуемые сверхэкспрессированием или амплификацией PI3K- , соматическими мутациями PIK3CA или мутациями зародышевого типа или соматическими мутациями PTEN или мутациями и транслокациями р 85, которые обеспечивают повышающую регуляцию комплекса p85-p110) предпочтительно представляют собой нарушения, которые реагируют благоприятным образом (например, происходит ослабление одного или большего количества симптомов, задержка начала заболевания, вплоть до временного или полного излечивания заболевания) на ингибирование киназы PI3, предпочтительно на ингибирование PI3K- или ее мутантной формы (где из числа подвергающихся лечению заболеваний в особенности можно отметить пролиферативные заболевания, такие как опухолевые заболевания и лейкозы)."Соли" (то, что означает выражение "или его соли" или "или его соль") могут содержаться по отдельности или в смеси со свободным соединением формулы (IA) и предпочтительно представляют собой фармацевтически приемлемые соли. Такие соли, например, образуются в виде солей присоединения с кислотами, предпочтительно с органическими или неорганическими кислотами, из соединений формулы(IA), содержащих основной атом азота, предпочтительно фармацевтически приемлемые соли. Подходящими неорганическими кислотами являются, например, галогенводородные кислоты, такие как хлористо-водородная кислота, серная кислота или фосфорная кислота. Подходящими органическими кислотами являются, например, карбоновые кислоты или сульфоновые кислоты, такие как фумаровая кислота или метансульфоновая кислота. Для выделения и очистки также можно использовать фармацевтически неприемлемые соли, например пикраты или перхлораты. Для терапевтического применения используют только фармацевтически приемлемые соли или свободные соединения (если они применимы в виде фармацевтических препаратов) и поэтому они являются предпочтительными. Вследствие близкого родства-4 018863 новых соединений в свободной форме и в форме их солей, включая соли, которые можно использовать в качестве промежуточных продуктов, например, при очистке или идентификации новых соединений, любое указание на свободное соединение выше и ниже в настоящем изобретении следует понимать также и как указание на соответствующие соли, если это является подходящим или целесообразным. Соли соединений формулы (IA) предпочтительно представляют собой фармацевтически приемлемые соли; подходящие противоионы, образующие фармацевтически приемлемые соли, известны в данной области техники."Комбинация" означает фиксированную комбинацию в одной разовой дозированной форме или набор компонентов для комбинированного введения, при котором соединение и компонент комбинации(например, другое лекарственное средство, как указано ниже, также называющееся как "терапевтическое средство" или "совместно вводимое средство") можно независимо вводить одновременно или по отдельности через определенные промежутки времени, предпочтительно так, чтобы эти промежутки времени позволяли компонентам комбинации оказывать совместное, например, синергетическое воздействие. Термины "совместное введение" или "комбинированное введение" и т.п. при использовании в настоящем изобретении означают введение выбранного компонента комбинации одному нуждающемуся в нем субъекту (например, пациенту) и включают режимы лечения, при которых средства необязательно вводят одним и тем же путем или в одно и то же время. Термин "фармацевтическая комбинация" при использовании в настоящем изобретении означает препарат, полученный смешиванием или комбинированием более одного активного ингредиента, и включает фиксированные и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" означает, что активные ингредиенты, например соединение и другой компонент комбинации, оба вводят пациенту одновременно в виде одного объекта или дозы. Термин "нефиксированная комбинация" означает, что активные ингредиенты, например соединение и другой компонент комбинации, оба вводят пациенту в виде отдельных объектов совместно, одновременно или последовательно без установленных временных ограничений и такое введение обеспечивает терапевтически эффективные содержания этих двух соединений в организме пациента. Последнее также относится к смешанному лечению, например, введению трех или большего количества активных ингредиентов. Соединения формулы (IA) могут быть также представлены в виде фармацевтически приемлемых пролекарств или фармацевтически приемлемых метаболитов. Соединения формулы (IA) могут быть получены с помощью подходящих известных методик превращения различных аминов в соответствующие производные мочевины с использованием соответствующего исходного вещества. Таким образом, соединение формулы (IA) можно получить реакцией соединения формулы (II) в которой заместители R2 и R3 являются такими, как определено выше, а цикл А означает пиридин, в присутствии активирующего реагента ("способ А"),или с соединением формулы (IIIB) в которой заместители R2 и R3 являются такими, как определено выше, цикл А означает пиридин и RG обозначает реакционноспособную группу, такую как имидазолилкарбонил, которая может реагировать непосредственно или путем образования промежуточного изоцианата формулы (IIIE) ("способ В"),в которой заместители являются такими, как определено в (IIIB), в каждом случае необязательно в присутствии разбавителя и необязательно в присутствии средства, способствующего протеканию реакции, и извлечение полученного соединения формулы (IA) в свободной форме или в форме соли и, необязательно, превращение соединения формулы (IA), полученного способом А или способом В, в другое соединение формулы (IA), и/или превращение полученной соли соединения формулы (IA) в другую его соль,и/или превращение полученного свободного соединения формулы (IA) в его соль, и/или отделение полученного изомера соединения формулы (IA) от одного или большего количества различных полученных изомеров формулы I. Условия проведения реакций Способ можно осуществить по методикам, известным в данной области техники, или описанным ниже в примерах. Например, соединение формулы II можно ввести в реакцию с соединением формулыIII в растворителе, например диметилформамиде, в присутствии основания, например органического амина, например триэтиламина. Когда выше или ниже в настоящем изобретении указаны значения температуры, к ним следует добавить слово "примерно", как указание на небольшие отклонения от приведенных числовых значений,например, допустимыми являются отклонения, составляющие 10%. Все реакции могут протекать в присутствии одного или большего количества разбавителей и/или растворителей. Исходные вещества можно использовать в эквимолярных количествах; альтернативно,соединение можно использовать в избытке, например, в качестве растворителя или для смещения равновесия, или для общего повышения скоростей реакций. Средства, способствующие протеканию реакций, такие как кислоты, основания или катализаторы,можно добавить в подходящих количествах, как это известно в данной области техники, необходимых для протекания реакции и в соответствии с общеизвестными методиками. Защитные группы Если в исходном веществе, описанном в настоящем изобретении, или в любом предшественнике одну или большее количество других функциональных групп, например карбоксигруппу, гидроксигруппу, аминогруппу сульфгидрил и т.п., необходимо снабдить защитной группой, поскольку они не должны принимать участие в реакции или влиять на реакцию, то ими являются защитные группы, которые обычно используются при синтезе пептидных соединений, а также цефалоспоринов и пенициллинов, а также производных нуклеиновых кислот и сахаров. Защитные группы являются такими группами, которые после удаления не должны содержаться в конечных соединениях, а группы, которые остаются в качестве заместителей, в использованном в настоящем описании смысле не являются защитными группами, которые вводят в исходное вещество или на промежуточной стадии и удаляют для получения конечного соединения. Также и в случае превращений соединения формулы (IA) в другое соединение формулы (IA) защитные группы можно вводить и удалять, если это целесообразно или необходимо. Защитные группы могут уже содержаться в предшественниках и должны защищать соответствующие функциональные группы от вступления в нежелательные вторичные реакции, такие как ацилирование, образование простого эфира, образование сложного эфира, окисление, сольволиз и аналогичные реакции. Особенностью защитных групп является то, что их можно легко, т.е. без нежелательных вторичных реакций, удалять, обычно с помощью ацетолиза, протолиза, сольволиза, восстановления, фотолиза, а также при воздействии ферментов, например, при условиях, аналогичных физиологическим условиям, и они не содержатся в конечных продуктах. Специалисту в данной области техники известно или он без труда может установить, какие защитные группы являются подходящими для проведения реакций, указанных выше и ниже в настоящем изобретении. Защита таких функциональных групп с помощью таких защитных групп, сами защитные группы и реакции их удаления описаны, например, в стандартных справочниках, таких как J.F.W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York 1973, in T. W. Greene, "Protectivelag, Stuttgart 1974. Необязательные реакции и превращения Соединение формулы (IA) можно превратить в другое соединение формулы (IA). Соединение формулы (IA), в которой R3 обозначает фтор, можно получить путем превращения соответствующего хлорпроизводного в соединение, содержащее фтор. Такие реакции известны и называются реакциями замещения. Это превращение может протекать на стадии, включающей исходное вещество формулы (IIIA или В), или путем превращения соответствующего соединения формулы (IA). В соединении формулы (IA), в которой заместитель содержит аминогруппу или амино-С 1-С 7-алкил в качестве заместителя, аминогруппу можно превратить в ациламиногруппу, например С 1-С 7 алканоиламиногруппу или С 1-С 7-алкансульфониламиногруппу, по реакции с соответствующим С 1-С 7 алканоилгалогенидом или С 1-С 7-алкансульфонилгалогенидом, например соответствующим хлоридом, в присутствии третичного азотистого основания, такого как триэтиламин или пиридин, при отсутствии или в присутствии подходящего растворителя, такого как метиленхлорид, например, при температурах в диапазоне от -20 до 50 С, например примерно при комнатной температуре. В соединении формулы (IA), в которой заместитель содержит цианогруппу в качестве заместителя,цианогруппу можно превратить в аминометильную группу, например, путем гидрирования в присутствии подходящего катализатора на основе метала, такого как никель Ренея или кобальт Ренея, в подходящем растворителе, например низш. алканоле, таком как метанол и/или этанол, например, при температурах в диапазоне от -20 до 50 С, например примерно при комнатной температуре. Соли соединения формулы (IA) с солеобразующей группой можно получить по известным методикам. Так, соли присоединения соединений формулы (IA) с кислотами можно получить обработкой кислотой или подходящим анионообменным реагентом. Соль с двумя молекулами кислоты (например, дигалогенид соединения формулы IA) также можно превратить в соль с одной молекулой кислоты на молекулу соединения (например, моногалогенид); это можно выполнить путем нагревания до плавления или например, путем нагревания в виде твердого вещества в высоком вакууме при повышенной температуре,например, равной от 130 до 170 С, в результате чего из одной молекулы соединения формулы (IA) удаляется одна молекула кислоты. Соли обычно можно превратить в свободные соединения, например, путем обработки подходящими основными соединениями, например, карбонатами щелочных металлов,гидрокарбонатами щелочных металлов или гидроксидами щелочных металлов, обычно карбонатом калия или гидроксидом натрия. Смеси стереоизомеров, например смеси диастереоизомеров, можно разделить на соответствующие изомеры по известным методикам, с помощью подходящих методик разделения. Например, смеси диастереоизомеров можно разделить на индивидуальные диастереоизомеры с помощью фракционированной кристаллизации, хроматографии, распределения в растворителях и аналогичных методик. Это разделение можно проводить или для исходного соединения или для самого соединения формулы (IA). Энантиомеры можно разделить путем образования диастереоизомерных солей, например, путем образования соли с энантиомерно чистой хиральной кислотой или с помощью хроматографии, например ВЭЖХ (высокоэффективная жидкостная хроматография), с использованием хроматографических субстратов, содержащих хиральные лиганды. Следует подчеркнуть, что реакции, аналогичные реакциям превращения, указанным в этом разделе,также можно проводить с подходящими промежуточными продуктами (и таким образом, они применимы для получения соответствующих исходных веществ). Исходные вещества Исходные вещества формул II и III, а также другие исходные вещества, указанные в настоящем изобретении, например, ниже, можно получить по методикам, которые известны в данной области техники, или по аналогичным методикам, или они имеются в продаже. Если получение исходных веществ специально не описано, то соединения являются известными или их можно получить по методикам, аналогичным известным в данной области техники, например, описанным в WO 05/021519 или WO 04/096797 или раскрытым ниже в настоящем изобретении. Новые исходные вещества, а также способы их получения также являются вариантами осуществления настоящего изобретения. В предпочтительных вариантах осуществления используют такие исходные вещества и реакцию выбирают так, чтобы можно было получить предпочтительные соединения. В исходных веществах (включая промежуточные продукты), которые также можно использовать и/или получать в виде солей, если это является подходящим и целесообразным, заместители предпочтительно являются такими, как определено для соединения формулы (IA). В соединениях формулы (IIIA) или их солях заместители являются такими, как определено для соединения формулы (IA). Соединения формулы (IIIA) можно получить с помощью известных способов, которые приводят к сочетанию двух компонентов арил/гетероарил (такие как реакции типа реакции Хека) с образованием соответствующего производного мочевины, являются подходящими и могут быть использованы с применением соответствующего исходного вещества. Таким образом, получение соединений формулы (IIIA) включает (стадия 1) реакцию соединения формулы (IV) в которой значения R3 являются такими, как определено выше, и PG обозначает защитную группу, такую как ацильная группа, с соединением формулы (V) в которой значения R1 являются такими, как определено выше, цикл А обозначает пиридин и Hal обозначает галоген, такой как бром, по реакции Хека; необязательно в присутствии разбавителя и необязательно в присутствии средства, способствующего протеканию реакции; (стадия 2) с последующим удалением защитной группы, например, в кислой среде; необязательно в присутствии разбавителя и необязательно в присутствии средства, способствующего протеканию реакции; и извлечение полученного соединения формулы (IIIA) в свободной форме или в форме соли и, необязательно, превращение полученного соединения формулы (IIIA) в другое соединение формулы (IIIA), и/или превращение полученной соли соединения формулы (IIIA) в другую его соль, и/или превращение полученного свободного соединения формулы (IIIA) в его соль, и/или отделение полученного изомера соединения формулы (IIIA) от одного или большего количества различных полученных изомеров формулы (IIIA). В соединениях формулы (IIIB) или их солях заместители R1 и R3 являются такими, как определено для соединения формулы (IA), цикл А означает пиридин, a RG обозначает реакционноспособную группу, предпочтительно имидазолилкарбонил, которая может реагировать непосредственно или путем образования промежуточного изоцианата формулы(IIIE). Соединения формулы (IIIB) можно получить известными способами, которые обеспечивают превращение амина или его соли в соответствующее активированное производное, являются подходящими и могут быть использованы с применением соответствующего исходного вещества. Таким образом, получение соединений формулы (IIIB) включает реакцию соединения формулы (IIIA) в которой заместители являются такими, как определено выше, с активирующим реагентом, таким как-8 018863 1,1'-карбонилдиимидазол, необязательно, в присутствии разбавителя и, необязательно, в присутствии средства, способствующего протеканию реакции; и извлечение полученного соединения формулы (IIIB) в свободной форме или в форме соли, и, необязательно, превращение полученного соединения формулы(IIIB) в другое соединение формулы (IIIB), и/или превращение полученной соли соединения формулы(IIIB) в другую его соль, и/или превращение полученного свободного соединения формулы (IIIB) в его соль, и/или отделение полученного изомера соединения формулы (IIIB) от одного или большего количества различных полученных изомеров формулы (IIIB). Соединения формулы (IA) применимы в качестве лекарственных средств. Поэтому в одном варианте осуществления настоящее изобретение относится к композициям, предназначенным для применения в медицине или ветеринарии, когда показано ингибирование PI3K. В одном варианте осуществления настоящее изобретение относится к лечению клеточных пролиферативных заболеваний, таких как опухоли и/или рост раковых клеток, опосредуемых с помощью PI3K. Заболевания могут включать такие, при которых наблюдаются сверхэкспрессирование или амплификация PI3K-, соматические мутации PIK3CA или мутации зародышевого типа или соматические мутацииPTEN или мутации и транслокации р 85, которые обеспечивают повышающую регуляцию комплексаp85-p110. В частности, эти соединения применимы для лечения раковых заболеваний человека или животного (например, мыши), включая, например, саркому, раковые заболевания легких, бронхов, предстательной железы, молочной железы (включая спорадические раковые заболевания молочной железы и страдающих болезнью Коудена), поджелудочной железы, желудочно-кишечный рак, толстой кишки,прямой кишки, карциному толстой кишки, колоректальную аденому, щитовидной железы, печени, внутрипеченочных желчных протоков, гепатоцеллюлярные, надпочечников, желудка, глиому, глиобластому,эндометрия, меланому, почек, почечных лоханок, мочевого пузыря, тела матки, шейки матки, влагалища,яичников, множественную миелому, пищевода, лейкоз, острый миелолейкоз, хронический миелолейкоз,лимфолейкоз, миелолейкоз, головного мозга, карциному головного мозга, полости рта и глотки, гортани,тонкого кишечника, неходжкинскую лимфому, меланому, ворсинчатую аденому толстой кишки, неоплазию, неоплазию эпителиального характера, лимфомы, карциному молочной железы, базально-клеточную карциному, плоскоклеточную карциному, старческий кератоз, опухолевые заболевания, включая солидные опухоли, опухоли головы и шеи, истинную полицитемию, эссенциальную тромбоцитемию, миелофиброз с миелоидной метаплазией и болезнь Вальденстрема. В других вариантах осуществления патологическое состояние или нарушение (например, опосредуемое с помощью PI3K) выбрано из группы, включающей истинную полицитемию, эссенциальную тромбоцитемию, миелофиброз с миелоидной метаплазией, астму, ХОЗЛ (хроническое обструктивное заболевание легких), ОРДС (острый респираторный дистресс синдром), синдром Леффлера, эозинофильную пневмонию, заражение паразитами (в частности, многоклеточными) (включая тропическую эозинофилию), бронхолегочный аспергиллез, нодозный полиартериит (включая синдром Черджа-Строса), эозинофильную гранулему, связанные с эозинофилами нарушения, влияющие на дыхательные пути, вызванные реакцией на лекарственное средство, псориаз, контактный дерматит, атопический дерматит, гнездную алопецию, многоформную эритему, герпетриформный дерматит, склеродерму, витилиго, аллергический васкулит, уртикарию, буллезный пемфигоид, красную волчанку, пузырчатку, врожденный буллезный эпидермолиз, аутоиммунные заболевания крови (например, гемолитическую анемию, апластическую анемию, истинную эритроцитарную анемию и идиопатическую тромбоцитопению), системную красную волчанку, полихондрию, склеродерму, гранулематоз Вегенера, дерматомиозит, хронический активный гепатит, злокачественную миастению, синдром Стивенса-Джонсона, идиопатическое спру,аутоиммунное воспалительное заболевание кишечника (например, язвенный колит и болезнь Крона),эндокринную офтальмопатию, диффузный токсический зоб, саркоидоз, альвеолит, хронический гиперчувствительный пневмонит, рассеянный склероз, первичный биллиарный цирроз, увеит (передний и задний), интерстициальный фиброз легких, псориатический артрит, гломерулонефрит, сердечно-сосудистые заболевания, атеросклероз, гипертензию, тромбоз глубоких вен, удар, инфаркт миокарда, нестабильную стенокардию, тромбоэмболию, эмболию легких, тромболитические заболевания, острую артериальную ишемию, тромботические окклюзии периферийных сосудов и ишемическую болезнь сердца, реперфузионные поражения, ретинопатию, такую как диабетическая ретинопатия или вызванная кислородом гипербарическая ретинопатия, и патологические состояния, характеризующиеся повышенным внутриглазным давлением или секрецией внутриглазной жидкости, такие как глаукома. Для указанных выше случаев применения необходимая доза, разумеется, будет меняться в зависимости от пути введения, конкретного патологического состояния, подвергающегося лечению, и необходимого эффекта. Обычно указывают, что удовлетворительные результаты систематически обеспечиваются при суточных дозах, равных от примерно 0,03 до примерно 100,0 мг/(кг массы тела), например от примерно 0,03 до примерно 10,0 мг/(кг массы тела). Показанная суточная доза для более крупного млекопитающего, например человека, находится в диапазоне от примерно 0,5 мг до примерно 3 г, например от примерно 5 мг до примерно 1,5 г, и ее обычно вводят, например, в виде разделенных доз до 4 раз в сутки или в форме пролонгированного действия. Разовые дозированные формы, подходящие для перо-9 018863 рального введения, содержат от примерно 0,1 до примерно 500 мг, например от примерно 1,0 до примерно 500 мг активного ингредиента. Соединения формулы (IA) можно вводить любым подходящим путем, в частности энтерально, например перорально, например в виде таблеток или капсул, или парентерально, например в виде растворов или суспензий для инъекций, местно, например в виде лосьонов, гелей, мазей или кремов, путем ингаляции, назально или в форме суппозитория. Соединения формулы (IA) можно вводить в свободной форме или в форме фармацевтически приемлемой соли, например, как указано выше. Такие соли можно получить обычным образом и они обладают активностью такого же порядка, как свободные соединения. Таким образом, соединения формулы (IA) можно использовать для предупреждения или лечения патологических состояний, нарушений или заболеваний, опосредуемых активацией фермента PI3K (например, киназы PI3-), например, таких как указано выше, у субъекта, нуждающегося в таком лечении, включающего введение указанному субъекту соединения формулы(IA) или его фармацевтически приемлемой соли в эффективном количестве; применения соединения формулы (IA) в свободной форме или в форме фармацевтически приемлемой соли в качестве лекарственного средства, например, в любом из способов, указанных в настоящем изобретении; применения соединения формулы (IA) в свободной форме или в форме фармацевтически приемлемой соли в любом из способов, указанных в настоящем изобретении, в частности, для лечения одного или большего количества заболеваний, опосредуемых фосфатидилинозит-3-киназой; применения соединения формулы (IA) в свободной форме или в форме фармацевтически приемлемой соли в любом из способов, указанных в настоящем изобретении, в частности, для приготовления лекарственного средства, предназначенного для лечения одного или большего количества заболеваний,опосредуемых фосфатидилинозит-3-киназой.PI3K выступают в качестве узла вторых мессенджеров, который объединяет параллельные пути передачи сигналов, и появляется все больше данных о том, что комбинация ингибитора PI3K с ингибиторами других путей будет применима для лечения рака и пролиферативных заболеваний у людей. Примерно у 20-30% людей, страдающих раком молочной железы, сверхэкспрессируется Her-2/neuErbB2, мишень для лекарственного препарата трастузумаб. Хотя показано, что трастузумаб приводит к длительным ответам у некоторых пациентов, у которых экспрессируется Her2/neu-ErbB2, ответ наблюдается только у части этих пациентов. Последние исследования показали, что такой ограниченный ответ можно существенно улучшить с помощью комбинации трастузумаба с ингибиторами пути PI3K или(2000), Nagata et al., Cancer Cell 6:117 (2004. При различных злокачественных заболеваниях людей происходят активирующие мутации или наблюдается повышенное содержание Her1/EGFR и для воздействия на эту рецепторную тирозинкиназу разработан целый ряд антител и небольших молекул-ингибиторов, в том числе тарцева, гефитиниб и эрбитукс. Однако, хотя ингибиторы EGFR проявляют противоопухолевую активность по отношению к некоторым опухолям человека (например, NSCLC), они не увеличивают общую выживаемость для всех пациентов, у которых имеются опухоли, экспрессирующие EGFR. Это можно объяснить тем, что для многих мишеней Herl/EGFR, расположенных ниже в пути передачи сигнала, включая путь PI3K/Akt, с высокой частотой происходят мутации или нарушения регуляции при различных злокачественных проявлениях. Например, по данным исследований in vitro гефитиниб подавляет рост линии клеток аденокарциномы. Однако можно выбрать субклоны этих линий клеток, которые резистентны к воздействию гефитиниба и у которых наблюдается усиленная активация пути PI3/Akt. Понижающая регуляция или ингибирование этого пути делает резистентные субклоны чувствительными к гефитинибу (Kokubo et al.,Brit. J. Cancer 92:1711 (2005. Кроме того, в модели рака молочной железы in vitro с использованием линии клеток, у которых скрыта мутация PTEN и происходит сверэкспрессирование EGFR, ингибирование и пути PI3K/Akt, и EGFR приводит к синергетическому эффекту (She et al., Cancer Cell 8:287-297(2005. Эти результаты показывают, что комбинация гефитиниба и ингибиторов пути PI3K/Akt, вероятно, будет привлекательной методологией для лечения рака. В модели ксенотрансплантата глиобластомы комбинация АЕЕ 778 (ингибитор Her-2/neu/ErbB2,VEGFR и EGFR) и RAD001 (ингибитор mTOR, расположенный в прямом направлении в пути передачи сигнала мишени Akt) приводит к большей суммарной эффективности, чем при использовании этих средств по отдельности (Goudar et al., Mol. Cancer. Ther. 4:101-112 (2005. Антиэстрогены, такие как тамоксифен, подавляют рост рака молочной железы, вызывая остановку клеточного цикла, для которой необходимо воздействие ингибитора p27Kip клеточного цикла. Недавно показано, что активация пути киназы Ras-Raf-MAP меняет состояние фосфорилирования p27Kip, так что ослабляется его ингибирующее воздействие при остановке клеточного цикла, что способствует резистентности к антиэстрогенам (Donovan, et al., J. Biol. Chem. 276:40888, 2001). Как показано в публикацииDonovan et al., ингибирование сигнального пути MAPK путем лечения ингибитором MEK обращает аномальное состояние фосфорилирования р 27 в случае резистентных к гормону линий клеток рака молоч- 10018863 ной железы и тем самым восстанавливает чувствительность к гормону. Аналогичным образом, фосфорилирование p27Kip посредством Akt также устраняет его воздействие при остановке клеточного цикла(Viglietto et al., Nat. Med. 8:1145 (2002. В соответствии с этим соединения формулы (IA) применяются для лечения зависящих от гормонов типов рака, таких как рак молочной и предстательной железы. Их применение направлено на обращение резистентности к гормонам, обычно наблюдающейся для этих типов рака при использовании обычных противораковых средств. При раковых заболеваниях крови, таких как хронический миелолейкоз (ХМЛ), транслокация хромосом ответственна за конститутивно активированную BCR-Abl тирозинкиназу. Страдающие этими заболеваниями пациенты реагируют на иматиниб, небольшую молекулу - ингибитор тирозинкиназы,вследствие ингибирования активности киназы Abl. Однако на прогрессирующей стадии заболевания многие пациенты сначала реагируют на иматиниб, но затем происходит рецидив вследствие приводящих к резистентности мутаций в домене киназы Abl. Исследования in vitro показали, что для оказания воздействия BCR-Abl использует путь киназы Ras-Raf. Кроме того, ингибирование на том же пути более одной киназы приводит к дополнительной защите от мутаций, приводящих к резистентности. В соответствии с этим соединения формулы (IA) могут быть использованы в комбинации по меньшей мере с одним дополнительным средством, выбранным из группы ингибиторов киназы, таким как глеевек, для лечения раковых заболеваний крови, таких как хронический миелолейкоз (ХМЛ). Их применение направлено на обращение или предупреждение резистентности по отношению к указанному по меньшей мере одному дополнительному средству. Поскольку активация пути PI3K/Akt способствует выживанию клеток, ингибирование этого пути в сочетании со средствами, которые способствуют апоптозу раковых клеток, включая лучевую терапию и химиотерапию, приведет к улучшенному ответу (Ghobrial et al., CA Cancer J. Clin 55:178-194 (2005. Примером является комбинация ингибитора киназы PI3 с карбоплатином, которая обнаруживает синергетический эффект при исследованиях пролиферации и апоптоза in vitro, а также при исследованиях эффективности воздействия на опухоль in vivo с использованием модели ксенотрансплантата рака яичников (Westfall и Skinner, Mol. Cancer Ther 4:1764-1771 (2005. Появляется все больше данных о том, что ингибиторы Р 13-киназ классов 1 А и 1 В могут иметь терапевтическую ценность не только при раке и пролиферативных заболеваниях, но и при других типах заболеваний. Установлено, что ингибирование р 110, изоформы PI3K, являющейся продуктом генаPIK3CB, может участвовать в индуцируемой сдвигом активации тромбоцитов (Jackson et al., NatureMedicine 11:507-514 (2005. Таким образом, ингибитор PI3K, который ингибирует p110, можно применять в качестве единственного средства или в сочетании с антитромботической терапией. Изоформаp110, которая является продуктом гена PIK3CD, является важной для В-клеточной функции и дифференциации (Clayton et al., J. Exp. Med. 196:753-763 (2002, а также для зависящих и независящих от Тклеток иммунных ответов (Jou et al., Mol. Cell. Biol. 22:8580-8590 (2002 и дифференциации мастоцитов(Ali et al., Nature 431:1007-1011 (2004. Таким образом, следует ожидать, что ингибиторы pi 105 могут быть применимыми для лечения связанных с В-клетками аутоиммунных заболеваний и астмы. Наконец,ингибирование р 110, изоформы, являющейся продуктом гена PI3KCG, приводит к пониженному Тклеточному, но не В-клеточному ответу (Reif et al., J. Immunol. 173:2236-2240 (2004 и эффективность ингибирования этой изоформы продемонстрирована на моделях аутоиммунных заболеваний на животных (Camps et al., Nature Medicine 11:936-943 (2005), Barber et al., Nature Medicine 11:933-935 (2005. Настоящее изобретение также относится к фармацевтическим композициям, включающим по меньшей мере одно соединение формулы (IA) совместно с фармацевтически приемлемым инертным наполнителем,пригодным для введения человеку или животному по отдельности или вместе с другими противораковыми средствами. Соединения формулы (IA) могут быть также использованы для лечения людей или животных, страдающих от клеточного пролиферативного заболевания, такого как рак. Таким образом, соединения формулы (IA) могут быть использованы для лечения человека или животного, нуждающегося в таком лечении, которое включает введение субъекту соединения формулы (IA) по отдельности или в комбинации с другими противораковыми средствами в терапевтически эффективном количестве. В частности, композиции можно приготовить совместно в виде комбинированного лекарственного средства или вводить по отдельности. Противораковые средства, подходящие для применения совместно с соединением формулы(IA), включают, но не ограничиваются только ими, одно или большее количество соединений, выбранных из группы, включающей ингибиторы киназы, антиэстрогены, антиандрогены, другие ингибиторы,химиотерапевтические противораковые лекарственные средства, алкилирующие средства, хелатные средства, модификаторы биологического ответа, противораковые вакцины, средства антисмысловой терапии, приведенные ниже. А. Ингибиторы киназы. Ингибиторы киназы, предназначенные для применения в качестве противораковых средств совместно с соединением формулы (I), включают ингибиторы киназ рецептора эпидермального фактора роста(EGFR), такие как небольшие молекулы хиналозинов, например гефитиниб (US 5457105, US 5616582 и(US 6727256 и WO 02/02552), ингибиторы киназ рецептора сосудистого эндотелиального фактора роста(VEGFR), включая SU-11248 (WO 01/60814), SU 5416 (US 5883113 и WO 99/61422), SU 6668 (US 5883113 и WO 99/61422), CHIR-258 (US 6605617 и US 6774237), ваталаниб или PTK-787 (US 6258812),VEGF-Trap (WO 02/57423), В 43-генистеин (WO-09606116), фенретинид (п-гидроксифениламиноретиноевая кислота) (US 4323581), IM-862 (WO 02/62826), бевацизумаб или авастин (WO 94/10202),KRN-951, 3-[5-(метилсульфонилпиперидинметил)индолил]хинолон, AG-13736 и AG-13925, пирроло[2,1f][1,2,4]триазины, ZK-304709, веглин, VMDA-3601, EG-004, CEP-701 (US 5621100), Cand5 (WO 04/09769), ингибиторы тирозинкиназы Erb2, такие как пертузумаб (WO 01/00245), трастузумаб и ритуксимаб, ингибиторы Akt протеинкиназы, такие как RX-0201, ингибиторы протеинкиназы С (PKC), такие как LY-317615 (WO 95/17182) и перифосин (US 2003171303), ингибиторы киназы Raf/Map/MEK/Ras,включая сорафениб (BAY 43-9006), ARQ-350RP, LErafAON, BMS-354825 AMG-548 и другие, раскрытые в WO 03/82272, ингибиторы киназы рецептора фактора роста фибробластов (FGFR), ингибиторы клеточно-зависимой киназы (CDK), включая CYC-202 и росковитин (WO 97/20842 и WO 99/02162), ингибиторы киназ рецептора тромбоцитарного фактора роста (PDGFR), такие как CHIR-258, 3G3 mAb, AG-13736,SU-11248 и SU-6668, и ингибиторы киназы Bcr-Abl и белков слияния, такие как STI-571 или глеевекB. Антиэстрогены. Воздействующие на эстрогены средства, предназначенные для применения в противораковой терапии совместно с соединением формулы (I), включают селективные модуляторы эстрогенного рецептора(SERMs), включая тамоксифен, торемифен, ралоксифен, ингибиторы ароматазы, включая аримидекс или анастрозол, негативные регуляторы эстрогенного рецептора (ERDs), включая фаслодекс или фульвестрант.C. Антиандрогены. Воздействующие на андрогены средства, предназначенные для применения в противораковой терапии совместно с соединением формулы (I), включают флутамид, бикалутамид, финастерид, аминоглютетамид, кетоконазол и кортикостероиды.D. Другие ингибиторы. Другие ингибиторы, предназначенные для применения в качестве противораковых средств совместно с соединением формулы (I), включают ингибиторы протеинфарнезилтрансферазы, включая типифарниб или R-115777 (US 2003134846 и WO 97/21701), BMS-214662, AZD-3409 и FTI-277, ингибиторы топоизомеразы, включая мербарон и дифломотекан (BN-80915), ингибиторы митотических кинезиновых белков веретена (KSP), включая SB-743921 и MKI-833, модуляторы протеосомы, такие как бортезомиб или велкаде (US 5780454), XL-784, и ингибиторы циклооксигеназы 2 (СОХ-2), включая нестероидные противовоспалительные лекарственные средства I (NSAIDs).E. Химиотерапевтические противораковые лекарственные средства. Конкретные противораковые химиотерапевтические средства, предназначенные для применения в качестве противораковых средств совместно с соединением формулы (I), включают анастрозол (аримидекс), бикалутамид (казодекс), блеомицинсульфат (бленоксан), бусульфан (милеран), бусульфан для инъекций (бусульфекс), капецитабин (кселода), N4-пентоксикабонил-5-дезокси-5-фторцитидин,карбоплатин (параплатин), кармустин (BiCNU), хлорамбуцил (лейкеран), цисплатин (платинол),кладрибин (лейстатин), циклофосфамид (цитоксан или неосар), цитарабин, цитозинарабинозид (цитосар-U), липосомный цитарабин для инъекций (DepoCyt), дакарбазин (DTIC-Dome), дактиномицин (актиномицин D, космеган), даунорубицингидрохлорид (церубидин), липосомный даунорубицинцитрат для инъекций (DaunoXome), дексаметазон, доцетаксел (таксотер, US 2004073044), доксорубицингидрохлорид (адриамицин, рубекс), этопозид (вепезид), флударабинфосфат (флудара), 5 фторурацил (адруцил, эфудекс), флутамид (эйлексин), тезацитибин, гемцитабин (дифтордезоксицитидин), гидроксимочевина (гидреа), идарубицин (идамицин), ифосфамид (IFEX), иринотекан (камптосар), L-аспарагиназа (ЭЛСПАР), лейковорин-кальций, мелфалан (алкеран), 6-меркаптопуринF. Алкилирующие средства. Алкилирующие средства, предназначенные для применения совместно с соединением формулы (I),включают VNP-40101M или клоретизин, оксалиплатин (US 4169846, WO 03/24978 и WO 03/04505), глюфосфамид, мафосфамид, этопофос (US 5041424), преднимустин, треосульфан, бусульфан, ирофлувен(ацилфульвен), пенкломедин, пиразолоакридин (PD-115934), О 6-бензилгуанин, децитабин (5-аза-2- 12018863 дезоксицитидин), бросталлицин, митомицин С (MitoExtra), TLK-286 (телцита), темозоломид, трабектедин (US 5478932), АР-5280 (композиция цисплатина на основе платината), порфиромицин и клеаразидG. Хелатные средства. Хелатные средства, предназначенные для применения совместно с соединением формулы (I), включают тетратиомолибдат (WO 01/60814), RP-697, химерик Т 84.66 (сТ 84.66), гадофосвесет (вазовист),дефероксамин и блеомицин, необязательно, в сочетании с электропорацией (ЕРТ). Н. Модификаторы биологического ответа. Модификаторы биологического ответа, такие как иммунномодуляторы, предназначенные для применения совместно с соединением формулы (I), включают стауроспорин и его макроциклические аналоги, включая UCN-01, СЕР-701 и мидостаурин (см. WO 02/30941, WO 97/07081, WO 89/07105, US 5621100, WO 93/07153, WO 01/04125, WO 02/30941, WO 93/08809, WO 94/06799, WO 00/27422, WO 96/13506 и WO 88/07045), скваламин (WO 01/79255), DA-9601 (WO 98/04541 и US 6025387), алемтузумаб, интерфероны (например, IFN-, IFN- и т.п.), интерлейкины, предпочтительно IL-2 или алдеслейкин, а также IL-1, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12 и их активные биологические варианты, содержащие аминокислотные последовательности, составляющие более 70% от нативной последовательности человека, алтретамин (гексален), SU 101 или лефлуномид (WO 04/06834 и US 6331555), имидазохинолины, такие как ресихимод и имихимод (US 4689338, 5389640, 5268376, 4929624,5266575, 5352784, 5494916, 5482936, 5346905, 5395937, 5238944 и 5525612), и SMIPs (небольшие молекулы, модулирующие иммунофармацевтические средства), включая бензазолы, антрахиноны, тиосемикарбазоны и триптантрины (WO 04/87153, WO 04/64759 и WO 04/60308).I. Противораковые вакцины. Противораковые вакцины, предназначенные для применения совместно с соединением формулы (I),включают авицин (Tetrahedron Lett. 26:2269-70 (1974, ореговомаб (OvaRex ), тератоп (STn-KLH),вакцины против мелатомы, серия GI-4000 (GI-4014, GI-4015 и GI-4016), нацеленные на 5 мутаций белкаRas, GlioVax-1, MelaVax, адвексин или INGN-201 (WO 95/12660), Sig/E7/LAMP-1, кодирующий HPV16 E7, вакцину MAGE-3 или M3TK (WO 94/05304), HER-2VAX, ACTIVE, который стимулирует Тклетки, специфические для опухолей, противораковую вакцину GM-CSF и вакцины на основе моноцитогенов Listeria.J. Средства антисмысловой терапии. Противораковые средства, предназначенные для применения совместно с соединением формулы(I), также включают антисмысловые композиции, такие как AEG-35156 (GEM-640), АР-12009 и АР 11014 (TGP2-специфические антисмысловые олигонуклеотиды), AVI-4126, AVI-4557, AVI-4472, облимерсен (генасенсе), JFS2, апринокарсен (WO 97/29780), GTI-2040 (антисмысловой олигонуклеотид,воздействующий на R2 рибонуклеотидредуктазы мРНК) (WO 98/05769), GTI-2501 (WO 98/05769), капсулированные в липосомах антисмысловые олигодезоксинуклеотиды c-Raf (LErafAON) (WO 98/43095) иSirna-027 (основанные на иммунной РНК лекарственные средства, воздействующие на VEGFR-1 мРНК). Соединение формулы (IA) также можно объединить в фармацевтической композиции с бронхорасширяющими или антигистаминными лекарственными веществами. Такие бронхорасширяющие лекарственные средства включают антихолинергические или антимускариновые средства, в частности гликопирролат, ипратропийбромид, окситропийбромид и тиотропийбромид, OrM3, аклидиний, CHF5407,GSK233705 и агонисты -2-адренорецептора, такие как салбутамол, тербуталин, салметерол, кармотерол,милветерол и предпочтительно индакатерол и формотерол. Совместно применяющиеся терапевтические антигистаминные лекарственные вещества включают цетиризингидрохлорид, клемастин фумарат, прометазин, лоратадин, дезлоратадин, дифенгидрамин и фексофенадингидрохлорид. Соединения формулы (IA) могут быть также использованы в комбинации, включающей помимо соединения формулы (IA) одно или большее количество соединений, которые применимы для лечения тромболитического заболевания, заболевания сердца, удара и т.п. Такие соединения включают аспирин,стрептокиназу, активатор плазминогена ткани, урокиназу, антикоагулянт, лекарственные средства, препятствующие агрегации тромбоцитов (например, ПЛАВИКС; клопидогрелбисульфат), статин (например,ЛИПИТОР или кальциевая соль аторвастатина), ЗОКОР (симвастатин), КРЕСТОР (росувастатин и т.п.),-блокатор (например, атенолол), НОРВАСК (амлодипинбезилат) и ингибитор АХЭ (ацтилхолинэстеразы) (например, лизиноприл). Соединения формулы (IA) могут быть также использованы в комбинации, включающей помимо соединения формулы (IA) одно или большее количество соединений, которые применимы для лечения гипертензии. Такие соединения включают ингибиторы АХЭ, средства, снижающие содержание липидов,такие как статины, ЛИПИТОР (кальциевая соль аторвастатина), блокаторы кальциевых каналов, такие как НОРВАСК (амлодипинбезилат). Соединения формулы (IA) могут быть также использованы в комбинации, включающей помимо соединения формулы (IA) одно или большее количество соединений, выбранных из группы, включающей фибраты, -блокаторы, ингибиторы NEPI, антагонисты ангиотензинового рецептора 2 и средства, пре- 13018863 пятствующие агрегации тромбоцитов. Соединения формулы (IA) могут быть также использованы в комбинации, включающей помимо соединения формулы (IA) и соединение, применимое для лечения воспалительных заболеваний, включая ревматоидный артрит. Такое соединение можно выбрать из группы, включающей ингибиторы TNF-,такие как анти-TNF- моноклональные антитела (такие как РЕМИКАДЕ, CDP-870) и D2E7 (ГУМИРА) и молекулы иммуноглобулина слияния рецептора TNF (такие как ЭМБРЕЛ), ингибиторы IL-1, антагонисты рецептора растворимого IL-IR (например, КИНЕРЕТ или ингибиторы ICE), нестероидные противовоспалительные лекарственные средства (НСПВЛС), пироксикам, диклофенак, напроксен, флурбипрофен, фенопрофен, кетопрофен, ибупрофен, фенаматы, мефенаминовую кислоту, индометацин, сулиндак,апазон, пиразолоны, фенилбутазон, аспирин, ингибиторы СОХ-2 (такие как ЦЕЛЕБРЕКС (целекоксиб),ПРЕКСИГ (лумиракоксиб, ингибиторы металлопротеазы (предпочтительно селективные ингибиторы ММР-13), р 27 ингибиторы, 2-ингибиторы, НЕЙРОТИН, прегабалин, применяющийся в низкой дозе метотрексат, лефлуномид, гидроксихлорхин, d-пеницилламин, ауранофин или вводимые парентерально или перорально препараты золота. Соединения формулы (IA) могут быть также использованы в комбинации, включающей помимо соединения формулы (IA) и соединение, применимое для лечения остеоартрита. Такое соединение можно выбрать из группы, включающей стандартные нестероидные противовоспалительные лекарственные средства (далее НСПВЛС), такие как пироксикам, диклофенак, пропионовые кислоты, такие как напроксен, флурбипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, такие как мефенаминовая кислота, индометацин, сулиндак, апазон, пиразолоны, такие как фенилбутазон, салицилаты, такие как аспирин,ингибиторы СОХ-2, такие как целекоксиб, валдекоксиб, лумиракоксиб и эторикоксиб, анальгетики и внутрисуставные лекарственные средства, такие как кортикостероиды, и гиалуроновые кислоты, такие как гиалган и синвиск. Соединения формулы (IA) могут быть также использованы в комбинации, включающей помимо соединения формулы (IA) и противовирусное средство и/или антисептические соединение. Такое противовирусное средство можно выбрать из группы, включающей вирацепт, AZT, ацикловир и фамцикловир. Такое антисептическое соединение можно выбрать из группы, включающей валант. Соединения формулы (IA) могут быть также использованы в комбинации, включающей помимо соединения формулы (IA) и одно или большее количество средств, выбранных из группы, включающей средства, действующие на ЦНС (центральная нервная система), такие как антидепрессанты (сертралин),лекарственные средства для лечения болезни Паркинсона (такие как депренил, L-дофа, реквип, мирапекс, ингибиторы МАОВ, такие как селегин и расагилин, ингибиторы comP, такие как тасмар, ингибиторы А-2, ингибиторы повторного всасывания допамина, антагонисты NMDA, агонисты никотина, агонисты допамина и ингибиторы нейронной синтазы оксида азота). Соединения формулы (IA) могут быть также использованы в комбинации, включающей помимо соединения формулы (IA) и одно или большее количество лекарственных средств для лечения болезни Альцгеймера. Такое лекарственное средство для лечения болезни Альцгеймера можно выбрать из группы, включающей донепезил, такрин, 2-ингибиторы, НЕЙРОТИН, прегабалин, ингибиторы СОХ-2,пропентофиллин и метрифонат. Соединения формулы (IA) могут быть также использованы в комбинации, включающей помимо соединения формулы (IA) и средства для лечения остеопороза и/или иммунодепрессивное средство. Такие средства для лечения остеопороза можно выбрать из группы, включающей ЭВИСТА (ралоксифенгидрохлорид), дролоксифен, лазофоксифен и фосамакс. Такие иммунодепрессивные средства можно выбрать из группы, включающей FK-506 и рапамицин. Соединения формулы (IA) могут быть также использованы в виде набора, который включает одно или большее количество соединений формулы (IA) и необязательно другой компонент комбинации, раскрытый в настоящем изобретении. Типичные наборы включают ингибитор PI3K (например, соединение формулы IA) и листок-вкладыш или другую маркировку, содержащую указания для лечения клеточного пролиферативного заболевания путем введения ингибирующего PI3K количества соединения (соединений). Обычно соединения формулы (IA) вводят в терапевтически эффективном количестве по любому из общепринятых путей введения средств, которые предназначены для аналогичных целей. Использующееся количество соединения формулы (IA), т.е. активного ингредиента, будет зависеть от множества факторов, таких как тяжесть заболевания, подвергающегося лечению, возраст и относительное состояние здоровья субъекта, активность использующегося соединения, путь и форма введения и других факторов. Лекарственное средство можно вводить более одного раза в сутки, предпочтительно один или два раза в сутки. Все эти факторы находятся в пределах компетенции лечащего врача. Терапевтически эффективные количества соединений формулы (IA) могут находиться в диапазоне от примерно 0,05 до примерно 50 мг/(кг массы тела) реципиента в сутки; предпочтительно примерно 0,1-25 мг/кг/сутки, более предпочтительно примерно от 0,5 до 10 мг/кг/сутки. Так, для введения пациенту массой 70 кг наиболее предпочтительный диапазон доз составляет примерно 35-70 мг в сутки.- 14018863 Обычно соединения формулы (IA) вводят в виде фармацевтических композиций по любому из следующих путей: перорально, системно (например, чрескожно, назально или с помощью суппозитория) или парентерально (например, внутримышечно, внутривенно или подкожно). Предпочтительным путем введения является пероральный с использованием обычного суточного режима, который можно изменить в соответствии со степенью поражения. Композиции могут находиться в форме таблеток, пилюль,капсул, полужидких веществ, порошков, препаратов пролонгированного действия, растворов, суспензий,эликсиров, аэрозолей или любых других подходящих композиций. Другим предпочтительным путем введения соединений формулы (IA) является ингаляция. Она является эффективной методикой доставки терапевтического средства непосредственно в дыхательные пути. Выбор композиции зависит от различных факторов, таких как путь введения лекарственного средства и биологическая доступность лекарственного вещества. Для доставки путем ингаляции соединение можно приготовить в виде жидкого раствора, суспензий, аэрозольного препарата или сухого порошка и поместить в дозирующее устройство, подходящее для введения. Имеется несколько типов фармацевтических устройств для ингаляции - ингаляторы типа небулайзера, мерные дозирующие ингаляторы (МДИ) и ингаляторы для сухих порошков (ИСП). В устройствах типа небулайзера образуется поток воздуха высокой скорости, который распыляет терапевтическое средство (которое приготовлено в жидкой форме) в воздушную дисперсию, которая попадает в дыхательные пути пациента. МДИ обычно содержат композицию вместе со сжатым газом. После активации устройство выбрасывает отмеренное количество терапевтического средства с помощью сжатого газа и таким образом является надежным средством введения заданного количества средства. ИСП дозирует терапевтические средства в виде сыпучего порошка, который может диспергироваться во вдыхаемом пациентом потоке воздуха. Для получения сыпучего порошка терапевтическое средство готовят вместе с инертным наполнителем, таким как лактоза. Определенное количество терапевтического средства хранится в виде капсулы и подается при каждом срабатывании. Соединения формулы (IA) могут быть также использованы в виде композиций, в которых размер частиц соединения формулы (IA) находится в диапазоне 10-1000 нм, предпочтительно 10-400 нм. Такие фармацевтические композиции, разработанные специально для лекарственных средств, обладающих низкой биологической доступностью, основаны на том, что биологическую доступность можно улучшить путем увеличения площади поверхности, т.е. уменьшения размера частиц. Например, в U.S.4107288 описана фармацевтическая композиция, обладающая частицами с размером в диапазоне примерно от 10 до 1000 нм, в которой активное вещество нанесено на матрицу из сшитых макромолекул. В U.S.5145684 описано приготовление фармацевтической композиции, в которой лекарственное вещество распыляют в наночастицы (средний размер частиц составляет 400 нм) в присутствии модификатора поверхности и затем диспергируют в жидкой среде и получают фармацевтическую композицию, обладающую довольно высокой биологической доступностью. Оба документа включены в настоящее изобретение в качестве ссылки. Другим объектом настоящего изобретения являются фармацевтические композиции, содержащие(терапевтически эффективное количество) соединения формулы (IA) и по меньшей мере один фармацевтически приемлемый инертный наполнитель. Приемлемые инертные наполнители являются нетоксичными, способствуют введению и не оказывают неблагоприятного воздействия на терапевтические характеристики соединения формулы (IA). Такой инертный наполнитель может являться любым твердым,жидким, полужидким или, в случае аэрозольной композиции, газообразным инертным наполнителем,которые обычно имеются в распоряжении специалиста в данной области техники. Твердые фармацевтические инертные наполнители включают крахмал, целлюлозу, тальк, глюкозу,лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат магния, стеарат натрия, глицеринмоностеарат, хлорид натрия, сухое обезжиренное молоко и т.п. Жидкие и полужидкие инертные наполнители можно выбрать из группы, включающей глицерин,пропиленгликоль, воду, этанол и различные масла, включая полученные из нефти, животного, растительного или синтетического происхождения, например арахисовое масло, соевое масло, минеральное масло,кунжутное масло и т.п. Предпочтительные жидкие носители, в особенности предназначенные для растворов для инъекций, включают воду, физиологический раствор, водный раствор декстрозы и гликоли. Сжатые газы можно использовать для диспергирования соединения формулы I в аэрозольной форме. Инертными газами, подходящими для этой цели, являются азот, диоксид углерода и т.п. Другие подходящие фармацевтически приемлемые инертные наполнители и их композиции описаны в публикацииRemington's Pharmaceutical Sciences, edited by E.W. Martin (Mack Publishing Company, 18th ed., 1990). Количество соединения в композиции может меняться в широких пределах, использующихся специалистами в данной области техники. Обычно композиция содержит примерно 0,01-99,99 мас.% соединения формулы (IA) в пересчете на полную массу композиции, а остальное представляет собой один или большее количество подходящих фармацевтических инертных наполнителей. Предпочтительно, если соединение содержится в количестве, составляющем примерно 1-80 мас.%. Настоящее изобретение также относится к фармацевтической композиции, включающей (т.е. содержащей или заключающей в себе) по меньшей мере одно соединение формулы (I) и по меньшей мере один фармацевтически приемлемый инертный наполнитель.- 15018863 Фармацевтические композиции, включающие соединение формулы (IA) в свободной форме или в форме фармацевтически приемлемой соли вместе по меньшей мере с одним фармацевтически приемлемым инертным наполнителем (таким как носитель и/или разбавитель), можно приготовить обычным образом путем смешивания компонентов. Объединенные фармацевтические композиции, включающие соединение формулы (IA) в свободной форме или в форме фармацевтически приемлемой соли и дополнительно включающие компонент комбинации (в одной дозированной разовой форме или в виде набора компонентов) вместе по меньшей мере с одним фармацевтически приемлемым носителем и/или разбавителем, можно приготовить обычным образом путем смешивания указанных активных ингредиентов с фармацевтически приемлемым носителем и/или разбавителем. Таким образом, соединения формулы (IA) могут быть также использованы в виде объединенной фармацевтической композиции, например, для применения в любом из способов,описанных в настоящем изобретении, которая включает соединение формулы (IA) в свободной форме или в форме фармацевтически приемлемой соли вместе с фармацевтически приемлемым разбавителем и/или носителем; объединенной фармацевтической композиции, которая включает соединение формулы (IA) в свободной форме или в форме фармацевтически приемлемой соли в качестве активного ингредиента; один или большее количество фармацевтически приемлемых носителей и/или разбавителей и необязательно одно или большее количество дополнительных лекарственных веществ. Такая объединенная фармацевтическая композиция может находиться в виде одной разовой дозы или в виде набора компонентов; объединенной фармацевтической композиции, включающей соединение формулы (IA) в свободной форме или в форме фармацевтически приемлемой соли в терапевтически эффективном количестве и второе лекарственное вещество, предназначенное для одновременного или последовательного введения; фармацевтической комбинации, например набора, включающего (а) первое средство, которое представляет собой соединение формулы (IA), раскрытое в настоящем изобретении, в свободной форме или в форме фармацевтически приемлемой соли, и (b) по меньшей мере одно совместно вводимое средство,указанное выше, и такой набор может содержать инструкции по его введению. Соединения формулы (IA) могут быть также использованы для способа, определенного выше,включающего совместное введение, например одновременное или последовательное, соединения формулы (IA) или его фармацевтически приемлемой соли в терапевтически эффективном нетоксичном количестве и по меньшей мере второго лекарственного вещества, например указанного выше. Приведенные ниже примеры соединений формулы (I) иллюстрируют настоящее изобретение, не ограничивая его объем. Способы получения таких соединений описаны ниже в настоящем изобретении. Пример 1. 2-Амид,1-[5-(2-трет-бутилпиридин-4-ил)-4-метилтиазол-2-ил]амид (S)-пирролидин 1,2-дикарбоновой кислотыEt3N (1,54 мл, 11,1 ммоль, 3 экв.) добавляют к раствору [5-(2-трет-бутилпиридин-4-ил)-4 метилтиазол-2-ил]амида имидазол-1-карбоновой кислоты (стадия 1.1) (1,26 г, 3,7 ммоль) и Lпролинамида (0,548 г, 4,8 ммоль, 1,3 экв.) в ДМФ (25 мл) в атмосфере аргона. Реакционную смесь перемешивают в течение 14 ч при КТ, реакцию останавливают путем добавления насыщенного раствораNaHCO3 и экстрагируют с помощью EtOAc. Органическую фазу промывают насыщенным растворомNaHCO3, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (ДХМ/МеОН, 1:094:6), затем растирают с Et2O и получают 1,22 г искомого соединения в виде почти белого твердого вещества. ИЭР-МС: 388,1 [М+Н]+; tR = 2,35 мин (система 1); ТСХ: Rf = 0,36 (ДХМ/МеОН, 9:1). 1 Н ЯМР (400 МГц, ДМСО-d6)(ч./млн): 1,32 (s, 9 Н), 1,75-1,95 (m, 3 Н), 1,97-2,13 (m, 1 Н), 2,39 (s,3 Н), 3,38-3,50 (m, 1 Н), 3,52-3,65 (m., 1 Н), 4,10-4,40 (m, 1 Н), 6,94 (br. s., 1H), 7,22 (d, 1 Н), 7,30-7,48 (т, 2 Н),8,49 (d, 1 Н), 10,87 (br. s., 1H). Стадия 1.1. [5-(2-трет-Бутилпиридин-4-ил)-4-метилтиазол-2-ил]амид имидазол-1-карбоновой кислоты Смесь 5-(2-трет-бутилпиридин-4-ил)-4-метилтиазол-2-иламина (стадия 1.2) (1 г, 4,05 ммоль) и 1,1'карбонилдиимидазола (0,984 г, 6,07 ммоль, 1,5 экв.) в ДХМ (50 мл) перемешивают в течение 4 ч при кипячении с обратным холодильником и дают охладиться. Полученный осадок собирают фильтрованием и получают 1,26 г искомого соединения в виде белого твердого вещества. ИЭР-МС: 340,2 [М-Н]-; tR = 2,85 мин (система 1). Стадия 1.2. 5-(2-трет-Бутилпиридин-4-ил)-4-метилтиазол-2-иламин Смесь N-[5-(2-трет-бутилпиридин-4-ил)-4-метилтиазол-2-ил]ацетамида (стадия 1.3) (2 г, 7 ммоль),6 н. водного раствора HCl (10 мл) и EtOH (50 мл) перемешивают в течение 2 ч при 85 С, дают охладиться, реакцию останавливают путем добавления насыщенного раствора NaHCO3 и экстрагируют смесью ДХМ/МеОН (9:1, об./об.). Органическую фазу промывают насыщенным раствором NaHCO3, сушат(Na2SO4), фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (ДХМ/МеОН, 1:096:4) и получают 1,21 г искомого соединения в виде желтого твердого вещества. ИЭР-МС: 248,1 [М+Н]+; ТСХ: Rf = 0,36 (ДХМ/МеОН, 9:1). Стадия 1.3. N-[5-(2-трет-бутилпиридин-4-ил)-4-метилтиазол-2-ил]ацетамид Смесь 2-ацетамидо-4-метилтиазол (1,2 г, 7,7 ммоль, 1,1 экв.), карбонат цезия (4,55 г, 14 ммоль, 2 экв.), три-трет-бутилфосфинийтетрафторборат (0,406 г, 1,4 ммоль, 0,2 экв.), ацетат палладия(II) (0,15 г,0,7 ммоль, 0,1 экв.) и 4-бром-2-трет-бутилпиридин (стадия 1.4) (1,5 г, 7 ммоль) в ДМФ (50 мл) перемешивают в течение 1,5 ч при 90 С в атмосфере аргона, дают охладиться, реакцию останавливают путем добавления насыщенного раствора NaHCO3 и фильтруют через слой целита. Фильтрат экстрагируют с помощью EtOAc. Органическую фазу промывают насыщенным раствором NaHCO3, сушат (Na2SO4),фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле(ДХМ/МеОН, 1:097:3) и получают 2,02 г искомого соединения в виде желтого твердого вещества. ИЭР-МС: 290,1 [М+Н]+; ТСХ: Rf = 0,35 (ДХМ/МеОН, 9:1). Стадия 1.4. 4-Бром-2-трет-бутилпиридин Смесь 2-трет-бутил-1 Н-пиридин-4-она (стадия 1.5) (4,25 г, 28 ммоль) и POBr3 (8,88 г, 31 ммоль, 1,1 экв.) нагревают при 120 С, перемешивают в течение 15 мин, дают охладиться, реакцию останавливают путем добавления насыщенного раствора NaHCO3 и экстрагируют смесью ДХМ/МеОН (9:1, об./об.). Ор- 17018863 ганическую фазу промывают насыщенным раствором NaHCO3, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (Hex/EtOAc, 95:5) и получают 5,18 г искомого соединения в виде желтого масла. ИЭР-МС: 214,0/216,0 [М+Н]+; tR = 2,49 мин (система 1); ТСХ: Rf = 0,35 (Hex/EtOAc, 1:1). Стадия 1.5. 2-трет-Бутил-1 Н-пиридин-4-он Смесь 2-трет-бутилпиран-4-она (стадия 1.6) (5,74 г, 37,7 ммоль) и 30% водного раствора гидроксида аммония (100 мл) перемешивают в течение 1 ч при кипячении с обратным холодильником, дают охладиться и концентрируют. Остаток растирают с МеОН (200 мл) и фильтруют. Фильтрат концентрируют и остаток очищают с помощью колоночной хроматографии на силикагеле (ДХМ/МеОН/NH3aq, 94:5:192:7:1) и получают 4,46 г искомого соединения в виде желтого твердого вещества. ИЭР-МС: 152,0(5,65 мл, 74 ммоль, 2 экв.) в бензоле (250 мл) перемешивают в течение 14 ч при КТ и концентрируют. Очистка остатка с помощью колоночной хроматографии на силикагеле (Hex/EtOAc, 1:075:25) дает 5,74 г искомого соединения в виде желтого масла. ИЭР-МС: 153,1 [М+Н]; tR = 3,21 мин (система 1); ТСХ:LiHMDS (1M в ТГФ, 100 мл, 2 экв.) по каплям добавляют к холодному (-78 С) раствору 4-метокси 3-бутен-2-она (10 мл, 100 ммоль, 2 экв.) в ТГФ (400 мл). После 30 мин перемешивания при -78 С добавляют раствор пивалоилхлорид (6,12 мл, 50 ммоль) в ТГФ (100 мл). Полученной смеси дают нагреваться до КТ в течение 2 ч и реакцию останавливают путем добавления насыщенного раствора NH4Cl. ТГФ удаляют в вакууме. Концентрированную смесь экстрагируют с помощью Et2O. Органическую фазу промывают рассолом, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (Hex/EtOAc, 1:085:15) и получают 6,83 г искомого соединения в виде желтого масла. ИЭР-МС: 185,1 [М+Н]+; ТСХ: Rf = 0,87 (Hex/EtOAc, 1:1). Пример 2. 2-Амид,1-[5-(2-циклопропилпиридин-4-ил)-4-метилтиазол-2-ил]амид (S)-пирролидин 1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. На стадии 1.1 реакционную смесь перемешивают в течение 4 ч при кипячении с обратным холодильником. На стадии 1.2 реакционную смесь перемешивают в течение 2 ч при 85 С. На стадии 1.3 используют 4-хлор-2-(1-метилциклопропил)пиридин (стадия 2.1) и реакционную смесь перемешивают в течение 2 ч при 150 С. Искомое соединение: ИЭР-МС: 372,1 [М+Н]+; ТСХ: Rf = 0,35 (ДХМ/МеОН,9:1). Искомое соединение получают по модифицированной методике, описанной в литературе [Comins,D.L.; Mantlo, N.В., Journal of Organic Chemistry, (1985), 50, 4410-4411]. Циклопропилмагнийбромид (0,5 М в ТГФ, 100 мл, 50 ммоль, 2,2 экв.) одной порцией добавляют к холодной (-78 С) суспензии 4-хлорпиридингидрохлорида (3,4 г, 22 ммоль) в ТГФ (68 мл). После 10 мин перемешивания при -78 С по каплям добавляют фенилхлорформиат (2,76 мл, 22 ммоль). Реакционную смесь перемешивают при -78 С в течение 15 мин, дают нагреться до КТ, реакцию останавливают путем добавления 20% водного раствора NH4Cl и экстрагируют с помощью Et2O (2100 мл). Органическую фазу промывают насыщенным раствором NaHCO3 (50 мл), сушат (Na2SO4), фильтруют и концентрируют. К остатку, растворенному в толуоле (100 мл), добавляют раствор о-хлоранила (6 г, 24,2 ммоль, 1,1 экв.) в ледяной АсОН (50 мл). Реакционную смесь перемешивают в течение 14 ч при КТ, охлаждают до 0 С,подщелачивают путем добавления 10% водного раствора NaOH и фильтруют через слой целита. Органический слой фильтрата промывают с помощью Н 2 О (20 мл) и экстрагируют 10% водным раствором HCl(325 мл). Объединенные кислые слои подщелачивают путем добавления 20% водного раствора NaOH и экстрагируют с помощью ДХМ (325 мл). Органическую фазу промывают с помощью Н 2 О (50 мл), сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (ДХМ/МеОН, 1:099:1) и получают 0,951 г искомого соединения в виде бесцветного масла. ИЭР-МС: 154,1 [М+Н]+; tR = 1,41 мин (система 1); ТСХ: Rf = 0,85 (ДХМ/МеОН, 9:1). Пример 3. 2-Амид,1-(5-[2-(2-фторфенил)пиридин-4-ил]-4-метилтиазол-2-иламид) Искомое соединение получают по аналогии с методикой, описанной в примере 1, но с использованием 4-хлор-2-(2-фторфенил)пиридина (стадия 3.1) и перемешивания соответствующей смеси в течение 2 ч при 150 С на стадии 1.3. ИЭР-МС: 426,1 [М+Н]+; tR = 2,60 мин (система 1); ТСХ: Rf = 0,40 Смесь 2-фторфенилбороновой кислоты (141 мг, 1 ммоль, 1,2 экв.) с EtOH (1 мл) при 105 С в атмосфере аргона добавляют к смеси 4-хлор-2-йодпиридина [Choppin, S.; Gros, P.; Fort, Y., European Journal ofNa2CO3 (2 М раствор в Н 2 О, 1,68 мл, 3,36 ммоль, 4 экв.) в толуоле (2 мл). Реакционную смесь перемешивают при 105 С в течение 1 ч, дают охладиться до КТ, реакцию останавливают путем добавления насыщенного раствора NaHCO3 и экстрагируют с помощью EtOAc. Органическую фазу промывают насыщенным раствором NaHCO3, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (Hex/EtOAc, 1:097:3) и получают 127 мг искомого соединения в виде белого твердого вещества. ИЭР-МС: 208,1 [М+Н]+; tR = 4,66 мин (система 1); ТСХ: Rf = 0,27 (Hex/EtOAc, 9:1). Пример 4. 2-Амид,1-[5-(2-циклобутилпиридин-4-ил)-4-метилтиазол-2-ил]амид (S)-пирролидин 1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 4 ч при КТ, разбавляют с помощью EtOAc и Н 2 О и экстрагируют с помощью EtOAc. После сушки и концентрирования органической фазы остаток очищают путем растирания с ДХМ. На стадии 1.3 реакционную смесь перемешивают в течение 2 ч при 120 С, охлаждают, разбавляют с помощью EtOAc и Н 2 О, фильтруют через слой целита и экстрагируют с помощью EtOAc. После сушки и концентрирования органической фазы остаток очищают путем растирания с Et2O. На стадии 1.5 реакционную смесь перемешивают в течение 1 ч при 80 С и растирание с МеОН не проводят. На стадии 1.7 4-метокси-3-бутен-2-он в ТГФ добавляют к холодному(-78 С) раствору LiHMDS в ТГФ. Через 30 мин добавляют циклобутилкарбонилхлорид в ТГФ и реакционной смеси дают нагреваться до КТ в течение 18 ч. Искомое соединение: ИЭР-МС: 386,1 [М+Н]+; ТСХ: Rf = 0,11 (ДХМ/МеОН, 95:5). Пример 5. 2-Амид,1-(4-метил-5-[2-(1-метилциклопропил)пиридин-4-ил]тиазол-2-иламид) (S)пирролидин-1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. На стадии 1.1 реакционную смесь перемешивают в течение 14 ч при кипячении с обратным холодильником. На стадии 1.2 реакционную смесь перемешивают в течение 1 ч при 85 С. На стадии 1.3 реакционную смесь перемешивают в течение 3 ч при 120 С. На стадии 1.5 реакционную смесь перемешивают в течение 1 ч при 65-70 С и растирание с МеОН не проводят. На стадии 1.7 используют 1-метилциклопропанкарбонилхлорид (стадия 5.1). Искомое соединение: ИЭР-МС: 386,1 [М+Н]+; ТСХ: Rf = 0,40 (ДХМ/МеОН, 9:1). 1 Н ЯМР (400 МГц, ДМСО-d6)(ч./млн): 0,71-0,87 (m, 2 Н), 1,11-1,26 (m, 2 Н), 1,47 (s, 3 Н), 1,74-1,96 Смесь 1-метилциклопропанкарбоновой кислоты (10 г, 100 ммоль) и оксалилхлорида (10,49 мл, 120 ммоль, 1,2 экв.) в CHCl3 (80 мл) перемешивают в течение 4 ч при 70 С. Реакционную смесь концентрируют и получают 11,8 г искомого соединения в виде желтого масла, которое используют без дополнительной очистки. Пример 6. 2-Амид,1-(4-метил-5-[2-(1-метилциклобутил)пиридин-4-ил]тиазол-2-иламид) (S)пирролидин-1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакцию останавливают путем разбавления смесью EtOAc и Н 2 О и экстрагируют с помощью EtOAc. На стадии 1.2 реакционную смесь перемешивают в течение 2 ч при 100 С. На- 20018863 стадии 1.3 реакционную смесь перемешивают в течение 3 ч при 100 С, разбавляют смесью EtOAc/H2O и экстрагируют с помощью EtOAc. После сушки и концентрирования органической фазы остаток очищают с помощью колоночной хроматографии на силикагеле (Hex/EtOAc, 1:4). На стадии 1.5 реакционную смесь перемешивают в течение 2 ч при 80 С и растирание с МеОН не проводят. На стадии 1.7 4-метокси 3-бутен-2-он (50 ммоль) в ТГФ (100 мл) добавляют к холодному (-78 С) раствору LiHMDS (1M в ТГФ,100 мл) в ТГФ (200 мл). Через 30 мин добавляют 1-метилциклобутанхлорид (стадия 6.1) и реакционной смеси дают нагреваться до КТ в течение 18 ч. Искомое соединение: ИЭР-МС: 400,1 [М+Н]+; ТСХ: Rf = 0,06 (ДХМ/MeOH/NH3aq, 94:5:1). Стадия 6.1. 1-Метилциклобутанкарбонилхлорид Искомое соединение получают по аналогии с методикой, описанной на стадии 5.1, но с использованием 1-метилциклобутанкарбоновой кислоты [Cowling, S.J.; Goodby, J.W., Chemical Communications,(2006), (39), 4107-4109]. Пример 7. 2-Амид,1-[5-(2-трет-бутилпиридин-4-ил)тиазол-2-ил]амид (S)-пирролидин-1,2 дикарбоновой кислоты Искомое соединение получают но аналогии с методикой, описанной в примере 1, со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 16 ч при КТ, реакцию останавливают путем разбавления смесью EtOAc/H2O и экстрагируют с помощью EtOAc. На стадии 1.1 реакционную смесь перемешивают в течение 2 ч при кипячении с обратным холодильником. На стадии 1.2 реакционную смесь перемешивают в течение 1 ч при 100 С. На стадии 1.3 используют N-тиазол-2 илацетамид. Реакционную смесь перемешивают в течение 2 ч при 120 С, разбавляют смесью EtOAc/H2O и экстрагируют с помощью EtOAc. После сушки и концентрирования органической фазы остаток очищают с помощью колоночной хроматографии на силикагеле (Hex/EtOAc, 1:1), затем растирают с Et2O. Искомое соединение: ИЭР-МС: 374,1 [М+Н]+; tR = 2,16 мин (система 1); ТСХ: Rf = 0,10 Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 16 ч при КТ, реакцию останавливают путем разбавления смесью EtOAc/H2O и экстрагируют с помощью EtOAc. На стадии 1.2 реакционную смесь перемешивают в течение 2 ч при 100 С. На стадии 1.3 используют 4-хлор-2 изопропилпиридин (стадия 8.1). Реакционную смесь перемешивают в течение 3 ч при 150 С, разбавляют смесью EtOAc/H2O и экстрагируют с помощью EtOAc. После сушки и концентрирования органической фазы остаток очищают с помощью колоночной хроматографии на силикагеле (Hex/EtOAc, 25:75). Искомое соединение: ИЭР-МС: 374,1 [М+Н]+; tR = 1,99 мин (система 1); ТСХ: Rf = 0,10 Искомое соединение получают по аналогии с методикой, описанной на стадии 2.1, но с использова- 21018863 нием изопропилмагнийхлорида (2 М в ТГФ): ИЭР-МС: 156,0 [М+Н]+; ТСХ: Rf = 0,32 (ДХМ). Пример 9. 2-Амид,1-[5-(2-циклобутилпиридин-4-ил)тиазол-2-ил]амид (3)-пирролидин-1,2 дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 16 ч при КТ, разбавляют смесью ДХМ/Н 2 О и экстрагируют с помощью ДХМ. На стадии 1.2 реакционную смесь перемешивают в течение 2 ч при 100 С и неочищенный продукт не очищают. На стадии 1.3 используют N-тиазол-2 илацетамид. Реакционную смесь перемешивают в течение 3 ч при 120 С, реакцию останавливают путем разбавления смесью EtOAc/H2O и экстрагируют с помощью EtOAc. После сушки и концентрирования органической фазы остаток очищают с помощью колоночной хроматографии на силикагеле (Hex/EtOAc,2:3). На стадии 1.5 реакционную смесь перемешивают в течение 1 ч при 80 С и растирание с МеОН не проводят. На стадии 1.7 4-метокси-3-бутен-2-он (50 ммоль) в ТГФ (100 мл) добавляют к холодному(-78 С) раствору LiHMDS (1M в ТГФ, 100 мл) в ТГФ (200 мл). Через 30 мин добавляют циклобутилкарбонилхлорид и реакционной смеси дают нагреваться до КТ в течение 18 ч. Искомое соединение: ИЭР-МС: 372,1 [М+Н]+; ТСХ: Rf = 0,13 (ДХМ/MeOH/NH3aq, 91,5:7,5:1). Пример 10. 2-Амид,1-(5-[2-(1-метилциклопропил)пиридин-4-ил]тиазол-2-иламид) Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. На стадии 1.1 реакционную смесь перемешивают в течение 14 ч при кипячении с обратным холодильником. На стадии 1.2 реакционную смесь перемешивают в течение 1 ч при 85 С. На стадии 1.3 используют N-тиазол-2-илацетамид и реакционную смесь перемешивают в течение 4 ч при 120 С. На стадии 1.5 растирание с МеОН не проводят. На стадии 1.7 используют 1 метилциклопропанкарбонилхлорид (стадия 5.1). Искомое соединение: ИЭР-МС: 372,1 [М+Н]+; ТСХ: Rf = 0,43 (ДХМ/МеОН, 9:1). Пример 11. 2-Амид,1-(5-[2-(1-трифторметилциклопропил)пиридин-4-ил]тиазол-2-иламид) (S)пирролидин-1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. На стадии 1.1 реакционную смесь перемешивают в течение 14 ч при кипячении с обратным холодильником. На стадии 1.3 используют N-тиазол-2-илацетамид. Реакционную смесь перемешивают в течение 2 ч при 120 С. На стадии 1.4 в качестве растворителя используют 1,2-дихлорэтан (2,55 мл на 1 ммоль пиридин-4-она). Реакционную смесь перемешивают в течение 1 ч при 83 С и после остановки реакции экстрагируют с помощью EtOAc. На стадии 1.5 реакционную смесь перемешивают в течение 1 ч при 65 С и растирание с МеОН не проводят. На стадии 1.7 используют 1-трифторметилциклопропанкарбонилхлорид (стадия 11.1). Искомое соединение: ИЭР-МС: 426,0 [М+Н]+; tR = 2,35 мин (система 1); ТСХ: Rf = 0,25 Искомое соединение получают по аналогии с методикой, описанной на стадии 5.1, но с использованием 1-трифторметилциклопропанкарбоновой кислоты. Пример 12. 2-Амид,1-(5-[2-(2,2,2-трифтор-1,1-диметилэтил)пиридин-4-ил]тиазол-2-иламид) (S)пирролидин-1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 5 ч при КТ. На стадии 1.1 реакционную смесь перемешивают в течение 14 ч при кипячении с обратным холодильником. На стадии 1.2 реакционную смесь перемешивают в течение 1 ч при 85 С и после остановки реакции экстрагируют с помощью EtOAc. На стадии 1.3 используют N-тиазол-2-илацетамид. Реакционную смесь перемешивают в течение 2,5 ч при 120 С. На стадии 1.4 реакционную смесь перемешивают в течение 1 ч при 83 С и после остановки реакции экстрагируют с помощью EtOAc. На стадии 1.5 реакционную смесь перемешивают в течение 1 ч при 65 С и растирание с МеОН не проводят. На стадии 1.6 неочищенный продукт не очищают. На стадии 1.7 используют 3,3,3-трифтор-2,2-диметилпропионилхлорид (стадия 12.1). Искомое соединение: ИЭР-МС: 428,0 [М+Н]+; tR = 2,75 мин (система 1); ТСХ: Rf = 0,21 (ДХМ/МеОН, 9:1). Стадия 12.1. 3,3,3-Трифтор-2,2-диметилпропионилхлорид Искомое соединение получают по аналогии с методикой, описанной на стадии 5.1, но с использованием 3,3,3-трифтор-2,2-диметилпропионовой кислоты. Пример 13. 2-Амид,1-(5-[2-(1-трифторметилциклобутил)пиридин-4-ил]тиазол-2-иламид) (S)пирролидин-1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 18 ч при КТ, реакцию останавливают путем разбавления смесью ДХМ/Н 2 О и экстрагируют с помощью ДХМ. На стадии 1.1 реакционную смесь перемешивают в течение 1 ч при кипячении с обратным холодильником. На стадии 1.2 реакционную смесь перемешивают в течение 1 ч при 100 С и после остановки реакции экстрагируют с помощью ДХМ. На стадии 1.7 N-тиазол-2-илацетамид используют. Реакционную смесь перемешивают в течение 5 ч при 120 С, реакцию останавливают путем разбавления смесью EtOAc/Н 2 О и экстрагируют с помощью EtOAc. На стадии 1.4 в качестве растворителя используют 1,2-дихлорэтан (2,26 мл на 1 ммоль пиридин-4-она). Реакционную смесь перемешивают в течение 1 ч при кипячении с обратным холодильником и после остановки реакции экстрагируют с помощью ДХМ. На стадии 1.5 реакционную смесь перемешивают в течение 1 ч при КТ и растирание с МеОН не проводят. На стадии 1.6 реакционную смесь перемешивают в течение 18 ч при КТ. На стадии 1.7 4-метокси-3-бутен-2-он в ТГФ добавляют к холодному (-78 С) раствору LiHMDS в ТГФ. Через 30 мин добавляют 1-трифторметилциклобутанкарбонилхлорид (стадия 13.1) в ТГФ. Реакционной смеси дают нагреваться до КТ в течение 18 ч и после остановки реакции экстрагируют с помощью EtOAc. Искомое соединение: ИЭР-МС: 440,0 [М+Н]+; tR = 2,68 мин(система 1); ТСХ: Rf = 0,08 Искомое соединение получают по аналогии с методикой, описанной на стадии 5.1, но с использованием 1-трифторметилциклобутанкарбоновой кислоты и перемешивания реакционной смеси в течение 2 ч при кипячении с обратным холодильником. Пример 14. 2-Амид,1-(4-метил-5-[2-(1-трифторметилциклопропил)пиридин-4-ил]тиазол-2-ил амид) (S)-пирролидин-1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. На стадии 1.1 реакционную смесь перемешивают в течение 14 ч при кипячении с обратным холодильником. На стадии 1.2 реакционную смесь перемешивают в течение 1 ч при 85 С и после остановки реакции экстрагируют с помощью EtOAc. На стадии 1.3 реакционную смесь перемешивают в течение 2 ч при 120 С. На стадии 1.4 в качестве растворителя используют 1,2-дихлорэтан (2,55 мл на 1 ммоль пиридин-4-она). Реакционную смесь перемешивают в течение 1 ч при 83 С и после остановки реакции экстрагируют с помощью EtOAc. На стадии 1.5 реакционную смесь перемешивают в течение 1 ч при 65 С и растирание с МеОН не проводят. На стадии 1.7 используют 1-трифторметилциклопропанкарбонилхлорид (стадия 11.1). Искомое соединение: ИЭР-МС: 440,0 [М+Н]+; tR = 2,65 мин (система 1); ТСХ: Rf = 0,36 Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. На стадии 1.1 реакционную смесь перемешивают в течение 14 ч при кипячении с обратным холодильником. На стадии 1.2 реакционную смесь перемешивают в течение 1 ч при 85 С и после остановки реакции экстрагируют с помощью EtOAc. На стадии 1.3 реакционную смесь перемешивают в течение 2,5 ч при 120 С. На стадии 1.4 реакционную смесь перемешивают в течение 1 ч при 83 С и после остановки реакции экстрагируют с помощью EtOAc. На стадии 1.5 реакционную смесь перемешивают в течение 1 ч при 65 С и растирание с МеОН не проводят. На стадии 1.6 неочищенный продукт не очищают. На стадии 1.7 используют 3,3,3-трифтор-2,2-диметилпропионилхлорид (стадия 12.1). Искомое соединение: ИЭР-МС: 442,0 [М+Н]+; tR = 3,02 мин (система 1); ТСХ: Rf = 0,35(d, 1 Н), 10,93 (br. s., 1H). В альтернативной методике искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями: N,N-диметилацетамид используют вместо ДМФ и смесь перемешивают при 65 С в течение 2 ч. На стадии 1.1 фенилхлорформиат (медленно добавляют) используют вместо 1,1'-карбонилдиимидазола и реакцию проводят в ТГФ в присутствии N,Nдиэтилизопропиламина при комнатной температуре (1,5 ч). На стадии 1.2 реакционную смесь кипятят с обратным холодильником при перемешивании в течение 5 ч и после остановки реакции экстрагируют с помощью EtOAc. На стадии 1.3 реакционную смесь перемешивают в течение 2 ч при 100 С. На стадии 1.4 реакцию проводят в толуоле с использованием 1,1 экв. POBr3 и 1,1 экв. трипропиламина и смесь перемешивают в течение 2 ч при 80 С и после остановки реакции экстрагируют с помощью EtOAc. На ста- 24018863 дии 1.5 реакционную смесь перемешивают в течение 1 ч при 65 С и растирание с МеОН не проводят. На стадии 1.6 толуол используют вместо бензола и неочищенный продукт не очищают. На стадии 1.7 используют 3,3,3-трифтор-2,2-диметилпропионилхлорид (стадия 12.1). Пример 16. 2-Амид,1-(4-метил-5-[2-(1-трифторметилциклобутил)пиридин-4-ил]тиазол-2-иламид) Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 72 ч при КТ, реакцию останавливают путем разбавления смесью ДХМ/Н 2 О и экстрагируют с помощью ДХМ. На стадии 1.1 реакционную смесь перемешивают в течение 1 ч при кипячении с обратным холодильником. На стадии 1.2 реакционную смесь перемешивают в течение 2 ч при 100 С и после остановки реакции экстрагируют с помощью ДХМ. На стадии 1.3 реакционную смесь перемешивают в течение 6 ч при 120 С, реакцию останавливают путем разбавления смесью EtOAC/H2O, фильтруют через слой целита и экстрагируют с помощью EtOAc. На стадии 1.4 в качестве растворителя используют 1,2-дихлорэтан (2,26 мл на 1 ммоль пиридин-4-она). Реакционную смесь перемешивают в течение 1 ч при кипячении с обратным холодильником и после остановки реакции экстрагируют с помощью ДХМ. На стадии 1.5 реакционную смесь перемешивают в течение 1 ч при КТ и растирание с МеОН не проводят. На стадии 1.6 реакционную смесь перемешивают в течение 18 ч при КТ. На стадии 1.7 4-метокси-3-бутен-2-он в ТГФ добавляют к холодному (-78 С) раствору LiHMDS в ТГФ. Через 30 мин добавляют 1-трифторметилциклобутанкарбонилхлорид (стадия 13.1) в ТГФ. Реакционной смеси дают нагреваться до КТ в течение 18 ч и после остановки реакции экстрагируют с помощью EtOAc. Искомое соединение: ИЭР-МС: 454,1 [М+Н]+; tR = 2,90 мин (система 1); ТСХ: Rf = 0,22 Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 24 ч при КТ, реакцию останавливают путем разбавления смесью EtOAc/H2O и экстрагируют с помощью EtOAc. На стадии 1.2 реакционную смесь перемешивают в течение 2 ч при 100 С и после остановки реакции экстрагируют с помощью ДХМ. На стадии 1.7 используют N-тиазол-2-илацетамид. Реакционную смесь перемешивают в течение 3 ч при 100 С, разбавляют смесью EtOAc/H2O и экстрагируют с помощью EtOAc. После сушки и концентрирования органической фазы остаток очищают с помощью колоночной хроматографии на силикагеле (Hex/EtOAc, 25:75). На стадии 1.5 реакционную смесь перемешивают в течение 2 ч при 80 С и растирание с МеОН не проводят. На стадии 1.7 4-метокси-3-бутен-2-он в ТГФ добавляют к холодному(-78 С) раствору LiHMDS в ТГФ. Через 30 мин добавляют 1-метилциклобутанхлорид (стадия 6.1) в ТГФ и реакционной смеси дают нагреваться до КТ в течение 18 ч. Искомое соединение: ИЭР-МС: 386,1 [М+Н]+; tR = 2,32 мин (система 1); ТСХ: Rf = 0,05- 25018863 Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 16 ч при КТ, реакцию останавливают путем разбавления смесью EtOAc/H2O и экстрагируют с помощью EtOAc. На стадии 1.1 используют 1-[4-(2-амино-4-метилтиазол-5-ил)пиридин-2-ил]циклопропанкарбонитрил (стадия 18.1) и реакционную смесь перемешивают в течение 2 ч при кипячении с обратным холодильником. Искомое соединение: ИЭР-МС: 397,0 [М+Н]+; tR = 2,90 мин (система 1); ТСХ: Rf = 0,08 Смесь трет-бутилового эфира 5-[2-(1-цианоциклопропил)пиридин-4-ил]-4-метилтиазол-2-илкарбаминовой кислоты (стадия 18.2) (295 мг), ДХМ (4 мл) и ТФК (1 мл) перемешивают в течение 2 ч при КТ и затем концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле Искомое соединение получают по аналогии с методикой, описанной на стадии 1.3, но с использованием 1-(4-бромпиридин-2-ил)циклопропанкарбонитрила (стадия 18.3) и трет-бутилового эфира (4 метилтиазол-2-ил)карбаминовой кислоты (стадия 18.4). Реакционную смесь перемешивают в течение 2 ч при 100 С, реакцию останавливают путем разбавления смесью EtOAc/H2O и экстрагируют с помощьюEtOAc. Неочищенный продукт очищают с помощью колоночной хроматографии на силикагеле(Hex/EtOAc, 1:1) и получают 122 мг искомого соединения в виде белого твердого вещества. ИЭР-МС: 357,1 [М+Н]; tR = 4,86 мин (система 1); ТСХ: Rf = 0,29 (Hex/EtOAc, 1:1). Стадия 18.3. 1-(4-Бромпиридин-2-ил)циклопропанкарбонитрилLiHMDS (1M в толуоле, 17,6 мл, 17,6 ммоль, 3,1 экв.) по каплям добавляют к холодной (-5 С) смеси 4-бром-2-фторпиридина [Marsais, F. et al., Journal of Organic Chemistry, (1992), 57, 565-573] (1 г, 5,7 ммоль),циклопропанкарбонитрила (1,25 мл, 17 ммоль, 3 экв.), 4 молекулярных сит и толуола (20 мл). Реакционной смеси дают нагреться до КТ, перемешивают в течение 16 ч, выливают в Н 2 О и фильтруют. Фильтрат разбавляют смесью EtOAc/H2O и экстрагируют с помощью EtOAc. Органическую фазу промывают с помощью Н 2 О и рассолом, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (Hex/EtOAc, 9:1) и получают 620 мг искомого соединения в виде белого твердого вещества. ИЭР-МС: 223,1/225,1 [М+Н]+; tR = 4,22 мин (система 1); ТСХ: Rf = 0,25 Раствор ди-трет-бутилдикарбоната (21 г, 96,5 ммоль, 1,1 экв.) в t-BuOH (50 мл) добавляют к раствору 4-метил-2-аминотиазола (10 г, 87,7 ммоль) и ДМАП (1,1 г, 8,8 ммоль, 0,1 экв.) в t-BuOH (50 мл). Реак- 26018863 ционную смесь перемешивают в течение 72 ч при КТ и концентрируют. Остаток разбавляют смесьюEtOAc/H2O и экстрагируют с помощью EtOAc. Органическую фазу промывают с помощью Н 2 О и рассолом, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (ДХМ/МеОН, 98:2) и получают 15,2 г искомого соединения в виде белого твердого вещества. ИЭР-МС: 215,1 [М+Н]+; tR = 3,43 мин (система 1); ТСХ: Rf = 0,30 (ДХМ/МеОН, 98:2). Пример 19. 2-Амид,1-(5-[2-(1-цианоциклобутил)пиридин-4-ил]-4-метилтиазол-2-иламид) (S)пирролидин-1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 6 ч при КТ. На стадии 1.1 используют 1-[4-(2-амино-4-метилтиазол-5-ил)пиридин-2-ил]циклобутанкарбонитрил (стадия 19.1) и реакционную смесь перемешивают в течение 3 ч при кипячении с обратным холодильником. Искомое соединение. ИЭР-МС: 411,1 [М+Н]+; ТСХ: Rf = 0,36 (ДХМ/МеОН, 9:1). Стадия 19.1. 1-[4-(2-Амино-4-метилтиазол-5-ил)пиридин-2-ил]циклобутанкарбонитрил Смесь трет-бутилового эфира 5-[2-(1-цианоциклобутил)пиридин-4-ил]-4-метилтиазол-2 илкарбаминовой кислоты (стадия 19.2) (300 мг), ДХМ (5 мл) и ТФК (1 мл) перемешивают в течение 4 ч при КТ, реакцию останавливают путем добавления насыщенного раствора NaHCO3 (50 мл) и экстрагируют с помощью ДХМ (375 мл). Органическую фазу промывают насыщенным раствором NaHCO3(250 мл), сушат (Na2SO4) фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (ДХМ/МеОН, 1:096:4) и получают 181 мг искомого соединения в виде желтого твердого вещества. ИЭР-МС: 271,1 [М+Н]+; tR = 2,48 мин (система 1); ТСХ: Rf = 0,45 Искомое соединение получают по аналогии с методикой, описанной на стадии 1.3, но с использованием 1-(4-бромпиридин-2-ил)циклобутанкарбонитрила (стадия 19.3) и трет-бутилового эфира (4 метилтиазол-2-ил)карбаминовой кислоты (стадия 18.4). Реакционную смесь перемешивают в течение 3 ч при 100 С. Искомое соединение: ИЭР-МС: 371,1 [М+Н]+; tR = 4,86 мин (система 1); ТСХ: Rf = 0,66LiHMDS (1M в толуоле, 17,7 мл, 17,7 ммоль, 3,1 экв.) по каплям добавляют к холодному (-5 С) раствору 4-бром-2-фторпиридина [Marsais, F. et al., Journal of Organic Chemistry, (1992), 57, 565-573] (1 г, 5,7 ммоль) и циклобутанкарбонитрила (1,39 г, 17,1 ммоль, 3 экв.) в толуоле (20 мл). Реакционной смеси дают нагреться до КТ, перемешивают в течение 5 ч, реакцию останавливают путем добавления насыщенного раствора NaHCO3 (50 мл) и фильтруют через слой целита. Фильтрат экстрагируют с помощью EtOAc(375 мл). Органическую фазу промывают насыщенным раствором NaHCO3 (250 мл), сушат (Na2SO4),фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле(Hex/EtOAc, 1:095:5) и получают 933 мг искомого соединения в виде желтого масла. ИЭР-МС: 237,0/239,0 [М+Н]+; tR = 4,27 мин (система 1); ТСХ: Rf = 0,30 (Hex/EtOAc, 9:1). Пример 20. 2-Амид,1-(5-[2-(1-карбамоилциклобутил)пиридин-4-ил]-4-метилтиазол-2-иламид (S)пирролидин-1,2-дикарбоновой кислоты) Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 3 ч при КТ. На стадии 1.1 используют амид 1-[4-(2-амино-4-метилтиазол-5-ил)пиридин-2-ил]циклобутанкарбоновой кислоты (стадия 20.1) и реакционную смесь перемешивают в течение 12 ч при кипячении с обратным холодильником. Искомое соединение: ИЭР-МС: 429,1 [М+Н]+; tR = 2,90 мин (система 1); ТСХ: Rf = 0,11 Смесь трет-бутилового эфира 5-[2-(1-цианоциклобутил)пиридин-4-ил]-4-метилтиазол-2 илкарбаминовой кислоты (стадия 19.2) (640 мг, 1,73 ммоль) и концентрированной серной кислоты перемешивают в течение 40 мин при 0 С, дают нагреться до КТ, перемешивают в течение 1 ч, реакцию останавливают путем добавления насыщенного раствора NaHCO3 (50 мл) и экстрагируют с помощью ДХМ(375 мл). Органическую фазу промывают насыщенным раствором NaHCO3 (250 мл), сушат (Na2SO4),фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле(ДХМ/MeOH/NH3aq, 99:0:193:6:1) и получают 35 мг искомого соединения в виде желтого твердого вещества. ИЭР-МС: 289,1 [М+Н]+; ТСХ: Rf = 0,32 (ДХМ/МеОН, 9:1). Пример 21. 2-Амид,1-(5-[2-(2-диметиламино-1,1-диметилэтил)пиридин-4-ил]-4-метилтиазол-2 иламид) (S)-пирролидин-1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. На стадии 1.1 используют 5-[2-(2-диметиламино-1,1-диметилэтил)пиридин-4-ил]-4 метилтиазол-2-иламин (стадия 21.1) и реакционную смесь перемешивают в течение 14 ч при кипячении с обратным холодильником. Искомое соединение: ИЭР-МС: 431,1 [М+Н]+; ТСХ: Rf = 0,12 (ДХМ/МеОН,9:1). Стадия 21.1. 5-[2-(2-Диметиламино-1,1-диметилэтил)пиридин-4-ил]-4-метилтиазол-2-иламин Искомое соединение получают по аналогии с методикой, описанной на стадии 19.1, но с использованием трет-бутилового эфира 5-[2-(2-диметиламино-1,1-диметилэтил)пиридин-4-ил]-4-метилтиазол-2 илкарбаминовой кислоты (стадия 21.2) и перемешивания реакционной смеси в течение 2 ч при КТ. Искомое соединение: ИЭР-МС: 291,1 [М+Н]+; tR = 2,48 мин (система 1); ТСХ: Rf = 0,11(0,34 г, 0,94 ммоль) и ацетоксиборогидрида натрия (0,6 г, 2,82 ммоль, 3 экв.) в 1,2-дихлорэтане (10 мл). Реакционную смесь перемешивают в течение 1 ч при КТ и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (ДХМ/MeOH/NH3aq, 99:0:197:2:1) и получают 0,222 г искомого соединения в виде белого твердого вещества. ИЭР-МС: 391,2 [М+Н] ; tR = 4,27 мин (система 1); ТСХ: Rf = 0,15 (ДХМ/МеОН, 9:1). Стадия 21.3. трет-Бутиловый эфир 5-[2-(2-амино-1,1-диметилэтил)пиридин-4-ил]-4-метилтиазол-2 илкарбаминовой кислотыLiAlH4 (1M в ТГФ, 3,06 мл, 3,06 ммоль, 1,5 экв.) добавляют к раствору трет-бутилового эфира 5[2-(цианодиметилметил)пиридин-4-ил]-4-метилтиазол-2-илкарбаминовой кислоты (стадия 21.4) (0,73 г,2,04 ммоль) в ТГФ (10 мл) в атмосфере аргона. Реакционную смесь перемешивают в течение 2 ч при КТ,реакцию останавливают путем добавления Н 2 О (20 мл) и экстрагируют с помощью EtOAc (275 мл). Органическую фазу промывают насыщенным раствором NaHCO3 (250 мл), сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле(ДХМ/MeOH/NH3aq, 99:0:194:5:1) и получают 318 мг искомого соединения в виде коричневого твердого вещества. ИЭР-МС: 363,1 [М+Н]; ТСХ: Rf = 0,11 (ДХМ/МеОН, 9:1). Стадия 21.4. трет-Бутиловый эфир 5-[2-(цианодиметилметил)пиридин-4-ил]-4-метилтиазол-2 илкарбаминовой кислоты Искомое соединение получают по аналогии с методикой, описанной на стадии 1.3, но с использованием 2-(4-йодпиридин-2-ил)-2-метилпропионитрила (стадия 21.5) и трет-бутилового эфира (4 метилтиазол-2-ил)карбаминовой кислоты (стадия 18.4). Реакционную смесь перемешивают в течение 3 ч при 100 С. Искомое соединение: ИЭР-МС: 359,1 [М+Н]+; ТСХ: Rf = 0,47 (Hex/EtOAc, 1:1). Стадия 21.5. 2-(4-Йодпиридин-2-ил)-2-метилпропионитрил Искомое соединение получают по аналогии с методикой, описанной на стадии 19.3, но с использованием 2-фтор-4-йодпиридина. Искомое соединение: ИЭР-МС: 273,0 [М+Н]+; tR = 4,22 мин (система 1); ТСХ: Rf = 0,36 (Hex/EtOAc, 9:1). Пример 22. 2-Амид,1-[5-(2-диэтиламинопиридин-4-ил)-4-метилтиазол-2-ил]амид (S)-пирролидин 1,2-дикарбоновой кислоты Искомое соединение получают по аналогии с методикой, описанной в примере 1, но со следующими изменениями. В примере 1 реакционную смесь перемешивают в течение 18 ч при КТ, реакцию оста- 29
МПК / Метки
МПК: A61K 31/4439, C07D 417/14, A61P 35/00
Метки: соединения, органические
Код ссылки
<a href="https://eas.patents.su/30-18863-organicheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Органические соединения</a>
Предыдущий патент: Модуляторы γ-секретазы
Следующий патент: Скважинная плунжерная насосная установка
Случайный патент: Способ и система для обработки подземного пласта


































