Полимерные мультиэпитопные вакцины против гриппа
Формула / Реферат
1. Синтетический или рекомбинантный мультиэпитопный полипептид гриппа, содержащий многократное число копий множества пептидных эпитопов вируса гриппа, расположенных в конфигурации, выбранной из группы, состоящей из:
i) B(X1ZX2Z…Xm)nB;
ii) B(X1)nZ(X2)nZ…(Xm)nB;
где В представляет собой необязательную последовательность из 1-4 аминокислотных остатков; n в каждом случае независимо равно целому числу 2-50; m равно целому числу 3-15; каждый из X1-Xm представляет собой пептидный эпитоп гриппа, выбранный из группы, состоящей из эпитопа В-клеточного типа, эпитопа Т-хелперного (Th) типа и эпитопа типа цитотоксических лимфоцитов (CTL), состоящих из 4-24 аминокислотных остатков; где максимальное число аминокислотных остатков в полипептиде составляет примерно 600; и в котором пептидные эпитопы гриппа выбраны из группы, состоящей из пептида гемагглютинина (НА), пептида M1, пептида М2 и пептида нуклеопротеина (NP).
2. Полипептид по п.1, где m равно 9, a n равно целому числу от 3 до 5.
3. Полипептид по п.2, в котором пептидные эпитопы гриппа выбраны из группы, состоящей из SEQ ID NO:1-SEQ ID NO:82.
4. Полипептид по п.1, в котором пептидные эпитопы гриппа выбраны из группы, состоящей из НА 354-372 (E1, SEQ ID NO:82), НА 91-108 (Е2, SEQ ID NO:48), M1 2-12 (Е3, SEQ ID NO:25), НА 150-159 (Е4, SEQ ID NO:52), НА 143-149 (E5, SEQ ID NO:51), NP 206-229 (E6, SEQ ID NO:64), HA 307-319 (E7, SEQ ID NO:59), NP 335-350 (E8, SEQ ID NO:69) и NP 380-393 (E9, SEQ ID NO:70).
5. Полипептид по п.4, в котором пептидные эпитопы гриппа состоят из НА 354-372 (E1, SEQ ID NO:82), НА 91-108 (Е2, SEQ ID NO:48), M1 2-12 (Е3, SEQ ID NO:25), НА 150-159 (Е4, SEQ ID NO:52), НА 143-149 (E5, SEQ ID NO:51), NP 206-229 (E6, SEQ ID NO:64), HA 307-319 (E7, SEQ ID NO:59), NP 335-350 (E8, SEQ ID NO:69) и NP 380-393 (E9, SEQ ID NO:70).
6. Полипептид по п.4 с последовательностью, выбранной из группы, состоящей из SEQ ID NO:84, SEQ ID NO:86 и SEQ ID NO:88.
7. Полипептид по п.1, содержащий
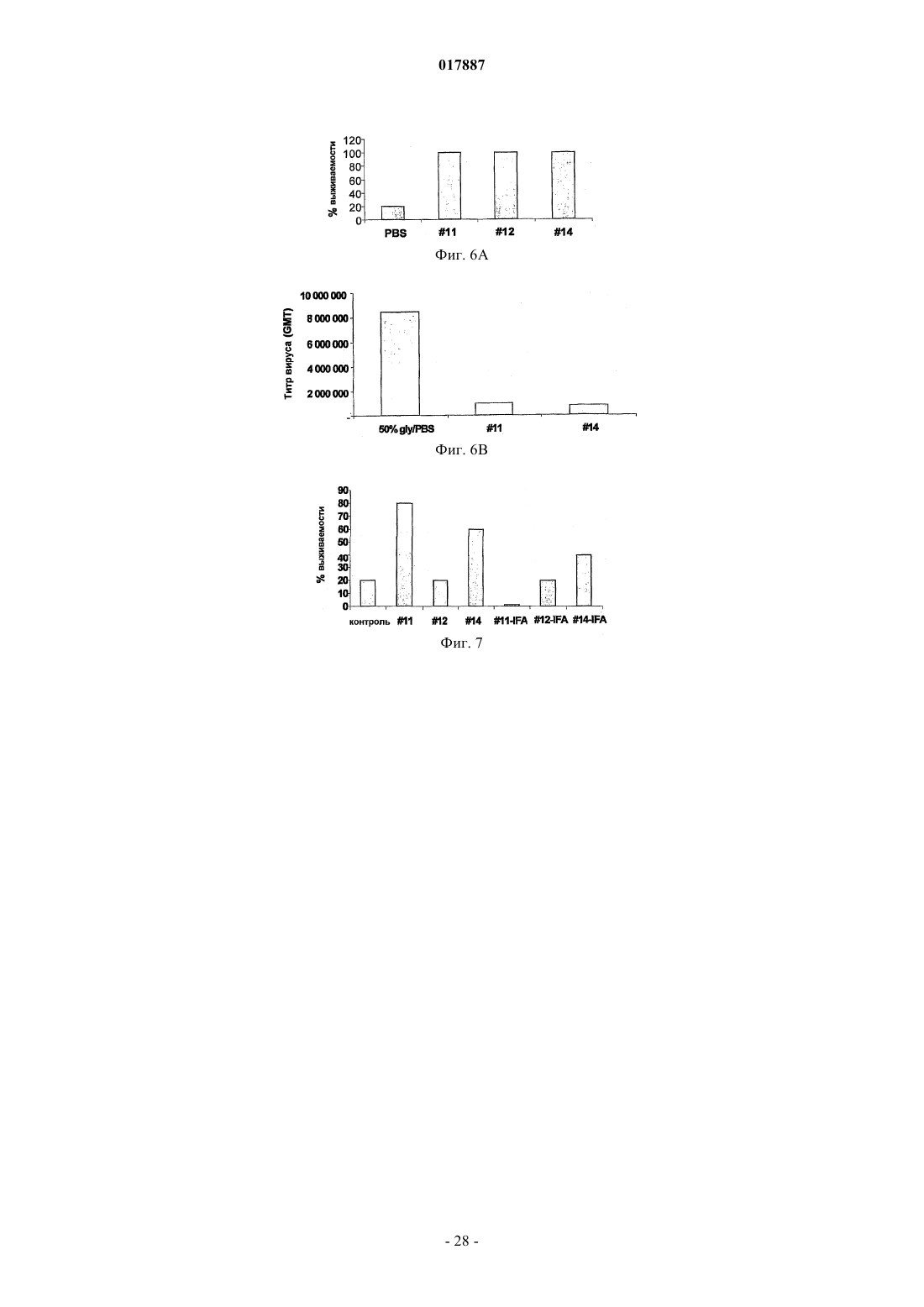
девять различных пептидных эпитопов вируса гриппа, расположенных в следующей чередующейся последовательной полимерной структуре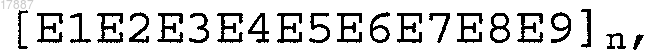
где n равно 3 или 5; Е1 представляет собой НА 354-372 (SEQ ID NO:82), Е2 представляет собой НА 91-108 (SEQ ID NO:48), Е3 представляет собой M1 2-12 (SEQ ID NO:25), Е4 представляет собой НА 150-159 (SEQ ID NO:52), Е5 представляет собой НА 143-149 (SEQ ID NO:51), Е6 представляет собой NP 206-229 (SEQ ID NO:64), Е7 представляет собой НА 307-319 (SEQ ID NO:59), Е8 представляет собой NP 335-350 (SEQ ID NO:69), а Е9 представляет собой NP 380-393 (SEQ ID NO:70); или
три повтора из девяти различных пептидных эпитопов вируса гриппа, расположенных в следующей структуре блок-сополимера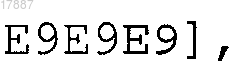
где Е1 представляет собой НА 354-372 (SEQ ID NO:82), Е2 представляет собой НА 91-108 (SEQ ID NO:48), Е3 представляет собой M1 2-12 (SEQ ID NO:25), Е4 представляет собой НА 150-159 (SEQ ID NO:52), Е5 представляет собой НА 143-149 (SEQ ID NO:51), Е6 представляет собой NP 206-229 (SEQ ID NO:64), Е7 представляет собой НА 307-319 (SEQ ID NO:59), Е8 представляет собой NP 335-350 (SEQ ID NO:69), а Е9 представляет собой NP 380-393 (SEQ ID NO:70); или
шесть повторов из пяти различных пептидных эпитопов В-клеточного типа вируса гриппа, расположенных в следующей чередующейся последовательной полимерной структуре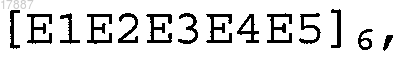
где Е1 представляет собой НА 354-372 (SEQ ID NO:82), Е2 представляет собой НА 91-108 (SEQ ID NO:48), Е3 представляет собой M1 2-12 (SEQ ID NO:25), Е4 представляет собой НА 150-159 (SEQ ID NO:52), Е5 представляет собой НА 143-149 (SEQ ID NO:51); или
шесть повторов из четырех различных пептидных эпитопов вируса гриппа Т-клеточного типа, расположенных в следующей чередующейся последовательной полимерной структуре [Е7Е8Е9Е6]6, где Е6 представляет собой NP 206-229 (SEQ ID NO:64), Е7 представляет собой НА 307-319 (SEQ ID NO:59), Е8 представляет собой NP 335-350 (SEQ ID NO:69), а Е9 представляет собой NP 380-393 (SEQ ID NO:70); или
четыре повтора из четырех различных пептидных эпитопов вируса гриппа Т-клеточного типа, расположенных в следующей чередующейся последовательной полимерной структуре [Е7Е8Е9Е6]4, где n равно 6, Е6 представляет собой NP 206-229 (SEQ ID NO:64), Е7 представляет собой НА 307-319 (SEQ ID NO:59), Е8 представляет собой NP 335-350 (SEQ ID NO:69), а Е9 представляет собой NP 380-393 (SEQ ID NO:70), и где указанный мультимерный полипептид слит с белком-носителем; или
шесть повторов из девяти различных пептидных эпитопов вируса гриппа, расположенных в следующей структуре блок-сополимера
где Е1 представляет собой НА 354-372 (SEQ ID NO:82), Е2 представляет собой НА 91-108 (SEQ ID NO:48), Е3 представляет собой M1 2-12 (SEQ ID NO:25), Е4 представляет собой НА 150-159 (SEQ ID NO:52), Е5 представляет собой НА 143-149 (SEQ ID NO:51), Е6 представляет собой NP 206-229 (SEQ ID NO:64), Е7 представляет собой НА 307-319 (SEQ ID NO:59), Е8 представляет собой NP 335-350 (SEQ ID NO:69), а Е9 представляет собой NP 380-393 (SEQ ID NO:70).
8. Полипептид по п.1, также содержащий последовательность носителя.
9. Полипептид по п.8, где эпитопы пептида включены в последовательность полипептидного носителя.
10. Выделенный полинуклеотид, кодирующий мультиэпитопный полипептид гриппа по любому из пп.1-9.
11. Выделенный полинуклеотид по п.10, кодирующий полипептидную последовательность, выбранную из группы, состоящей из SEQ ID NO:84, SEQ ID NO:86 и SEQ ID NO:88.
12. Выделенный полинуклеотид по п.10, содержащий последовательность, выбранную из группы, состоящей из SEQ ID NO:83, SEQ ID NO:85 и SEQ ID NO:87.
13. Вакцина для иммунизации индивидуума против гриппа, содержащая по меньшей мере один полипептид по п.1.
14. Вакцина по п.13, где первый полипептид содержит множество пептидных эпитопов вируса гриппа В-клеточного типа, а второй полипептид содержит множество пептидных эпитопов вируса гриппа Т-клеточного типа.
15. Вакцина по п.13, дополнительно содержащая адъювант.
16. Вакцина по п.15, где адъювант выбран из группы, состоящей из вода-в-масляной эмульсии, липидной эмульсии и липосом.
17. Способ индукции иммунного ответа и обеспечения защиты против гриппа у индивида, где способ предусматривает введение индивиду вакцины по любому из пп.13-16.
18. Способ по п.17, где путь введения вакцины выбран из внутримышечного, интраназального, перорального, внутрибрюшного, подкожного, местного, чрезкожного и трансдермального.
19. Применение полипептида по любому из пп.1-9 для получения вакцинной композиции для иммунизации против гриппа.
Текст
ПОЛИМЕРНЫЕ МУЛЬТИЭПИТОПНЫЕ ВАКЦИНЫ ПРОТИВ ГРИППА Изобретение относится к полимерным мультиэпитопным пептидным вакцинам. В частности,настоящее изобретение относится к применению полимерных мультиэпитопных пептидных вакцин, создающих защитный иммунитет против гриппа. Область техники, к которой относится изобретение Настоящее изобретение относится к полимерным мультиэпитопным пептидным вакцинам. В частности, настоящее изобретение относится к применению полимерной мультиэпитопной пептидной вакцины, вызывающей защитный иммунитет против гриппа. Предшествующий уровень техники Мультиэпитопные вакцины. Известно, что В-клеточные эпитопы, Т-хелперные эпитопы и эпитопы цитотоксических Тлимфоцитов имеют важное значение в таких двух иммунных ответах. Очевидно, что для эффективной вакцинации необходимо индуцировать продолжительные гуморальные и клеточные реакции широкого спектра. До сих пор не существует вакцин широкого спектра и эффективных против вирусов с высокой частотой мутирования, таких как вирус гриппа и вирус иммунодефицита человека. Существует тесная взаимосвязь между дозой антигена и эффективностью специфического Вклеточного ответа. Исследования с использованием системы химически связанного белка-носителя и эпитопного пептида, состоящей из одинакового количества белка-носителя, связанного с различными количествами эпитопного пептида, показали, что плотность эпитопа существенно влияла на IgG реакции,зависящие от клеток Т-хелперов (Jegerlehner et al., Eur J. Immunol. 2002, 32:3305-14). Авторы Liu et al.(Vaccine. 2004, 23 (3):366-71) обнаружили положительное влияние плотности эпитопа на гуморальный ответ мышей и кроликов, иммунизированных белками, слитыми с глутатион-S-трансферазой, несущими многократное число копий пептидного эпитопа М 2 е (1, 2, 4, 8 и 16 копий) белка М 2 вируса гриппа. В аналогичном исследовании анализ заражения летальной дозой показал, что слитый белок с более высокой плотностью эпитопов привел к более высокой степени выживаемости и более медленной потере массы. Мультиэпитопные вакцины, т.е. вакцины, содержащие более одного эпитопа, были разработаны для широкого спектра применений. Неполный перечень примеров включает, например, рекомбинантную поливалентную вакцину против стрептококковых бактерий, описанную в патенте США 6063386; вакцину для лечения малярии, которая содержит единственный белок, содержащий пептиды, полученные на различных стадиях жизненного цикла паразита Plasmodium falciparum, описанную в патенте США 6828416; противоопухолевые иммуногенные композиции, содержащие полипептид, содержащий антигенные эпитопы стволовой клетки простаты, описанные в патентной заявке США 2007/0056315; и мультиэпитопные противовирусные вакцины против HIV (международная публикация WO 01/24810), вируса краснухи (см. международную публикацию WO 93/14206) и вируса гепатита С (международная публикация WO 01/21189). В международной публикации WO 2006/069262 описаны композиции, слитые белки и полипептиды, содержащие патогенсвязанные молекулярные наборы (РАМР) и эпитопы белков вируса гриппа, используемые для стимуляции иммунных ответов у индивидуума. РАМР представляют собой молекулярные повторы (например, белки, пептиды, нуклеиновые кислоты, углеводы, липиды), обнаруженные в микроорганизмах, которые могут запускать врожденный иммунный ответ хозяина, т.е. действовать в качестве адъюванта. В некоторых вариантах осуществления слитые белки включают многократное число копий эпитопа гриппа М 2 е. В международной публикации WO 2006/078657 описаны аналогичные слитые белки и полипептиды, содержащие один или несколько РАМР, и множество эпитопов белков флавивирусов. Грипп. Грипп представляет собой заболевание, вызываемое вирусами трех основных подтипов, грипп А, В и С, которые классифицируются по антигенным детерминантам. Вирион гриппа состоит из генома - одноцепочечной РНК, тесно связанной с нуклеопротеином (NP) и окруженной липопротеиновой оболочкой, заполненной белком матрикса (M1) и несущей два главных поверхностных гликопротеиновых антигена, гемагглютинин (НА) и нейраминидазу (NA). Гликопротеины НА и NA наиболее подвержены изменению; например, существует 16 иммунных классов НА и 9 различных классов NA, что является основой для различных подтипов вируса гриппа, подобных H1N1 или H3N2. Вирус гриппа А обладает дополнительным трансмембранным гликопротеином М 2, который высоко консервативен у различных подтиповHN. Ген М 2 кодирует белок из 96-97 аминокислот, который экспрессируется в виде тетрамера на поверхности клетки вириона. Он состоит из примерно 24 внеклеточных аминокислот, примерно 19 трансмембранных аминокислот и примерно 54 цитоплазматических остатков (Lamb et al., Cell. 1985; 40:627633). Вирусы гриппа А и В являются самыми частыми причинами гриппа у человека. Грипп оказывает огромное влияние на здоровье общества и имеет тяжелые экономические последствия в дополнение к невероятным проблемам со здоровьем, включая заболеваемость и даже смертность. Инфекционное заболевание может протекать в легкой, средней и тяжелой форме, изменяясь от бессимптомного течения,легкого инфекционного заболевания верхних дыхательных путей и трахеобронхита до тяжелой, иногда летальной вирусной пневмонии. Вирусы гриппа обладают двумя важными иммунологическими характеристиками, которые представляют проблему для создания вакцины. Первая касается генетических изменений, которые возникают на поверхностных гликопротеинах каждые несколько лет, обозначаемых как"антигенный дрейф". Такое антигенное изменение продуцирует вирусы, которые ускользают от противодействия, оказываемого существующими вакцинами. Вторым отличием, делающим вклад к проблеме здоровья общества, является то, что вирусы гриппа, в частности вирус гриппа А, могут обмениваться генетическим материалом и сливаться. Этот процесс, известный как "антигенный сдвиг", приводит к новым штаммам, отличающимся от обоих родительских вирусов, которые могут являться летальными пандемичными штаммами. Антигены вируса гриппа и получение вакцины. Иммунизация против вируса гриппа ограничивается антигенной изменчивостью вируса и распространением инфекции лишь на слизистые оболочки респираторного тракта. Доступные в настоящее время вакцины против гриппа основаны либо на целом инактивированном вирусе, на белках вируса, представленных на поверхности бактериальных клеток, либо на флагеллине, несущем антигенные детерминанты вируса. НА представляет собой сильный иммуноген и самый важный антиген в определении серологической специфичности различных штаммов вируса. Молекула НА (75-80 кДа) содержит многократное число копий антигенных детерминант, некоторые из которых находятся в областях, которые подвергаются последовательным изменениям в различных штаммах (штамм-специфические детерминанты), а другие расположены в областях, которые консервативны у большинства молекул НА (общие детерминанты). Из-за таких изменений вакцины против гриппа необходимо модифицировать по меньшей мере раз в несколько лет. В данной области известно много антигенов гриппа и вакцин, полученных на их основе. В патенте США 4474757 описана вакцина против вируса гриппа, состоящая из синтетического пептида, соответствующего антигенному фрагменту НА, присоединенного к подходящему макромолекулярному носителю,такому как полимеры аминокислот или столбнячный анатоксин. В международной публикации РСТ WO 93/20846 некоторые из авторов настоящего изобретения сообщают о синтетической рекомбинантной вакцине против большого числа различных штаммов вируса гриппа, содержащей по меньшей мере один рекомбинантный белок, содержащий аминокислотную последовательность флагеллина и по меньшей мере одну аминокислотную последовательность эпитопа НА или NP вируса гриппа или агрегат указанного химерного белка. Согласно такому подходу было обнаружено, что синтетическая рекомбинантная вакцина против гриппа, основанная на трех эпитопах, высокоэффективна на мышах. Приведенные в качестве примера вакцины включают химеры флагеллина, содержащие эпитоп НА 91-108, В-клеточный эпитоп из НА, который консервативен во всех штаммах Н 3 и вызывает выработку нейтрализующих антител против гриппа, вместе с одним или обоими эпитопами NP,Т-хелперным или CTL (NP 55-69 и NP 147-158 соответственно), которые индуцируют МНСограниченные иммунные ответы. Для обеспечения лучшей защиты против вирусной инфекции рассматривали вакцину, содержащую комбинацию трех указанных выше химер. В патенте США 6740325 некоторыми из авторов настоящего изобретения рассматривается синтетическая пептидная вакцина против гриппа человека, содержащая по меньшей мере четыре эпитопа вируса гриппа, при этом указанные эпитопы вируса гриппа являются активными в отношении клеток человека,и указанные эпитопы содержат:(ii) один Т-хелперный эпитоп гемагглютинина (НА) или нуклеопротеина (NP), который может связываться со многими молекулами HLA;(iii) по меньшей мере два эпитопа нуклеопротеина (NP) или белка матрикса (М) для цитотоксических лимфоцитов (CTL), которые ограничиваются преобладающими молекулами HLA у различных популяций людей, в частности конкретных этнических или расовых группах. Пептидные эпитопы гриппа могут быть экспрессированы в рекомбинантном флагеллине сальмонеллы. Для такой вакцины требуется сложноосуществимое получение по меньшей мере четырех химерных полипептидов. В международной публикации РСТ WO 2007/066334 некоторые из авторов настоящего изобретения описывают вакцину, способную вызывать длительную и перекрестную между штаммами защиту, содержащую большое число химерных белков, содержащих по меньшей мере два пептидных эпитопа вируса гриппа, где по меньшей мере один эпитоп представляет собой пептидный эпитоп белка матрикса М вируса гриппа А, а второй эпитоп представляет собой пептидный эпитоп гемагглютинина НА. В этом случае пептидные эпитопы гриппа могут быть также экспрессированы в рекомбинантном флагеллине сальмонеллы. У млекопитающих часто отмечали иммунные реакции на флагеллярные антигены. Тем не менее,клинические данные показали, что эффективные дозы рекомбинантного флагеллина у животных оказывают негативные эффекты на людей, включая сильную лихорадку, вероятно, вследствие высокого соотношения флагеллин/антиген. Также полагают, что высокие концентрации флагеллина оказывают временное влияние на сердце. Таким образом, необходима вакцина против гриппа на основе пептидного эпитопа, которая сможет индуцировать продолжительный гуморальный и клеточный ответы, обладающие специфичностью. Кроме того, существует необходимость в вакцине, которую можно легко получать и осуществлять контроль качества. Сущность изобретения Настоящее изобретение относится к вакцинам против гриппа, у которых отсутствуют недостатки известных вакцин против гриппа, в том числе отрицательное влияние высокого соотношения носителя к антигену и высокого соотношения адъюванта к антигену. Вакцина настоящего изобретения содержит полипептид, содержащий многократное число копий многократное число копий пептидных эпитопов вируса гриппа, обеспечивая разнообразную и высокой плотности вакцину. В соответствии с настоящим изобретением полимерный мультиэпитопный полипептид может быть получен рекомбинантными технологиями в виде выделенного полипептида или в виде слитого белка, или синтетически путем связывания большого числа синтетических пептидов, или может быть смешан или находиться в смеси с внешним адъювантом. Полимерные полипептиды настоящего изобретения содержат комбинацию В-клеточных эпитопов,Т-хелперных эпитопов и эпитопов цитотоксических лимфоцитов (CTL) вируса гриппа. Эпитопы предпочтительно выбирают из пептидов гемагглютинина (НА), пептидов белка матрикса (M1 и М 2) и пептидов нуклеопротеина (NP). Эпитопы обладают наглядной активностью перекрестной защиты против нескольких подтипов гриппа человека и их выбирают на основании их улучшенной способности индуцировать клеточный и гуморальный иммунный ответ. Неожиданно было обнаружено, что некоторые полимерные полипептиды настоящего изобретения активны для создания иммунного ответа, даже не связываясь с белком-носителем или не входя в состав белка-носителя. Более того, вследствие высокой плотности и вариабельности иммуногенных эпитопов,расположенных на полипептиде, вакцина вызывает сильный иммунный ответ даже в отсутствии адъюванта. Кроме того, введение большого числа различных иммуногенных эпитопов в один полипептид облегчает способы получения и контроль качества. Согласно первому аспекту настоящее изобретение относится к синтетическому или рекомбинантному полипептиду, содержащему множество пептидных эпитопов вируса гриппа, при этом каждый эпитоп представлен по меньшей мере дважды в одном полипептиде. В контексте настоящего изобретения под термином "полимерный" полипептид понимают полипептид, который содержит многократное число повторов (по меньшей мере два, как правило, по меньшей мере три или больше), необязательно расположенных рядом, в аминокислотной цепи полипептида. Термин "полимерный мультиэпитоп" поэтому относится к полипептиду, содержащему многократное число повторов множества эпитопов. В соответствии с данным аспектом настоящее изобретение относится к синтетическому или рекомбинантному мультиэпитопному полипептиду гриппа, содержащему многократное число копий множества пептидных эпитопов вируса гриппа, расположенных в чередующейся последовательной полимерной структуре или структуре блок-сополимера Синтетический или рекомбинантный мультиэпитопный полипептид гриппа настоящего изобретения выбран из группы, состоящей из: где В представляет собой необязательную последовательность из 1-4 аминокислотных остатков; n в каждом случае независимо равно целому числу 2-50; m равно целому числу 3-50; каждый из представляет собой пептидный эпитоп гриппа, состоящий из 4-24 аминокислотных остатков; Z в каждом случае представляет собой связь или спейсер из 1-4 аминокислотных остатков; и где максимальное число аминокислотных остатков в полипептиде составляет примерно 1000. В соответствии с некоторыми вариантами осуществления n в каждом случае независимо равно целому числу 2-50; m равно целому числу 3-15; каждое из X1-Xm представляет собой пептидный эпитоп гриппа, выбранный из группы, состоящей из эпитопа В-клеточного типа, эпитопа Т-хелперного (Th) типа и эпитопа для цитотоксических лимфоцитов (CTL), состоящий из 4-24 аминокислотных остатков; и максимальное число аминокислотных остатков в полипептиде составляет примерно 600. В соответствии с другими вариантами осуществления пептидные эпитопы гриппа выбраны из группы, состоящей из пептида гемагглютинина (НА), пептида M1, пептида М 2 и пептида нуклеопротеина(NP). В соответствии с некоторыми конкретными вариантами осуществления m равно 9 и n равно целому числу 3-5. В соответствии с другими вариантами осуществления пептидные эпитопы гриппа выбраны из группы, состоящей из последовательностей от SEQ ID NO:1 до SEQ ID NO:82. В соответствии с некоторыми конкретными вариантами осуществления пептидные эпитопы гриппа выбраны из эпитопов Е 1-Е 9 согласно табл. 1. В соответствии с более специфическими вариантами осуществления пептидные эпитопы гриппа состоят из НА 354-372 (E1, SEQ ID NO:82), НА 91-108 (Е 2, SEQ ID NO:48), M1 2-12 (Е 3, SEQ ID NO:25),НА 150-159 (Е 4, SEQ ID NO:52), НА 143-149 (E5, SEQ ID NO:51), NP 206-229 (E6, SEQ ID NO:64), HA 307-319 (E7, SEQ ID NO:59), NP 335-350 (E8, SEQ ID NO:69) и NP 380-393 (E9, SEQ ID NO:70). В соответствии с еще одним вариантом осуществления полипептидная последовательность выбрана из группы, состоящей из SEQ ID NO:84, SEQ ID NO:86 и SEQ ID NO:88. В соответствии с некоторыми вариантами осуществления полипептид содержит девять различных пептидных эпитопов вируса гриппа, расположенных в следующей чередующейся последовательной полимерной структуре [Е 1 Е 2 Е 3 Е 4 Е 5 Е 6 Е 7 Е 8 Е 9]n, где n равно 3 или 5; Е 1 представляет собой НА 354-372(SEQ ID NO:82), Е 2 представляет собой НА 91-108 (SEQ ID NO:48), Е 3 представляет собой M1 2-12 (SEQID NO:25), Е 4 представляет собой НА 150-159 (SEQ ID NO:52), Е 5 представляет собой НА 143-149 (SEQID NO:51), Е 6 представляет собой NP 206-229 (SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQID NO:70). В соответствии с другими вариантами осуществления полипептид содержит три повтора девяти различных пептидных эпитопов вируса гриппа, расположенных в следующей структуре блоксополимера [Е 1 Е 1 Е 1-Е 2 Е 2 Е 2-Е 3 Е 3 Е 3-Е 4 Е 4 Е 4-Е 5 Е 5 Е 5-Е 6 Е 6 Е 6-Е 7 Е 7 Е 7-Е 8 Е 8 Е 8-Е 9 Е 9 Е 9], где E1 представляет собой НА 354-372 (SEQ ID NO:82), Е 2 представляет собой НА 91-108 (SEQ ID NO:48), Е 3 представляет собой M1 2-12 (SEQ ID NO:25), Е 4 представляет собой НА 150-159 (SEQ ID NO:52), Е 5 представляет собой НА 143-149 (SEQ ID NO:51), Е 6 представляет собой NP 206-229 (SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQ ID NO:59), Е 8 представляет собой NP 335-350 (SEQ ID NO:69) и Е 9 представляет собой NP 380-393 (SEQ ID NO:70). В соответствии с еще одним вариантом осуществления полипептид содержит шесть повторов пяти различных пептидных эпитопов вируса гриппа В-клеточного типа, расположенных в следующей чередующейся последовательной полимерной структуре [Е 1 Е 2 Е 3 Е 4 Е 5]6, где Е 1 представляет собой НА 354372 (SEQ ID NO:82), Е 2 представляет собой НА 91-108 (SEQ ID NO:48), Е 3 представляет собой M1 2-12(SEQ ID NO:25), E4 представляет собой НА 150-159 (SEQ ID NO:52), Е 5 представляет собой НА 143-149(SEQ ID NO:51). В соответствии с другими вариантами осуществления полипептид содержит шесть повторов четырех различных пептидных эпитопов вируса гриппа Т-клеточного типа, расположенных в следующей чередующейся последовательной полимерной структуре [Е 7 Е 8 Е 9 Е 6]6, где Е 6 представляет собой NP 206229 (SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQ ID NO:59), Е 8 представляет собой NP 335350 (SEQ ID NO:69) и Е 9 представляет собой NP 380-393 (SEQ ID NO:70). В соответствии с еще одним вариантом осуществления полипептид содержит четыре повтора четырех различных пептидных эпитопов вируса гриппа Т-клеточного типа, расположенных в следующей чередующейся последовательной полимерной структуре [Е 7 Е 8 Е 9 Е 6]n, где n равно 6 и где Е 6 представляет собой NP 206-229 (SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQ ID NO:59), Е 8 представляет собой NP 335-350 (SEQ ID NO:69) и Е 9 представляет собой NP 380-393 (SEQ ID NO:70), и где указанный полимерный полипептид слит с белком-носителем. В соответствии с дополнительным вариантом осуществления полипептид содержит шесть повторов девяти различных пептидных эпитопов вируса гриппа, расположенных в следующей структуре блоксополимера[Е 2 Е 2 Е 2 Е 2 Е 2 Е 2-Е 1 Е 1 Е 1 Е 1 Е 1 Е 1-Е 3 Е 3 Е 3 Е 3 Е 3 Е 3-Е 4 Е 4 Е 4 Е 4 Е 4 Е 4-Е 5 Е 5 Е 5 Е 5 Е 5 Е 5 Е 6 Е 6 Е 6 Е 6 Е 6 Е 6-Е 7 Е 7 Е 7 Е 7 Е 7 Е 7-Е 8 Е 8 Е 8 Е 8 Е 8 Е 8-Е 9 Е 9 Е 9 Е 9 Е 9 Е 9], где Е 1 представляет собой НА 354-372(SEQ ID NO:82), Е 2 представляет собой НА 91-108 (SEQ ID NO:48), Е 3 представляет собой M1 2-12 (SEQID NO:25), Е 4 представляет собой НА 150-159 (SEQ ID NO:52), Е 5 представляет собой НА 143-149 (SEQID NO:51), Е 6 представляет собой NP 206-229 (SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQID NO:70). В различных вариантах осуществления полипептид содержит по меньшей мере два повтора каждого эпитопа, как правило, по меньшей мере три повтора каждого эпитопа, альтернативно, по меньшей мере четыре повтора, альтернативно, по меньшей мере пять повторов, альтернативно, по меньшей мере шесть повторов каждого эпитопа, максимально по меньшей мере 50 повторов каждого эпитопа. Для улучшения экспозиции эпитопов в иммунной системе эпитопы предпочтительно разделяют спейсером,который в соответствии с некоторыми вариантами осуществления состоит из единственной аминокислоты и в соответствии с другими вариантами осуществления содержит по меньшей мере одну аминокислоту или представляет собой пептид. Предпочтительно спейсер состоит из 1-4 нейтральных аминокислотных остатков. В соответствии с конкретными вариантами осуществления синтетический или рекомбинантный мультиэпитопный полипептид гриппа состоит из многократного числа копий множества пептидных эпитопов вируса гриппа, расположенных в чередующейся последовательной полимерной структуре или в структуре блок-сополимера В некоторых вариантах осуществления настоящего изобретения полимерный мультиэпитопный полипептид содержит по меньшей мере два пептидных эпитопа гриппа, причем по меньшей мере один эпитоп выбран из группы, состоящей из эпитопов В-клеточного типа, эпитопов Т-хелперного (Th) типа и эпитопов для цитотоксических лимфоцитов (CTL). В некоторых вариантах осуществления пептидные эпитопы гриппа выбраны из группы, состоящей из пептидных эпитопов гемагглютинина (НА), пептидных эпитопов белка матрикса (M1 или М 2) и пептидных эпитопов нуклеопротеина (NP). В некоторых предпочтительных вариантах осуществления пептидные эпитопы выбраны из группы, состоящей из эпитопов Е 1-Е 9 в соответствии с табл. 1. Предлагаются различные примеры вариантов осуществления, содержащие эпитопы, выбранные из табл. 1, в которых число повторов для каждого эпитопа является одинаковым или различным, и где полипептид может быть расположен в чередующейся последовательной полимерной структуре или структуре блок-сополимера. Под термином "чередующаяся последовательная полимерная" структура понимают, что одна копия всех эпитопов, содержащихся в полипептиде, располагается последовательно и такое расположение повторяется последовательно столько раз, сколько имеется повторов. Например,если полимерный мультиэпитопный полипептид содержит четыре повтора трех эпитопов X1, X2 и Х 3 в чередующейся последовательной структуре, то полипептид имеет следующую полимерную структуру: также записываемую как Под термином структура "блоксополимера" понимают, что все копии одного эпитопа, содержащиеся в полилептиде, располагаются рядом. Например, аналогичный полимерный мультиэпитопный полипептид, содержащий четыре повтора трех эпитопов X1, X2 и Х 3 в структуре блок-сополимера, имеет следующую полимерную структуру: также записываемую как В соответствии с некоторыми вариантами осуществления по меньшей мере одна аминокислота спейсера индуцирует специфическую конформацию на сегменте полипептида (например, пролиновый остаток). В соответствии с еще одним вариантом осуществления спейсер содержит расщепляемую последовательность. В соответствии с одним из вариантов осуществления расщепляемый спейсер расщепляется внутриклеточными ферментами. В соответствии с более конкретным вариантом осуществления расщепляемый спейсер содержит расщепляемую последовательность, специфичную для протеазы. В соответствии с некоторыми вариантами осуществления полимерный полипептид предпочтительно не конъюгирован с белком-носителем и лишен слитого белка-носителя. В других вариантах осуществления полипептиды настоящего изобретения могут также содержать последовательность носителя, т.е. пептидные эпитопы встраивают в последовательность полипептида носителя или соединяют с последовательностью носителя. В соответствии с некоторыми вариантами осуществления полимерные полипептиды продуцируют в виде рекомбинантного слитого белка, содержащего последовательность носителя. В некоторых конкретных вариантах осуществления последовательность носителя представляет собой бактериальный флагеллин или его часть. В некоторых вариантах осуществления мультиэпитопный полипептид встраивают в гипервариабельную область флагеллина, таким образом, образуя рекомбинантный слитый с флагеллином белок, содержащий полимерный мультиэпитопный полипептид. В других вариантах осуществления полипептид сливают саминоконцевой или карбоксиконцевой частью белка-носителя. Настоящее изобретение относится в еще одном аспекте к последовательностям выделенного полинуклеотида, кодирующим мультиэпитопные полипептиды гриппа. В соответствии с некоторыми вариантами осуществления последовательности выделенного полинуклеотида кодируют полипептидную последовательность, выбранную из группы, состоящей из SEQ IDNO:84, SEQ ID NO:86 и SEQ ID NO:88. В соответствии с конкретными вариантами осуществления последовательности выделенного полинуклеотида содержат последовательность, выбранную из группы, состоящей из SEQ ID NO:83, SEQ IDNO:85 и SEQ ID NO:87. В еще одном аспекте настоящее изобретение относится к вакцинным композициям для иммунизации индивидуума против гриппа, содержащим по меньшей мере один синтетический или рекомбинантный мультиэпитопный полипептид гриппа, содержащий многократное число копий множества пептидных эпитопов вируса гриппа, расположенных в чередующейся последовательной полимерной структуре или структуре блок-сополимера В соответствии с некоторыми вариантами осуществления вакцинная композиция содержит по меньшей мере два таких полипептида. В соответствии с некоторыми вариантами осуществления вакцина содержит два полипептида, где первый полипептид содержит множество пептидных эпитопов вируса гриппа В-клеточного типа, а второй полипептид содержит множество пептидных эпитопов вируса гриппа Т-клеточного типа. В соответствии с конкретным вариантом осуществления первый полипептид представляет собой полипептид структуры [Е 1 Е 2 Е 3 Е 4 Е 5]6, где Е 1 представляет собой НА 354-372 (SEQ IDNO:82), Е 2 представляет собой НА 91-108 (SEQ ID NO:48), Е 3 представляет собой M1 2-12 (SEQ IDNO:25), Е 4 представляет собой НА 150-159 (SEQ ID NO:52), Е 5 представляет собой НА 143-149 (SEQ IDNO:51); и второй полипептид представляет собой полипептид [Е 7 Е 8 Е 9 Е 6]6, где Е 6 представляет собойNP 206-229 (SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQ ID NO:59), Е 8 представляет собой(SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQ ID NO:59), Е 8 представляет собой NP 335-350(SEQ ID NO:69) и Е 9 представляет собой NP 380-393 (SEQ ID NO:70). В еще одном аспекте настоящее изобретение относится к вакцине для иммунизации индивидуума,содержащей полимерный мультиэпитопный полипептид, содержащий множество пептидных эпитопов вируса гриппа. В некоторых вариантах осуществления вакцина содержит по меньшей мере три повтора каждого эпитопа, альтернативно по меньшей мере четыре повтора, альтернативно по меньшей мере пять повторов, альтернативно по меньшей мере шесть повторов каждого эпитопа. В некоторых вариантах осуществления эпитопы разделены спейсером, который может представлять собой одну аминокислоту или пептид по меньшей мере из двух аминокислот. В некоторых вариантах осуществления вакцина содержит по меньшей мере два пептидных эпитопа гриппа, где по меньшей мере один эпитоп выбран из группы, состоящей из эпитопов В-клеточного типа,эпитопов Т-хелперного (Th) типа и эпитопов типа CTL. В некоторых вариантах осуществления пептидные эпитопы гриппа выбраны из группы, состоящей из пептидных эпитопов гемагглютинина (НА), пептидных эпитопов M1, пептидных эпитопов М 2 и пептидных эпитопов NP. В предпочтительных вариантах осуществления пептидные эпитопы выбраны из группы, состоящей из эпитопов Е 1-Е 9 по табл. 1 выше. В одном из вариантов осуществления вакцина содержит три повтора девяти эпитопов Е 1-Е 9, расположенных согласно чередующейся последовательной полимерной структуре В еще одном варианте осуществления вакцина содержит пять повторов девяти эпитопов, расположенных согласно чередующейся последовательной полимерной структуре В еще одном варианте осуществления вакцина содержит три повтора девяти эпитопов,расположенных согласно структуре блоксополимера В еще одном варианте осуществления вакцина содержит шесть повторов девяти эпитопов, расположенных согласно структуре блоксополимера Другой аспект настоящего изобретения относится к вакцине против гриппа, содержащей смесь полимерных мультиэпитопных полипептидов, в которой первый полипептид содержит множество пептидных эпитопов вируса гриппа В-клеточного типа, и второй полипептид содержит множество пептидных эпитопов вируса гриппа Т-клеточного типа. Каждый мультиэпитопный полипептид может быть частью белка, слитого с белком-носителем. В соответствии с некоторыми вариантами осуществления вакцинные композиции настоящего изобретения не содержат адъюванта. В соответствии с другими вариантами осуществления вакцина дополнительно содержит адъювант. Фармацевтически приемлемые адъюванты включают, но не ограничиваясь ими, эмульсию вода в масле, липидную эмульсию и липосомы. В соответствии с конкретными вариантами осуществления адъювант выбран из группы, состоящей из монтанида, квасцов, мурамилдипептида, гелвакас, микро-6 017887 частиц хитина, хитозана, субъединиц В холерного токсина, интралипида и липофундина. В предпочтительном на сегодняшний день варианте осуществления адъювант представляет собой монтанид. В некоторых вариантах осуществления вакцину смешивают для внутримышечной, интраназальной,пероральной, внутрибрюшной, подкожной, местной, в кожу и чрезкожной доставки. В некоторых вариантах осуществления вакцину вводят интраназально. В других вариантах осуществления вакцину вводят внутримышечно. В еще одних вариантах осуществления вакцину вводят в кожу. Настоящее изобретение относится в одном из вариантов осуществления к способу индукции иммунного ответа и создания защиты против гриппа у индивидуума, включающему введение индивидууму вакцинной композиции, содержащей по меньшей мере один синтетический или рекомбинантный мультиэпитопный полипептид гриппа, содержащий многократное число копий множества пептидных эпитопов вируса гриппа, расположенных в чередующейся последовательной полимерной структуре или структуре блок-сополимера Способ введения вакцины выбран из внутримышечной, интраназальной, пероральной, внутрибрюшной, подкожной, местной, в кожу и чрезкожной доставки. В предпочтительных вариантах осуществления вакцину вводят интраназально, внутримышечно или в кожу. Настоящее изобретение относится также к применению полипептида настоящего изобретения для получения вакцинной композиции для иммунизации против гриппа, а также применению выделенного полинуклеотида настоящего изобретения для получения полинуклеотида. Все полимерные полипептиды, описанные в настоящем изобретении, могут быть получены в виде рекомбинантного белка, слитого белка и путем химического синтеза. Соответственно, в другом аспектенастоящее изобретение относится к рекомбинантному белку, содержащему полимерный мультиэпитопный полипептид, содержащий множество пептидных эпитопов вируса гриппа. В некоторых вариантах осуществления полипептид встраивают в гипервариабельную область бактериального флагеллина. В другом аспекте настоящее изобретение относится к слитому белку, содержащему по меньшей мере один полимерный мультиэпитопный полипептид и по меньшей мере один дополнительный полипептид. В некоторых вариантах осуществления полипептид слит с бактериальным флагеллином или его частью. В конкретном варианте осуществления полипептид, содержащий шесть повторов девяти эпитопов,расположенных согласно структуре блок-сополимера сливают с бактериальным флагеллином или его частью. В другом аспекте настоящее изобретение относится к синтетическому полимерному полипептиду,содержащему множество синтетических пептидных эпитопов, соединенных спейсером, выбранным из группы, состоящей из простой связи, аминокислоты и пептида, содержащего по меньшей мере две аминокислоты. Настоящее изобретение также относится к синтетическим полимерным полипептидам для иммунизации против гриппа. Дополнительные варианты осуществления и полный объем применимости настоящего изобретения станут понятны из подробного описания, приведенного ниже. Тем не менее, следует понимать, что подробное описание и конкретные примеры, указывающие на предпочтительные варианты осуществления изобретения, приведены только с целью иллюстрации, и специалисту в данной области будет очевидно,что могут быть осуществлены изменения и модификации, не отходя от существа и объема настоящего изобретения. Краткое описание фигур На фиг. 1 А и 1 В представлен полимерный полипептид, содержащий пять повторов девяти пептидных эпитопов гриппа, расположенных в чередующейся последовательной полимерной структуре:(SEQ ID NO:83) конструкции, использованной для получения полимерного полипептида; (В) аминокислотная последовательность (SEQ ID NO:84) полимерного полипептида, кодируемая нуклеотидной последовательностью А. Эпитопы в первой последовательности из девяти эпитопов подчеркнуты. На фиг. 2 А и 2 В представлен полимерный полипептид, содержащий три повтора девяти пептидных эпитопов гриппа,расположенных в структуре блок-сополимера:ID NO:85) конструкции, использованной для получения полипептида. (В) Аминокислотная последовательность (SEQ ID NO:86) полимерного полипептида. Три повтора первого эпитопа подчеркнуты. На фиг. 3 А и 3 В представлен полимерный полипептид, содержащий три повтора девяти пептидных эпитопов гриппа, расположенных в чередующейся последовательной полимерной структуре:(SEQ ID NO:87) конструкции, использованной для получения полипептида. (В) Аминокислотная после-7 017887 довательность (SEQ ID NO:88) полимерного полипептида. Эпитопы в первой последовательности из девяти эпитопов подчеркнуты. На фиг. 4 показан клеточный иммунный ответ на некоторые штаммы вирусов гриппа мышей, вакцинированных двумя полимерными вакцинами: 11 и 14. Измеряли клеточный иммунный ответ для двух различных концентраций стимулирующего вируса, он представлен в виде индекса пролиферации лимфоцитов, инкубированных со стимулирующим вирусом. На фиг. 5 показан защитный эффект полимерной вакцины 14 против высоколетальной дозы штамма вируса гриппа H3N2, адаптированного для мышей (A/Texas/1/77). Защитный эффект вакцины показан через существенное снижение титра вируса в легких вакцинированных мышей по сравнению с контрольными мышами (PBS). На фиг. 6 А и 6 В показана эффективность нескольких полимерных вакцин у мышей, защищенных от заражения вирусом. Защитный эффект полимерной вакцины 11, 12 и 14 показан более высокой степенью выживания (фиг. 6 А) вакцинированных мышей по сравнению с контрольными (PBS) мышами после инфицирования летальной дозой штамма вируса гриппа H3N2, адаптированного к мышам(A/Texas/1/77), и посредством существенно меньшей вирусной нагрузки в легких (фиг. 6 В) вакцинированных мышей по сравнению с контрольными (50% Gly/PBS) мышами. На фиг. 7 сравнивается эффективность иммунизации мышей несколькими вакцинами, содержащими полимерные конструкции в 50% глицерине в PBS (11, 12 и 14) или в эмульсии с неполным адъювантом Фрейнда (11-IFA, 12-IFA и 14-IFA). Защитное влияние различных вакцин и влияние IFA измеряют посредством степени выживаемости вакцинированных мышей по сравнению с контрольными мышами после инфицирования штаммом вируса гриппа H3N2, адаптированным к мыши (A/Texas/1/77). Подробное описание изобретения Настоящее изобретение относится к полимерным мультиэпитопным полипептидам и вакцинам на основе таких полипептидов, содержащим множество пептидных эпитопов вируса гриппа. Полипептид настоящего изобретения содержит по меньшей мере два повтора каждого эпитопа. Предпочтительно полипептид настоящего изобретения содержит по меньшей мере три повтора каждого эпитопа. Настоящее изобретение также относится к вакцинам на основе таких полипептидов и способам их применения. Пептидные эпитопы, полученные из белков гриппа, можно использовать для получения вакцин против гриппа. Тем не менее, каждый пептид сам по себе почти не различим для иммунной системы,быстро разрушается и вызывает недостаточный иммунный ответ. Если иммунной системе представляется многократное число копий иммуногенных пептидов в виде единичного полипептида, то величина эпитоп-специфического иммунного ответа возрастает. Например, вакцины на основе рекомбинантного белка, слитого с флагеллином, содержащие одну копию одного пептидного эпитопа гриппа, обеспечивают соотношение эпитоп/флагеллин примерно 1:28. Используя мультиэпитопные вакцины, содержащие множество эпитопов в нескольких копиях каждого, можно получить соотношение эпитоп/флагеллин вплоть до 2:1. В настоящем изобретении описаны полимерные мультиэпитопные полипептиды с усиленной иммуногенностью по сравнению с известными конструкциями и конфигурациями. Каждый полипептид содержит множество эпитопов, где каждый эпитоп повторяется многократным числом копий. Многократное число копий или повторов каждого эпитопа могут быть прилегающими в виде блока каждого эпитопа. Альтернативно, множество эпитопов могут находиться в заранее определенной последовательности, где данная последовательность повторяется многократно в полипептиде. В настоящее время показано, что оба таких типа конфигураций множества эпитопов дают неожиданно высокие результаты при создании иммунитета против гриппа у индивидуума. Определения. Для удобства описываются некоторые термины, использованные в описании, примерах и пунктах формулы изобретения. Под термином "презентация антигена" понимают экспрессию антигена на поверхности клетки в ассоциации с молекулами главного комплекса гистосовместимости класса I или класса II (MHC-I илиMHC-II) животных или с HLA-I и HLA-II людей. Под термином "иммуногенность" или "иммуногенный" понимают способность вещества стимулировать или вызывать иммунный ответ. Иммуногенность измеряют, например, определением наличия антител, специфичных для данного вещества. Наличие антител определяют способами, известными в данной области, например, используя анализ ELISA. Эпитопы гриппа могут быть классифицированы на В-клеточный тип, Т-клеточный тип или как на В-клеточный, так и Т-клеточный тип в зависимости от типа иммунного ответа, который они вызывают. Определение В-клеточного или Т-клеточного пептидного эпитопа не является однозначным, например,пептидный эпитоп может индуцировать продукцию антитела, но в то же время этот эпитоп может иметь последовательность, которая способна связываться с молекулой HLA человека, делая его доступным дляCTL, приводя в результате к двойственности классификации В-клеточного и Т-клеточного типа для такого конкретного эпитопа. "CTL", "T-клетки-киллеры" или "цитотоксические Т-клетки" представляют группу дифференцированных Т-клеток, которые распознают и лизируют клетки-мишени, несущие специфический чужеродный антиген, которые функционируют для защиты против вирусной инфекции и раковых клеток. "Т-хелперные клетки" или "Th" представляют собой любые Т-клетки, которые при стимуляции специфическим антигеном высвобождают цитокины, которые усиливают активацию и функционирование В-клеток и Т-клеток-киллеров. Под термином "рекомбинантный белок, слитый с флагеллином" понимают полипептид флагеллина,содержащий пептидный эпитоп или полимерный мультиэпитопный полипептид, встроенный в его последовательность, или альтернативно, часть полипептида флагеллина, слитую с пептидным эпитопом или полимерным мультиэпитопным полипептидом на его N- или С-конце. Как используется в данном описании, под термином "аминокислотная последовательность" понимают олигопептид, пептид, полипептид или последовательность белка и их фрагмент, и природные или синтетические молекулы. В описании и пунктах формулы изобретения под термином "спейсер" понимают любое химическое соединение, которое может присутствовать в полипептидной последовательности на одном из ее концов или между двумя эпитопами. Предпочтительно спейсер состоит из 1-4 аминокислотных остатков. Спейсер может содержать последовательность, которая может расщепляться ферментативным способом или может распадаться самопроизвольно. Спейсер может вызывать или индуцировать благоприятную конформацию в полипептиде. Спейсер может необязательно содержать последовательность, расщепляемую специфической протеазой. Пептидные эпитопы, используемые для получения вакцины. В соответствии с предпочтительным вариантом осуществления настоящего изобретения пептидные эпитопы получают из белков гриппа, выбранных из группы, состоящей из НА, M1, M2 и NP. Эпитопы также могут быть выбраны согласно их типу: В-клеточному типу, типу Th и типу CTL. Следует отметить, что пептидные эпитопы, перечисленные в данном описании, рассматриваются только в качестве примера. Белки вируса гриппа изменяются от изолята к изоляту, создавая, таким образом, множество вариантов последовательности для каждого белка гриппа. Соответственно настоящее изобретение охватывает пептидные эпитопы, имеющие одну или несколько аминокислотных замен, добавлений или делеций. Белок матрикса M1 представляет собой основной структурный компонент вирусных частиц гриппа и образует внутренний слой липидной оболочки клеточного происхождения. Внутри вириона и в инфицированных клетках на поздних стадиях вирусной репликации белок M1 связывается с вирусными рибонуклеопротеинами (vRNP), которые состоят из молекул вирусной РНК, многократного числа копий нуклеопротеинов и трех субъединиц вирусной полимеразы, удерживающих концы вирусных РНК. Под Nконцевым доменом M1 понимают аминокислоты белка M1 с 1 до примерно 20 аминокислот. Белок матрикса М 2 представляет собой водородный ионный канал, приводящий к диссоциации комплекса матрикса и нуклеопротеина в вакуолях. Этот ионный канал высвобождает геном, давая возможность вирусной РНК войти в ядро инфицированной клетки и инициировать вирусную репликацию. Терапевтические вещества против гриппа, такие как амантадин и римантадин, действуют путем блокирования активности М 2. Вирус гриппа В обладает белком-дубликатом, известным как NB; несмотря на то что не существует аналогии последовательностей между М 2 и NB, оба они представляют собой трансмембранные белки и могут выполнять одинаковую функцию. Внеклеточный домен белка М 2, который представляет собой трансмембранный белок вируса гриппа А, почти не имеет вариантов во всех штаммах гриппа А. Под N-концевым доменом М 2 понимают N-конец аминокислотной последовательности для трансмембранного домена. В табл. 2 представлен конкретный перечень пептидных эпитопов M1 и М 2, которые могут быть использованы для получения полимерных полипептидов настоящего изобретения. Таблица 2 Пептидные эпитопы M1 и М 2 Нуклеопротеин (NP) представляет собой одну из групп специфических антигенов, которые различаются между вирусами гриппа А, В и С. В отличие от НА NP высококонсервативен, сохраняясь на 94% во всех вирусах гриппа А. Антитело, специфичное против NP вируса гриппа А, не обладает активностью,нейтрализующей вирус, но NP является важной мишенью для цитотоксических Т-лимфоцитов (CTL),которые перекрестно реагируют со всеми вирусами типа A (Townsend, J. Exp Med 1984 160 (2):552-63).CTL распознают короткие синтетические пептиды, соответствующие линейным областям молекулы NP гриппа. Гемагглютинин (НА) представляет собой гликопротеиновый тример, включенный в оболочку гриппа. Он отвечает за прикрепление и проникновение вируса в клетку-хозяина. Антитела против НА нейтрализуют вирусную инфекцию. Антигенные варианты такой молекулы ответственны за частые вспышки гриппа и за неудовлетворительный контроль инфекции путем иммунизации (Ada and Jones, Curr TopMicrobial Immunol 1986; 128:1-54). РНК-полимераза вируса гриппа представляет собой гетерокомплекс, состоящий из трех белков полимеразы (Р); РВ 1, РВ 2 и РА, представленных в соотношении 1:1:1. Их роль в вирулентности гриппа полностью не выяснена. В табл. 3 перечислены примеры пептидных эпитопов НА, NP, PB1 и РВ 2, но не ограничиваясь ими. Химерные или рекомбинантные молекулы. Термины "химерный белок", "химерный полипептид" или "рекомбинантный белок" используются взаимозаменяемо и относятся к полимерному полипептиду гриппа, функционально связанному с полипептидом, отличным от полипептида, из которого получен пептидный эпитоп. Полимерные мультиэпитопные полипептиды настоящего изобретения могут быть получены экспрессией в экспрессирующем векторе per se или в виде химерного белка. Специалистам в данной области известны способы получения химерного или рекомбинантного белка, содержащего один или несколько пептидных эпитопов гриппа. Последовательность нуклеиновой кислоты, кодирующая один или несколько пептидных эпитопов гриппа, может быть встроена в экспрессирующий вектор для получения полинуклеотидной конструкции для размножения и экспрессии в клетках-хозяевах. Конструкция нуклеиновой кислоты, кодирующей полипептид, содержащий многократное число повторов нескольких эпитопов, такой как полимерный мультиэпитопный полипептид, может быть получена лигированием более мелких полинуклеотидных конструкций, несущих подходящие сайты рестрикции на своих 3' и 5' концах. В одном из неограничивающих примеров полипептид настоящего изобретения включает химеры пептидного эпитопа гриппа с одним из следующих полипептидов: флагеллином, холерным токсином,столбнячным токсином, овальбумином, белком теплового шока М. tuberculosis, дифтерийным анатоксином, белком G респираторно-синцитиального вируса, белком внешней мембраны Neisseria meningitides,нуклеопротеином вируса везикулярного, стоматита, гликопротеином вируса везикулярного стоматита,богатым глутаматом белком антигена Plasmodium falciparum, поверхностным белком 3 мерозоита или белком оболочки вирусов. Под терминами "экспрессирующий вектор" и "рекомбинантный экспрессирующий вектор", как использовано в данном описании, понимают молекулу ДНК, например, плазмиды, флагеллина или вируса,содержащую желаемые и подходящие последовательности нуклеиновой кислоты, необходимые для экспрессии рекомбинантных пептидных эпитопов, для экспрессии в конкретной клетке-хозяине. Как используется в данном описании, "функционально связанный" относится к функциональной связи по меньшей мере двух последовательностей. "Функционально связанный" включает связь между промотором и второй последовательностью, например нуклеиновой кислотой настоящего изобретения, где последовательность промотора инициирует и опосредует транскрипцию последовательности ДНК, соот- 11017887 ветствующей второй последовательности. Регуляторные области, необходимые для транскрипции пептидных эпитопов, могут быть обеспечены экспрессирующим вектором. Точная природа регуляторных областей, необходимых для генной экспрессии, может изменяться между векторами и клетками-хозяевами. Как правило, требуется промотор,который способен связываться с РНК-полимеразой и усиливать транскрипцию функциональносвязанной последовательности нуклеиновой кислоты. К регуляторным областям могут относиться 5'некодирующие последовательности, вовлеченные в инициацию транскрипции и трансляции, такие какTATA бокс, кэппинг-последовательность, последовательность СААТ и подобные. Некодирующая область 3' для кодирующей последовательности может содержать последовательности, регулирующие терминацию транскрипции, такие как терминаторы и сайты полиаденилирования. Также может быть создан кодон инициации трансляции (ATG). Для клонирования последовательностей нуклеиновых кислот в сайт клонирования вектора в процессе синтеза нуклеиновых кислот добавляют линкеры или адапторы, создающие подходящие совместимые сайты рестрикции. Например, желаемый сайт для рестриктазы может быть встроен во фрагмент ДНК амплификацией ДНК, используя ПЦР с праймерами, содержащими желаемый сайт рестрикции фермента. Экспрессирующая конструкция, содержащая последовательность пептидного эпитопа, функционально связанную с регуляторными областями, может быть непосредственно встроена в подходящие клетки-хозяева для экспрессии и получения полимерного мультиэпитопного полипептида как такового или в виде рекомбинантных слитых белков. Экспрессирующие векторы, которые могут быть использованы, включают, но не ограничиваясь ими, плазмиды, космиды, фаг, фагемиды, флагеллин или модифицированные вирусы. Как правило, такие экспрессирующие векторы содержат функциональный источник репликации для размножения вектора в подходящей клетке-хозяине, один или несколько сайтов рестрикции для эндонуклеазы для встраивания желаемой генной последовательности, и один или несколько маркеров для отбора. Рекомбинантная полинуклеотидная конструкция, содержащая экспрессирующий вектор и полимерный полипептид, затем должна быть перенесена в бактериальную клетку-хозяина, где она может реплицироваться и быть экспрессированной. Это может быть осуществлено способами, известными в данной области. Экспрессирующий вектор используют с совместимой прокариотической или эукариотической клеткой-хозяином, которая может быть получена из бактерий, дрожжей, насекомых, млекопитающих и людей. Согласно одному из примеров, но без ограничений, экспрессирующий вектор представляет собой флагеллиновый вектор, например, описанный в патенте США 6130082. В соответствии с другим конкретным вариантом осуществления плазмидный вектор содержит ген флагеллина fliC с уникальными сайтами рестрикции, в гипервариабельную область которого встраивают полимерный полипептид, и рекомбинантный слитый с флагеллином белок, содержащий мультиэпитопный полипептид, экспрессируют в безжгутиковой мутантной сальмонелле или Е.coli. Клетки-хозяева, которые экспрессируют рекомбинантный слитый с флагеллином белок, могут находиться в смеси в виде живых вакцин. Получение полимерного полипептида. Один раз экспрессированный клеткой-хозяином полимерный полипептид может быть отделен от нежелательных компонентов многими способами очистки белка. В одном из таких способов используют полигистидиновый хвост на рекомбинантном белке. Полигистидиновый хвост состоит по меньшей мере из шести гистидиновых (His) остатков, добавленных к рекомбинантному белку часто на N- или С-конце. Полигистидиновые хвосты часто используют для аффинной очистки рекомбинантных белков, меченных полигистидином, которые экспрессируются в Е.coli или других прокариотических экспрессирующих системах. Бактериальные клетки собирают центрифугированием, и полученный клеточный осадок может быть лизирован физическими способами или с помощью детергентов или ферментов, таких как лизозим. Неочищенный лизат на данной стадии содержит рекомбинантный белок среди некоторых других белков,полученных из бактерий, и его инкубируют с аффинными средами, такими как NTA-агароза, смола HisPur или смола Talon. Такие аффинные среды содержат связанные ионы металлов, либо никеля, либо кобальта, с которыми связывается полигистидиновый хвост с микромолярной аффинностью. Смолу затем промывают фосфатным буфером для удаления белков, которые специфически не взаимодействуют с ионом кобальта или никеля. Эффективность промывки может быть улучшена добавлением имидазола при концентрации 20 мМ, и белки затем обычно элюируют имидазолом при концентрации 150-300 мМ. Полигистидиновый хвост может быть затем удален, используя рестриктазы, эндопротеазы или экзопротеазы. Наборы для очистки белков, меченных гистидином, могут быть приобретены, например, у фирмыQiagen. Другой способ осуществляют через продукцию телец включения, которые представляют собой неактивные агрегаты белка, которые могут образовываться, если рекомбинантный полипептид экспрессируют в прокариоте. Несмотря на то что кДНК может должным образом кодировать транслируемую мРНК, полученный белок может свернуться неправильно, или гидрофобность добавленных пептидных эпитопов может привести к получению рекомбинантного полипептида, который становится нераствори- 12017887 мым. Тельца включения легко очищают способами, хорошо известными в данной области. В данной области известны различные методики очистки телец включения. В некоторых вариантах осуществления тельца включения выделяют из бактериальных лизатов центрифугированием и промывают детергентами и хелирующими агентами для удаления как можно большего количества бактериального белка из агрегированного рекомбинантного белка. Для получения растворимого белка промытые тельца включения растворяют в денатурирующих агентах и высвобожденный белок затем повторно сворачивается за счет постепенного удаления денатурирующих реагентов разбавлением или диализом (как описано, например,в Molecular cloning: a laboratory manual, 3rd edition, Sambrook, J. and Russell, D.W., 2001; CSHL Press). Альтернативно, рекомбинантный слитый с флагеллином белок сохраняет способность образовывать интактный жгутик. В данной области известны различные методики очистки интактного жгутика. В одном из вариантов осуществления молекулы рекомбинантного флагеллина, экспрессируемые исходным флагеллин-дефицитным неподвижным штаммом бактерий, продуцируют функциональный жгутик. Препаративная форма вакцины. Вакцины настоящего изобретения содержат мультиэпитопный полипептид или рекомбинантный слитый белок, содержащий мультиэпитопный полипептид, и необязательно адъювант. Вакцина может быть составлена в композицию для введения одним из различных способов. В соответствии с одним из вариантов осуществления изобретения вакцину вводят интраназально. Составленная в композицию вакцина может быть применена на лимфатической ткани носа любым удобным способом. Тем не менее,предпочтительно применять ее в виде струи жидкости или жидких капель для стенок носового хода. Интраназальная композиция может быть смешана, например, в жидкой форме в виде капель, спрея для носа или форме, подходящей для ингаляции, в виде порошка, крема или эмульсии. Композиция может содержать различные добавки, такие как адъювант, эксципиент, стабилизаторы, буферы или консерванты. Для эффективного применения вакцинную композицию предпочтительно поставлять в емкости,подходящей для распространения полипептида или рекомбинантного слитого белка в виде капель для носа или аэрозоля. В некоторых предпочтительных вариантах осуществления вакцина составлена в композицию для доставки к слизистой оболочке, в частности, назальной доставки (Arnon et al., Biologicals. 2001; 29(3-4):237-42; Ben-Yedidia et al., Int Immunol. 1999; 11(7):1043-51). В другом варианте осуществления изобретения введением является пероральное введение, и вакцина может быть представлена, например, в виде таблетки или заключена в желатиновую капсулу или микрокапсулу. В еще одном варианте осуществления вакцина составлена в композицию для парентерального введения. В некоторых вариантах осуществления вакцина составлена в композицию для массовой инокуляции, например, для применения с помощью безыгольного шприца или одноразового картриджа. В соответствии с еще одним вариантом осуществления введением является внутримышечное введение. В соответствии с еще одним вариантом осуществления введение представляет собой введение в кожу. В данной области известны иглы, специально созданные для введения вакцины в кожу, как описано, например, среди прочих, в патентах США 6843781 и 7250036. В соответствии с другими вариантами осуществления введение осуществляют с помощью безыгольного шприца. Специалистам в данной области хорошо известны способы составления в композицию таких вакцин. Липосомы представляют другую систему доставки для доставки и презентации антигена. Липосомы представляют собой двухслойные пузырьки, составленные из фосфолипидов и других стеролов, окружающих обычно водный центр, где могут быть инкапсулированы антигены или другие продукты. Структура липосомы очень разнообразна со многими типами размера от нанометров до микрометров, от примерно 25 нм до примерно 500 мкм. Было обнаружено, что липосомы эффективны при доставке терапевтических средств к кожным и слизистым поверхностям. Липосомы могут быть дополнительно модифицированы для требуемой доставки, например, путем встраивания специфических антител в поверхностную мембрану, или изменены для инкапсулирования бактерий, вирусов или паразитов. Среднее время выживаемости или период полураспада интактной структуры липосомы может быть увеличен с помощью включения некоторых полимеров, например полиэтиленгликоля, что дает возможность продлить высвобождение in vivo. Липосомы могут быть однослойными или многослойными. Вакцинная композиция может быть составлена в композицию путем инкапсулирования антигена или комплекса антиген/адъювант в липосомах с образованием липосом-инкапсулированного антигена и смешивания липосом-инкапсулированного антигена с носителем, содержащим дисперсионную фазу гидрофобного вещества. Если на первой стадии не используют комплекс антиген/адъювант, то подходящий адъювант может быть добавлен к липосом-инкапсулированному антигену, к смеси липосоминкапсулированного антигена и носителя или к носителю перед смешиванием носителя с липосоминкапсулированным антигеном. Порядок проведения процесса может зависеть от типа используемого адъюванта. Как правило, при использовании адъюванта, подобно квасцам, для образования комплекса антиген/адъювант адъювант и антиген сначала смешивают с последующим инкапсулированием комплеса антиген/адъювант с помощью липосом. Полученный липосом-инкапсулированный антиген затем смешивают с носителем. Термин "липосом-инкапсулированный антиген" в зависимости от контекста может относиться к инкапсуляции только антигена или к инкапсуляции комплекса антиген/адъювант. Это усиливает близкий контакт между адъювантом и антигеном и может, по меньшей мере частично, объяснить иммунный ответ при использовании в качестве адъюванта квасцов. При использовании адъюванта, отличного от квасцов, антиген может быть сначала инкапсулирован в липосомы, и полученный липосоминкапсулированный антиген затем смешивают с адъювантом в гидрофобном веществе. При составлении вакцинной композиции, которая, по существу, не содержит воды, антиген или комплекс антиген/адъювант инкапсулируют с помощью липосом и смешивают с гидрофобным веществом. При составлении вакцины в эмульсии вода-в-гидрофобном веществе антиген или комплекс антиген/адъювант инкапсулируют с помощью липосом в водной среде, с последующим смешиванием водной среды с гидрофобным веществом. В случае эмульсии для поддержания гидрофобного вещества в постоянной фазе к гидрофобному веществу может быть добавлена водная среда, содержащая липосомы, в аликвотах при перемешивании. Во всех способах составления в композицию липосом-инкапсулированный антиген может быть лиофилизирован перед смешиванием с гидрофобным веществом или с водной средой в зависимости от конкретного случая. В некоторых случаях комплекс антиген/адъювант может быть инкапсулирован с помощью липосом, с последующей лиофилизацией. В других случаях антиген может быть инкапсулирован с помощью липосом, с последующим добавлением адъюванта, затем лиофилизацией, с образованием лиофилизованного липосом-инкапсулированного антигена с внешним адъювантом. В еще одном примере антиген может быть инкапсулирован с помощью липосом, с последующей лиофилизацией перед добавлением адъюванта. Лиофилизация может стимулировать лучшее взаимодействие между адъювантом и антигеном, приводя к получению более эффективной вакцины. Составление в композицию липосом-инкапсулированного антигена в смеси с гидрофобным веществом может также включать использование эмульгатора, способствующего более равномерному распределению липосом в гидрофобном веществе. В данной области хорошо известны конкретные эмульгаторы, и они включают маннидолеат (Arlacel А), лецитин, Tween 80, Spans 20, 80, 83 и 85. Эмульгатор используют в количестве, эффективном для содействия равномерному распределению липосом. Как правило, объемное соотношение (v/v) гидрофобного вещества к эмульгатору находится в диапазоне примерно от 5:1 до примерно 15:1. В микрочастицах и наночастицах используются небольшие биодеградируемые сферы, которые действуют в качестве депо для доставки вакцины. Основное преимущество таких полимерных микросфер над другими эффективными в отношении депонирования адъювантами заключается в их абсолютной безопасности, и они были одобрены Комиссией по применению пищевых продуктов и лекарственных средств в США для применения в медицинской практике на людях в качестве подходящего шовного материала и для применения в качестве биодеградируемойсистемы доставки лекарственных средств(Langer R. Science. 1990; 249 (4976):1527-33). Скорости гидролиза сополимеров очень хорошо изучены,что в свою очередь дает возможность производить микрочастицы с непрерывным высвобождением антигена в течение продолжительного периода времени (O'Hagen, et al., Vaccine. 1993; 11(9):965-9). Парентеральное введение микрочастиц вызывает длительно сохраняющийся иммунитет, особенно если в них заключены характеристики длительного высвобождения. Скорость высвобождения может модулироваться смесью полимеров и их относительными молекулярными массами, которые будут гидролизоваться в течение различных периодов времени. Не касаясь теории, нахождение в смеси различных по размеру частиц (от 1 до 200 мкм) также может приводить к длительно сохраняющимся иммунологическим ответам, поскольку большие частицы должны распасться до меньших частиц перед тем, как они станут доступны для поглощения макрофагом. Таким образом, однократно вводимая вакцина может быть разработана путем интеграции частиц различного размера, пролонгируя, тем самым, презентацию антигена и в значительной степени помогая продуцентам. В некоторых применениях адъювант или эксципиент могу быть включены в состав вакцины. Для применения на людях предпочтительны такие адъюванты, как, например, монтанид (неполный адъювант Фрейнда) и квасцы. Выбор адъюванта будет определяться в частности способом введения вакцины. Например, вакцинация без инъекции будет приводить к общему согласию и меньшим суммарным затратам. Предпочтительным способом введения является внутримышечное введение. Другим предпочтительным способом введения является интраназальное введение. Неограничивающие примеры интраназальных адъювантов включают порошок хитозана, микросферы PLA и PLG, QS-21, наночастицы фосфата кальция (САР) и mCTA/LTB (мутантный холерный токсин Е 112 К с пентамерной субъединицей В термолабильного энтеротоксина). Используемым адъювантом также может быть, теоретически, любой адъювант, известный при получении вакцин на основе пептидов или белков. Например, неорганические адъюванты в форме геля(гидроксид алюминия/фосфат алюминия, Warren et al., 1986; фосфат кальция, Relyvelt, 1986); бактериальные адъюванты, такие как монофосфорил липид A (Ribi, 1984; Baker et al., 1988) и мурамилпептиды(Ellouz et al., 1974; Allison and Byars, 1991; Waters et al., 1986); корпускулярные адъюванты, такие как так называемые ISCOMS ("иммуностимулирующие комплексы", Mowat and Donachie, 1991; Takahashi et al.,- 14017887Gregoriadis, 1990) и биодеградируемые микросферы (Marx et al., 1993); адъюванты на основе масляных эмульсий и эмульгаторов, такие как IFA ("неполный адъювант Фрейнда" (Stuart-Harris, 1969; Warren etal., 1986), SAF (Allison and Byars, 1991), сапонины (такие как QS-21; Newman et al., 1992), сквален/сквалан (Allison and Byars, 1991); синтетические адъюванты, такие как неионные блок-сополимеры(WO 97/30721). Адъюванты для применения с иммуногенами настоящего изобретения включают соли алюминия или кальция (например, соли гидроксиды или фосфаты). Особенно предпочтительным адъювантом для применения в настоящем изобретении является гель гидроксида алюминия, такой как Альгидрогель. Наночастицы фосфата кальция (САР) представляют собой адъювант, разработанный фирмой Biosante,Inc (Lincolnshire, Ill). Представляющий интерес иммуноген может либо покрывать частицы снаружи, либо быть инкапсулирован внутрь [Не et al. (November 2000), Clin. Diagn. Lab. Immunol., 7 (6):899-903]. Другой адъювант для применения с иммуногеном настоящего изобретения представляет собой эмульсию. Предполагаемая эмульсия может представлять собой эмульсию масло-в-воде или эмульсию вода-в-масле. Помимо частиц иммуногенного химерного белка такие эмульсии содержат масляную фазу сквалена, сквалана, арахисовое масло или подобное, что хорошо известно, и диспергирующий агент. Предпочтительны неионные диспергирующие агенты, и такие материалы включают сложные эфиры моно- и ди-С 12-С 24-жирных кислот сорбитана и маннида, такие как моностеарат сорбитана, моноолеат сорбитана и моноолеат маннида. Такие эмульсии представляют собой, например, эмульсии вода-в-масле, которые содержат сквален,глицерин и поверхностно-активное вещество, такое как моноолеат маннида (Arlacel А), необязательно со скваланом, эмульгированные с частицами химерного белка в водной фазе. Альтернативные компоненты масляной фазы включают альфа-токоферол, смесь цепей ди- и триглицеридов и сложные эфиры сорбитана. Хорошо известные примеры таких эмульсий включают Монтанид ISA-720 и Монтанид ISA 703 (Seppic, Castres, France). Другие адъюванты типа эмульсий масло-в-воде включают адъюванты, описанные в патентах WO 95/17210 и ЕР 0399843. В данном описании также рассматривается применение низкомолекулярных адъювантов. Один из типов низкомолекулярных адъювантов, использованных в данном описании, представляет собой производное 7-замещенного 8-оксо- или 8-сульфогуанозина, описанное в патенте США 4539205, патенте США 4643992, патенте США 5011828 и патенте США 5093318. Было показано, что в индукции антиген(иммуноген) специфического ответа особенно эффективен 7-аллил-8-оксогуанозин (локсорибин). К используемым адъювантам относятся монофосфорил липид А (MPL), 3-дезацилмонофосфорил липид A (3D-MPL), хорошо известный адъювант, доступный от фирмы Corixa Corp. Сиеттла, ранееRibi Immunochem, Hamilton, Mont. Адъювант содержит три компонента, экстрагированных из бактерий: монофосфорил липид (MPL) А, димиколат трегалозы (TDM) и скелет клеточной стенки (CWS)(MPL+TDM+CWS) в эмульсии 2% сквален/Tween 80. Такой адъювант может быть получен способами,описанными в GB 2122204 В. Другие соединения структурно связаны с адъювантом MPL и называются фосфатами аминоалкилглюказамида (AGP), такие как соединения, доступные от фирмы Corixa Corp под названием адъювантRC-529 триэтиламмониевая соль 2-[(R)-3-тетрадеканоилокситетрадеканоиламино]этил-2-дезокси-4-Oфосфоно-3-O-[(R)-3-тетрадеканоилокситетрадеканоил]-2-[(R)-3-тетрадеканоилокситетрадеканоиламино]p-D-глюкопиранозида. Адъювант RC-529 доступен в виде эмульсии сквалена, под названием RC-529SE,и в водном препарате, под названием RC-529AF, доступные от фирмы Corixa Corp. (см. патент США 6355257 и патент США 6303347; патент США 6113918 и публикацию США 03-0092643). Дополнительные предлагаемые адъюванты включают синтетические олигонуклеотидные адъюванты, содержащие нуклеотидный мотив CpG один или несколько раз (плюс фланкирующие последовательности), доступные от фирмы Coley Pharmaceutical Group. Адъювант, обозначаемый QS21, доступный от фирмы Aquila Biopharmaceuticals, Inc., представляет собой обладающие активностью адъюванта иммунологически активные фракции сапонина, полученного из коры дерева Quillaja Saponaria Molina, произрастающего в Южной Америке (например, Quil A), и способ их получения описан в патенте США 5057540. Также описаны производные Quil А, например, QS21 (производное Quil A, представляющее собой очищенную ВЭЖХ фракцию, также известное как QA21), и другие фракции, такие как QA17. Также могут быть использованы полусинтетические и синтетические производные сапонинов QuillajaSaponaria Molina, такие как описано в патенте США 5977081 и патенте США 6080725. Адъювант, обозначаемый MF59, доступный от фирмы Chiron Corp., описан в патенте США 5709879 и патенте США 6086901. Предлагаются также мурамилдипептидные адъюванты, которые включают N-ацетилмурамил-Lтреонил-D-изоглютамин (thur-MDP), N-ацетилнормурамил-L-аланил-D-изоглютамин [CGP 11637, обозначаемый nor-MDP] и N-ацетилмурамил-L-аланил-D-изоглютаминил-L-аланин-2-(1'-2'-дипальмитиол- 15017887 втор-н-глицеро-3-гидроксифосфорилокси)этиламин) [(CGP)1983A, обозначаемый МТР-РЕ]. Так называемые аналоги мурамилдипептида описаны в патенте США 4767842. Другие смеси адъювантов включают комбинации 3D-MPL и QS21 (ЕР 0671948 B1), эмульсии масло-в-воде, содержащие 3D-MPL и QS21 (WO 95/17210, РСТ/ЕР 98/05714), 3D-MPL, находящиеся в смеси с другими носителями (ЕР 0689454 B1), QS21, составленные в холестеринсодержащих липосомах(WO 96/33739), или иммуностимулирующие олигонуклеотиды (WO 96/02555). Адъговант SBAS2 (в настоящее время ASO2), доступный от фирмы SKB (в настоящее время Glaxo-SmithKline), содержит QS21,а также можно использовать MPL в эмульсии масло-в-воде. Альтернативные адъюванты включают адъюванты, описанные в патенте WO 99/52549, и недисперсные суспензии полиоксиэтиленового простого эфира (патентная заявка Великобритании 9807805.8). Применение адъюванта, который содержит один или несколько агонистов толл-подобного рецептора-4 (TLR-4), такого как адъювант MPL, или родственного по структуре соединения, такого как адъювант RC-529 или миметик липида А, только одного или вместе с агонистом TLR-9, таким как неметилированный олигодезоксинуклеотид, содержащий мотив CpG, также является необязательным. Другой тип смеси адъюванта содержит стабильную эмульсию вода-в-масле, дополнительно содержащую фосфаты аминоалкилглюкозамина, такие как описано в патенте США 6113918. Среди фосфатов аминоалкилглюкозамина самой предпочтительной является молекула, известная как RC-529 триэтиламмониевая соль (2-[(R)-3-тетрадеканоилокситетрадеканоиламино]этил-2-дезокси-4-О-фосфоно-3-О[(R)-3-тетрадеканоилокситетрадеканоил]-2-[(R)-3-тетрадеканоилокситетрадеканоиламино]-p-Dглюкопиранозида). Предпочтительная эмульсия вода-в-масле описана в патенте WO 9956776. Адъюванты используют в количестве, которое может меняться в зависимости от адъюванта, животного-хозяина и иммуногена. Конкретное количество может изменяться примерно от 1 мкг до примерно 1 мг на иммунизацию. Специалистам в данной области известно, что подходящие концентрации или количества могут быть без труда определены. В объем настоящего изобретения также входят вакцинные композиции, содержащие адъювант на основе эмульсии масло-в-воде. Эмульсия вода-в-масле может содержать метаболизируемое масло и сапонин, например, такие как описано в патенте США 7323182. Масло и сапонин присутствуют, например,в соотношении между 1:1 и 200:1. В соответствии с некоторыми вариантами осуществления вакцинные композиции настоящего изобретения могут содержать один или несколько адъювантов, характеризующихся тем, что они присутствуют в виде раствора или эмульсии, которые, по существу, не содержат ионов неорганических солей, где указанный раствор или эмульсия содержит одно или несколько водорастворимых или водоэмульгируемых веществ, которые способны создавать изотоничную или гипотоничную вакцину. Водорастворимые или водоэмульгируемые вещества могут быть выбраны, например, из группы, состоящей из: мальтозы; фруктозы; галактозы; сахарозы; сахарного спирта; липида и их комбинаций. Композиции настоящего изобретения могут необязательно содержать агент, усиливающий доставку к слизистой, такой как, например, проницаемый пептид, который обратимо усиливает парацеллюлярный транспорт эпителия слизистой, модулируя соединительную структуру и/или физиологию эпителия, как описано в патенте США 2004/0077540. Полимерные мультиэпитопные полипептиды настоящего изобретения содержат, в соответствии с некоторыми конкретными вариантами осуществления, протеосомный адъювант. Протеосомный адъювант содержит очищенный препарат белков внешней мембраны менингококков и аналогичные препараты других бактерий. Данные белки высоко гидрофобны, отражая их роль в качестве трансмембранных белков и поринов. Вследствие своих гидрофобных белок-белковых взаимодействий при выделении подходящим образом белки образуют мультимолекулярные структуры, состоящие из цельных, диаметром примерно 60-100 нм или фрагментированных мембранных везикул. Такое физическое состояние, подобное липосоме, позволяет протеосомному адъюванту действовать в качестве белка-носителя, а также функционировать в качестве адъюванта. Применение протеосомного адъюванта было описано в предшествующем уровне техники и рассматривается автором Lowell G.H. в книге "New Generation Vaccines", второе издание, Marcel Dekker Inc,New York, Basel, Hong Kong (1997), с. 193-206. Везикулы протеосомного адъюванта описываются как совместимые по размеру с определенными вирусами, которые гидрофобны и безопасны для применения на людях. В обзоре описана препаративная форма композиций, содержащая нековалентные комплексы между большим числом антигенов и везикулами протеосомного адъюванта, которые образуются при выборочном удалении солюбилизирующего детергента, используя технологию исчерпывающего диализа. Полипептиды настоящего изобретения необязательно объединяют с образованием везикул протеосом, содержащих антиген, через гидрофобные фрагменты. Например, антиген конъюгируют с липидным фрагментом, таким как жирная ацильная группа. Такой гидрофобный фрагмент может быть связан непосредственно с полимерным полипептидом или, альтернативно, для соединения полимерного полипептида с жирной группой может быть использован короткий спейсер, например, из одной, двух, трех или че- 16017887 тырех, вплоть до шести или десяти аминокислот. Этот гидрофобный фрагмент взаимодействует с гидрофобной мембраной везикул протеосомного адъюванта, представляя при этом, как правило, гидрофильный антигенный пептид. В частности, гидрофобный фрагмент может содержать жирную ацильную группу, присоединенную к аминоконцу или близко к карбоксильному концу полимерного полипептида. Одним из примеров является лауроил, имеющий цепь с двенадцатью атомами углерода (СН 3(СН)10 СО), хотя в качестве гидрофобных фрагментов может использоваться любая цепь, аналогичная жирной ацильной группе, включающая, но не ограничиваясь ими, ацильные группы, которые имеют цепи длиной восемь, десять, четырнадцать, шестнадцать, восемнадцать или двадцать атомов углерода. Фрагмент может быть соединен с пептидным антигеном, используя иммуностимулирующий спейсер. Такой линкер может состоять из 1-10 аминокислот, которые могут участвовать в поддержании конформационной структуры пептида. Два компонента, а именно полимерный полипептид и протеосомный адъювант, могут быть составлены в композицию путем смешивания компонентов в выбранном растворе детергента(ов) и затем удаления детергента(ов) способами диафильтрации/ультрафильтрации. Как правило, соотношение протеосомного адъюванта к полимерному полипептиду, содержащихся в композиции, предпочтительно больше чем 1:1 и может составлять, например, 1:2, 1:3, 1:4 вплоть до 1:5, 1:10 или 1:20 (по массе). Растворы на основе детергентов двух компонентов могут содержать одинаковый детергент или различные детергенты, и в смеси, подвергаемой ультрафильтрации/диафильтрации, может находиться более одного детергента. Подходящие детергенты включают тритон, эмпиген и мега-10. Также могут быть использованы и другие подходящие детергенты. Детергенты предназначены для солюбилизации компонентов, используемых для получения композиции. Вакцины, содержащие различные полимерные полипептиды, могут быть получены смешиванием многих различных антигенных пептидов с протеосомным адъювантом. Альтернативно, могут быть получены и затем смешаны две или несколько композиций протеосомный адъювант/антигенный пептид. Если коммерческая вакцина против гриппа, которую получают на основе яиц, вызывает аллергию у индивидуумов, восприимчивых к куриным яйцам, то полимерная вакцина не вызвала таких реакций, что доказано с помощью титра IgE до и после иммунизации. Содержание антигена оптимально определяется по биологическому эффекту, который он вызывает. Конечно, для провокации продукции измеряемых количеств протективного антитела должно присутствовать достаточное количество антигена. Удобный тест на биологическую активность вирусов включает способность антигенного материала, подвергаемого тестированию, истощать известную позитивную антисыворотку своего защитного антитела. Результат представляют в виде отрицательного log LD50 (летальная доза, 50%) для мышей, обработанных вирулентными организмами, которые предварительно были обработаны известной антисывороткой, которую саму предварительно обрабатывали многократным числом разведений оцениваемого антигенного материала. Высокая величина поэтому отражает высокое содержание антигенного материала, который связался с антителами в известной антисыворотке, снижая,таким образом, или устраняя влияние антисыворотки на вирулентный организм, что приводит к летальности при небольшой дозе. Предпочтительно, чтобы антигенный материал, присутствующий в конечной препаративной форме, находился на уровне, достаточном для увеличения отрицательного log LD50 по меньшей мере на 1, предпочтительно на 1,4 по сравнению с результатом, полученным с вирулентным организмом, обработанным необработанной антисывороткой. Абсолютные величины, полученные для материала контроля антисыворотки и подходящей вакцины, конечно, зависят от вирулентного организма и выбранных стандартов антисыворотки. Для получения идеальной вакцинной препаративной формы также может быть использован следующий способ: исходя из определенного антигена, который предназначен для провоцирования желаемого иммунного ответа, на первой стадии находят адъювант, совместимый с антигеном, как описано в специальной литературе, в частности в патенте WO 97/30721. На следующей стадии вакцину оптимизируют добавлением различных веществ, создающих изотоничность, как определено в настоящем изобретении, предпочтительно, сахаров и/или сахарных спиртов в изотоничной или слабо гипотоничной концентрации, к смеси антигена и адъюванта, при этом композиция в остальном остается идентичной, и доведением раствора до физиологического рН в диапазоне от рН 4,0 до 10,0, в частности 7,4. Затем на первой стадии определяют вещества или их концентрацию, которые будут улучшать растворимость композиции антиген/адъювант по сравнению с общепринятым забуференным солевым раствором. Улучшение характеристик растворимости кандидатным веществом является первым указанием, что это вещество способно приводить к увеличению иммуногенной активности вакцины. Поскольку одним из возможных условий увеличения клеточного иммунного ответа является повышенное связывание антигена с АРС (антиген-презентирующими клетками), на следующей стадии исследования можно проследить, приводит ли данное вещество к такому увеличению. Используемая методика может быть аналогична описанной в определении адъюванта, например, инкубирование клеток АРС с флуоресцентно-меченным пептидом или белком, адъювантом и веществом, создающим изотоничность. Повышенное поглощение или связывание пептида с АРС, обусловленное веществом, может быть определено путем сравнения с клетками, которые смешивали с пептидом и адъювантом отдельно или с ком- 17017887 позицией пептид/адъювант, которая присутствует в общепринятом забуференном солевом растворе, используя проточную цитометрию. На второй стадии кандидатные вещества могут быть изучены in vitro, чтобы проследить, способно ли их наличие повысить презентацию пептида клеткам АРС и в какой мере способно; концентрация МНС на клетках может быть измерена, используя способы, описанные в патенте WO 97/30721 для тестируемых пептидов. Другой возможный путь тестирования эффективности препаративной формы представляет собой применение in vitro модельной системы. В этом случае клетки АРС инкубируют вместе с адъювантом,пептидом и кандидатным веществом и измеряют относительную активацию Т-клеточного клона, который специфически распознает использованный пептид (Coligan et al., 1991; Lopez et al., 1993). Эффективность препаративной формы также может быть необязательно продемонстрирована с помощью клеточного иммунного ответа путем детекции реакции "гиперчувствительности замедленного типа" (DTH) у иммунизированных животных. В заключение, иммуномодулирующую активность препаративной формы оценивают в тестах на животных. Полимерные пептиды и полипептиды настоящего изобретения могут быть синтезированы химическим путем, используя известные в данной области способы синтеза пептидов, пептидных мультимеров и полипептидов. Такие способы, как правило, основаны на известных принципах пептидного синтеза; наиболее общепринято, методики могут быть осуществлены согласно известным принципам твердофазного пептидного синтеза. Как использовано в данном описании, "пептид" определяет последовательность аминокислот, соединенных пептидными связями. Пептиды настоящего изобретения содержат последовательность из 424 аминокислотных остатков. Полимерные полипептиды содержат по меньшей мере два повтора и максимально 50 повторов пептидных эпитопов. Аналоги пептидов и пептидомиметики также включены в объем настоящего изобретения, а также соли и сложные эфиры пептидов настоящего изобретения. Аналог пептида настоящего изобретения может необязательно содержать по меньшей мере одну неприродную аминокислоту и/или по меньшей мере одну блокирующую группу либо на С-конце, либо на N-конце. Соли пептидов настоящего изобретения представляют собой физиологически приемлемые органические и неорганические соли. Создание подходящих "аналогов" можно осуществить с помощью компьютера. Термин "пептидомиметик" означает, что пептид настоящего изобретения модифицируют таким образом, чтобы он включал по меньшей мере одну непептидную связь, такую как, например, карбамидная связь, карбаматная связь, сульфонамидная связь, гидразиновая связь или любая другая ковалентная связь. Создание подходящего "пептидомиметика" можно осуществить с помощью компьютера. В объем настоящего входят соли и сложные эфиры пептидов настоящего изобретения. Соли пептидов настоящего изобретения представляют собой физиологически приемлемые органические и неорганические соли. Функциональные производные пептидов настоящего изобретения охватывают производные, которые могут быть получены из функциональных групп, которые встречаются в виде боковых цепей на остатках, или N- или С-концевых групп, способами, известными в данной области, и охватываются изобретением, при условии, если они остаются физиологически приемлемыми, т.е. они не противодействуют активности пептида и не придают токсичных свойств композициям, их содержащим. Такие производные могут включать, например, алифатические сложные эфиры карбоксильных групп, амиды карбоксильных групп, получаемые при взаимодействии с аммонием или с первичными или вторичными аминами, N-ацильные производные свободных аминогрупп аминокислотных остатков, образуемые при взаимодействии с ацильными фрагментами (например, алканоильной или карбоциклической ароильной группами), или О-ацильные производные свободной гидроксильной группы (например, гидроксильной группы серильного или треонильного остатков), образуемые при взаимодействии с ацильными фрагментами. Под термином "аминокислота" понимают соединения, которые имеют аминогруппу и группу карбоновой кислоты, предпочтительно в 1,2-, 1,3- или 1,4-замещении на углеродном скелете. Самыми предпочтительными являются -аминокислоты, и они включают 20 природных аминокислот (которые представляют собой L-аминокислоты, за исключением глицина), которые находятся в белках, соответствующие D-аминокислоты, соответствующие N-метильные аминокислоты, аминокислоты с модифицированной боковой цепью, аминокислоты, доступные с помощью биосинтеза, которые не обнаруживаются в белках (например, 4-гидроксипролин, 5-гидроксилизин, цитруллин, орнитин, канаванин, дьенколовая кислота, -цианоланин) и искусственно полученные -аминокислоты, такие как аминоизомасляная кислота, норлейцин, норвалин, гомоцистеин и гомосерин. Примерами 1,3 и 1,4-аминокислот являются аланин и -аминомасляная кислота, соответственно, в данной области хорошо известны и многие другие. Также используемыми остатками согласно настоящему изобретению являются статин-подобные изостеры (дипептид, содержащий две аминокислоты, где связь CONH заменена СНОН), гидроксиэтиленовые изостеры (дипептид, содержащий две аминокислоты, где связь CONH заменена СНОНСН 2), восстанов- 18017887 ленные амидные изостеры (дипептид, содержащий две аминокислоты, где связь CONH заменена связьюCH2NH) и тиоамидные изостеры (дипептид, содержащий две аминокислоты, где связь CONH заменена связью CSNH). Аминокислоты, используемые в настоящем изобретении, представляют собой аминокислоты, которые коммерчески доступны или могут быть получены общепринятыми способами синтеза. Для некоторых остатков могут потребоваться специальные способы встраивания в пептид и, следовательно, в настоящем изобретении можно использовать дивергентные и конвергентные способы синтеза пептидной последовательности. Природные кодируемые аминокислоты и их производные представляются трехбуквенными кодами в соответствии с конвенциями IUPAC. При отсутствии индикации использовали L изомер. В объем настоящего изобретения входят консервативные замены аминокислот, известные специалистам в данной области. Консервативные аминокислотные замены включают замену одной аминокислоты другой, имеющей тот же тип функциональной группы или боковой цепи, например алифатическую,ароматическую, положительно заряженную, отрицательно заряженную. Такие замены могут усиливать пероральную биодоступность, проникновение в центральную нервную систему, мечение специфических клеточных популяций и подобное. Специалисту в данной области известно, что конкретные замены, делеции или добавления к пептиду, полипептиду или белковой последовательности, которые изменяют,добавляют или удаляют одну аминокислоту или небольшой процент аминокислот в кодируемой последовательности, представляют собой "консервативно модифицированный вариант", где изменение приводит к замещению аминокислоты химически подобной аминокислотой. В данной области хорошо известны таблицы консервативных замен, создающих функционально подобные аминокислоты. Каждая из следующих шести групп содержит аминокислоты, которые представляют собой консервативные замены одной на другую: аланин (А), серин (S), треонин (Т); аспарагиновая кислота (D), глутаминовая кислота (Е); аспарагин (N), глутамин (Q); аргинин (R), лизин (K); изолейцин (I), лейцин (L), метионин (М), валин (V); фенилаланин (F), тирозин (Y), триптофан (W). Следующие примеры представлены для более полной иллюстрации некоторых вариантов осуществления изобретения. Тем не менее, они ни в коей мере не должны быть истолкованы как ограничивающие широкий объем изобретения. Специалист в данной области сможет без труда разработать многие варианты и модификации принципов, описанных в данном описании, не отходя от существа и объема настоящего изобретения. Примеры Материалы и способы. Полимерные мультиэпитопные полипептиды: представлены примеры полимерных мультиэпитопных полипептидов, содержащих несколько повторов пептидных эпитопов вируса гриппа Е 1-Е 9, перечисленных в табл. 1. Полипептиды включают аминокислоты и короткие пептиды в качестве спейсеров. Полипептиды располагаются в чередующейся последовательной полимерной структуре или структуре блок-сополимера. Полипептиды получают экспрессией в экспрессирующем векторе из полинуклеотидной конструкции, содержащей различные сайты рестрикции для дополнительного манипулирования полипептидом. Полинуклеотидную конструкцию получают из коммерческого источника. Вакцины: для исследований иммунизации различных линий мышей использовали вакцины, полученные из полимерных мультиэпитопных полипептидов, представленных в примерах 1-3. Примерами конкретных полученных и тестированных вакцин являются: полимерная 11, созданная на основе полимерного полипептида, содержащего пять повторов девяти пептидных эпитопов гриппа, расположенных в чередующейся последовательной полимерной структуре представленного в примере 1; полимерная 12, созданная на основе полимерного полипептида, содержащего три повтора девяти пептидных эпитопов гриппа, расположенных в чередующейся последовательной полимерной структуре представленного в примере 3; полимерная 14, созданная на основе полимерного полипептида, содержащего три повтора девяти пептидных эпитопов гриппа,расположенных в структуре блок сополимера представленного в примере 2. Исследования иммунизации: для исследований иммунизации использовали три линии мышей: аутбредную линию (ICR), инбредную линию (BALB/c) и трансгенную по молекулам человека линию HLA А 0201 (HLA А 0201), а также в некоторых экспериментах кроликов. Используемые вирусы включали следующие: A/Texas/1/77, A/Wisconsin/67/05 (WISC), A/WSN/33 (WSN), B/Malaysia/2506/04 (MAL),A/California/07-2007, A/New Caledonia20/99 (NC) и другие. Все исследования проводили при внутримы- 19017887 шечном введении 150 мкг полимерного мультиэпитопного полипептида в 100 мкл, введенных в равном количестве в обе задние конечности. Пример 1. Полимерный полипептид с пятью повторами единицы, содержащей девять различных эпитопов, расположенных в чередующейся последовательной структуре. Данный пример является примером полимерного полипептида, содержащего пять повторов девяти пептидных эпитопов гриппа, расположенных в чередующейся последовательной полимерной структуре Оцененная молекулярная масса составляет 80 кДа. На фиг. 1 В представлена аминокислотная последовательность данного полимерного полипептида,включающая гистидиновый хвост. На фиг. 1 А представлена последовательность ДНК полинуклеотидной конструкции, использованной для получения данного полимерного пептида. Пример 2. Полимерный полипептид с тремя повторами каждого из девяти различных эпитопов,расположенных в структуре блок-сополимера. В данном примере последовательность ДНК полинуклеотидной конструкции, использованной для получения полимерного пептида, содержащего три повтора девяти пептидных эпитопов гриппа, расположенных в структуре блок-сополимера представлена на фиг. 2 А, и соответствующая аминокислотная последовательность представлена на фиг. 2 В. Оцененная молекулярная масса составляет 48 кДа. Пример 3. Полимерный полипептид с тремя повторами единицы, содержащей девять эпитопов,расположенных в чередующейся последовательной структуре. Данный пример является примером полимерного полипептида, содержащего три повтора девяти пептидных эпитопов гриппа, расположенных в чередующейся последовательной полимерной структуре Оцененная молекулярная масса составляет 48 кДа. На фиг. 3 В представлена аминокислотная последовательность данного полимерного полипептида. На фиг. 3 А представлена последовательность ДНК полинуклеотидной конструкции, использованной для получения данного полимерного пептида. Пример 4. Клеточный иммунный ответ. Оценивали клеточные иммунные ответы на две различные концентрации стимулирующего вируса гриппа штаммов A/Texas/1/77, A/WisxWisc/67/05, A/California/07-2007 и B/Malaysia/2506/04. Трансгенных мышей (трансгенез по HLA А 0201) вакцинировали однократно двумя полимерными вакцинами: 11 и 14, эмульгированными в IFA (неполном адъюванте Фрейнда). Через 7-10 дней после иммунизации удаляли их селезенку и лимфатические узлы (LN) и затем инкубировали с вышеуказанными вирусами. Пролиферацию измеряли по поглощению тимидина, и результаты представлены на фиг. 4 в виде индекса пролиферации лимфоцитов, инкубированных со стимулирующим вирусом. Пролиферация ассоциировалась с секрецией гамма-IFN в диапазоне 300-1300 пг/мл. Этот ответ указывает на опосредованный клетками Th1 иммунный ответ на вакцину, которая могла вызвать более сильный иммунитет против инфицирования вирусом. Пример 5. Распознавание иммунизирующего антигена и вирусов иммунной сывороткой. Мышей ICR иммунизировали полимерным мультиэпитопным полипептидом, содержащим пять повторов девяти эпитопов, расположенных в чередующейся последовательной полимерной структуре(полимерная 11), или полимерным мультиэпитопным полипептидом, содержащим три повтора девяти эпитопов, расположенных в структуре блок-сополимера(полимерная 14), суспендированным в 50% глицерине в PBS или суспендированным в IFA в качестве адъюванта, или в качестве контроля носителя вводили раствор 50% глицерина в PBS. Распознавание известных защитных эпитопов гриппа НА 91-108 и М 2 2-12 и нескольких вирусов гриппа (WISC, WSN, NC и MAL) сыворотками мышей, иммунизированных полипептидом антигена (11 и 14 соответственно), определяли с помощью ELISA, и результаты обобщены в табл. 4 а и 4b. Значимое распознавание определяют как по меньшей мере 4-кратное повышение титра сыворотки до иммунизации и сыворотки после трех иммунизаций IM с интервалами 23 недели. Таблица 4 а Кратное повышение титра к различным антигенам сыворотки до иммунизации и сыворотки после 3 иммунизации с помощью полимерного мультиэпитопного полипептида в 50% глицерине в PBS Таблица 4b Кратное повышение титра у различных антигенов сыворотки до иммунизации и сыворотки после 3 иммунизаций с помощью полимерного мультиэпитопного полипептида в IFA в качестве адъюванта В обеих группах наблюдается значимое распознавание иммунизирующего антигена, пептиды НА 91-108 и М 2 2-18 распознавались только сывороткой мышей, иммунизированных антигенным полипептидом 14, но не сывороткой мышей, иммунизированных полипептидом 11. Нормальная сыворотка человека могла распознавать полимерные вакцинные кандидаты, указывая на потенциальные ответы памяти, возникающие после иммунизации людей с помощью данной вакцины. Средние титры 4 сывороток человека к полипептидам 11 и 14 составили 6000 и 6400 соответственно. Пример 6. Защита против высоколетального инфицирования штаммом H3N2 A/Texas/1/77. Группы из восьми трансгенных мышей иммунизировали три раза с интервалами 3 недели внутримышечным введением полимерной вакцины 14 или PBS. Инфицирование высоколетальной дозой(300 LD50) штамма H3N2 A/Texas/1/77 проводили через три недели после последней вакцинации. Мышей умерщвляли через пять дней после инфицирования. Как описано на фиг. 5, несмотря на большое количество вируса, использованного для инфицирования, в легких мышей наблюдали существенное снижение титра вируса. Пример 7. Исследования эффективности in vivo. Две версии вакцины были оценены in vivo: полимерный полипептид, суспендированный в растворе 50% глицерина в PBS или в неполном адъюванте Фрейнда. Для установления эффективности вакцины механизма действия и предварительных данных по токсикологии перед определением токсичности повторной дозы очищенную вакцину использовали на нескольких моделях мышей. Исследования гуморального ответа, а также фармакодинамики осуществляли на нескольких линиях мышей. Одна из животных моделей, которую использовали для оценки вакцины,представляет собой трансгенных мышей по HLA А 0201. Данную модель использовали для определения оптимальной дозы, а также для клеточных параметров иммунного ответа, чтобы понять механизм ее действия. Пример 8. Эффективность вакцины продемонстрировали в двух предварительных исследованиях, используя мышей ICR и трансгенных мышей (HLA А 0201). Мышей вакцинировали внутримышечно три раза с 3 хнедельным интервалом дозой 150 мкг/мышь вакцин 11, 12 и 14 при наличии и отсутствии адъюванта(IFA). Через три-четыре недели после последней иммунизации мышей инфицировали дозой 300 LD50 штамма вируса гриппа, адаптированного к мышам H3N2 (A/Texas/1/77). Через пять дней после инфицирования наблюдали степень выживаемости. Сравнивали обработанные и контрольные группы, иммунизированные раствором 50% глицерина в PBS при наличии и отсутствии IFA. Степень выживаемости (фиг. 6 А) после инфицирования дозой 300 LD50 у мышей ICR оказалась 100%, тогда как в контрольных группах (50% глицерин в PBS) была показана степень выживаемости 20%. Вирусная нагрузка в их легких подробно показана на фиг. 6 В только для вакцин 11 и 14. Вирусная нагрузка в группах, где обнаруживалась 100% выживаемость, существенно ниже, чем вирусная нагрузка в контрольных группах (р 0,05). Из-за небольшого количества мышей на группу (5 мышей) ста- 21017887 тистический анализ проводили, используя двусторонний точный тест Фишера. Величину р, равную 5% или меньше, полагают статистически значимой. Данные анализировали, используя версию 9.1 SAS(SAS Institute, Cary North Carolina). В отношении жизнеспособности трансгенных мышей (фиг. 7), иммунизированных вакциной в растворе PBS/50% глицерин, используя способы вакцинации и инфицирования, аналогично указанным выше, степень выживаемости оказалась 80 и 60% при вакцинации 11 и 14 соответственно по сравнению с 20% в контрольной группе. Вакцина 12 оказалась неэффективной на данной модели мышей, а также протестированные вакцины с адъювантом (IFA). Это указывает на то, что на данной животной модели или, по меньшей мере, в данном исследовании добавление адъюванта было необязательно и даже снижало защитный потенциал вакцины. Пример 9. Токсикология повторных доз. Испытания токсикологичности повторных доз осуществляют с вакциной 14 (полимерная вакцина в трех повторах блоков, суспендированная в растворе 50% глицерина в PBS или в неполном адъюванте Фрейнда) в соответствии с протоколом,основанным на электронном адресе:http;//www3.niaid.nih.gov/daids/vaccine/Science/VRTT/06SafetyT est.htm. Предварительное исследование токсикологии повторных доз проводили на аутбредных мышах ICR. Для каждой временной точки умерщвления использовали трех животных на пол на дозу для исследования гистопатологии их основных органов после внутримышечного введения вакцины один, два и три раза. Для оценки токсичности продукта и возможности повторного введения, по всей видимости, достаточно использовать самую высокую дозу, предназначенную для клинической практики, в многократной дозе в течение 6 недель, содержащей три вакцинации каждые две недели. Исследования включают мониторинг прижизненной стадии с последующим исследованием полного комплекса токсикологических параметров, включая некропсию и полную гистопатологическую оценку всех основных органов, на 2 день и через 2 недели после иммунизации, чтобы продемонстрировать обратимость какие-либо токсикологических эффектов, наблюдавшихся во время периода воздействия. Пример 10. Клиническое испытание в фазе I/IIa. Основной целью данного клинического исследования является оценка безопасности превентивной вакцины против гриппа после однократного или двукратного внутримышечного введения. Исследование проводят под контролем клинической ситуации среди здоровых добровольцев в возрасте от 18 до 49 лет. Второй целью является оценка иммуногенности, индуцированной введением полимерной вакцины. В данном исследовании в фазе I/II оцениваются самые распространенные острые негативные эффекты и оценивается величина доз, которую пациенты могут получать безопасно без высокого риска побочных эффектов. Пример 11. Антивирусный ответ сыворотки мышей, иммунизированных коммерческой вакциной против гриппа, с последующей иммунизацией полимерной вакциной. Трансгенных по HLA А 0201 мышей иммунизировали коммерческой инактивированной вакциной против гриппа (расщепленный вирион) ВР Vaxigrip трижды в дни 0, 60, 81 или только один раз вакциной Vaxigrip в день 0 и 2 дополнительными иммунизациями (в дни 60 и 81) полимерными вакцинами 11, 12 и 14. Забор крови осуществляли перед иммунизацией (до формирования иммунитета) и после последней иммунизации. Антитела против некоторых штаммов гриппа определяли в смешанных сыворотках: H3N2: A/Wisconsin/67/05, A/Texas/1/77, A/California/07/2007, A/Fujian/411/2002, A/Moscow/10/99 и A/Panama/2007/99; H1N1: A/New Caledonia/20/99, A/WSN/33, A/PR8/34, B: B/Malaysia/2506/04,B/Lee/40. После первой иммунизации вакциной Vaxigrip, которая предназначена для однократной иммунизации людей, не оказалось значительного повышения титров ко всем вирусам (за исключением 4 кратного повышения титра к штамму A/California). Результаты представлены в табл. 5 А и 5 В. При участии полимерных препаративных форм предварительная иммунизация вакциной Vaxigrip существенно не повысила ответ на вирусы, по сравнению с другими данными исследований иммунизации, где были продемонстрированы схожие гуморальные ответы. После двух иммунизации полимерной вакциной наблюдали максимально 8-кратное повышение титров при сравнении пост/пре иммунитета. Контрольная группа, которой вводили PBS, оказалась отрицательной ко всем вирусам. При сравнении различных полимерных вариантов лучшим кандидатом с точки зрения гуморального ответа на вирусы был 14.t=титр, f=кратность. Пример 12. Пептидный синтез. Пептиды и полимерные пептиды синтезировали общепринятым твердофазным пептидным синтезом, используя следующие материалы: защищенные аминокислоты, 9-фторенилметилоксикарбонил-Nгидроксисукцинимид (Fmoc-OSu), гексафторфосфат бром-трис-пирролидонфосфония (PyBrop), ринкамид-метилбензгидриламин(МВНА)-полистирольные смолы, и различные органические вещества и подложки для твердофазного пептидного синтеза (SPPS) покупали у фирмы Nova Biochemicals (Laufelfingen,Switzerland). бис-(Трихлорметил)карбонат (ВТС) покупали у фирмы Lancaster (Lancashire, England),трифторуксусную кислоту (ТФУК) и растворители для высокоэффективной жидкостной хроматографии(ВЭЖХ) покупали у фирмы Bio-Lab (Jerusalem, Israel). Растворители для органической химии покупали у фирмы Frutarom (Haifa, Israel). Спектр ядерного магнитного резонанса (ЯМР) записывали на спектрометре Bruker AMX-300 MHz. Macc-спектрометрию проводили на масс-спектрометре с ионной ловушкой Finnigan LCQ DUO. Тонкослойную хроматографию(ТСХ) осуществляли на пластинах с силикагелем Merck F245 60 (Darmstadt, Germany). Анализ ВЭЖХ осуществляли, используя аналитическую RP колонку Vydac (C18, 4,6250 мм, номер по каталогу 201 ТР 54), и использовали насос Merck-Hitachi L-7100 и детектор различной длины волн Merck-Hitachi L7400, работающий при 215 нм. Подвижная фаза состояла из градиентной системы с растворителем А,соответствующим воде с 0,1% ТФУК, и растворителем В, соответствующим ацетонитрилу (ACN) с 0,1% ТФУК. Подвижная фаза начиналась с 95% А от 0 до 5 мин, с последующим линейным градиентом от 5% В до 95% В, начиная с 5 до 55 мин. Градиент поддерживали при 95% В в течение дополнительных 5 мин и затем по каплям добавляли до 95% А и 5% В, начиная с 60 до 65 мин. Градиент поддерживали при 95% А в течение дополнительных 5 мин до достижения уравновешивания колонки. Скорость потока подвижной фазы составляла 1 мл/мин. Пептидную очистку осуществляли ВЭЖХ с обращенной фазой (ОФВЭЖХ) (на насосе L-6200 А, доступный от фирмы Merck-Hitachi, Japan), используя препаративную RP колонку Vydac (C8, 22250 мм, номер по каталогу 218 ТР 1022). Все препаративные анализы ВЭЖХ осуществляли, используя градиентную систему с растворителем А, соответствующим воде с 0,1% ТФУК, и растворителем В, соответствующим ацетонитрилу ACN с 0,1% ТФУК. Несмотря на то что настоящее изобретение было подробно описано, специалистам в данной области будет очевидно, что может быть создано много вариантов и модификаций. Поэтому изобретение не должно быть истолковано, как ограниченное подробно описанными вариантами осуществления, и объем и сущность изобретения будут легче поняты при обращении к формуле изобретения, приведенной далее. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Синтетический или рекомбинантный мультиэпитопный полипептид гриппа, содержащий многократное число копий множества пептидных эпитопов вируса гриппа, расположенных в конфигурации,выбранной из группы, состоящей из:ii) B(X1)nZ(X2)nZ(Xm)nB; где В представляет собой необязательную последовательность из 1-4 аминокислотных остатков; n в каждом случае независимо равно целому числу 2-50; m равно целому числу 3-15; каждый из X1-Xm представляет собой пептидный эпитоп гриппа, выбранный из группы, состоящей из эпитопа В-клеточного типа, эпитопа Т-хелперного (Th) типа и эпитопа типа цитотоксических лимфоцитов (CTL), состоящих из 4-24 аминокислотных остатков; где максимальное число аминокислотных остатков в полипептиде составляет примерно 600; и в котором пептидные эпитопы гриппа выбраны из группы, состоящей из пептида гемагглютинина (НА), пептида M1, пептида М 2 и пептида нуклеопротеина (NP). 2. Полипептид по п.1, где m равно 9, a n равно целому числу от 3 до 5. 3. Полипептид по п.2, в котором пептидные эпитопы гриппа выбраны из группы, состоящей из SEQID NO:1-SEQ ID NO:82. 4. Полипептид по п.1, в котором пептидные эпитопы гриппа выбраны из группы, состоящей из НА 354-372 (E1, SEQ ID NO:82), НА 91-108 (Е 2, SEQ ID NO:48), M1 2-12 (Е 3, SEQ ID NO:25), НА 150-159(Е 4, SEQ ID NO:52), НА 143-149 (E5, SEQ ID NO:51), NP 206-229 (E6, SEQ ID NO:64), HA 307-319 (E7,SEQ ID NO:59), NP 335-350 (E8, SEQ ID NO:69) и NP 380-393 (E9, SEQ ID NO:70). 5. Полипептид по п.4, в котором пептидные эпитопы гриппа состоят из НА 354-372 (E1, SEQ IDNO:82), НА 91-108 (Е 2, SEQ ID NO:48), M1 2-12 (Е 3, SEQ ID NO:25), НА 150-159 (Е 4, SEQ ID NO:52),НА 143-149 (E5, SEQ ID NO:51), NP 206-229 (E6, SEQ ID NO:64), HA 307-319 (E7, SEQ ID NO:59), NP 335-350 (E8, SEQ ID NO:69) и NP 380-393 (E9, SEQ ID NO:70). 6. Полипептид по п.4 с последовательностью, выбранной из группы, состоящей из SEQ ID NO:84,SEQ ID NO:86 и SEQ ID NO:88. 7. Полипептид по п.1, содержащий девять различных пептидных эпитопов вируса гриппа, расположенных в следующей чередующейся где n равно 3 или 5; Е 1 представпоследовательной полимерной структуре ляет собой НА 354-372 (SEQ ID NO:82), Е 2 представляет собой НА 91-108 (SEQ ID NO:48), Е 3 представляет собой M1 2-12 (SEQ ID NO:25), Е 4 представляет собой НА 150-159 (SEQ ID NO:52), Е 5 представляет собой НА 143-149 (SEQ ID NO:51), Е 6 представляет собой NP 206-229 (SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQ ID NO:59), Е 8 представляет собой NP 335-350 (SEQ ID NO:69), а Е 9 представляет собой NP 380-393 (SEQ ID NO:70); или три повтора из девяти различных пептидных эпитопов вируса гриппа, расположенных в следующей структуре блок-сополимера где Е 1 представляет собой НА 354-372 (SEQ ID NO:82), Е 2 представляет собой НА 91-108(SEQ ID NO:48), Е 3 представляет собой M1 2-12 (SEQ ID NO:25), Е 4 представляет собой НА 150-159(SEQ ID NO:52), Е 5 представляет собой НА 143-149 (SEQ ID NO:51), Е 6 представляет собой NP 206-229(SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQ ID NO:59), Е 8 представляет собой NP 335-350(SEQ ID NO:69), а Е 9 представляет собой NP 380-393 (SEQ ID NO:70); или шесть повторов из пяти различных пептидных эпитопов В-клеточного типа вируса гриппа, расположенных в следующей чередующейся последовательной полимерной структуре где Е 1 представляет собой НА 354-372 (SEQ ID NO:82), Е 2 представляет собой НА 91-108 (SEQ ID NO:48), Е 3 представляет собой M1 2-12 (SEQ ID NO:25), Е 4 представляет собой НА 150-159 (SEQ ID NO:52), Е 5 представляет собой НА 143-149 (SEQ ID NO:51); или шесть повторов из четырех различных пептидных эпитопов вируса гриппа Т-клеточного типа, расположенных в следующей чередующейся последовательной полимерной структуре [Е 7 Е 8 Е 9 Е 6]6, где Е 6 представляет собой NP 206-229 (SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQ ID NO:59), Е 8 представляет собой NP 335-350 (SEQ ID NO:69), а Е 9 представляет собой NP 380-393 (SEQ ID NO:70); или четыре повтора из четырех различных пептидных эпитопов вируса гриппа Т-клеточного типа, расположенных в следующей чередующейся последовательной полимерной структуре [Е 7 Е 8 Е 9 Е 6]4, где n равно 6, Е 6 представляет собой NP 206-229 (SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQ IDNO:70), и где указанный мультимерный полипептид слит с белком-носителем; или шесть повторов из девяти различных пептидных эпитопов вируса гриппа, расположенных в следующей структуре блок-сополимера где Е 1 представляет собой НА 354-372 (SEQ ID NO:82), Е 2 пред- 24017887 ставляет собой НА 91-108 (SEQ ID NO:48), Е 3 представляет собой M1 2-12 (SEQ ID NO:25), Е 4 представляет собой НА 150-159 (SEQ ID NO:52), Е 5 представляет собой НА 143-149 (SEQ ID NO:51), Е 6 представляет собой NP 206-229 (SEQ ID NO:64), Е 7 представляет собой НА 307-319 (SEQ ID NO:59), Е 8 представляет собой NP 335-350 (SEQ ID NO:69), а Е 9 представляет собой NP 380-393 (SEQ ID NO:70). 8. Полипептид по п.1, также содержащий последовательность носителя. 9. Полипептид по п.8, где эпитопы пептида включены в последовательность полипептидного носителя. 10. Выделенный полинуклеотид, кодирующий мультиэпитопный полипептид гриппа по любому из пп.1-9. 11. Выделенный полинуклеотид по п.10, кодирующий полипептидную последовательность, выбранную из группы, состоящей из SEQ ID NO:84, SEQ ID NO:86 и SEQ ID NO:88. 12. Выделенный полинуклеотид по п.10, содержащий последовательность, выбранную из группы,состоящей из SEQ ID NO:83, SEQ ID NO:85 и SEQ ID NO:87. 13. Вакцина для иммунизации индивидуума против гриппа, содержащая по меньшей мере один полипептид по п.1. 14. Вакцина по п.13, где первый полипептид содержит множество пептидных эпитопов вируса гриппа В-клеточного типа, а второй полипептид содержит множество пептидных эпитопов вируса гриппа Т-клеточного типа. 15. Вакцина по п.13, дополнительно содержащая адъювант. 16. Вакцина по п.15, где адъювант выбран из группы, состоящей из вода-в-масляной эмульсии, липидной эмульсии и липосом. 17. Способ индукции иммунного ответа и обеспечения защиты против гриппа у индивида, где способ предусматривает введение индивиду вакцины по любому из пп.13-16. 18. Способ по п.17, где путь введения вакцины выбран из внутримышечного, интраназального, перорального, внутрибрюшного, подкожного, местного, чрезкожного и трансдермального. 19. Применение полипептида по любому из пп.1-9 для получения вакцинной композиции для иммунизации против гриппа.
МПК / Метки
МПК: A61K 39/145
Метки: вакцины, против, мультиэпитопные, полимерные, гриппа
Код ссылки
<a href="https://eas.patents.su/30-17887-polimernye-multiepitopnye-vakciny-protiv-grippa.html" rel="bookmark" title="База патентов Евразийского Союза">Полимерные мультиэпитопные вакцины против гриппа</a>
Предыдущий патент: Голографический защитный элемент
Следующий патент: Реактор синтеза углеводородов типа барботажной колонны и содержащая его реакционная система синтеза углеводородов
Случайный патент: Загрузочное устройство, прежде всего подогреватель шихты