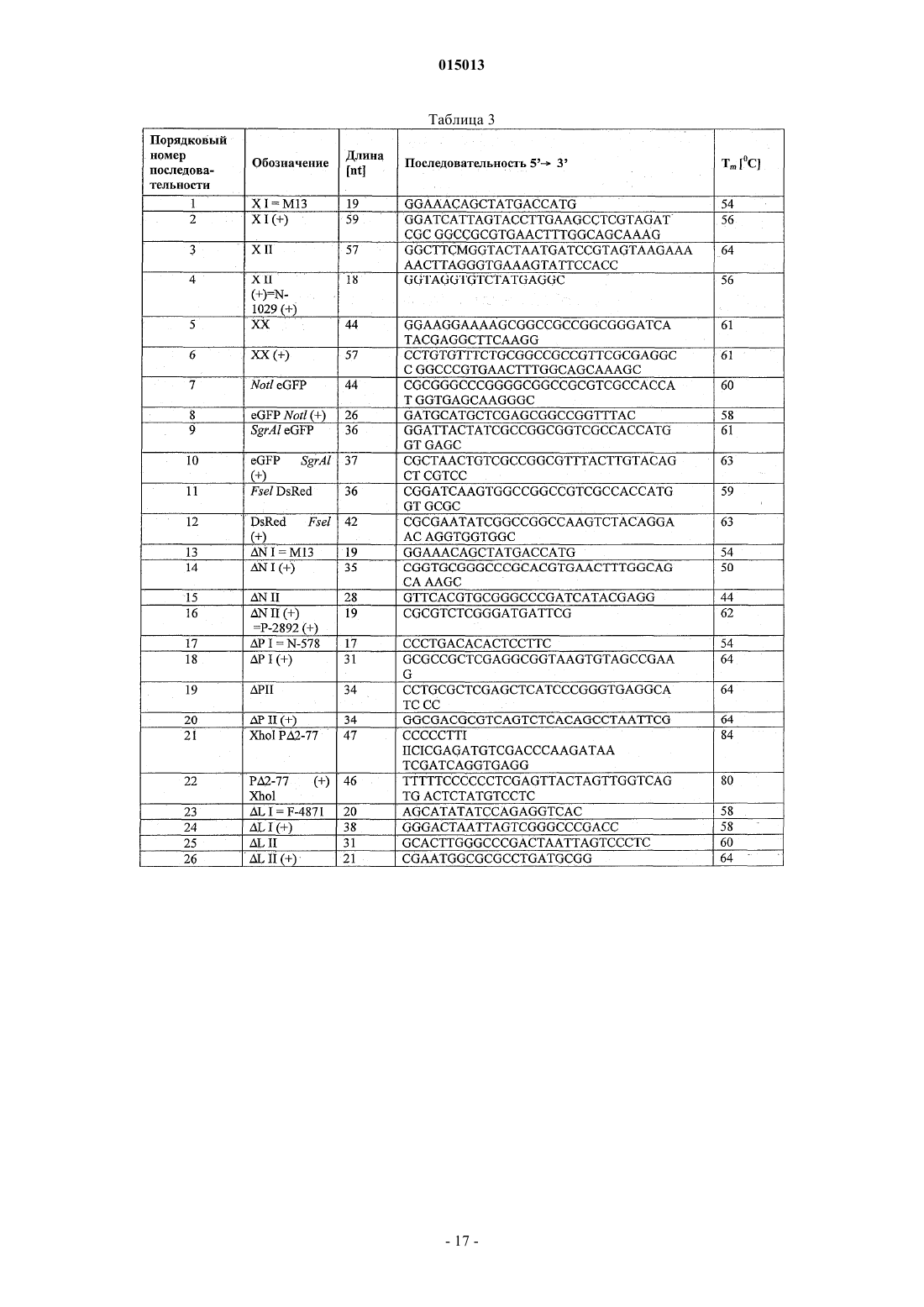
Рекомбинантный вирус сендай с ослабленной способностью к репликации, предназначенный для использования в качестве вакцин
Номер патента: 15013
Опубликовано: 29.04.2011
Авторы: Нойберт Вольфганг Й., Боссов Саша, Шлехт Забине
Формула / Реферат
1. Рекомбинантный вирус Сендай, содержащий вирусный геном с делецией аминокислот 2-77 белка, кодируемого Р-геном, приводящей к потере способности к репликации без потери вторичной способности к транскрипции.
2. Рекомбинантный вирус Сендай по п.1, отличающийся тем, что вирусный геном дополнительно содержит по меньшей мере одну последовательность, кодирующую чужеродный генный продукт.
3. Рекомбинантный вирус Сендай по п.2, отличающийся тем, что чужеродный генный продукт является белком, рибозимом, антисмысловой молекулой или молекулой миРНК.
4. Рекомбинантный вирус Сендай по п.3, отличающийся тем, что чужеродный генный продукт является репортерным белком, антигенным или терапевтическим белком.
5. Рекомбинантный вирус Сендай по п.4, отличающийся тем, что чужеродный генный продукт является антигенным белком патогена, выбранного из вирусов, бактерий и простейших.
6. Рекомбинантный вирус Сендай по п.5, отличающийся тем, что антигенный белок является вирусным белком.
7. Рекомбинантный вирус Сендай по п.6, отличающийся тем, что вирусный белок происходит от одинаковых или разных вирусов.
8. Рекомбинантный вирус Сендай по любому из пп.2-7, отличающийся тем, что по меньшей мере одна из последовательностей, кодирующих чужеродный генный продукт, встроена в вирусный геном, в частности, заменяет последовательность, кодирующую гомологичный генный продукт.
9. Рекомбинантный вирус Сендай по любому из пп.1-8, отличающийся тем, что его транскрипционная способность уменьшена не более чем в 20 раз по сравнению с диким типом.
10. Нуклеокапсид рекомбинантного вируса Сендай по любому из пп.1-9.
11. Геном рекомбинантного вируса Сендай по любому из пп.1-9.
12. Молекула ДНК, которая кодирует геном и/или антигеном рекомбинантного вируса Сендай по любому из пп.1-9.
13. Молекула ДНК по п.12, отличающаяся тем, что она функционально связана с транскрипционным сигналом.
14. Молекула ДНК по п.13, отличающаяся тем, что транскрипционный сигнал является промотором бактериофага, например, Т7 или SP6-промотором.
15. Клетка, которая содержит рекомбинантный вирус Сендай по любому из пп.1-9, нуклеокапсид по п.10, геном по п.11 или молекулу ДНК по любому из пп.12-14.
16. Клетка по п.15, отличающаяся тем, что она является клеткой, способной к размножению рекомбинантного вируса Сендай.
17. Клетка по п.15, отличающаяся тем, что она является клеткой, способной к продуцированию рекомбинантного вируса Сендай.
18. Клетка по п.17, отличающаяся тем, что она дополнительно содержит молекулу ДНК, кодирующую чужеродную ДНК-зависимую РНК-полимеразу, осуществляющую транскрипцию молекулы ДНК, кодирующую рекомбинантный вирус Сендай.
19. Клетка по пп.15-18, отличающаяся тем, что дополнительно содержит молекулу ДНК, кодирующую Р-ген.
20. Способ получения рекомбинантного вируса Сендай по любому из пп.1-9, включающий следующие этапы:
(а) получение клетки, трансфицированной молекулой ДНК, которая кодирует геном рекомбинантного вируса Сендай, содержащий мутацию в Р-гене, приводящую к потере вирусным геномом способности к репликации без потери вторичной способности к транскрипции, и, при необходимости, содержащий по меньшей мере одну последовательность, кодирующую чужеродный генный продукт, и,
(б) культивирование клетки в условиях, при которых происходит транскрипция ДНК согласно (а) и образуется рекомбинантный вирус Сендай.
21. Способ по п.20, дополнительно включающий получение нуклеокапсида или вирусного генома рекомбинантного вируса Сендай.
22. Способ размножения рекомбинантного вируса Сендай по любому из пп.1-9, включающий следующие этапы:
(а) получение клетки, которая инфицирована рекомбинантным вирусом Сендай, содержащим мутацию в Р-гене, приводящую к потере вирусным геномом способности к репликации без потери вторичной способности к транскрипции, и, при необходимости, содержащий по меньшей мере одну последовательность, кодирующую чужеродный генный продукт, и
(б) культивирование клетки в условиях, в которых происходит размножение вируса.
23. Фармацевтическая композиция, содержащая рекомбинантный вирус Сендай по любому из пп.1-9, нуклеокапсид по п.10 или вирусный геном по п.11 в качестве действующего вещества, а также, при необходимости, фармацевтически приемлемые наполнители и/или вспомогательные вещества.
24. Фармацевтическая композиция по п.23, предназначенная для использования в качестве вакцины.
25. Фармацевтическая композиция по п.24, предназначенная для использования в качестве моно- или поливалентной вакцины.
26. Фармацевтическая композиция по пп.23 и 24, предназначенная для использования в качестве вакцины против вирусных инфекций, например в качестве вакцины против инфекций патогенными вирусами с РНК-негативной цепью.
27. Фармацевтическая композиция по п.23, предназначенная для использования в антиопухолевой терапии.
28. Фармацевтическая композиция по любому из пп.23-27, предназначенная для использования у пациентов из групп риска, таких как дети, пожилые люди и пациенты с поврежденной или ослабленной иммунной системой.
29. Фармацевтическая композиция по любому из пп.23-28, содержащая нуклеокапсид в нативной вирусной оболочке.
30. Применение клетки, которая конститутивно или репродуцируемо стабильно экспрессирует Р-белок рекомбинантного вируса Сендай для продуцирования или размножения рекомбинантного вируса Сендай по любому из пп.1-9, нуклеокапсида по п.10 или вирусного генома по п.11.
31. Применение по п.30, отличающееся тем, что клетка является клеткой млекопитающего.
32. Применение по пп.30 и 31, отличающееся тем, что клетка выбрана из клетки Н29 (DSM ACC2702) или производной от нее клетки.
Текст
РЕКОМБИНАНТНЫЙ ВИРУС СЕНДАЙ С ОСЛАБЛЕННОЙ СПОСОБНОСТЬЮ К РЕПЛИКАЦИИ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ВАКЦИН Изобретение относится к рекомбинантному вирусу Сендай, обладающему ослабленной способностью к репликации генома и способного к транскрипции, который можно использовать для экспрессии трансгенов и, в частности, для разработки вакцин. Вирусный геном содержит мутацию в гене Р.(71)(73) Заявитель и патентовладелец: МАКС-ПЛАНК-ГЕЗЕЛЬШАФТ ЗУР ФРДЕРУНГ ДЕР ВИССЕНШАФТЕН Е.В. (DE) 015013 Изобретение относится к имеющему ослабленную способность к репликации и обладающему транскрипционной активностью рекомбинантному вирусу Сендай с РНК с негативной цепью, который может использоваться для экспрессии трансгенов и, в частности, в области разработки вакцин. Иммунизация живыми вакцинами аналогична естественной инфекции и вызывает универсальный иммунный ответ. При вакцинации используют ослабленные, но способные к размножению вирусы. Размножение вирусов должно происходить настолько медленно, что гарантируются иммунологический ответ и, тем самым, контролирование размножения или уничтожение вируса. Концепция живой вакцины многократно подтвердилась на различных возрастных группах. Правда, имеются важные целевые группы, иммунизация которых живыми вакцинами проблематична и требует дополнительных мер предосторожности. Материнские антитела защищают новорожденных в первые месяцы жизни. Одновременно они создают барьер, который должен быть преодолен при иммунизации живой вакциной, но чтобы при этом, с другой стороны, не наблюдалось излишнего размножения вируса вакцины и связанных с этим отрицательных последствий вакцинации. Другой целевой группой являются пожилые люди, иммунная система которых уже не настолько сильна, поэтому могут проявиться перегрузка в результате вакцинации и отрицательные последствия вакцинации из-за усиленного размножения вируса вакцины. Таким образом, существует проблема сделать иммунологически отличную живую вакцинацию еще надежнее для применения на определенных целевых группах, а также повысить профиль надежности для общего ее применения. Вирусы с РНК с негативной цепью, как например, вирус бешенства или вирус Сендай (SeV), уже на протяжении нескольких последних лет целенаправленно подвергают модификациям с помощью генной инженерии. ЕР-А-0702085 описывает приготовление рекомбинантных, инфекционных, воспроизводящихся несегментированных вирусов с РНК с негативной цепью из клонированной кДНК. ЕР-А-0863202 описывает рекомбинантный вирус Сендай, в геноме которого есть внедренный чужеродный ген или же один ген удален или инактивирован, но репликация такого генома еще не нарушена. В качестве основы вакцины особенно пригодны вирусы с РНК с негативной цепью, так как их размножение происходит в цитоплазме и гены внутри генома вируса могут легко обмениваться. Так, уже удалось успешно получить рекомбинантные вирусы с поверхностными белками различных типов вирусов и использовать их в качестве вакцины в опытах с животными (Schmidt et al., J. Virol. 75 (2001), 45944603 и WO 01/42445). Путем рекомбинантного встраивания F- и HN-белков человеческого парагриппозного вируса типа 3 (hPIV 3) и G- или F-белков респираторного синциального вируса (RSV) в вектор на основе коровьего парагриппозного вируса типа 3 (bPIV 3) удалось выявить при применении на хомяках мукозный иммунный ответ на hPIV 3 и RSV. Бивалентная антигенность этой испытанной в опытах с животными живой вакцины, таким образом, уже достигнута. Из-за включения видовых барьеров коровий парагриппозный вирус должен быть достаточно разбавлен поверхностными антигенами человеческого PIV 3 и RSV для того, чтобы быть использованным на человеке. Мутации по отношению к исходному виду ожидать не следует, так как все гены для вирусных поверхностных белков подверглись обмену. Уже начали клинические испытания вакцины. Поскольку описанные мутанты вируса обладают способностью к репликации, в подвергнувшемся вакцинации наверняка происходит размножение вируса, которое хотя и ослаблено в результате модификации вируса, но все-таки не исключено полностью. Интенсивность ожидаемой вирусемии, а одновременно и проявление у вакцинированного побочных эффектов зависят при этом от индивидуальных факторов. В рамках настоящего изобретения сделана попытка существенно уменьшить отрицательные последствия вакцинации живыми вакцинами, в частности отрицательные последствия для вакцинированных из определенных целевых групп. Подход к этому заключается в подавлении репликации вирусного генома после введения вакцины. С помощью этого можно, независимо от иммунологической реакции вакцинированного, исключить размножение вируса и соответствующие вредные последствия вакцинации. При таком подходе главная трудность заключается в том, что вирусная РНК-полимераза выполняет две функции, а именно синтеза вирусной мРНК и размножения вирусного генома. Эта двойственность в новой вакцине должна быть устранена, так как вакцина должна быть в состоянии только лишь осуществлять синтез вирусной мРНК. Другая проблема заключается в том, что рекомбинантный вирус должен обладать способностью к эффективному синтезу вирусной мРНК, чтобы вообще быть пригодным в качестве живой вакцины. Таким образом, имеются два принципиально противоречащих друг другу требования, которые дают основание для значительных трудностей при приготовлении надежной и эффективной живой вакцины на основе вирусов с РНК с негативной цепью.Shoji et al. (Virology 318 (2004), 295-305) описывают приготовление не имеющего Р-гена вируса бешенства и приводят его характеристику. Получают этот вирус с помощью вспомогательных клеток с экспрессией Р-белка. Вирусы без de/novo/синтеза Р-белка в состоянии осуществлять только первичную транскрипцию. Слабая вирусная экспрессия генов проявляется в очень слабом сигнале для N-белка в иммунной флюоресценции и только лишь у очень небольшого количества клеток, более убедительное-1 015013 доказательство этой слабой вирусной экспрессии генов получают лишь методом PCR. Использование этого мутанта вируса в опыте по заражению в модели на мышах имело целью обнаружение защиты,правда отсутствует контрольный эксперимент с неактивным в отношении транскрипции вирусом и интервал для вирусного заражения слишком короток. Продолжительность предполагаемой защиты не исследовалась. Использование таких вирусных мутантов для приготовления разбавленной вакцины против бешенства видится, таким образом, малообещающим. В рамках ведущих к настоящему изобретению исследований установлено, что у парамиксовирусов разъединение функций репликации и транскрипции может быть достигнуто тем, что составные части полимеразы, которые ответственны за функцию репликации генома, частично удаляются. При этом речь может идти об одном из вирусных белков N, Р и L или о специальной функциональной области такого белка. Неожиданно было установлено, что в результате мутаций, при которых функция кодированных вирусными генами N, L или/и Р белков исключается не полностью, а частично, могут быть получены РНК вирусы с ослабленной способностью к репликации, которые обладают достаточной транскрипционной функцией для того, чтобы быть пригодными для приготовления живых вакцин. Предметом настоящего изобретения является, таким образом, рекомбинантный вирус Сендай, который имеет ограниченную репликацию и обладает транскрипционной активностью. Соответствующий изобретению вирус имеет вирусный геном с мутацией в гене Р, приводящей к потере репликации генома без потери вторичной транскрипционной активности. Соответствующий изобретению вирус может быть использован для приготовления живых вакцин, в частности для приготовления живых вакцин с повышенной степенью надежности, которые особенно пригодны для пациентов из групп риска со слабой или нарушенной иммунной системой. Изобретение также относится к нуклеокапсиду, включающему негативную цепь РНК рекомбинантного вируса Сендай, комплексированную с белками N, L и Р, а также к изолированной негативной цепи РНК рекомбинантного вируса Сендай. Следующим предметом изобретения является кДНК, которая кодирует соответствующую изобретению РНК с негативной цепью, в частности, вирусную РНК или/и комплементарную к ней РНК. Следующим предметом изобретения является клеточная линия для размножения соответствующего изобретению рекомбинантного вируса Сендай. Соответствующий изобретению рекомбинантный вирус с РНК с негативной цепью можно получить в результате мутации исходного вируса по меньшей мере в одном из генов N, L и Р. Исходным вирусом может быть природный вирус с РНК с негативной цепью, в частности, из семейств Paramyxoviridae илиRhabdoviridae или их рекомбинантных вариантов. Особенно предпочтительными представителями являются парамиксовирусы, например вирус Сендай (hPIV) типов 1, 2, 3, 4 а или 4b, вирус ньюкаслской болезни, вирус паротита, вирус кори, или человеческий респираторный синциальный вирус (hRSV) или рабдовирусы, например, вирус везикулярного стоматита (VSV). Особенно предпочтителен из вирусов вирус Сендай, например штамм Fushimi (АТСС VR105). Кроме того, изобретение относится также к рекомбинантным вариантам вышеназванных вирусов, как они, например, описаны в ЕР-А-702085, ЕР-А 0863202 или WO 01/42445. К другим предпочтительным вирусам с РНК с негативной цепью относятся представители Rhabdoviridae, Filoviridae, Borraviridae, Arenaviridae или Bunyaviridae, например VSV. Вирус Сендай, как и другие парамиксовирусы, является оболочечным вирусом со спиральным нуклеокапсидом (фиг. 1). Оболочка состоит из липидной мембраны, которая образуется из плазменной мембраны клетки-хозяина, из которой был выделен вирус. В вирусной оболочке закреплены трансмембранные гликобелки, а именно белок слияния (F) и гемагглютинин-нейрамидаза (HN). Матричный белок (М) покрывает внутреннюю сторону мембраны. Находящийся в оболочке нуклеокапсид состоит из одноцепочной РНК в комплексе с нуклеобелком (N), причем 6 нуклеотидов связаны одним N-белком, зависимой от РНК РНК-полимеразой (L) и кофакторным фосфобелком (Р). Геном РНК с негативной цепью у вируса Сендай содержит 6 структурных белков в следующей последовательности: 3'-N-P/C-M-F-HN-L-5' (фиг. 2). Р/С-ген кодирует всего 8 белков, структурный фосфобелок и все известные в настоящее время неструктурные белки. Белки Р, N и L важны для функциональной транскрипции и репликации (Lamb et al., Paramyxoviridae: The Viruses and their Replication (Семейство Paramyxoviridae: вирусы и их репликация) Fields Virology, 4. Auagabe (2001) Lippicott, WilliamsWilkins, Philadelphia, 1305-1340). Соответствующий изобретению вирус с РНК с негативной цепью имеет мутацию по меньшей мере в одном из генов N, L и Р. Мутацией, которая приводит к ослаблению репликации вируса, но не лишает его способности к транскрипции, может быть делеция, замещение или/и инсерция в одном из генов N, L или Р. Мутация затрагивает преимущественно тот участок последовательности кодированных генами N,L или/и Р белков, который необходим для репликации, в то время как необходимые для транскрипции участки последовательности остаются функционально способными. В одном из предпочтительных вариантов осуществления изобретения рекомбинантный вирус имеет мутацию в гене Р, а именно в N-терминальном участке последовательности гена Р. Мутация касается-2 015013 предпочтительно, по меньшей мере, области аминокислот 33-41 белка Р, которые важны для репликационной способности. Кроме того, предпочтительно, если не имеет вредящих транскрипционной функции мутаций С-терминальная область (с аминокислоты 320). Особенно предпочтительной является вызывающая потерю репликационной способности мутация в области аминокислот 2-77, например, делеция аминокислот (а) кодированного геном Р белка или одного участка (b) последовательности из достаточных для потери репликационной способности участков последовательности аминокислот (а). Соответствующие мутации могут происходить и в Р-белках других вирусов с РНК с негативной цепью, например,других парамиксовирусов, например hPIV3. Соответствующий изобретению рекомбинантный вирус имеет ограниченную репликацию и обладает транскрипционной активностью. Потеря репликационной способности означает, что в клетке-мишени(клетке, которая не обладает устраненными мутацией функциями in trans) не обнаруживается никаких следов размножения генома вируса, причем, в отличие от уменьшенной или конициональной ограниченной репликации, нет в наличии и никаких разрешительных условий, при которых может происходить репликация. Определять потерю репликационной способности можно способом, описанным в примере 8. Соответствующий изобретению вирус, однако, в состоянии транскрибировать после инфицирования в клетке-мишени кодированный им генный материал, поэтому может происходить экспрессия вирусных белков, в том числе одного или нескольких чужеродных генных материалов в клетке-мишени. Важно то,что соответствующий изобретению рекомбинантный вирус обладает способностью к вторичной транскрипции, т.е. вирусные генные материалы, которые образуются в результате первичной транскрипции с первоначально содержавшимися в нуклеокапсиде белковыми компонентами, в состоянии сами вызывать или/и поддерживать вторичную транскрипцию. Размер вторичной транскрипции имеет при этом следствием синтез белка предпочтительно, по меньшей мере, в количестве 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4% или по меньшей мере 5% по сравнению с диким типом вируса, т.е. вирусом без мутации по меньшей мере в одном из генов N, L и Р. Способность к вторичной транскрипции по сравнению с соответствующим диким типом вируса может уменьшиться, предпочтительно, однако, на более чем в 20 раз, особенно предпочтительно в 10 раз. Способность к вторичной транскрипции можно определить, как в примере 7.1 или/и 7.3, путем количественного определения экспрессии одного из чужеродных генных материалов, например одного из репортерных белков. Соответствующий изобретению рекомбинантный вирус наряду с мутацией имеет предпочтительно по меньшей мере один трансген, т.е. по меньшей мере одну кодирующую чужеродный генный материал последовательность. Чужеродным генным материалом может быть белок, например репортерный белок,например флюоресцентный белок, как например GFP или его производное, или антиген, на который должен даваться иммунный ответ, или терапевтический белок, например белок для вирусной терапии,или же функциональная РНК-молекула, например, антисмысловая РНК, один из рибозимов или одна из обладающих интерференцией siPHK-молекул. Предпочтителен чужеродный генный материал в виде антигена, который происходит от патогенов, как например вируса, бактерии, гриба или протозоа, а также опухолевого антигена или автоантигена. Особенно предпочтителен антиген в виде вирусного антигена,который происходит от чужеродного вируса с РНК с негативной цепью, как например, от человеческого парагриппозного вируса или RSV, например, hPIV3 F и HN или hRSV F и G. Соответствующий изобретению вирус может содержать одну или несколько, например две или три, кодирующих чужеродный генный материал последовательностей. Кодирующие чужеродные генные материалы последовательности могут быть встроены в геном рекомбинантного вируса. С другой стороны, кодирующие чужеродные генные материалы последовательности, например гены F или/и HN, могут также замещаться последовательностями, которые кодируют чужеродные генные материалы, например химерные генные материалы. Возможны и комбинации встроенных и замещенных трансгенов. Так, например, последовательности вируса Сендай замещаются полностью или частично чужеродными последовательностями других вирусов с РНК с негативной цепью, например последовательностями парагриппозных вирусов, например hPIV3 или/и последовательностяи RSV. Особенно предпочтительны для применения химерные последовательности, т.е. последовательности, которые состоят из участков чужеродного вирусного генома. Например, могут быть внедрены в вирусный геном химерные геныF или/и HN, которые состоят из последовательностей генома базового вируса, например вируса Сендай,и из чужеродных последовательностей, например из человеческих парагриппозных вирусов, как например hPIV3, или/и RSV. Рекомбинантный вирус может содержать один или несколько разных трансгенов. В случае наличия нескольких трансгенов, они могут быть одинакового или разного происхождения, они могут, например,происходить от одного и того же или от разных патогенов, например вирусов. Так, например, могут присутствовать трансгены из нескольких, например 2 или 3, различных патогенов, предпочтительно вирусов, особенно предпочтительно вирусов с РНК с негативной цепью. Встраивание трансгенов в парамиксовирусы описано, например, Hasan et al. (J. Gen. Virol. 78 (1997),2813-2820), Bukreyev et al. (J. Virol. 70 (1996), 6634-6641), Yu et al. (Genes Cells 2 (1997), 457-466), Masaki(Mol. Therapy 7 (2003), 210-217). Предпочтительно трансгены встраиваются в 3'-область вирусного генома. Инсерция происходит, например, в форме транскрипционных кассет, причем на векторном уровне(т.е. на уровне вектора, например плазмидного вектора, который кодирует РНК с негативной цепью) встраиваются непосредственно после лидерной области одна или несколько транскрипционных кассет с уникальными рестрикционными сайтами для интеграции соответствующих считывающих рамок. Интеграция нескольких трансгенов происходит предпочтительно в соответствующих независимых транскрипционных кассетах. Транскрипционная кассета преимущественно содержит кодирующую чужеродный генный материал последовательность в оперативной связи с последовательностью старта транскрипции и последовательностью завершения транскрипции и преимущественно трансляционными сигналами. Другим предметом настоящего изобретения является одноцепочная или двуцепочная молекула ДНК, например, кДНК-молекула, которая кодирует соответствующий изобретению рекомбинантный вирусный геном с РНК с негативной цепью или его предшественник или же вирусный антигеном или его предшественник. Термин "предшественник" в данной связи означает, что ДНК-молекула еще не содержит никакой кодирующей чужеродный генный материал последовательности, а лишь место клонирования для включения такой последовательности. Место клонирования может быть рестрикционным сайтом встраивания, например единичным или множественным рестрикционным сайтом встраивания в ДНК или составным сайтом клонирования, включающим несколько следующих друг за другом рестрикционных сайтов, предпочтительно единичных рестрикционньгх сайтов. Кодирующая геном вируса или/и комплементарную последовательности ДНК-молекула предпочтительно находится в функциональной связи с соответствующими последовательностями контроля экспрессии. ДНК-молекула предпочтительно является вектором, например, плазмидным вектором, который пригоден для размножения в пригодной для этого клетке-хозяине, т.е. в векторной или плазмидной размножающей клетке, предпочтительно в прокариотической клетке, а также в эукариотической клетке, в частности в клетке млекопитающего, и имеет для этого необходимые генетические элементы, как например, источник репликации, последовательности интеграции или/и последовательности селекционного маркера. Молекула ДНК включает последовательность, кодирующую рекомбинантный вирус или комплементарную последовательности, предпочтительно под контролем транскрипционных сигнальных последовательностей, поэтому при транскрипции ДНК-зависимой РНК-полимеразой в пригодной для первичного приготовления вируса клетке-хозяине, т.е. в клетке для приготовления вируса, может образовываться вирусная РНК с негативной цепью. Транскрипционный сигнал выбирается таким, что он делает возможной эффективную транскрипцию ДНК в соответственно примененной клетке-хозяине. Для этого может применяться также чужеродный для соответствующей клетки транскрипционный сигнал, например, промотор бактериофагов, как например Т 7- или SP6-промотор, причем клетка для приготовления вируса должна в этом случае содержать и соответствующую чужеродную обеспечивает ДНК-зависимую РНК-полимеразу, например Т 7- или SP6-РНК-полимеразу, которая вызывает транскрипцию. Кроме того,молекула ДНК содержит наряду с транскрипционным сигналом предпочтительно на 3'-конце кодирующей рекомбинантный вирус последовательности терминатор транскрипции и последовательности рибозима, которая делает возможной расщепление транскрипта на конце вирусной последовательности. Клетка для приготовления вируса является преимущественно эукариотической клеткой и в первую очередь клеткой млекопитающего. Соответствующие изобретению производящие вирус клетки содержат кроме ДНК, кодирующей парамиксовирус с ослабленной репликацией, вспомогательные последовательности, генные материалы которых делают возможным сборку соответствующего изобретению рекомбинантного вируса РНК intrans. Для этого эти клетки могут, например, содержать, кроме того, один или несколько векторов, которые вырабатывают N-белок, Р-белок или/и L-белок in trans. В результате этого оказывается возможной сборка нуклеокапсидов соответствующего изобретению рекомбинантного вируса в производящей клетке. Размножение собранного вначале в производящей вирус клетке рекомбинантного вируса происходит в производящей вирус клетке, которая инфицирована соответствующим изобретению вирусом. Кроме того, размножающая вирус клетка содержит вышеназванные вспомогательные последовательности для выработки N-белка, Р-белка или/и L-белка in trans. Предпочтительно применяют клетку для размножения вируса, в которой происходит постоянная экспрессия вспомогательных последовательностей, например, путем геномной интеграции. Размножающей вирус клеткой является преимущественно клетка млекопитающего. Особенно предпочтительной клеткой для размножения является производная от клетки 293, человеческой эмбриональной клеточной линии почечных фибропластов, клетка Н 29 или производная от нее клетка. Клетка Н 29 депонирована 05.11.2004 (DSM АСС 2702) соответственно условиям Будапештского договора в ГмбХ Немецкая коллекция микроорганизмов и клеточных культур, Брауншвейг, (улица) Maschroder Weg. Кроме того, пригодны клетки, производные от клеток Vero, линии почечных клеток африканской зеленой мартышки, или от LLCMK2-клеток, линии почечных клеток резус обезьян, которые устойчиво трансфицированы соответствующими вспомогательными последовательно-4 015013 стяи, например SeV N- и Р-генами. Следующим предметом изобретения является, поэтому, клетка, преимущественно эукариотическая клетка и, особенно предпочтительно, клетка млекопитающего, которая (i) содержит молекулу ДНК, которая кодирует геном соответствующего изобретению рекомбинантного вируса или/и его комплементарную последовательности или его предшественник, или/и (ii) содержащий РНК-геном соответствующего изобретению вируса. Данная клетка, как рассмотрено выше, может быть клеткой для размножения вектора, клеткой для приготовления вируса или клеткой для размножения вируса. Если эта клетка является клеткой для размножения вектора, например клеткой для размножения плазмид, то для размножения соответствующего вектора можно применять любую пригодную для этого клетку, например, и прокариотическую клетку, как например, трансформированную клетку E.coli. Если эта клетка является клеткой для выработки или клеткой для размножения вируса, то она содержит вспомогательные последовательности для выработки вирусных белков N, Р или/и L in trans. Интегрированная для выработки вируса ДНК находится преимущественно под управлением чужеродного транскрипционного сигнала, причем лучше, если клетка, кроме того, содержит ДНК, которая кодирует чужеродную ДНК зависимую РНК-полимеразу, которая распознает чужеродный транскрипционный сигнал и вызывает транскрипцию ДНК, кодирующей рекомбинантный вирус с РНК с негативной цепью. Если эта клетка является клеткой для размножения вируса, то она инфицирована геномной вирусной молекулой РНК, например, в форме нуклеокапсида, и содержит вспомогательные последовательности в постоянно экспримируемой форме. Еще одним предметом настоящего изобретения является способ получения соответствующего изобретению рекомбинантного вируса с РНК с негативной цепью, включающий следующие этапы: (а) получение клетки для приготовления вируса, которая инфицирована молекулой ДНК, кодирующей геном вируса с РНК с негативной цепью, имеющего мутацию, по меньшей мере, в одном из генов N, Р и L, которая приводит к потере способности генома к репликации без потери способности к транскрипции, а также, при необходимости по меньшей мере одну кодирующую чужеродный генный материал последовательности и (b) культивирование клетки-хозяина в условиях, при которых происходит согласно (а) транскрипция молекулы ДНК и вначале образуется рекомбинантный вирус с РНК с негативной цепью. Клетка-хозяин предпочтительно в состоянии вырабатывать N-белок, Р-белок и/или L-белок in trans, например, путем трансфекции с соответствующими вспомогательными капсидами, которые содержат кодирующие белки N, Р или/и L последовательности. Для приготовления больших количеств нуклеокапсидов или вирусных частиц используют преимущественно клетку, которая конститутивно или репродуцируемо постоянно экспримирует белки N, L или/и Р, преимущественно, по меньшей мере, белок Р вируса с РНК с негативной цепью. Таким образом,изобретение относится и к способу размножения соответствующего изобретению рекомбинантного вируса с РНК с негативной цепью, предусматривающему этапы: (а) получение размножающей вирус клетки, которая инфицирована геномом вируса с РНК с негативной цепью, имеющим мутацию по меньшей мере в одном из генов N, L и Р, которая приводит к потере геномом репликационной способности без потери транскрипционной способности, а также, при необходимости по меньшей мере одну кодирующую чужеродный генный материал последовательности и (b) культивирование клетки-хозяина в условиях, приводящих к размножению вируса. Еще одним предметом настоящего изобретения является фармацевтическая композиция, включающая рекомбинантный, с ограниченной способностью к репликации и способный к транскрипции вирус с РНК с негативной цепью, как он был описан выше, или его нуклеокапсид в качестве действующего вещества, а также, при необходимости, обычно применяемые в фармацевтике наполнители или вспомогательные вещества. Фармацевтическая композиция пригодна для применения в медицине и ветеринарии. Его можно, в частности, применять в качестве вакцины или для противоопухолевой терапии, в частности для применения на пациентах из групп риска, как например, на детях, пожилых пациентах или/или пациентах с поврежденной или слабой иммунной системой. Фармацевтическая композиция может при этом содержать вирус с РНК с негативной отрицательной цепью в его нативной вирусной оболочке. Особенно предпочтительно применение в качестве вакцины, например вакцины против таких патогенов, как вирусы, бактерии или простейшие. Если рекомбинантный вирус содержит один или несколько трансгенов одинакового происхождения, например из одного и того же патогена, речь идет о моновалентной вакцине. Если рекомбинантный вирус содержит трансгены разного происхождения, то он может быть использован также и в качестве поливалентной вакцины, например, в качестве бивалентной или тривалентной вакцины. Например, поливалентная вакцина может быть использована против нескольких патогенных вирусов, например, против нескольких патогенных вирусов с РНК с негативной цепью, как например, человеческого парагриппозного вируса и RSV. Соответствующая изобретению вакцина в состоянии вызывать гуморальный иммунный ответ, преимущественно образование нейтрализующих антител или/и Т-клеточный иммунный ответ. Особенно предпочтительно вызывается гуморальный иммунный ответ и Т-клеточный иммунный ответ. Фармацевтическая композиция может быть в форме раствора, суспензии, лиофилизата или в любой другой пригодной форме. Наряду с действующим веществом состав может содержать средство для регу-5 015013 лирования рН, буфер, средство для регулирования осмотического давления, смачивающее средство и т.п., а также активизирующие иммунную систему вещества. Введение может осуществляться обычным путем, например, орально, накожно, назально, пульмонально и т.д. в форме аэрозолей, жидкостей, порошков и т.д. При этом пациенту вводят терапевтически эффективную дозу вируса, причем эта доза зависит от соответствующего способа применения (например, виротерапия или вакцина), вида заболевания, состояния здоровья и веса пациента, способа введения и формы лекарственного средства. Обычно в разовой дозе вводят 103-107 вирусных частиц, особенно предпочтительно примерно 104-106 вирусных частиц. При необходимости можно вводить одновременно несколько разных вирусных частиц, например, в случае комбинированных вакцин. Введение может проводиться одно- или многократно, в зависимости от потребности. Предпочтительными областями применения являются, например, профилактика или лечение респираторных вирусных болезней. Далее изобретение раскрывается с использованием нижеследующих фигур и примеров. Сведения, подтверждающие возможность осуществления изобретения 1. Общие сведения. Фиг. 1 отражает строение одного из вирусов Сендай (SeV) по Филдсу, Fields (Virology. Lippincott,Williams и Wilkins (2001), 4. издание; измененное). Геном состоит из одноцепочной РНК, которая представлена белками N, Р и L, в форме нуклеокапсида. Нуклеокапсид окружен мембранной оболочкой, в которой размещены белки HN и F (состоящие соответственно из F1- и F2-подъединиц). С внутренней стороной мембраны ассоциирован белок М, который одновременно присутствует и в соединениях с компонентами нуклеокапсида. Геном из одноцепочной негативно ориентированной РНК вируса Сендай дикого типа состоит из 15384 нуклеотидов. Гены 6 структурных белков расположены в нем в последовательности 3'-N-P/C-M-FHN-L-5' (фиг. 2). Между генами имеются мостики из 50-80 нуклеотидов, в каждом из которых имеется сильно консервативный участок из 22 нуклеотидов: терминирующий сигнал предшествующего гена,межгенная последовательность и инициирующий сигнал для последующего гена. Единицу, состоящую из инициирующего сигнала, открытой считывающей рамки (ORF), в соответствующих случаях нетранслируемых участков и терминирующего сигнала называют транскрипционной кассетой. Перед N-концом находится состоящая из 55 нуклеотидов лидирующая последовательность (ld), которая транскрибируется, но не транслируется. Вслед за L-геном располагается состоящая из 54 нуклеотидов терминирующая последовательность (tr). Указанные ld-участок и tr-участок выступают в качестве геномных и антигеномных промоторов реликации генома или антигенома. Образовавшиеся путем транскрипции мРНКмолекулы, за исключением Р/С-РНК, являются моноцистронными. Цикл размножения вируса Сендай включает внедрение в клетку-хозяина, транскрипцию и трансляцию, а также репликацию и созревание вируса с последующим выходом вновь выработанных вирусов. В процессе транскрипции особенно активно участвуют белки N, Р и L, причем L представляет вирусная РНК-зависимая РНК-полимераза со всеми каталитическими активностями. Так как геном вируса Сендай представлен в негативноцепочной ориентации, вирусная РНК не может переводиться непосредственно в белки. Сначала происходит первичная транскрипция в мРНК с помощью РНК-полимеразы, которая ассоциированно с нуклеокапсидом вводится в клетку. Фиг. 3 является схематичным изображением процесса транскрипции вируса Сендай. В нем полимеразный комплекс, состоящий из одного L-белка и одного гомотетрамера из Р-белков, перемещается по упакованной N-белками РНК в направлении 5'-конца. При этом считывается генетическая информация на геномной РНК с негативной цепью и транскрибируется в мРНК с положительной цепью. Репликация генома включает выработку новых геномов вируса с отрицательной цепью. Для этого сначала образуются антигеномы, которые затем служат в качестве матриц для образования геномов. Поскольку транскрипция начинается на 3'-конце генома (ld), необходимо переключение из режима транскрипции в режим репликации. Это переключение обусловливается большим количеством свободного Nбелка в клетке. Репликация может происходить лишь после того, как образовалось достаточное количество N-белка после трансляции мРНК-молекул. После того, как появится в наличии антигеном, который по всей своей длине находится в комплексе с N-белками, эта матрица сможет служить для выработки других геномов. Они также упаковываются непосредственно N-белками. За процесс репликации опять же ответственны белки N, Р и L (фиг. 4). Во время репликации вируса в результате увеличивающегося количества мРНК-молекул все больше синтезируется и вирусных белков. Затем комплексы из вирусных РНК и вирусных белков (нуклеокапсиды) транспортируются в форме секреторных пузырьков к цитоплазматическим мембранам, где происходит капсулирование вирусных частиц поверхностными белками и их почкование. В рамках настоящего изобретения получают рекомбинантные вирусные мутанты, у которых функции транскрипции и репликации разделены, т.е. вирусы являются способными к транскрипции, но имеют ослабленную способность к репликации. Отсутствующая функция репликации генома для выработки вирусных частиц или их нуклеокапсидов должна компенсироваться вспомогательными клетками, которые комплементируют отсутствующий или с ослабленной функцией вирусный белок in trans. Предпоч-6 015013 тительной вспомогательной клеткой такого рода является клеточная линия Н 29 (Willenbrink и Neubert, J.Virol. 68 (1994), 8413-8417). Эта клеточная линия в рамках настоящей заявки депонирована 05.11.2004 согласно условиям Будапештского договора под регистрационным номером DSM ACC2702. Для выработки вирусов с ослабленной способностью к репликации, но способных к транскрипции удален не весь ген, кодирующий Р-белок, а только ответственный за репликацию генома домен. Так, из более ранних работ (Curran, Virology 221 (1996), 130-140; Curran et al. J. Virology 69 (1995), 849-855) известно, что в invitro системе при делеции аминокислот 2-77 белка Р ингибируется репликация генома, в то время как вирусная транскрипция остается активной. На фиг. 5 схематично изображен Р-белок с его N- и С-концевыми доменами (PNT, РСТ), доменами тетрамеризации (аминокислоты 320-446), Р:L-доменами (аминокислоты 411-445) и P:RNPсоединительными доменами (аминокислоты 479-568). Для отключения функции репликации вирусного генома при одновременном сохранении способности к синтезу вирусной мРНК выбрана делеция первых 77 аминокислот белка Р. При этом впервые был получен соответствующий мутант вируса Сендай (SeVP2-77), в котором делегирована 5'-концевая область P-ORF. У таких вирусов могут кодироваться толькоN-терминально укороченные Р-белки. Изучение инфицирования показало, что вирусные мутанты в клеточной культуре не способны к размножению. С помощью вспомогательной линии Н 29 (DSM ACC2702),которая, кроме всего прочего, производит требуемый Р-белок дикого типа, может достигаться размножение вирусного мутанта. Эффективность размножения вируса составляет примерно 45% в сравнении с вирусом Сендай дикого типа. После инфицирования соответствующий изобретению вирусный мутант в состоянии экспримировать вирус-специфические трансгены в инфицированные клетки. Произведенный вирусным мутантом укороченный белок Р в достаточной степени поддерживает вторичный синтез вирусной мРНК. Синтез вирус-специфических белков продолжается в инфицированных клетках на протяжении нескольких дней и по сравнению с диким типом вируса ослаблен лишь примерно в 10 раз, поэтому при использовании мутанта в качестве вакцины можно с уверенностью ожидать достаточный иммунный ответ. 2. Получение конструктов для имеющих ослабленную способность к репликации векторов вируса Сендай (SEVV). Приготовление кДНК-конструкта pSeV-X. Кодирующая транскрипционная кассета была встроена в 3'-область SeV, штамм Fushimi (ATCCVR105). У всех мутаций генома обязательно общее число нуклеотидов рекомбинантного генома SeV должно быть кратным шести ("правило шести"). На основе использованной в качестве матрицы кДНК pSeV были выработаны два PCR-фрагментаPCR XI и PCR XII для приготовления pSeV-X (фиг. 6), PCR X I (370 bp) состоит из последовательности Т 7-промотора (Т-7 Prom.), лидерной (ld)-последовательности, начала N-гена с 5'-конца до инициаторного кодона N-ORF Open Reading Frame - открытой рамки считывания). С помощью обратного праймера X I(+) (табл. 3) был встроен единичный рестрикционный сайт Notl и 24 нуклеотида последовательности конца N-конца гена. Указанные 24 нуклеотида последовательности N-конца гена в PCR X I, встроенные посредством мутагенного праймера X I (+), на следующем этапе конструирования выполняют роль области перекрытия с PCR XII.PCR XII (970 bp) состоит из последовательности N-начала гена и первой трети N-ORF. Через прямой-праймер XII была встроена последовательность 3'-NTR N и последовательность N конца гена, а также межгенная область (IR). Обратный-праймер X II (+) осуществляет связь в первой трети N-ORF после единственного Sphl-сайта в геноме SeV. Ампликон PCR X I располагался в 3'-области комплементарно к 5'-области PCR X II. Через эту область могли объединяться оба указанных PCR-фрагмента X I и X II. После PCR продукт (1310 bp) в результате рестрикционного расщепления Mlul и Sphl мог встраиваться в аналогично обработанный Mlul и Sphl вектор pSeV. Из полученных клонов была выделена плазмидная ДНК и проанализирована с помощью рестрикционного анализа и секвенирования на правильность вставки транскрипционной кассеты. Таким образом был получен конструкт кДНК pSeV. Чтобы можно было легко проследить приготовление рекомбинантных вирусов, ген улучшенного зеленого флюоресцирующего белка (eGFP) был встроен в пустую кассету pSeV-X. eGFP-ORF был амплифицирован с помощью PCR из ORFP-N1 (фирма Clontech), причем с помощью мутагенного праймера было соблюдено "правило шести" и достигнуто включение двух фланкирующих сайтов Notl. Образовавшийся PCR-фрагмент размером 771 bp был расщеплен рестрикционным ферментом Notl и методом экстракции из гелей был выделен фрагмент размером 738 bp, который был встроен по сайту Notl pSeV-X в его "пустую" транскрипционную кассету pSeV-X. После трансформации E.coli, плазмида и последующего секветирования выделенной плазмиды был получен конструкт кДHK pSeV-eGFP. 2.2. Получение кДНК-конструкта pSeV-X-X. С помощью конструкта pSeV-X-X нужно было получить две дополнительные рестрикционные кассеты, в которые можно было бы встроить два трансгена. Применение pSeV-X-X в качестве базисного вектора при приготовлении векторов с ослабленной способностью к репликации должно было обеспечить возможность создания вектора с мультивалентными, например, трехвалентными свойствами.pSeV-X-X был получен с помощью PCR, в которой в качестве матрицы был использован pSeV-X(фиг. 7). Прямой праймер XX был гибридизирован с pSeV-X в области сайта Notl и с 3'-NTR предназначенной для встраивания, второй транскрипционной кассеты. Уникальный рестрикционный сайт SgrA1 был встроен с помощью прямого праймера XX между сайтом Notl 3'-NTR. Он выполняет роль уникального рестрикционного сайта для последующего встраивания ORF одного из трансгенов. В PCR-продуктеXX следуют друг за другом конец гена, межгенная область (IR), начало гена и 5'-NTR. С помощью праймера XX (+), который гибридизовали с 5'-NTR, были встроены уникальные рестрикционные сайты Fsel иNru I. Fsel-сайт служит для встраивания ORF-ов второго трансгена. Уникальный Nru-1-сайт был встроен с целью иметь возможность при необходимости встроить третью транскрипционную кассету. ПраймерXX (+) гибридизовали в 3'-области с сайтом Notl pSeV-X. PCR-продукт XX (220 bp) был обработан рестрикционным ферментом Notl и методом гелевой экстракции был выделен фрагмент размером 144 bp. Этот фрагмент, по строению соответствующий "правилу шести", можно было затем встраивать в плазмиду, также расщепленную Notl. После проверки правильности ориентации Notl PCR-фрагмента XX определения первичной структуры плазмида pSeV-X-X была готова. В уникальные сайты Fsel и Nru I можно встраивать любые трансгены. Для исследований в данной работе обе транскрипционные кассеты (X) pSeV-X-X были обеспечены считывающими рамками двух разных флюоресцирующих белков. С одной стороны, была амплифицирована считывающая рамка для флюоресцирующего белка eGFP из экспрессионного плазмида pEGFP-N1 с помощью PCR с соблюдением "правила шести", причем с помощью мутагенного праймера были добавлены два фланкирующих сайта SgrAl. После рестрикционного расщепления с помощью SgrAl и экстракции из геля, фрагмент размером примерно 738 bp встраивали в первую транскрипционную кассету pSeVX-X (pSeV- eGFP-X). Таким же образом, с другой стороны, ORF флюоресцирующего белка DsRed (из плазмида pDsRed, фирма Clontech) с соблюдением "правила шести" с помощью PCR была обеспечена рестрикционными сайтами Fsel, расшеплена, подвергнута экстракции из геля ДНК и этот фрагмент (702bp) был клонирован во вторую транскрипционную кассету в 3'области pSeV- eGFP-X. Таким путем был создан геномный SeV кДНК конструкт pSeV- eGFP- DsRed. 3. Приготовление векторов (SeVV) вируса Сендай с ослабленной способностью к репликации. Были получены кДНК конструкты pSeVV- eGFP-N, Р и L, кодирующие вирусы Сендай с ослабленной способностью к репликации, в которых соответственно делегирован ген белка N, Р и L. Для этого необходимо было с соблюдением "правила шести" делетировать соответствующую считывающую рамку генов N, Р или L, причем должна была остаться некодирующая транскрипционная кассета в соответствующей области (фиг. 8 А). Путем встраивания рестрикционного сайта вместо делетированной ORF в каждом кДНК конструктеpSeVV-eGFP-N, Р и L для последующего использования должна была остаться еще одна функциональная транскрипционная кассета, в которую при необходимости можно было бы включить еще один трансген. В качестве еще одного варианта SeVV с ограниченной способностью к репликации был получен делеционный мутант pSeVV-eGFP-P2-77, который кодирует N-терминально укороченный Р белок, в котором отсутствуют аминокислоты 2-77 (фиг. 8 В). Все клонирования pSeVV-eGFP-N, -Р и -L проводили по одному и тому же принципу. В качестве примера, в ниже следующем абзаце приведено подробное описание клонирования pSeVV-eGFP-Р. Вслед за этим в краткой форме сведены в таблицу различия в клонировании pSeVV-eGFP-N и L. 3.1. Клонирование кДНК-конструктов pSeVV- eGFP-P и pSeVV- eGFP-P2-77.ORF белка была удалена из кДНК конструкта способного к репликации вируса pSeVV-eGFP, чтобы получить новую кДНК pSeVV-eGFP-P, кодирующую вектор с ослабленной способностью к репликации. Вместо P-ORF был встроен Xhol рестрикционный сайт. Для клонирования pSeVV-eGFP-P были созданы и впоследствии объединены два PCR-фрагмента,называемых PCR Р I и PCR Р II. В качестве матриц для обеих PCR-реакций служил pSeVV-eGFP. Для фрагмента PCR Р I (1272 bp) матрицу в области N ORF перед уникальным Sphl-участком гибридизовали с прямым праймером Р I (= N-578; табл. 3). Обратный праймер Р I (+) гибридизовали с матрицей в 5'-NTR области Р-гена перед ATG-кодоном Р, включая рестрикционный сайт Xhol. Фрагмент PCR Р II состоит из 1938 bp, в качестве матрицы использовали pSeV. Прямой праймер Р II гибридизовали с частью 5'-NTR P последовательности, включающий сайт Xhol. Обратный праймерPCR Р II (+) гибридизуется с ORF F гена вслед за уникальным Есо 47 Ш участком и дополнительно имеет не природный Mlul-сайт. Оба PCR-фрагмента Р I и Р II объединяли по Xhol-сайту. Продукт объединения - состоящий из частичной последовательности N ORF, не кодирующей Р-транскрипционной кассеты с включенным рестрикционным Xhol-сайтом, М, а также четверти F ORF - был расщеплен рестрикционными ферментамиSphl и Miul, подвергнут промежуточному этапу клонирования и секвенирования. Из одного из подклонов с правильной последовательностью был вырезан Sphl-Eco47III фрагмент размером 3006 bp, который был лигирован аналогичным образом обработанный вектор pSeVV-eGFP. После проверки последовательности получен pSeVV- eGFP-P клон (геномная вирусная кДНК) (фиг. 9), который использовали для полу-8 015013 чения имеющего ослабленную способность к репликации SeVV-eGFP-P. Для сборки делеционного мутанта pSeVV-eGFP-P2-77 была использована одна PCR с двумя мутагенными праймерами. Прямой праймер "Xhol Р 2-77" имеет один Xhol-сайт, за которым следуют инициаторный ATG-кодон, и кодоны аминокислот 78-86 Р белка. Обратный праймер "Р 2-77 (+) Xhol" содержит 10 последних кодонов Р белка и один сайт Xhol. Считывающая рамка укороченного с N-конца на 76 аминокислот Р-белка была создана с помощью PCR, на основе матрицы pSeV, фрагмент размером 1488 bp в результате двух этапов клонирования был встроен в некодирующую транскрипционную кассету pSeVV- eGFP-P вместо первичной P-ORF. После секвенирования был получен геномный клон кДНК,который использовали для получения имеющего ослабленную способность к репликации pSeVV-eGFPP2-77. Делеция кодонов 2-77 в Р ORF привела к получению N-терминально укороченных неструктурных белков и белков V и W, а из С-семейства кодирующим остается только лишь С', также транкированный; белки С, Y1 и Y2 из-за отсутствия инициаторных кодонов уже не могут транслироваться с укороченной мРНК. 3.2. Клонирование кДНК-конструктов pSeVV-eGFP-N и -L. Получение pSeVV-eGFP-N и pSeVV-eGFP-L проводили аналогично клонированию pSeVV-eGFPP. Схема клонирования приведена в табл. 1. Путем приготовления соответственно двух объединяющихся PCR-продуктов PCR I и PCR II с учетом "правила шести" удалили ORF генов N или L из pSeVV-eGFP и на их место встроили уникальныйApal-рестрикционный сайт как в pSeVV-eGFP-N, так и в pSeVY-eGFP-L. Последовательности праймеров для клонирования pSeVV-eGFP-N, -Р и -L приведены в табл.3. Приготовленные PCR-продуктыPCR I и PCR II были соединены и амплифицированы с помощью прямого праймера PCR I и обратного праймера PCR II. Затем продукты соединения PCR были расщеплены рестрикционными ферментами,имеющими уникальные сайты в pSeV- eGFP и допускают инсерцию соответствующих продуктов в pSeVeGFP (например: Narl при клонировании pSeVV-eGFP-N, см. табл. 1). Очищенный продукт был встроен в расщепленный соответствующими ферментами вектор pSeV-eGFP. Таблица 1. Перечень применявшихся при клонировании pSeVV-eGFP-X праймеров и рестрикционных сайтовRSS = рестрикционный сайт Затем трансформировали Е. coli, и выделяли плазмидную ДНК в аналитических количествах. Плазмиды анализировали методом рестрикционного анализа и секвенирования, далее из каждого положительного клона выделяли по одному плазмидному препарату (прибор DNA Maxi Prep-Kit, Qiagen), в результате чего были получены различные делеционные мутанты pSeVV-eGFP-Х. 4. Приготовление вирусных мутантов с ослабленной способностью к репликации. Из кДНК конструктов pSeVV-eGFP-N, -Р и -L в клеточной культуре были приготовлены SeVвекторы (SeVV-eGFP-X) с ослабленной способностью к репликации. 4.1. Первичное приготовление SeVV-eGFP-X. Для приготовления рекомбинантного SeV с полным геномом инфицируются и трансфицируются кДНК вирусного генома (pSeV), а также кодированными плазмидом генами N, Р и L (pTM-N, -Р, -L;Elroy-Stein et al. (1989) PNAS 86, 6126-6130),или клеточная линия "BSR-T7", которая стабильно экспримирует Т 7 РНК-полимеразу (Buchholz etal. (1999) J. Virol. 73, 251-259),или клеточная культура с рекомбинантным Vaccinia вирусом MVA-T7, который экспримирует Т 7 РНК-полимеразу (Sutter et al. (1995) FEBS 371, 9-12). После этого Т 7-полимераза транскрибирует вирусный антигеном или/и комплементарные последовательности и гены N, Р и L. Экспримированный посредством pTM-N N-белок упаковывает синтезированную вирусную антигеномную или/и комплементарную РНК, и это нуклеокапсидное ядро (RNP) образует вместе с белками Р и L репликационный комплекс, посредством которого может снова приготовляться и упаковываться в нуклеокапсиды геномная РНК (Leyer et al., J. Virol. Meth. 75 (1998), 47-55). В довершение к этому происходит транскрипция всех кодированных вирусом белков и репликация других вирусных геномов (фиг. 10). В отличие от описанного приготовления рекомбинантного SeV wt с полным геном в кодированной плазмидом кДНК pSeVV-eGFP-N, -Р и -L отсутствует генетическая информация соответственно одного гена N, Р или L. В результате этого приготовленные вначале нуклеокапсиды могут теперь экспри-9 015013 мировать два соответствующих гена N, Р или L. Нужное для размножения pSeVV-eGFP-N, -Р и -L нуклеокапсидов количество отсутствующего белка должно вырабатываться, поэтому исключительно посредством управляемой Т 7-промотором экспрессии кодированных плазмидом генов N, Р или L. Приготовление имеющих ослабленную способность к репликации pSeVV-eGFP-N, -Р и -L происходило аналогично приготовлению способных к репликации вариантов SeV в HeLa-клетках (АТССCCL2) или BSR-T7-клетках. После 48-часовой инкубации HeLa-клеток определяли, были ли вирусные частицы pSeVV-eGFP-N, -Р или -L высвобождены в надклеточную среду и как много появилось первичных делеционных мутантов. 4.2. Детекция первичных приготовленных SeVV-eGFP-N, -Р или -L. Клеточные среды HeLa-клеток и BSR-T7-клеток, в которых должны были бы быть первично приготовлены SeVV-eGFP-N, -Р или -L, исследовали на присутствие этих вирусных векторов. SeVV-eGFPN, -Р или -L, в отличие от рекомбинантного SeV wt, интегрировали в 3'-области репортерный ген дляeGFP. Этот детекционный маркер применяли теперь для того, чтобы определить, как много образовалосьSeVV-eGFP-X. В параллельных опытах 5105 клеток Vero (АТСС CCL18) с каждым 1 мл клеточной среды трансфицированных при первичном приготовлении SeVV-eGFP-N, -Р, -L HeLa-клеток и одновременно сSeV wt (MOI=3) коинфицировали с целью транскомплементации отсутствующего белка. В качестве контроля инфицировали клетки Vero или только с 1 мл первично приготовленных SeVV-eGFP или же с первично приготовленными SeVV-eGFP и одновременно с SeV wt (MOI=3). Результат коинфекции клеток с остатками культуры для приготовления SeVV-eGFP-N, -Р или L и SeV wt указывает на то, что все три вирусных мутанта SeVV-eGFP-Х могут быть приготовлены первично и после первичного приготовления в состоянии инфицировать клетки, что можно детектировать с помощью проявляющуюся eGFP-трансгенную экспрессию. Первично можно приготовлять примерно 13102 SeVV-eGFP, 6,7102 SeVV-eGFP-N, 3,2102 SeVV-eGFP-P и 0,55102 SeVV-eGFPL вирусных мутантов. 5. Размножение SeVV-eGFP-X. Определяли, могут ли размножаться векторы SeVV-eGFP-X, т.е. функциональны ли они биологически. Способность к репликации определяли в первую очередь по выработке белков отсутствующих генов N, Р или L путем вирусной транскомплементации с SeV. 5.1. Подтверждение способности SeV к размножению. Прежде всего нужно было доказать, что мутанты при соответствующей транскомплементации посредством вируса SeV wt в состоянии размножаться и при этом инфицировать окружающие их клетки. Для изучения способности SeVV-eGFP-X к размножению опять же предлагается коинфекция клеток сSeVV-eGFP-X и SeV wt. Клетки в этом исследовании инфицировали SeV wt при низкой MOI, коинфицировали с SeVV-eGFP-X и в течение нескольких дней инкубировали, чтобы таким образом можно было детектировать распространение векторов SeVV-eGFP-X по увеличивающемуся количеству флюоресцирующих клеток. Одновременно в среднем со 100 мл первично приготовленных SeVV-eGFP-N, -Р или -L и SeVwt (MOI=0,2) инфицировали 5105 клеток Vero. В качестве положительного контроля служила коинфекция клеток Vero с примерно 100 частицами способного к репликации вируса SeVV-eGFP и SeV wt. В течение 48-часовой инкубационной фазы наблюдали размножение всех трех делеционных мутантов: сначала, естественно, флюоресцировали только отдельные клетки Vero, которые были коинфицированыSeVV-eGFP-Х и SeV wt. Примерно через 24 ч из этих клеток были высвобождены вирусные частицы,которые теперь были в состоянии проникать в прилегающие к ним клетки. Если эти клетки снова инфицировали одновременно с SeVV-eGFP-X и SeV wt, то и в таких клетках начиналась детектируемая флюоресценция. Размножение SeVV-eGFP-N, -Р и -L в коинфицированных wt клетках можно было детектировать по этому "шлейфообразованию" флюоресцирующих клеток через 48 ч после начала культуры и после этого. В результате этого исследования было выявлено, что геномные кДНК-конструкты, из которых образовались SeVV-eGFP-N, -Р и -L, функциональны во всех областях. Кроме того, удалось показать,что при добавлении отсутствующего вирусного белка размножение вирусных мутантов возможно. Достаточно лишь предоставляемого wt вирусом белка (например, Р), чтобы размножать не только делеционные мутанты, но и wt, т.е., возможно, и субоптимальное количество Р-белка приводит к образованию функциональных нуклеокапсидов SeV wt и SeVV-eGFP-Р. Путем предоставления отсутствующего белка партнером транскомплементации SeV wt удалось достигнуть наблюдаемого размножения, регистрируемого по увеличению количества флюоресцирующих клеток, всех SeVV-eGFP-X в повторностях их культуры. 5.2. Определение требуемых для размножения SeVV-eGFP-Х белков. В первую очередь изучили, какие белки должны предоставляться в каждом отдельном случае размножения SeVV-eGFP-N, -Р и -L вспомогательной клеткой, если бы нужно было добиться того, что- 10015013 бы SeV белки N, Р и L могли синтезироваться независимо друг от друга. Для независимого синтеза SeV белков N, Р и L были в распоряжении три рекомбинантных вируса Vaccinia (VV) VV-N, VV-P, VV-L,которые рекомбинантно экспримируют SeV белки N, Р или L (Graef, H. (1994) Funktionelle Charaterisierung des rekombinanten Sendai-Virus Large (L) Proteins. Dissertation, Eberhard-Karls-Universitaet Tuebingen- Г. Греф (1994) Функциональная характеристика рекомбинантного L белка вируса Сендай. Диссертация,Университет Эберхарда - Карла в Тюбингене). Коинфицировали 1106 клеток Vero одновременно SeVV-eGFP-Х или SeVV-eGFP (MOI=0,01) иVV. VV-N, - P и -L использовали при этом по отдельности или в комбинациях (MOI=0,5). После одночасового периода абсорбции произошла замена питательной среды DMEM + 10% эмбриональной телячьей сыворотки (FKS) + цитозин-арабинозид (AraC) (100 мкг/мл) и клетки инкубировали в течение 72 ч при 33 С, причем питательную среду меняли ежедневно, чтобы добавить AraC. Распространение SeVV-eGFP-Х определили на основании eGFP-экспрессии через 72 ч. За это время в положительных опытах было выявлено увеличение количества флюоресцирующих зеленых клеток с одной первичной клетки до 10-30 соседних, флюоресцирующих клеток. Результаты исследования, направленного на выявление того, какие SeV белки необходимы для размножения SeVV-eGFP-N, -Р или -L в клетках Vero, приведены в табл. 2. Экспрессия вирусом VV-N только лишь SeV N не приводит к размножению SeVV-eGFP-N. SeVV-eGFP-N размножается только в том случае, если SeV белки N и Р с помощью рекомбинантных вирусов Vaccinia VV-N и VV-P в инфицированных клетках экспримируются одновременно. SeVV-eGFP-P может размножаться отдельно в результате экспрессии SeV Р-белков с помощью VV-P в клетках Vero. Для размножения SeVV-eGFP-L необходим одновременный синтез белков Р или L вирусом VV. В SeVV-eGFP-L и инфицированной только лишь VV-L клетке Vero размножения SeVV-eGFP-L не происходит. Табл. 2. SeV белки, необходимые для размножения SeVV-eGFP-Х Для размножения SeVV-eGFP-N вспомогательная клетка должна экспримировать одновременноSeV белки N и Р, для размножения SeVV-eGFP-P достаточно экспрессии SeV Р-белка во вспомогательной клетке, а амплификация SeVV-eGFP-L была бы возможной в результате клеточной экспрессии SeV белков Р и L. 5.3. Поддержка амплификации SeVV-eGFP-Х вспомогательными клетками Н 29. Изучение размножения SeVV-eGFP-Х проводили с помощью клеточной линии Н 29. Для этого 1106 клеток Н 29 в 4 разных опытах соответственно инфицировали с примерно 100 первично приготовленными в HeLa-клетках вирусными частицами SeVV-eGFP-N, -Р или -L или в качестве контроля для успешного размножения способного к репликации SeV в клетках Н 29 с примерно 100 вирусными частицами SeVV-eGFP. Начиная с 1-го по 10-й день после инфицирования определяли размножение SeVVeGFP-Х путем регистрации шлейфообразного распространения флюоресцирующих клеток (образование пятна от первично инфицированной клетки Н 29. В контрольном опыте зарегистрировано размножение SeVV-eGFP, от единично флюоресцирующих клеток в 1-й день после инфицирования до пятен из флюоресцирующих клеток в количестве до 50 на 3-й день после инфицирования. Таким образом было установлено, что при выбранной методике проведения эксперимента осуществляется размножение SeV. В инфицированных SeVV-eGFP-N клетках Н 29 также происходило размножение вируса. Наряду с клетками Н 29 (производное от человеческих почечных клеток 293) для размножения вируса пригодны также производные клеток Vero (почечные клетки африканской зеленой мартышки) и производныеLLCMK2-клетки (почечные клетки резус обезьяны), стабильно трансфицированные SeV Р и N-генами. В опыте с SeVV-eGFP-Р через 1 день были детектированы 100 первично инфицированных отдельных клеток. Через 3 дня после начала опыта примерно 70% флюоресцирующих отдельных клеток превратились в пятна, в которых было до 30 флюоресцирующих клеток. Таким образом, удалось точно выявить распространение SeVV-eGFP-P на расположенные вокруг клетки Н 29. Тем самым впервые стало возможным размножить вирусный вектор SeV, у которого делегирована P-ORF. Характеристика размножения SeVV-eGFP-Р будет приведена в следующем подпункте. 5.4. Размножение SeVV-eGFP-P в Н 29-клетках.SeVV-eGFP-P может быть амплифицирован выработанными вспомогательными Н 29-клеткамиSeV Р-белками. Высвобожденные делеционные Р-мутанты в состоянии инфицировать прилегающие клетки Н 29. Анализ распространения SeVV-eGFP-P ограничен в данном случае сравнением его с распространением способного к репликации SeVV-eGFP. Для этого инфицировали 1106 клеток Н 29 в среднем 100 SeVV-eGFP-P или SeVV-eGFP. Через 3,5 и 10 дней культуры с помощью флюоресцентного микроскопа происходила детекция флюоресцирую- 11015013 щих зеленым клеток. Размножение SeVV-eGFP-P удалось провести успешно благодаря клеточной выработке SeV Рбелков. Во все даты наблюдений было видно, что SeVV-eGFP-P и SeVV-eGFP успешно размножаются на клетках Н 29. В противовес этому, распространения SeVV-eGFP-P на клетках, которые не вырабатывают отсутствующий Р-белок ("клетки-мишени", например клетки Vero), не отмечено, что подтверждает ослабленность способности SeVV-eGFP-Р к репликации (см. пункт 8). 5.5. Генная экспрессия Se-eGFP-P в инфицированных клетках-мишенях. Удалось подтвердить отсутствие размножения SeVV-eGFP-Р на типах клеток, которые не вырабатывают Р белок in trans. Одновременно ниже ожидаемого уровня была степень выраженности экспрессии. Как и в случае с -Р мутантами вируса бешенства, (Shoji et al. (2004) Virology 318, 295-305) слабаяeGFP-флюоресценция проявилась только у некоторых инфицированных клеток (меньше 5% см. фиг. 11),хотя статистически при MOI=1 фактически каждая из примерно 70% клеток была инфицирована вирусной частицей. И при большем значении MOI=5 можно было наблюдать только отдельные светящиеся изза SeVV-eGFP-P зеленым клетки Vero (см. фиг. 12, вверху слева). Это подтверждает гипотезу о том, что после инфицирования клетки вирусом с отсутствующим Р геном возможна только первичная транскрипция посредством введенного полимеразного комплекса из вирусной частицы. В случае SeV ДР-мутантов, кроме того, видимо, к тому способны только несколько процентов инфицированных клеток или генную экспрессию можно наблюдать только тогда, когда в клетке находится одновременно несколько транскрибируемых нуклеокапсидов. Для терапевтического применения этого обладающего слабой способностью к репликации SeVV выраженность экспрессия, Вероятно, очень слаба или нужно было бы использовать несоразмерно много частиц SeVV Р в расчете на одного пациента. Поэтому желательно применять вариант SeVV с ослабленной способностью к репликации, который осуществляет также вторичную транскрипцию. Это дает возможность разрабатывать другие модифицированные полимеразные комплексы, которые не могут реплицировать вирусный геном, но обладают способностью к повышенной экспрессии терапевтического гена или антигена. 6. Приготовление модифицированного SeVV-eGFP-P кДНК конструкта. Для возможного улучшения транскрипционной деятельности SeVV с дефицитом Р гена в клеткемишени был приготовлен другой рекомбинантный конструкт, который в позиции первичной Рсчитывающей рамки кодирует укороченную N-конца на 76 аминокислоты форму Р-белка ("pSeVV-eGFPP2-77"; см. пункт 3.1 и фиг. 8 В). Получение SeVV-eGFP-P2-77 частиц и их размножение происходили аналогично пунктам 4.1 и 5.4. 6.1. Размножение SeVV-eGFP-P2-77 во вспомогательных клетках Н 29. В инфицированных pSeVV-eGFP-P2-77 вспомогательных клетках Н 29 укороченный с N-конца на 76 аминокислот, кодированный вирусом Р 2-77-белок синтезируется вместе с клеточно кодированным Р-белком. Для изучения влияния экспрессии укороченного Р-белка Р 2-77 на вирусную репликацию инфекцию (MOI=3) клеток Н 29 SeVV-eGFP-P2-77, SeV-eGFP-Р или контрольным вирусом SeV-eGFP проводили способом, аналогичным описанному при изложении кинетики роста SeVV-eGFP-Р. Клеточные среды отдельных повторностей опыта на протяжении 120 ч анализировали способом тестирования на дозу инфицирования клеток, определяя титр вирусного потомства по числу eGFP-экспримирующих клеток. Из одной инфицированной SeV-eGFP Н 29-клетки (положительный контроль) в течение 120 ч высвобождалось в среднем 80 вирусных частиц, причем транскомплементация Р-белка клетками Н 29 в данном случае необходимой не являлась. SeVV-eGFP-P2-77 мог в Н 29-транскомплементационной системе размножаться примерно с такой же эффективностью, как SeVV-eGFP-P: из инфицированных клеток Н 29 по истечении 120 ч высвобождалось примерно 20106 вирусных частиц SeVV-eGFP-Р или SeVVeGFP-P2-77, что соответствует примерно 40 высвобожденным вирусным частицам Р-мутантов в расчете на одну клетку Н 29. 7. Сравнение генной экспрессии SeVV-eGFP-P и SeVV-eGFP-P2-77 и количественное выражение синтеза белка в инфицированных клетках-мишенях. Для выяснения того, проявляет ли вектор SeVV-eGFP-P2-77 в инфицированных клетках повышенную трансгенную экспрессию - по сравнению с SeVV-eGFP-P - подробно характеризовали кодированную вирусами экспрессию репортерного гена eGFP, а также HN белка. Инфицировали (MOI=1) SeVV-eGFP-P2-77 5105 клеток Vero, причем на второй день после инфицирования можно было наблюдать примерно 70% флюоресцирующих клеток Vero (не показано). Это означает, что почти каждый RNP-комплекс этого вирусного векторного варианта в состоянии вызывать- 12015013 измеряемую транскрипцию в клетке-мишени. 7.1. Количественное выражение eGFP-экспрессии с помощью FACS-анализа. Транскрипционная кассета, в которой репортерный ген eGFP был встроен в SeVV-eGFP-P2-77,должна при последующем применении в медицинских целях кодировать антиген какого-нибудь патогена, например, требующегося вируса. Экспрессия антигена должна быть достаточной для того, чтобы вызвать у пациента защитный иммунный ответ. Для того чтобы убедиться, что каждый SeVV-eGFP-P2-77 нуклеокапсид, инфицировавший клетку,в состоянии осуществить детектируемую экспрессию трансгена, одинаковое число клеток Vero и клеток Н 29 инфицировали одним и тем же количеством вирусных частиц и с помощью FACS (сортинг флюоресцентно активированных клеток) - анализа при использовании проточного цитометра FACS-Calibur сравнивали число экспримирующих eGFP клеток Н 29 и клеток Vero. Данные обрабатывали с помощью компьютерной гистограммы, сопоставляя флюоресцентные сигналы инфицированных клеток с общим количеством клеток. Инфицировали 2,5105 клеток Vero или клеток Н 29 SeVV-eGFP-P2-77 или вирусом SeVV-eGFPР с дефицитом гена Р при MOI=1. FACS-анализ проб проводили через 24 ч после инфицирования. Инфицированные клетки собирали в PBS и методом проточной цитометрии определяли количество флюоресцирующих клеток. Результат в виде доли [%] флюоресцирующих Vero- и Н 29-клеток показан на фиг. 11. Через 24 ч после инфицирования вспомогательных клеток Н 29 вирусом SeVV-eGFP-P путемFACS-анализа удалось детектировать 86% экспримирующих eGFP клеток Н 29. В данном случае клеточный синтез Р-белка поддерживает образование нового Р: L-комплекса и, тем самым, выработку новой мРНК, что приводит к синтезу eGFP-белков в инфицированной клетке. Если же клетки Vero были инфицированы SeVV-eGFP-P, то ни через 24 ч после инфицирования, ни в более поздние сроки в других повторностях опыта экспрессии eGFP-белка обнаружить не удалось. Трансферированные нуклеокапсидамиSeVV-eGFP-Р Р: L-комплексы при инфицировании с MOI=1 не в состоянии привнести детектируемую экспрессию в инфицированные клетки Vero. Зато через 24 ч после инфицирования SeVV-eGFP-P2-77 удалось идентифицировать FACSанализом почти 80% экспримирующих eGFP клеток Н 29 и также 75% экспримирующих eGFP клетокVero. При инфицировании клеток Н 29 транскрипция eGFP мРНК может поддерживаться клеточным синтезом Р-белка и, тем самым, новыми Р: L-комплексами. При инфицировании клеток Vero SeVV-eGFPP2-77 транскрипция усиливается новым синтезом укороченного с N-конца Р-белка Р 2-77. Из приведенных результатов можно сделать важный вывод о количестве способных к транскрипции SeVV-eGFP-P2-77: клетки Н 29 и клетки Vero инфицировались при MOI=1. Теоретически возможные многократные инфицирования одной клетки в обоих повторениях статистически маловероятны. Через 24 ч после инфицирования идентифицировали почти 80% экспримирующих eGFP клеток Н 29 и примерно 75% экспримирующих eGFP клеток Vero. Из всего этого можно заключить, что каждый RNPкомплекс с укороченным Р-вариантом Р 2-77, который способен к экспрессии трансгенов в Рвспомогательной клетке, также вызывает экспрессию трансгенов в инфицированной клетке-мишени. В отличие от этого, вариант SeVV-eGFP-Р с полной делецией Р ORF таким свойством не обладает. 7.2. Функциональный тест экспримированного в инфицированной клетке-мишени HN-белка. С помощью гемаадсорбционного (HAD)-теста определяли на отдельных инфицированных клетках эффективность адсорбции человеческих эритроцитов и тем самым эффективность экспозиции вирусныхHN-белков (фиг. 12). 5105 клеток Vero инфицировали SeVV-eGFP-P2-77 при низком MOI=0,5. В отличие от этого,клетки Vero в случае SeVV-eGFP- нужно было инфицировать при 10-кратно большей MOI=5, чтобы вообще можно наблюдать отдельные флюоресцирующие клетки. После 1-часовой адсорбции заменяли среду DMEM + 10% FRS. Затем клетки в течение нескольких дней инкубировали при 33 С. Экспрессию трансгенов для двух векторных вариантов сначала определяли с помощью eGFP-флюоресценции. На 5-й и 9-й дни после инфицирования проводили серии (HAD)-тестов, чтобы проанализировать экспозицию вирусных HN-белков на основании адсорбции человеческих эритроцитов. Хотя в случае SeVV-eGFP-Р при MOI=5 статистически должны бы быть инфицированы 99,3% клеток Vero, под микроскопом удалось наблюдать только лишь 0,01% eGFP-положительных клеток (фиг. 12 вверху слева). Наоборот, с SeVV-eGFP-P2-77 можно было согласно ожиданиям наблюдать зеленую флюоресценцию при MOI=0,5 в 40% клеток (фиг. 12 внизу слева). Через 2 дня после инфицирования SeVV-eGFP-P только половина eGFP-положительных клеток(25 из 5105 инфицированных) была способна закреплять на своей поверхности эритроциты (фиг. 12 вверху в середине). После дальнейшей инкубации и очередного HAD-теста на инфицированных клетках адсорбции эритроцитов больше не происходило. Со вторым с ослабленной способностью к репликацииSeVV вариантом SeVV-eGFP-P2-77 опять были получены значительно лучшие результаты: через 5 дней после инфицирования примерно 40% инфицированных клеток (MOI=0,5) были в состоянии адсорбиро- 13015013 вать эритроциты на своей поверхности (фиг. 12 внизу в середине). При этом у отдельных клеток можно было наблюдать различную активность связывания от 10 до 70 адсорбированных эритроцитов. Тем самым было показано, что инфицированные SeVV-eGFP-P2-77 клетки через 5 дней после инфицирования в состоянии экспонировать HN-белки на поверхности клеток, функциональный HAD-тест может оцениваться как положительный. Одновременно на основании различных количеств адсорбированных эритроцитов удалось выявить эффективную экспрессию HN-белка в инфицированных клетках. Инфицированные клетки продолжали инкубировать при 33 С, причем нейраминидазная активностьHN-белка приводила к отделению прикрепленных к инфицированным клеткам эритроцитов. Клетки промывали, чтобы удалить отделившиеся эритроциты и инкубировали еще на протяжении 4 дней при 33 С. Очередной HAD-тест провели на 9-й день после инфицирования. Теперь удалось детектировать только лишь 30% HAD-положительных клеток Vero. При этом число прикрепленных красных кровяных телец уменьшилось до 5-20 эритроцитов на одну клетку. Следовательно через 9 дней после инфицирования имевшим ослабленную способность к репликации вариантом SeVV-eGFP-P2-77 синтезировалось все еще достаточно функциональных HN. В противовес этому, вариант SeVV-eGFP-P с полной делецией Р QRF такими свойствами не обладает. 7.3. Количественное выражение eGFP-экспрессии с помощью анализа Western Blot. Полуколичественная оценка eGFP-экспрессии обладающего ослабленной способностью к репликации SeV-вектора в сравнении со способным к репликации SeV-eGFP была проведена с помошью анализаWestern Blot путем серийных разведений клеточного общего белка. 5105 клеток Vero (MOI=3) инфицировали SeV-eGFP или SeVV-eGFP-P2-77. Через 24 ч после инфицирования произошло растворение клеток; после чего серийное разведение (1:2) клеточных экстрактов от 20 мкг до 2,5 мкг общего количества разделяли с помощью SDS-PAGE. Белки переносили наPVDF-мембрану и с помощью Western Blot анализа определили кодированный вирусом eGFP-белок (26 кДа) (фиг. 13). С помощью Western Blot анализа флюоресцентный белок eGFP обнаруживали в клетках Vero, инфицированных как в SeV-eGFP, так и в SeVV-eGFP-P2-77. Сравнение интенсивности eGFP-сигналов подтверждает, что экспрессия для SeVV-eGFP-P2-77 с ослабленной способностью к репликации была меньше примерно в 16 раз по сравнению со способным к репликации SeVV-eGFP. Уменьшение в 16 раз при этом является небольшим и позволяет сказать, что SeVV-eGFP-P2-77 несмотря на модифицированный Р-белок может обеспечивать очень эффективную вторичную транскрипцию. 7.4. Оценка HN-экспрессии с помощью Western Blot анализа.HN-белок SeV является, в отличие от eGFP-белка, мембранным поверхностным белком и представляет собой важный антигенный детерминант. Путем относительной количественной оценки интенсивности экспрессии HN-белка в инфицированных SeVV-eGFP-Р 2-77 клетках оказалось возможным оценивать интенсивность экспрессии HN-антигена SeV. Полуколичественная оценка HN-экспрессии для обладающего ослабленной способностью к репликации SeV-вектора в сравнении со способным к репликации SeV-eGFP проводилась с помощью WesternBlot анализа серийных разведений клеточного общего белка. 5105 клеток Vero инфицировали в 2 параллельных повторностях SeV-eGFP или SeVV-eGFP-P2-77 (MOI=1) и инкубировали в течение 24 и 48 ч. Затем происходило растворение клеток; в серийные разведения (1:2) клеточных экстрактов от 16 мкг до 2 мкг общего количества разделяли в SDS-PAGE. Белки переносили на PVDF-мембрану и определяли кодированный вирусом HN-белок (60 кДа) с помощью моноклонального HN-антитела (фиг. 14).HN-белок в случае инфицированных SeV-eGFP клеток Vero после обоих периодов инкубирования можно было эффективно детектировать на всех дорожках (от 16 до 2 мкг общего белка; дорожки 2-5 слева и справа). В случае SeVV-eGFP-P2-77 полоса HN-белка еще видна в дорожках с 16 и 8 мкг общего белка (дорожки 7, 8), однако гораздо слабее. Относительная количественная оценка HN-экспрессии в инфицированных SeVV-eGFP-P2-77 клетках Vero по сравнению с SeV-eGFP проводилась путем сопоставления дорожек с 16 и 8 мкг относительно 2 мкг общего белка (дорожки 7 и 8 относительно 5, слева и справа) и дает основание считать уменьшение HN-экспрессии в Р-делеционном варианте 8-16-кратным,независимо от продолжительности инкубации. На основании это можно сделать вывод об относительно высокой степени транскрипции в инфицированных SeVV-eGFP-P2-77 клетках и вместе с тем о высокой в целом экспрессии трансгена вирусного вектора с ослабленной способностью к репликации. С учетом обоих измерений (eGFP- и HN-белок) можно исходить из среднего уменьшения экспрессии в 10 раз. 8. Ослабленная способность к репликации у SeVV-eGFP-P2-77 в клетке-мишени. Если клетки Vero инфицируют способным к репликации SeVV-eGFP, вокруг первично инфицированных, сильно флюоресцирующих клеток в последующие два дня образуется пятно из других флюоресцирующих клеток в количестве до тысячи. Чтобы доказать ослабленную способность SeVV-eGFP-P2-77 к репликации в клетках Vero, нужно было подтвердить отсутствие увеличения флюоресцирующих зеленым клеток вокруг первично инфицированной клетки-мишени с учетом естественной скорости деления- 14015013 клеток Vero. Клетки Vero делились в среднем каждые 24 ч. Если клетки Vero инфицированы SeVVeGFP-Р 2-77, детектируемую eGFP-экспрессию можно наблюдать примерно через 24 ч. Отмечали, что после последующей 24-часовой фазы инкубации из этой первично инфицированной, флюоресцирующей клетки Vero в результате естественного деления в некоторых случаях возникают две (слабее) флюоресцирующие дочерние клетки. Это наблюдение не имеет никакого отношения к размножению вируса, при котором из одной инфицированной клетки высвобождается от 101 до 104 вирусных частиц, которые затем инфицируют расположенные поблизости клетки. Эта естественная интенсивность деления инфицированных клеток оказывает, с другой стороны, влияние на интенсивность eGFP-экспрессии, которая с увеличением количества делений клеток уменьшается. Это наблюдение показывает, что вирусный векторSeVV-eGFP-P2-77 является ослабленным в отношении репликации генома, следовательно новые геномы синтезироваться не могут. Если несколько следующих друг за другом делений инфицированной клетки приводят к непрерывному уменьшению интенсивности флюоресценции, пока она наконец не прекратится, то размножение вируса можно исключить. Для окончательного подтверждения ослабленной репликационной способности SeVV-eGFP-P2-77 в клетках-мишенях было проведено последнее исследование. Роллер Т 75 засевали примерно 20106 клетками Vero. Клетки уже до начала инкубационной фазы были высеяны с высокой плотностью и поэтому не проявляли больше сильной активности деления. Далее клетки Vero инфицировали SeVV-eGFP-P2-77 с MOI=0,001. Смену среды DMEM с 5% FRS (для уменьшения активности деления) происходила после одночасового инкубационного периода и клеткиVero инкубировали при 33 С (Р 1). Через 2 дня после инфицирования удалось наблюдать, соответственно примененной MOI=0,001, несколько тысяч отдельно расположенных первично инфицированных, флюоресцирующих клеток Vero. Из-за высокой плотности клеток в последующие 4 инкубационных дня деления клеток практически не происходило, т.е. количество первично инфицированных клеток, детектированных по флюоресценции, не менялось. Если бы в этих клетках образовались вирусные частицы, они бы могли инфицировать расположенные рядом клетки, что отразилось бы в усилении флюоресценции. Распространения вирусного вектора из-за отсутствия новых инфекций окружающих клеток не было и через 8 дней. Для обеспечения клеток свежей средой надклеточную среду удаляли, и клетки Vero покрывали новой средой. Через 12 дней после начала инкубации клетки Vero отделились от субстрата. В течение всего периода проведения опыта не проявлялось никакой репликации вирусного вектора в форме увеличения количества флюоресцирующих клеток. Следовательно, удалось исключить распространениеSeVV-eGFP-P2-77 путем выработки новых вирусных геномов и частиц от первично инфицированных клеток на расположенные вокруг клетки Vero. Поэтому SeVV-eGFP-P2-77 можно считать вирусным вектором с ослабленной способностью к репликации. Резюме. Приведенные выше результаты показывают, что путем целенаправленной манипуляции с генами компонентов полимеразного комплекса можно приготовить вирусы с РНК с негативной цепью с ослабленной способностью к репликации, которые в состоянии транскрибировать кодированные вирусами гены, но не могут больше реплицировать вирусный геном. В случае вируса Сендай специально исследовано детальнее два варианта, в которых ген для полимеразного кофактора фосфо-белка делетировали или полностью, или удаляли кодоны для аминокислот 2- 77 ("SeVV-eGFP-P2-77"). Оба SeV вектора в клетках, которые предоставляют Р белок не in trans (так называемые клетки-мишени), имеют ослабленную способность к репликации, однако сильно отличаются по эффективности своей генной экспрессии. Хотя в случае SeVV-eGFP-Р при MOI=5 статистически инфицированными остаются только 0,7% вирусных клеток - 99,3% должны бы содержать, по меньшей мере, один RNP-комплекс - под микроскопом удалось наблюдать только 0,01% eGFP-положительных клеток. Из этого путем расчетов можно прийти к выводу, что видимая трансгенная экспрессия имеет место только тогда, когда в инфицированной клетке одновременно присутствуют 15 или больше RNP SeVV-eGFP-Р. Этот SeVV с дефектным геном Р проявляет такую же слабую экспрессию, как и аналогичный Рвариант бешенства (Shoji et al., см. выше). Оба вектора в инфицированных клетках способны только к первичной транскрипции с помощью привнесенного полимеразного комплекса из вирусной частицы. Для терапевтического же применения вектора желательна более сильная экспрессия кодированного трансгена или антигена. Это условие может быть выполнено с помощью имеющего ослабленную способность к репликации варианта SeVV-eGFP-P2-77, который в клетках-мишенях обеспечивает в среднем в 10 раз меньшую интенсивность экспрессии по сравнению со способным к репликации SeV. Благодаря присутствию в геноме гена N-терминально укороченного Р белка возможна не только первичная, но и вторичная транскрипция. Она обеспечивается недавно появившимися, модифицированными полимеразными комплексами, которые содержат кодированный вектором Р 2-77 белок; он, однако, не поддерживает репликационный режим полимеразы. Путем количественной характеристики синтеза белка в инфицированных клетках-мишенях доказано, что имеющий ослабленную способность к репликации вирусный вектор SeVV-eGFP-P2-77 в со- 15015013 стоянии осуществлять эффективную транскрипцию и экспрессию кодированных вирусом генов. При этом эффективно синтезируется не только 3'-проксимальный трансген (eGFP); также по меньшей мере через 9 дней после инфицирования транскрибируется расположенный в геномной позиции 6 HN-ген,функционально активный продукт которого экспонируется на инфицированных клетках-мишенях. 9. Определение иммунного ответа индуцированного РНК-вакциной с ослабленной способностью к репликации, на модели на мышах. Было показано, что в результате делиции в Р-гене ("Р 2-77") возникает измененный вирусный полимеразный комплекс, который больше не обеспечивает синтеза новых геномов. Одновременно после инфицирования такими вирусами с ослабленной способностью к репликации определенная в клеткемишени экспрессия вирусных генов приблизительно в 10 раз меньше по сравнению с инфицированием способным к репликации вирусом. Для доказательства достаточной иммуногенной способности обладающего ослабленной способностью к репликации вируса с РНК с негативной цепью в вирусный геном встроили антигены или антигенные детерминанты двух гетерогенных вирусов (человеческого парагриппозного вируса типа 3, hPIV3, и респираторного синциального вируса, RSV). Для этого был выбран SeV Р 2-77 с ослабленной способностью к репликации, в котором гены первичных поверхностных белков F и HN заменены на гены, которые кодируют химерные F и HN белки SeV/hPIV3. Химерный F-белок содержит 558 аминокислот и состоит из внеклеточного домена hPIV3 (493 аминокислоты), трансмембранного домена SeV (23 аминокислоты) и цитоплазматического домена SeV (42 аминокислоты). Химерный HN-белок имеет 579 аминокислот и состоит из цитоплазматического домена SeV (35 аминокислот), трансмембранного домена SeV (25 аминокислот), а также внеклеточного домена hPIV3 (519 аминокислот). Аминокислотные последовательности химерного F-белка и химерного HN-белка в перечне последовательностей приведены под номерами SEQ ID27 и 28. В результате инсерции химерных генов в вирусный геном создаются новые антигены и одновременно обеспечивается эффективное объединение вакцинных частиц при их приготовлении. В дополнительной экспрессионной кассете, встроенной между двумя вирусными генами, происходило кодирование поверхностного белка F RSV, в результате чего конструкт был увеличен до бивалентной вакцины. Эта новая вакцина проверена в модели на животных. Группы мышей Balb/C трижды с интервалом 3 недели иммунизировали интраназально двумя разными вирусными препаратами (каждая из групп А и С по 104 инфекционных единиц), контрольная группа (В) получала вместо вакцины PBS. После третьей иммунизации отбирали для анализа мукозного иммунного ответа назальную промывочную жидкость(NW), а также проводили бронхоальвеолярные полоскания (BAL) и изолировали для анализа гуморального иммунного ответа сыворотку. С помощью ELISA определяли количество индуцированных иммунглобулинов IgA и IgG, специфичных для hPIV, a также RSV. Прототип вакцины с ослабленной способностью к репликации вызывал явную индукцию IgA-антител, специфичных для hPIV (фиг. 15 А), индукция анти- RSV IgA-антител проявлялась слабее (не показано). Индукция гуморального ответа на поверхностные антигены обоих вирусов обеспечила сравнимые титры, количество специфичного IgG отличается в 2 раза (фиг. 15 В). Более глубокий анализ анти- hPIV3-IgG показал, что индуцированные антитела проявляют нейтрализующие свойства (титр 1/64). В отличие от этого у контрольной группы не удалось выявить - как и ожидалось - какой бы то ни было специфичной IgA- или IgG-индукции. Соответствующая изобретению вакцина не могла индуцировать специфичного мукозного и гуморального ответа на чужеродные вирусные антигены. Дополнительные эксперименты показали, что лимфоциты иммунизированных мышей продуцировали интерферон-7, в то время как IL-5 обнаружить не удалось. Этот результат указывает на то, что бивалентная, с ослабленной способностью к репликации РНК-вакцина в состоянии индуцировать Т-клеточный иммунный ответ, который является предпосылкой длительно сохраняющегося иммунитета. Резюме. После инфицирования подопытных животных модифицированным вектором, в котором были использованы последовательности, кодирующие антигены двух чужеродных вирусов, была выявлена индукция нейтрализующих антител. Это свидетельствует о потенциале имеющих ослабленную способность к репликации вирусов с РНК с негативной цепью для разработки новых вакцин. 9. Список применявшихся ДНК-олигонуклеотидов. Применявшиеся в вышеприведенных примерах ДНК-олигонуклеотиды перечислены в нижеследующей табл. 3 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантный вирус Сендай, содержащий вирусный геном с делецией аминокислот 2-77 белка, кодируемого Р-геном, приводящей к потере способности к репликации без потери вторичной способности к транскрипции. 2. Рекомбинантный вирус Сендай по п.1, отличающийся тем, что вирусный геном дополнительно содержит по меньшей мере одну последовательность, кодирующую чужеродный генный продукт. 3. Рекомбинантный вирус Сендай по п.2, отличающийся тем, что чужеродный генный продукт является белком, рибозимом, антисмысловой молекулой или молекулой миРНК. 4. Рекомбинантный вирус Сендай по п.3, отличающийся тем, что чужеродный генный продукт является репортерным белком, антигенным или терапевтическим белком. 5. Рекомбинантный вирус Сендай по п.4, отличающийся тем, что чужеродный генный продукт является антигенным белком патогена, выбранного из вирусов, бактерий и простейших. 6. Рекомбинантный вирус Сендай по п.5, отличающийся тем, что антигенный белок является вирус- 28015013 ным белком. 7. Рекомбинантный вирус Сендай по п.6, отличающийся тем, что вирусный белок происходит от одинаковых или разных вирусов. 8. Рекомбинантный вирус Сендай по любому из пп.2-7, отличающийся тем, что по меньшей мере одна из последовательностей, кодирующих чужеродный генный продукт, встроена в вирусный геном, в частности, заменяет последовательность, кодирующую гомологичный генный продукт. 9. Рекомбинантный вирус Сендай по любому из пп.1-8, отличающийся тем, что его транскрипционная способность уменьшена не более чем в 20 раз по сравнению с диким типом. 10. Нуклеокапсид рекомбинантного вируса Сендай по любому из пп.1-9. 11. Геном рекомбинантного вируса Сендай по любому из пп.1-9. 12. Молекула ДНК, которая кодирует геном и/или антигеном рекомбинантного вируса Сендай по любому из пп.1-9. 13. Молекула ДНК по п.12, отличающаяся тем, что она функционально связана с транскрипционным сигналом. 14. Молекула ДНК по п.13, отличающаяся тем, что транскрипционный сигнал является промотором бактериофага, например, Т 7 или SP6-промотором. 15. Клетка, которая содержит рекомбинантный вирус Сендай по любому из пп.1-9, нуклеокапсид по п.10, геном по п.11 или молекулу ДНК по любому из пп.12-14. 16. Клетка по п.15, отличающаяся тем, что она является клеткой, способной к размножению рекомбинантного вируса Сендай. 17. Клетка по п.15, отличающаяся тем, что она является клеткой, способной к продуцированию рекомбинантного вируса Сендай. 18. Клетка по п.17, отличающаяся тем, что она дополнительно содержит молекулу ДНК, кодирующую чужеродную ДНК-зависимую РНК-полимеразу, осуществляющую транскрипцию молекулы ДНК,кодирующую рекомбинантный вирус Сендай. 19. Клетка по пп.15-18, отличающаяся тем, что дополнительно содержит молекулу ДНК, кодирующую Р-ген. 20. Способ получения рекомбинантного вируса Сендай по любому из пп.1-9, включающий следующие этапы:(а) получение клетки, трансфицированной молекулой ДНК, которая кодирует геном рекомбинантного вируса Сендай, содержащий мутацию в Р-гене, приводящую к потере вирусным геномом способности к репликации без потери вторичной способности к транскрипции, и, при необходимости, содержащий по меньшей мере одну последовательность, кодирующую чужеродный генный продукт, и,(б) культивирование клетки в условиях, при которых происходит транскрипция ДНК согласно (а) и образуется рекомбинантный вирус Сендай. 21. Способ по п.20, дополнительно включающий получение нуклеокапсида или вирусного генома рекомбинантного вируса Сендай. 22. Способ размножения рекомбинантного вируса Сендай по любому из пп.1-9, включающий следующие этапы:(а) получение клетки, которая инфицирована рекомбинантным вирусом Сендай, содержащим мутацию в Р-гене, приводящую к потере вирусным геномом способности к репликации без потери вторичной способности к транскрипции, и, при необходимости, содержащий по меньшей мере одну последовательность, кодирующую чужеродный генный продукт, и(б) культивирование клетки в условиях, в которых происходит размножение вируса. 23. Фармацевтическая композиция, содержащая рекомбинантный вирус Сендай по любому из пп.19, нуклеокапсид по п.10 или вирусный геном по п.11 в качестве действующего вещества, а также, при необходимости, фармацевтически приемлемые наполнители и/или вспомогательные вещества. 24. Фармацевтическая композиция по п.23, предназначенная для использования в качестве вакцины. 25. Фармацевтическая композиция по п.24, предназначенная для использования в качестве моноили поливалентной вакцины. 26. Фармацевтическая композиция по пп.23 и 24, предназначенная для использования в качестве вакцины против вирусных инфекций, например в качестве вакцины против инфекций патогенными вирусами с РНК-негативной цепью. 27. Фармацевтическая композиция по п.23, предназначенная для использования в антиопухолевой терапии. 28. Фармацевтическая композиция по любому из пп.23-27, предназначенная для использования у пациентов из групп риска, таких как дети, пожилые люди и пациенты с поврежденной или ослабленной иммунной системой. 29. Фармацевтическая композиция по любому из пп.23-28, содержащая нуклеокапсид в нативной вирусной оболочке. 30. Применение клетки, которая конститутивно или репродуцируемо стабильно экспрессирует Рбелок рекомбинантного вируса Сендай для продуцирования или размножения рекомбинантного вируса
МПК / Метки
МПК: C07K 14/115, A61K 48/00, C12N 15/86
Метки: вирус, использования, сендай, предназначенный, репликации, качестве, способностью, ослабленной, вакцин, рекомбинантный
Код ссылки
<a href="https://eas.patents.su/30-15013-rekombinantnyjj-virus-sendajj-s-oslablennojj-sposobnostyu-k-replikacii-prednaznachennyjj-dlya-ispolzovaniya-v-kachestve-vakcin.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантный вирус сендай с ослабленной способностью к репликации, предназначенный для использования в качестве вакцин</a>
Предыдущий патент: Композиция, содержащая фентермин и избирательный агонист рецептора 5ht2c и ее применение
Следующий патент: Катализатор оксихлорирования и способ, использующий такой катализатор
Случайный патент: Способ тренировки игроков и спортсменов