Производные оптически активных изомеров 2-амино-4-(бициклил) амино-6-(алкилзамещенного)-1,3,5-триазина, способы их получения, их применение в качестве гербицидов и регуляторов роста растений, гербицидная или регулирующая рост растений композиция, способ борьбы с сорными растениями и промежуточные соединения
Номер патента: 12406
Опубликовано: 30.10.2009
Авторы: Аренс Хартмут, Менне Хуберт, Бирингер Херманн, Минн Клеменс, Хилльс Мартин, Кене Хайнц, Аулер Томас, Дитрих Хансёрг
Формула / Реферат
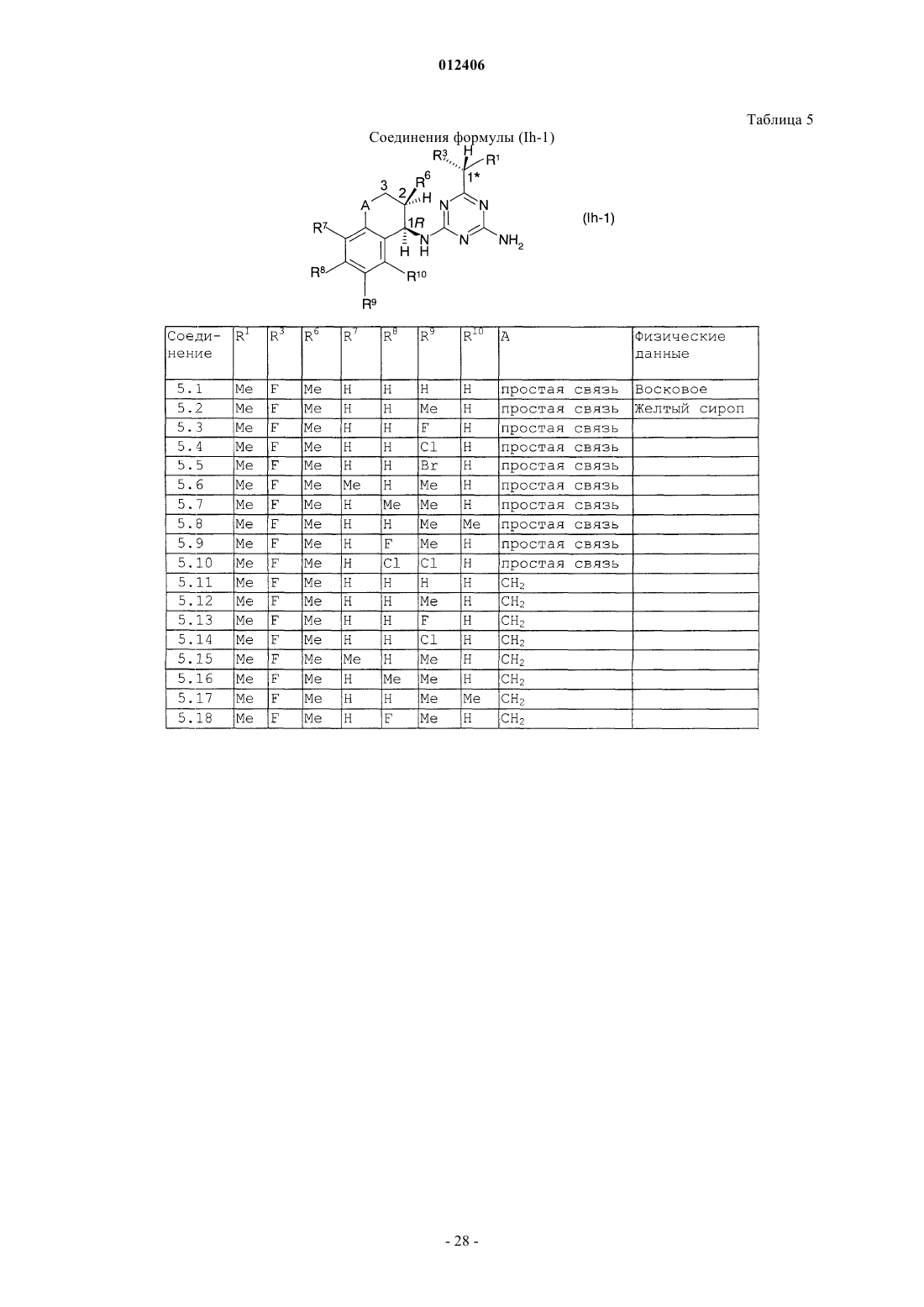
1. Производные оптически активных изомеров 2-амино-4-(бициклил)амино-6-(алкилзамещенного)-1,3,5-триазина формулы (I)
где R1 означает H, галоид, (С1-С6)алкил, (С1-С6)галоидалкил, [(C1-C4)алкокси](С1-С6)алкил, (С3-С6)циклоалкил, который не замещен или замещен одним или несколькими радикалами, выбираемыми из группы, которая включает галоид, (С1-С4)алкил и (С1-С4)галоидалкил, или означает (С2-С6)алкенил, (С2-С6)алкинил, (С2-С6)галоидалкенил, (С4-С6)циклоалкенил, (С4-С6)галоидциклоалкенил, (С1-С6)алкокси- или (С1-С6)галоидалкоксигруппу;
R2 означает H, галоид, (С1-С6)алкил или (С1-С4)алкоксигруппу; или
R1 и R2 могут образовать вместе с атомом углерода, к которому они присоединены, (С3-С6)циклоалкильное или (С4-С6)циклоалкенильное кольцо;
R3 означает H, (С1-С6)алкил, (С1-С4)алкоксигруппу или галоид;
R4 и R5, каждый независимо, означают H, (С1-С4)алкил, (С1-С4)галоидалкил, (С3-С4)алкенил, (С3-С4)галоидалкенил, (С3-С4)алкинил, (С3-С4)галоидалкинил или ацильный радикал;
R6 означает Н, (С1-С6)алкил или (С1-С6)алкоксигруппу;
R7, R8, R9 и R10, каждый независимо, означают H, (С1-С4)алкил, (C1-C3)галоидалкил, галоид, (C1-C3)алкокси-, (C1-C3)галоидалкоксигруппу или CN;
А означает CH2, О или простую химическую связь;
и стереохимическая конфигурация в отмеченном 1 положении является (R)-конфигурацией, а стереохимическая чистота составляет от 60 до 100% (R),
или соль этого соединения, приемлемую в сельском хозяйстве.
2. Производные оптически активных изомеров 2-амино-4-(бициклил)амино-6-(алкилзамещенного)-1,3,5-триазина или их соль по п.1, где
R1 означает H, галоид, (С1-С4)алкил, такой как метил, этил, н-пропил или изопропил, или означает (С1-С4)галоидалкил, [(С1-С4)алкокси](С1-С4)алкил, (С3-С6)циклоалкил, который не замещен или замещен одной или двумя (С1-С4)алкильными группами, или означает (C3-C4)галоидциклоалкил, (С2-С4)алкенил, (С2-С4)галоидалкенил, (C2-C4)алкинил, (С1-С4)алкокси- или (С1-С4)галоидалкоксигруппу;
R2 означает H или (С1-С4)алкил; или
R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют (С3-С6)циклоалкильное кольцо;
R3 означает H, (С1-С4)алкил, (С1-С2)алкоксигруппу или галоид;
R4 означает H, (С1-С4)алкил, (С1-С4)галоидалкил, (С3-С4)алкенил, (C3-С4)алкинил или ацильный радикал, который содержит от 1 до 12 атомов углерода;
R5 означает H, (С1-С4)алкил или (С1-С4)галоидалкил;
R6 означает H, (C1-C3)алкил или (C1-C3)алкоксигруппу;
R7, R8, R9 и R10, каждый независимо, означают H, (C1-C3)алкил, галоид или (C1-C3)алкоксигруппу; и
А означает CH2, О или простую химическую связь.
3. Производные оптически активных изомеров 2-амино-4-(бициклил)амино-6-(алкилзамещенного)-1,3,5-триазина или их соль по пп.1 или 2, где
R1 означает Н или (С1-С3)алкил;
R2 означает H или (С1-С3)алкил; или
R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют (С3-С4)циклоалкильное кольцо;
R3 означает H, (С1-С2)алкил, метоксигруппу, Cl или F;
R4 означает H, (C1-C3)алкил, (C1-C3)галоидалкил, аллил, пропаргил, CHO, -CO(C1-C3)алкил или -СО(C1-C3)галоидалкил;
R5 означает H или (С1-С2)алкил;
R6 означает H, (C1-C3)алкил или (C1-C3)алкоксигруппу;
R7, R8, R9 и R10, каждый независимо, означают H, метил, F или Cl; и
А означает СН2, O или простую химическую связь.
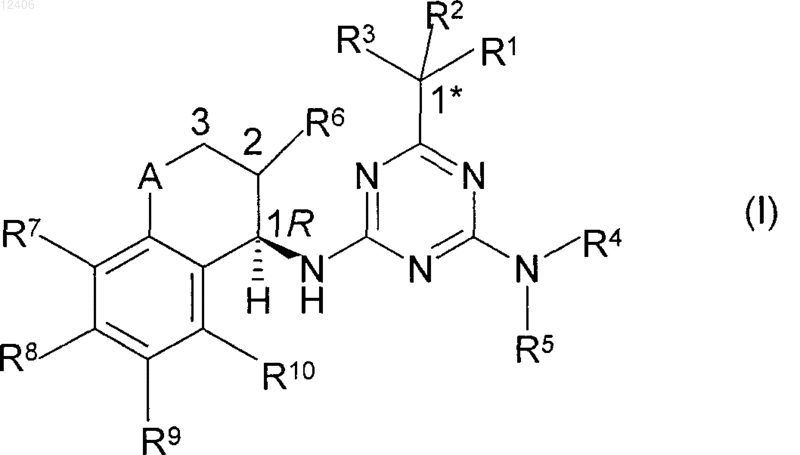
4. Способ получения соединения формулы (I) или его соли по одному из пп.1-3, при котором соединение формулы (II)
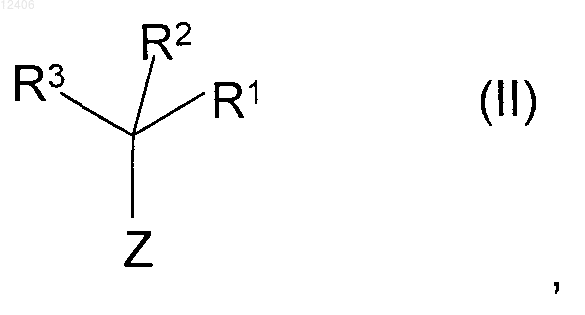
где R1, R2 и R3 имеют значения, указанные в формуле (I), и
Z означает функциональную группу, выбираемуюиз группы, которая включает эфиры карбоновых кислот, ортоэфиры карбоновых кислот, хлориды карбоновых кислот, амиды карбоновых кислот, цианогруппы, ангидриды карбоновых кислот или трихлорметил,
подвергают взаимодействию с бигуанидиновым соединением формулы (III) или его солью присоединения с кислотой
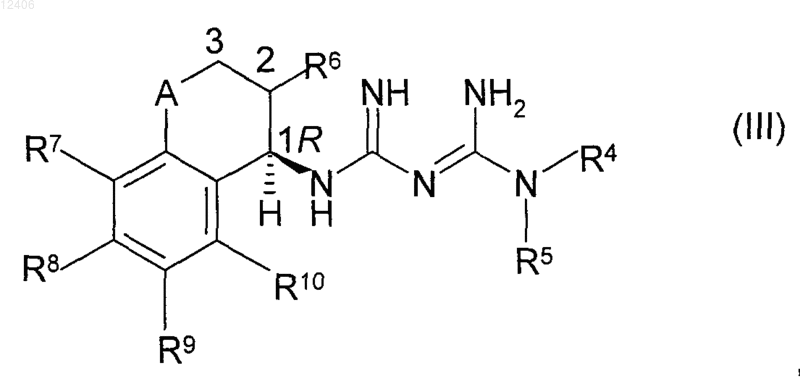
где R4, R5, R6, R7, R8, R9, R10 и А и конфигурация в отмеченном положении 1 такая, как показано в формуле (I).
5. Способ получения соединения формулы (IV)
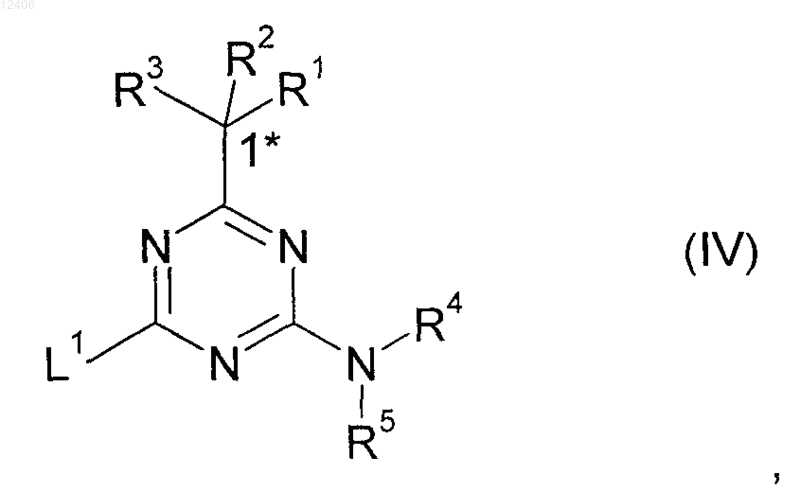
где R1, R2, R3, R4 и R5 и конфигурация в отмеченном 1* положении такая, как указано в формуле (I), и
L1 означает отщепляемую группу,
подвергают взаимодействию с амином формулы (V) или его солью присоединения с кислотой
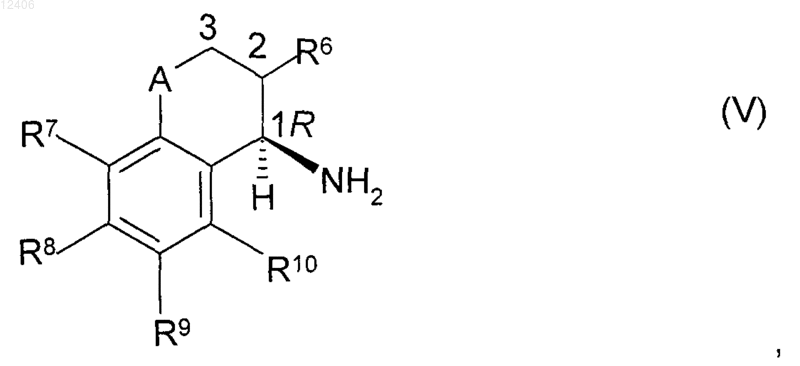
где значения R6, R7, R8, R9, R10, А и конфигурация в отмеченном 1 положении такие, как указано в формуле (I).
6. Гербицидная или регулирующая рост растений композиция, которая включает одно или несколько соединений формулы (I) или их соли по одному из пп.1-3 и вспомогательные вещества для приготовления готовых форм препаратов, применяемые для защиты растений.
7. Способ борьбы с сорными растениями или регулирования роста растений, который включает применение эффективного количества одного или нескольких соединений формулы (I) или их солей по одному из пп.1-3 для обработки растений, семян растений или обрабатываемой посевной площади.
8. Применение соединений формулы (I) или их солей по одному из пп.1-3 в качестве гербицидов или регуляторов роста растений.
9. Соединение формулы (V) или его соль по п.5, где
R6 означает H, (С1-С6)алкил или (С1-С6)алкоксигруппу;
R7, R8, R9 и R10, каждый независимо, означают H, (С1-С4)алкил, (C1-С3)галоидалкил, галоид, (C1-C3)алкокси-, (С1-С3)галоидалкоксигруппу или CN;
А означает СН2, O или простую химическую связь;
и в котором стереохимическая конфигурация в помеченном 1 положении такая, как указано в формуле (I),
за исключением соединений формулы (V), или их солей, где
(i) A означает простую химическую связь, R6, R7, R8 и R9 каждый означают водород, a R10 означает водород, метокси-, н-пропокси- или цианогруппу; или
А означает простую химическую связь, R6, R7, R9 и R10 каждый означают водород, a R8 означает фтор; или
А означает простую химическую связь, R7, R8, R9 и R10 каждый означают водород, a R6 означает метил; или
(ii) A означает CH2, R6, R7, R8 и R10 каждый означают водород, a R9 означает водород, метил, метокси-, изопропоксигруппу или трет-бутил; или
А означает CH2, R6, R7 и R9 каждый означают водород, a R8 означает метил и R10 означает метил; или
А означает CH2, R6, R8 и R10 каждый означают водород, a R7 означает метил и R9 означает метил; или
А означает CH2, R6, R7, R9 и R10 каждый означают водород, a R8 означает метокси; или
А означает CH2, R6, R8, R9 и R10 каждый означают водород, a R7 означает метокси; или
А означает CH2, R7, R8, R9 и R10 каждый означают водород, a R6 означает метил; или
(iii) A означает атом кислорода и R6, R7, R8, R9 и R10 каждый означают H.
10. Соединение формулы (III) или его соль по п.5.
11. Соединение формулы (XIII) или его соль
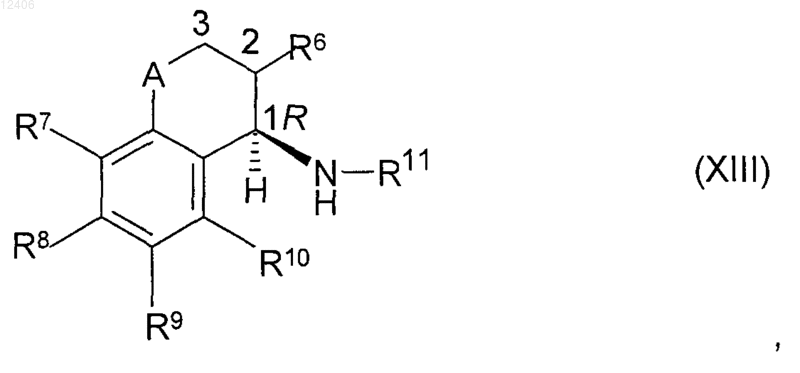
где R6 означает H, (С1-С6)алкил или (С1-С6)алкоксигруппу;
R7, R8, R9 и R10, каждый независимо, означают H, (С1-С4)алкил, (C1-C3)галоидалкил, галоид, (С1-С3)алкокси-, (С1-С3)галоидалкоксигруппу или CN;
R11 означает (С1-С6)алканоил, который не замещен или замещен одним или несколькими радикалами, выбираемыми из группы, включающей галоид, (С1-С4)алкокси- и (С1-С4)алкилтиогруппу;
А означает CH2, О или простую химическую связь;
и в котором стереохимическая конфигурация в помеченном 1 положении является (R)-конфигурацией, обладающей стереохимической чистотой от 60 до 100% (R),
за исключением соединений формулы (XIII) или их солей, где
(i) A означает простую химическую связь, R6, R7, R8, R9 и R10 каждый означают водород; или
А означает простую химическую связь, R6 означает метил; R7, R8, R9 и R10 каждый означают водород и R11 означает ацетил; или
А означает простую химическую связь; R6, R7, R9 и R10 каждый означают водород, R8 означает фтор и R11 означает ацетил; или
(ii) A означает CH2, R6, R7, R8, R9 и R10 каждый означают водород, и R11 означает ацетил, трифторацетил, хлорацетил или бутаноил; или
А означает CH2, R6, R7 и R9 каждый означают водород, R8 означает метил, R10 означает метил, и R11 означает ацетил; или
А означает CH2, R6, R8 и R10 каждый означают водород, R7 означает метил, R9 означает метил, и R11 означает ацетил; или
А означает CH2, R6, R7, R9 и R10 каждый означают водород, R8 означает метоксигруппу, a R11 означает ацетил, или
А означает CH2, и R6 означает метил, R7, R8, R9 и R10 означают каждый водород, a R11 означает ацетил, или
А означает CH2, R7, R8, R9 и R10 означают каждый водород, R6 означает метил, a R11 означает ацетил, или
А означает CH2, R6, R8, R9 и R10 означают каждый водород, a R7 означает метоксигруппу и R11 означает бромацетамид или хлорпропионил; или
iii) A означает атом кислорода, R6, R7, R8, R9 и R10 каждый означают H, a R11 означает ацетил.
Текст
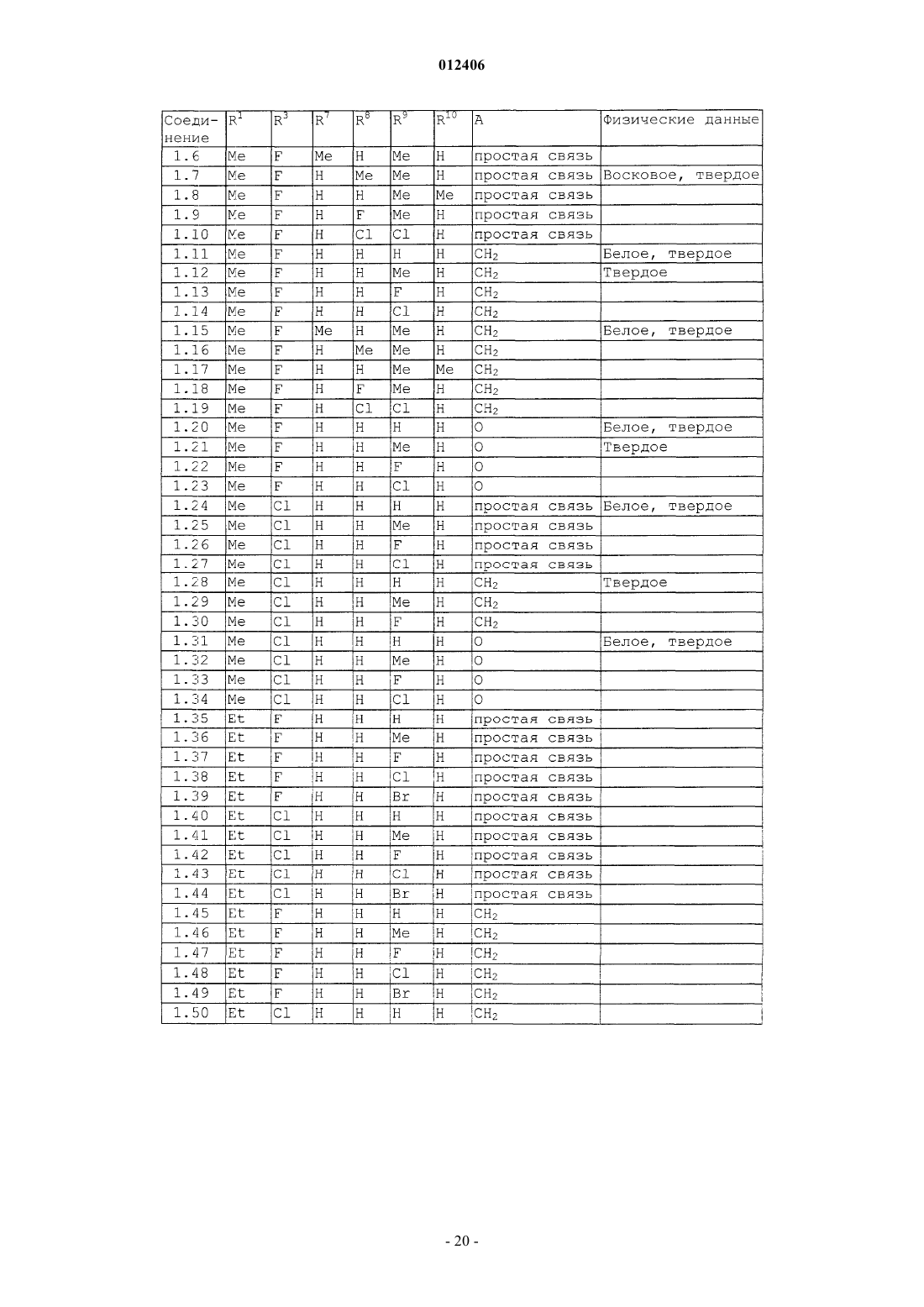
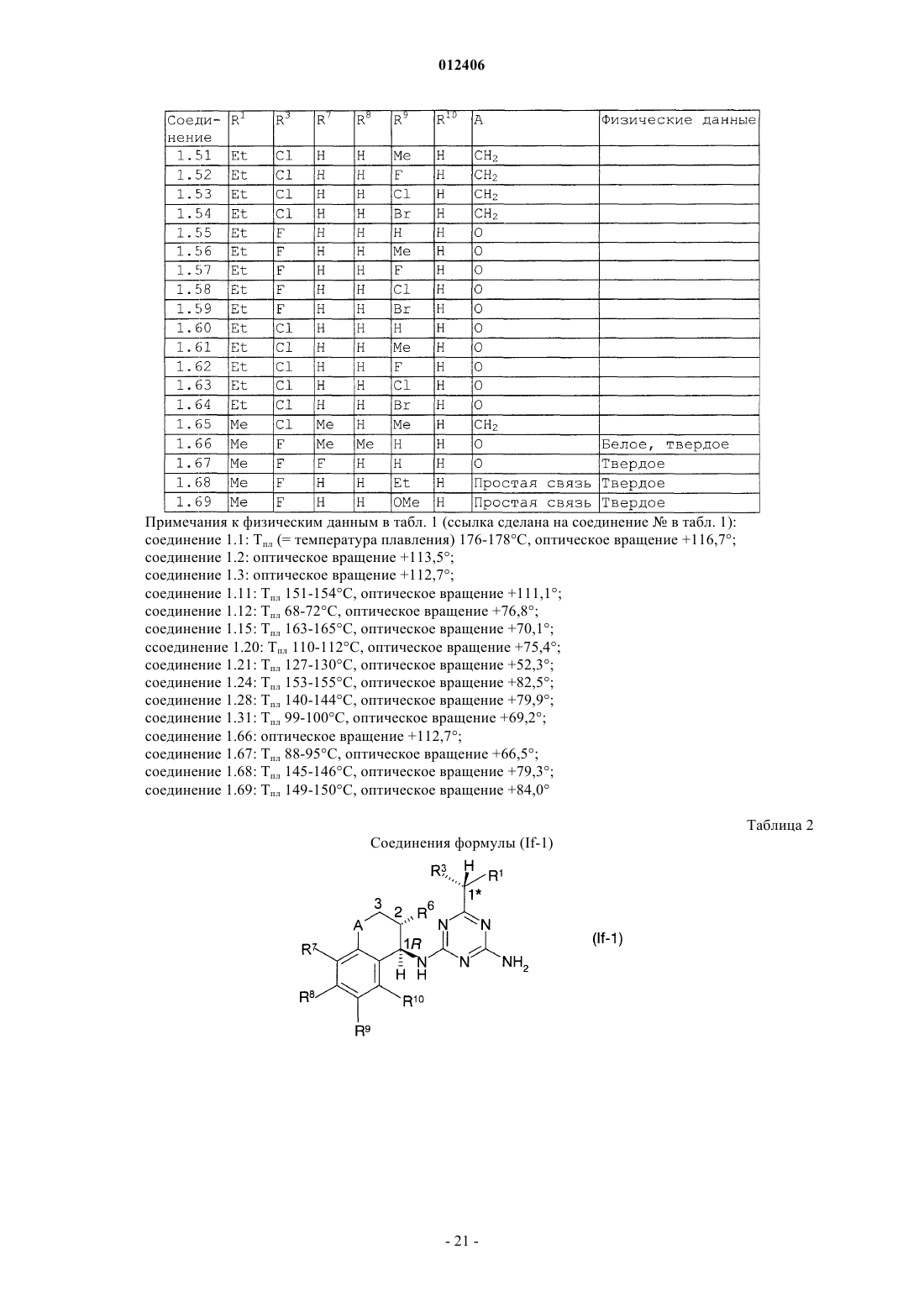
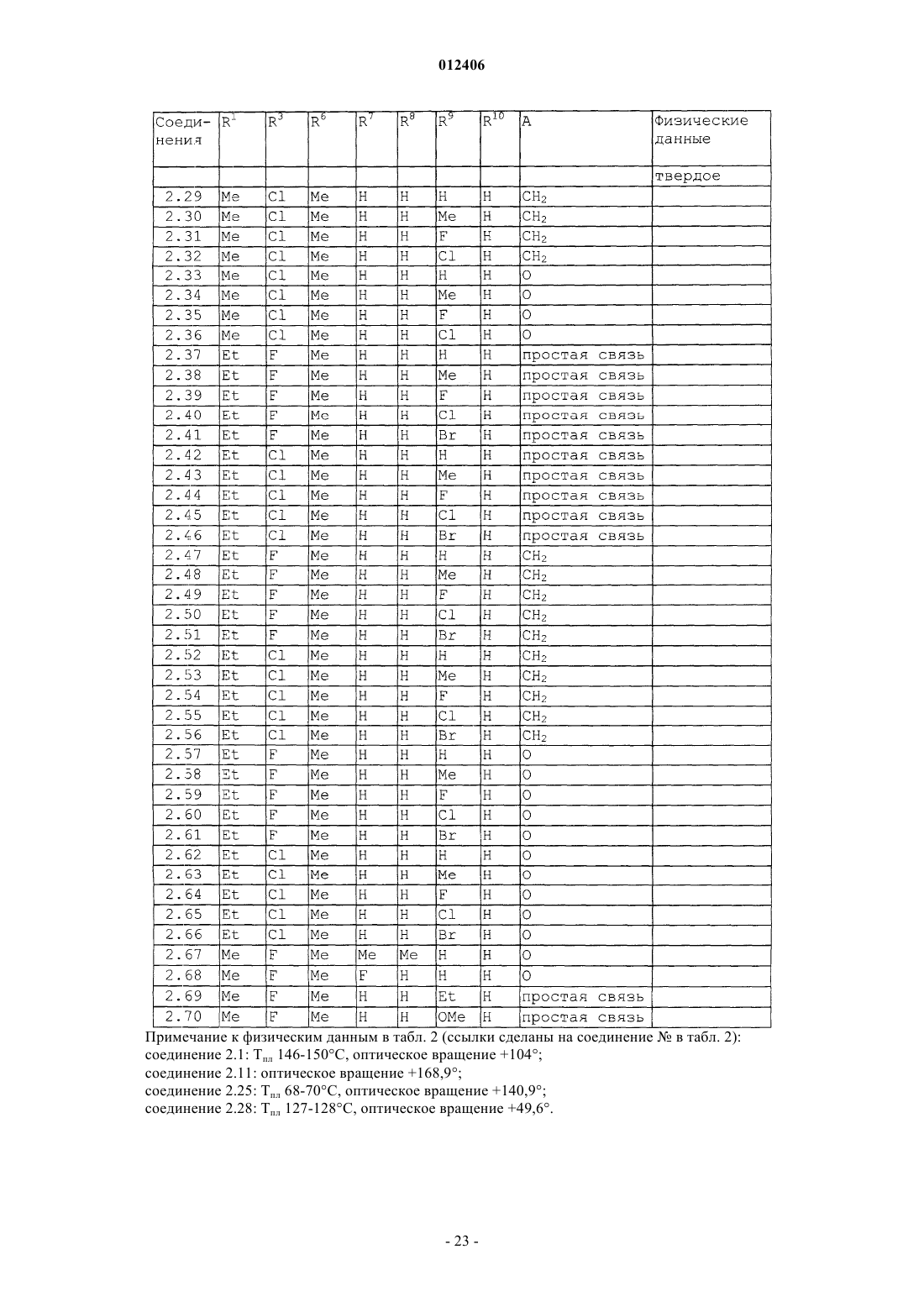
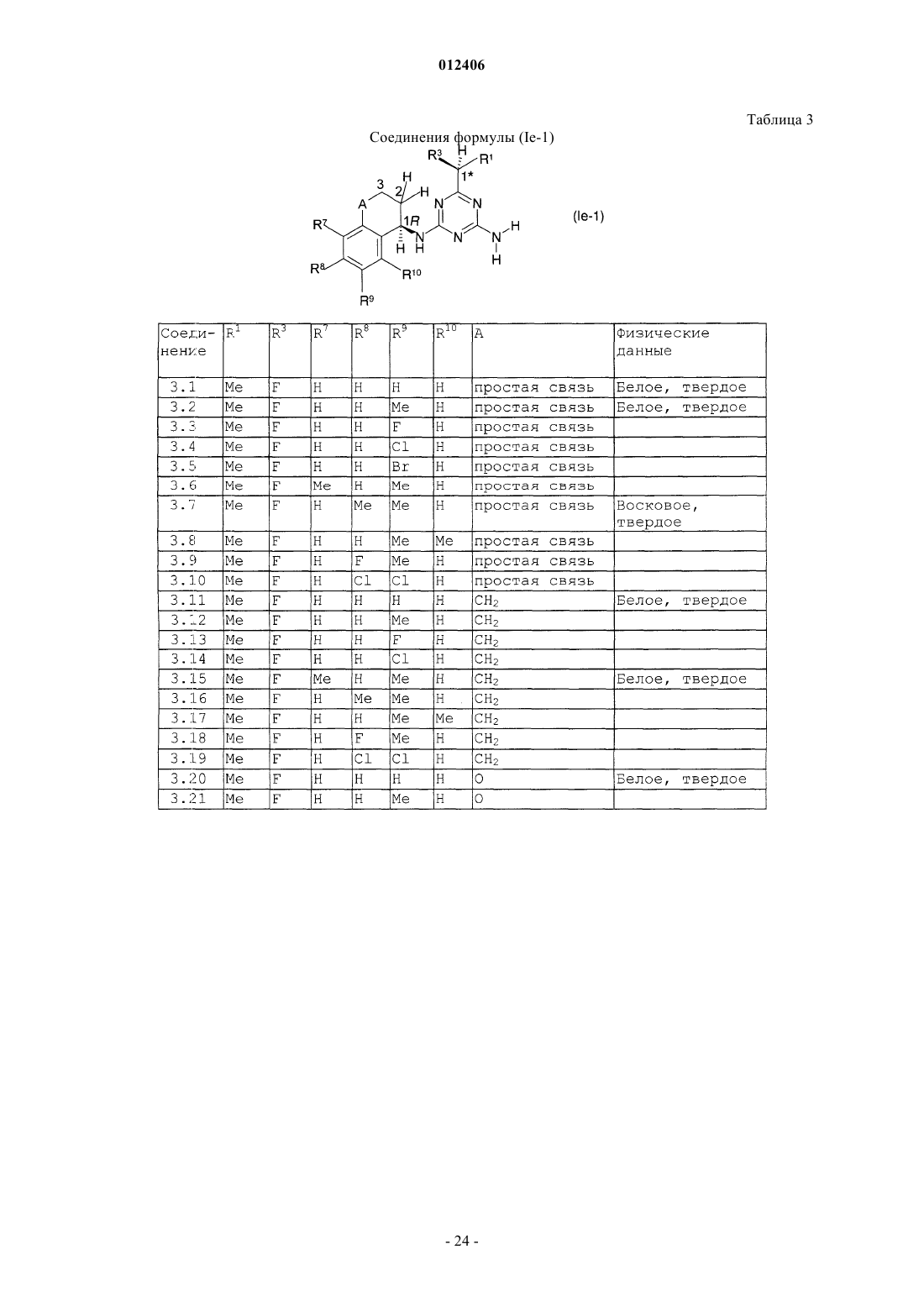
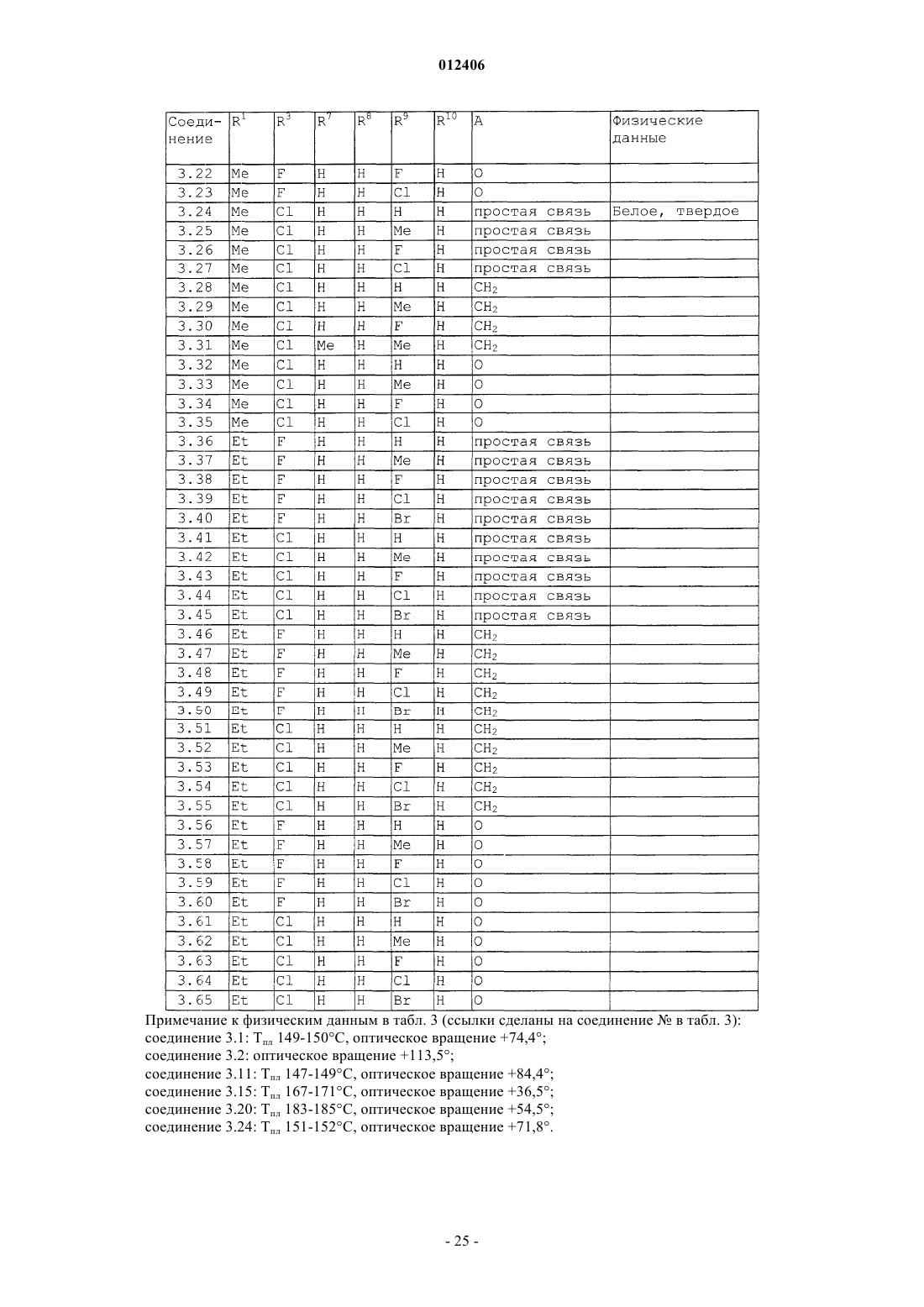
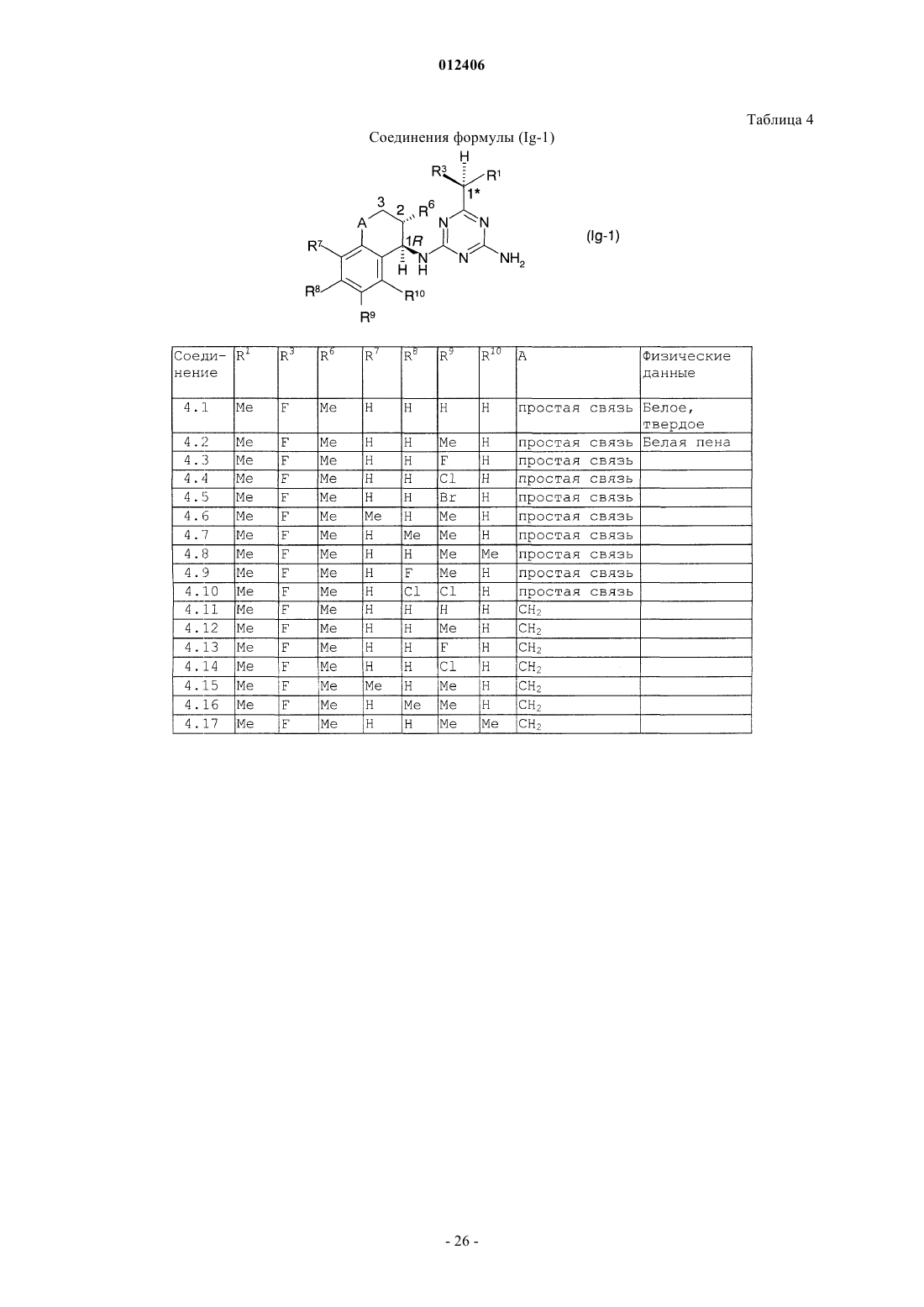
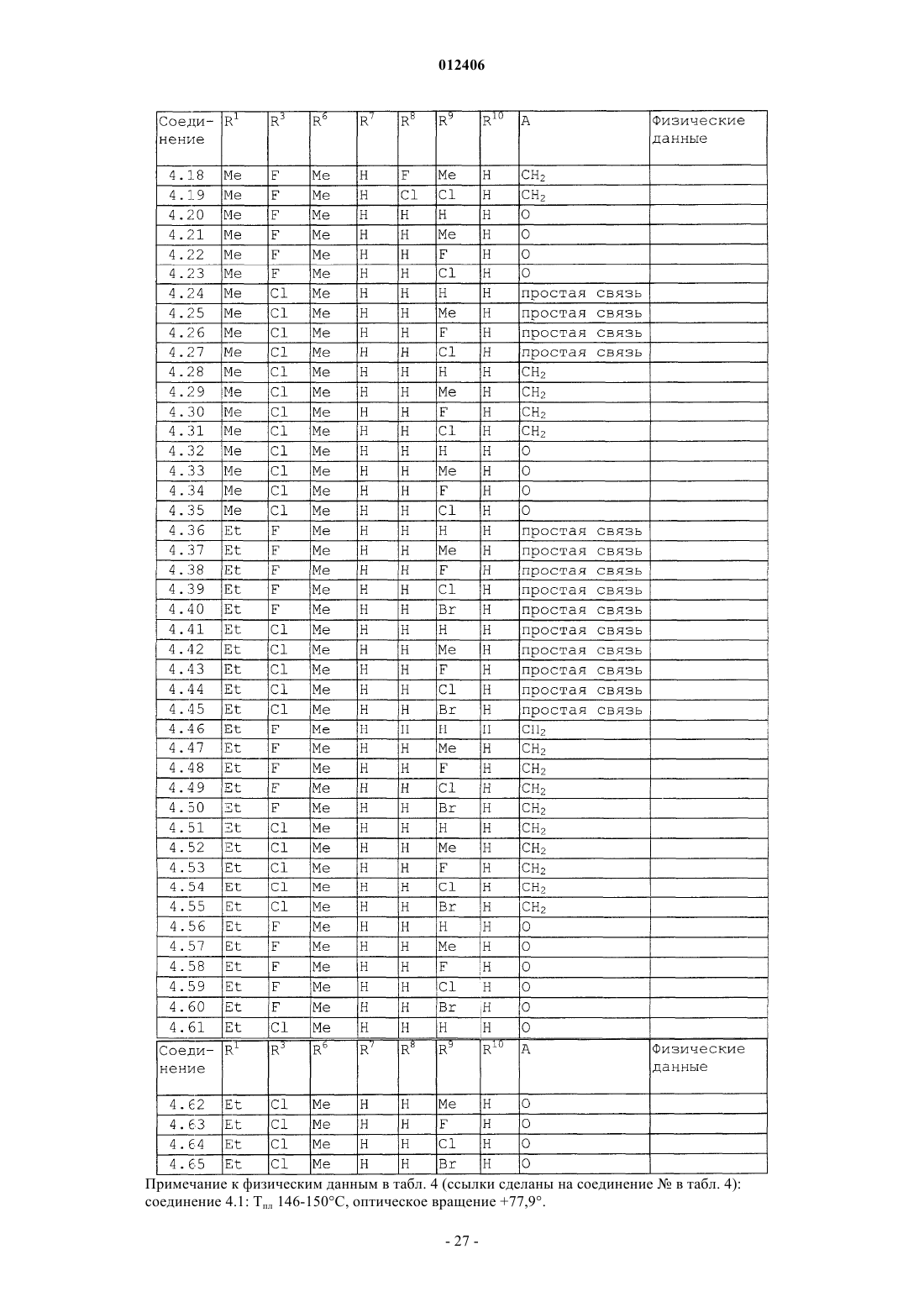
012406 Изобретение относится к области борьбы с сорными растениями, более конкретно, к производным оптически активных изомеров 2-амино-4-(бициклил)амино-6-(алкилзамещенного)-1,3,5-триазина, способам их получения, их применению в качестве гербицидов или регуляторов роста растений, гербицидной или регулирующей рост композиции, способу борьбы с нежелательными растениями и промежуточным соединениям. Основа изобретения В WO 97/31904 и ЕР-А-0864567 описано получение 2-амино-4-бициклиламино-1,3,5-триазинов и их использование в качестве гербицидов и регуляторов роста растений. В указанных патентных заявках главным образом описаны различные производные амино-1,3,5-триазина, которые замещены несколькими радикалами, содержащими, по существу, один или несколько хиральных центров. Специфические вновь открытые производные, однако, описаны только в виде смесей стереоизомеров, таких как рацемические смеси, энантиомеров или смеси диастереомеров в их рацемических формах. В некоторых случаях известные активные вещества неблагоприятны при применении, например, не обладают достаточной гербицидной эффективностью по отношению к сорным растениям, имеют слишком жесткие ограничения, связанные с погодными, климатическими и/или почвенными условиями, охватывают слишком узкий спектр подавляемых сорных растений или имеют слишком низкую селективность по отношению к культурным растениям. Неожиданно было обнаружено, что определенные оптически активные изомеры некоторых замещенных производных 2-амино-1,3,5-триазина обладают очень хорошими для применения свойствами по сравнению с ранее полученными видами соединений или соответствующими рацемическими соединениями или их оптическими изомерами. Например, они являются очень активными гербицидами, которые могут быть использованы для борьбы с рядом вредных сорных растений, причем эти гербициды на удивление проявляют более сильный гербицидный эффект, чем их стереоизомеры или рацемические смеси. Подробное описание изобретения Данное изобретение относится к соединению, которое является оптически активным соединением формулы (I) где R1 означает H, галоид, (C1-C6)алкил, (C1-C6)галоидалкил, [(C1-C4)алкокси](C1-C6)алкил, (C3-C6)циклоалкил, который не замещен или замещен одним или несколькими радикалами, выбираемыми из группы,которая включает галоид, (C1-C4)алкил и (C1-C4)галоидалкил, или означает (C2-C6)алкенил, (C2C6)алкинил, (C2-C6)галоидалкенил, (C4-C6)циклоалкенил, (C4-C6)галоидциклоалкенил, (C1-C6)алкоксиили (C1-C6)галоидалкоксигруппу;R1 и R2 могут образовать вместе с атомом углерода, к которому они присоединены, (C3C6)циклоалкильное или (C4-C6)циклоалкенильное кольцо;R7, R8, R9 и R10, каждый независимо, означают H, (C1-C4)алкил, (C1-C3)галоидалкил, галоид, (C1C3)алкокси-, (C1-C3)галоидалкоксигруппу или CN; А означает CH2, О или простую химическую связь; и стереохимическая конфигурация в отмеченном 1 положении является (R)-конфигурацией, а стереохимическая чистота составляет от 60 до 100% (R), предпочтительно 70-100% (R), более предпочтительно 80-100% (R), основываясь на содержании стереоизомеров, имеющих (R)- и (S)-конфигурацию в этом положении; или к приемлемой в сельском хозяйстве соли этого соединения. С целью ссылок некоторые кольцевые атомы углерода в формуле (I) пронумерованы от 1 до 3, тогда как атом углерода, связанный с триазинозным кольцом, обозначен 1. В данном изобретении стереохимическая конфигурация у помеченного 1 положения зафиксирована как предоминирующая (R)-конфигурация по отношению к системе Кана-Ингольдта-Прелога, однако,предметом изобретения являются также все стереоизомеры у других локантов, которые охватываются формулой (I), а также их смеси. Такие соединения формулы (I) содержат, например, один или более до-1 012406 полнительных асимметрических атома углерода или также двойные химические связи, которые особо не показаны в формуле (I). Понятно, что данное изобретение охватывает как чистые изомеры, так и более или менее обогащенные смеси их, у которых асимметрический атом углерода, помеченный в 1 положении, находится в R-конфигурации или смеси, соединение или соединения которых имеют то же самое химическое строение с R-конфигурацией в 1 положении или представленные в соотношении, в котором соединение, имеющее R-конфигурацию, является предоминирующим (по крайней мере 60% Rконфигурации), тогда как другой(ие) асимметричный(ые) атом(ы) углерода могут быть представлены в рацемической форме или также более или менее разделены. При условии, что стереохимическая конфигурация в помеченном 1 положении удовлетворяется, возможные стереоизомеры, определяемые их особой пространственной формой, такие как энантиомеры, диастереомеры, Z- и Е-изомеры, все охватываются формулой (I) и могут быть получены обычными способами из смесей стереоизомеров или также быть получены с помощью стереоселективных реакций с использованием стереохимически чистых исходных материалов. В зависимости от значений радикалов R1, R2 и R3 может появиться один возможный дополнительный центр асимметрии, относящийся к помеченному атому углерода 1 в формуле (I), в этом случае соединение формулы (I) согласно данному изобретению может существовать в виде по крайней мере двух чистых стереоизомерных форм, то есть (1R,1R) и (1R, 1S), выбираемых из четырех изомеров, которые могут существовать в принципе. Другой центр асимметрии может быть также представлен у помеченного атома углерода 2 в формуле (I), в этом случае соединение данного изобретения может существовать,по крайней мере, в виде четырех чистых стереоизомерных форм, каждый из этих дополнительных асимметричных атомов углерода имеет (R)- или (S)-конфигурацию, согласно системе Кана-ИнгольдаПрелога, то есть чистые изомеры имеют конфигурацию (1R,1R,2R), (1R,1R,2S), (1R,1S,2R) и(1R,1S,2S), выбираемые из восьми чистых стереоизомеров, которые могут существовать в принципе. Более того, в зависимости от природы групп R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 могут появиться другие асимметричные атомы углерода. В случае, когда в формуле, приведенной здесь ниже, специфическая стереохимическая конфигурация указана в любом положении, например у помеченных атомов углерода 1, 2 или 1 без других указаний, то это означает что стереохимическая чистота в отмеченном положении составляет от 60 до 100%,предпочтительно 70-100%, более предпочтительно 80-100%, наиболее предпочтительно 100%. "Стереохимическая чистота" означает количество установленного стереоизомера, выраженное в процентах от общего количества стереоизомеров, имеющих данный хиральный центр. Изобретение также включает любые кето и энольные таутомерные формы и смеси, а также их соли в том случае, если соответствующие функциональные группы присутствуют. Соединения формулы (I) могут образовывать соли присоединения с подходящей неорганической или органической кислотой, такой как, например, HCl, HBr, H2SO4 или HNO3 или моно- или бифункциональная карбоновая кислота или сульфоновая кислота, к основной группе, такой как, например, аминоили алкиламиногруппа. Некоторые соединения формулы (I) могут образовывать соли присоединения с подходящими неорганическими или органическими основаниями. Такие соединения (I) имеют функциональную группу,которая содержит один "кислотный атом водорода", такую как карбоксильная или сульфонильная группа, которая может быть заместителем в определении ацильной группы. Примерами таких солей являются соли металлов, в особенности соли щелочных металлов или соли щелочно-земельных металлов, предпочтительно натриевые или калиевые соли, или не замещенные или замещенные аммониевые соли, такие как аммониевые соли, или соли органических аминов, или четвертичные аммониевые соли. В данном описании изобретения, включая формулу изобретения, упомянутые выше заместители имеют следующие значения. Галоид означает фтор, хлор, бром или йод. Термин "галоид" в начале названия радикала означает, что этот радикал частично или полностью галоидирован, то есть замещен F, Cl, Br или I в любом сочетании. Выражение "(C1-С 6)алкил" означает линейный или разветвленный нециклический насыщенный углеводородный радикал, содержащий 1, 2, 3, 4, 5 или 6 атомов углерода (интервал числа атомов углерода указан в скобках), такой как, например, метил, этил, пропил, изопропил, 1-бутил, 2-бутил, 2 метилпропил или трет-бутил. То же относится к алкильным группам в составных радикалах, таких как"алкоксиалкил". Алкильные радикалы, а также алкильные радикалы в составных группах, если особо не оговорено, предпочтительно имеют 1-4 атома углерода."(C1-C6)галоидалкил" означает алкильную группу, упомянутую в выражении "(C1-C6)алкил", в которой один или несколько атомов водорода замещены тем же числом одинаковых или различных атомов галоида, такие как моногалоидалкил, то есть CH2F, CH2Cl, CH2Br, CH2I, CH2CH2F, CH2CH2Cl, CH2CH2Br,CH2CH2I, CHFCH3, или пергалоидалкил, например CF3, CCl3, CF2CF3, CCl2CCl3, CF2CCl3 и CCl2CClF2,или CHF2, CF3CH2, CHF2CF2, CH2FCHCl, или CHCl2.(C1-C6)алкоксигруппа означает алкоксигруппу, углеродная цепь которой означает "(C1-C6)алкил". "Галоидалкокси"-группа означает, например, OCF3, OCHF2, OCH2F, CF3CF2O, OCH2CF3 или OCH2CH2Cl."(C2-C6)Алкенил" означает линейную или разветвленную, нециклическую углеводородную цепь,содержащую столько атомов углерода, сколько указано в скобках, и которая содержит по крайней мере одну двойную связь, которая может быть локализована в любом положении соответствующего ненасыщенного радикала. "(C2-C6)алкенил" в соответствии с записью означает, например, винил, аллил, 2 метил-2-пропенил, 2-бутенил, пентенил, 2-метилпентил или гексенильную группу."(C2-C6)Алкинил" означает линейную или разветвленную, нециклическую углеводородную цепь,которая содержит столько атомов углерода, сколько указано в скобках, и которая содержит по крайней мере одну тройную связь, которая может быть локализована в любом положении соответствующего ненасыщенного радикала. "(C2-C6)-алкинил" в соответствии с записью, например, означает пропаргил, 1 метил-2-пропинил, 2-бутинил или 3-бутинил."(C3-C6)Циклоалкил" означает моноциклические алкильные радикалы, такие как циклопропил, циклобутил, циклопентил или циклогексил."(C4-C6)Циклоалкенил" означает карбоциклическое, неароматическое, частично ненасыщенное кольцо, содержащее 4-6 атомов углерода, например 1-циклобутенил, 2-циклобутенил, 1-циклопентенил,2-циклопентенил, 3-циклопентенил или 1-циклогексенил, 2-циклогексенил, 3-циклогексенил, 1,3 циклогексадиенил или 1,4-циклогексадиенил. Ацильный радикал означает в широком смысле этого термина радикал органической кислоты, который формально образуется при отрыве ОН-группы, например радикал карбоновой кислоты и радикал кислоты, полученной из нее, такой как тиокарбоновая кислота, не замещенная или N-замещенная иминокарбоновая кислота или радикал карбоновых моноэфиров, не замещенная или N-замещенная карбаминовая кислота, не замещенная или N-замещенная тиокарбаминовая кислота, сульфоновые кислоты, сульфиновые кислоты, фосфоновые кислоты и фосфиновые кислоты. Ацил означает, например, формил, алкилкарбонил, такой как [(C1-C4)алкил]карбонил, фенилкарбонил, алкилоксикарбонил, фенилоксикарбонил, бензилоксикарбонил, алкилсульфонил, алкилсульфинил, фенилсульфонил, N-алкил-1-иминоалкил и другие радикалы органических кислот. В этом контексте радикалы могут быть далее замещены как в алкильной, так и в фенильной части, например в алкильной части одним или несколькими радикалами, выбираемыми из группы, которая включает галоид, алкокси-, фенил и феноксигруппу; примерами замещения в фенильной части являются моно- или полизамещенные, предпочтительно замещенные от одного до трех одинаковыми или различными радикалами, выбираемыми из группы, которая включает галоид, (C1C4)алкил, (C1-C4)алкоксигруппу, (C1-C4)галоидалкил, (C1-C4)галоидалкокси- и нитрогруппу, например о-,м- и п-толил, диметилфенилы, 2-, 3- и 4-хлорфенил, 2,3,4-трифторфенил и -трихлорфенил, 2,4-, 3,5-, 2,5 и 2,3-дихлорфенил, о-, м- и п-метоксифенил. Ацильный радикал обычно содержит 1-24 атома углерода, предпочтительно 1-18, более предпочтительно 1-12, наиболее предпочтительно 1-7, в особенности 1-4. Ацил в более узком смысле означает, например, радикал алкановой кислоты, алкеновой кислоты,алкиновой кислоты или арилкарбоновой кислоты (например, бензоил), или означает, например, алкоксикарбонил, алкенилоксикарбонил, алкинилоксикарбонил, арилоксикарбонил, алкилсульфонил, алкилсульфинил или фенилсульфонил; в еще более узком смысле этого слова ацил означает радикал алкановой кислоты, например (С 1-С 24)алкановой кислоты, предпочтительно (C1-C18)алкановой кислоты, более предпочтительно (C1-C12)алкановой кислоты, наиболее предпочтительно (C1-С 6)алкановой кислоты, такой радикал, как формил, ацетил или пропионил. Выражение "один или несколько радикалов, выбираемых из группы, которая включает" в пояснении означает, что в каждом случае один или несколько идентичных или различных радикалов выбирают из указанной группы радикалов, если особо не сделано определенных ограничений. При комбинировании переменных общая формула может формально включать нестабильные функциональные группы, то есть карбамильный радикал или гидроксикарбонилоксильный радикал, которые нестабильны в нейтральной или кислотной водной среде и которым таким образом не отдают предпочтение или используют их стабильные соли или только продукты распада соответственно. Соединения общей формулы (I) согласно данному изобретению или их соли, в которых индивидуальные радикалы имеют одно из предпочтительных значений, которые уже были заявлены выше или заявлены ниже, и в особенности те, которые приведены в табличных примерах, и в особенности такие, в которых комбинируется два или более предпочтительных значения, которые уже заявлены или будут заявлены ниже, представляют особый интерес, главным образом в связи с их возможным гербицидным действием, лучшей селективностью и/или большей легкостью получения. Особый интерес представляют соединения формулы (I), где радикал выбирают из группы радикалов R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и А, которая определена как предпочтительная, как указано ниже,в которой значения радикала независимы от значений других радикалов указаной группы. Предпочтительные соединения формулы (I) содержат комбинацию радикалов той группы, которая включает два или более предпочтительных значения, указанных ниже.-3 012406 Понятно, что символы и радикалы, которые особо не оговорены в приведенных ниже препочтительных значениях, вообще имеют такие значения, которые указаны выше в описании. Предпочтительно R1 означает H, галоид, (С 1-С 4)алкил, (C1-C4)галоидалкил, [(C1-C4)алкокси](C1C4)алкил, (С 3-С 6)циклоалкил, который не замещен или замещен одной или несколькими, предпочтительно одной или двумя (C1-C4)алкильными группами, или означает (C3-C4)галоидциклоалкил, (C2-C4)алкенил, (C2-C4)алкинил, (C2-C4)галоидалкенил, (C1-C4)алкокси- или (C1-C4)галоидалкоксигруппу; более предпочтительно R1 означает H, галоид, (C1-C4)алкил, (С 3-С 6)циклоалкил или (C1-C4)алкоксигруппу; наиболее предпочтительно R1 означает H или (C1-C4)алкил; очень предпочтительно R1 означает H или(С 1-С 3)алкил, особенно H, метил или этил. Предпочтительно R2 означает H или (C1-C4)алкил; более предпочтительно R2 означает H. Предпочтительно R1 и R2 образуют вместе с атомом углерода, к которому они присоединены, (С 3 С 6)циклоалкильное кольцо, более предпочтительно (С 3-С 4)циклоалкил. Предпочтительно R3 означает H, (C1-C4)алкил, (C1-C4)алкоксигруппу или галоид; более предпочтительно R3 означает H, (C1-C3)алкил, (C1-C4)алкоксигруппу, Cl или F; наиболее предпочтительно R3 означает H, (C1-C2)алкил, метоксигруппу, хлор или фтор. Предпочтительно R4 означает H, (C1-C4)алкил, (C1-C4)галоидалкил, (C3-C4)алкенил, (C3-C4)алкинил или ацильный радикал, который содержит 1-12 атомов углерода, ацильный радикал означает предпочтительно радикал, выбираемый из группы, которая включает CHO, -СО(C1-C6)алкил, -СО(C1-C6)галоидалкил, -CO2(C1-C6)алкил, -SO2(C1-C6)алкил, -CO2-фенил или -СО-фенил, где каждый фенил не замещен или замещен одним или несколькими радикалами, выбираемыми из группы, которая включает галоид,(C1-C2)алкил, (C1-C2)галоидалкил, (C1-C2)алкокси-, (C1-C2)галоидалкоксигруппу и NO2; более предпочтительно R4 означает H, (C1-C3)алкил, (C1-C3)галоидалкил, аллил, пропаргил, CHO,-СО(C1-C3)алкил или -CO(C1-C3)галоидалкил; наиболее предпочтительно R4 означает H, CHO, COCH3,COCH2Cl, COCH(CH3)Cl или COCF3; очень предпочтительно R4 означает H. Предпочтительно R5 означает H, (C1-C4)алкил или (C1-C4)галоидалкил; более предпочтительно R5 означает H или (C1-C2)алкил; наиболее предпочтительно R5 означает H. Предпочтительно R6 означает H, (С 1-С 3)алкил или (C1-C3)алкоксигруппу; более предпочтительно R6 означает H, метил или этил. Предпочтительно R7, R8, R9 и R10 означают каждый независимо H, (C1-C3)алкил, галоид или (C1C3)алкоксигруппу; более предпочтительно R7, R8, R9 и R10 означают, каждый независимо, H, метил, F илиCl. Предпочтительно А означает CH2 или простую химическую связь. Предпочтительными соединениями формулы (I) являются такие соединения, у которых(C1-C4)галоидалкил, [(C1-C4)алкокси](C1-C4)алкил, (C3-C6)циклоалкил, который не замещен или замещен одной или двумя (C1-C4)алкильными группами, или означает (C3-C4)галоидциклоалкил, (C2-C4)алкенил,(C2-C4)галоидалкенил, (C2-C4)алкинил, (C1-C4)алкокси- или (C1-C4)галоидалкоксигруппу;R4 означает H, (C1-C4)алкил, (C1-C4)галоидалкил, (C3-C4)алкенил, (C3-C4)алкинил или ацильный радикал, который включает 1-12 атомов углерода (предпочтительно CHO, -СО(C1-C6)алкил, -CO(C1C6)галоидалкил, -CO2(C1-C6)алкил, -SO2(C1-C6)алкил, -CO2-фенил или -СО-фенил, где каждый фенил не замещен или замещен одним или несколькими радикалами, выбираемыми из группы, которая включает галоид, (C1-C2)алкил, (C1-C2)галоидалкил, (C1-C2)алкокси-, (C1-C2)галоидалкоксигруппу и NO2;R7, R8, R9 и R10 означают, каждый независимо, H, (C1-C3)алкил, галоид или (C1-C3)алкоксигруппу; и А означает CH2, O или простую химическую связь (предпочтительно А означает CH2 или простую химическую связь, более предпочтительно означает простую химическую связь). Более предпочтительны соединения формулы (I), гдеR7, R8, R9 и R10 означают, каждый независимо, H, метил, F и Cl; и А означает CH2, O или простую химическую связь (предпочтительно А означает CH2 или простую химческую связь, более предпочтительно простую химическую связь). Наиболее предпочтительными соединениями формулы (I) являются такие, гдеH, метил, F и Cl; и А означает CH2, O или простую химическую связь. Предпочтительно радикал формулы CR1R2R3 в формуле (I) означает радикал, выбираемый из группы, которая включает (C1-C4)алкил, (C1-C4)галоидалкил, (C3-C4)циклоалкил, 1-(C1-C3)алкил-(C3-C4)циклоалкил и (C3-C4)галоидциклоалкил, более предпочтительно (C1-C3)алкил, (C1-C4)фторалкил, (C1C4)хлоралкил, (C3-C4)циклоалкил, 1-(C1-C3)алкил-(C3-C4)циклоалкил, (C3-C4)фторциклоалкил или (C3C4)хлорциклоалкил, например, такие радикалы, как метил, этил, н-пропил, изопропил, н-бутил, 2-бутил,изобутил, трет-бутил, 1-фторэтил, 1-фторпропил, 1-фторизопропил, 1-фтор-н-бутил, 1-хлорэтил, 1 хлорпропил, 1-хлор-изопропил, 1-хлор-н-бутил, 1-метилциклопропил, 1-хлорциклопропил или 1-фторциклопропил. Предпочтительное воплощение изобретения относится к оптически активным соединениям формулы (Ia), у которых атомы углерода, помеченные 1 и 1, являются оба хиральными и атом углерода, помеченный 2, является ахиральным где R1, R2 и R3 имеют значения, которые указаны в формуле (I), при условии, что R1, R2 и R3 являются структурно различными; различные другие символы имеют такие же значения, как в формуле (I),и стереохимическая конфигурация у помеченного 1 атома углерода такая же, как указано в формуле(I),и стереохимия у помеченного 1 атома углерода является (R)- или (S)-конфигурацией или их смесью, также включая рацемическую смесь (R,S), предпочтительно рацемическая конфигурация или избыток (R)- или (S)-конфигурации от 60 до 100%, более предпочтительно от 70 до 100%, наиболее предпочтительно от 80 до 100% от общего количества изомеров (R)- и (S)-конфигурации; или к их солям. Более предпочтительно соединение формулы (Ia), гдеR7, R8, R9 и R10 означают, каждый независимо, H, (C1-С 6)алкил или галоид; и А означает CH2, О или простую химическую связь (более предпочтительно А означает CH2 или простую химическую связь, наиболее предпочтительно означает простую химическую связь); при условии, что R1, R2 и R3 структурно различны. Еще более предпочтительны соединения формулы (Ia),гдеH, метил, Br, Cl или F; и А означает CH2, О или простую химическую связь (более предпочтительно А означает CH2 или простую химическую связь, наиболее предпочтительно означает простую химическую связь); при условии, что R1, R2 и R3 являются структурно различными. Второе предпочтительное воплощение изобретения относится к оптически активным соединениям формулы (Ib), где помеченные атомы углерода 1 и 2 являются оба хиральными и атом углерода, помеченный 1, является ахиральным где R1, R2 и R3 имеют такие значения, которые указаны в формуле (I), при условии, что по крайней мере два из радикалов R1, R2 и R3 являются структурно идентичными;R6 означает (C1-C6)алкил; различные другие символы имеют такие же значения, которые указаны для формулы (I); а стереохимическая конфигурация у помеченного 1 атома углерода такая же, как в формуле (I); и стереохимия у помеченного атома углерода 2 означает (R)- или (S)-конфигурацию или их смесь,также включая рацемическую конфигурацию (R,S), предпочтительно рацемическая конфигурация или избыток изомеров (R)- или (S)-конфигурации от 60 до 100%, более предпочтительно от 70 до 100%, наиболее предпочтительно от 80 до 100% от общего количества изомеров (R)- и (S)-конфигурации; или к их солям. Также предпочтительны соединения формулы (Ib), гдеR7, R8, R9 и R10 означают, каждый независимо, H, (C1-C6)алкил или галоид; и А означает CH2, О или простую химическую связь (более предпочтительно А означает CH2 или простую химическую связь, наиболее предпочтительно простую химическую связь); при условии, что по крайней мере два радикала из R1, R2 и R3 являются структурно идентичными. Еще более предпочтительны соединения формулы (Ib), гдеH, метил, Br, Cl или F; и А означает CH2, О или простую химическую связь (более предпочтительно А означает CH2 или простую химическую связь, наиболее предпочтительно означает простую химическую связь); при условии, что по крайней мере два радикала из R1, R2 и R3 являются структурно идентичными. Третье предпочтительное воплощение изобретения относится к оптически активным соединениям формулы (Ic), где помеченные атомы углерода 1, 2 и 1 все являются хиральнымиR означает (C1-С 6)алкил, предпочтительно (C1-C4)алкил; все другие разные символы имеют такие значения, которые указаны для соединения формулы (I); и стереохимическая конфигурация у помеченного 1 атома углерода, такая же, как указана для формулы (I); и стереохимия у каждого помеченного атома углерода 2 и 1 означает (R)- или (S)-конфигурацию или их смесь, также включая рацемическую конфигурацию (R,S), предпочтительно рацемическая конфигурация или избыток (R)- или (S)-конфигураций от 60 до 100%, более предпочтительно от 70 до 100%,наиболее предпочтительно от 80 до 100% от общего количества (R)- и (S)-конфигураций; или к их солям. Четвертое предпочтительное воплощение данного изобретения относится к оптически активным соединениям формулы (I), где помеченный атом углерода 1 является хиральным и помеченные атомы углерода 2 и 1 оба являются ахиральными и где R1, R2 и R3 имеют такие значения, которые указаны для формулы (I), при условии, что по крайней мере два радикала из R1, R2 и R3 являются структурно идентичными;R6 означает H; значения разных других символов и радикалов такие, как указаны для формулы (I); и стереохимическая конфигурация у помеченного 1 положения такая же, как указано для формулы(I); или к их солям. Также предпочтительны соединения общей формулы (Id) и (1e), которые являются стереоизомерами соединений общей формулы (Ia), у которых конфигурация у помеченного атома углерода 1 специфически установлена как (R) или (S)R3 означает галоид; и разные радикалы и символы имеют такие значения, которые указаны в формуле (I). Предпочтительны также соединения формулы (If), (Ig), (Ih) и (Ii), которые являются стереоизомерами соединений общей формулы (Ic), где конфигурации у помеченных атомов углерода 1, 2 и 1 определены специфическиR являются структурно различными. Более предпочтительны соединения формулы (If), (Ig), (Ih) и (Ii), гдеR1 означает метил или этил;R6 означает метил или этил; иR7, R8, R9 и R10 означают, каждый независимо, H, метил, Br, Cl или F; при условии, что R1, R2 и R3 являются структурно различными. Также более предпочтительны соединения формулы (Id) и (Ie), гдеR1 означает метил или этил;R7, R8, R9 и R10 означают, каждый независимо, H, метил, Br, Cl или F; при условии, что R1, R2 и R3 являются структурно различными. Предпочтительны также соединения формулы (Ij), которые являются стереоизомерами соединений общей формулы (Ib), где конфигурации у помеченнных атомов углерода 1 и 2 установлены специфическиR1 и R2 могут образовать вместе с атомом углерода, к которому они присоединены, (C3-C6)циклоалкильное кольцо;R6 означает (C1-C6)алкил; и разные другие символы и радикалы имеют такие же значения, которые указаны для формулы (I); при условии, что по крайней мере два радикала из R1, R2 и R3 являются структурно идентичными. Также предпочтительны соединения формулы (Ij), гдеR1 и R2 могут образовать вместе с атомом углерода, к которому они присоединены, циклопропильное кольцо;H, метил, Br, Cl или F. Соединения формулы (If) и (Ih) являются особенно предпочтительными. Соединения формулы (If) наиболее предпочтительны. Другим классом предпочтительных соединений являются соединения формулы (Ia), (Ib), (Ic), (Id),(Ie), (If), (Ig), (Ih), (Ii) или (Ij), где радикалы R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и А имеют такие значения,которые указаны в качестве предпочтительных значений для формулы (I). Особенно предпочтительным классом соединений являются соединения формулы (If), гдеR7, R8, R9 и R10 означают, каждый независимо, H, метил, F или Cl; и А означает CH2, О или простую химическую связь (более предпочтительно А означает простую химическую связь); при условии, что R1, R2 и R3 являются структурно различными. Также предпочтительны соединения формулы (Ia-1), (Ic-1), (Id-1), (Ie-1), (If-1), (Ig-1), (Ih-1), (Ii-1) и(Ij-1), как изображено в формулах, приведенных перед таблицами ниже, где R4 и R5 означают каждый H,и радикалы R1, R2, R3, R6, R7, R8, R9, R10 и А имеют такие значения, которые указаны выше для основной формулы (Ia), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii) и (Ij). Более предпочтительны соединения формулы (Ia-1), (Id-1) и (Ie-1), как изображено в формулах,приведенных перед таблицами ниже, гдеR7 , R8 , R9 и R10 означают, каждый независимо, H, (C1-C6)алкил или галоид; при условии, что R1, R2 3 и R являются структурно различными. Также более предпочтительны соединения формулы (Ic-1), (If-1), (Ig-1), (Ih-1) и (Ii-1), как изображено в формулах, приведенных перед таблицами ниже,где R1 означает (C1-C6)алкил;-9 012406 и R3 являются структурно различными. Также более предпочтительны соединения формулы (Ij-1), которые изображены в формуле, приведенной перед таблицей ниже, гдеR7, R8, R9 и R10 означают, каждый независимо, H, (C1-С 6)алкил или галоид; при условии что по крайней мере два радикала из R1, R2 и R3 являются структурно идентичными. Также предпочтительны соединения формулы (Ik), (Il), (Im), (In), и (Ip), которые изображены в формулах, приведенных перед таблицами ниже, в которых радикалы R1-R10 и А имеют значения, указанные выше в предпочтительных значениях соответствующей общей формулы. Более предпочтительны соединения формулы (Ik), которые изображены в формуле, приведенной перед таблицей ниже, гдеR7, R8, R9 и R10 означают, каждый независимо, H, (C1-C6)алкил или галоид; и как минимум два радикала из R1, R2 и R3 являются структурно идентичными. Также более предпочтительны соединения формулы (Il), (Im), (In), и (Ip), которые изображены в формулах, приведенных перед таблицами ниже, гдеR7, R8, R9 и R10 означают, каждый независимо, H, (C1-C6)алкил или галоид. Предпочтительные соединения формулы (I) являются оптически активными производными инданиламино-1,3,5-триазина формулы (I) (А = простая химическая связь). Также предпочтительны оптически активные производные хроман-4-иламино-1,3,5-триазина формулы (I) (А = атом кислорода) и оптически активные производные тетрагидронафталиниламино-1,3,5-триазина формулы (I) (А = метилен). Приведенные выше соединения формулы (I) могут быть получены при применении или адаптации известных способов (то есть способов, использованных до этого или описанных в литературе), например в общем виде описанных в WO 97/31904 или WO 97/29095, и в приведенных там ссылках и как описано в них. В последующем описании, если символы, появляющиеся в формуле, особо не поясняются, то это означает, что они имеют такие значения "как здесь указано выше" в соответствии с первым указанием значений каждого символа в описании, или предпочтительно имеют ввиду предпочтительные значения. Под этим следует понимать, что в предписании для следующих способов последовательности могут быть выполнены в различных порядках, и что могут быть использованы разные защитные группы для получения нужного соединения. В соответствии с одним аспектом данного изобретения соединения формулы (I) можно получить,если соединение общей формулы (II) где R1, R2 и R3 имеют такие значения, как указаны для формулы (I), и Z означает функциональную группу, которую выбирают из группы, включающей эфир карбоновой кислоты, ортоэфир карбоновой кислоты, хлорид карбоновой кислоты, карбоксамид, цианогруппу, ангидрид карбоновой кислоты или трихлорметил, подвергнуть взаимодействию с бигуанидиновым соединением общей формулы (III) или с его солью присоединения с кислотой где R4, R5, R6, R7, R8, R9, R10 и А, а также конфигурация у помеченного 1 положения такая же, как в формуле (I). Вообще реакцию осуществляют в присутствии основания, в инертном растворителе, таком как тетрагидрофуран, диоксан, ацетонитрил, N,N-диметилформамид, метанол или этанол, при температуре от 0C до температуры дефлегмации растворителя, предпочтительно от 20 до 60C. Основанием вообще является гидроксид щелочного металла, гидрид щелочного металла, карбонат щелочного металла, алкоксид щелочного металла, карбонат щелочно-земельного металла или органическое основание, такое как третичный амин, например триэтиламин, или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). В соответствии с другим аспектом данного изобретения эти соединения формулы (I) можно также получить, если соединение общей формулы (IV) где R1, R2, R3, R4 и R5 имеют такие же значения, а конфигурация в отмеченном 1 положении такая же,как в формуле (I), и L1 означает отщепляемую группу, такую как хлор, трихлорметил, (C1-C4)алкилсульфонил, фенилсульфонил или (C1-C4)алкилфенилсульфонил, подвергнуть взаимодействию с амином формулы (V) или его солью присоединения с кислотой где R6 , R7 , R8 , R9 , R10 и А имеют такие же значения, а конфигурация в помеченном 1 положении такая же, как в формуле (I). Реакцию вообще осуществляют в присутствии основания, в инертном, то есть полярном органическом растворителе, таком как тетрагидрофуран, диоксан, ацетонитрил, N,Nдиметилформамид, метанол или этанол, при температуре от 0 С до температуры дефлегмации растворителя, предпочтительно от 20 до 100C. Основанием вообще является гидроксид щелочного металла, гидрид щелочного металла, карбонат щелочного металла, алкоксид щелочного металла, карбонат щелочноземельного металла или органическое основание, такое как третичный амин, например триэтиламин, или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Способ известен в общих принципах, например, из Comprehensive Heterocyclic Chemistry, A.R.Katritzky и C.W. Rees, Pergamon Press, Oxford, New York, 1984, т. 3; часть 2B; ISBN 0-08-030703-5, стр. 482. В соответствии с другим аспектом данного изобретения в случае, если один из радикалов R4 или R5 в формуле (I) означает (C1-C4)алкил, (C1-C4)галоидалкил, (C3-C4)алкенил, (C3-C4)галоидалкенил, (C3C4)алкинил или (C3-C4)галоидалкинил, соединения формулы (I) данного изобретения можно получить,если соответствующее соединение формулы (I), где этот радикал R или R5, соответственно, означает H, а другие радикалы имеют такие же значения и конфигурация такая же, как в формуле (I), подвергнуть взаимодействию с алкилирующим агентом формулы (VI) или (VII) соответственно где L2 означает отщепляемую группу, как правило, галоид, предпочтительно хлор, бром или йод, или алкил- или фенилсульфонилоксигруппу, такую как метилсульфонилокси- или 4-толуолсульфонилоксигруппа. Реакцию вообще проводят в инертном растворителе, таком как тетрагидрофуран, диоксан, ацетонитрил или N,N-диметилформамид при температуре от 0 С до температуры дефлегмации растворителя, предпочтительно от 20 до 100C. В соответствии с другим аспектом даного изобретения соединения формулы (I), где один из ради- 11012406 калов R4 или R5 означает ацильный радикал, можно получить, если соответствующее соединение формулы (I), где один из этих радикалов R4 или R5, соответственно, означает H, а другие радикалы имеют такие же значения и конфигурация такая же, как указано в формуле (I), подвергнуть взаимодействию с ацилирующим агентом формулы (VIII) или (IX) соответственно где R4 и R5 означают каждый ацильный радикал, такой как указан в формуле (I), и L3 означает отщепляемую группу, как правило, галоид, предпочтительно хлор; или подвергнуть взаимодействию с формилирующим агентом, таким как муравьиная кислотаангидрид уксусной кислоты. Основание, обычно используемое для реакции ацилирования, как правило,выбирают из группы, которая включает гидроксид щелочного металла, гидрид щелочного металла, карбонат щелочного металла, алкоксид щелочного металла, карбонат щелочно-земельного металла или органическое основание, такое как третичный амин, например триэтиламин. Реакцию, как правило, проводят в инертном растворителе, таком как тетрагидрофуран, диоксан,ацетонитрил или N,N-диметилформамид, при температуре от 0C до температуры дефлегмации растворителя, предпочтительно от 20 до 100C. Промежуточные соединения формулы (III) можно получить, если соединение формулы (X) подвергнуть взаимодействию с соединением формулы (V). Реакцию, как правило, осуществляют, используя соль присоединения с кислотой, например гидрохлорид соединения формулы (X), в таком растворителе, как 1,2-дихлорбензол, декалин или белое минеральное масло, при температуре от 20C до температуры дефлегмации растворителя, предпочтительно от 50 до 200C. Промежуточные соединения формулы (V) можно получить известными способами, например восстановительным аминированием по выбору асимметричным восстановительным аминированием кетонов формулы (XI) или соответствующих оксимов где R6, R7, R8, R9, R10 и А имеют такие значения, которые приведены в формуле (I), или, если соединение формулы (XII) где R6, R7, R8, R9, R10 и А имеют такие же значения, которые приведены в формуле (I), и L4 означает отщепляемую группу, такую как галоид, гидрокси-, метилсульфонилокси- или 4-толуолсульфонилоксигруппа, подвергнуть взаимодействию с аммиаком или его солью, согласно известным способам, например, как описано в патентной публикации WO 97/031904. Для получения соединений формулы (I), в которых присутствуют один или более асимметричных атомов углерода в виде отдельной энантиомерной формы, приведенные выше способы могут быть адаптированы с использованием подходящих энантиомерных или диастереомерных форм соединений формулы (II), (III), (IV), (V), (VI), (VII) или (XII). Соединения формулы (II) в энантиомерно чистой форме известны или могут быть получены в соответствии с известными способами, например, как описано в Tetrahedron Asymmetry 1994, 5, 981, J. Chem.Soc. Perkin Trans I, 1979, 2248 и в цитированной там литературе. Получение соединений формулы (I) в разделенном или частично разделенном виде можно, например, осуществить, следуя вышеуказанным способам с использованием одного или нескольких промежуточных веществ (II), (III), (IV) или (V), конфигурация которых отличается от конфигурации, указанной- 12012406 для соединения формулы (I), которое надо получить, и разделив полученную смесь известными способами разделения. Вообще возможно использование обычных способов разделения оптических изомеров (см. Textbooks of Stereochemistry), например, следуя способам разделения смесей на диастереомеры, например, с помощью физических способов, таких как кристаллизация, хроматографических способов, в частности на хроматографических колонках или с помощью жидкостной хроматографии высокого давления, перегонки по возможности при пониженном давлением, экстракции и других способов оказывается возможным разделить остающуюся смесь энантиомеров, главным образом с помощью хроматографического разделения на хиральные твердые фазы. Пригодными для получения препаративных количеств или для промышленных масштабов являются такие способы, как кристаллизация диастереомерных солей, которые могут быть получены из соединений (I), используя оптически активные кислоты, и, если подходит,при условии, что кислотные группы присутствуют, используя оптически активные основания. Оптически активными кислотами, которые пригодны для оптического разделения при кристаллизации диастереомерных солей, например, являются камфорсульфоновая кислота, камфорная кислота,бромкамфорсульфоновая кислота, хинная кислота, винная кислота, дибензоилвинная кислота и другие аналогичные кислоты; подходящими оптически активными основаниями являются, например, хинин,цинхонин, хинидин, бруцин, 1-фенилэтиламин или другие аналогичные основания. Кристаллизацию в большинстве случае осуществляют в водных или в водно-органических растворителях, в которых слабее растворимый диастереомер выпадает первым, при необходимости после внесения затравочных кристаллов. После этого один энантиомер соединения формулы (I) выделяют из осажденной соли или другой энантиомер выделяют из кристаллов подкислением или с использованием основания. Энантиомерно чистые амины формулы (V), являющиеся промежуточными соединениями, можно получить известными способами, например, как описано в Houben-Weyl, Methoden der Organischen Chemie, 4 изд., т. E 21b, 1833 ff. или т. E 21 е, 5133. Один из предпочтительных способов состоит в восстановительном аминировании кетонов формулы (XI) асимметричным катализатором, включая энзиматическое трансаминирование. Другим способом получения энантиомерно чистых аминов формулы (V) является способ расщепления рацематов, описанный в J. Prakt. Chem. 339, (1997), стр. 381 - 384, или способ,описанный в Org. Lett., т. 3,25, стр. 4101. В этом способе рацемические амины общей формулы (V) ацилируют энантиоселективно с таким ацилирующим агентом, как при необходимости замещенный эфир жирной кислоты (предпочтительно метилхлорацетат, или этилхлорацетат, или метилметоксиацетат,или этилметоксиацетат) в присутствии биокатализатора. Не ацилированный энантиомер затем отделяют простой обработкой минеральной кислотой. Ацилированный энантиомер амина затем расщепляют обратно в соответствующий амин, используя основание, например гидроксид щелочного металла, такой как гидроксид натрия, или кислоту, например, такую минеральную кислоту, как хлористо-водородная кислота. В качестве биокатализаторов, липазы, например, Pseudomonas cepacia, Candida cylindracea или Candida Antarctica особенно пригодны для этих целей. Некоторые из этих липаз имеются в продаже в иммобилизованной форме (фирменное название: "Новозим 435"). По аналогии с этим методом энзиматического ацилирования могут быть получены соединения формулы (XIII) или (XIV) в качестве промежуточных соединений при ацилировании рацемических аминов, соответствующих соединениям формулы (V) в принципе где R6, R7, R8, R9, R10 и А имеют такие значения, как указано в формуле (I), и R11 означает ацил, предпочтительно (C1-C6)алканоил, который не замещен или замещен одним или несколькими радикалами, выбираемыми из группы, которая включает галоид, (C1-C4)алкокси- и (C1-C4)алкилтиогруппу; более предпочтительно означает формил, ацетил, пропионил, галоидацетил, галоидпропионил, (C1-C4)алкоксиацетил или (C1-C4)алкоксипропионил; наиболее предпрочтительно означает хлорацетил или метоксиацетил; желательный оптический изомер (V) затем получают, расщепляя соединение (XIII) с использованием минеральной кислоты, или, в случае, если ацилированное соединение (XIV) образовано энзиматически, используя неацилированный амин (V) непосредственно. Следующие кислоты, например, пригодны для получения солей присоединения с кислотами соединений формулы (I):- 13012406 галоидо-водородные кислоты, такие как хлористо-водородная кислота или бромисто-водородная кислота, а также фосфорная кислота, азотная кислота, серная кислота, моно- или бифункциональные карбоновые кислоты и гидроксикарбоновые кислоты, такие как уксусная кислота, щавелевая кислота, малеиновая кислота, сукциновая кислота, фумаровая кислота, винная кислота, лимонная кислота, салициловая кислота, сорбиновая кислота или молочная кислота, и также сульфоновые кислоты, такие как птолуолсульфоновая кислота и 1,5-нафталиндисульфоновая кислота. Соли присоединения с кислотой соединений формулы (I) могут быть получены обычными способами образования солей, например растворением соединения формулы (I) в подходящем органическом растворителе, таком как, например, метанол, ацетон, метиленхлорид или бензол, и добавлением кислоты при температуре от 0 до 100C, и они могут быть выделены известным путем, например фильтрованием и, если необходимо, очищены промыванием инертным органическим растворителем. Соли присоединения с основаниями соединений формулы (I) предпочтительно получают в инертных полярных растворителях, таких как, например, вода, метанол или ацетон при температуре от 0 до 100C. Примерами подходящих оснований для приготовления солей согласно данному изобретению являются карбонаты щелочных металлов, такие как карбонат калия, гидроксиды щелочных и щелочноземельных металлов, например NaOH или KOH, гидриды щелочных и щелочно-земельных металлов,например NaH, алкоксиды щелочных и щелочно-земельных металлов, например метоксид натрия, третбутоксид калия, или аммиак или этаноламин. Четвертичные аммониевые соли можно получить, например, обменом солью или конденсацией с четвертичной аммониевой солью формулы [NRR'RR]+Х-, гдеR, R', R и R независимо один от другого означают (C1-C4)алкил, фенил или бензил и X- означает анион,например, Cl- или OH-. Некоторые из соединений формулы (III) и (V), в которых присутствует один или более асимметричных атомов углерода в отдельной или оптически обогащенной энантиомерной форме являются новыми и как таковые представляют собой другой аспект данного изобретения и могут быть получены, как описано выше. Известны следующие амины формулы (V): а) инданы:(1R)-1-амино-7-трет-бутил-1,2,3,4-тетрагидронафталин (WO-98/47877); хлористо-водородная соль двух последних соединений (WO-98/47877);(4R)-4-аминохроманы (Beilstein Registry No. 7687402 и/или 7687403). Поэтому другой аспект данного изобретения относится к соединениям формулы (III) или (V) или к их солям, гдеR7, R8, R9 и R10, каждый независимо, означают H, (C1-C4)алкил, (C1-C3)галоидалкил, галоид, (C1C3)алкокси-, (C1-C3)галоидалкоксигруппу или CN; А означает CH2, О или простую химическую связь; и в которых стереохимическая конфигурация в помеченном 1 положении такая, как указано в формуле (I),за исключением соединений формулы (V), или их солей, где(i) A означает простую химическую связь, R6, R7, R8 и R9 каждый означают водород, a R10 означает водород, метокси-, н-пропокси- или цианогруппу; или А означает простую химическую связь, R6, R7, R9 и R10 каждый означают водород, a R8 означает фтор; или А означает простую химическую связь, R7, R8, R9 и R10 каждый означают водород, a R6 означает метил; или(iii) A означает атом кислорода и R6, R7, R8, R9 и R10 каждый означают H. К предпочтительному классу новых промежуточных соединений формулы (III) и (V) или их солей относятся такие, гдеR9 означает H, метил, Cl, F или Br; и А означает простую химическую связь, CH2 или О; и стереохимическая конфигурация в помеченном 1 положении такая же, как указано в формуле (I),за исключением соединений формулы (V) или их солей, где(i) A означает простую химическую связь, R6, R7, R8 и R9 каждый означают водород, a R10 означает водород; или А означает простую химическую связь, R6, R7, R9 и R10 каждый означают водород, a R8 означает фтор; или А означает простую химическую связь, R7, R8, R9 и R10 каждый означают водород, a R6 означает метил; или(iii) A означает атом кислорода и R6, R7, R8, R9 и R10 каждый означают H. К более предпочтительному классу новых промежуточных соединений формулы (III) и (V) или их солей относятся такие соединения, где А означает простую химическую связь, R6 означает H или метил;R7 и R10 означают водород, R8 означает H, метил, Cl или F; R9 означает метил, Cl, F или Br; и стереохимическая конфигурация в помеченном 1 положении такая же, как указано в формуле (I). К другому более предпочтительному классу относятся новые промежуточные соединения формулыR9 означает H, метил, Cl, F или Br; и А означает простую химическую связь, CH2 или О. Некоторые из соединений формулы (XIII) (амиды), которые могут быть использованы в качестве промежуточных соединений для получения оптически активных аминов формулы (V) или бигуанидинов формулы (III), где присутствует один или более асимметричных атомов углерода в виде отдельной или оптически обогащенной энантиомерной формы, являются новыми и как таковые представляют собой другой аспект данного изобретения и могут быть получены, как описано выше. Следующие ацилированные амины формулы (XIII) уже известны: а) инданы:(4R)-4-ацетиламинохроман (Org. Lett. 4 (2002) 1695-1668). Другим аспектом данного изобретения являются новые соединения формулы (XIII) или их соли, гдеR11 означает (C1-C6)алканоил, который может быть замещен одним или несколькими радикалами,выбираемыми из группы, включающей галоид, (C1-C4)алкокси- и (C1-C4)алкилтиогруппу; А означает СН 2, О или простую химическую связь; и где стереохимическая конфигурация в помеченном 1 положении такая же, как указано в формуле(I), за исключением соединений или их солей, где(i) A означает простую химическую связь, a R6, R7, R8, R9 и R10 означают каждый водород и R11 означает формил, ацетил, трифторацетил или бромацетил, или А означает простую химическую связь, R6 означает метил; R7, R8, R9 и R10 означают каждый водород и R11 означает ацетил, или А означает простую химическую связь; R6, R7, R9 и R10 означают каждый водород, R8 означает фтор 11 и R означает ацетил, или(ii) A означает CH2, a R6, R7, R8, R9 и R10 означают каждый водород и R11 означает ацетил, трифторацетил или хлорацетил; или А означает CH2, a R6, R7 и R9 означают каждый водород и R8 означает метил, и R10 означает метил; и 11(iii) A означает атом кислорода, a R6, R7, R8, R9 и R10 означают каждый H, и R11 означает ацетил. Соединения формулы (II), (IV), (VI), (VII), (VIII), (IX), (X), (XI) и (XII), а также рацемические соединения (III) и (V) известны или могут быть получены аналогично известным способам. Коллекция соединений формулы (I), которая может быть синтезирована упомянутыми выше способами, может быть дополнительно получена параллельным путем, который может быть осуществлен вручную, частично автоматически или полностью автоматически. В этом контексте это означает автоматизацию способа проведения реакции, обработки или очистки продуктов или промежуточных продуктов. В общем под этим следует понимать, что имеют ввиду способ, который описан, например, S.H. DeWitt вEscom, 1997, стр. 69-77. Для выполнения реакции и переработки параллельным способом можно использовать ряд имеющихся в продаже аппаратов, которые можно приобрести, например, у Stem Corporation, Woodrolfe Road,Tollesbury, Essex, CM9 8SE, England или у H+P Labor-technik GmbH, Bruckmannring 28, 85764 Oberschleissheim, Germany. Для проведения параллельной очистки соединений (I) или промежуточных соединений, полученных в препаративной работе, можно приобрести, среди прочего, хроматографическое оборудование, например, у фирмы ISCO, Inc., 4700 Superior Street, Lincoln, NE 68504, USA. Упомянутое оборудование создает возможность для модульного осуществления способа, при котором отдельные стадии автоматизированы, однако, между стадиями осуществляют ручные операции. Этого можно избежать, если использовать частично или полностью интегрированные автоматические системы, в которых указанные автоматические модули управляются, например, роботами. Такие автоматические системы можно приобрести, например, у фирмы Zymark Corporation, Zymark Center, Hopkinton, MA 01748, USA. В дополнение к описанным выше способам соединения формулы (I) могут быть получены частично или полностью твердофазным способом. Для этой цели отдельные промежуточные стадии или все промежуточные стадии синтеза или синтез, приспособленный для осуществления рассматриваемого способа, связывают с синтетической смолой. Способы твердофазного синтеза подробно описываются в специальной литературе, например Barry A. Bunin в "The Combinatorial Index", Academic Press, 1998. Использование способов твердофазного синтеза допускает серию протоколов, которые известны из литературы и которые, в свою очередь, можно проводить вручную или автоматически. Например, "способ чайного пакетика" (Houghten, US 4,631,211, Houghten et al., Proc. Natl. Acad. Sci, 1985, 82, 5131-5135),в котором используется продукция IRORI, 1114 9 North Torrey Pines Road, La Jolla, CA 92037, USA, может быть полуавтоматизирован. Автоматизация параллельного твердофазного синтеза успешно осуществлена, например, в аппаратах Argonaut Technologies, Inc., 887 Industrial Road, San Carlos, CA 94070, USA или MultiSynTech GmbH, Wullener Feld 4, 58454 Witten, Germany. При осуществлении способов, описанных здесь, получают соединения формулы (I) в виде коллекций веществ, которые называют библиотеками. Данное изобретение также относится к библиотекам,- 16012406 которые включают, как минимум, два соединения формулы (I) и их предшественников. Следующие, не ограничивающие примеры иллюстрируют получение соединений формулы (I). А. Химические примеры. В приведенных ниже примерах количества (также проценты) приведены по отношению к весу, если по другому не оговорено. Соотношения растворителей взяты по объему. Оптическое вращение измеряют как удельное вращение [] поляризованного света с длиной волны 589 нм (поляризованное Na-D излучение) при стандартных условиях (с = 1 г/мл, t = 25 С). Растворителем является хлороформ, если по другому не оговорено. Пример A1. 2-Амино-4-[(1R)-1-инданиламино]-6-метил-1,3,5-триазин (табл. 8, соединение номер 8.1). Смесь 2-амино-4-хлор-6-метил-1,3,5-триазина (2,2 г, 0,015 моль), R(-)-1-аминоиндан (2,0 г, 0,015 моль) и карбоната калия (4,6 г, 2,2 моль) в N,N-диметилформамиде перемешивают в течение 5 ч при температуре 90-100C. После завершения реакции растворитель отгоняют в вакууме при температуре ниже 100C, полученную смесь охлаждают и добавляют воду. Добавляют этилацетата и отделяют органическую фазу, сушат (сульфатом натрия) и отгоняют растворитель. Остаток чистят на хроматографической колонке, элюируют этилацетатом и получают 2-амино-4-[(1R)-1-инданиламино]-6-метил-1,3,5 триазин (3,5 г, 95% выход, соединение номер 8.1), Тпл 94-96 С, химическая чистота выше 95%, ее 91% с помощью ЖХВД (жидкостная хроматография высокого давления), оптическое вращение (CHCl3, с=1):+87,4). Пример А 2. 2-Амино-4-[(4R)-4-хроманиламино]-6-[(1R)-1-фторэтил]-1,3,5-триазин (табл. 1, соединение номер 1.20). а. Хроман-4-он-оксим. Смесь ацетата натрия (41,53 г, 0,506 моль) в воде при температуре 60C комбинируют с перемешиваемой смесью хроман-4-она (25 г, 0,169 моль) и гидрохлорида гидроксиламина (20,0 г, 0,287 моль) в этаноле при температуре 60C. Полученную смесь нагревают при температуре дефлегмации в течение 90 мин, охлаждают и фильтруют. Неочищенный твердый продукт промывают водой и получают хроман-4 он-оксим (27,9 г, выход 96%), Тпл 114-117 С, чистота 95%. б. Гидрохлорид 4-аминохромана. Хроман-4-он-оксим (27,9 г, 0,157 моль) в этаноле добавляют к катализатору никель-Ренея (3,0 г) в этаноле в атмосфере азота. Смесь перемешивают и вводят водород пока не адсорбируется теоретически необходимое количество (приблизительно 3,6 л). Катализатор отфильтровывают, растворитель отгоняют и добавляют 6 н. этанольный раствор хлористо-водородной кислоты (25 мл). Растворитель выпаривают и остаток промывают смесью диэтиловый эфир/ацетон (10:1) и снова фильтруют, получая гидрохлорид 4 аминохромана (18,3 г, выход 58%), Тпл 220-226C, чистота 95%. в. N-[(4R)-4-хроманил]-2-метоксиацетамид. Смесь гидрохлорида 4-аминохромана (27,8 г, 0,15 моль) и водного гидроксида натрия (2H) экстрагируют этилацетатом и органическую фазу сушат (над сульфатом натрия) и выпаривают растворитель,получая рацемический 4-аминохроман (14,2 г, 0,095 моль). К нему добавляют метил-2-метоксиацетат(10,94 г, 0,105 моль) и 2,5 г Новозим (Novozym) 435 (фирмы Aldrich Corp.) в трет-бутилметиловом эфире и смесь нагревают при температуре дефлегмации в течение 2 ч. Добавляют еще Новозим 435 (0,5 г) и продолжают нагревание пока реакция не закончится, что подтверждает ЖХВД. Добавляют дихлорметан,фильтруют биокатализатор и органическую фазу сушат (над сульфатом натрия) и отгоняют растворитель. Остаток растворяют в минимуме дихлорметана, добавляют этанольный раствор хлористоводородной кислоты (8H) и получают гидрохлорид (4S)-4-аминохромана, который фильтруют и фильтрат выпаривают, получая N-[(4R)-4-хроманил]-2-метоксиацетамид (8,2 г), Тпл (температура плавления) 109-112C. г. Гидрохлорид (4R)-4-аминохромана. Раствор приведенного выше N-[(4R)-4-хроманил]-2-метоксиацетамида (2,2 г, 0,0325 моль) в этаноле(100 мл) и концентрированную хлористо-водородную кислоту (30 мл) нагревают при температуре дефлегмации растворителя в течение 12 ч, затем растворитель выпаривают. Добавляют небольшое количество этилацетата к остатку и отфильтровывают твердое вещество, получая гидрохлорид (4R)-4 аминохромана (2,3 г), Тпл 261-263 С, химическая чистота выше 95%. д. Гидрохлорид (4S)-4-(бисгуанидино)хромана. Гомогенную смесь (4R)-3,4-дигидро-2 Н-4-хроманиламмоний хлорида (2,3 г, 0,0124 моль) и 1 цианогуанидина (1,04 г, 0,0124 моль) в 1,3-дихлорбензоле нагревают при температуре около 140-150C в течение 150 мин. Охлажденную смесь разбавляют толуолом и фильтруют, получая гидрохлорид (4S)-4(бисгуанидино)хромана (3,3 г, выход 89,4%) в виде твердого вещества, чистота 90%. е. 2-Амино-4-[(4R)-4-хроманиламино]-6-[(1R)-1-трифторэтил]-1,3,5-триазин. 30%-ный раствор метоксида натрия в метаноле (0,7 г, 0,75 мл, 0,004 моль) добавляют к перемешиваемой суспензии гидрохлорида (4S)-4-(бисгуанидино)хромана (1,1 г, 0,004 моль) в метаноле. Затем добавляют метил-(2R)-2-фторпропаноат (1,08 г, 0,01 моль) при комнатной температуре, за которым следует дополнительное количество 30%-го раствора метоксида натрия (1,0 г, 1,0 мл, 0,006 моль). Перемешивают- 17012406 4 ч при комнатной температуре, после этого смесь фильтруют, испаряют растворитель из фильтрата и остаток растворяют в этилацетате. Органическую фазу промывают (водой) сушат (над сульфатом натрия) и выпаривают растворитель. Остаток чистят на хроматографической колонке, элюируя смесью этилацетат/гептан 7:3 и получают 2-амино-4-[(4R)-4-хроманиламино]-6-[(1R)-1-фторэтил]-1,3,5-триазин (0,3 г,выход 25%, соединение номер 1.20), Тпл 110-112C, оптическое вращение (дихлорметан, с=1): +75,4,чистота 98,35% (ЖХВД, Chiralcel OD, 2504,6 мм, элюент н-гексан/2-пропанол 90:10, 0,6 мл/мин, время удерживания 21,4 мин). Пример A3. 2-Амино-4-[(1R,2S)-2-метил-1-инданиламино]-6-[(1R)-1-фторэтил]-1,3,5-триазин (табл. 2, соединение номер 2.1). а. 2-Метилиндан-1-он-оксим. Смесь 2-метил-1-инданона (10 г, 0,0684 моль) и гидрохлорида гидроксиламина (9,5 г, 0,1368 моль) в этаноле перемешивают при температуре 60C и добавляют раствор ацетата натрия (16,8 г, 0,2052 моль) в воде. Полученную смесь нагревают при температуре дефлегмации в течение 90 мин, после этого охлаждают и отфильтровывают твердое вещество. Сырой продукт промывают водой и фильтруют, получая 2 метилиндан-1-он-оксим (9,9 г, выход 81%), Тпл 82-91 С, с 90% чистоты. б. Гидрохлорид 1-(RS)-1-амино-2-метилиндана. Смесь вышеуказанного 2-метилиндан-1-он-оксима (9,5 г, 0,0589 моль) и палладиевого катализатора на активированном угле (10%, 1,0 г) в метаноле и уксусную кислоту перемешивают в атмосфере азота. Затем подают водород, пока не поглотится (адсорбируется необходимое количество). Катализатор отфильтровывают и растворитель отгоняют в вакууме. Добавляют этанольный раствор хлористоводородной кислоты (6H), растворитель отгоняют и остаток промывают смесью диэтиловый эфир/ацетон(10:1) и фильтруют, получая гидрохлорид 1-(RS)-1-амино-2-метил (9,7 г, выход 85%), Тпл 241-242C,чистота 95%. в. Транс-1-амино-2-метилиндан. Гидрохлорид 1-(RS)-1-амино-2-метилиндан (19,7 г, 0,1073 моль) смешивают с водным гидроксидом натрия (2H) и экстрагируют этилацетатом. Органическую фазу сушат (над сульфатом натрия), отгоняют растворитель и остаток чистят на хроматографической колонке, элюируя этилацетатом/триэтиламином (100:1), и получают следующие соединения:(1S,2R)-1-амино-2 метилиндана. Новозим (Novozym) 435 (фирмы Aldrich Corp., 1,0 г) добавляют к смеси транс-1-амино-2 метилиндана (6,6 г, 0,0448 моль) и метил-2-метоксиацетата (5,04 г, 0,0484 моль) в трет-бутилметиловом эфире. Смесь нагревают при температуре дефлегмации в течение 2 ч, затем добавляют дополнительное количество Новозим 435 (0,5 г) и нагревание продолжают еще в течение двух часов. Добавляют дихлорметан к охлажденной смеси и отфильтровывают биокатализатор. Органическую фазу сушат (над сульфатом натрия), выпаривают и остаток растворяют в минимуме дихлорметана. Добавляют этанольный раствор хлористо-водородной кислоты (8H) и отфильтровывают твердое вещество, получая гидрохлорид(1S, 2R)-1-амино-2-метилиндана, и из фильтрата после выпаривания получают N-[(1R,2S)-2-метил-1 инданил]-2-метоксиацетамида (5,9 г), Тпл 78-79 С. д. Гидрохлорид (1R,2S)-1-амино-2-метилиндана. Концентрированную хлористо-водородную кислоту (8 мл) добавляют к раствору N-[(1R,2S)-2 метил-1-инданил]-2-метоксиацетамида (5,9 г, 0,0269 моль) в этаноле и воде и смесь нагревают в течение 12 ч при температуре дефлегмации. Растворитель отгоняют и добавляют небольшое количество этилацетата. Нерастворенное твердое вещество отфильтровывают, получая гидрохлорид (1R,2S)-1-амино-2 метилиндана (1,0 г) в виде твердого вещества, химическая чистота выше 95%. е. Моногидрохлорид (1R,2S)-1-(бисгуанидино)-2-метилиндана. Гомогенную смесь гидрохлорида (1R,2S)-1-амино-2-метилиндана (1,0 г, 0,0054 моль) и 1 цианогуанидина (0,46 г, 0,0054 моль) в 1,3-дихлорбензоле нагревают в течение 150 мин при 140-150C. Охлажденную смесь разбавляют толуолом и отфильтровывают твердое вещество, получая моногидрохлорид (1R,2S)-1-(бисгуанидино)-2-метилиндан (1,1 г, выход 61,1%) в виде твердого вещества, Тпл 172178 С, чистота 90%. ж. 2-Амино-4-[(1R,2S)-2-метил-1-инданиламино]-6-[(1R)-1-фторэтил]-1,3,5-триазин. 30%-ный раствор метоксида натрия (0,39 г, 0,4 мл, 0,0022 моль) в метаноле добавляют к перемешиваемой суспензии моногидрохлорида (1R,2S)-1-(бисгуанидино)-2-метилиндана (0,550 г, 0,0021 моль) в метаноле. Затем добавляют метил-(2R)-2-фторпропаноат (0,55 г, 0,0051 моль) при комнатной температуре, добавляют дополнительное количество 30%-го раствора метоксида натрия (0,59 г, 0,6 мл, 0,0033- 18012406 моль). Через 4 ч при комнатной температуре смесь фильтруют и выпаривают растворитель из фильтрата. Остаток растворяют в этилацетате, промывают (водой), сушат (над сульфатом натрия) и отгоняют растворитель. Полученный остаток чистят на хроматографической колонке, элюируя смесью этилацетат/гептан (7:3) в качестве элюента, и получают 2-амино-4-[(1R,2S)-2-метил-1-инданиламино]-6-[(1R)-1 фторэтил]-1,3,5-триазин (0,09 г, выход 15%, соединение номер 2.1), Тпл 146-150C, оптическое вращение(хлороформ, с=1): +104,4, чистота 95,25% (ЖХВД, Chiralcel OD, 2504,6 мм, элюент н-гексан/2 пропанол 90:10, 0,6 мл/мин, время удерживания 17,93 мин). Следующие предпочтительные соединения формулы (I), приведенные в табл. 1-14, которые также представляют собой часть данного изобретения, получены способами, приведенными выше в примерахA1, A2 и A3, или аналогично им, или с помощью описанных выше общих способов. В таблицах структура соединения представлена формулой предоминирующего стереохимического изомера, если по-другому особо не оговорено (то есть рацемическая смесь хиральных соединений). Следующие сокращения использованы в табл. 1-14: "Me" означает метил, "Et" означает этил и "Pr" означает н-пропил."Соединение" означает номер соединения. Номера соединений приведены только для ссылки. После некоторых таблиц приведены дополнительные физические данные для некоторых соединений соответствующей таблицы. Оптическое вращение измеряют, как указано для примеров A1-A3, приведенных выше. 1 Н-ЯМР-спектры записаны в дейтерохлороформе, если по-другому не оговорено, а химические сдвиги приведены в млн долях. Использованы следующие обозначения: s = синглет, d = дублет, t = триплет, m = мультиплет, простая связь = простая химическая связь. Таблица 1 Соединение формулы (Id-1) Примечания к физическим данным в табл. 1 (ссылка сделана на соединениев табл. 1): соединение 1.1: Тпл (= температура плавления) 176-178C, оптическое вращение +116,7; соединение 1.2: оптическое вращение +113,5; соединение 1.3: оптическое вращение +112,7; соединение 1.11: Тпл 151-154C, оптическое вращение +111,1; соединение 1.12: Тпл 68-72 С, оптическое вращение +76,8; соединение 1.15: Тпл 163-165 С, оптическое вращение +70,1; ссоединение 1.20: Тпл 110-112 С, оптическое вращение +75,4; соединение 1.21: Тпл 127-130 С, оптическое вращение +52,3; соединение 1.24: Тпл 153-155 С, оптическое вращение +82,5; соединение 1.28: Тпл 140-144 С, оптическое вращение +79,9; соединение 1.31: Тпл 99-100 С, оптическое вращение +69,2; соединение 1.66: оптическое вращение +112,7; соединение 1.67: Тпл 88-95 С, оптическое вращение +66,5; соединение 1.68: Тпл 145-146 С, оптическое вращение +79,3; соединение 1.69: Тпл 149-150C, оптическое вращение +84,0 Таблица 2 Соединения формулы (If-1) Примечание к физическим данным в табл. 2 (ссылки сделаны на соединениев табл. 2): соединение 2.1: Тпл 146-150C, оптическое вращение +104; соединение 2.11: оптическое вращение +168,9; соединение 2.25: Тпл 68-70 С, оптическое вращение +140,9; соединение 2.28: Тпл 127-128 С, оптическое вращение +49,6. Примечание к физическим данным в табл. 3 (ссылки сделаны на соединениев табл. 3): соединение 3.1: Тпл 149-150C, оптическое вращение +74,4; соединение 3.2: оптическое вращение +113,5; соединение 3.11: Тпл 147-149 С, оптическое вращение +84,4; соединение 3.15: Тпл 167-171 С, оптическое вращение +36,5; соединение 3.20: Тпл 183-185 С, оптическое вращение +54,5; соединение 3.24: Тпл 151-152 С, оптическое вращение +71,8. Примечание к физическим данным в табл. 4 (ссылки сделаны на соединениев табл. 4): соединение 4.1: Тпл 146-150C, оптическое вращение +77,9.
МПК / Метки
МПК: C07D 251/18, C07D 311/68, C07D 405/12, A01N 43/68
Метки: качестве, получения, соединения, амино-6-(алкилзамещенного)-1,3,5-триазина, композиция, применение, регулирующая, изомеров, регуляторов, сорными, гербицидная, борьбы, способ, роста, оптически, производные, рост, растениями, промежуточные, активных, 2-амино-4-(бициклил, способы, гербицидов, растений
Код ссылки
<a href="https://eas.patents.su/30-12406-proizvodnye-opticheski-aktivnyh-izomerov-2-amino-4-biciklil-amino-6-alkilzameshhennogo-135-triazina-sposoby-ih-polucheniya-ih-primenenie-v-kachestve-gerbicidov-i-regulyatorov-rosta.html" rel="bookmark" title="База патентов Евразийского Союза">Производные оптически активных изомеров 2-амино-4-(бициклил) амино-6-(алкилзамещенного)-1,3,5-триазина, способы их получения, их применение в качестве гербицидов и регуляторов роста растений, гербицидная или регулирующая рост растений композиция, способ борьбы с сорными растениями и промежуточные соединения</a>