Медицинский продукт, покрытый биологически стабильным полисульфоновым слоем, и способ нанесения покрытия
Номер патента: 11822
Опубликовано: 30.06.2009
Авторы: Хоррес Роланд, Ди Биазе Донато, Хоффманн Эрика, Хоффманн Михель, Фауст Фолькер
Формула / Реферат
1. Имплантируемый медицинский продукт, отличающийся тем, что его поверхность, по меньшей мере, частично покрыта по меньшей мере одним биологически стабильным полисульфоновым слоем, и в, под и/или на полисульфоновом слое содержится по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент.
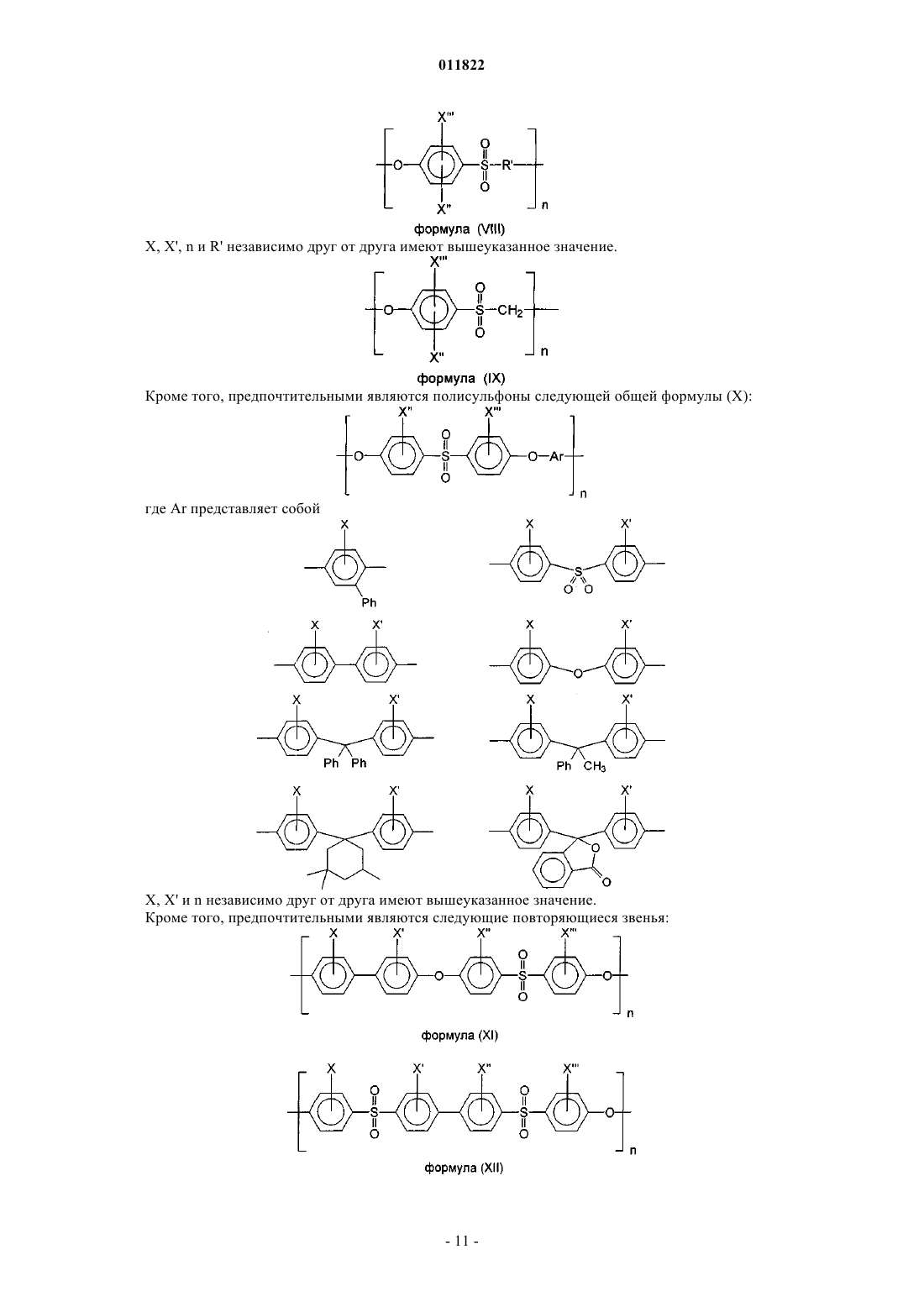
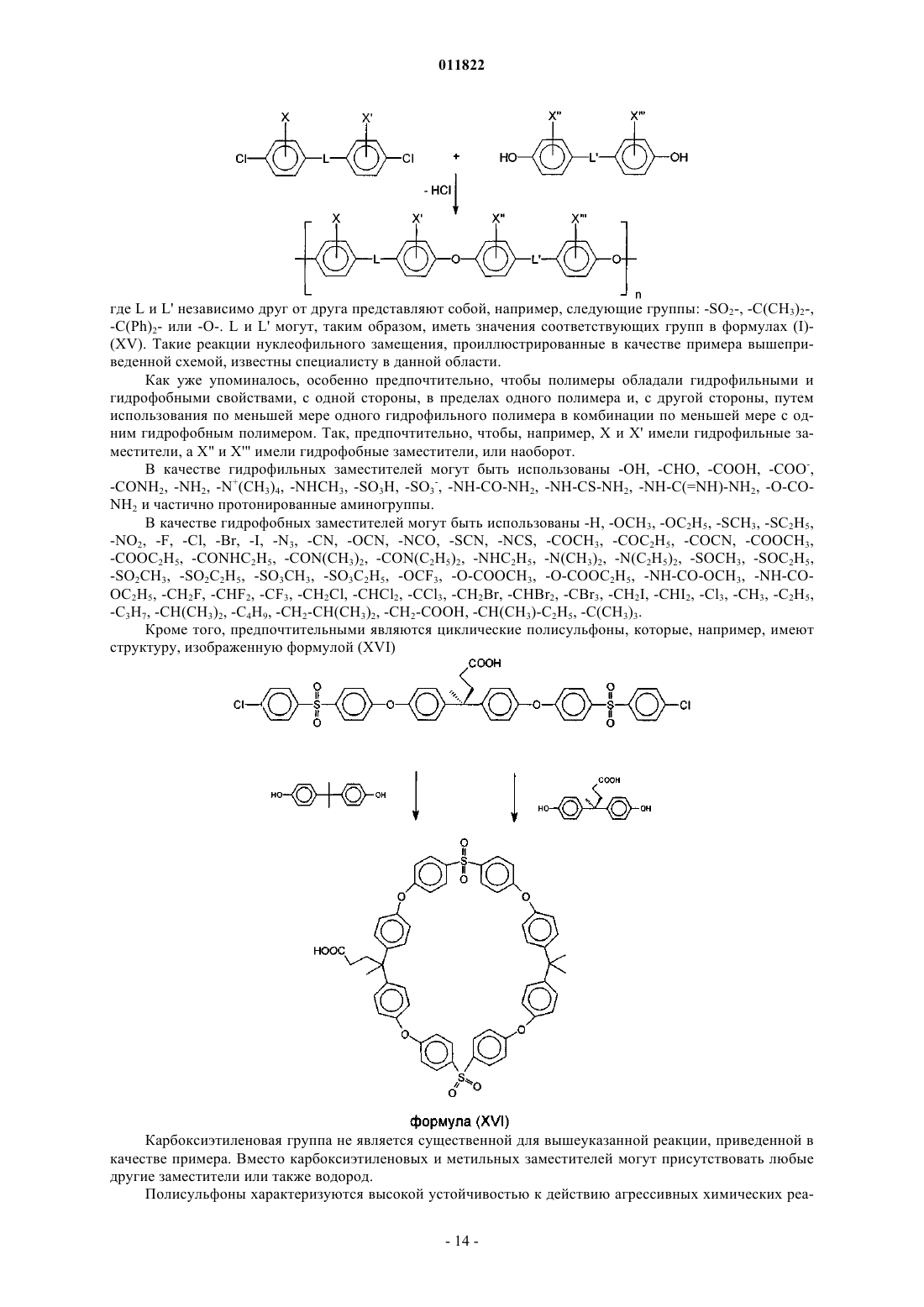
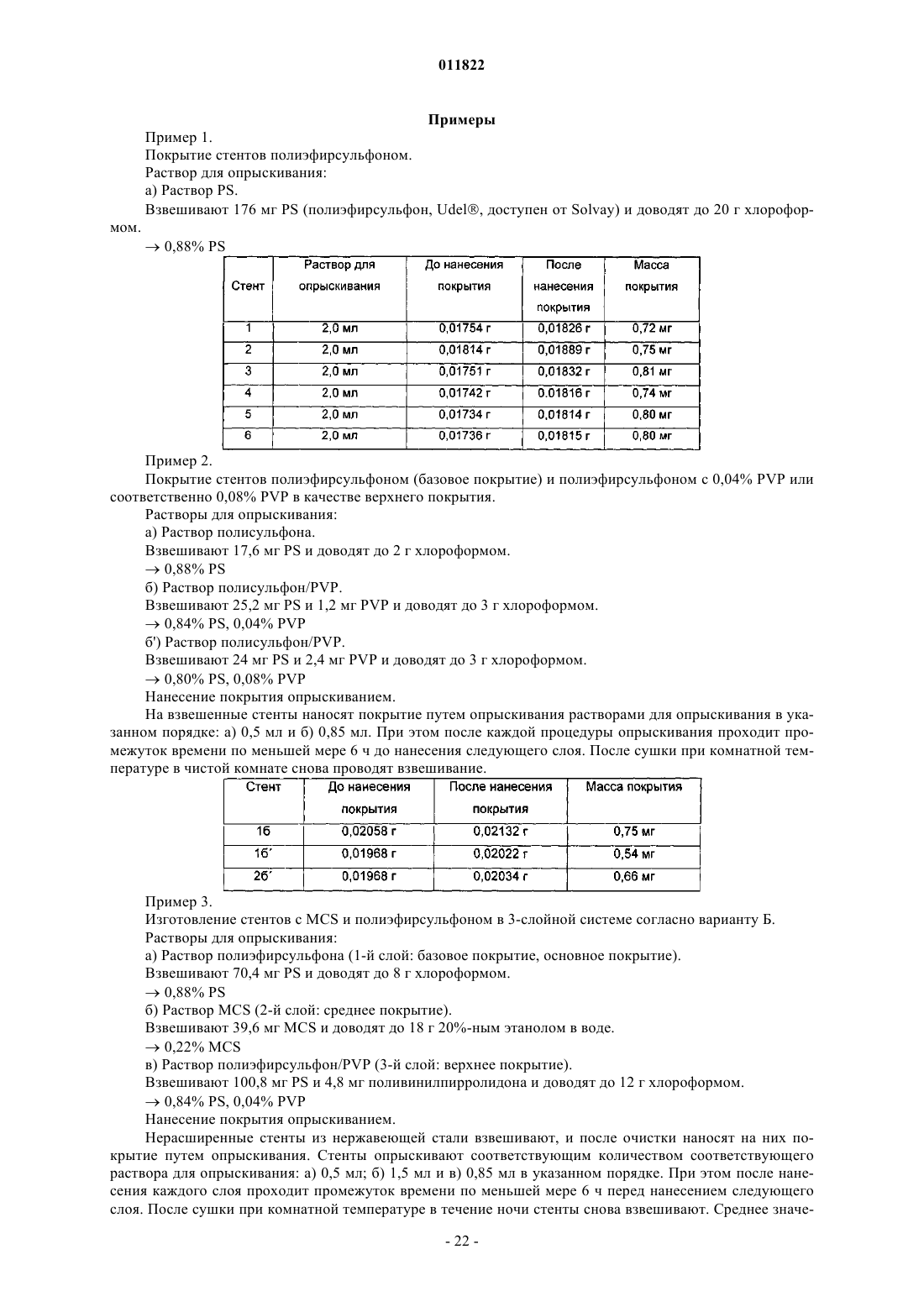
2. Имплантируемый медицинский продукт по п.1, отличающийся тем, что полисульфон выбран из группы, включающей полиэфирсульфон, замещенный полиэфирсульфон, полифенилсульфон, замещенный полифенилсульфон, полисульфоновые блок-сополимеры, перфторированные полисульфоновые блок-сополимеры, полуфторированные полисульфоновые блок-сополимеры, замещенные полисульфоновые блок-сополимеры и/или смеси вышеуказанных полимеров, где заместители выбраны из -OH,
-OCH3, -OC2H5, -SH, -SCH3, -SC2H5, -NO2, -F, -Cl, -Br, -I, -N3, -CN, -OCN, -NCO, -SCN, -NCS, -CHO,
-COCH3, -COC2H5, -COOH, -COCN, -COOCH3, -COOC2H5, -CONH2, -CONHCH3, -CONHC2H5,
-CON(CH3)2, -CON(C2H5)2, -NH2, -NHCH3, -NHC2H5, -N(CH3)2, -N(C2H5)2, -SOCH3, -SOC2H5, -SO2CH3,
-SO2C2H5, -SO3H, -SO3CH3, -SO3C2H5, -OCF3, -O-COOCH3, -O-COOC2H5, -NH-CO-NH2, -NH-CS-NH2, -NH-C(=NH)-NH2, -O-CO-NH2, -NH-CO-OCH3, -NH-CO-OC2H5, -CH2F, -CHF2, -CF3, -CH2Cl, -CHCl2, -CCl3,
-CH2Br, -CHBr2, -CBr3, -CH2I, -CHI2, -Cl3, -CH3, -C2H5, -C3H7, -CH(CH3)2, -C4H9, -CH2-CH(CH3)2, -CH2-COOH, -CH(CH3)-C2H5, -C(CH3)3, -H.
3. Имплантируемый медицинский продукт по п.1 или 2, отличающийся тем, что по меньшей мере один биологически стабильный полисульфоновый слой содержит по меньшей мере один гидрофильный полимер.
4. Имплантируемый медицинский продукт по п.3, отличающийся тем, что в полисульфоновом слое соотношение полисульфона к гидрофильному полимеру составляет от 50:50 мас.% вплоть до 99,999:0,001 мас.%.
5. Имплантируемый медицинский продукт по п.3 или 4, отличающийся тем, что гидрофильный полимер выбран из группы, включающей следующее: поливинилпирролидон, полиэтиленгликоль, полипропиленгликоль, поливиниловый спирт, полигидроксиэтилметакрилаты, полиакриламид, поливалеролактоны, поли-e-декалактоны, полилактоновую кислоту, полигликолевую кислоту, полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, поли-e-капролактон, полигидроксибутановую кислоту, полигидроксибутираты, полигидроксивалераты, сополимеры полигидроксибутиратов и валератов, поли(1,4-диоксан-2,3-дионы), поли(1,3-диоксан-2-оны), полипарадиоксаноны, полиангидриды, такие как ангидриды полималеиновой кислоты, фибрин, полицианоакрилаты, поликапролактондиметакрилаты, поли-b-малеиновую кислоту, поликапролактона бутилакрилаты, мультиблок-полимеры, например, из олигокапролактондиолов и олигодиоксанондиолов, полиэфирные сложноэфирные мультиблок-полимеры, такие как PEG (полиэтиленгликоль) и полибутилентерефталат, полипивотолактоны, триметилкарбонаты полигликолевой кислоты, поликапролактон-гликолиды, поли-g-этилглутамат, поли(DTH(дезаминотирозилтирозингексиловый эфир)иминокарбонат), поли(DTE-со-DT-карбонат), (поли(сополимер карбоната дезаминотирозилтирозинэтилового эфира и дезаминотирозилтирозина)), поли(бисфенол-А-иминокарбонат), полиортоэфиры, триметилкарбонаты полигликолевой кислоты, политриметилкарбонаты, полииминокарбонаты, поли(N-винил)пирролидон, поливиниловые спирты, полиэфирамиды, гликолированные полиэфиры, полифосфоэфиры, полифосфазены, поли[(паракарбоксифенокси)пропан], полигидроксипентановую кислоту, полиангидриды, полиэтиленоксид-пропиленоксид, мягкие полиуретаны, полиуретаны с аминокислотными остатками в основной цепи, полимеры, содержащие простую эфирную и сложную эфирную связь, такие как полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, а также их сополимеры, липиды, каррагенаны, фибриноген, крахмал, коллаген, полимеры на основе белков, полиаминокислоты, синтетические полиаминокислоты, зеин, модифицированный зеин, полигидроксиалканоаты, пектиновую кислоту, актиновую кислоту, модифицированный и немодифицированный фибрин и казеин, карбоксиметилсульфат, альбумин, гиалуроновую кислоту, хитозан и его производные, хондроитинсульфат, декстран, b-циклодекстрины, сополимеры с PEG и полипропиленгликолем, гуммиарабик, гуар, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, фосфолипиды, сополимеры и/или смеси вышеупомянутых веществ.
6. Имплантируемый медицинский продукт по п.5, отличающийся тем, что гидрофильный полимер выбран из группы, включающей поливинилпирролидон, полиэтиленгликоль и/или полипропиленгликоль.
7. Имплантируемый медицинский продукт по любому из пп.1-6, отличающийся тем, что биологически стабильный слой адгезионно или ковалентно связан с поверхностью медицинского продукта.
8. Имплантируемый медицинский продукт по любому из пп.1-7, отличающийся тем, что покрытие поверхности медицинского продукта состоит из одного, двух, трех или более слоев.
9. Имплантируемый медицинский продукт по любому из пп.1-8, отличающийся тем, что по меньшей мере под одним биологически стабильным полисульфоновым слоем по меньшей мере с одним гидрофильным полимером или без него и/или на указанном слое присутствует по меньшей мере один слой полностью десульфатированного и N-реацетилированного гепарина, десульфатированного и N-реацетилированного гепарина, N-карбоксиметилированного и/или частично N-ацетилированного хитозана и/или смесей этих веществ.
10. Имплантируемый медицинский продукт по любому из пп.1-9, отличающийся тем, что в многослойных системах по меньшей мере один полисульфоновый слой с добавлением или без добавления по меньшей мере одного гидрофильного полимера, по меньшей мере, частично покрывает биологически стабильный полисульфоновый слой по меньшей мере с одним слоем по меньшей мере одного биодеградируемого полимера.
11. Имплантируемый медицинский продукт по любому из пп.1-10, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент выбран из группы, содержащей сиролимус (рапамицин), эверолимус, соматостатин, такролимус, рокситромицин, дунаимицин, аскомицин, бафиломицин, эритромицин, мидекамицин, джозамицин, конканамицин, кларитромицин, тролеандомицин, фолимицин, церивастатин, симвастатин, ловастатин, флувастатин, розувастатин, аторвастатин, правастатин, питавастатин, винбластин, винкристин, виндезин, винорелбин, этопозид, тенипозид, нимустин, кармустин, ломустин, циклофосфамид, натриуретический пептид С-типа (CNP), 4-гидроксициклофосфамид, эстрамустин, мелфалан, ифосфамид, трофосфамид, хлорамбуцил, бендамустин, дакарбазин, бусульфан, прокарбазин, треосульфан, темозоломид, тиотепа, даунорубицин, доксорубицин, акларубицин, эпирубицин, митоксантрон, идарубицин, блеомицин, митомицин, дактиномицин, метотрексат, флударабин, флударабин-5'-дигидрофосфат, кладрибин, меркаптопурин, тиогуанин, цитарабин, фторурацил, гемцитабин, капецитабин, доцетаксел, карбоплатин, цисплатин, криптофицин, ангинекс, оксалиплатин, амсакрин, иринотекан, топотекан, гидроксикарбамид, милтефосин, пентостатин, алдеслейкин, третиноин, аспарагиназу, пэгаспаргазу, анастрозол, экземестан, летрозол, форместан, аминоглутетимид, адриамицин, азитромицин, спирамицин, цефарантин, ингибитюЁ пролиферации гладкомышечных клеток типа 2w, эпотилон А и В, митоксантрон, азатиоприн, микофенолата мофетил, c-myc-антисмысловой, b-myc-антисмысловой, бетулиновую кислоту, камптотецин, лапахол, b-лапахон, подофиллотоксин, бетулин, подофилловой кислоты 2-этилгидразид, молграмостим (rhuGM-CSF (рекомбинантный человеческий гранулоцитарно-макрофагальный колониестимулирующий фактор)), пэгинтерферон a-2b, ленограстим (r-HuG-CSF (рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор)), филграстим, макрогол, ангинекс, Na-уретические пептиды, дакарбазин, базиликсимаб, даклизумаб, селектин (антагонист цитокинов), криптофицины, ингибитор СЕТР (белка-переносчика эфиров холестерина), кадхерины, ингибиторы цитокининов, ингибитор СОХ-2 (циклооксигеназы 2), АЕ-941 (NeovastatТ) NFkB (ядерный фактор каппа-В), ангиопептин, ципрофлоксацин, камптотецин, флуробластин, моноклональные антитела, которые ингибируют пролиферацию мышечных клеток, антагонисты bFGF (щелочного фактора роста фибробластов), пробукол, простагландины, Ac-YVAD-CMK (ацетил-тирозинил-валил-аланил-аспартил-хлорметил-кетон), 1,11-диметоксикантин-6-он, 1-гидрокси-11-метоксикантин-6-он, скополетин, колхицин, доноры NO, такие как пентаэритритола тетранитрат и синдноеимины, S-нитрозопроизводные, тамоксифен, стауроспорин, b-эстрадиол, a-эстрадиол, эстриол, эстрон, этинилэстрадиол, фосфестрол, медроксипрогестерон, эстрадиола ципионаты, эстрадиола бензоаты, траниласт, камебакаурин и другие терпеноиды, которые применяются в терапии рака, верапамил, ингибиторы тирозинкиназы (тирфостины), циклоспорин А, паклитаксел и его производные, такие как 6-a-гидроксипаклитаксел, баккатин, таксотер и другие, синтетические и получаемые из природных источников макроциклические олигомеры субоксида углерода (MCS) и его производные, мофебутазон, ацеметацин, диклофенак, лоназолак, дапсон, ортокарбамоилфеноксиуксусную кислоту, лидокаин, кетопрофен, мефенамовую кислоту, пироксикам, мелоксикам, хлорохина фосфат, пеницилламин, гидроксихлорохин, ауранофин, ауротиомалат натрия, оксацепрол, целекоксиб, b-ситостерин, адеметионин, миртекаин, полидоканол, нонивамид, левоментол, бензокаин, аэсцин, эллиптицин, D-24851 (Calbiochem), колцемид, цитохалазин А-Е, инданоцин, нокодазол, белок S-100, бацитрацин, антагонисты рецептора витронектина, азеластин, стимулятор гуанидилциклазы, тканевый ингибитор металлопротеиназы-1 и -2, свободные нуклеиновые кислоты, нуклеиновые кислоты, встроенные в вирусные трансмиттеры, фрагменты ДНК и РНК, ингибитор активатора плазминогена 1 типа, ингибитор активатора плазминогена 2 типа, антисмысловые олигонуклеотиды, ингибиторы VEGF (фактор роста эндотелия сосудов), IGF-1 (инсулиноподобный фактор роста), активные агенты, выбранные из группы антибиотиков, такие как цефадроксил, цефазолин, цефаклор, цефотаксим, тобрамицин, гентамицин, пенициллины, такие как диклоксациллин, оксациллин, сульфонамиды, метронидазол, антитромботические средства, такие как аргатробан, аспирин, абциксимаб, синтетический антитромбин, бивалирудин, кумадин, эноксапарин, десульфатированный и N-реацетилированный гепарин (hemoparinТ), тканевый активатор плазминогена, тромбоцитарный мембранный рецептор GpIIb/IIIa, антитело-ингибитор фактора Ха, гепарин, гирудин, r-гирудин, PPACK (D-фенилаланил-L-пролил-L-аргининилхлорметилкетон), протамин, проурокиназу, стрептокиназу, варфарин, урокиназу, вазодилататоры, такие как дипирамидол, триазолопиримидин (trapidilТ), нитропруссиды, антагонисты PDGF (тромбоцитарного фактора роста), такие как триазолопиримидин и серамин, ингибиторы АСЕ (ангиотензинпревращающего фермента), такие как каптоприл, цилазаприл, лизиноприл, эналаприл, лозартан, ингибиторы тиопротеазы, простациклин, вапипрост, интерферон a, b и g, антагонисты гистамина, блокаторы серотонина, ингибиторы апоптоза, регуляторы апоптоза, такие как р65 NFkB и Bcl-xL антисмысловые олигонуклеотиды, галофугинон, нифедипин, токоферол, траниласт, молсидомин, полифенолы чая, эпикатехина галлат, эпигаллокатехина галлат, босвелиевые кислоты и их производные, лефлуномид, анакинра, этанерцепт, сульфасалазин, этопозид, диклоксациллин, тетрациклин, триамцинолон, мутамицин, прокаинамид, ретиноевую кислоту, хинидин, дизопиримид, флекаинид, пропафенон, соталол, амидорон, природные и синтетические стероиды, такие как бриофиллин А, инотодиол, махирозид А, галакинозид, мансонин, стреблозид, гидрокортизон, бетаметазон, дексаметазон, нестероидные вещества (NSAIDS (нестероидные противовоспалительные лекарственные средства)), такие как фенопрофен, ибупрофен, индометацин, напроксен, фенилбутазон, и другие противовирусные агенты, такие как ацикловир, ганцикловир и зидовудин, противогрибковые средства, такие как клотримазол, флуцитозин, гризеофульвин, кетоконазол, миконазол, нистатин, тербинафин, противопротозойные агенты, такие как хлорохин, мефлохин, хинин, а также природные терпеноиды, такие как гиппоцескулин, баррингтогенол-C21-ангелат, 14-дегидроангростистахин, агроскерин, агростистахин, 17-гидроксиангростистахин, оватодиолиды, 4,7-оксициклоанизомелиновая кислота, бакхариноиды В1, В2, B3, тубеимозид, бруцеанол А, В и С, бруцеатинозид С, яданзиозиды N и Р, изодезоксиэлефантопин, томенфантопин А и В, коронарин А, В, С и D, урсоловая кислота, гиптатовая кислота А, зеорин, изоиридогерманал, майтенфолиол, эффусантин А, эксцисанин А и В, лонгикаурин В, скульпонеатин С, камебаунин, лейкаменин А и В, 13,18-дегидро-6-a-сенециоилоксичапаррин, таксамаирин А и В, регенилол, триптолид, а также цимарин, апоцимарин, аристолохиевая кислота, аноптерин, гидроксианоптерин, анемонин, протоанемонин, берберин, челибурина хлорид, циктоксин, синококулин, бомбрестатин А и В, кудраисофлавон А, куркумин, дигидронитидин, нитидина хлорид, 12-b-гидроксипрегнадиен-4,16-диен-3,20-дион, билобол, гинкгол, гинкголевая кислота, геленалин, индицин, индицин-N-оксид, лазиокарпин, инотодиол, гликозид 1а, подофиллотоксин, джустицидин А и В, ларреатин, маллотерин, маллотохроманол, изобутирилмаллотохроманол, махирозид А, марчантин А, майтанзин, ликоридицин, маргетин, панкратистатин, лириоденин, биспартенолидин, оксоушинсунин, аристолактам-AII, периплокозид А, галакинозид, урсолиевая кислота, дезоксипсороспермин, психорубин, рицин А, сангвинарин, кислота из пшеницы manwu, метилсорбифолин, сфателиахромен, стизофиллин, мансонин, стреблозид, акагерин, дигидроусамбаренсин, гидроксиусамбарин, стрихнопентамин, стрихнофиллин, усамбарин, усамбарензин, берберин, лириоденин, дафноретин, ларицирезинол, метоксиларицирезинол, сирингарезинол, умбеллиферон, афромозон, ацетилвисмион В, дезацетилвисмион А, висмион А и В.
12. Имплантируемый медицинский продукт по п.11, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент выбран из группы, содержащей паклитаксел и его производные, b-эстрадиол, симвастатин, PI-88 (Progen Ind.), макроциклические субоксиды углерода (MCS) и их производные, trapidilТ, N-(пиридин-4-ил)-[1-4-(4-хлорбензил)индол-3-ил]глиоксиламид (D-24851), активированный протеин С (аРС), Ac-YVAD-CMK, Anginex (b-Pep25), NeovastatТ, Cryptophycin 52, такролимус.
13. Имплантируемый медицинский продукт по любому из пп.1-12, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент содержится в фармацевтически активной концентрации 0,001-20 мг/см2 поверхности.
14. Имплантируемый медицинский продукт по любому из пп.1-13, отличающийся тем, что в многослойэых системах по меньшей мере два слоя с добавлением или без добавления по меньшей мере одного гидрофильного полимера содержат по меньшей мере один активный агент с одинаковой или разной концентрацией активного агента, связанного ковалентно и/или адгезионно.
15. Имплантируемый медицинский продукт по любому из пп.1-14, отличающийся тем, что в многослойных системах последний слой представляет собой слой чистого активного агента, связанный ковалентно и/или адгезионно.
16. Способ нанесения биосовместимого покрытия на имплантируемые медицинские продукты, характеризующийся следующими стадиями:
а) берут стент,
б) наносят по меньшей мере один биологически стабильный полисульфоновый слой по меньшей мере с одним гидрофильным полимером или без него,
в) наносят и/или включают по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент на и/или в биологически стабильный слой или
б') наносят по меньшей мере один биологически стабильный полисульфоновый слой по меньшей мере с одним гидрофильным полимером или без него вместе по меньшей мере с одним антипролиферативным, противовоспалительным и/или антитромботическим активным агентом.
17. Способ по п.16, включающий стадию (б') и дополнительную стадию, на которой:
в') наносят по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент на биологически стабильный полимерный слой.
18. Способ по п.16 или 17, включающий дополнительную стадию, на которой:
г) наносят по меньшей мере один второй биологически стабильный полисульфоновый слой с содержанием гидрофильных полимеров, которое равно или отличается от первого слоя, или без таких полимеров, без и/или с включением и/или нанесением по меньшей мере одного активного агента в той же самой или другой концентрации.
19. Способ по любому из пп.16-18, включающий дополнительную стадию, на которой:
г') наносят по меньшей мере один дополнительный слой по меньшей мере одного биодеградируемого полимера без или с включением и/или нанесением по меньшей мере одного активного агента в той же самой или другой концентрации.
20. Способ по любому из пп.16-18, отличающийся тем, что на и/или под по меньшей мере один биологически стабильный полисульфоновый слой наносят по меньшей мере один слой полностью десульфатированного и N-реацетилированного гепарина, N-карбоксиметилированного и/или частично N-ацетилированного хитозана и/или смесей этих веществ.
21. Имплантируемый медицинский продукт, полученный способом по любому из пп.16-19.
22. Имплантируемый медицинский продукт по любому из пп.1-15 или 21, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент высвобождается контролируемым образом через поверхностное покрытие.
23. Имплантируемый медицинский продукт по любому из пп.1-15 или 21, отличающийся тем, что антипролиферативный, противовоспалительный и/или антитромботический активный агент содержится в фармацевтически активной концентрации 0,001-10 мг/см2 поверхности медицинского продукта и на слой, несущий этот активный агент.
24. Имплантируемый медицинский продукт по любому из пп.1-15 или 21, 22, отличающийся тем, что медицинский продукт представляет собой стент.
Текст
011822 Описание изобретения Данное изобретение относится к медицинским поверхностям с биосовместимым, биологически стабильным покрытием из полисульфонов или/и полисульфоновых производных или сополимеров соответственно, причем полисульфон содержит по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент и/или покрыт агентом, к способам изготовления таких поверхностей, а также к их применению в форме долговременных имплантантов, в частности стентов для предотвращения рестеноза. В последние годы все более и более увеличивается практика имплантации стентов при расширении закупоренных кровеносных сосудов посредством баллонов. Хотя стенты снижают риск повторной закупорки сосудов, в настоящее время они не способны полностью предотвратить такой рестеноз. В технической литературе отсутствует точное описание термина "рестеноз". Наиболее часто используемым морфологическим определением рестеноза является определение рестеноза как уменьшения диаметра сосуда до менее чем 50% от нормального после успешной РТСА (чрескожной транслюминальной коронарной ангиопластики). Это эмпирически определяемое значение, гемодинамическая релевантность и связь с клинической патологией которого не имеют стабильного научного обоснования. На практике признаком рестеноза ранее обработанного сегмента сосуда часто считается клиническое ухудшение состояния здоровья пациента. Существуют три разные причины рестеноза, вызываемого стентом: а) в первое время после имплантации поверхность стента непосредственно подвергается воздействию крови, и из-за присутствия чужеродной поверхности может развиться острый тромбоз, который вновь приводит к закупорке кровеносного сосуда; б) имплантация стента вызывает повреждения сосуда, которые, как и вышеупомянутый тромбоз,также провоцируют воспалительные реакции, которые играют решающую роль для процесса восстановления в течение первых семи дней. Происходящие при этом процессы среди прочего связаны с высвобождением ростовых факторов, за счет чего инициируется усиленная пролиферация гладкомышечных клеток, быстро приводящая к повторной закупорке сосуда из-за неконтролируемого роста; в) через несколько недель стент начинает врастать в ткань кровеносного сосуда. Это означает, что стент полностью окружается гладкомышечными клетками и не контактирует с кровью. Такое заживление может быть слишком активным (гиперплазия неоинтимы) и может приводить к тому, что охватывается не только поверхность стента, но и полностью закупоривается внутреннее пространство стента. Были предприняты безрезультатные попытки решить проблему рестеноза путем покрытия стентов гепарином (J. Whrle et al., European Heart Journal (2001) 22, 1808-1816). Гепарин, однако, выступает как антикоагулянт только в отношении первой из вышеупомянутых причин и, кроме того, его суммарный эффект может проявляться только в растворе. Между тем данная первая проблема может быть почти полностью предотвращена при помощи лечения посредством введения антикоагулянтов. В настоящий момент вторую и третью проблему предполагается решить путем локального ингибирования роста гладкомышечных клеток на стенте. Предпринимаются попытки решения с помощью, например, радиоактивных стентов или стентов, содержащих фармацевтически активные агенты. Так, например, в US-A-5891108 описан отлитый с полостями стент, который может содержать в своей внутренней части активные агенты, высвобождающиеся через большое число отверстий в стенте. С другой стороны, в ЕР-А-1127582 описан стент, на поверхности которого имеются выемки глубиной 0,1-1 мм и длиной 7-15 мм, пригодные для размещения в них активного агента. Такие резервуары для активного агента высвобождают содержащийся в них фармацевтически активный агент в нужное время с высокой концентрацией и в течение относительного длительного периода времени по сравнению с отверстиями в стенте с полостями, что, однако, приводит к тому, что гладкомышечные клетки более не могут или могут только очень замедленно окружать стент. Как следствие, стент намного дольше подвергается воздействию крови, что в свою очередь ведет к увеличению числа закупорок сосудов, вызываемых тромбозом (Liistro F., Colombo A., Late acute thrombosis after Paclitaxel eluting stent implantation. Heart(2001) 86, 262-4). Одним из подходов к решению этой проблемы является фосфорилхолиновое покрытие биосовместимых элементов (WO 0101957), в силу чего фосфорилхолин, компонент клеточной мембраны эритроцитов, предназначается для создания нетромбогенной поверхности как компонента нанесенного бионедеградируемого полимерного слоя на стенте. Таким образом, в зависимости от молекулярной массы активный агент абсорбируется фосфорилхолиновым слоем, содержащим полимер, либо адсорбируется на поверхности. Краткое изложение сущности изобретения В настоящем изобретении предложен имплантируемый медицинский продукт, отличающийся тем,что его поверхность, по меньшей мере, частично покрыта по меньшей мере одним биологически стабильным полисульфоновым слоем, содержащим в, под и/или на указанном полисульфоновом слое по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент. В одном аспекте изобретения предложен имплантируемый медицинский продукт, отличающийся-1 011822 тем, что полисульфон выбран из группы, включающей полиэфирсульфон, замещенный полиэфирсульфон, полифенилсульфон, замещенный полифенилсульфон, полисульфоновые блок-сополимеры, перфорированные полисульфоновые блок-сополимеры, полуфторированные полисульфоновые блоксополимеры, замещенные полисульфоновые блок-сополимеры и/или смеси вышеуказанных полимеров,где заместители выбраны из -OH, -OCH3, -OC2H5, -SH, -SCH3, -SC2H5, -NO2, -F, -Cl, -Br, -I, -N3, -CN,-OCN, -NCO, -SCN, -NCS, -CHO, -COCH3, -COC2H5, -COOH, -COCN, -COOCH3, -COOC2H5, -CONH2,-CONHCH3, -CONHC2H5, -CON(CH3)2, -CON(C2H5)2, -NH2, -NHCH3, -NHC2H5, -N(CH3)2, -N(C2H5)2,-SOCH3, -SOC2H5, -SO2CH3, -SO2C2H5, -SO3H, -SO3CH3, -SO3C2H5, -OCF3, -O-COOCH3, -O-COOC2H5,-NH-CO-NH2, -NH-CS-NH2, -NH-C(=NH)-NH2, -O-CO-NH2, -NH-CO-OCH3, -NH-CO-OC2H5, -CH2F, -CHF2,-CF3, -CH2Cl, -CHCl2, -CCl3, -CH2Br, -CHBr2, -CBr3, -CH2I, -CHI2, -Cl3, -CH3, -C2H5, -C3H7, -CH(CH3)2,-C4H9, -CH2-CH(CH3)2, -CH2-COOH, -CH(CH3)-C2H5, -C(CH3)3, -H. В еще одном аспекте изобретения предложен имплантируемый медицинский продукт, отличающийся тем, что по меньшей мере один биологически стабильный полисульфоновый слой содержит по меньшей мере один гидрофильный полимер. В предпочтительном воплощении в имплантируемом медицинском продукте по изобретению полисульфон, содержащий по меньшей мере один гидрофильный полимер, присутствует в смеси в соотношении от 50:50 мас.% вплоть до 99,999:0,001 мас.%. Согласно еще одному воплощению изобретения гидрофильный полимер в имплантируемом медицинском продукте по изобретению выбран из группы, включающей следующее: поливинилпирролидон,полиэтиленгликоль, полипропиленгликоль, поливиниловый спирт, полигидроксиэтилметакрилаты, полиакриламид, поливалеролактоны, полидекалактоны, полилактоновую кислоту, полигликолевую кислоту, полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, поликапролактон,полигидроксибутановую кислоту, полигидроксибутираты, полигидроксивалераты, сополимеры полигидроксибутиратов и валератов, поли(1,4-диоксан-2,3-дионы), поли(1,3-диоксан-2-оны), полипарадиоксаноны, полиангидриды, такие как ангидриды полималеиновой кислоты, фибрин, полицианоакрилаты, поликапролактондиметакрилаты, поли-b-малеиновую кислоту, поликапролактона бутилакрилаты, мультиблок-полимеры, например, из олигокапролактондиолов и олигодиоксанондиолов, полиэфирные сложноэфирные мультиблок-полимеры, такие как PEG (полиэтиленгликоль) и полибутилентерефталат, полипивотолактоны, триметилкарбонаты полигликолевой кислоты, поликапролактон-гликолиды, поли-gэтилглутамат, поли(DTH(дезаминотирозилтирозингексиловый эфир)иминокарбонат), поли(DTE-со-DTкарбонат), (поли(сополимер карбоната дезаминотирозилтирозин-этилового эфира и дезаминотирозилтирозина, поли(бисфенол-А-иминокарбонат), полиортоэфиры, триметилкарбонаты полигликолевой кислоты, политриметилкарбонаты, полииминокарбонаты, поли(N-винил)пирролидон, поливиниловые спирты, полиэфирамиды, гликолированные полиэфиры, полифосфоэфиры, полифосфазены, поли[(паракарбоксифенокси)пропан], полигидроксипентановую кислоту, полиангидриды, полиэтиленоксид-пропиленоксид, мягкие полиуретаны, полиуретаны с аминокислотными остатками в основной цепи,полимеры, содержащие простую эфирную и сложную эфирную связь, такие как полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, а также их сополимеры, липиды, каррагенаны, фибриноген, крахмал,коллаген, полимеры на основе белков, полиаминокислоты, синтетические полиаминокислоты, зеин, модифицированный зеин, полигидроксиалканоаты, пектиновую кислоту, актиновую кислоту, модифицированный и немодифицированный фибрин и казеин, карбоксиметилсульфат, альбумин, гиалуроновую кислоту, хитозан и его производные, хондроитинсульфат, декстран, b-циклодекстрины, сополимеры с PEG и полипропиленгликолем, гуммиарабик, гуар, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, фосфолипиды, сополимеры и/или смеси вышеупомянутых веществ. В предпочтительном воплощении имплантируемый медицинский продукт по изобретению содержит гидрофильный полимер, выбранный из группы, включающей поливинилпирролидон, полиэтиленгликоль и/или полипропиленгликоль. Согласно одному аспекту изобретения предложен имплантируемый медицинский продукт, отличающийся тем, что биологически стабильный слой адгезионно или ковалентно связан с поверхностью медицинского продукта. Согласно еще одному аспекту изобретения предложен имплантируемый медицинский продукт по изобретению, отличающийся тем, что покрытие поверхности этого медицинского продукта состоит из одного, двух, трех или более слоев. Согласно еще одному аспекту изобретения предложен имплантируемый медицинский продукт, отличающийся тем, что под по меньшей мере одним биологически стабильным полисульфоновым слоем по меньшей мере с одним гидрофильным полимером или без него и/или на указанном слое присутствует по меньшей мере один слой полностью десульфатированного и N-реацетилированного гепарина, десульфатированного и N-реацетилированного гепарина, N-карбоксиметилированного и/или частично Nацетилированного хитозана и/или смесей этих веществ. Согласно еще одному аспекту изобретения предложен имплантируемый медицинский продукт по изобретению, отличающийся тем, что в многослойных системах по меньшей мере один полисульфоновый слой с добавлением или без добавления по меньшей мере одного гидрофильного полимера, по мень-2 011822 шей мере, частично покрывает биологически стабильный полисульфоновый слой по меньшей мере с одним слоем по меньшей мере одного биодеградируемого полимера. Согласно еще одному аспекту изобретения предложен имплантируемый медицинский продукт, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент выбран из группы, содержащей сиролимус (рапамицин), эверолимус,соматостатин, такролимус, рокситромицин, дунаимицин, аскомицин, бафиломицин, эритромицин, мидекамицин, джозамицин, конканамицин, кларитромицин, тролеандомицин, фолимицин, церивастатин, симвастатин, ловастатин, флувастатин, розувастатин, аторвастатин, правастатин, питавастатин, винбластин,винкристин, виндезин, винорелбин, этопозид, тенипозид, нимустин, кармустин, ломустин, циклофосфамид, натриуретический пептид С-типа (CNP), 4-гидроксициклофосфамид, эстрамустин, мелфалан, ифосфамид, трофосфамид, хлорамбуцил, бендамустин, дакарбазин, бусульфан, прокарбазин, треосульфан,темозоломид, тиотепа, даунорубицин, доксорубицин, акларубицин, эпирубицин, митоксантрон, идарубицин, блеомицин, митомицин, дактиномицин, метотрексат, флударабин, флударабин-5'-дигидрофосфат,кладрибин, меркаптопурин, тиогуанин, цитарабин, фторурацил, гемцитабин, капецитабин, доцетаксел,карбоплатин, цисплатин, криптофицин, ангинекс, оксалиплатин, амсакрин, иринотекан, топотекан, гидроксикарбамид, милтефосин, пентостатин, алдеслейкин, третиноин, аспарагиназу, пэгаспаргазу, анастрозол, экземестан, летрозол, форместан, аминоглутетимид, адриамицин, азитромицин, спирамицин, цефарантин, ингибитор пролиферации гладкомышечных клеток типа 2w, эпотилон А и В, митоксантрон, азатиоприн, микофенолата мофетил, с-myc-антисмысловой, b-myc-антисмысловой, бетулиновую кислоту,камптотецин, лапахол, -лапахон, подофиллотоксин, бетулин, подофилловой кислоты 2-этилгидразид,молграмостим (rhuGM-CSF (рекомбинантный человеческий гранулоцитарно-макрофагальный колониестимулирующий фактор, пэгинтерферон -2b, ленограстим (r-HuG-CSF (рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор, филграстим, макрогол, ангинекс, Naуретические пептиды, дакарбазин, базиликсимаб, даклизумаб, селектин (антагонист цитокинов), криптофицины, ингибитор СЕТР (белка-переносчика эфиров холестерина), кадхерины, ингибиторы цитокининов, ингибитор СОХ-2 (циклооксигеназы 2), АЕ-941 (Neovastat) NFB (ядерный фактор каппа-В), ангиопептин, ципрофлоксацин, камптотецин, флуробластин, моноклональные антитела, которые ингибируют пролиферацию мышечных клеток, антагонисты bFGF (щелочного фактора роста фибробластов),пробукол, простагландины, Ac-YVAD-CMK (ацетил-тирозинил-валил-аланил-аспартил-хлорметилкетон), 1,11-диметоксикантин-6-он, 1-гидрокси-11-метоксикантин-6-он, скополетин, колхицин, донорыNO, такие как пентаэритритола тетранитрат и синдноеимины, S-нитрозопроизводные, тамоксифен, стауроспорин, -эстрадиол, -эстрадиол, эстриол, эстрон, этинилэстрадиол, фосфестрол, медроксипрогестерон, эстрадиола ципионаты, эстрадиола бензоаты, траниласт, камебакаурин и другие терпеноиды, которые применяются в терапии рака, верапамил, ингибиторы тирозинкиназы (тирфостины), циклоспорин А,паклитаксел и его производные, такие как 6 гидроксипаклитаксел, баккатин, таксотер и другие, синтетические и получаемые из природных источников макроциклические олигомеры субоксида углерода(MCS) и его производные, мофебутазон, ацеметацин, диклофенак, лоназолак, дапсон, ортокарбамоилфеноксиуксусную кислоту, лидокаин, кетопрофен, мефенамовую кислоту, пироксикам, мелоксикам, хлорохина фосфат, пеницилламин, гидроксихлорохин, ауранофин, ауротиомалат натрия, оксацепрол, целекоксиб, -ситостерин, адеметионин, миртекаин, полидоканол, нонивамид, левоментол, бензокаин, аэсцин,эллиптицин, D-24851 (Calbiochem), колцемид, цитохалазин А-Е, инданоцин, нокодазол, белок S-100, бацитрацин, антагонисты рецептора витронектина, азеластин, стимулятор гуанидилциклазы, тканевый ингибитор металлопротеиназы-1 и -2, свободные нуклеиновые кислоты, нуклеиновые кислоты, встроенные в вирусные трансмиттеры, фрагменты ДНК и РНК, ингибитор активатора плазминогена 1 типа, ингибитор активатора плазминогена 2 типа, антисмысловые олигонуклеотиды, ингибиторы VEGF (фактор роста эндотелия сосудов), IGF-1 (инсулиноподобный фактор роста), активные агенты, выбранные из группы антибиотиков, такие как цефадроксил, цефазолин, цефаклор, цефотаксим, тобрамицин, гентамицин, пенициллины, такие как диклоксациллин, оксациллин, сульфонамиды, метронидазол, антитромботические средства, такие как аргатробан, аспирин, абциксимаб, синтетический антитромбин, бивалирудин, кумадин, эноксапарин, десульфатированный и N-реацетилированный гепарин (hemoparin), тканевый активатор плазминогена, тромбоцитарный мембранный рецептор GpIIb/IIIa, антитело-ингибитор фактора Ха,гепарин, гирудин, r-гирудин, PPACK (D-фенилаланил-L-пролил-L-аргининилхлорметилкетон), протамин, проурокиназу, стрептокиназу, варфарин, урокиназу, вазодилататоры, такие как дипирамидол, триазолопиримидин (trapidil), нитропруссиды, антагонисты PDGF (тромбоцитарного фактора роста), такие как триазолопиримидин и серамин, ингибиторы АСЕ (ангиотензинпревращающего фермента), такие как каптоприл, цилазаприл, лизиноприл, эналаприл, лозартан, ингибиторы тиопротеазы, простациклин, вапипрост, интерферон ,и , антагонисты гистамина, блокаторы серотонина, ингибиторы апоптоза, регуляторы апоптоза, такие как р 65 NFB и Bcl-xL антисмысловые олигонуклеотиды, галофугинон, нифедипин, токоферол, траниласт, молсидомин, полифенолы чая, эпикатехина галлат, эпигаллокатехина галлат, босвелиевые кислоты и их производные, лефлуномид, анакинра, этанерцепт, сульфасалазин, этопозид, диклоксациллин, тетрациклин, триамцинолон, мутамицин, прокаинамид, ретиноевую кислоту, хи-3 011822 нидин, дизопиримид, флекаинид, пропафенон, соталол, амидорон, природные и синтетические стероиды,такие как бриофиллин А, инотодиол, махирозид А, галакинозид, мансонин, стреблозид, гидрокортизон,бетаметазон, дексаметазон, нестероидные вещества (NSAIDS (нестероидные противовоспалительные лекарственные средства, такие как фенопрофен, ибупрофен, индометацин, напроксен, фенилбутазон, и другие противовирусные агенты, такие как ацикловир, ганцикловир и зидовудин, противогрибковые средства, такие как клотримазол, флуцитозин, гризеофульвин, кетоконазол, миконазол, нистатин, тербинафин, противопротозойные агенты, такие как хлорохин, мефлохин, хинин, а также природные терпеноиды, такие как гиппоцескулин, баррингтогенол-C21-ангелат, 14-дегидроангростистахин, агроскерин,агростистахин, 17-гидроксиангростистахин, оватодиолиды, 4,7-оксициклоанизомелиновая кислота, бакхариноиды В 1, В 2, B3, тубеимозид, бруцеанол А, В и С, бруцеатинозид С, яданзиозиды N и Р, изодезоксиэлефантопин, томенфантопин А и В, коронарин А, В, С и D, урсоловая кислота, гиптатовая кислота А,зеорин, изоиридогерманал, майтенфолиол, эффусантин А, эксцисанин А и В, лонгикаурин В, скульпонеатин С, камебаунин, лейкаменин А и В, 13,18-дегидро-6 сенециоилоксичапаррин, таксамаирин А и В, регенилол, триптолид, а также цимарин, апоцимарин, аристолохиевая кислота, аноптерин, гидроксианоптерин, анемонин, протоанемонин, берберин, челибурина хлорид, циктоксин, синококулин, бомбрестатин А и В, кудраисофлавон А, куркумин, дигидронитидин, нитидина хлорид, 12-гидроксипрегнадиен-4,16-диен-3,20-дион, билобол, гинкгол, гинкголевая кислота, геленалин, индицин,индицин-N-оксид, лазиокарпин, инотодиол, гликозид 1 а, подофиллотоксин, джустицидин А и В, ларреатин, маллотерин, маллотохроманол, изобутирилмаллотохроманол, махирозид А, марчантин А, майтанзин, ликоридицин, маргетин, панкратистатин, лириоденин, биспартенолидин, оксоушинсунин, аристолактам-AII, периплокозид А, галакинозид, урсолиевая кислота, дезоксипсороспермин, психорубин, рицин А, сангвинарин, кислота из пшеницы manwu, метилсорбифолин, сфателиахромен, стизофиллин, мансонин, стреблозид, акагерин, дигидроусамбаренсин, гидроксиусамбарин, стрихнопентамин, стрихнофиллин, усамбарин, усамбарензин, берберин, лириоденин, дафноретин, ларицирезинол, метоксиларицирезинол, сирингарезинол, умбеллиферон, афромозон, ацетилвисмион В, дезацетилвисмион А, висмион А и В. В предпочтительном воплощении изобретения предложен имплантируемый медицинский продукт по изобретению, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент выбран из группы, содержащей следующее: паклитаксел и его производные, -эстрадиол, симвастатин, PI-88 (Progen Ind.), макроциклические субоксиды углерода (MCS) и их производные, trapidil, N-(пиридин-4-ил)-[1-4-(4-хлорбензил)-индол-3-ил]глиоксиламид (D-24851), активированный протеин С (аРС), Ac-YVAD-CMK, Anginex (-Pep25), Neovastat, Cryptophycin 52, такролимус. Согласно еще одному аспекту изобретения предложен имплантируемый медицинский продукт, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент содержится в фармацевтически активной концентрации 0,001-20 мг на см 2 поверхности. Согласно еще одному аспекту изобретения предложен имплантируемый медицинский продукт, отличающийся тем, что в многослойных системах по меньшей мере два слоя с добавлением или без добавления по меньшей мере одного гидрофильного полимера содержат по меньшей мере один активный агент с одинаковой или разной концентрацией активного агента, связанного ковалентно или/и адгезионно. Согласно еще одному аспекту изобретения предложен имплантируемый медицинский продукт по изобретению, отличающийся тем, что в многослойных системах последний слой представляет собой слой чистого активного агента, связанный ковалентно или/и адгезионно. Также в изобретении предложен способ нанесения биосовместимого покрытия на имплантируемые медицинские продукты, характеризующийся следующими стадиями: а) берут стент, и б) наносят по меньшей мере один биологически стабильный полисульфоновый слой по меньшей мере с одним гидрофильным полимером или без него, и в) наносят и/или включают по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент на и/или в биологически стабильный слой, или б') наносят по меньшей мере один биологически стабильный полисульфоновый слой по меньшей мере с одним гидрофильным полимером или без него вместе по меньшей мере с одним антипролиферативным, противовоспалительным и/или антитромботическим активным агентом. Согласно одному аспекту изобретения предложенный способ по изобретению включает стадию (б') и дополнительную стадию, на которой: в') наносят по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент на биологически стабильный полимерный слой. Согласно еще одному аспекту изобретения предложенный способ по изобретению включает дополнительную стадию, на которой: г) наносят по меньшей мере один второй биологически стабильный полисульфоновый слой с со-4 011822 держанием гидрофильных полимеров, которое равно или отличается от первого слоя, или без таких полимеров, без и/или с включением или/и нанесением по меньшей мере одного активного агента в той же самой или другой концентрации. Согласно еще одному аспекту изобретения предложенный способ по изобретению включает дополнительную стадию, на которой: г') наносят по меньшей мере один дополнительный слой по меньшей мере одного биодеградируемого полимера без или с включением или/и нанесением по меньшей мере одного активного агента в той же самой или другой концентрации. Согласно одному аспекту изобретения предложен способ по изобретению, отличающийся тем, что на и/или под по меньшей мере один биологически стабильный полисульфоновый слой наносят по меньшей мере один слой полностью десульфатированного и N-реацетилированного гепарина, Nкарбоксиметилированного и/или частично N-ацетилированного хитозана и/или смесей этих веществ. Также в данном изобретении предложен имплантируемый медицинский продукт, который получен способом по изобретению. Согласно одному аспекту изобретения предложен имплантируемый медицинский продукт по изобретению, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент высвобождается контролируемым образом через поверхностное покрытие. Согласно еще одному аспекту изобретения предложен имплантируемый медицинский продукт по изобретению, отличающийся тем, что соответствующийантипролиферативный, противовоспалительный и/или антитромботический активный агент содержится в фармацевтически активной концентрации 0,001-10 мг на см 2 поверхности медицинского продукта и на слое, несущем этот активный агент. Согласно еще одному аспекту изобретения предложен имплантируемый медицинский продукт по изобретению, отличающийся тем, что данный медицинский продукт представляет собой стент. Подробное описание изобретения Задачей настоящего изобретения является предложение медицинского продукта с гемосовместимой поверхностью и способа изготовления такого медицинского продукта с гемосовместимой поверхностью. В частности, предполагается, что гемосовместимая поверхность медицинского продукта будет обеспечивать возможность непрерывного и контролируемого врастания медицинского продукта в стенку сосуда. Эта задача решена при помощи технических решений, изложенных в независимых пунктах формулы настоящего изобретения. Дополнительные полезные воплощения данного изобретения пояснены в зависимых пунктах, описании, графических материалах, а также примерах. Настоящее изобретение относится к медицинским продуктам, поверхность(и) которого(ых), по меньшей мере, частично покрыта(ы) по меньшей мере одним биологически стабильным полисульфоновым слоем. Неожиданно было обнаружено, что покрытие медицинских поверхностей, находящихся в постоянном контакте с кровью, с полисульфоном, полиэфирсульфоном и/или полифенилсульфоном и их производными представляет собой чрезвычайно подходящий биосовместимый субстрат для активных агентов. Посредством смешивания гидрофильных биосовместимых полимеров или посредством использования полисульфонов с амбивалентными свойствами, т.е. с липофильными и гидрофильными группировками,можно варьировать размер пор полисульфоновой матрицы таким образом, чтобы стало возможным обеспечивать широкие возможности в отношении используемых активных агентов, применяемого количества, а также желаемой скорости высвобождения. При помощи размера пор в биологически стабильном слое можно, в частности, регулировать кинетику элюирования по меньшей мере одного активного агента. Размер пор, в свою очередь, определяется типом и количеством используемого гидрофильного полимера или, соответственно, количеством липофильных и липофобных групп в полисульфоне или полисульфоновой смеси. Кроме влияния добавленного гидрофильного полимера, на будущие свойства покрытого имплантата, нагруженного активным агентом, влияет добавление в покрывающий раствор небольших количеств воды (или также этилацетата). На параметры распределения нагрузки, характеристики высвобождения (как функции от времени и элюируемого количества активного агента) и свойств покрывающего раствора в отношении распыления несомненно влияет указанное добавление воды (или также этилацетата либо других добавок, описанных ниже) в распыляемый раствор. Также было обнаружено, что полезным является использование азота в качестве газа-носителя для напыляемого покрытия, приводящее к насыщению полимерного слоя, содержащего активный агент, азотом, который остается в этом слое и обеспечивает сохранность активного агента в нем в силу своей способности как защитного газа. Тем самым в течение длительного времени обеспечивается сохраняемость активного агента в форме, которая остается эффективной в неизмененном виде. Модификация полисульфонового каркаса посредством полимераналогичных реакций, таких как получение новых полисульфоновых сополимеров (например, полисульфоновых блок-сополимеров или продуктов со статистическим распределением), оказывает влияние на физические свойства получаемых полимеров, посредством чего можно регулировать свойства полимера, и эти полимеры применимы либо в-5 011822 комбинации с немодифицированными полимерами, либо индивидуально в качестве нового гемосовместимого материала для покрытия. Так, полиэфирсульфон, содержащий карбоксильные группы, может быть получен путем взаимодействия полисульфоновых сополимеров с 4,4'-бис-(гидроксифенил)пентановой кислотой (ВРА), что ведет к явной гидрофильности этого полимера. Свойства гидрофильного полисульфона позволяют использовать его также в качестве гидрофильной полимерной добавки к немодифицированному полисульфону, как уже упоминалось выше. Задавая степень модификации,воздействуют на степень гидрофильности так, что получают полимерную молекулу, в которой каждая цепь содержит немодифицированные и модифицированные участки и таким образом объединяет в себе гидрофобные и гидрофильные свойства, что также придает полимеру измененную пространственную организацию сегментов цепей, так называемую вторичную структуру. Поэтому предпочтительно использовать для покрытия полисульфон, имеющий как гидрофильные, так и гидрофобные участки. Аналогичные полисульфоны могут быть получены путем придания полисульфону гидрофильных боковых цепей или функциональных групп после полимеризации посредством полимераналогичных реакций при условии, что сам полимер является гидрофобным, или наоборот, путем придания гидрофильному полисульфону гидрофобных боковых цепей или функциональных групп. В этом предпочтительном воплощении гидрофильные и гидрофобные свойства объединены в одной полимерной молекуле, как правило, со статистическим распределением, поскольку полимераналогичные реакции протекают со статистическим распределением. Кроме того, такие системы гидрофильного полисульфона с гидрофобным полисульфоном могут быть получены путем статистической полимеризации по меньшей мере одного гидрофильного мономера и по меньшей мере одного гидрофобного мономера. В результате получают структуры, аналогичные вышеупомянутому воплощению последующей модификации посредством полимераналогичных реакций. Третье воплощение заключается в блок-сополимеризации по меньшей мере одного гидрофильного сульфонового блок-полимера по меньшей мере с одним гидрофобным сульфоновым блокполимером в полисульфон, который соответственно обладает гидрофильными и гидрофобными свойствами в отдельных блоках. Другой вариант заключается в превращении по меньшей мере одного гидрофильного мономера в процессе чередующейся сополимеризации по меньшей мере с одним гидрофобным мономером. Таким образом, гидрофильные и гидрофобные свойства в полученном полисульфоне чередующимся образом распределены в полимерной цепи. Кроме того, в покрытии по изобретению можно использовать смесь по меньшей мере одного гидрофильного полисульфона по меньшей мере с одним гидрофобным полисульфоном. В этом случае гидрофильные и гидрофобные свойства не объединены в одной полимерной молекуле, но, с другой стороны, они могут быть обнаружены в покрытии и оказывать те же самые эффекты, что и в случае вышеуказанных воплощений. Для получения полисульфонов пригодны все реакции полимеризации, известные специалисту в данной области, такие как радикальная, анионная, катионная или термическая полимеризация. Примеры вышеуказанных полисульфонов, а также возможности их получения описаны ниже. Кроме того, существует возможность дериватизации введенных функциональных групп, например карбоксильной группы (Macrom. Chem. Phys. 1994, 195, 1709). Так, гидрофобность активного агента можно легко увеличить выше гидрофобных свойств используемого полимера, например путем введения фторированных соединений (Coll. Polym. Sci. 2001, 279, 727). Путем введения функциональных групп могут быть получены привитые сополимеры, в которых боковые цепи теперь состоят из структурных единиц, отличных от главной цепи. Для этой цели могут быть использованы биосовместимые, биологически стабильные и биодеградируемые полимеры. Функциональные группы также могут быть использованы для связывания, которое неустойчиво к гидролизу активных агентов. Следовательно, активный агент высвобождается в форме, которая также контролируется посредством гидролиза и в зависимости от типа связывания (тиоэфирное связывание,сложноэфирное связывание). При этом преимуществом является возможность контролировать элюирование активного агента таким образом, чтобы кривая высвобождения имела другую траекторию, и то,что при помощи имплантанта можно осуществить адаптацию к разнообразной динамике заболевания с различными требованиями в отношении концентрации активного агента в зависимости от времени. Изменение состоит в ковалентном связывании десульфатированного и N-реацетилированного гепарина и/или N-карбоксиметилированного и/или частично N-ацетилированного хитозана с полимерной цепью, в результате чего, при помощи атромбогенного соединения, улучшается гемосовместимость полимера. Благодаря возможности конструирования по меньшей мере двух слоев полимера, регулируемого в отношении его состава, а также варьирования добавок, в зависимости от слоя можно осуществить разграничение в отношении используемых активных агентов, а также в отношении концентрации. Такая адаптируемость отличает полисульфоновую матрицу как универсально используемый биологически стабильный покрывающий материал для предотвращения рестеноза. Для регулировки размера пор и тем самым количества активного агента в полисульфоновой матрице, в качестве добавок можно использовать не только гидрофильные полимеры, но также и минералы и даже воду. Размер пор регулирует с одной стороны кинетику высвобождения по меньшей мере одного антипролиферативного, противовоспалительного, антифлогистического и/или антитромботического активного агента, а также, в определенных воплощениях, количество активного агента, которое может-6 011822 быть включено или соответственно нанесено в полисульфоновом покрытии, поскольку поры в полисульфоне могут служить вместилищем для активного агента. Для создания пор в полисульфоновой матрице при использовании таких добавок можно или, соответственно, нужно следовать разным стратегиям. В принципе создание пор осуществляют таким образом, чтобы добавки наносились вместе с матрицеобразующим полисульфоном на медицинский продукт, который следует покрывать подходящим способом. При этом в зависимости от различий в гидрофильности применяемых добавок, а также матрицеобразующего полисульфона, в полисульфоне образуются однородные компартменты добавки, которые можно регулировать по размеру. Количество таких гомогенных компартментов на единицу объема полисульфоновой матрицы можно регулировать посредством количества добавленной в процентном соотношении добавки. В качестве добавок можно использовать, в частности, аминокислоты, полиаминокислоты, гидрофильные полимеры, сахариды, олигосахариды, полисахариды, олигопептиды, поливинилпирролидон,полиэтиленимин, глицерин, полиэфиры, гликоль, минералы и воду. В случае аминокислот предпочтительными являются генетически кодируемые кислые аминокислоты: аспарагиновая кислота, глутаминовая кислота; нейтральные аминокислоты: аланин, аспарагин, цистеин, глутамин, глицин, изолейцин, лейцин, метионин, фенилаланин, пролин, серин, треонин, триптофан,тирозин, валин; и основные аминокислоты: аргинин, гистидин, лизин; а также не кодируемые генетически аминокислоты орнитин и таурин. Особенно предпочтительными являются представители L-ряда этих аминокислот. Кроме того, предпочтительными являются представители D-ряда этих аминокислот, а также D,L-смеси одной аминокислоты и D,L-смеси большего числа аминокислот. В случае полиаминокислот предпочтительными являются аминокислоты: поли-L-аспарагиновая кислота, поли-L-глутаминовая кислота, поли-L-аланин, поли-L-аспарагин, поли-L-цистеин, поли-Lглутамин, поли-L-глицин, поли-L-изолейцин, поли-L-лейцин, поли-L-метионин, поли-L-фенилаланин,поли-L-пролин, поли-L-серин, поли-L-треонин, поли-L-триптофан, поли-L-тирозин, поли-L-валин, полиL-аргинин, поли-L-гистидин, поли-L-лизин, а также полиорнитин и политаурин. Кроме того, пригодными также являются представители D-ряда полиаминокислот, а также D,L-смеси одной полиаминокислоты и D,L-смеси нескольких полиаминокислот. В случае гидрофильных полимеров предпочтительными являются глобулярные молекулы, такие как органические наночастицы, звездообразные полимеры, дендримеры и/или высокоразветвленные полимеры. В случае минералов предпочтительными являются карбонаты, хлораты, фосфаты и сульфаты катионов натрия, кальция, калия и/или магния. Для создания пористой структуры эти компартменты затем удаляют из полисульфоновой матрицы. В результате остается трехмерная структура с предопределенной степенью пористости, которая затем может быть "заполнена" активным агентом. Далее кратко описаны три предпочтительные системы создания пористой структуры на основе аддитивных классов полимера, минерала и воды. Система 1. Полимер. В качестве полимерных добавок используют, например, специальные высокоразветвленные полиэфиры с термически нестабильными триазеновыми группами в главной цепи. Молекулярно диспергированный высокоразветвленный полимер интегрован в полисульфоновую матрицу. В результате последующей термической обработки системы высокоразветвленный порообразователь разлагается на летучие продукты разложения с образованием соответствующего нанопористого полимерного слоя. Полисульфоны отличаются, среди прочего, своей температурной стабильностью и стабильностью размеров, благодаря чему эта стратегия безусловно применима. Более того, такую термическую обработку можно сочетать со стадией стерилизации, что дает в результате эффективный метод. Система 2. Минерал. В качестве минеральной добавки применяют физиологически безвредное соединение - карбонат кальция. Полисульфоновая матрица состоит из двойных гидрофильных блок-сополимеров. Эти двойные гидрофильные блок-сополимеры содержат гидрофильный блок, который не взаимодействует с минеральной добавкой, и второй полиэлектролитный блок, который в значительной степени взаимодействует с поверхностями минеральной добавки. Эти блок-сополимеры оказывают модифицирующее рост воздействие при кристаллизации кальция карбоната. Получающиеся в результате минеральные компартменты имеют приблизительно овальную, штангообразную или сферическую форму. Благодаря исключительной устойчивости полисульфонов к действию агрессивных химических средств, а также устойчивости к гидролизу, минеральные добавки могут быть полностью удалены в кислотной бане. В результате остается требуемая нанопористая структура полисульфоновой матрицы. Система 3. Вода. В качестве жидкой добавки вода рассматривается как самое простое решение в случае покрытия медицинского продукта полярными активными агентами. При использовании метода опрыскивания по-7 011822 лисульфон находится в органическом растворителе, таком как, например, хлороформ. Хлороформный раствор, насыщенный полисульфоном, только условно способен к дополнительному приему активного агента. Таким образом, активный агент растворяется главным образом в водной фазе, которая, благодаря разделению фаз, образует компартменты после нанесения на поверхность медицинского продукта. Впоследствии воду из этих компартментов можно полностью удалить из системы посредством, например,сушки вымораживанием. В результате остаются нанопористые структуры, нагруженные активным агентом. Концентрация активного агента в порах может быть увеличена на последующих стадиях с помощью активного агента, растворенного в воде, и предпочтительно с последующей сушкой вымораживанием. В способах, существующих до настоящего времени, активный агент также растворяли вместе с полисульфоном в хлороформе. Последующее увеличение концентрации активного агента также осуществляли из хлороформного раствора. Так как хлороформ никоим образом не может быть удален из слоя на 100%,хлороформ все больше и больше концентрируется в окончательном продукте, что вызывает неблагоприятное воздействие на пациента. При использовании воды в качестве субстрата для активного агента, хлороформ используют только один раз для нанесения полисульфоновой матрицы и его воздействие снижается до минимума. Для приготовления распыляемого раствора, содержащего по меньшей мере один полисульфон и по меньшей мере один антипролиферативный, противовоспалительный, антифлогистический и/или антитромботический активный агент, пригодны дополнительные предпочтительные растворители, которые легко выпариваются, т.е. являются летучими, например хлороформ, дихлорметан, тетрагидрофуран, ацетон, метанол, этанол, изопропанол, диэтиловый эфир и этилацетат, и которые, кроме того, могут быть насыщены водой или могут быть приготовлены с определенным содержанием воды. Приемлемым является содержание воды от 1,6 до 15%, предпочтительно от 2,1 до 10%, более предпочтительно от 2,6 до 7,9% и особенно предпочтительно от 3,3 до 6,8%. Кроме того, предпочтительно, чтобы органический растворитель, вода, полисульфон и активный агент образовывали гомогенный раствор. Посредством создания сополимеров также можно варьировать гидрофильность или, соответственно, гидрофобность полисульфона. Так, например, возможно синтезировать полисульфоновые сополимеры с помощью 4,4'-бис-(гидроксифенил)пентановой кислоты (ВРА) так, чтобы таким образом вводить карбоксильные боковые группы, которые понижают гидрофобность полисульфоновой матрицы. Кроме того, теперь возможно дериватизировать введенные функциональные группы, например карбоксильную группу (Macrom. Chem. Phys. 195 (1994), 1709; Coll. Polym. Sci. 279 (2001), 727). Благодаря возможности образования по меньшей мере двух слоев полимера, который варьируется по своему составу, а также варьирования добавок, можно дополнительно осуществить зависящую от слоя дифференциацию в отношении применяемых активных агентов, а также в отношении концентрации. Такая адаптивность отличает полисульфоновую матрицу как универсально применимый биологически стабильный покрывающий материал для предотвращения рестеноза. Также предпочтительным является применение термопластичных полисульфонов. Термопластичные полисульфоны могут быть пластично деформированы (пластичный) под воздействием тепла (термо). Как правило, термопластичные полисульфоны состоят из линейных или менее разветвленных молекулярных цепей. При нагревании они могут удлиняться путем растяжения. При дальнейшем нагревании они могут быть полностью расплавлены и восстановлены. В частности предпочтительно, чтобы эти термопластичные полисульфоны обладали гидрофильными, а также гидрофобными свойствами. Такие термопластичные полисульфоны, обладающие этими амбивалентными свойствами, можно синтезировать описанными выше способами посредством полимераналогичных реакций, блок-сополимеризаций или полимеризации гидрофильных мономеров с гидрофобными. Полученные таким образом термопластичные полимеры или, соответственно, покрытые ими медицинские продукты отличаются многократной стерилизуемостью, устойчивостью к горячему пару и гидролизу, высокой стабильностью размеров, устойчивостью к действию агрессивных химических реагентов, а также хорошей стабильностью при термическом старении. Предпочтительный термопластичный полисульфон синтезируют из бисфенола А и 4,4'дихлорфенилсульфона посредством реакций поликонденсации (см. следующую ниже формулу (II. Поли[окси-1,4-фенилен-сульфонил-1,4-фениленокси(4,4'-изопропилидендифенилен)] Полисульфоны, которые применимы для покрытия по изобретению, имеют следующую общую структуру формулы (I): где n представляет собой степень полимеризации, которая лежит в диапазоне от n=10 до n=10000, предпочтительно в диапазоне от n=20 до n=3000, более предпочтительно в диапазоне от n=40 до n=1000, еще-8 011822 более предпочтительно в диапазоне от n=60 до n=500, еще более предпочтительно в диапазоне от n=80 до n=250 и особенно предпочтительно в диапазоне от n=100 до n=200. Кроме того, предпочтительно, когда n лежит в таком диапазоне, что средневесовое значение для полимера получается равным 60,000-120,000 г/моль, предпочтительно от 70,000 до 99,000 г/моль, более предпочтительно 80,000-97,000 г/моль, еще более предпочтительно 84,000-95,000 г/моль и особенно предпочтительно 86,000-93,000 г/моль. Кроме того, предпочтительно, когда n лежит в таком диапазоне, что среднечисловое значение для полимера получается в диапазоне 20,000-70,000 г/моль, предпочтительно 30,000-65,000 г/моль, более предпочтительно 32,000-60,000, еще более предпочтительно 35,000-59,000 и особенно предпочтительно 45,000-58,000 г/моль.Y и z являются целыми числами в диапазоне от 1 до 10, и R и R' независимо друг от друга означают алкиленовую группу, имеющую от 1 до 12 атомов углерода, ароматическую группу, имеющую от 6 до 20 атомов углерода, гетероароматическую группу, имеющую от 2 до 10 атомов углерода, циклоалкиленовую группу, имеющую от 3 до 15 атомов углерода, алкиленариленовую группу, имеющую от 6 до 20 атомов углерода, ариленалкиленовую группу, имеющую от 6 до 20 атомов углерода, алкиленоксигруппу,имеющую от 1 до 12 атомов углерода, ариленоксигруппу, имеющую от 6 до 20 атомов углерода, гетероариленоксигруппу, имеющую от 6 до 20 атомов углерода, циклоалкиленоксигруппу, имеющую от 3 до 15 атомов углерода, алкиленариленоксигруппу, имеющую от 6 до 20 атомов углерода, или ариленалкиленоксигруппу, имеющую от 6 до 20 атомов углерода. Вышеуказанные группы могут иметь дополнительные заместители, в частности те, которые описаны ниже как "замещенные" полисульфоны. Примерами групп R и R' являются -R1-, -R2-, -R3-, -R4-, -R5-, -R6-, -R1-R2-, -R3-R4-, -R5-R6-, -R1-R2-R3-,4-R -R5-R6-, -R1-R2-R3-R4-, -R1-R2-R3-R4-R5- и -R1-R2-R3-R4-R5-R6-; где R1, R2, R3, R4, R5 и R6 независимо друг от друга представляют собой следующие группы:-CH2-, -C2H4-, -CH(OH)-, -CH(SH)-, -CH(NH2)-, -CH(OCH3)-, -C(OCH3)2-, -CH(SCH3)-, -C(SCH3)2-,-CH(NH(CH3-, -C(N(CH3)2)-, -CH(OC2H5)-, -C(OC2H5)2-, -CHF-, -CHCl-, -CHBr-, -CF2-, -CCl2-, -CBr2-,-CH(COOH)-, -CH(COOCH3)-, -CH(COOC2H5)-, -CH(COCH3)-, -CH(COC2H5)-, -CH(CH3)-, -C(CH3)2-,-CH(C2H5)-, -C(C2H5)2-, -CH(CONH2)-, -CH(CONH(CH3-, -CH(CON(CH3)2)-,-C3H6-, -C4H8-, -C5H9-, -C6H10-, цикло-C3H4-, цикло-C3H4-, цикло-C4H6-, цикло-C5H8-, -OCH2-,-OC2H4-, -OC3H6-, -OC4H8-, -OC5H9-, -OC6H10-, -CH2O-, -C2H4O-, -C3H6O-, -C4H8O-, -C5H9O-, -C6H10O-,-NHCH2-, -NHC2H4-, -NHC3H6-, -NHC4H8-, -NHC5H9-, -NHC6H10-, -CH2NH-, -C2H4NH-, -C3H6NH-C4H8NH-, -C5H9NH-, -C6H10NH-, -SCH2-, -SC2H4-, -SC3H6-, -SC4H8-, -SC5H9-, -SC6H10-, -CH2S-, -C2H4S-,-C3H6S-, -C4H8S-, -C5H9S-, -C6H10S-,-C6H4-, -C6H3(CH3)-, -C6H3(C2H5)-, -C6H3(OH)-, -C6H3(NH2)-, -C6H3(Cl)-, -C6H3(F)-, -C6H3(Br)-,-C6H3(OCH3)-, -C6H3(SCH3)-, -C6H3(COCH3)-, -C6H3(COC2H5)-, -C6H3(COOH)-, -C6H3(COOCH3)-,-C6H3(COOC2H5)-,-C6H3(NH(CH3-,-C6H3(N(CH3)2)-,-C6H3(CONH2)-,-C6H3(CONH(CH3-,-C6H3(CON(CH3)2)-,-OC6H4-, -OC6H3(CH3)-, -OC6H3(C2H5)-, -OC6H3(OH)-, -OC6H3(NH2)-, -OC6H3(Cl)-, -OC6H3(F)-,-OC6H3(Br)-, -OC6H3(OCH3)-, -OC6H3(SCH3)-, -OC6H3(COCH3)-, -OC6H3(COC2H5)-, -OC6H3(COOH)-,-OC6H3(COOCH3)-, -OC6H3(COOC2H5)-, -OC6H3(NH(CH3-, -OC6H3(N(CH3)2)-, -OC6H3(CONH2)-,-OC6H3(CONH(CH3-, -OC6H3(CON(CH3)2)-,-C6H4O-, -C6H3(CH3)O-, -C6H3(C2H5)O-, -C6H3(OH)O-, -C6H3(NH2)O-, -C6H3(Cl)O-, -C6H3(F)O-,-C6H3(Br)O-, -C6H3(OCH3)O-, -C6H3(SCH3)O-, -C6H3(COCH3)O-, -C6H3(COC2H5)O-, -C6H3(COOH)O-,-C6H3(COOCH3)O-, -C6H3(COOC2H5)O-, -C6H3(NH(CH3O-, -C6H3(N(CH3)2)O-, -C6H3(CONH2)O-,-C6H3(CONH(CH3O-, -C6H3(CON(CH3)2)O-,-SC6H4-, -SC6H3(CH3)-, -SC6H3(C2H5)-, -SC6H3(OH)-, -SC6H3(NH2)-, -SC6H3(Cl)-, -SC6H3(F)-,-SC6H3(Br)-, -SC6H3(OCH3)-, -SC6H3(SCH3)-, -SC6H3(COCH3)-, -SC6H3(COC2H5)-, -SC6H3(COOH)-,-SC6H3(COOCH3)-,-SC6H3(COOC2H5)-,-SC6H3(NH(CH3-,-SC6H3(N(CH3)2)-,-SC6H3(CONH2)-,-SC6H3(CONH(CH3-, -SC6H3(CON(CH3)2)-,-C6H4S-, -C6H3(CH3)S-, -C6H3(C2H5)S-, -C6H3(OH)S-, -C6H3(NH2)S-, -C6H3(Cl)S-, -C6H3(F)S-,-C6H3(Br)S-, -C6H3(OCH3)S-, -C6H3(SCH3)S-, -C6H3(COCH3)S-, -C6H3(COC2H5)S-, -C6H3(COOH)S-,-C6H3(COOCH3)S-,-C6H3(COOC2H5)S-,-C6H3(NH(CH3S-,-C6H3(N(CH3)2)S-,-C6H3(CONH2)S-,-C6H3(CONH(CH3S-, -C6H3(CON(CH3)2)S-,-NH-C6H4-, -NH-C6H3(CH3)-, -NH-C6H3(C2H5)-, -NH-C6H3(OH)-, -NH-C6H3(NH2)-, -NH-C6H3(Cl)-,-NH-C6H3(F)-, -NH-C6H3(Br)-, -NH-C6H3(OCH3)-, -NH-C6H3(SCH3)-, -NH-C6H3(COCH3)-, -NHC6H3(COC2H5)-, -NH-C6H3(COOH)-, -NH-C6H3(COOCH3)-, -NH-C6H3(COOC2H5)-, -NH-C6H3(NH(CH3-,-NH-C6H3(N(CH3)2)-, -NH-C6H3(CONH2)-, -NH-C6H3(CONH(CH3-, -NH-C6H3(CON(CH3)2)-, -C6H4-NH-,-C6H3(CH3)-NH-, -C6H3(C2H5)-NH-, -C6H3(OH)-NH-, -C6H3(NH2)-NH-, -C6H3(Cl)-NH-, -C6H3(F)-NH-,-C6H3(Br)-NH-,-C6H3(OCH3)-NH-,-C6H3(SCH3)-NH-,-C6H3(COCH3)-NH-,-C6H3(COC2H5)-NH-,-C6H3(COOH)-NH-, -C6H3(COOCH3)-NH-, -C6H3(COOC2H5)-NH-, -C6H3(NH(CH3-NH-, -C6H3(N(CH3)2)NH-, -C6H3(CONH2)-NH-, -C6H3(CONH(CH3-NH-, -C6H3(CON(CH3)2)-NH-. Особенно предпочтительными являются полисульфоны и их смеси, где группы -R1-, -R2-, -R3-, -R1-9 011822R2-, -R1-R2-R3- независимо друг от друга представляют собой следующие группы: -C6H4O-, -C(CH3)2-,-C6H4-, -C6H4SO2-, -SO2C6H4-, -OC6H4- и -C6H4O-C(CH3)2-C6H4-.R и R' независимо друг от друга также могут предпочтительно представлять собой группировку, которая связана с сульфоновой группой в формулах (II)-(XV). Согласно изобретению полисульфон или полисульфоны, соответственно, для биологически стабильного слоя или биологически стабильных слоев выбирают из группы, включающей: полиэфирсульфон, замещенный полиэфирсульфон, полифенилсульфон, замещенный полифенилсульфон, полисульфоновые блок-сополимеры, перфорированные полисульфоновые блок-сополимеры, полуфторированные полисульфоновые блок-сополимеры, замещенные полисульфоновые блок-сополимеры и/или смеси вышеуказанных полимеров. Термин "замещенные" полисульфоны следует понимать как полисульфоны, которые имеют функциональные группы. В частности, метиленовые звенья могут иметь один или два заместителя, а фениленовые звенья - один, два, три или четыре заместителя. Примерами таких заместителей (также именуемых как X, X', X", X"') являются -OH, -OCH3, -OC2H5, -SH, -SCH3, -SC2H5, -NO2, -F, -Cl, -Br, -I, -N3, -CN,-OCN, -NCO, -SCN, -NCS, -CHO, -COCH3, -COC2H5, -COOH, -COCN, -COOCH3, -COOC2H5, -CONH2,-CONHCH3, -CONHC2H5, -CON(CH3)2, -CON(C2H5)2, -NH2, -NHCH3, -NHC2H5, -N(CH3)2, -N(C2H5)2,-SOCH3, -SOC2H5, -SO2CH3, -SO2C2H5, -SO3H, -SO3CH3, -SO3C2H5, -OCF3, -O-COOCH3, -O-COOC2H5,-NH-CO-NH2, -NH-CS-NH2, -NH-C(=NH)-NH2, -O-CO-NH2, -NH-CO-OCH3, -NH-CO-OC2H5, -CH2F, -CHF2,-CF3, -CH2Cl, -CHCl2, -CCl3, -CH2Br, -CHBr2, -CBr3, -CH2I, -CHI2, -Cl3, -CH3, -C2H5, -C3H7, -CH(CH3)2,-C4H9, -CH2-CH(CH3)2, -CH2-COOH, -CH(CH3)-C2H5, -C(CH3)3, -H. Другими предпочтительными заместителями функциональных групп являются -CH2-X и -C2H4-X. Следующие общие структурные формулы представляют собой предпочтительные повторяющиеся звенья полисульфонов. Предпочтительно полимеры состоят только из этих повторяющихся звеньев. Однако возможно также, чтобы в одном полимере кроме показанных повторяющихся звеньев присутствовали также другие повторяющиеся звенья или блоки. Предпочтительными являютсяX, X', n и R' независимо друг от друга имеют вышеуказанное значение.X, X', n и R' независимо друг от друга имеют вышеуказанное значение. Кроме того, предпочтительными являются полисульфоны следующей общей формулы (X):X, X' и n независимо друг от друга имеют вышеуказанное значение. Кроме того, предпочтительными являются следующие повторяющиеся звенья:X, X', X", X'" и n независимо друг от друга имеют вышеуказанное значение.R" и R'" могут независимо друг от друга представлять собой заместитель, как он определен для X или X', либо могут независимо друг от друга представлять собой группу -R1-H или -R2-H. Другое предпочтительное повторяющееся звено имеет циклический заместитель между двумя ароматическими кольцами, например, как в формуле (XIV) или (XV)R" предпочтительно представляет собой -CH2-, -OCH2-, -CH2O-, -O-, -C2H4-, -C3H6-, -CH(OH)-. Группа -R-R"- предпочтительно представляет собой циклический сложный эфир, амид, карбонат, мочевину или уретан, например -O-CO-O-, -O-CO-O-CH2-, -O-CO-O-C2H4-, -CH2-O-CO-O-CH2-, -C2H4-, -C3H6-,-C4H8-, -C5H10-, -C6H12-, -O-CO-NH-, -NH-CO-NH-, -O-CO-NH-CH2-, -O-CO-NH-C2H4-, -NH-CO-NH-CH2-,-NH-CO-NH-C2H4-, -NH-CO-O-CH2-, -NH-CO-O-C2H4-, -CH2-O-CO-NH-CH2-, -C2H4-SO2-, -C3H6-SO2-,-C4H8-SO2-, -C2H4-SO2-CH2-, -C2H4-SO2-C2H4-, -C2H4-O-, -C3H6-O-, -C4H8-O-, -C2H4-O-CH2-, -C2H4-O-C2H4-,-C2H4-CO-, -C3H6-CO-, -C4H8-CO-, -C2H4-CO-CH2-, -C2H4-CO-C2H4-, -O-CO-CH2-, -O-CO-C2H4-, -O-COC2H2-, -CH2-O-CO-CH2- или циклические сложные эфиры, которые содержат ароматическое кольцо. Далее будут описаны полимераналогичные реакции, которые известны специалисту в данной области и могут служить для модификации полисульфонов. Посредством использования формальдегида, ClSiMe3 и катализатора, такого как SnCl4, в качестве группировок X и X' могут быть введены хлорметиленовые группы, которые затем могут быть дополнительно замещены. Посредством нуклеофильного замещения с помощью этих реакций могут быть введены, например, гидроксильные группы, аминогруппы, карбоксилатные группы, простые эфирные или алкильные группы, которые связаны с ароматической частью посредством метиленовой группы. В результате взаимодействия с алкоголятами, такими как, например, фенолят, бензилат, метанолят, этанолят,пропанолят или изопропанолят, получают полимер, в котором происходит замещение более чем 75% хлорметиленовых групп. Получают следующий полисульфон с липофильными боковыми группами: где R представляет собой, например, алкильную группировку или арильную группировку. Группировки X" и X'", если они еще не присутствуют в мономерах, могут быть введены в полимер посредством следующей реакции: Кроме сложноэфирной группы могут быть введены различные другие заместители путем сначала осуществления одинарного или двойного депротонирования с помощью сильного основания, например н-BuLi или трет-BuLi, а затем добавлением электрофила. В вышеуказанном примере для введения сложноэфирной группы добавляют диоксид углерода, и на другой стадии полученную углекислотную группу этерифицируют. Комбинацию по изобретению полисульфона с липофильными группировками и полисульфона с липофобными группировками получают, например, путем использования полисульфона формулы (IIB) вместе с полисульфоном формулы (IIC). Количественные соотношения обоих полисульфонов друг к другу могут варьироваться от 98:2% до 2:98%. Предпочтительные соотношения составляют 10% к 90%, 15% к 85%, 22% к 78% и 27% к 73%, 36% к 64%, 43% к 57% и 50% к 50%. Эти процентные значения применимы для любой комбинации гидрофильных и гидрофобных полисульфонов и не ограничены вышеупомянутой смесью. Пример полисульфона с гидрофильными и гидрофобными группировками в одной молекуле может быть получен, например, путем неполной эстерификации полисульфона формулы (IIC), и таким образом,в одной молекуле присутствуют гидрофильные карбоксилатные группы и гидрофобные сложноэфирные группы. Мольное соотношение (число) карбоксилатных групп к сложноэфирным группам может составлять от 5:95% до 95:5%. Эти процентные значения применимы для любой комбинации гидрофильных и гидрофобных групп и не ограничены вышеупомянутыми. Предполагается, что при помощи такой комбинации по изобретению гидрофильных групп или, соответственно, полимеров с гидрофобными группами или, соответственно, полимеров, на медицинском продукте создаются аморфные полимерные слои. Очень важно, что полимерные слои, изготовленные из полисульфона, не являются кристаллическими или в основном кристаллическими, поскольку кристалличность приводит к жестким слоям, которые начинают ломаться и отделяться. Гибкие полисульфоновые покрытия, служащие барьерным слоем, могут быть получены только из аморфных или в основном аморфных полисульфоновых слоев. Конечно, возможно также применять мономеры, которые уже соответствующим образом замещены, для получения желаемого замещения после осуществления полимеризации. Соответствующие полимеры затем получают известным способом согласно следующей реакционной схеме: где L и L' независимо друг от друга представляют собой, например, следующие группы: -SO2-, -C(CH3)2-,-C(Ph)2- или -О-. L и L' могут, таким образом, иметь значения соответствующих групп в формулах (I)(XV). Такие реакции нуклеофильного замещения, проиллюстрированные в качестве примера вышеприведенной схемой, известны специалисту в данной области. Как уже упоминалось, особенно предпочтительно, чтобы полимеры обладали гидрофильными и гидрофобными свойствами, с одной стороны, в пределах одного полимера и, с другой стороны, путем использования по меньшей мере одногогидрофильного полимера в комбинации по меньшей мере с одним гидрофобным полимером. Так, предпочтительно, чтобы, например, X и X' имели гидрофильные заместители, а X" и X'" имели гидрофобные заместители, или наоборот. В качестве гидрофильных заместителей могут быть использованы -OH, -CHO, -COOH, -COO-,-CONH2, -NH2, -N+(CH3)4, -NHCH3, -SO3H, -SO3-, -NH-CO-NH2, -NH-CS-NH2, -NH-C(=NH)-NH2, -O-CONH2 и частично протонированные аминогруппы. В качестве гидрофобных заместителей могут быть использованы -H, -OCH3, -OC2H5, -SCH3, -SC2H5,-NO2, -F, -Cl, -Br, -I, -N3, -CN, -OCN, -NCO, -SCN, -NCS, -COCH3, -COC2H5, -COCN, -COOCH3,-COOC2H5, -CONHC2H5, -CON(CH3)2, -CON(C2H5)2, -NHC2H5, -N(CH3)2, -N(C2H5)2, -SOCH3, -SOC2H5,-SO2CH3, -SO2C2H5, -SO3CH3, -SO3C2H5, -OCF3, -O-COOCH3, -O-COOC2H5, -NH-CO-OCH3, -NH-COOC2H5, -CH2F, -CHF2, -CF3, -CH2Cl, -CHCl2, -CCl3, -CH2Br, -CHBr2, -CBr3, -CH2I, -CHI2, -Cl3, -CH3, -C2H5,-C3H7, -CH(CH3)2, -C4H9, -CH2-CH(CH3)2, -CH2-COOH, -CH(CH3)-C2H5, -C(CH3)3. Кроме того, предпочтительными являются циклические полисульфоны, которые, например, имеют структуру, изображенную формулой (XVI) Карбоксиэтиленовая группа не является существенной для вышеуказанной реакции, приведенной в качестве примера. Вместо карбоксиэтиленовых и метильных заместителей могут присутствовать любые другие заместители или также водород. Полисульфоны характеризуются высокой устойчивостью к действию агрессивных химических реа- 14011822 гентов, они устойчивы к гидролизу и нагреву, и обладают очень хорошими механическими и трибологическими (отсутствие поверхностного изнашивания) свойствами. В качестве дополнительных важных свойств для материала, используемого в живом организме, можно особо подчеркнуть высокую стабильность размера и многократную стерилизуемость. Полисульфоны уже в течение длительного времени используются в качестве медицинских полимеров. Основное применение сконцентрировано на полых волокнах, например, в приборах для диализа крови, где на мировом рынке лидируют полисульфоновые волокна от компании Fresenius, благодаря их хорошей гемосовместимости и мембранообразующим свойствам. Таким образом, проблема диализа состоит главным образом в необходимости введения во время диализа антикоагулянта, как правило, гепарина, побочные эффекты которого усиливаются после пары лет. В процессе пятичасовой обработки через прибор для диализа проходит приблизительно 75 л крови,что эквивалентно приблизительно 15-кратному количеству крови, имеющемуся у пациента. Поэтому понятно, что мембрана должна соответствовать очень высоким требованиям гемосовместимости. Другой обширной областью является использование полисульфоновых капилляров в офтальмологии и в форме плоских мембран в различных медицинских технологических вспомогательных средствах. Предпочтительно, чтобы к полисульфону, используемому для биологически стабильного слоя, был добавлен по меньшей мере один гидрофильный полимер. Таким образом, в соответствующем полисульфоновом слое соотношение полисульфона к гидрофильному полимеру может составлять от 50% к 50% по массе вплоть до 99,999% к 0,001% по массе. В качестве пригодных гидрофильных полимеров предпочтительно используют поливинилпирролидон, глицерин, полиэтиленгликоль, полипропиленгликоль, поливиниловый спирт, полигидроксиэтилметакрилаты, полиакриламид, поливалеролактоны, полидекалактоны, полимолочную кислоту, полигликолевую кислоту, полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, поли-капролактон, полигидроксибутановую кислоту, полигидроксибутираты, полигидроксивалераты, сополимеры полигидроксибутират-валераты, поли(1,4-диоксан-2,3-дионы), поли(1,3-диоксан-2-оны), полипарадиоксаноны, полиангидриды, такие как полималеиновые ангидриды, фибрин, полицианоакрилаты, поликапролактондиметилакрилаты, поли-b-малеиновую кислоту, поликапролактона бутилакрилаты, мультиблок-полимеры, например из олигокапролактандиолов и олигодиоксандиолов, полиэфирные сложноэфирные мультиблок-полимеры, такие как PEG (полиэтиленгликоль) и полибутилентерефталат, полипивотолактоны, триметилкарбонаты полигликолевой кислоты, поликапролактонгликолиды, поли-gэтилглутамат,поли(DTH-иминокарбонат),поли(DTE-со-DT-карбонат),поли(бисфенол-Аиминокарбонат), полиортоэфиры, триметилкарбонаты полигликолевой кислоты, политриметилкарбонаты, полииминокарбонаты, поли(N-винил)пирролидон, поливиниловые спирты, полиэфирамиды, гликолированные полиэфиры, полифосфоэфиры, полифосфазены, поли[(паракарбоксифенокси)пропан], полигидроксипентановую кислоту, полиангидриды, полиэтиленоксид-пропиленоксид, мягкие полиуретаны,полиуретаны с аминокислотными остатками в основной цепи, полимеры, содержащие простую эфирную и сложную эфирную связь, такие как полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, а также их сополимеры, липиды, каррагенаны, фибриноген, крахмал, коллаген, полимеры на основе белков, полиаминокислоты, синтетические полиаминокислоты, зеин, модифицированный зеин, полигидроксиалканоаты, пектиновую кислоту, актиновую кислоту, модифицированный и немодифицированный фибрин и казеин, карбоксиметилсульфат, альбумин, гиалуроновую кислоту, хитозан и его производные, хондроитинсульфат, декстран, b-циклодекстрины, сополимеры с PEG и полипропиленгликолем, гуммиарабик,гуар, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, фосфолипиды, модификации и сополимеры и/или смеси вышеупомянутых веществ, поливинилпирролидон, полиэтиленгликоль и глицерин. Например, для повышения вязкости при получении раствора полисульфона добавляют поливинилпирролидон (PVP), который растворяется в осадителе в процессе изготовления полых волокон, и соответственно опять удаляют. Конечное пористое полое волокно все же в среднем содержит PVP в количестве 1-2%. Добавление поливинилпирролидона не только благоприятно влияет на вязкость в процессе производства, то есть повышает вязкость, но также является фактором, соопределяющим размер пор полисульфона и таким образом имеет решающее значение для свойств проницаемости конечного продукта,поскольку они зависят от размера пор и размера частиц. Таким образом, размер пор, и соответственно проницаемость получаемого полисульфона, можно регулировать посредством количества и молекулярной массы примешиваемого поливинилпирролидона. Биосовместимость и хорошие механические свойства полисульфона, и возможность регулирования размера пор путем добавления поливинилпирролидона и/или другого гидрофильного полимера и/или воды (этилацетата) делает этот полимер идеальным субстратом для всех фармацевтических средств, который может применяться для нацеленного локального применения, например, в кардиологии для предупреждения повторной закупорки кровеносных сосудов. Одновременно, включенный азот обеспечивает сохраняемость активного агента. Предпочтительное количество добавленного полимера находится в диапазоне от 0-50% по массе, более предпочтительными являются 1-20% по массе, особенно предпочтительны 2-10% по массе. Добавленное количество по существу согласуется с желаемой скоростью элюирования применяемого активного агента.- 15011822 Медицинские продукты по изобретению имеют поверхность, которая может быть изготовлена из любого материла. Эта поверхность предпочтительно не является гемосовместимой. Кроме того, эта поверхность предпочтительно не имеет покрытия, особенно не имеет покрытия из полимеров и/или органических макромолекул. Биологически стабильный полисульфоновый слой может быть связан с этой поверхностью адгезионно или ковалентно, а также частично адгезионно и частично ковалентно. Предпочтительным является ковалентное связывание. Полисульфоновый слой покрывает поверхность медицинского продукта по меньшей мере частично, однако, предпочтительно полностью. Если медицинский продукт представляет собой стент, то, по меньшей мере, поверхность, подвергающаяся воздействию крови, покрыта полисульфоном. Предпочтительно по меньшей мере один слой, содержащий по меньшей мере один антипролиферативный, противовоспалительный, антифлогистический и/или антитромботический активный агент, может быть нанесен и/или введен на в этот первый биологически стабильный полисульфоновый слой,и/или в этот первый полисульфоновый слой. По меньшей мере один слой, содержащий по меньшей мере один антипролиферативный, противовоспалительный, антифлогистический и/или антитромботический активный агент, может полностью состоять из одного или более активных агентов или может присутствовать другой биологически стабильный полисульфоновый слой, в котором локализован(ы) активный агент или активные агенты, либо может присутствовать гемосовместимый слой, в котором локализован(ы) активный агент или активные агенты. В то время как гидрофобные активные агенты могут быть нанесены в и/или на биологически стабильный слой, и/или под него, гидрофильные активные агенты предпочтительно нанесены на биологически стабильный слой и/или под него. Таким образом, медицинские продукты по изобретению могут иметь поверхности, покрытые одним, двумя, тремя или более слоями, причем один, два или три слоя, а особенно два слоя, являются предпочтительными. Антипролиферативный(е), противовоспалительный(е), антифлогистический(е) и/или антитромботический(е) активный(е) агент(ы) может(гут) быть связан(ы) с соответствующим слоем адгезионно или ковалентно, либо частично адгезионно и частично ковалентно, причем адгезионное связывание является предпочтительным. В случае если поверхностное покрытие имеет большее количество биологически стабильных полисульфоновых слоев, и/или гемосовместимых слоев, и/или слоев с активными агентами, каждый из этих слоев может состоять из разных полисульфонов с разными гидрофильными полимерами и разными количествами гидрофильных полимеров, а также разными гемосовместимыми соединениями или разными активными агентами. Также предпочтительно, чтобы медицинский продукт имел поверхность, содержащую гемосовместимый слой, который нанесен или введен на, или в, самый нижний первый биологически стабильный полисульфоновый слой. Такой гемосовместимый слой может также образовывать второй или третий слой, который непосредственно или опосредованно лежит на самом нижнем биологически стабильном слое, и/или на, или под слоем с активным агентом, или вторым биологически стабильным полисульфоновым слоем. Также предпочтительно, чтобы гемосовместимый слой образовывал самый нижний слой, и чтобы на этом слое мог находиться активный агент, покрытый в свою очередь биологически стабильным полисульфоновым слоем, или чтобы биологически стабильный полисульфоновый слой с активным агентом или комбинацией активных агентов был нанесен на самый нижний гемосовместимый слой. Этот гемосовместимый слой предпочтительно состоит из полностью десульфированного и Nреацетилированного гепарина, десульфированного и N-реацетилированного гепарина, Nкарбоксиметилированного, частично N-ацетилированного хитозана и/или смесей этих веществ. Гемосовместимый слой может кроме вышеупомянутых веществ содержать другие гемосовместимые органические вещества, но предпочтительно состоит только из вышеупомянутых веществ. Что касается медицинских продуктов по изобретению, то предпочтительно, чтобы присутствовал единственный гемосовместимый слой. Кроме того, предпочтительно, чтобы этот единственный гемосовместимый слой образовывал наружный или самый нижний слой. Кроме того, предпочтительно, чтобы слой полностью покрывал расположенную ниже поверхность или расположенный ниже слой, но при этом также возможно частичное покрытие. Кроме того, особенно предпочтительно, чтобы медицинский продукт по изобретению представлял собой стент. Этот стент может быть изготовлен из любого материала или смесей материалов. Предпочтительными являются металлы и пластмассы, такие как, например, медицинская нержавеющая сталь,титан, хром, ванадий, вольфрам, молибден, золото и нитинол. Стент предпочтительно не имеет покрытия, и/или не является гемосовместимым, или является только условно гемосовместимым. В частности,стент не имеет покрытия, изготовленного из органического материала. Медицинские проволоки могут быть исключены из числа медицинских продуктов. Такие стенты по изобретению предпочтительно снабжены по меньшей мере одним биосовместимым слоем биологически стабильного полисульфона, покрывающим стент полностью или не полностью,с определенной долей гидрофильного полимера или без него, и по меньшей мере с одним антипролифе- 16011822 ративным, противовоспалительным, антифлогистическим и/или антитромботическим активным агентом. Таким образом, активный агент может присутствовать в матрице и/или покрывать матрицу в виде второго слоя. В данном контексте второй слой понимают как слой, нанесенный на первый слой, и т. д. В другом предпочтительном воплощении стенты по изобретению имеют покрытие, которое состоит из по меньшей мере двух полисульфоновых слоев. Согласно этому двухслойному дизайну, первый слой состоит из слоя, который покрыт по существу полностью другим биологически стабильным слоем с таким же или другим размером пор. Один или оба слоя содержат по меньшей мере один антипролиферативный, противовоспалительный, антифлогистический и/или антитромботический активный агент. Также используются комбинации активных агентов, которые взаимно содействуют друг другу и/или дополняют друг друга в осуществляемом ими воздействии. Исходя из такого двухслойного дизайна, имеется возможность включать разные активные агенты отдельно друг от друга в слой, который соответственно подходит для соответствующего активного агента, так что, например, гидрофобный активный агент локализован в слое, который является более гидрофильным, и имеет другую кинетику элюирования по сравнению с другим гидрофобным активным агентом, который локализован в более гидрофобном полимерном слое, или наоборот. Это предоставляет широкие возможности в установлении определенной рациональной последовательности в доступности активных агентов, а также в регуляции времени элюирования и концентрации. В другом предпочтительном воплощении стенты по изобретению имеют покрытие, которое состоит по меньшей мере из трех слоев. Согласно этому трехслойному дизайну первый слой состоит из слоя, который по существу полностью или не полностью покрыт другим вторым слоем чистого активного агента или комбинаций активных агентов, который в свою очередь покрыт третьим биологически стабильным полисульфоновым слоем с таким же или другим размером пор. Полисульфоновые слои содержат либо не содержат активного агента, либо один или оба представляют собой матрицы для по меньшей мере одного антипролиферативного, противовоспалительного, антифлогистического и/или антитромботического активного агента. Также используются комбинации активных агентов, которые взаимно содействуют друг другу и/или дополняют друг друга в воздействии. Это воплощение особенно подходит для применения гидрофильных активных агентов или комбинаций активных агентов в форме слоя чистого активного агента. Вышерасположенный биологически стабильный полимерный слой с определенным содержанием гидрофильного полимера служит для регулируемого элюирования активного агента. Результатом комбинирования активного агента по меньшей мере с одним гидрофильным активным агентом являются разные кинетики элюирования. В качестве верхнего покрытия также можно использовать гидрофильный полимер, который может быть смешан с полисульфоном, который также расположен ниже. Биосовместимое покрытие стента обеспечивает необходимую гемосовместимость, и вследствие активного агента (или комбинация активных агентов), равномерно распределенного по всей поверхности стента, нарастание на поверхность стента клеток, в частности гладкомышечных клеток и эндотелиальных клеток, происходит регулируемым образом. Таким образом, не происходит быстрого нарастания клеток или чрезмерного роста клеток на поверхности стента, которое могло бы привести к рестенозу; однако, высокая концентрация лекарственного средства не предотвращает полностью нарастание клеток на поверхность стента, что влечет за собой опасность тромбоза. Таким образом, применение полисульфона обеспечивает возможность высвобождения активного агента или комбинации активных агентов, адгезионно связанных с нижележащим слоем и/или адгезионно включенных в слой, непрерывно и небольшими дозами, так что предотвращается не нарастание клеток на поверхность стента, а чрезмерный рост клеток. Такая комбинация обоих эффектов придает стенту по изобретению способность быстро врастать в стенку сосуда и снижает риск рестеноза, а также риск тромбоза. Высвобождение активного агента или активных агентов продолжается в течение периода времени от 1 до 24 месяцев, предпочтительно от более чем 1 до 12 месяцев после имплантации, особенно предпочтительно от 1 до 3 месяцев после имплантации. Высвобождение активного агента может быть адаптировано путем регуляции размера пор посредством добавления поливинилпирролидона или аналогичного гидрофильного полимера таким образом,чтобы индивидуальные характеристики активного агента, скорость элюирования, а также его фармакологическая кинетика и, в случае более чем одного активного агента, также последовательность элюирования могли соответствовать выдвигаемым требованиям. В качестве активных агентов используют антипролиферативные вещества, антифлогистические, а также антитромботические агенты. В качестве антипролиферативных активных агентов, предпочтительно цитостатиков, используют макролидные антибиотики и/или статины. Приемлемыми антипролиферативными агентами являются сиролимус (рапамицин), эверолимус, пимекролимус, соматостатин, такролимус, рокситромицин, дунаимицин (dunaimycin), аскомицин, бафиломицин, эритромицин, мидекамицин, джозамицин, конканамицин, кларитромицин, тролеандомицин, фолимицин, церивастатин, симвастатин, ловастатин, флувастатин, розувастатин, аторвастатин, правастатин, питавастатин, винбластин,винкристин, виндезин, винорелбин, этопозид, тенипозид, нимустин, кармустин, ломустин, циклофосфамид, 4-гидроксициклофосфамид, эстрамустин, мелфалан, бетулиновая кислота, камптотецин, лапахол, - 17011822 лапахон, подофиллотоксин, бетулин, трофосфамид, подофилловой кислоты 2-этилгидразид, ифосфамид,хлорамбуцил, бендамустин, дакарбазин, бусульфан, прокарбазин, треосульфан, темозоломид, тиотепа,даунорубицин, доксорубицин, акларубицин, эпирубицин, митоксантрон, идарубицин, блеомицин, митомицин, дактиномицин, метотрексат, флударабин, флударабин-5'-дигидрофосфат, мофебутазон, ацеметацин, диклофенак, лоназолак, дапсон, ортокарбамоилфеноксиуксусная кислота, лидокаин, кетопрофен,мефенамовая кислота, пироксикам, мелоксикам, хлорохина фосфат, пеницилламин, гидроксихлорохин,ауранофин, натрия ауротиомалат, оксацепрол, целекоксиб, -ситостерин, адеметионин, миртекаин, полидоканол, нонивамид, левоментол, бензокаин, аэсцин, кладрибин, меркаптопурин, тиогуанин, цитарабин,фторурацил, гемцитабин, капецитабин, доцетаксел, карбоплатин, цисплатин, оксалиплатин, амсакрин,иринотекан, топотекан, гидроксикарбамид, милтефосин, пентостатин, алдеслейкин, третиноин, аспарагиназа, пэгаспаргаза, анастрозол, экземестан, летрозол, форместан, аминоглутетимид, адриамицин, азитромицин, спирамицин, цефарантин, ингибитор пролиферации гладкомышечных клеток типа 2w, эпотилон А и В, митоксантрон, азатиоприн, микофенолата мофетил, с-myc-антисмысловой, b-mycантисмысловой селектин (антагонист цитокина), ингибитор СЕТР (белка-переносчика эфиров холестерина), кадхерины, ингибиторы цитокининов, ингибитор СОХ-2 (циклооксигеназы 2), NFB (ядерный фактор каппа-В), ангиопептин, ципрофлоксацин, камптотецин, флуробластин, моноклональные антитела,которые ингибируют пролиферацию мышечных клеток, антагонисты bFGF (щелочного фактора роста фибробластов), пробукол, простагландины, фолиевая кислота и ее производные, витамины В-ряда, производные витамина D, такие как кальципотриол и такальцитол, тимозин -1, фумаровая кислота и ее производные, такие как диметилфумарат, ингибитор IL-1, колхицин, доноры NO, такие как пентаэритритола тетранитрат и синдноеимины (syndnoeimines), S-нитрозо-производные, тамоксифен, стауроспорин, -эстрадиол, -эстрадиол, эстрон, эстриол, этинилэстрадиол, фосфестрол, медроксипрогестерон,эстрадиола ципионаты, эстрадиола бензоаты, траниласт, камебакаурин и другие терпеноиды, которые применяются в терапии рака, верапамил, ингибиторы тирозинкиназы (тирфостины), циклоспорин А,паклитаксел и его производные (6 гидроксипаклитаксел, баккатин, таксотер и другие), синтетические макроциклические олигомеры субоксида углерода (MCS) и его производные, а также олигомеры, полученные из природных источников, молграмостим (rhuGM-CSF), пэгинтерферон -2b, ленограстим (rHuG-CSF), филграстим, макрогол, дакарбазин, басиликсимаб, даклизумаб, эллиптицин, D-24851 (Calbiochem), колцемид, цитохалазин А-Е, инданоцин, нокодазол, белок S-100, PI-88, меланоцитстимулирующий гормон (-MSH), бацитрацин, антагонисты рецептора витронектина, азеластин, стимулятор гуанидилциклазы, тканевый ингибитор металлопротеиназы-1 и -2, свободные нуклеиновые кислоты, нуклеиновые кислоты, встроенные в вирусные трансмиттеры, фрагменты ДНК и РНК, ингибитор-1 активатора плазминогена, ингибитор-2 активатора плазминогена, антисмысловые олигонуклеотиды, ингибиторы VEGF (фактор роста эндотелия сосудов), именуемые IGF-1 (инсулиноподобный фактор роста). Из группы антибиотиков также применимы цефадроксил, цефазолин, цефаклор, цефотаксим, тобрамицин, гентамицин. Положительное влияние на послеоперационной фазе оказывают также пенициллины,такие как диклоксациплин, оксациллин, сульфонамиды, метронидазол, антитромботические средства,такие как аргатробан, аспирин, абциксимаб, синтетический антитромбин, бивалирудин, кумадин, эноксапарин, hemoparin (десульфатированный и N-реацетилированный гепарин), тканевый активатор плазминогена, тромбоцитарный мембранный рецептор GpIIb/IIIa, ингибитор фактора Ха, активированный протеин С, антитела, гепарин, гирудин, r-гирудин, PPACK (D-фенилаланил-L-пролил-L-аргининхлорметилкетон), протамин, проурокиназа, стрептокиназа, варфарин, урокиназа, вазодилататоры, такие как дипирамидол, триазолопиримидин (trapidil), нитропруссиды, антагонисты PDGF (тромбоцитарного фактора роста), такие как триазолопиримидин и серамин, ингибиторы АСЕ (ангиотензинпревращающего фермента), такие как каптоприл, цилазаприл, лизиноприл, эналаприл, лозартан, ингибиторы тиопротеазы, ингибиторы каспазы, ингибиторы апоптоза, регуляторы апоптоза, такие как р 65 NFB и Bcl-xL антисмысловые олигонуклеотиды и простациклин, вапипрост, -, - и -интерферон, антагонисты гистамина,блокаторы серотонина, галофугинон, нифедипин, токоферол, траниласт, молсидомин, полифенолы чая,эпикатехина галлат, эпигаллокатехина галлат, босвелиевые кислоты и их производные, лефлуномид,анакинра, этанерцепт, сульфасалазин, этопозид, диклоксациллин, тетрациклин, триамцинолон, мутамицин, прокаинамид, ретиноевая кислота, хинидин, дизопиримид, флекаинид, пропафенон, соталол, амидорон. Дополнительные агенты представляют собой стероиды (гидрокортизон, бетаметазон, дексаметазон),нестероидные вещества (NSAIDS), такие как фенопрофен, ибупрофен, индометацин, напроксен, фенилбутазон и другие. Также применимы противовирусные агенты, такие как ацикловир, ганцикловир и зидовудин. В данной области используют различные противогрибковые средства. Примерами являются клотримазол, флуцитозин, гризеофульвин, кетоконазол, миконазол, нистатин, тербинафин. Противопротозойные агенты, такие как хлорохин, мефлохин, хинин являются активными агентами равной эффективности, кроме того, природные терпеноиды, такие как гиппоцескулин, баррингтогенол-C21-ангелат,14-дегидроангростистахин, агроскерин, агростистахин, 17-гидроксиангростистахин, оватодиолиды, 4,7 оксициклоанизомелиновая кислота, бакхариноиды В 1, В 2, B3, тубеимозид, бруцеанол А, В и С, бруцеантинозид С, яданзиозиды N и Р, изодезоксиэлефантопин, томенфантопин А и В, коронарин А, В, С и D,- 18011822 урсоловая кислота, гиптатовая кислота А, зеорин, изоиридогерманал, майтенфолиол, эффузантин А, эксцизанин А и В, лонгикаурин В, скульпонеатин С, камебаунин, лейкаменин А и В, 13,18-дегидро-6-сенециоилоксичапаррин, 1,11-диметоксикантин-6-он, 1-гидрокси-11-метоксикантин-6-он, скополетин,таксамайрин А и В, регенилол, триптолид, а также цимарин, апоцимарин, аристолохиевая кислота, аноптерин, гидроксианоптерин, анемонин, протоанемонин, берберин, челибурина хлорид, циктоксин, синококулин, бомбрестатин А и В, кудраисофлавон А, куркумин, дигидронитидин, нитидина хлорид, 12-гидроксипрегнадиен-4,16-диен-3,20-дион, билобол, гинкгол, гинкголевая кислота, геленалин, индицин,индицин-N-оксид, лазиокарпин, инотодиол, гликозид 1 а, подофиллотоксин, джустицидин А и В, ларреатин, маллотерин, маллотохроманол, изобутирилмаллотохроманол, махирозид А, марчантин А, майтанзин, ликоридицин, маргетин, панкратистатин, лириоденин, оксоушинсунин, аристолактам-AII, биспартенолидин, периплокозид А, галакинозид, урсоловая кислота, дезоксипсороспермин, психорубин, рицин А,сангвинарин, кислота из пшеницы manwu, метилсорбифолин, сфателиахромен, стизофиллин, мансонин,стреблозид, акагерин, дигидроусамбаренсин, гидроксиусамбарин, стрихнопентамин, стрихнофиллин,усамбарин, усамбарензин, берберин, лириоденин, оксоушинсунин, дафноретин, ларицирезинол, метоксиларицирезинол, сирингарезинол, умбеллиферон, афромозон, ацетилвисмион В, дезацетилвисмион А,висмион А и В, другие природные терпеноиды, такие как гиппокаэскулин, 14-дегидроагростистахин,натриуретический пептид С-типа (CNP) агроскерин, агростистахин, 17-гидроксиагростистахин, оватодиолиды, 4,7-оксициклоанизомелиновая кислота, яданзиозиды N и Р, изодезоксиэлефантопин, томенфантопин А и В, коронарин А, В, С и D, урсоловая кислота, гиптатовая кислота А, зеорин, изоиридогерманал, майтенфолиол, эффусантин А, эксисанин А и В, лонгикаурин В, скульпонеатин. Активные агенты используют по отдельности или в комбинации в одной и той же или в разной концентрации. Особенно предпочтительными являются активные агенты, которые, кроме их антипролиферативного действия, также обладают иммуносупрессивными свойствами. К числу таких активных агентов относятся эритромицин, мидекамицин, такролимус, сиролимус, паклитаксел и его производные, и джозамицин, а также тиазолопиримидины (trapidil), D-24851, - и -эстрадиол, макроциклический субоксид углерода (MCS) и его производные, PI-88, натриевая соль 2-метилтиазолидин-1,4-дикарбоновой кислоты и ее производные, и сиролимус. Кроме того, предпочтительной является комбинация нескольких веществ с антипролиферативным действием или агентов с антипролиферативной активностью с агентами с иммуносупрессивной активностью. Особенно предпочтительные активные агенты выбраны из группы, содержащей паклитаксел и его производные, -эстрадиол, симвастатин, PI-88 (сульфатированный олигосахарид; Progen Ind.), макроциклические субоксиды углерода (MCS) и их производные, trapidil, N-(пиридин-4-ил)-[1-4-(4-хлорбензил)индол-3-ил]глиоксиламид (D-24851) и такролимус. Активный агент предпочтительно присутствует в фармацевтически активной концентрации, от 0,001 до 20 мг на см 2 поверхности стента, более предпочтительно от 0,005 до 15 и особенно предпочтительно от 0,01 до 10 мг на см 2 поверхности стента. Другие активные агенты могут присутствовать в такой же концентрации в том же самом или в других слоях. Также предпочтительным является воплощение, которое включает два разных активных агента в одном слое или в разных слоях. Кроме того, предпочтительным является воплощение, в котором слой чистого активного агента является верхним слоем. Количества полимера, нанесенного на медицинский продукт и особенно на стент, предпочтительно находятся в диапазоне от 0,01 до 3 мг/см 2 поверхности, более предпочтительно от 0,20 до 1 мг/см 2 и особенно предпочтительно от 0,2 до 0,5 мг/см 2 поверхности. Кроме того, предпочтительными являются воплощения, где активный агент включен в два слоя. Это также могут быть два разных активных агента. Если один и тот же активный агент содержится в двух слоях, предпочтительно, чтобы эти два слоя имели разную концентрацию активного агента. Кроме того, предпочтительно, когда нижний слой имеет меньшую концентрацию активного агента, чем верхний слой. Стенты по изобретению могут быть изготовлены способом нанесения биосовместимого покрытия на стент, в основе которого лежит следующий принцип: а) берут стент и б) наносят по меньшей мере один биологически стабильный полисульфоновый слой по меньшей мере с одним гидрофильным полимером или без него,в) наносят по меньшей мере один антипролиферативный, противовоспалительный, антифлогистический и/или антитромботический активный агент на биологически стабильный слой и/или включают указанный агент в биологически стабильный слой, или б') наносят по меньшей мере один биологически стабильный полисульфоновый слой по меньшей мере с одним гидрофильным полимером и/или без него вместе по меньшей мере с одним антипролиферативным, противовоспалительным, антифлогистическим и/или антитромботическим активным агентом. После стадии (б') предпочтительно также может следовать стадия (в'): в') наносят по меньшей мере один антипролиферативный, противовоспалительный, антифлогисти- 19011822 ческий и/или антитромботический активный агент на биологически стабильный полимерный слой. После стадий (а), (б) и (в), или стадий (а), (б'), или стадий (а), (б') и (в') может следовать еще одна стадия (г): г) накладывают по меньшей мере один второй биологически стабильный полисульфоновый слой. Этот второй биологически стабильный полисульфоновый слой может состоять, с одной стороны, из иного полисульфона, нежели первый нижележащий слой, и может содержать, с другой стороны, другое количество того же самого илидругого гидрофильного полимера. Предпочтительно, чтобы этот второй биологически стабильный полисульфоновый слой содержал по меньшей мере один активный агент. Особенно предпочтительными являются воплощения с биологически стабильным полисульфоновым слоем с гидрофильным полимером в качестве наружного слоя или без такого полимера. Антипролиферативный, противовоспалительный, антифлогистический и/или антитромботический активный агент предпочтительно выбран из группы, приведенной выше. Кроме того, предпочтительными являются воплощения, имеющие гемосовместимый слой. Этот гемосовместимый слой состоит из вышеупомянутых гемосовместимых веществ, в частности, полностью десульфатированного и N-реацетилированного гепарина, десульфатированного и N-реацетилированного гепарина, N-карбоксиметилированного, частично N-ацетилированного хитозана и/или смесей этих веществ, и опосредованно или непосредственно нанесен на нижний биологически стабильный слой. Этот гемосовместимый слой может быть локализован между двумя другими слоями, а также может образовывать верхний слой. Также возможны воплощения с двумя гемосовместимыми слоями, где, однако, предпочтительным является только один гемосовместимый слой. Гемосовместимый слой может быть связан с нижним слоем адгезионно, а также ковалентно, или частично адгезионно и частично ковалентно. Соответствующие слои предпочтительно наносят методом погружения или опрыскивания. Кроме того, предпочтительно отдельные слои не наносят на нижний слой до тех пор, пока он не высохнет. Предпочтительным является способ, состоящий из двух стадий: (а) и (б'). Принцип покрытия предоставляет широкий спектр вариаций в отношении требований, касающихся активного агента, а также свойств применяемого полисульфона, так что в результате получаются разные варианты покрытия, которые также могут быть скомбинированы друг с другом. Возможность влияния на свойства полисульфона посредством количества и молекулярной массы добавляемого гидрофильного полимера, такого как PVP, обеспечивает в отношении используемых активных агентов широкую адаптируемость компонентов к соответствующей системе. Возможны также дополнительные слои полисульфона без добавления PVP, и/или с одинаковым или разным содержанием PVP, и с активными агентами либо без них. Аналогично, может быть нанесен слой,который предпочтительно ковалентно связан непосредственно с поверхностью, полностью Nдеацетилированного гепарина и реацетилированного гепарина, десульфатированного и Nреацетилированного гепарина, N-карбоксиметилированного и/или частично N-ацетилированного хитозана и/или смесей этих веществ, атромбогенные свойства которых могут обеспечить экранирование нижележащей чужеродной поверхности в случае повреждения поверхности вышележащего биологически стабильного слоя или слоев, как это происходит, например, перед имплантацией или же в процессе имплантации при механической деструкции покрытия. Этот инертный слой может быть нанесен, если необходимо, возможно ковалентно или адгезионно между двумя слоями, а также и/или как верхний слой. Вариант А: а) берут непокрытый стент,б) наносят один биологически стабильный полисульфоновый слой с гидрофильным полимером или без него,в) наносят активный агент или комбинацию активных агентов в и/или на полисульфоновый слой методом погружения или опрыскивания,г) по существу полностью и/или не полностью покрывают этот биологически стабильный полисульфоновый слой, содержащий активный агент, по меньшей мере еще одним биологически стабильным полисульфоновым слоем, соответствующим первому слою или отличающимся от этого первого слоя содержанием гидрофильного полимера и, таким образом, размером пор,д) наносят тот же самый или другой активный агент или комбинацию активных агентов в и/или на наружный биологически стабильный слой, так что разные активные агенты и/или комбинации активных агентов могут быть нанесены на стент заданным образом отдельно друг от друга посредством обоих слоев, а также в случае разного размера пор полимера можно реализовать разную нагрузку активным агентом, а также разную скорость элюирования того же самого и/или другого активного агента. В частности, термин "наносят" на стадии (в) и/или стадии (д) означает "диффузию" активного агента в соответствующий слой. Предпочтительными являются медицинские продукты с двумя биологически стабильными полисульфоновыми слоями, которые могут содержать разные гидрофильные полимеры в разных концентрациях. Нанесение всехпредложенных полимерных слоев можно осуществить перед диффузией активного агента в эти слои, если один и тот же активный агент или одна и та же комбинация активных агентов- 20011822 должны содержаться в обоих слоях. Кроме того, может быть нанесен другой слой подходящего полисульфона или даже чистого гидрофильного полимера в качестве диффузионного барьера и верхнего покрытия. Вариант Б: а) берут непокрытый стент,б) наносят один биологически стабильный полисульфоновый слой с гидрофильным полимером или без него,в) по существу полностью и/или не полностью покрывают этот биологически стабильный полисульфоновый слой по меньшей мере одним антипролиферативным, антифлогистическим и/или антитромботическим активным агентом и/или комбинацией активных агентов методом опрыскивания,г) по существу полностью и/или не полностью покрывают слой активного агента по меньшей мере еще одним биологически стабильным полисульфоновым слоем, который соответствует первому слою или отличается от этого первого слоя содержанием гидрофильного полимера и, таким образом, размером пор, с активным агентом и/или комбинацией активных агентов или без них, и/или г') по существу полностью и/или не полностью покрывают слой активного агента гидрофильным полимером в качестве верхнего покрытия с активным агентом и/или комбинацией активных агентов или без них. С помощью этих вариантов возможно адаптировать материал покрытия к активным агентам, а также высвобождаемое во времени количество активного агента - к требованиям в соответствующем сегменте. В многослойных системах вновь нанесенный слой покрывает нижний слой по существу полностью."По существу" означает на 50-100%, предпочтительно на 70-100%, более предпочтительно на 80-100%,более предпочтительно на 90-100% и особенно предпочтительно на более чем 96% и в частности еще более предпочтительно на более чем 98%. Объектами данного изобретения также являются медицинские продукты, которые могут быть изготовлены согласно вышеупомянутым способам, и в частности стенты. Стенты по изобретению решают проблему острого тромбоза, а также проблему гиперплазии неоинтимы после имплантации стента. Кроме того, стенты по изобретению, благодаря их покрытию как в виде однослойной, так и в виде многослойной системы, особенно подходят для непрерывного высвобождения одного или более антипролиферативных, противовоспалительных, антифлогистических, антитромботических и/или иммуносупрессивных активных агентов. Благодаря своей способности непрерывно высвобождать активный агент нужным образом в требуемом количестве, покрытые стенты по изобретению почти полностью предотвращают опасность рестеноза. Предотвращение или снижение рестеноза осуществляется, с одной стороны, путем подавления клеточных реакций в течение первых суток и недель после имплантации при помощи выбранных активных агентов и комбинаций активных агентов и, с другой стороны, путем обеспечения биосовместимой поверхности, так что при уменьшении влияния активного агента на имеющейся чужеродной поверхности не начинаются никакие реакции, которые в перспективе могли бы также привести к повторной закупорке кровеносного сосуда. Описание графических материалов Фиг. 1: диаграмма элюирования макроциклического субоксида углерода (MCS) в трехслойной системе с полисульфоном в качестве базового покрытия, активным агентом в качестве среднего слоя и полисульфоновым покрытием, полностью покрывающим средний слой активного агента с процентным содержанием поливинилпирролидона 0,04%. Фиг. 2: диаграмма элюирования паклитаксела из полисульфоновой матрицы с количеством поливинилпирролидона 9,1%. Фиг. 3: диаграмма элюирования симвастатина из чистой полисульфоновой матрицы, не содержащей гидрофильного полимера. Фиг. 4: диаграмма элюирования -эстрадиола с процентным содержанием 15% по массе из чистой полисульфоновой матрицы, не содержащей гидрофильного полимера. Фиг. 5: диаграмма элюирования trapidil из полисульфоновой матрицы с количеством поливинилпирролидона 4,5%. Фиг. 6: диаграмма элюирования trapidil, присутствующего в количестве 50% от чистой полисульфоновой матрицы. Фиг. 7: фотомикрография сегментов сосуда после 4-недельной имплантации у свиньи; А - увеличенная часть матриксного стента; Б - поперечный разрез сегмента сосуда со стентом, который покрыт полисульфоном и нагружен MCS в высокой концентрации. Пример 2. Покрытие стентов полиэфирсульфоном (базовое покрытие) и полиэфирсульфоном с 0,04% PVP или соответственно 0,08% PVP в качестве верхнего покрытия. Растворы для опрыскивания: а) Раствор полисульфона. Взвешивают 17,6 мг PS и доводят до 2 г хлороформом.0,88% PS б) Раствор полисульфон/PVP. Взвешивают 25,2 мг PS и 1,2 мг PVP и доводят до 3 г хлороформом.0,84% PS, 0,04% PVP б') Раствор полисульфон/PVP. Взвешивают 24 мг PS и 2,4 мг PVP и доводят до 3 г хлороформом.0,80% PS, 0,08% PVP Нанесение покрытия опрыскиванием. На взвешенные стенты наносят покрытие путем опрыскивания растворами для опрыскивания в указанном порядке: а) 0,5 мл и б) 0,85 мл. При этом после каждой процедуры опрыскивания проходит промежуток времени по меньшей мере 6 ч до нанесения следующего слоя. После сушки при комнатной температуре в чистой комнате снова проводят взвешивание. Пример 3. Изготовление стентов с MCS и полиэфирсульфоном в 3-слойной системе согласно варианту Б. Растворы для опрыскивания: а) Раствор полиэфирсульфона (1-й слой: базовое покрытие, основное покрытие). Взвешивают 70,4 мг PS и доводят до 8 г хлороформом.0,88% PS б) Раствор MCS (2-й слой: среднее покрытие). Взвешивают 39,6 мг MCS и доводят до 18 г 20%-ным этанолом в воде.0,22% MCS в) Раствор полиэфирсульфон/PVP (3-й слой: верхнее покрытие). Взвешивают 100,8 мг PS и 4,8 мг поливинилпирролидона и доводят до 12 г хлороформом.0,84% PS, 0,04% PVP Нанесение покрытия опрыскиванием. Нерасширенные стенты из нержавеющей стали взвешивают, и после очистки наносят на них покрытие путем опрыскивания. Стенты опрыскивают соответствующим количеством соответствующего раствора для опрыскивания: а) 0,5 мл; б) 1,5 мл и в) 0,85 мл в указанном порядке. При этом после нанесения каждого слоя проходит промежуток времени по меньшей мере 6 ч перед нанесением следующего слоя. После сушки при комнатной температуре в течение ночи стенты снова взвешивают. Среднее значе- 22011822 ние содержания активного агента на стентах составляет 1539 мкг. Пример 4. Определение кинетики элюирования MCS из полиэфирсульфона с 4,5% PVP. В каждый стеклянный сосуд с фиксируемой крышкой помещают один стент, добавляют 2 мл буфера PBS (забуференный фосфатом физиологический раствор), закрывают парафилмом и инкубируют в течение определенных промежутков времени в сушильном шкафу при 37 С. После окончания выбранного периода времени, супернатант отбирают пипеткой и измеряют его УФ-поглощение при 207 нм. К соответствующему стенту снова добавляют 2 мл PBS и снова инкубируют 37 С. Эту операцию повторяют несколько раз. Пример 5. Покрытие стентов полисульфоновой матрицей, нагруженной симвастатином. Растворы для опрыскивания: а) Раствор PS/симвастатин. Взвешивают 26,4 мг PS и 8,8 мг симвастатина и доводят до 4 г хлороформом.0,66% PS, 0,22% симвастатина б) Раствор PS/симвастатин/PVP. Взвешивают 24,8 мг PS, 8,8 мг симвастатина и 1,6 мг PVP, и доводят до 4 г хлороформом.0,62% PS, 0,22% симвастатина, 0,04% PVP Пример 6. Покрытие стентов полисульфоновой матрицей, нагруженной симвастатином с высокой долей PVP. Раствор для опрыскивания: а) Раствор PS/симвастатин/PVP. Взвешивают 23,2 мг PS, 8,8 мг симвастатина и 3,2 мг PVP и доводят до 4 г хлороформом.0,58% PS, 0,22% симвастатина, 0,08% PVP Пример 7. Покрытие стентов полисульфоновой матрицей, нагруженной паклитакселем. Растворы для опрыскивания: а) Раствор PS/паклитаксел. Взвешивают 13,2 мг PS и 4,4 мг паклитаксела, и доводят до 2 г хлороформом.0,66% PS, 0,22% паклитаксела б) Раствор PS/PVP/паклитаксел. Взвешивают 11,6 мг PS, 1,6 мг PVP и 4,4 мг паклитаксела, и доводят до 2 г хлороформом.0,58% PS, 0,08% PVP, 0,22% паклитаксела Пример 9. Покрытие стентов полисульфоновой матрицей, содержащей триазолопиримидин (trapidil). Раствор для опрыскивания: раствор PS/trapidil. Взвешивают 19,8 мг PS и 6,6 мг trapidil, и доводят до 3 г хлороформом.0,66% PS, 0,22% trapidilIn vivo исследование стентов с полиэфирсульфоном в качестве матрицы, с макроциклическим субоксидом и без него. В коронарные артерии 13 домашних свиней разного пола с массой 20-25 кг имплантировали стенты,покрытые полиэфирсульфоном. Использовали три разные группы стентов. Одна группа содержала высокую дозировку паклитаксела, вторая содержала низкую дозировку паклитаксела, и последняя группа представляла собой стенты с чистой матрицей без добавления активного агента. Через четыре недели стенты извлекали и анализировали на воспалительные реакции (peri-strut) и образование неоинтимы. Все проанализированные стенты, независимо от покрытия, продемонстрировали лишь минимальные воспаления вокруг стентовых распорок и на месте внедрения. Более значительная средняя толщина- 24011822 интимы у стентов с низкой нагрузкой активного агента может быть отнесена за счет более сильного сверхрасширения сосуда во время имплантации. Стент с чистой матрицей не продемонстрировал никаких заметных проблем в реакциях сосудов, которые следовало бы отнести на счет полимера, что свидетельствует в пользу его гемосовместимости и пригодности в качестве субстрата для активных агентов. Пример 11.In vivo исследование стентов с полиэфирсульфоном в качестве матрицы, с паклитакселем и без него. По аналогии с предыдущим примером 10, стенты, которые были покрыты полиэфирсульфоном,сравнивали со стентами, которые были покрыты полиэфирсульфоном и нагружены паклитакселем. Результаты этого исследования также демонстрируют полезность полисульфонового покрытия. Пример 12. Получение полисульфона формулы (IIA). Полисульфон (IIA) получали согласно инструкции Е. Avram et al. J. Macromol Sci. Pure Appl. Chem.,1997, A34, 1701. 3 моль-эквивалента бензилового спирта растворяют в толуоле и депротонируют натрием. Добавляют 1 моль-эквивалент полисульфона (IIA) и затем реакционную смесь нагревают до температуры кипения. Продукт реакции получают с выходом 22%. Пример 13. Получение полисульфона формулы (IIC). Полисульфон (IIC) получали согласно инструкции М. D. Guiver et al., Brit. Polym. L 1990, 23, 29. 1 г полученного полисульфона (IIC) эстерифицировали, используя ортоэтилацетат, причем в качестве растворителя использовали толуол, и летучие продукты реакции удаляли из равновесной реакционной смеси посредством дистилляции. 40% карбоксилатных групп были превращены в группы этилового эфира. Согласно примеру 7 этот полимер наносят на стент вместе с паклитакселом. Стент демонстрирует хорошую гемосовместимость и аморфное полисульфоновое покрытие, которое пригодно для регулируемого высвобождения паклитаксела. Пример 14. 1 г полисульфона, полученного согласно примеру 12, смешивают с 200 мг полисульфона формулы(IIC) и наносят согласно примеру 7 вместе с активным агентом паклитакселом на стент. Стент с нанесенным покрытием имеет хорошую гемосовместимость и аморфное полисульфоновое покрытие, которое пригодно для регулируемого высвобождения паклитаксела. Пример 15. Введение хлорсульфоновых групп в полисульфон. 2,4 г полисульфона растворяют в 700 мл хлороформа и охлаждают до -20 С. Затем медленно по каплям добавляют 23,3 мл хлорсульфоновой кислоты. Поскольку реакция является сильно экзотермической, реакционный сосуд охлаждают в ледяной бане. После добавления хлорсульфоновой кислоты раствор нагревают до комнатной температуры при перемешивании. Через 30 мин полимер осаждают в этаноле и затем промывают деионизированной водой. Для полного удаления хлорсульфоновой кислоты ее снова экстрагируют в течение 10 мин деионизированной водой. Пример 16.S-алкокси-де-хлорирование. 10 г этанола растворяют в 100 мл воды и смешивают с 2-3 каплями метилового красного в ацетоне. Этот раствор выливают на 5 г мелкозернистого хлорсульфонированного полисульфона. Раствор смешивают капельным методом с 5 н. KOH до изменения окраски с желтой на красную. Затем сосуд закрывают и хорошо встряхивают. Добавляют раствор каустической соды и встряхивают до тех пор, пока не прекращается изменение окраски. Образовавшийся полисульфоновый эфир отсасывают,промывают водой и перекристаллизовывают с целью очистки. Пример 17.S-алкокси-де-хлорирование. 10 г сухого этанола смешивают с 60 мл пиридина. Этот раствор при охлаждении льдом добавляют к 40 г тонкоизмельченного хлорсульфонированного полисульфона. Затем его перемешивают с удалением влаги в течение ночи при комнатной температуре. Затем суспензию вливают в ледяную воду и осторож- 25011822 но подкисляют концентрированной соляной кислотой. Осуществляют промывку водным раствором гидрокарбоната. После фильтрации эстерифицированный полисульфон можно подвергнуть перекристаллизации. Пример 18. Покрытие смесью полисульфона и полисульфона формулы (IIC). Взвешивают 24 мг PS и 2,4 мг полисульфона формулы (IIC) и доводят до 3 г хлороформом.0,80% PS, 0,08% PVP Стент покрывают этой смесью согласно примеру 7 методом опрыскивания. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Имплантируемый медицинский продукт, отличающийся тем, что его поверхность, по меньшей мере, частично покрыта по меньшей мере одним биологически стабильным полисульфоновым слоем, и в,под и/или на полисульфоновом слое содержится по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент. 2. Имплантируемый медицинский продукт по п.1, отличающийся тем, что полисульфон выбран из группы, включающей полиэфирсульфон, замещенный полиэфирсульфон, полифенилсульфон, замещенный полифенилсульфон, полисульфоновые блок-сополимеры, перфторированные полисульфоновые блок-сополимеры, полуфторированные полисульфоновые блок-сополимеры, замещенные полисульфоновые блок-сополимеры и/или смеси вышеуказанных полимеров, где заместители выбраны из -OH,-OCH3, -OC2H5, -SH, -SCH3, -SC2H5, -NO2, -F, -Cl, -Br, -I, -N3, -CN, -OCN, -NCO, -SCN, -NCS, -CHO,-COCH3, -COC2H5, -COOH, -COCN, -COOCH3, -COOC2H5, -CONH2, -CONHCH3, -CONHC2H5,-CON(CH3)2, -CON(C2H5)2, -NH2, -NHCH3, -NHC2H5, -N(CH3)2, -N(C2H5)2, -SOCH3, -SOC2H5, -SO2CH3,-SO2C2H5, -SO3H, -SO3CH3, -SO3C2H5, -OCF3, -O-COOCH3, -O-COOC2H5, -NH-CO-NH2, -NH-CS-NH2, -NHC(=NH)-NH2, -O-CO-NH2, -NH-CO-OCH3, -NH-CO-OC2H5, -CH2F, -CHF2, -CF3, -CH2Cl, -CHCl2, -CCl3,-CH2Br, -CHBr2, -CBr3, -CH2I, -CHI2, -Cl3, -CH3, -C2H5, -C3H7, -CH(CH3)2, -C4H9, -CH2-CH(CH3)2, -CH2COOH, -CH(CH3)-C2H5, -C(CH3)3, -H. 3. Имплантируемый медицинский продукт по п.1 или 2, отличающийся тем, что по меньшей мере один биологически стабильный полисульфоновый слой содержит по меньшей мере один гидрофильный полимер. 4. Имплантируемый медицинский продукт по п.3, отличающийся тем, что в полисульфоновом слое соотношение полисульфона к гидрофильному полимеру составляет от 50:50 мас.% вплоть до 99,999:0,001 мас.%. 5. Имплантируемый медицинский продукт по п.3 или 4, отличающийся тем, что гидрофильный полимер выбран из группы, включающей следующее: поливинилпирролидон, полиэтиленгликоль, полипропиленгликоль, поливиниловый спирт, полигидроксиэтилметакрилаты, полиакриламид, поливалеролактоны, полидекалактоны, полилактоновую кислоту, полигликолевую кислоту, полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, поликапролактон, полигидроксибутановую кислоту, полигидроксибутираты, полигидроксивалераты, сополимеры полигидроксибутиратов и валератов, поли(1,4-диоксан-2,3-дионы), поли(1,3-диоксан-2-оны), полипарадиоксаноны, полиангидриды, такие как ангидриды полималеиновой кислоты, фибрин, полицианоакрилаты, поликапролактондиметакрилаты,поли-b-малеиновую кислоту, поликапролактона бутилакрилаты, мультиблок-полимеры, например, из олигокапролактондиолов и олигодиоксанондиолов, полиэфирные сложноэфирные мультиблокполимеры, такие как PEG (полиэтиленгликоль) и полибутилентерефталат, полипивотолактоны, триметилкарбонаты полигликолевой кислоты, поликапролактон-гликолиды, поли-g-этилглутамат, поли(DTH(дезаминотирозилтирозингексиловый эфир)иминокарбонат), поли(DTE-со-DT-карбонат), (поли(сополимер карбоната дезаминотирозилтирозинэтилового эфира и дезаминотирозилтирозина, поли(бисфенол-А-иминокарбонат), полиортоэфиры, триметилкарбонаты полигликолевой кислоты, политриметилкарбонаты, полииминокарбонаты, поли(N-винил)пирролидон, поливиниловые спирты, полиэфирамиды,гликолированные полиэфиры,полифосфоэфиры,полифосфазены,поли[(паракарбоксифенокси)пропан], полигидроксипентановую кислоту, полиангидриды, полиэтиленоксид-пропиленоксид, мягкие полиуретаны, полиуретаны с аминокислотными остатками в основной цепи,полимеры, содержащие простую эфирную и сложную эфирную связь, такие как полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, а также их сополимеры, липиды, каррагенаны, фибриноген, крахмал,коллаген, полимеры на основе белков, полиаминокислоты, синтетические полиаминокислоты, зеин, модифицированный зеин, полигидроксиалканоаты, пектиновую кислоту, актиновую кислоту, модифицированный и немодифицированный фибрин и казеин, карбоксиметилсульфат, альбумин, гиалуроновую кислоту, хитозан и его производные, хондроитинсульфат, декстран, b-циклодекстрины, сополимеры с PEG и полипропиленгликолем, гуммиарабик, гуар, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, фосфолипиды, сополимеры и/или смеси вышеупомянутых веществ. 6. Имплантируемый медицинский продукт по п.5, отличающийся тем, что гидрофильный полимер выбран из группы, включающей поливинилпирролидон, полиэтиленгликоль и/или полипропиленгликоль.- 26011822 7. Имплантируемый медицинский продукт по любому из пп.1-6, отличающийся тем, что биологически стабильный слой адгезионно или ковалентно связан с поверхностью медицинского продукта. 8. Имплантируемый медицинский продукт по любому из пп.1-7, отличающийся тем, что покрытие поверхности медицинского продукта состоит из одного, двух, трех или более слоев. 9. Имплантируемый медицинский продукт по любому из пп.1-8, отличающийся тем, что по меньшей мере под одним биологически стабильным полисульфоновым слоем по меньшей мере с одним гидрофильным полимером или без него и/или на указанном слое присутствует по меньшей мере один слой полностью десульфатированного и N-реацетилированного гепарина, десульфатированного и Nреацетилированного гепарина, N-карбоксиметилированного и/или частично N-ацетилированного хитозана и/или смесей этих веществ. 10. Имплантируемый медицинский продукт по любому из пп.1-9, отличающийся тем, что в многослойных системах по меньшей мере один полисульфоновый слой с добавлением или без добавления по меньшей мере одного гидрофильного полимера, по меньшей мере, частично покрывает биологически стабильный полисульфоновый слой по меньшей мере с одним слоем по меньшей мере одного биодеградируемого полимера. 11. Имплантируемый медицинский продукт по любому из пп.1-10, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент выбран из группы, содержащей сиролимус (рапамицин), эверолимус, соматостатин, такролимус, рокситромицин, дунаимицин, аскомицин, бафиломицин, эритромицин, мидекамицин, джозамицин,конканамицин, кларитромицин, тролеандомицин, фолимицин, церивастатин, симвастатин, ловастатин,флувастатин, розувастатин, аторвастатин, правастатин, питавастатин, винбластин, винкристин, виндезин,винорелбин, этопозид, тенипозид, нимустин, кармустин, ломустин, циклофосфамид, натриуретический пептид С-типа (CNP), 4-гидроксициклофосфамид, эстрамустин, мелфалан, ифосфамид, трофосфамид,хлорамбуцил, бендамустин, дакарбазин, бусульфан, прокарбазин, треосульфан, темозоломид, тиотепа,даунорубицин, доксорубицин, акларубицин, эпирубицин, митоксантрон, идарубицин, блеомицин, митомицин, дактиномицин, метотрексат, флударабин, флударабин-5'-дигидрофосфат, кладрибин, меркаптопурин, тиогуанин, цитарабин, фторурацил, гемцитабин, капецитабин, доцетаксел, карбоплатин, цисплатин, криптофицин, ангинекс, оксалиплатин, амсакрин, иринотекан, топотекан, гидроксикарбамид, милтефосин, пентостатин, алдеслейкин, третиноин, аспарагиназу, пэгаспаргазу, анастрозол, экземестан, летрозол, форместан, аминоглутетимид, адриамицин, азитромицин, спирамицин, цефарантин, ингибитор пролиферации гладкомышечных клеток типа 2w, эпотилон А и В, митоксантрон, азатиоприн, микофенолата мофетил, c-myc-антисмысловой, b-myc-антисмысловой, бетулиновую кислоту, камптотецин, лапахол, -лапахон, подофиллотоксин, бетулин, подофилловой кислоты 2-этилгидразид, молграмостим(rhuGM-CSF (рекомбинантный человеческий гранулоцитарно-макрофагальный колониестимулирующий фактор, пэгинтерферон -2b, ленограстим (r-HuG-CSF (рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор, филграстим, макрогол, ангинекс, Na-уретические пептиды, дакарбазин, базиликсимаб, даклизумаб, селектин (антагонист цитокинов), криптофицины, ингибитор СЕТР(белка-переносчика эфиров холестерина), кадхерины, ингибиторы цитокининов, ингибитор СОХ-2 (циклооксигеназы 2), АЕ-941 (Neovastat) NFB (ядерный фактор каппа-В), ангиопептин, ципрофлоксацин,камптотецин, флуробластин, моноклональные антитела, которые ингибируют пролиферацию мышечных клеток, антагонисты bFGF (щелочного фактора роста фибробластов), пробукол, простагландины, AcYVAD-CMK (ацетил-тирозинил-валил-аланил-аспартил-хлорметил-кетон), 1,11-диметоксикантин-6-он,1-гидрокси-11-метоксикантин-6-он, скополетин, колхицин, доноры NO, такие как пентаэритритола тетранитрат и синдноеимины, S-нитрозопроизводные, тамоксифен, стауроспорин, -эстрадиол, -эстрадиол,эстриол, эстрон, этинилэстрадиол, фосфестрол, медроксипрогестерон, эстрадиола ципионаты, эстрадиола бензоаты, траниласт, камебакаурин и другие терпеноиды, которые применяются в терапии рака, верапамил, ингибиторы тирозинкиназы (тирфостины), циклоспорин А, паклитаксел и его производные, такие как 6 гидроксипаклитаксел, баккатин, таксотер и другие, синтетические и получаемые из природных источников макроциклические олигомеры субоксида углерода (MCS) и его производные, мофебутазон,ацеметацин, диклофенак, лоназолак, дапсон, ортокарбамоилфеноксиуксусную кислоту, лидокаин, кетопрофен, мефенамовую кислоту, пироксикам, мелоксикам, хлорохина фосфат, пеницилламин, гидроксихлорохин, ауранофин, ауротиомалат натрия, оксацепрол, целекоксиб, -ситостерин, адеметионин, миртекаин, полидоканол, нонивамид, левоментол, бензокаин, аэсцин, эллиптицин, D-24851 (Calbiochem), колцемид, цитохалазин А-Е, инданоцин, нокодазол, белок S-100, бацитрацин, антагонисты рецептора витронектина, азеластин, стимулятор гуанидилциклазы, тканевый ингибитор металлопротеиназы-1 и -2, свободные нуклеиновые кислоты, нуклеиновые кислоты, встроенные в вирусные трансмиттеры, фрагменты ДНК и РНК, ингибитор активатора плазминогена 1 типа, ингибитор активатора плазминогена 2 типа,антисмысловые олигонуклеотиды, ингибиторы VEGF (фактор роста эндотелия сосудов), IGF-1 (инсулиноподобный фактор роста), активные агенты, выбранные из группы антибиотиков, такие как цефадроксил, цефазолин, цефаклор, цефотаксим, тобрамицин, гентамицин, пенициллины, такие как диклоксациллин, оксациллин, сульфонамиды, метронидазол, антитромботические средства, такие как аргатробан,- 27011822 аспирин, абциксимаб, синтетический антитромбин, бивалирудин, кумадин, эноксапарин, десульфатированный и N-реацетилированный гепарин (hemoparin), тканевый активатор плазминогена, тромбоцитарный мембранный рецептор GpIIb/IIIa, антитело-ингибитор фактора Ха, гепарин, гирудин, r-гирудин,PPACK (D-фенилаланил-L-пролил-L-аргининилхлорметилкетон), протамин, проурокиназу, стрептокиназу, варфарин, урокиназу, вазодилататоры, такие как дипирамидол, триазолопиримидин (trapidil), нитропруссиды, антагонисты PDGF (тромбоцитарного фактора роста), такие как триазолопиримидин и серамин, ингибиторы АСЕ (ангиотензинпревращающего фермента), такие как каптоприл, цилазаприл, лизиноприл, эналаприл, лозартан, ингибиторы тиопротеазы, простациклин, вапипрост, интерферон ,и ,антагонисты гистамина, блокаторы серотонина, ингибиторы апоптоза, регуляторы апоптоза, такие как р 65 NFB и Bcl-xL антисмысловые олигонуклеотиды, галофугинон, нифедипин, токоферол, траниласт,молсидомин, полифенолы чая, эпикатехина галлат, эпигаллокатехина галлат, босвелиевые кислоты и их производные, лефлуномид, анакинра, этанерцепт, сульфасалазин, этопозид, диклоксациллин, тетрациклин, триамцинолон, мутамицин, прокаинамид, ретиноевую кислоту, хинидин, дизопиримид, флекаинид,пропафенон, соталол, амидорон, природные и синтетические стероиды, такие как бриофиллин А, инотодиол, махирозид А, галакинозид, мансонин, стреблозид, гидрокортизон, бетаметазон, дексаметазон, нестероидные вещества (NSAIDS (нестероидные противовоспалительные лекарственные средства, такие как фенопрофен, ибупрофен, индометацин, напроксен, фенилбутазон, и другие противовирусные агенты,такие как ацикловир, ганцикловир и зидовудин, противогрибковые средства, такие как клотримазол,флуцитозин, гризеофульвин, кетоконазол, миконазол, нистатин, тербинафин, противопротозойные агенты, такие как хлорохин, мефлохин, хинин, а также природные терпеноиды, такие как гиппоцескулин,баррингтогенол-C21-ангелат,14-дегидроангростистахин,агроскерин,агростистахин,17 гидроксиангростистахин, оватодиолиды, 4,7-оксициклоанизомелиновая кислота, бакхариноиды В 1, В 2,B3, тубеимозид, бруцеанол А, В и С, бруцеатинозид С, яданзиозиды N и Р, изодезоксиэлефантопин, томенфантопин А и В, коронарин А, В, С и D, урсоловая кислота, гиптатовая кислота А, зеорин, изоиридогерманал, майтенфолиол, эффусантин А, эксцисанин А и В, лонгикаурин В, скульпонеатин С, камебаунин, лейкаменин А и В, 13,18-дегидро-6 сенециоилоксичапаррин, таксамаирин А и В, регенилол, триптолид, а также цимарин, апоцимарин, аристолохиевая кислота, аноптерин, гидроксианоптерин, анемонин, протоанемонин, берберин, челибурина хлорид, циктоксин, синококулин, бомбрестатин А и В, кудраисофлавон А, куркумин, дигидронитидин, нитидина хлорид, 12 гидроксипрегнадиен-4,16-диен-3,20 дион, билобол, гинкгол, гинкголевая кислота, геленалин, индицин, индицин-N-оксид, лазиокарпин, инотодиол, гликозид 1 а, подофиллотоксин, джустицидин А и В, ларреатин, маллотерин, маллотохроманол,изобутирилмаллотохроманол, махирозид А, марчантин А, майтанзин, ликоридицин, маргетин, панкратистатин, лириоденин, биспартенолидин, оксоушинсунин, аристолактам-AII, периплокозид А, галакинозид,урсолиевая кислота, дезоксипсороспермин, психорубин, рицин А, сангвинарин, кислота из пшеницыmanwu, метилсорбифолин, сфателиахромен, стизофиллин, мансонин, стреблозид, акагерин, дигидроусамбаренсин, гидроксиусамбарин, стрихнопентамин, стрихнофиллин, усамбарин, усамбарензин, берберин, лириоденин, дафноретин, ларицирезинол, метоксиларицирезинол, сирингарезинол, умбеллиферон,афромозон, ацетилвисмион В, дезацетилвисмион А, висмион А и В. 12. Имплантируемый медицинский продукт по п.11, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент выбран из группы, содержащей паклитаксел и его производные, -эстрадиол, симвастатин, PI-88 (Progen Ind.), макроциклические субоксиды углерода (MCS) и их производные, trapidil, N-(пиридин-4-ил)-[1-4-(4 хлорбензил)индол-3-ил]глиоксиламид (D-24851), активированный протеин С (аРС), Ac-YVAD-CMK,Anginex (-Pep25), Neovastat, Cryptophycin 52, такролимус. 13. Имплантируемый медицинский продукт по любому из пп.1-12, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент содержится в фармацевтически активной концентрации 0,001-20 мг/см 2 поверхности. 14. Имплантируемый медицинский продукт по любому из пп.1-13, отличающийся тем, что в многослойных системах по меньшей мере два слоя с добавлением или без добавления по меньшей мере одного гидрофильного полимера содержат по меньшей мере один активный агент с одинаковой или разной концентрацией активного агента, связанного ковалентно и/или адгезионно. 15. Имплантируемый медицинский продукт по любому из пп.1-14, отличающийся тем, что в многослойных системах последний слой представляет собой слой чистого активного агента, связанный ковалентно и/или адгезионно. 16. Способ нанесения биосовместимого покрытия на имплантируемые медицинские продукты, характеризующийся следующими стадиями: а) берут стент,б) наносят по меньшей мере один биологически стабильный полисульфоновый слой по меньшей мере с одним гидрофильным полимером или без него,в) наносят и/или включают по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент на и/или в биологически стабильный слой или- 28011822 б') наносят по меньшей мере один биологически стабильный полисульфоновый слой по меньшей мере с одним гидрофильным полимером или без него вместе по меньшей мере с одним антипролиферативным, противовоспалительным и/или антитромботическим активным агентом. 17. Способ по п.16, включающий стадию (б') и дополнительную стадию, на которой: в') наносят по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент на биологически стабильный полимерный слой. 18. Способ по п.16 или 17, включающий дополнительную стадию, на которой: г) наносят по меньшей мере один второй биологически стабильный полисульфоновый слой с содержанием гидрофильных полимеров, которое равно или отличается от первого слоя, или без таких полимеров, без и/или с включением и/или нанесением по меньшей мере одного активного агента в той же самой или другой концентрации. 19. Способ по любому из пп.16-18, включающий дополнительную стадию, на которой: г') наносят по меньшей мере один дополнительный слой по меньшей мере одного биодеградируемого полимера без или с включением и/или нанесением по меньшей мере одного активного агента в той же самой или другой концентрации. 20. Способ по любому из пп.16-18, отличающийся тем, что на и/или под по меньшей мере один биологически стабильный полисульфоновый слой наносят по меньшей мере один слой полностью десульфатированного и N-реацетилированного гепарина, N-карбоксиметилированного и/или частично Nацетилированного хитозана и/или смесей этих веществ. 21. Имплантируемый медицинский продукт, полученный способом по любому из пп.16-19. 22. Имплантируемый медицинский продукт по любому из пп.1-15 или 21, отличающийся тем, что по меньшей мере один антипролиферативный, противовоспалительный и/или антитромботический активный агент высвобождается контролируемым образом через поверхностное покрытие. 23. Имплантируемый медицинский продукт по любому из пп.1-15 или 21, отличающийся тем, что антипролиферативный, противовоспалительный и/или антитромботический активный агент содержится в фармацевтически активной концентрации 0,001-10 мг/см 2 поверхности медицинского продукта и на слой, несущий этот активный агент. 24. Имплантируемый медицинский продукт по любому из пп.1-15 или 21, 22, отличающийся тем,что медицинский продукт представляет собой стент.MCS - макроциклический олигомер субоксида углерода
МПК / Метки
МПК: A61L 27/00
Метки: покрытия, продукт, нанесения, медицинский, биологически, полисульфоновым, покрытый, способ, слоем, стабильным
Код ссылки
<a href="https://eas.patents.su/30-11822-medicinskijj-produkt-pokrytyjj-biologicheski-stabilnym-polisulfonovym-sloem-i-sposob-naneseniya-pokrytiya.html" rel="bookmark" title="База патентов Евразийского Союза">Медицинский продукт, покрытый биологически стабильным полисульфоновым слоем, и способ нанесения покрытия</a>
Предыдущий патент: Автомобильное бензиновое топливо для двигателя внутреннего сгорания, способ работы двигателя и способ снижения выбросов
Следующий патент: Бактериальная система селекции и ее применение
Случайный патент: Обработка опасного, являющегося отходом, материала