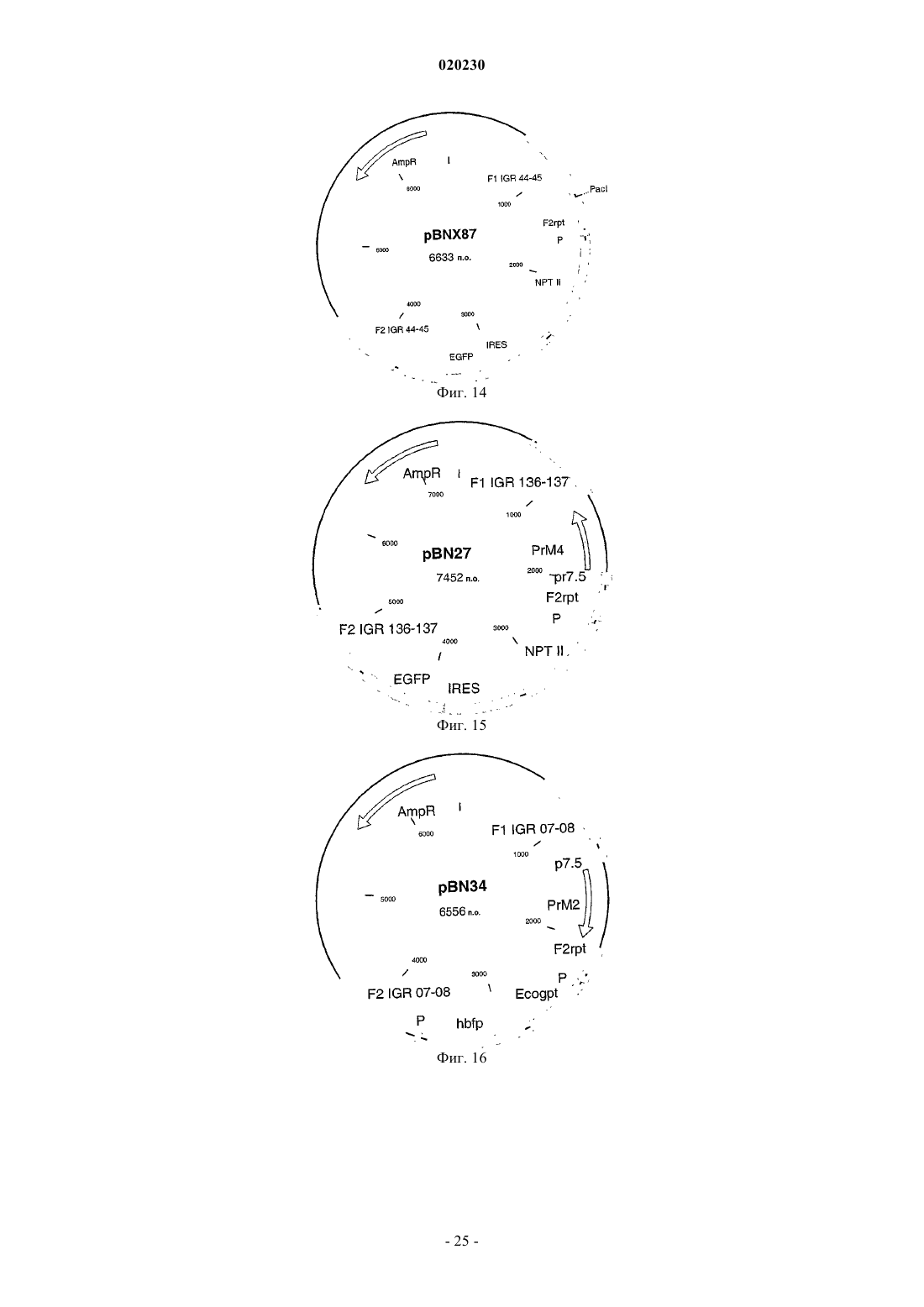
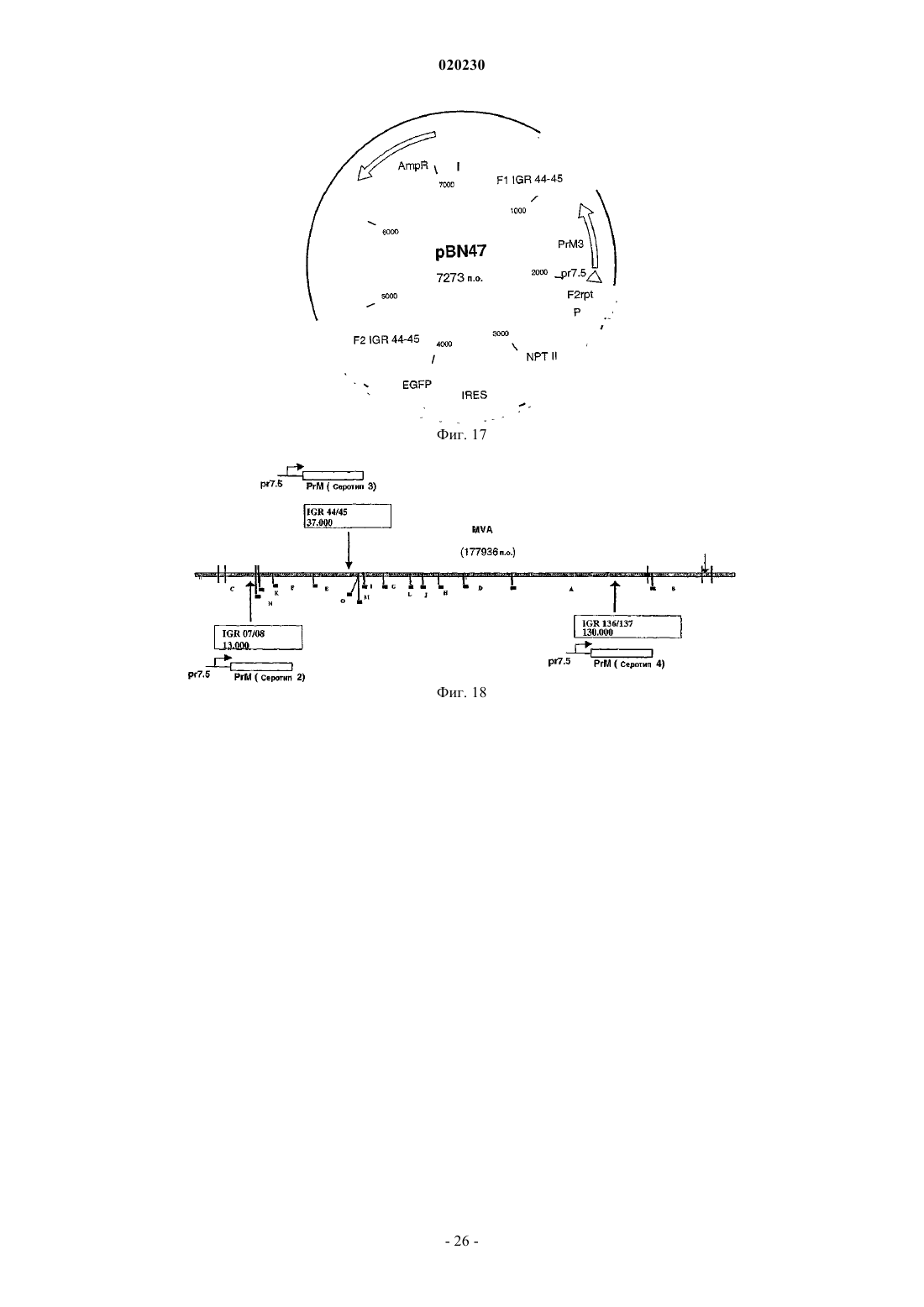
Рекомбинантный модифицированный вирус осповакцины анкара (mva), экспрессирующий гомологичные последовательности, встроенные в поксвирусный геном, и его применение
Формула / Реферат
1. Рекомбинантный модифицированный вирус осповакцины Анкара (MVA), используемый для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека, содержащий по меньшей мере две гомологичные между собой чужеродные последовательности, которые получены из разных вариантов микроорганизмов, которые не являются чужеродными генами, с гомологией, составляющей по меньшей мере 50%, в котором каждая из указанных последовательностей встроена в отдельный сайт инсерции вирусного генома.
2. Рекомбинантный вирус MVA, используемый для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, содержащий по меньшей мере две гомологичные между собой чужеродные последовательности, которые получены из разных вариантов микроорганизмов, которые не являются чужеродными генами, где указанные гомологичные последовательности имеют гомологию, составляющую по меньшей мере 60%.
3. Рекомбинантный вирус MVA по п.1 или 2, в котором последовательности имеют гомологию 65-75%.
4. Рекомбинантный вирус MVA по любому из пп.1-3, в котором гомологичные чужеродные последовательности идентичны.
5. Рекомбинантный вирус MVA по любому из пп.1-4, в котором указанные по меньшей мере две гомологичные последовательности являются промоторами, функционально связанными с геном.
6. Рекомбинантный вирус MVA по п.5, в котором промоторы представляют собой ранний/поздний промотор р7,5 вируса осповакцины.
7. Рекомбинантный вирус MVA по пп.1-6, полученный на основе вируса MVA-BN ECACC V00083008.
8. Рекомбинантный вирус MVA по пп.1-7, который является дефицитным или некомпетентным по репликации в клетках млекопитающих, включая клетки человека.
9. Рекомбинантный вирус MVA по пп.1-8, в котором указанные последовательности встроены в природный сайт делеции и/или в межгенную область вирусного генома.
10. Рекомбинантный вирус MVA по пп.1-9, представляющий собой лекарственное средство или вакцину для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека.
11. Вакцина для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека, содержащая рекомбинантный вирус MVA по любому из пп.1-10.
12. Фармацевтическая композиция для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека, содержащая рекомбинантный вирус MVA по любому из пп.1-10 и фармацевтически приемлемый носитель, разбавитель, адъювант и/или добавку.
13. Применение рекомбинантного вируса MVA по любому из пп.1-10 для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека.
14. Применение вакцины по п.11 для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека.
15. Применение композиции по п.12 для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека.
16. Применение рекомбинантного вируса MVA по любому из пп.1-10 для приготовления лекарственного средства для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека.
17. Способ воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека, предусматривающий введение терапевтически эффективного количества рекомбинантного вируса MVA по любому из пп.1-10, вакцины по п.11 или композиции по п.12 животному или человеку, подлежащему лечению.
18. Клетка, содержащая рекомбинантный вирус MVA по пп.1-10.
19. Способ получения рекомбинантного вируса MVA по пп.1-10, предусматривающий стадии
инфицирования клетки вирусом MVA;
трансфекции инфицированной клетки первой векторной конструкцией, содержащей чужеродную последовательность, предназначенную для введения в вирусный геном, и геномную последовательность вируса MVA, способную направлять интеграцию чужеродной гетерологичной последовательности, предназначенной для инсерции в сайт инсерции вирусного генома;
идентификации и выделения образованного рекомбинантного вируса MVA;
повторения указанных выше стадий с использованием рекомбинантного вируса MVA, полученного на предыдущих стадиях, для инфицирования клетки и трансфицирования указанной клетки дополнительной векторной конструкцией, содержащей следующую чужеродную последовательность, предназначенную для введения в вирусный геном, где указанная чужеродная последовательность является гомологичной по отношению к последовательности первой векторной конструкции.
20. Способ по п.19, дополнительно включающий очистку полученного рекомбинантного вируса MVA.
21. Набор для получения рекомбинантного вируса MVA по любому из пп.1-10, содержащий две или более векторных конструкций, причем каждая конструкция содержит чужеродную последовательность, предназначенную для включения в геном вируса MVA, где последовательности, включенные в разные векторы, являются гомологичными по меньшей мере на 50%, и каждая последовательность фланкирована последовательностью ДНК вируса MVA, способной направлять интеграцию каждой из чужеродных гомологичных последовательностей в геном вируса MVA, и средства для идентификации и/или селекции рекомбинантных вирусов MVA, которые включили указанные чужеродные гомологичные последовательности в свой геном.
22. Набор по п.21, где каждая из указанных гомологичных последовательностей фланкирована последовательностью ДНК вируса MVA, способной направлять интеграцию каждой из указанных гомологичных последовательностей в отдельный сайт инсерции вирусного генома.
23. Последовательность ДНК генома рекомбинантного вируса MVA по пп.1-10.
24. Способ выявления клетки, инфицированной рекомбинантным вирусом MVA по пп.1-10, предусматривающий стадии:
a) контактирования клетки с ДНК-праймерами, селективно амплифицирующими чужеродные последовательности, которые интегрированы в геном вируса MVA;
b) определения того, произошла ли гибридизация между ДНК-праймером и ДНК рекомбинантного вируса, находящегося в клетке; и
c) определения присутствия рекомбинантного вируса MVA в клетке на основании информации, полученной на стадии b).
25. Способ по п.24, в котором осуществляют контактирование клетки в дополнение или в качестве альтернативы стадии а) с ДНК-праймерами, селективно связывающимися с фланкирующими последовательностями по отношению к сайтам инсерции чужеродных последовательностей.
26. Способ идентификации рекомбинантного вируса MVA по пп.1-10 в образце, предусматривающий стадии:
a) контактирования образца с ДНК-праймерами, селективно амплифицирующими чужеродные последовательности, которые интегрированы в геном вируса MVA;
b) определения того, произошла ли гибридизация между ДНК-праймером и ДНК рекомбинантного вируса MVA в образце; и
c) определения присутствия рекомбинантного вируса в образце на основании информации, полученной на стадии b).
27. Способ по п.26, в котором осуществляют контактирование образца в дополнение или в качестве альтернативы стадии а) с ДНК-праймерами, селективно связывающимися с фланкирующими по-следовательностями по отношению к сайтам инсерции чужеродных последовательностей.
Текст
РЕКОМБИНАНТНЫЙ МОДИФИЦИРОВАННЫЙ ВИРУС ОСПОВАКЦИНЫ АНКАРА Данное изобретение относится к рекомбинантному вектору модифицированного вируса осповакцины Анкара (MVA), способному экспрессировать две или более гомологичных чужеродных последовательности, которые получены из разных вариантов микроорганизма и которые имеют гомологию 50% или выше. Изобретение, кроме того, относится к способу получения такого рекомбинантного вируса MVA и применению указанного рекомбинантного вируса в качестве лекарственного средства или вакцины. Кроме того, предлагается способ воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека. Данное изобретение относится к рекомбинантному модифицированному вирусу осповакцины Анкара (MVA), способному экспрессировать две или более гомологичных последовательности. Указанные последовательности являются гетерологичными по отношению к вирусному геному, но гомологичными при сравнении друг с другом. Указанные последовательности главным образом получают из близко родственных вариантов или подтипов микроорганизма. Изобретение, кроме того, относится к способу получения таких рекомбинантных вирусов MVA и к применению таких рекомбинантных вирусов MVA в качестве лекарственного средства или вакцины. Кроме того, предлагается способ воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека. Предпосылка изобретения Каждый живой организм постоянно атакуется инфекционными или патогенными агентами, такими как бактерии, вирусы, грибы или паразиты. Так называемая иммунная система оберегает организм от постоянных инфекций, заболеваний или интоксикации, вызванных такими агентами. Иммунную систему млекопитающего можно разделить на специфическую и неспецифическую части, хотя обе части тесно перекрестно связаны. Неспецифический иммунный ответ создает возможность для немедленной защиты от широкого множества патогенных веществ или инфекционных агентов. Специфический иммунный ответ возникает после лаг-фазы, когда вещество попадает в организм в первый раз. Указанный специфический иммунный ответ главным образом основан на выработке антигенспецифичных антител и образовании макрофагов и лимфоцитов, например цитотоксических Т-клеток(CTL). Специфический иммунный ответ ответственен за тот факт, что индивидуум, который выздоравливает от конкретной инфекции, защищен от данной конкретной инфекции, но по-прежнему восприимчив по отношению к другим инфекционным заболеваниям. В общем, повторная инфекция тем же самым или очень сходным инфекционным агентом вызывает намного более легкие симптомы или вообще не вызывает симптомов. Указанный так называемый иммунитет сохраняется в течение длительного времени, в некоторых случаях даже пожизненно. Лежащее в основе действие часто называют иммунологической памятью, которую можно использовать в целях вакцинации. Что касается вакцинации, описан способ, при котором индивидуума заражают безопасной, неполной или инактивированной формой инфекционного агента, чтобы оказать воздействие на иммунологический ответ, предпочтительно на его индуцирование у указанного индивидуума, который приводит к продолжительному - если не пожизненному - иммунитету против конкретного инфекционного агента. Заболевание оспы человека вызывается вирусом Variola. Вирус Variola относится к семейству Poxviridae, большому семейству сложных ДНК-вирусов, которые реплицируются в цитоплазме клеток позвоночных и беспозвоночных. Семейство Poxviridae можно разделить на два подсемейства Chordopoxvirinae и Entomopoxvirinae на основании круга хозяев - позвоночных и насекомых. Chordopoxvirinae помимо прочих включают родыOrthopoxviruses и Avipoxviruses (Fields Virology, ed. by Fields B.N., Lippincott-Raven Publishers, 3rd edition 1996, ISBN: 0-7817-0253-4, Chapter 83). К роду Orthopoxviruses относится вирус Variola, являющийся агентом, вызывающим натуральную оспу человека, а также другие вирусы, важные с экономической точки зрения, например вирус оспы верблюдов, коровьей оспы, оспы овец, оспы коз, оспы обезьян и вирус осповакцины (Vaccinia virus). Все представители данного рода генетически близки и имеют сходную морфологию или сходный круг хозяев. Карты рестрикции эндонуклеазами показали высокую идентичность последовательностей, составляющую до 90%, между различными представителями Orthopoxviruses (Mackett and Archard, [1979], J.Gen. Virol., 45: 683-701). Название вирус осповакцины (VV) дано агенту, который использовали по меньшей мере последние 100 лет для вакцинации против натуральной оспы. Не известно, является ли VV новым видом, полученным из вируса коровьей оспы или вируса натуральной оспы в результате длительных серийных пассажей, живым представителем ныне вымершего вируса или может быть продуктом генетической рекомбинации. Кроме того, на протяжении истории VV возникли многие штаммы осповакцины. Указанные различные штаммы проявляют разную иммуногенность и в разной степени вовлечены в возможные осложнения, наиболее серьезным из которых является поствакцинационный энцефалит. Однако многие из указанных штаммов использовали для вакцинации против натуральной оспы. Например, штаммы NYCBOH,Western Reserve или Wyeth использовали главным образом в США, тогда как штамм Ankara, Bern, Copenhagen, Lister и MVA использовали для вакцинации в Европе. В результате программы всемирной вакцинации указанными разными штаммами VV в 1980 г. ВОЗ наконец объявила об успешном искоренении вируса Variola. В настоящее время VV главным образом используют в качестве лабораторного штамма, но помимо этого его еще рассматривают как прототип Orthopoxviruses, что также является причиной того, почемуVV стал одним из наиболее интенсивно охарактеризованных вирусов (Fields Virology, ed. by Fields В.N.,Lippincott-Raven Publishers, 3rd edition 1996, ISBN: 0-7817-0253-4, Chapter 83 and 84).VV, а в последнее время и другие поксвирусы, использовали для встраивания чужеродных генов и их экспрессии. Основной способ встраивания чужеродных генов в живой инфекционный поксвирус заключается в рекомбинации между последовательностями ДНК поксвируса, фланкирующими чужерод-1 020230 ный генетический элемент в донорной плазмиде, и гомологичными последовательностями, присутствующими в спасающем поксвирусе. Генетическая рекомбинация в общем представляет собой обмен гомологичными участками ДНК между двумя нитями ДНК. В некоторых вирусах ДНК может быть заменена РНК. Гомологичными участками нуклеиновой кислоты являются участки нуклеиновой кислоты(ДНК или РНК), которые имеют одну и ту же последовательность нуклеотидных оснований. Генетическая рекомбинация может происходить естественным образом во время репликации или получения новых вирусных геномов в инфицированных клетках-хозяевах. Таким образом, генетическая рекомбинация между вирусными генами может происходить во время цикла репликации вируса, который происходит в клетке-хозяине, которая совместно инфицирована двумя или более различными вирусами или другими генетическими конструкциями. Участок ДНК из первого генома посредством взаимного обмена используют при конструировании участка генома второго совместно инфицирующего вируса, в котором ДНК гомологична ДНК первого вирусного генома. Успешная экспрессия встроенной генетической последовательности ДНК модифицированным инфекционным вирусом требует двух условий. Во-первых, инсерция должна осуществляться в не имеющую важного значения область вируса, для того чтобы указанный модифицированный вирус оставался жизнеспособным. Вторым условием для экспрессии встроенной ДНК является присутствие промотора,правильно взаимосвязанного со встроенной ДНК. В соответствии с требованиями промотор располагают выше последовательности ДНК, которую необходимо экспрессировать. Применимость рекомбинантного VV, экспрессирующего, например, поверхностный антиген вируса гепатита В (HBsAg), гемагглютинин вируса гриппа (InfHA) или антиген спорозоита Plasmodium knowlesi,в качестве живых вакцин для профилактики инфекционных заболеваний показана и описана (Smith et al.[1984] Biotechnology and Genetic Engineering Reviews 2, 383-407). Следующим преимуществом VV является способность принимать множество чужеродных последовательностей, генов или антигенов в один геном VV (Smith and Moss [1983], Gene, 25(1): 21-28). Кроме того, сообщалось, что можно вызвать иммунитет к ряду гетерологичных инфекционных заболеваний с помощью одной прививки поливалентной вакцины (Perkus et al., [1985], Science, Vol. 229, 981-984). Один пример экспрессии различных антигенов посредством единственного VV описан Bray et al. Показано, что рекомбинантный VV, который способен экспрессировать три разных структурных белка серотипа 4 вируса Денге, а именно белок капсида (С), премембранный белок (prM), белок оболочки (Е), и два неструктурных белка серотипа 4 вируса Денге, а именно NS1 и NS2a, обладал способностью защищать мышей от заражения гомологичным вирусом Денге серотипа 4 (Bray et al., [1989], Virology 28532856). Вирус Денге с его четырьмя серотипами, от вируса Денге серотипа 1 (Den-1) до вируса Денге серотипа 4 (Den-4), является одним из важных представителей рода Flavivirus по отношению к инфекциям человека. Инфекция вирусом Денге вызывает заболевания в диапазоне от подобных гриппу симптомов до тяжелой или смертельной болезни, геморрагической лихорадки Денге (DHF) с шоковым синдромом(DSS). Вспышки Денге остаются основной проблемой для здравоохранения в густонаселенных областях тропических и субтропических районов, где в изобилии имеются переносчики инфекции - комары. Беспокойство по поводу распространения инфекции Денге и других заболеваний, индуцированных флавивирусами, переносимыми комарами, во многих частях света привело к тому, что предпринимается больше усилий для того, чтобы разработать вакцины против Денге, которые могли бы предотвратить как лихорадку Денге (DF), так и геморрагическую лихорадку Денге (DHF), и вакцин, применимых для защиты вакцинированного человека от инфекций, индуцированных некоторыми или всеми переносимыми комарами флавивирусами. Хотя большинство случаев DF обнаруживаются после первой инфекции каким-либо их четырех серотипов, большой процент случаев DHF встречается у субъектов, которые инфицированы во второй раз серотипом, который отличается от первого инфицирующего серотипа вируса Денге. Результатом указанных наблюдений явилась гипотеза о том, что последовательная инфекция индивидуума, имеющего антитела против одного серотипа Денге, другим серотипом вируса через соответствующий интервал в ряде случаев может привести к DHF. Следовательно, вакцинация против одного серотипа не приводит к полной защите от инфекции вирусами Денге, а только против инфекции тем же самым штаммом вируса Денге. Еще более важно то, что для человека, вакцинированного против одного серотипа, существует повышенный риск развития тяжелых осложнений, таких как геморрагическая лихорадка Денге, в том случае, когда указанный человек подвергается инфекции штаммом вируса Денге другого серотипа. Таким образом, необходима поливалентная вакцина, которая содержит антигены всех четырех серотипов вируса Денге. До настоящего времени предлагалось получать поливалентные вакцины смешиванием панели рекомбинантных VV, где каждый VV кодирует последовательности разных вирусов (Moss, [1990] Immunology, 2, 317-327). Однако такая поливалентная вакцина обладает несколькими недостатками. Вопервых, трудоемким является создание нескольких независимых рекомбинантных VV. Кроме раздельных процессов получения также много времени занимают контроль качества и проверка качества. Во-2 020230 вторых, инфекция смесью рекомбинантных вирусов, экспрессирующих разные последовательности, всегда несет риск того, что процесс инфицирования не особенно хорошо сбалансирован. Главный риск состоит в том, что только отдельные рекомбинанты, а не все разные рекомбинанты, содержащиеся в поливалентной вакцине, будут инфицировать клетки-мишени. Одной из причин может быть неравномерное распределение рекомбинантных вирусов. Другой причиной могут быть взаимные помехи между разными рекомбинантными вирусами при инфицировании отдельных клеток. Такие взаимные помехи известны как явление суперинфекции. В данном случае только некоторые антигены, а не все разные антигены поливалентной вакцины, в конечном счете будут экспрессированы инфицированными клетками и, следовательно, представлены иммунной системе пациента. Как следствие будет получена иммунная защита только против некоторых антигенов, но это далеко от обеспечения полной иммунной защиты против различных антигенов, которые презентируются или могут быть презентированы поливалентной вакциной. В контексте вакцины против инфекции вирусом Денге подход на основе поливалентной вакцины имеет недостаток, состоящий в том, что если разные последовательности экспрессируются в разных количествах или непредсказуемым образом, как это показано для белка оболочки вируса Денге 2 (Deuble etal., [1988], J. Virol 65: 2853), то такая вакцинация в высокой степени рискованна для пациента. Неполная вакцинация с использованием панели рекомбинантных вирусов Vaccinia будет обеспечивать иммунную защиту только против некоторых, но не против всех серотипов вируса Денге. К сожалению, в случае инфекции Денге неполная вакцинация в высшей степени недопустима, так как она увеличивает риск летальных осложнений, таких как геморрагическая лихорадка Денге. Цель изобретения Таким образом, целью данного изобретения является предоставление стабильной, эффективной и надежной вакцины против инфекционных болезней, которые могут быть вызваны более чем одним штаммом, кладой, вариантом, подтипом или серотипом микроорганизма, вызывающего указанную инфекционную болезнь. Следующей целью данного изобретения является предоставление стабильной, эффективной и надежной вакцины против инфекций вирусом Денге, которая обеспечивает надежную вакцинацию против всех серотипов вируса Денге. Подробное описание изобретения Данное изобретение основано на идее включения в поксвирус гомологичных генов, полученных из разных штаммов, клад, вариантов, подтипов или серотипов микроорганизма, вызывающего инфекционное заболевание. Как уже упоминалось выше, существует, например, 4 группы, подтипа или серотипа вируса Денге, которые все содержат одни и те же типы генов, как, например, ген, кодирующий белок капсида (С), ген, кодирующий премембранный белок (PrM) или белок оболочки (Е). Однако последовательности нуклеиновой кислоты одного и того же типа гена не полностью идентичны и не в полной мере гомологичны соответственно во всех 4 серотипах: например, сравнение последовательностей (с помощью Lasergene 4.05 Magalign, Macintosh) между генами PrM серотипов 1, 2, 3 и 4 вируса Денге (PrM1-4) выявило идентичность последовательностей на 66,5-72,9%, т.е. гомология составляет примерно 65-75%. Предполагается, что различия и вариации в генах разных подтипов микроорганизмов, вызывающих инфекционное заболевание, соответственно, являются причиной того, почему вакцинация против одного подтипа не дает автоматически защиты против инфекций другими вариантами того же самого микроорганизма. Таким образом возникла идея создать рекомбинантный вирус, содержащий близкородственные или гомологичные гены, полученные из разных штаммов, клад, вариантов, подтипов или серотипов микроорганизма, вызывающего инфекционное заболевание. Однако, как уже указано выше, в ходе жизненного цикла вируса происходит гомологичная рекомбинация между гомологичными последовательностями, и она происходит даже между участками ДНК, которые не полностью гомологичны. Таким образом ожидалось, что инсерция гомологичных генов в один вирусный геном может привести к гомологичной рекомбинации и соответственно к делециям встроенных гомологичных генов. Однако при создании рекомбинантного модифицированного вируса осповакцины Анкара (MVA),содержащего в своем геноме по меньшей мере две чужеродных последовательности с гомологией по меньшей мере 60%, неожиданно обнаружено, что указанные гомологичные последовательности остаются стабильно встроенными в вирусный геном. Даже в том случае, когда гомологичные последовательности предпочтительно с гомологией по меньшей мере 50% встроены в разные сайты инсерции вирусного генома, эти последовательности также остаются стабильно встроенными в вирусный геном. В данном случае предполагалось, что события рекомбинации между указанными гомологичными последовательностями могут, кроме того, приводить к потере вирусных генов, важных для амплификации вируса и для жизненного цикла вируса, соответственно, т.е. предполагалось, что жизненный цикл вируса мог быть серьезно нарушен. Так как, кроме того,частота рекомбинации пропорциональна расстоянию между двумя связанными последовательностями,предполагалось, что частота событий рекомбинации между двумя или более гомологичными последовательностями, локализованными в разных сайтах инсерции, может быть высокой и, следовательно, приводить к делециям указанных последовательностей и/или серьезным взаимным помехам. Соответственно особенно неожиданным было то, что события рекомбинации не происходят и что гомологичные последовательности остаются стабильно встроенными в разные сайты инсерции вирусного генома. Согласно предшествующему уровню техники известны рекомбинантные поксвирусы, содержащие чужеродную ДНК из флавивируса, такого как вирус японского энцефалита (JEV), вирус желтой лихорадки (YFV) и вирус Денге (патент США 5514375). Однако каждый ген,полученный из указанных флавивирусов, встраивали только в разное время и в один и тот же сайт инсерции. Кроме того, сравнение последовательностей с помощью подходящей компьютерной программы (Lasergene 4.05 Megalign, Macintosh) выявило гомологию генов, встроенных в поксвирусный геном и полученных из JEV - 20,2-29,6%, изYFV - 29,2-45,3% и из вируса Денге - 22,8-29,5%. Сходное сообщение касается заявки на выдачу патента WO 98/13500, описывающей инсерцию антигенов вируса Денге в один и тот же сайт инсерции модифицированного вируса осповакцины Ankara(MVA), главным образом в сайт делеции II. В патенте США 5338683 описана инсерция генов гликопротеидов герпесвируса gp 13 и 14 в два разных сайта инсерции одного рекомбинантного поксвируса; однако оба гена имели гомологию, составляющую только 25,2%. Сравнение последовательностей между геном гемагглютинина и геном нуклеопротеида вируса гриппа, встроенных в один и тот же сайт инсерции (сайт делеции III) модифицированного вируса осповакцины Ankara (MVA), выявило гомологию, составляющую 49,1% (патент США 5676950; Sutter et al.,[1994], Vaccine 12: 1032). В патенте США 5891442 описан рекомбинантный поксвирус, содержащий кодирующую последовательность полибелка VP2, VP3 и VP4 инфекционного бурсита. Указанные гены сливали и таким образом встраивали в один сайт инсерции, и они имели гомологию 41,9-50,3%. Наконец в патенте США 6217882 описан рекомбинантный вектор на основе вируса оспы свиней,содержащий антигены инфекционного бульбарного паралича gp50 и gp63 с гомологией 52,7%, встроенные в один и тот же сайт инсерции. В заключение можно констатировать, что согласно предшествующему уровню техники гомологичные гены или последовательности, имеющие гомологию, составляющую по меньшей мере 50%, все встраивали в один и тот же или сразу в один сайт инсерции вирусного генома. Согласно данному изобретению гомологичные последовательности имеют гомологию по меньшей мере 50%, т.е. гомологию, составляющую 50-100%, т.е. по меньшей мере 50% идентичных оснований нуклеотидов. Последовательности, имеющие гомологию меньше 50%, можно считать гетерологичными. В контексте данного изобретения термин гомологичные или гомология используют в том случае,когда последовательности сравнивают друг с другом, тогда как термины чужеродная, экзогенная или гетерологичная последовательность используют в том случае, когда последовательности сравнивают с геномом вируса MVA; т.е. указанные термины относятся к последовательности ДНК, которая в природе обычно не встречается ассоциированной с вирусом MVA, который используется согласно изобретению. Таким образом, данное изобретение относится к рекомбинантному MVA, содержащему по меньшей мере две последовательности, которые являются гетерологичными по сравнению с вирусным геномом, но которые являются гомологичными между собой. Согласно одному варианту данного изобретения гомология последовательностей составляет предпочтительно от 70 до 80%, более предпочтительно от 80 до 90% или от 90 до 100%. Наиболее предпочтительна гомология от 65 до 75%. Так как рекомбинантный вирус MVA согласно данному изобретению содержит соответствующую генетическую информацию в одной единственной инфекционной единице или только в одной вирусной частице, не существует риска неравномерной инфекции и несбалансированной экспрессии разных гомологичных последовательностей. Таким образом, рекомбинантный вирус MVA согласно данному изобретению, содержащий и способный экспрессировать несколько близких или даже наиболее близких или почти идентичных последовательностей в одной инфицированной клетке, является особенно предпочтительным для создания поливалентных вакцин. Указанное преимущество представляет особый интерес для разработки вакцин против заболеваний,которые могут быть вызваны несколькими близко родственными штаммами или серотипами вируса, подобного, например, вирусу Денге. Рекомбинантные вирусы MVA, содержащие гомологичные гены разных серотипов вируса Денге, описаны в примерах. Гомологичные последовательности согласно данному изобретению можно получить из любого микроорганизма, такого как любой вирус, за исключением векторного вируса, любая бактерия, любой гриб или паразит. Предпочтительно гомологичные последовательности получают из инфекционного или патогенного микроорганизма и наиболее предпочтительно из разных штаммов или клад, вариантов, подтипов или серотипов указанного микроорганизма. Термины штамм или клада являются техническими терминами, хорошо известными специалистам, относящимися к таксономии микроорганизмов. Таксономическая система классифицирует все охарактеризованные до настоящего времени микроорганизмы в иерархическом порядке в семейства, роды,виды, штаммы (Fields Virology, ed. by Fields B.N., Lippincott-Raven Publishers, 4th edition 2001). В то время как критерием для представителей семейства является их филогенетическая взаимосвязь, род включает в себя всех представителей, которые проявляют общие свойства, и вид определяют как класс, основанный на сравнении нескольких признаков, который составляет воспроизводящую линию и занимает конкретную экологическую нишу. Термин штамм или клада описывает микроорганизм, т.е. вирус, который проявляет общие признаки, подобные основной морфологии или структуре и организации генома, но отличаются по биологическим свойствам, подобным кругу хозяев, тканевому тропизму, географическому распространению, аттенюации или патогенности. Термин варианты или серотипы дополнительно дифференцирует представителей одного и того же штамма, также называемых подтипами, которые проявляют индивидуальный спектр инфекции или антигенные свойства вследствие минорных вариаций генома. Согласно следующему варианту данного изобретения гомологичные последовательности выбраны из вирусов, предпочтительно вирусов, которые относятся к роду флавивирусов, таких как предпочтительно - но не ограничивая указанным - вирус Денге, вирус Западного Нила или вирус японского энцефалита; которые относятся к роду ретровирусов, таких как предпочтительно - но не ограничивая указанным - вирус иммунодефицита человека (ВИЧ); которые относятся к роду энтеровирусов, таких как предпочтительно - но не ограничивая указанным - вирус ящура, EV71; которые относятся к роду ротавирусов или которые относятся к роду ортомиксовирусов, таких как предпочтительно - но не огранивая указанным - вирус гриппа. Наиболее предпочтительно гомологичные последовательности получают из флавивируса. Согласно следующему предпочтительному варианту гомологичные последовательности выбраны генов вируса Денге, предпочтительно С, NS1 и/или NS2, или предпочтительно Е, более предпочтительноPrM. Наиболее предпочтительными являются гомологичные последовательности, полученные из разных серотипов вируса, при этом указанные последовательности могут быть получены из одного, двух, трех или из всех 4 серотипов вируса Денге. Согласно еще одному варианту гомологичные последовательности выбраны из разных штаммов или клад ВИЧ. Предпочтительно гомологичные последовательности выбраны из кодирующей последовательности gag/pol, более предпочтительно из кодирующей последовательности env или еще более предпочтительно из комбинации структурных и/или регуляторных кодирующих последовательностей ВИЧ. Векторный вирус, подходящий для данного изобретения, выбран из группы поксвирусов, которые можно легко культивировать в выбранных клетках-хозяевах, таких как, например, клетки-хозяева птиц,но которые в высокой степени дефицитны по репликации или фактически не реплицируются у человека или в клетках человека. Согласно следующему варианту данного изобретения используют аттенюированный вирус осповакцины для создания рекомбинантных поксвирусов и вирусов MVA соответственно, содержащих две или более гомологичных последовательности. Хотя известно, что вирусы осповакцины (VV) могут подвергаться гомологичной рекомбинации коротких гомологичных последовательностей и поэтому могут происходить делеции гомологичных последовательностей (Howley et al., [1996], Gene 172: 233-237), авторы данного изобретения предлагают рекомбинантный вирус осповакцины, содержащий гомологичные последовательности или гены, стабильно встроенные в его геном. Кроме того, как показано в примерах, экспрессия указанных гомологичных генов может управляться одним и тем же, т.е. идентичным промотором с гомологией, составляющей соответственно 100%, в частности ранним/поздним промотором р 7.5 вируса осповакцины. Указанные открытия особенно неожиданны, так как согласно Howley et al. даже короткие последовательности длиной до 300 пар оснований (п.о.) достаточны для того, чтобы индуцировать перестройки генома и делецию гомологичных последовательностей в вирусе осповакцины. Таким образом, специалист может ожидать, что более длинные последовательности будут индуцировать события рекомбинации с еще более высокой вероятностью. Однако согласно данному изобретению даже последовательности, содержащие полностью гомологичные гены, могут быть стабильно встроены в геном вируса осповакцины, в значительной степени аттенюированный штамм осповакцины с ограниченным кругом хозяев - модифицированный вирус осповакцины Ankara (MVA) (Sutter, G. et al. [1994], Vaccine 12: 1032-40). MVA был создан примерно при проведении 570 серийных пассажей на фибробластах эмбрионов цыплят штамма Ankara вируса осповакцины (CVA) (для обзора см. Mayr, A. et al. [1975], Infection 3, 6-14). Вследствие указанных длительных пассажей в CVA были делетированы примерно 31 тысяча оснований в его геномной последовательности. Полученный в результате вирусный штамм MVA описан как штамм с очень ограниченным кругом клеток-хозяев (Meyer, H. et al., J. Gen. Virol. 72, 1031-1038 [1991]). Типичным штаммом MVA является штамм MVA 575, который был депонирован в Европейской коллекции культур клеток животных с номером депозита ЕСАСС V00120707. В другом варианте осуществления можно использовать штамм MVA-Vero или его производный. Штамм MVA-Vero депонирован в Европейской коллекции культур клеток животных с номером депозита ЕСАСС V99101431 и ЕСАСС 01021411. Безопасность MVA-Vero отображена биологическими, химическими и физическими характеристиками, которые описаны в международной заявке на выдачу патента РСТ/ЕР 01/02703. По сравнению с нормальным MVA MVA-Vero имеет одну дополнительную делецию в геноме. Термин производные вируса согласно данному изобретению относится к потомству вирусов, проявляющему такие же характерные признаки, как и родительский вирус, но в котором обнаруживаются различия в одной или нескольких частях генома. В еще одном варианте согласно данному изобретению используют MVA-BN. MVA-BN депонирован в Европейской коллекции культур клеток животных с номером депозита ЕСАСС V00083008. Используя MVA-BN или его производное, создают особенно безопасную вирусную вакцину, так как было показано, что вирус MVA-BN является очень сильно аттенюированным вирусом, полученным из модифицированного вируса осповакцины Ankara. Таким образом, в наиболее предпочтительном варианте в качестве вирусного вектора используют MVA-BN или его производные, содержащие два или более гомологичных генов согласно данному изобретению. Термин производное MVA-BN описывает вирус,который имеет такие же функциональные характеристики, сравнимые с MVA-BN. Признаки MVA-BN,описание биологических анализов, позволяющих оценить, является ли MVA вирусом MVA-BN и его производным, и способы, позволяющие создавать MVA-BN или его производные, описаны в WO 02/42480 (включена в данное описание в виде ссылки). Одним из простых путей оценки функциональной характеристики MVA-BN и его производных является оценка его аттенюации и отсутствия репликации в клетках HaCat человека. В рекомбинантном вирусе MVA согласно данному изобретению экспрессия экзогенных последовательностей предпочтительно контролируется элементом регуляции транскрипции поксвируса, более предпочтительно элементом регуляции транскрипции MVA, оспы канареек, оспы домашних птиц или оспы пингвинов или наиболее предпочтительно промотором вируса осповакцины. Поксвирусные элементы регуляции транскрипции согласно данному изобретению, кроме того, включают все элементы регуляции транскрипции, функциональные в поксвирусной системе. Инсерция экзогенных последовательностей согласно данному изобретению предпочтительно направлена в несущественную область вирусного генома. Несущественными областями являются, например, локусы или открытые рамки считывания (ORF) поксвирусных генов, которые не являются необходимыми для жизненного цикла поксвируса. Также в качестве несущественных областей согласно данному изобретению рассматриваются межгенные области, которыми характеризуют пространство между двумя ORF. В другом варианте изобретения экзогенные последовательности встраивают во встречающийся в природе сайт делеции в геноме MVA (описан в РСТ/ЕР 96/02926, которая включена в данное описание в виде ссылки). Ориентация встроенной ДНК не оказывает влияния на функциональность или стабильность рекомбинантного вируса согласно данному изобретению. Так как рекомбинантный вирус MVA согласно изобретению является сильно ограниченным в отношении роста и, следовательно, сильно аттенюированным, он является идеальным кандидатом для лечения широкого круга млекопитающих, включая человека и даже людей с нарушенной иммунологической реактивностью. Поэтому в данном изобретении также предлагается фармацевтическая композиция,а также вакцина для индукции иммунного ответа в живом организме животного, включая человека. Фармацевтическая композиция, как правило, может включать в себя один или несколько фармацевтически приемлемых и/или разрешенных к применению носителей, добавок, антибиотиков, консервантов, адъювантов, разбавителей и/или стабилизаторов. Такими вспомогательными веществами могут быть вода, физиологический раствор, глицерин, этанол, увлажняющие или эмульгирующие агенты, вещества для рН-буферов или тому подобное. Подходящими носителями обычно являются крупные медленно метаболизируемые молекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, агрегаты липидов или тому подобное. Для получения вакцин рекомбинантный вирус MVA согласно изобретению превращают в физиологически приемлемую форму. Это можно осуществить на основе опыта приготовления поксвирусных вакцин, используемых для вакцинации против натуральной оспы (как описано Stickl, H. et al. [1974]Dtsch. med. Wschr. 99, 2386-2392). Например, очищенный вирус хранят при -80 С с титром 510 Е 8 ТЦИД 50/мл, приготовленным примерно в 10 мМ трис, 140 мМ NaCl, pH 7,4. Для приготовления небольших доз вакцины, например, 10 Е 2-10 Е 8 частиц вируса, лиофилизируют в 100 мл фосфатно-солевого буфера (PBS) в присутствии 2% пептона и 1% альбумина человека в ампуле, предпочтительно стеклянной ампуле. Альтернативно небольшие дозы вакцины можно получить ступенчатой сушкой вымораживанием вируса в композиции. Указанная композиция может содержать дополнительные добавки, такие как маннит, декстран, сахар, глицин, лактозу или поливинилпирролидон или другие вспомогательные вещества, такие как антиоксиданты или инертный газ, стабилизаторы или рекомбинантные белки (например,сывороточный альбумин человека), подходящие для введения in vivo. Затем стеклянную ампулу герметично запаивают, и ее можно хранить при температуре от 4 С до комнатной температуры в течение нескольких месяцев. Однако если в этом нет необходимости, ампулу предпочтительно хранят при температуре ниже -20 С. Для вакцинации или лечения лиофилизат можно растворять в 0,1-0,5 мл водного раствора, предпочтительно физиологического раствора или трис-буфера, и вводить либо системно, либо местно, т.е. парентерально, подкожно, внутривенно, внутримышечно, скарификацией или любым другим путем введения,известным специалисту. Способ введения, доза и число введений могут быть оптимизированы специалистами в данной области известным способом. Однако в большинстве случаев пациента вакцинируют второй дозой спустя период времени примерно от одного месяца до шести недель после первой дозы вакцинации. Рекомбинантный вирус согласно данному изобретению используют для введения экзогенных кодирующих последовательностей в клетку-мишень. Введение экзогенной кодирующей последовательности в клетку-мишень можно использовать для получения in vitro белков, полипептидов, пептидов, антигенов и эпитопов, соответственно. Кроме того, способ введения гомологичной или гетерологичной последовательности в клетки можно применять для терапии in vitro и in vivo. В случае терапии in vitro выделенные клетки, которые предварительно (ex vivo) были инфицированы рекомбинантным вирусом MVA согласно изобретению, вводят в организм животного для индукции иммунного ответа. В случае терапии in vivo рекомбинантный вирус согласно изобретению непосредственно вводят в организм животного для индукции иммунного ответа. В данном случае клетки, окружающие место инокуляции, непосредственно инфицируются in vivo вирусом или его рекомбинантом согласно изобретению. После инфекции клетки синтезируют белки, полипептиды, пептиды или антигены, которые кодируются экзогенными кодирующими последовательностями, и затем презентируют их или их части на клеточной поверхности. Специализированные клетки иммунной системы узнают презентацию таких чужеродных белков, полипептидов,пептидов, антигенов и эпитопов и запускают специфичный иммунный ответ. Способы получения рекомбинантных вирусов MVA или инсерции экзогенных кодирующих последовательностей в вирусный геном хорошо известны специалисту в данной области. Кроме того, способ описан в примерах, а также его можно найти и дополнить, используя следующие публикации:Cold Spring Harbor Laboratory Press. 1989: описаны методики и специальные приемы стандартных методик молекулярной биологии, таких как методики клонирования ДНК, выделения ДНК и РНК, Вестернблот-анализа, ОТ-ПЦР и ПЦР-амплификации.Virology Methods Manual. Edited by Brian W. J. Mahy and Hillar O. Kangro. Academic Press. 1996: описаны методики обращения и манипулирования вирусами.Expression of proteins in mammalian cells using Vaccinia viral vector: описаны методики и специальные приемы обращения, манипулирования и генетического конструирования MVA. Для создания рекомбинантных вирусов MVA согласно данному изобретению могут быть использованы различные способы. Последовательность, которую необходимо встроить в вирус, может быть помещена в конструкцию плазмиды Е. coli, в которую была встроена ДНК, гомологичная участку ДНК поксвируса. Последовательность ДНК, которую необходимо встроить, отдельно лигируют с промотором. Соединение промотор-ген располагают в плазмидной конструкции так, чтобы соединение промотор-ген было фланкировано с обоих концов ДНК, гомологичной последовательности ДНК, фланкирующей область ДНК поксвируса, содержащую несущественный локус. Полученную в результате плазмидную конструкцию амплифицируют выращиванием в бактериях Е. coli и выделяют. Выделенную плазмиду, содержащую последовательность ДНК встраиваемого гена, трансфицируют в культуру клеток, например,фибробласты куриных эмбрионов (CEF) вместе с поксвирусом. Рекомбинация между гомологичной ДНК поксвируса в плазмиде и вирусным геномом, соответственно, дает поксвирус, модифицированный благодаря присутствию чужеродных последовательностей ДНК. Согласно более предпочтительному варианту клетку подходящей культуры клеток, например клеток CEF, инфицируют вирусом MVA. Затем инфицированную клетку трансфицируют первым плазмидным вектором, содержащим чужеродную последовательность предпочтительно под транскрипционным контролем элемента регуляции экспрессии поксвируса. Как указано в объяснении выше, плазмидный вектор также содержит последовательности, способные направлять инсерцию экзогенной последовательности в выбранную часть генома вируса MVA. Необязательно плазмидный вектор также содержит кассету, содержащую маркерный и/или селектируемый ген, функционально связанный с поксвирусным промотором. Подходящими маркерными или селектируемыми генами являются, например, гены, кодирующие зеленый флуоресцентный белок, 6-галактозидазу, неомицин, фосфорибозилтрансферазу или другие маркеры. Использование кассет для селекции или маркерных кассет упрощает идентификацию и выделение созданного рекомбинантного вируса. Однако рекомбинантный вирус MVA также можно идентифицировать с помощью методики ПЦР. Затем следующую клетку инфицируют рекомбинантным вирусом, полученным, как описано выше, и трансфицируют вторым вектором, содержащим последовательность, кото-7 020230 рая является гомологичной последовательности, включенной в первый вектор. В том случае, если данная последовательность должна быть включена в другой сайт инсерции вирусного генома, второй вектор также отличается по последовательности, направляющей интеграцию гомологичной последовательности в геном вируса MVA. После того как произойдет гомологичная рекомбинация, можно выделить рекомбинантный вирус, содержащий две гомологичных последовательности. Для введения более двух гомологичных последовательностей в рекомбинантный вирус стадии инфекции и трансфекции повторяют, используя для инфекции рекомбинантный вирус, выделенный на предыдущей стадии, и используя для трансфекции следующий вектор, содержащий следующую гомологичную последовательность. Альтернативно стадии инфекции и трансфекции, которые описаны выше, являются взаимно заменяемыми, т.е. подходящую клетку сначала можно трансфицировать плазмидным вектором, содержащим чужеродный ген, а затем инфицировать вирусом MVA. В качестве следующей альтернативы также можно вводить каждую гомологичную последовательность в разные вирусы, клетку совместно инфицировать всеми полученными рекомбинантными вирусами и проводить скрининг в отношении рекомбинанта, в который включены все гомологичные последовательности. В изобретении, кроме того, предлагается набор, содержащий две или более плазмидных векторных конструкций, способных направлять интеграцию экспрессируемых гомологичных последовательностей в геном вируса MVA. Кроме подходящего сайта клонирования такие плазмидные векторы содержат последовательности, способные направлять инсерцию экзогенной последовательности в выбранные части генома поксвируса. Необязательно такие векторы содержат кассеты селектируемых или маркерных генов. Набор, кроме того, содержит средства и инструкции для селекции вирусов, которые являются рекомбинантами в отношении одной или нескольких гомологичных последовательностей, и необязательно селектируемого или маркерного гена, встраиваемого посредством указанных векторных конструкций. Согласно еще одному варианту в изобретение включены последовательности ДНК или их части,полученные из рекомбинантного вируса MVA или гомологичные рекомбинантному вирусу MVA согласно данному изобретению. Такие последовательности могут содержать часть экзогенной последовательности, содержащей фрагмент гомологичного гена, и, по меньшей мере, фрагмент последовательности генома вируса MVA согласно данному изобретению, при этом указанные последовательности генома вируса MVA предпочтительно фланкируют экзогенную последовательность. Такие последовательности ДНК можно использовать для идентификации и выделения вируса или его производных, например, используя их для создания ПЦР-праймеров, зондов для гибридизации или в способах на основе матриц. Краткое описание чертежей Фиг. 1. Схематичное представление сайтов инсерции четырех генов PrM (= премембранных) (серотипы 1-4) в геноме MVA согласно примеру 1. Фиг. 2-9 и 12-17. Конструкции инсерционных плазмидных векторов с указанием названия вектора,его размера и положения представляющих интерес последовательностей, таких как: AmpR = ген резистентности к ампициллину, bfp = ген белка с голубой флуоресценцией, dA = делеция A, dE = делеция Е,d2 = делеция 2, Ecogpt = ген гуанозинфосфорибозилтрансферазы Е. coli, EGFP = ген белка с усиленной зеленой флуоресценцией, F1 = фланкирующая последовательность 1, F2 = фланкирующая последовательность 2, I4L = межгенная область I4L, IGR = межгенная область, NPT II = ген резистентности к неомицину, Р = промотор поксвируса, pr7.5 = промотор Vaccinia 7.5, PrM = ген премембранного белка вируса Денге, при этом номер указывает, из какого из четырех серотипов он получен, rpt = повторение фланкирующей последовательности. Фиг. 10. Подтверждение с помощью ПЦР методик векторного клонирования четырех разных инсерционных векторов (pBN49, pBN50, pBN40, pBN39). Каждую из плазмид тестировали с 4 разными комбинациями ПЦР-праймеров. Каждая комбинация является специфичной для одной отдельной последовательности PrM, интегрированной в один отдельный сайт инсерции. Фиг. 11. Проверка с помощью ПЦР рекомбинантного поксвируса, содержащего четыре гомологичных гена PrM вируса Денге (пример 1). В то время как в верхней части геля показаны результаты различных ПЦР рекомбинантного вируса, в нижней части представлены результаты тех же самых реакций ПЦР для контрольных плазмид, которые указаны. Плазмиды, содержащие гомологичные последовательности, названы pBN39, pBN49 или pBN50. PrM означает встроенные гены премембранных белков вируса Денге, где номера указывают, из какого из четырех серотипов он получен. dA = делеция A, dE = делеция Е, d2 = делеция 2, I4L = межгенная область I4L, изображает сайт инсерции экзогенной ДНК. Фиг. 18. Схематичное представление сайтов инсерции трех генов PrM (серотипы 2-4) в геноме MVA согласно примеру 2. Фиг. 19. Проверка с помощью ПЦР рекомбинантного поксвируса, содержащего три гомологичных гена PrM вируса Денге, встроенные в межгенные области (пример 2). На верхней панели показаны результаты реакций ПЦР, специфичных в отношении PrM2; на средней панели показаны результаты реак-8 020230 ций ПЦР, специфичных для PrM3, и на нижней панели показаны результаты реакций ПЦР, специфичных для PrM4. На дорожке 8 показаны такие же реакции ПЦР для контрольных плазмид. На дорожке 2 показан пустой контрольный вектор MVA. PrM означает встроенные гены премембранных белков вируса Денге, где номера указывают, из какого из четырех серотипов он получен. М = маркер молекулярной массы. Следующие примеры будут дополнительно иллюстрировать данное изобретение. Специалисту в данной области будет хорошо понятно, что предложенные примеры ни коим образом не могут быть интерпретированы как способ ограничения применимости методики, предлагаемой в данном изобретении,указанными примерами. Пример 1. Инсерционные векторы Инсерционный вектор для делеции А Для инсерции экзогенных последовательностей в геном MVA в так называемый сайт делеции А или делеции 1, соответственно, соответствующий положению в геноме 7608-7609, конструировали плазмидный вектор, который содержит примерно 600 п.о. фланкирующих последовательностей, прилежащих к сайту делеции А. Чтобы выделить фланкирующие последовательности из геномной ДНК MVA-BN, конструировали подходящие ПЦР-праймеры с помощью подходящей компьютерной программы (DNAsis,Hitashi software engeneering, San Bruno, USA). Такие праймеры содержат удлинения с сайтами для ферментов рестрикции, которые будут использованы для клонирования фланкирующих последовательностей в векторной плазмиде. Между указанными фланкирующими последовательностями вводят кассету селектируемого гена, например гена NPT II (резистентности к неомицину), под транскрипционным контролем промотора поксвируса. Кроме того, имеется сайт клонирования для встраивания дополнительных генов или экзогенных последовательностей, которые необходимо встроить в сайт делеции А. Одна из таких конструкций вектора согласно данному изобретению изображена на фиг. 2 (pBNX10). Инсерционный вектор для делеции Е Для инсерции экзогенных последовательностей в геном MVA в так называемый сайт делеции Е или делеции 4, соответственно, соответствующий положению в геноме 170480-170481, конструировали вектор, который содержит примерно 600 п.о. фланкирующих последовательностей, прилежащих к сайту делеции Е. Вектор разрабатывают и конструируют подобно тому, как описано выше. Между фланкирующими последовательностями располагают ген EGFP (белок с зеленой флуоресценцией, Clonetech) под транскрипционным контролем промотора поксвируса. Кроме того, имеется сайт клонирования для встраивания дополнительных генов или последовательностей, которые необходимо встроить в сайт делеции А. Одна такая конструкция вектора согласно данному изобретению изображена на фиг. 3(pBNX32). Инсерционный вектор для делеции 2 Для инсерции экзогенных последовательностей в геном MVA в так называемый сайт делеции 2, соответствующий положению в геноме 20718-20719, конструировали вектор, который содержит примерно 600 п.о. фланкирующих последовательностей, прилежащих к сайту делеции 2. Вектор разрабатывают и конструируют подобно тому, как описано выше. Между фланкирующими последовательностями располагают ген hbfp (гуманизированный белок с зеленой флуоресценцией, Pavalkis G.N. et al.) под транскрипционным контролем промотора поксвируса. Кроме того, имеется сайт клонирования для встраивания дополнительных генов или последовательностей, которые необходимо встроить в сайт делеции 2. Одна такая конструкция вектора согласно данному изобретению изображена на фиг. 4 (pBNX36). Инсерционный вектор для межгенной области I4L Для инсерции экзогенных последовательностей в межгенную область между ORF I3L и I4L, соответствующую положению в геноме 56760, конструировали вектор, который содержит примерно 600 п.о. фланкирующих последовательностей, прилежащих к межгенной области у локуса I4L. Вектор разрабатывают и конструируют подобно тому, как описано выше. Между фланкирующими последовательностями располагают ген Ecogpt (или gpt, означающий ген фосфорибозилтрансферазы, выделенный из Е.coli) под транскрипционным контролем промотора поксвируса. Кроме того, имеется сайт клонирования для встраивания дополнительных генов или последовательностей, которые необходимо встроить в межгенную область после ORF 14L. Одна такая конструкция вектора согласно данному изобретению изображена на фиг. 5 (pBNX39). Конструирование рекомбинантного поксвируса, содержащего несколько гомологичных генов, интегрированных в его геном. Инсерционные векторы Для инсерции четырех генов PrM четырех серотипов вируса Денге в геном MVA использовали четыре независимых рекомбинантных вектора. Указанные векторы содержат - как подробно описано выше - последовательности, гомологичные геному MVA для целенаправленной инсерции путем гомологичной рекомбинации. Кроме того, каждый вектор содержит кассету селектируемого или репортерного гена. Последовательности PrM четырех серотипов вируса Денге получали синтетически путем отжига олигонуклеотидов и ПЦР-амплификации. Последовательности PrM клонировали ниже промоторных элементов поксвируса, чтобы образовать экспрессируемую кассету. Затем данную экспрессируемую кассету клонировали в сайте клонирования соответствующих конструкций инсерционных векторов. В результате конструкция инсерционного вектора для делеции А содержала ген PrM серотипа 2 вируса Денге (фиг. 6 - pBN39). Конструкция инсерционного вектора для делеции 2 содержала ген PrM серотипа 1 вируса Денге (фиг. 7 - pBN49). Конструкция инсерционного вектора для межгенной области I4L содержала ген PrM серотипа 3 вируса Денге (фиг. 8 - pBN50). Конструкция инсерционного вектора для делеции Е содержала ген PrM серотипа 4 вируса Денге (фиг. 9 - pBN40). Проверка инсерционных векторов с помощью ПЦР Для проверки методики клонирования осуществляли ПЦР-анализы. Для указанных ПЦР-анализов выбранная пара праймеров представляет собой комбинацию праймера, специфично связывающегося с конкретной фланкирующей последовательностью, родственной сайту инсерции, и второго праймера,специфично связывающегося с одним из высоко гомологичных генов PrM вируса Денге. Скрининг инсерционного вектора для делеции А, содержащего ген PrM серотипа 2 вируса Денге,проводили с использованием праймеров oBN93 (CGCGGATCCATGCTGAACATCTTGAACAGGAGACGCAGA, SEQ ID NO: 1) и oBN477 (CATGATAAGAGATTGTATCAG, SEQ ID NO: 2). Скрининг инсерционного вектора для делеции 2, содержащего ген PrM серотипа 1 вируса Денге,проводили с использованием праймеров oBN194 (ATGTTGAACATAATGAACAGGAGGAAAAGATCTGTGACCATGCTCCTCATGCTGCTGCCCACAGCCCTGGCGTTCCATCT, SEQ ID NO: 3) иoBN476 (GATTTTGCTATTCAGTGGACTGGATG, SEQ ID NO: 4). Скрининг инсерционного вектора для межгенной области 14L, содержащего ген PrM серотипа 3 вируса Денге, проводили, используя праймеры oBN255 (CCTTAATCGAATTCTCATGTCATGGATGGGGTAACCAGCATTAATAGT, SEQ ID NO: 5) и oBN479 (GCTCCCATTCAATTCACATTGG, SEQ ID NO: 6). Скрининг инсерционного вектора для делеции Е, содержащего ген PrM серотипа 4 вируса Денге,проводили с использованием праймеров oBN210 (ATCCCATTCCTGAATGTGGTGTTAAAGCTACTGAGCGCTTCTCTCGTCTCCGTTCTCCGCTCTGGGTGCATGTCCCATAC, SEQ ID NO: 7) иoBN478 (GTACATGGATGATATAGATATG, SEQ ID NO: 8). Эксперименты ПЦР осуществляли в термоциклере GeneAmp 9700 (Perkin Elmer), используя набор с ДНК-полимеразой Taq, содержащий 10 ПЦР-буфер, MgCl2-буфер и ДНК-полимеразу Taq (Roche,в каталоге 201205) или эквивалент. В общем, реакции ПЦР готовили в общем объеме реакции 50 мкл, содержащем 45 мкл основной смеси, образец ДНК и ddH2O до нужного объема. Основную смесь необходимо приготовить с использованием 30,75 мкл DdH2O, 5 мкл 10 буфера, 1 мкл смести dNTP (10 мМ каждого), 2,5 мкл каждого праймера (5 пмоль/мкл), 3 мкл MgCl2 (25 мМ) и 0,25 мкл Taq-полимеразы На основании размера встраиваемого гена время элонгации должно составлять по меньшей мере 1 мин/т.о. Результаты ПЦР, показанные на фиг. 10, свидетельствуют о специфичности комбинаций праймеров,используемых для отдельных инсерций. Комбинация праймеров oBN194/oBN476 специфична для делеции 2 и PrM1 в качестве вставки. Ожидаемый фрагмент ПЦР плазмиды pBN49 имеет размер 678 п.о. (показан на дорожке 3, верхняя часть геля). Комбинация праймеров oBN255/oBN479 специфична для межгенной области I4L и PrM3 в качестве вставки. Ожидаемый фрагмент ПЦР плазмиды pBN50 имеет размер 825 п.о. (показан на дорожке 9, верхняя часть геля). Комбинация праймеров oBN210/oBN478 специфична для делеции Е и PrM4 в качестве вставки. Ожидаемый фрагмент ПЦР плазмиды pBN40 имеет размер 607 п.о. (показан на дорожке 5, нижняя часть геля). Комбинация праймеров oBN93/oBN477 специфичная для делеции А и PrM2 в качестве вставки. Ожидаемый фрагмент ПЦР плазмиды pBN39 имеет размер 636 п.о. (показан на дорожке 11, нижняя часть геля). Образование рекомбинанта MVA посредством гомологичной рекомбинации Для экспрессии чужеродных генов рекомбинантным MVA указанные гены должны быть встроены в вирусный геном посредством процесса, называемого гомологичной рекомбинацией. С этой целью представляющий интерес чужеродный ген клонировали в инсерционном векторе, как описано выше. Указанный вектор должен быть трансфицирован после инфекции клеток MVA-BN. Рекомбинация будет происходить в клеточной цитоплазме инфицированных и трансфицированных клеток. С помощью селектируемой и/или репортерной кассеты, которая также находится в инсерционном векторе, идентифицируют и выделяют клетки, содержащие рекомбинантные вирусы. Гомологичная рекомбинация Для гомологичной рекомбинации клетки ВНК (клетки почки сирийского хомячка) или клетки CEF(модифицированная Дюльбекко среда Игла, Gibco BRL) + 10% фетальной сыворотки теленка (FCS) илиVP-SFM (Gibco BRL) + 4 ммоль/1 л L-глутамина в случае способа получения без сыворотки. Клетки должны быть все еще в фазе роста и поэтому должны достигать 60-80% слияния в день трансфекции. Клетки перед посевом подсчитывали, так как для инфекции необходимо знать количество клеток для определения множественности инфекции (moi). Для инфекции исходную культуру MVA разбавляют в DMEM/FCS или VP-SFM/L-глутамин так,чтобы 500 мкл разбавления содержали соответствующее количество вируса, которое даст moi, равное 0,01. Предполагается, что клетки делятся один раз после посева. Среду удаляют из клеток и клетки инфицируют 500 мкл разбавленного вируса в течение 1 ч на качалке при комнатной температуре. Инокулят удаляют и клетки промывают DMEM/VP-SFM. Инфицированные клетки оставляют в 1,6 мл DMEM/FCS и VP-SFM/L-глутамин, соответственно, пока готовят реакцию трансфекции (набор Qiagen Effectene). Для трансфекции используют набор для трансфекции Effectene (Qiagen). Смесь для трансфекции готовят из 1-5 мкг линеаризованного инсерционного вектора (общее количество для множественной трансфекции) с буфером ЕС, получая конечный объем 150 мкл. Добавляют 8,0 мкл усилителя на мкг ДНК, встряхивают и инкубируют при комнатной температуре в течение 5 мин. Затем после встряхивания пробирки с исходной культурой добавляют 25 мкл Effectene на мкг ДНК и раствор тщательно перемешивают с помощью встряхивания и инкубируют при комнатной температуре в течение 10 мин. Добавляют 600 мкл DMEM/FCS и VP-SFM/L-глутамин, соответственно, смешивают и затем полную смесь для трансфекции добавляют к клеткам, которые уже покрыты средой. Чашку осторожно встряхивают, чтобы перемешать реакционную смесь для трансфекции. Инкубация происходит при 37 С с 5% СО 2 в течение ночи. На следующий день среду удаляют и заменяют свежей DMEM/FCS или VP-SFM/L-глутамин. Инкубацию продолжают вплоть до 3 дня. Для сбора клетки соскабливают в среду, затем суспензию клеток переносят в подходящую пробирку и замораживают при -20 С для кратковременного хранения или при -80 С для длительного хранения. Инсерция PrM4 в MVA В первом раунде клетки инфицировали MVA-BN согласно описанному выше протоколу и, кроме того, трансфицировали инсерционным вектором pBN40, содержащим ген PrM вируса Денге серотипа 4 и в качестве репортерного гена ген EGPF. Так как трансфицированный вектор содержит репортерный генEGFP, в клетках, инфицированных рекомбинантным вирусом, может быть зарегистрирован синтезированный белок самое позднее на третий день. Полученные в результате рекомбинантные вирусы необходимо очистить с помощью очистки бляшек. Для очистки бляшек инфицированные клетки (флуоресцирующие или окрашенные) выделяют кончиком пипетки, ресуспендируют и отсасывают в 200 мкл PBS или среды. Затем свежую культуру в чашке, содержащей примерно 10 Е 6 клеток, инфицируют 100 мкл ресуспендированных бляшек. Через 48 ч клетки собирают в 300 мкл PBS. Из суспензии экстрагируют ДНК и проводят скрининг с помощью ПЦРанализа. Отбирают клон, в котором наблюдаются ожидаемые полосы, и свежие 6-луночные планшеты инфицируют разными количествами данного вируса. Покрывание лунок 1% агарозой предотвращает дальнейшее распространение вируса. Через 48 ч выделяют инфицированные клетки, содержащие рекомбинантный вирусный клон. Указанную процедуру повторяют вплоть до того момента, когда невозможно обнаружить MVA-BN дикого типа в анализе ПЦР. Через 4 раунда очистки бляшек рекомбинантные вирусы, MVA-PrM4, идентифицировали ПЦРанализом, используя пару праймеров, избирательно амплифицирующих ожидаемую инсерцию (oBN210 и oBN478, которые описаны выше) и в качестве контроля пару праймеров, специфично узнающих место инсерции делецию Е (oBN453: GTTGAAGGATTCACTTCCGTGGA, SEQ ID NO: 9 и oBN454: GCATTCACAGATTCTATTGTGAGTC, SEQ ID NO: 10). Инсерция PrM2 в MVA-PrM4 Клетки, инфицированные MVA-PrM4 согласно описанному выше протоколу, кроме того, трансфицировали инсерционным вектором pBN39, содержащим ген PrM вируса Денге серотипа 2 и в качестве селектируемого гена NPT II, ген резистентности к неомицину. Для очистки рекомбинантного MVA, экспрессирующего ген резистентности к антибиотику, рекомендованы три раунда амплификации вируса в условиях селекции перед очисткой бляшек. Для селекции в отношении неомицинфосфотрансферазы в среду добавляют G418. G418 является производным неомицина и ингибирует биосинтез белка, препятствуя действию рибосом. Активность гена NPT инактивирует G418 посредством фосфорилирования. После 16 раундов очистки бляшек в условиях селекции неомицином идентифицировали рекомбинантные вирусы, MVA-PrM4/PrM2, с помощью ПЦР-анализов, используя пару праймеров, избирательно амплифицирующих ожидаемую инсерцию (oBN93 и oBN477, которые описаны выше), и в качестве контроля пару праймеров, специфично узнающих место инсерции делецию А (oBN477: который описан выше) и oBN452: GTTTCATCAGAAATGACTCCATGAAA, SEQ ID NO: 11). Кроме того, также подтверждают инсерцию PrM4 в делецию Е с помощью пар праймеров: oBN210-oBN478 и oBN453-oBN454. Инсерция PrM1 в MVA В первом раунде клетки инфицировали MVA-BN согласно описанному выше протоколу и, кроме того, трансфицировали инсерционным вектором pBN49, содержащим ген PrM вируса Денге серотипа 1 и в качестве репортерного гена hbfp, ген гуманизированного белка с голубой флуоресценцией. Синтезированный белок hbfp выявляется на третий день в клетках, инфицированных рекомбинантным вирусом. Полученные в результате рекомбинантные вирусы очищали с помощью очистки бляшек. После 10 раундов очистки бляшек рекомбинантные вирусы MVA-PrM1 идентифицировали с помощью ПЦР-анализов, используя пару праймеров, избирательно амплифицирующих ожидаемую инсерцию(oBN194 и oBN476, которые описаны выше), и в качестве контроля пару праймеров, специфично узнающих место инсерции делецию 2 (oBN54: CGGGGTACCCGACGAACAAGGAACTGTACAGAGGCATC,SEQ ID NO: 12 и oBN56: AACTGCAGTTGTTCGTATGTCATAAATTCTTTAATTAT, SEQ ID NO: 13). Инсерция PrM3 в MVA В первом раунде клетки инфицировали MVA-BN согласно описанному выше протоколу и, кроме того, трансфицировали инсерционным вектором pBN50, содержащим ген PrM вируса Денге серотипа 3 и в качестве репортерного гена ген Ecogpt (Ecogpt или укороченно gpt означает ген фосфорибозилтрансферазы). Полученные в результате рекомбинантные вирусы очищали 3 раундами очистки бляшек в условиях селекции в отношении метаболизма с участием фосфорибозилтрансферазы путем добавления микофенольной кислоты, ксантина и гипоксантина. Микофенольная кислота (МРА) ингибирует инозинмонофосфатдегидрогеназу и приводит к блокированию синтеза пуринов и ингибированию репликации вирусов в большинстве клеточных линий. Указанное блокирование может быть преодолено в результате экспрессии Ecogpt с конститутивного промотора и обеспечения субстратами, ксантином и гипоксантином. Полученные в результате рекомбинантные вирусы MVA-PrM3 идентифицировали с помощью ПЦРанализов, используя пару праймеров, избирательно амплифицирующих ожидаемую инсерцию (oBN255 иoBN479, которые описаны выше), и в качестве контроля пару праймеров, специфично узнающих место инсерции I4L (oBN499: CAACTCTCTTCTTGATTACC, SEQ ID NO: 14 и oBN500: CGATCAAAGTCAATCTATG, SEQ ID NO: 15). Совместная инфекция MVA-PrM1 и MVA-PrM3 Клетки инфицировали равными количествами MVA-PrM1 и MVA-PrM3 согласно описанному выше протоколу. После 3 раундов очистки бляшек в условиях селекции в отношении метаболизма с участием фосфорибозилтрансферазы клоны рекомбинантных вирусов с голубой флуоресценцией анализировали с помощью ПЦР, используя пары праймеров (oBN255 и oBN479, oBN499 и oBN500, oBN194 и oBN476,oBN54 и oBN56, которые описаны выше). Полученные в результате рекомбинантные вирусы названыMVA-PrM1/PrM3. Совместная инфекция MVA-PrM1/PrM3 и MVA-PrM2/PrM4. Клетки инфицировали равными количествами MVA-PrM1/PrM3 и MVA-PrM2/PrM4 согласно описанному выше протоколу. Очистку бляшек осуществляли в условиях селекции в отношении метаболизма с участием фосфорибозилтрансферазы и селекции неомицином. Выделяли рекомбинантные вирусы, индуцирующие зеленую и голубую флуоресценцию, и анализировали с помощью ПЦР, используя пары праймеров (oBN255 и oBN479, oBN499 и oBN500, oBN194 и oBN476, oBN54 и oBN56, oBN93 и oBN477,oBN477 и oBN452, oBN210 и oBN478, oBN453 и oBN454, которые описаны выше). ПЦР-анализ рекомбинантного вируса (клон 20), содержащего все четыре гена PrM, показан на фиг. 11. В то время как в верхней части геля показаны результаты разных ПЦР рекомбинантного вируса, в нижней части представлены результаты тех же самых реакций ПЦР контрольных плазмид (которые указаны). На дорожках 1, 10 и 11 показаны молекулярные маркеры 1 т.п.о. и 100 п.о. Комбинация праймеров oBN210/oBN478 специфична для делеции Е и PrM4 в качестве вставки. Ожидаемый ПЦР-фрагмент рекомбинантного вируса и плазмиды pBN40 имеет размер 607 п.о. (показан на дорожке 2). Комбинация праймеров oBN453/oBN454 специфична для делеции Е. Ожидаемый ПЦР-фрагмент рекомбинантного вируса составляет 2,7 т.п.о, ожидаемая полоса вируса дикого типа составляет 2,3 т.п.о.(показано на дорожке 3). Также в верхней части геля можно идентифицировать полосу, специфичную для вируса дикого типа. Это означает, что препарат рекомбинантного вируса еще не полностью освобожден от вируса дикого типа. Необходима дальнейшая очистка бляшек. Комбинация праймеров oBN93/oBN477 специфична для делеции А и PrM2 в качестве вставки. Ожидаемый ПЦР-фрагмент рекомбинантного вируса и плазмиды pBN39 имеет размер 636 п.о. (показан на дорожке 4). Комбинация праймеров oBN477/oBN452 специфична для делеции А. Ожидаемый ПЦР-фрагмент рекомбинантного вируса составляет 4,1 т.п.о., ожидаемая полоса вируса дикого типа - 2,7 т.п.о. (показано на дорожке 5). В верхней части геля может быть идентифицирована полоса вируса дикого типа. Комбинация праймеров oBN255/oBN479 специфична для межгенной области I4L и PrM3 в качестве вставки. Ожидаемый ПЦР-фрагмент рекомбинантного вируса и плазмиды pBN50 имеет размер 825 п.о.(показан на дорожке 6). Комбинация праймеров oBN499/oBN500 специфична для межгенной области I4L. Ожидаемый ПЦРфрагмент рекомбинантного вируса составляет 1,0 т.п.о., ожидаемая полоса вируса дикого типа - 0,3 т.п.о.(показано на дорожке 7). Комбинация праймеров oBN194/oBN476 специфична для делеции 2 и PrM1 в качестве вставки. Ожидаемый ПЦР-фрагмент рекомбинантного вируса и плазмиды pBN49 имеет размер 678 п.о. (показан на дорожке 8). Комбинация праймеров oBN54/oBN56 специфична для делеции 2. Ожидаемый ПЦР-фрагмент рекомбинантного вируса составляет 1,6 т.п.о., ожидаемая полоса вируса дикого типа - 0,9 т.п.о. (показаны на дорожке 9). В верхней части геля может быть идентифицирована полоса, специфичная для вируса дикого типа. Альтернативно можно получить 4 разных вируса, клетки инфицировать совместно всеми четырьмя вирусами и провести скрининг в отношении рекомбинанта. Усовершенствования могут быть достигнуты с помощью рекомбинантных векторов, которые содержат дополнительные маркеры для селекции или маркеры резистентности. Пример 2. Инсерционные векторы Рекомбинантный вектор для межгенной области 136-137 (IGR 136-137) Для инсерции экзогенных последовательностей в геном MVA в так называемую межгенную область(IGR) 136-137, соответствующую положению генома 129.940, конструировали плазмидный вектор, который содержит примерно 600 п.о. фланкирующих последовательностей, прилежащих к сайту инсерции. Чтобы выделить фланкирующие последовательности из геномной ДНК MVA-BN, могут быть разработаны подходящие праймеры ПЦР. Такие праймеры содержат удлинения с соответствующими сайтами для ферментов рестрикции, которые будут использованы для клонирования фланкирующих последовательностей в векторной плазмиде. Между указанными фланкирующими последовательностями вводят кассету селектируемого гена, например гена NPT II (резистентности к неомицину), под транскрипционным контролем промотора поксвируса (Р). Кроме того, имеется сайт клонирования для встраивания дополнительных генов или экзогенных последовательностей, которые необходимо встроить в IGR 136-137 (PacI). Одна из таких конструкций вектора согласно данному изобретению изображена на фиг. 12 (pBNX67). Рекомбинантный вектор для межгенной области 07-08 (IGR 07-08) Для инсерции экзогенных последовательностей в геном MVA в межгенную область (IGR) 07-08, соответствующую положению генома 12.800, конструировали плазмидный вектор, который содержит примерно 600 п.о. фланкирующих последовательностей, прилежащих к сайту инсерции. Чтобы выделить фланкирующие последовательности из геномной ДНК MVA-BN, можно сконструировать подходящие ПЦР-праймеры. Такие праймеры содержат удлинения с сайтами для ферментов рестрикции, которые будут использованы для клонирования фланкирующих последовательностей в векторной плазмиде. Между указанными фланкирующими последовательностями вводят кассету селектируемого гена, например гена Ecogpt (гуанинфосфорибозилтрансфераза), под транскрипционным контролем промотора поксвируса (Р). Кроме того, имеется сайт клонирования для встраивания дополнительных генов или экзогенных последовательностей, которые необходимо встроить в IGR 07-08 (PacI). Одна из таких конструкций вектора согласно данному изобретению изображена на фиг. 13 (pBNX88). Рекомбинантный вектор для межгенной области 44-45 (IGR 44-45) Для инсерции экзогенных последовательностей в геном MVA в межгенную область (IGR) 44-45, соответствующую положению генома 37.330, конструировали плазмидный вектор, который содержит примерно 600 п.о. фланкирующих последовательностей, прилежащих к сайту инсерции. Чтобы выделить фланкирующие последовательности из геномной ДНК MVA-BN, могут быть разработаны подходящие праймеры ПЦР. Такие праймеры содержат удлинения с соответствующими сайтами для ферментов рестрикции, которые будут использованы для клонирования фланкирующих последовательностей в векторной плазмиде. Между указанными фланкирующими последовательностями вводят кассету селектируемого гена, например гена NPT II (резистентности к неомицину), под транскрипционным контролем промотора поксвируса (Р). Кроме того, имеется сайт клонирования для встраивания дополнительных генов или экзогенных последовательностей, которые необходимо встроить в IGR 44-45 (PacI). Одна из таких конструкций вектора согласно данному изобретению изображена на фиг. 14 (pBNX87). Конструирование рекомбинантного поксвируса, содержащего несколько гомологичных генов, интегрированных в его геном. Инсерционные векторы Для инсерции трех генов PrM серотипа 2, 3 и 4 вируса Денге в геном MVA использовали три независимых рекомбинантных вектора. Указанные векторы содержат - как подробно описано выше - последовательности, гомологичные геному MVA, для целенаправленного встраивания посредством гомологичной рекомбинации. Кроме того, каждый вектор содержит кассету селектируемого или репортерного гена. Последовательности PrM трех серотипов вируса Денге получали путем синтеза, как описано в примере 1. В результате конструкция инсерционного вектора для IGR 136-137 содержала PrM серотипа 4 вируса Денге 4 (фиг. 15 - pBN27). Конструкция инсерционного вектора для IGR 07-08 содержала PrM серотипа 2 вируса Денге (фиг. 16 - pBN34) и конструкция инсерционного вектора для IGR 44-45 содержала PrM серотипа 3 вируса Денге (фиг. 17 - pBN47). Образование рекомбинантного MVA посредством гомологичной рекомбинации Образование рекомбинантного MVA посредством гомологичной рекомбинации осуществляли, как описано в примере 1. Сайты инсерции для PrM4, PrM3 и PrM2 в геноме MVA изображены на фиг. 18. Инсерция PrM4 в MVA. В первом раунде клетки инфицировали MVA-BN согласно описанному выше протоколу и, кроме того, трансфицировали инсерционным вектором pBN27, содержащим ген PrM вируса Денге серотипа 4 и в качестве репортерного гена ген EGPF. Так как трансфицированный вектор содержит репортерный генEGFP, в клетках, инфицированных рекомбинантным вирусом, может быть зарегистрирован синтезированный белок самое позднее на третий день. Полученные в результате рекомбинантные вирусы должны быть очищены с помощью очистки бляшек, как описано в примере 1. После 4 раундов очистки бляшек рекомбинантные вирусы, MVA-PrM4, идентифицировали ПЦР-анализом, используя пару праймеров,избирательно амплифицирующих сайт инсерции IGR136-137 (oBN1008: gataccgatcacgttcta, SEQ ID NO: 16; и oBN1009 ggatatgattatgtagag, SEQ ID NO: 17). Инсерция PrM2 в MVA Клетки инфицировали MVA-PrM4 согласно описанному выше протоколу и, кроме того, трансфицировали инсерционным вектором pBN34, содержащим ген PrM серотипа 2 вируса Денге и в качестве репортерного гена ген BFP. Так как трансфицированный вектор содержит репортерный ген BFP, в клетках,инфицированных рекомбинантным вирусом, может быть зарегистрирован синтезированный белок самое позднее на третий день. Полученные в результате рекомбинантные вирусы должны быть очищены с помощью очистки бляшек, как описано в примере 1. После шести раундов очистки бляшек рекомбинантный вирус, MVA-PrM4+PrM2, далее пересевали и амплифицировали и готовили неочищенную культуру. Рекомбинант идентифицировали ПЦР-анализами, используя пару праймеров, избирательно амплифицирующих сайт инсерции IGR07-08 (oBN 903: ctggataaatacgaggacgtg, SEQ ID NO: 18; и oBN904: gacaattatccgacgcaccg; SEQ ID NO: 19). Инсерция PrM3 в MVA Клетки инфицировали MVA-PrM2+4 согласно описанному выше протоколу и кроме того трансфицировали инсерционным вектором pBN47, содержащим ген PrM серотипа 3 вируса Денге и в качестве репортерного гена ген EGFP. Так как трансфицированный вектор содержит репортерный ген EGFP, в клетках, инфицированных рекомбинантным вирусом, может быть зарегистрирован синтезированный белок самое позднее на третий день. Полученные в результате рекомбинантные вирусы должны быть очищены с помощью очистки бляшек, как описано в примере 1. После трех раундов очистки бляшек рекомбинантный вирус, MVA-PrM4+3+2 идентифицировали ПЦР-анализами, используя пару праймеров,избирательно амплифицирующих сайт инсерции IGR44-45 (oBN904: cgttagacaacacaccgacgatgg, SEQ IDNO: 20; и oBN905 cggatgaaaaatttttggaag, SEQ ID NO: 21). ПЦР-анализ рекомбинантного вируса, содержащего три гена PrM вируса Денге, показан на фиг. 19. Эксперименты ПЦР осуществляли, как описано в примере 1. Комбинация праймеров oBN1008 и oBN1009 специфична для IGR136-137, которая содержит инсерцию PrM4 (фиг. 19, нижняя панель). Ожидаемый ПЦРфрагмент рекомбинантного вируса имеет размер 1 т.п.о. (показан на дорожках 4, 5 и 6), так же как позитивного плазмидного контроля (дорожка 8). Контроль пустого вектора, не имеющего PrM4, показывает ожидаемый фрагмент 190 п.о. (дорожка 2). На дорожке М показан маркер молекулярной массы, а дорожки 1, 3 и 7 являются пустыми. Комбинация праймеров oBN902 и oBN903 специфична для IGR07-08, которая содержит инсерцию PrM2 (фиг. 19, верхняя панель). Ожидаемый ПЦР-фрагмент рекомбинантного вируса имеет размер 960 п.о. (показан на дорожках 4-6), так же как позитивного плазмидного контроля (дорожка 8). Контроль пустого вектора, не имеющего PrM, показывает ожидаемый фрагмент 190 п.о. (дорожка 2). Комбинация праймеров oBN904 и oBN905 специфична для IGR44-45, который содержит инсерцию PrM3 (фиг. 19, средняя панель). Ожидаемый ПЦР-фрагмент рекомбинантного вируса имеет размер 932 п.о. (показан на дорожках 4-6),так же как позитивного плазмидного контроля (дорожка 8). Контроль пустого вектора, не содержащего PrM2,показывает ожидаемый фрагмент 185 п.о. (дорожка 2). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантный модифицированный вирус осповакцины Анкара (MVA), используемый для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека,содержащий по меньшей мере две гомологичные между собой чужеродные последовательности, которые получены из разных вариантов микроорганизмов, которые не являются чужеродными генами, с гомологией, составляющей по меньшей мере 50%, в котором каждая из указанных последовательностей встроена в отдельный сайт инсерции вирусного генома. 2. Рекомбинантный вирус MVA, используемый для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, содержащий по меньшей мере две гомологичные между собой чужеродные последовательности, которые получены из разных вариантов микроорганизмов, кото- 18020230 рые не являются чужеродными генами, где указанные гомологичные последовательности имеют гомологию, составляющую по меньшей мере 60%. 3. Рекомбинантный вирус MVA по п.1 или 2, в котором последовательности имеют гомологию 6575%. 4. Рекомбинантный вирус MVA по любому из пп.1-3, в котором гомологичные чужеродные последовательности идентичны. 5. Рекомбинантный вирус MVA по любому из пп.1-4, в котором указанные по меньшей мере две гомологичные последовательности являются промоторами, функционально связанными с геном. 6. Рекомбинантный вирус MVA по п.5, в котором промоторы представляют собой ранний/поздний промотор р 7,5 вируса осповакцины. 7. Рекомбинантный вирус MVA по пп.1-6, полученный на основе вируса MVA-BN ECACCV00083008. 8. Рекомбинантный вирус MVA по пп.1-7, который является дефицитным или некомпетентным по репликации в клетках млекопитающих, включая клетки человека. 9. Рекомбинантный вирус MVA по пп.1-8, в котором указанные последовательности встроены в природный сайт делеции и/или в межгенную область вирусного генома. 10. Рекомбинантный вирус MVA по пп.1-9, представляющий собой лекарственное средство или вакцину для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного,включая человека. 11. Вакцина для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека, содержащая рекомбинантный вирус MVA по любому из пп.1-10. 12. Фармацевтическая композиция для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека, содержащая рекомбинантный вирус MVA по любому из пп.1-10 и фармацевтически приемлемый носитель, разбавитель, адъювант и/или добавку. 13. Применение рекомбинантного вируса MVA по любому из пп.1-10 для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека. 14. Применение вакцины по п.11 для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека. 15. Применение композиции по п.12 для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека. 16. Применение рекомбинантного вируса MVA по любому из пп.1-10 для приготовления лекарственного средства для воздействия на иммунный ответ, предпочтительно на его индуцирование у животного, включая человека. 17. Способ воздействия на иммунный ответ, предпочтительно на его индуцирование у животного,включая человека, предусматривающий введение терапевтически эффективного количества рекомбинантного вируса MVA по любому из пп.1-10, вакцины по п.11 или композиции по п.12 животному или человеку, подлежащему лечению. 18. Клетка, содержащая рекомбинантный вирус MVA по пп.1-10. 19. Способ получения рекомбинантного вируса MVA по пп.1-10, предусматривающий стадии инфицирования клетки вирусом MVA; трансфекции инфицированной клетки первой векторной конструкцией, содержащей чужеродную последовательность, предназначенную для введения в вирусный геном, и геномную последовательность вируса MVA, способную направлять интеграцию чужеродной гетерологичной последовательности,предназначенной для инсерции в сайт инсерции вирусного генома; идентификации и выделения образованного рекомбинантного вируса MVA; повторения указанных выше стадий с использованием рекомбинантного вируса MVA, полученного на предыдущих стадиях, для инфицирования клетки и трансфицирования указанной клетки дополнительной векторной конструкцией, содержащей следующую чужеродную последовательность, предназначенную для введения в вирусный геном, где указанная чужеродная последовательность является гомологичной по отношению к последовательности первой векторной конструкции. 20. Способ по п.19, дополнительно включающий очистку полученного рекомбинантного вирусаMVA. 21. Набор для получения рекомбинантного вируса MVA по любому из пп.1-10, содержащий две или более векторных конструкций, причем каждая конструкция содержит чужеродную последовательность,предназначенную для включения в геном вируса MVA, где последовательности, включенные в разные векторы, являются гомологичными по меньшей мере на 50%, и каждая последовательность фланкирована последовательностью ДНК вируса MVA, способной направлять интеграцию каждой из чужеродных гомологичных последовательностей в геном вируса MVA, и средства для идентификации и/или селекции рекомбинантных вирусов MVA, которые включили указанные чужеродные гомологичные последовательности в свой геном. 22. Набор по п.21, где каждая из указанных гомологичных последовательностей фланкирована последовательностью ДНК вируса MVA, способной направлять интеграцию каждой из указанных гомоло- 19020230 гичных последовательностей в отдельный сайт инсерции вирусного генома. 23. Последовательность ДНК генома рекомбинантного вируса MVA по пп.1-10. 24. Способ выявления клетки, инфицированной рекомбинантным вирусом MVA по пп.1-10, предусматривающий стадии:a) контактирования клетки с ДНК-праймерами, селективно амплифицирующими чужеродные последовательности, которые интегрированы в геном вируса MVA;b) определения того, произошла ли гибридизация между ДНК-праймером и ДНК рекомбинантного вируса, находящегося в клетке; иc) определения присутствия рекомбинантного вируса MVA в клетке на основании информации, полученной на стадии b). 25. Способ по п.24, в котором осуществляют контактирование клетки в дополнение или в качестве альтернативы стадии а) с ДНК-праймерами, селективно связывающимися с фланкирующими последовательностями по отношению к сайтам инсерции чужеродных последовательностей. 26. Способ идентификации рекомбинантного вируса MVA по пп.1-10 в образце, предусматривающий стадии:a) контактирования образца с ДНК-праймерами, селективно амплифицирующими чужеродные последовательности, которые интегрированы в геном вируса MVA;b) определения того, произошла ли гибридизация между ДНК-праймером и ДНК рекомбинантного вируса MVA в образце; иc) определения присутствия рекомбинантного вируса в образце на основании информации, полученной на стадии b). 27. Способ по п.26, в котором осуществляют контактирование образца в дополнение или в качестве альтернативы стадии а) с ДНК-праймерами, селективно связывающимися с фланкирующими последовательностями по отношению к сайтам инсерции чужеродных последовательностей.
МПК / Метки
МПК: C12N 15/39, C12Q 1/68, A61K 39/12, C12N 5/10, C12N 7/01
Метки: применение, гомологичные, встроенные, осповакцины, поксвирусный, mva, геном, анкара, вирус, модифицированный, экспрессирующий, рекомбинантный, последовательности
Код ссылки
<a href="https://eas.patents.su/28-20230-rekombinantnyjj-modificirovannyjj-virus-ospovakciny-ankara-mva-ekspressiruyushhijj-gomologichnye-posledovatelnosti-vstroennye-v-poksvirusnyjj-genom-i-ego-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантный модифицированный вирус осповакцины анкара (mva), экспрессирующий гомологичные последовательности, встроенные в поксвирусный геном, и его применение</a>
Предыдущий патент: Агонисты mglu2
Следующий патент: Порошок бария-стронция-алюмосиликата
Случайный патент: Замещенные пиперидины