Способ идентификации сероокисляющих бактерий и мониторинга элементарной серы в окружающей среде
Формула / Реферат
1. Способ идентификации сероокисляющих бактерий в почве, включающий выделение ДНК из почвенных образцов окружающей среды и последующую идентификацию по меньшей мере одного фрагмента рибосомального гена Thio 16S и/или гена SoxB, присутствующего у этих бактерий, посредством амплификации гена в присутствии пар олигонуклеотидов, комплементарных гену Thio 16S, выбранных из следующих пар последовательностей:

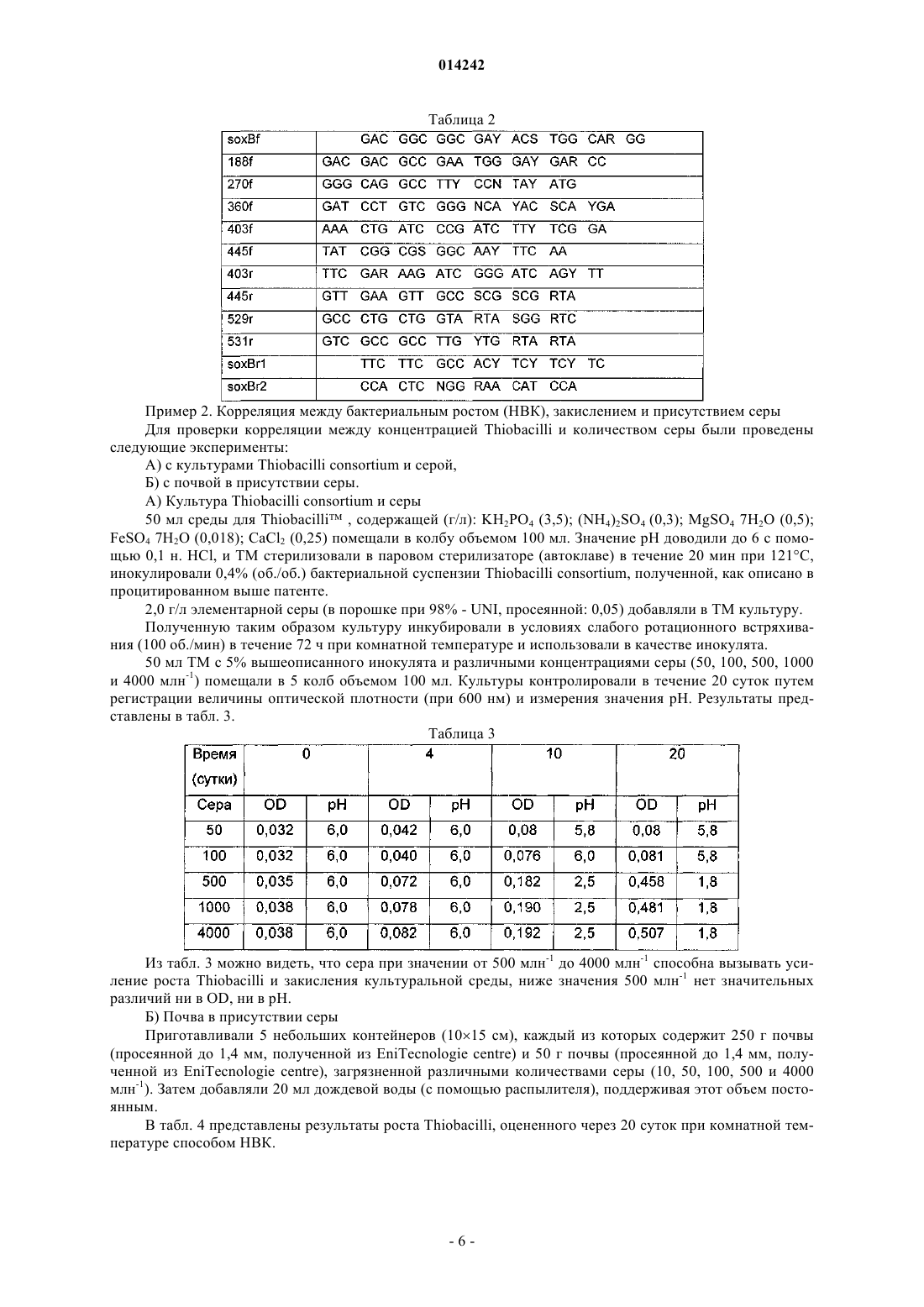
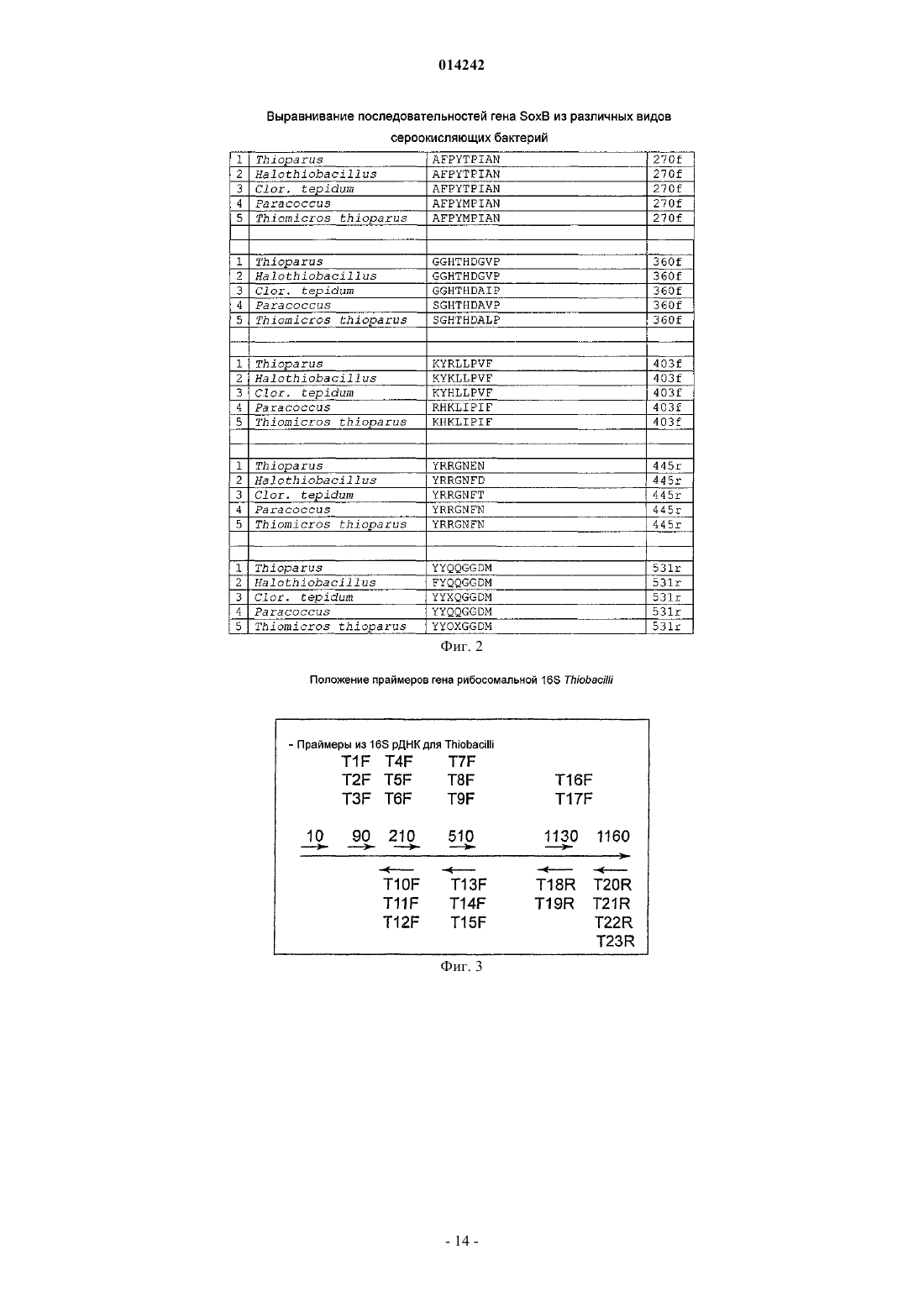
и/или в присутствии пар олигонуклеотидов, комплементарных гену SoxB, где прямой праймер выбран из следующих последовательностей:
![]()
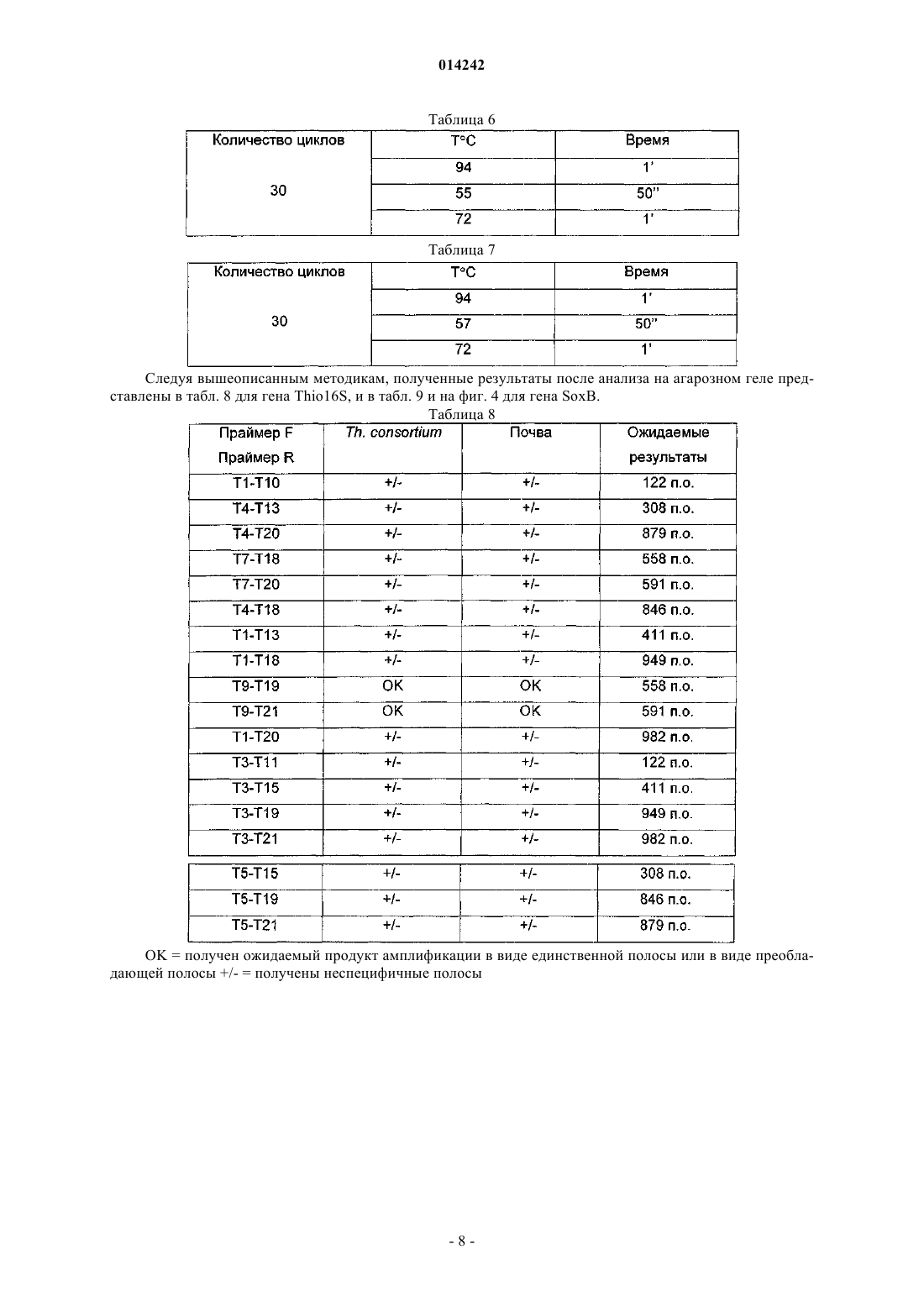
и обратный праймер выбран из следующих последовательностей:
![]()
2. Способ по п.1, где амплификацию гена SoxB осуществляют в присутствии пар олигонуклеотидов, выбранных из следующих пар последовательностей:

3. Способ идентификации сероокисляющих бактерий по пп.1-2, включающий следующие стадии:
выделение ДНК из образцов;
приведение выделенной ДНК в контакт с парой праймеров, выбранных из тех, которые определены в п.1, в условиях, обеспечивающих специфическую амплификацию фрагмента гена SoxB;
анализ продукта генной амплификации с помощью ПЦР в реальном масштабе времени, гель-электрофореза или другого метода анализа.
4. Способ идентификации сероокисляющих бактерий по п.3, где температуры отжига в фазе, предшествующей специфической генной амплификации, варьируют от -5 до -1°С в соответствии с наименьшей температурой плавления Tm из температур плавления используемых пар зондов, и время полимеризации составляет минуту реакции на тысячу пар нуклеотидов полимеризующейся ДНК.
5. Способ количественного определения сероокисляющих бактерий, включающий:
а) осуществление генной амплификации в соответствии со способом по п.3 в присутствии различных количеств геномной ДНК сероокисляющих бактерий;
б) количественное определение продукта генной амплификации;
в) построение калибровочной кривой;
г) количественное определение геномной ДНК в анализируемых образцах посредством интерполяции.
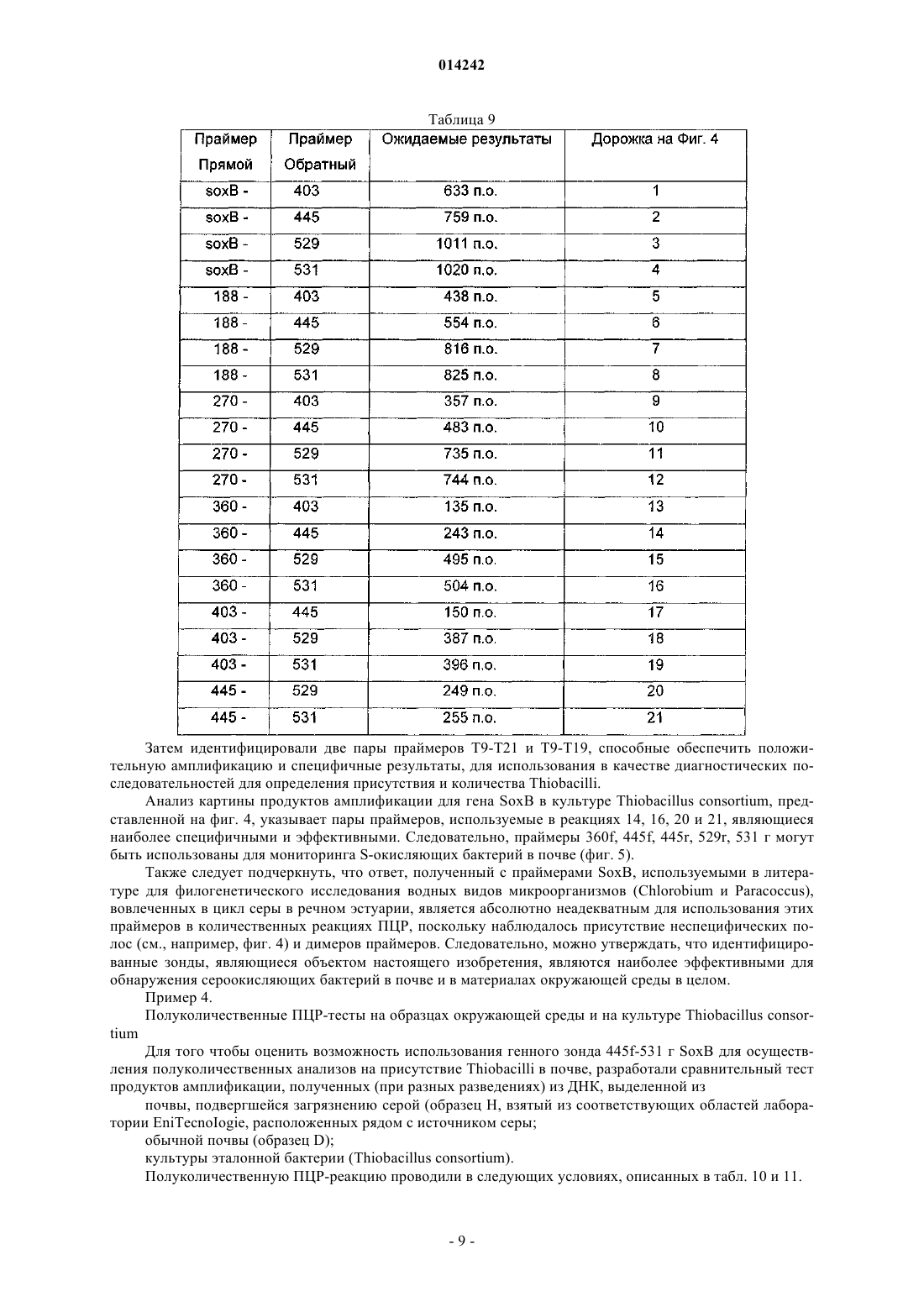
6. Способ по п.3 или 5, где генную амплификацию осуществляют в присутствии пар олигонуклеотидов, комплементарных гену SoxB, имеющих следующую пару последовательностей:
![]()
7. Способ определения распределения серы в почве, включающий идентификацию сероокисляющих бактерий и их количественную оценку, где количественную оценку сероокисляющих бактерий осуществляют способом по п.5.
8. Диагностический набор для идентификации присутствия сероокисляющих бактерий в образцах окружающей среды, основанной на идентификации гена Thio 16S посредством генной амплификации в присутствии пар олигонуклеотидов, комплементарных гену Thio 16S, выбранных из следующих пар последовательностей:

или гена SoxB посредством генной амплификации в присутствии пар олигонуклеотидов, комплементарных гену SoxB, где прямой праймер выбран из следующих последовательностей:
![]()
и обратный праймер выбран из следующих последовательностей:
![]()
9. Пара олигонуклеотидов, комплементарных гену Thio 16S сероокисляющих бактерий, выбранная из следующих пар последовательностей:

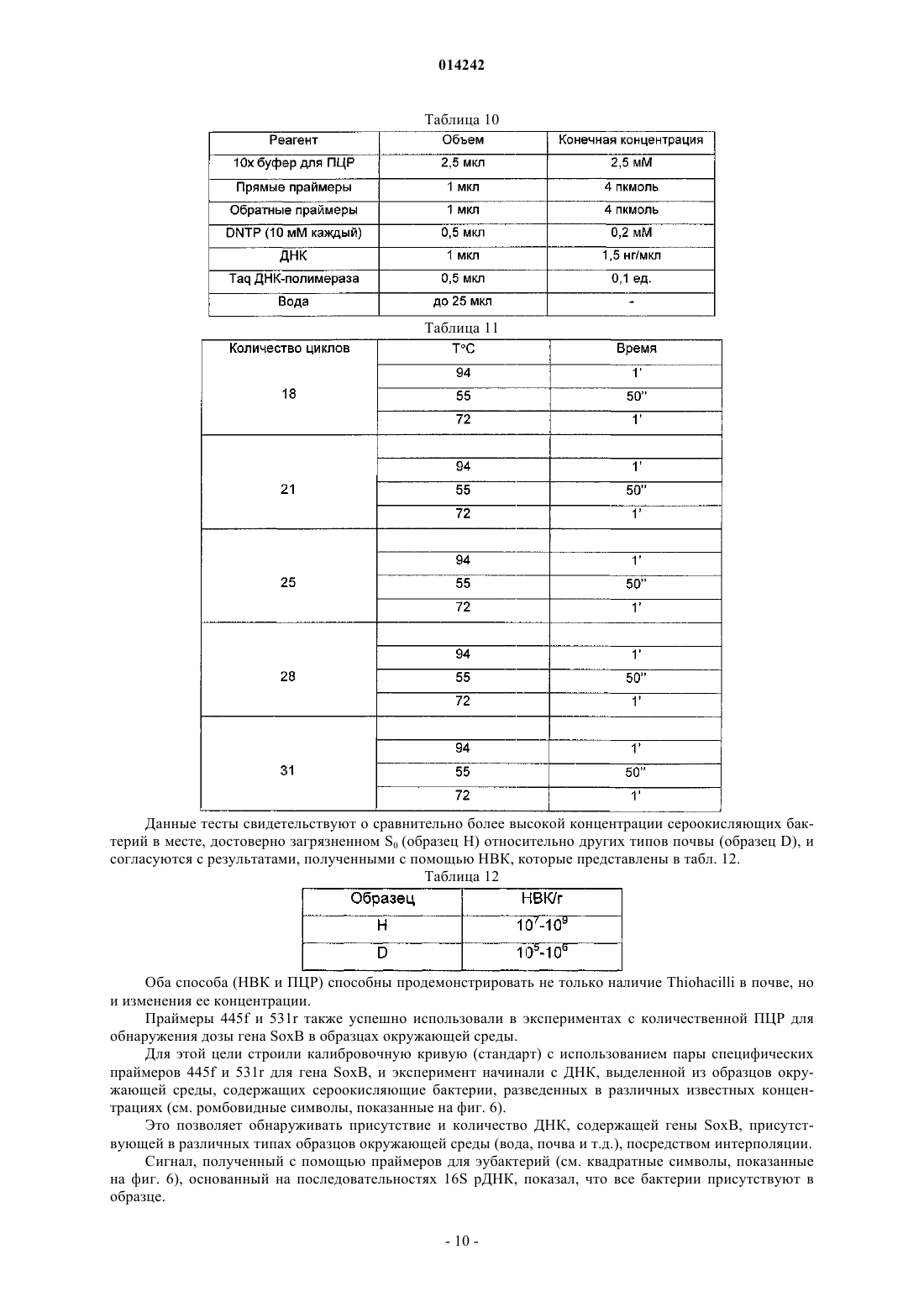
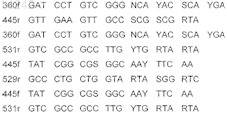
10. Пара олигонуклеотидов, комплементарных гену SoxB сероокисляющих бактерий, выбранная из следующих пар последовательностей:
![]()

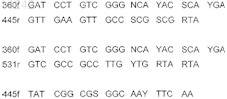
11. Олигонуклеотид, комплементарный гену Thio 16S сероокисляющих бактерий, выбранный из одной из следующих последовательностей:
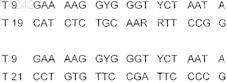
12. Олигонуклеотид, комплементарный гену Thio 16S сероокисляющих бактерий, выбранный из одной из следующих последовательностей:
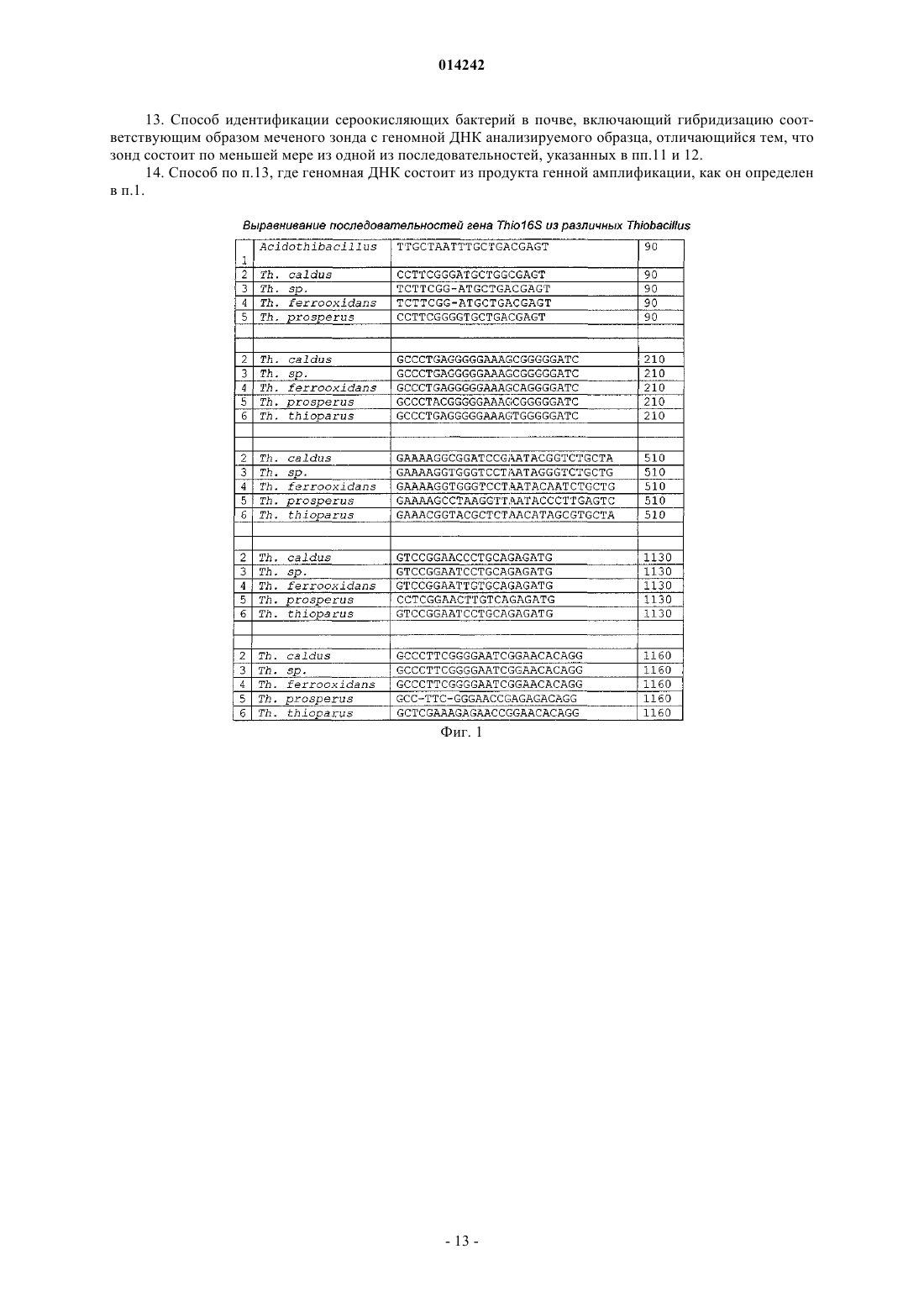
13. Способ идентификации сероокисляющих бактерий в почве, включающий гибридизацию соответствующим образом меченого зонда с геномной ДНК анализируемого образца, отличающийся тем, что зонд состоит по меньшей мере из одной из последовательностей, указанных в пп.11 и 12.
14. Способ по п.13, где геномная ДНК состоит из продукта генной амплификации, как он определен в п.1.
Текст
СПОСОБ ИДЕНТИФИКАЦИИ СЕРООКИСЛЯЮЩИХ БАКТЕРИЙ И МОНИТОРИНГА ЭЛЕМЕНТАРНОЙ СЕРЫ В ОКРУЖАЮЩЕЙ СРЕДЕ Описан способ идентификации сероокисляющих бактерий, включающий выделение ДНК из образцов окружающей среды и последующую идентификацию по меньшей мере одного фрагмента гена Thio 16S или гена SoxB, присутствующего у этих бактерий. Этот способ может быть использован для определения уровня элементарной серы в образцах почвы. 014242 Настоящее изобретение относится к способу идентификации сероокисляющих бактерий в образцах окружающей среды путем идентификации специфических генов, присутствующих у этих бактерий. Известно, что сероокисляющие бактерии представляют собой микроорганизмы, которые в природных условиях в значительной степени ответственны за окисление элементарной серы до серной кислотыsoil. J. Bacteriology 7, 239-256(1952. Таким образом, сера и соединения на основе серы солюбилизируются в форме сульфатов и становятся доступными для ассимиляции частично другими микроорганизмами и растениями, таким образом внося вклад в удобрение почвы. Однако биологическое окисление серы может быть вредным для окружающей среды, если количество кислоты, образующейся в результате окисления серы, превышает способность почвы нейтрализовать эту кислотность. Эта проблема, как правило, возникает в тех местах, где сера восстанавливается путем десульфуризации органического топлива и в больших количествах остается в отложениях. В результате биологического окисления частью сероокисляющих бактерий в серных отложениях фактически формируются чрезвычайно кислые перколяты, которые возникают в результате контакта между дождевой водой и поверхностью серы. Аналогичное явление также возникает в областях, окружающих отложения, где сера может легко распространяться под действием ветра; все это приводит к серьезному нарушению окружающей среды, а также риску для здоровья людей. Поскольку сероокисляющие бактерии в основном отвечают за процессы закисления, ассоциированные с присутствием серы, способы их идентификации и контроля представляют собой достоверные средства для слежения за этим явлением и контроля за риском для окружающей среды из-за распределения серы. Классический способ идентификации сероокисляющих бактерий, которые включают в себя различные виды, среди которых находятся Thiobacilli, основан на методике НВК (наиболее вероятное количество от англ. Most Probable Number), которая состоит в оценке наиболее вероятного количества бактерий,присутствующих в почве, посредством последовательных разведений образца селективной среды дляThiobacilli, в присутствии серы и индикатора рН, который свидетельствует о том, что произошло закисление. Однако для этого способа требуется длительное время работы, поскольку если концентрация бактерий низкая, то время инкубации может достигать даже четырех недель (С. Knickerbocker. The role ofThiooxidans Chem. Geology 169:425-433 (2000, и он не является очень точным вследствие того, что, как широко описано в литературе, только небольшую фракцию активных видов микроорганизмов в природных экосистемах можно легко культивировать в лаборатории. В литературе описаны различные способы идентификации сероокисляющих бактерий, которые основаны на генетических методиках, таких как, например, применение генов устойчивости к ртути или устойчивости к мышьяку в качестве маркерных генов в отношении Thiobacilli (М. Barrow. Production and(1985. Применение генов устойчивости к ртути (Т. Barkay, D. Fouts. Preparation of a DNA gene probe for detection of mercury resistance genes in Gram-negative bacterial communities. Applied and Environmental Microbiology. 49:686-692 (1985 основано на зонде ДНК, способном идентифицировать их (mer-зонд). Однако этот ген не может рассматриваться в качестве специфичного для Thiobacilli, a только позволяет отличать грамотрицательные бактерии (которые имеют mer-зонд) от грамположительных бактерий (которые его не имеют). Способ, в котором резистентность к мышьяку используют в качестве маркера, основан на трансформации Thiohacillus плазмидой и последующем обнаружении самой плазмиды. Поэтому он представляет собой лабораторный метод, который может быть использован только в экспериментальных ситуациях, но не при мониторинге окружающей среды. Также описано применение генетических зондов, обнаруживаемых с помощью FISH (флуоресцентной гибридизации In Situ), которые распознают специфические последовательности 16s РНК Thiobacillusbiodegradation 49: 271-276 (2002. Однако эти способы идентификации являются специфичными только для этих двух видов Thiobacillus, тогда как существуют многочисленные известные сероокисляющие виды и с различными 16S последовательностями. В дополнение к этому первому и важному замечанию также немыслимо представить кампании, осуществляющие мониторинг бактерий на основании методикиFISH, которая является гораздо более сложной и трудоемкой для применения, чем методики, основанные-1 014242 на амплификации генов, обеспечиваемой ПЦР (полимеразной цепной реакции), главным образом на почвенном материале. Биологическая система использования элементарной серы частью почвенных микроорганизмов еще полностью не ясна как на генетическом уровне, так и на уровне микробной экологии. Поэтому для разработки нового способа мониторинга серы в почве необходимо было экспериментально проверить, может ли доза гена в системе, которую можно рассматривать как вовлеченную в окислительные реакции серосодержащих соединений (генная система, ответственная за экспрессию Sox генов), коррелировать с наличием и количеством элементарной серы в почве. В настоящее время найден способ, основанный на распознавании специфических генов, таких какThio16S или SoxB, который позволяет идентифицировать и количественно определять сероокисляющие бактерии с высокой чувствительностью, специфичностью и скоростью. В частности, способ по изобретению предусматривает, что гены Thio16S или SoxB определяются посредством амплификации одного из их фрагментов в присутствии специфических праймеров. Также обнаружили, что количественный уровень этих генов может коррелировать с присутствием и количеством элементарной серы в почве. Таким образом, задача настоящего изобретения относится к способу идентификации сероокисляющих бактерий, включающему выделение ДНК из образцов окружающей среды и последующую идентификацию по меньшей мере одного фрагмента рибосомального гена Thio16S или гена SoxB, присутствующего у сероокисляющих бактерий. Еще одна задача настоящего изобретения относится к способу определения распределения серы в окружающей среде, включающему идентификацию сероокисляющих бактерий, как было описано выше,и их количественное определение. Идентификацию фрагмента гена Thio16S осуществляют посредством амплификации в присутствии пар олигонуклеотидов, комплементарных гену Thio16S, выбранных из следующих пар последовательностей: тогда как идентификацию гена SoxB осуществляют посредством генной амплификации в присутствии пар олигонуклеотидов, комплементарных гену SoxB, где прямой праймер выбран из следующих последовательностей: и обратный праймер выбран из следующих последовательностей: Амплификацию гена SoxB предпочтительно осуществляют в присутствии пар олигонуклеотидов,выбранных из следующих пар последовательностей: Способы генной амплификации (полимеразная цепная реакция - ПЦР) обладают преимуществом по сравнению с более широко используемыми методиками НВК для бактериальных культур (длительных и часто ненадежных), поскольку также способны идентифицировать трудно культивируемые виды, которые часто представляют собой важную фракцию бактерий, представленных в экосистеме.-2 014242 Для повсеместного использования способы на основе ПЦР должны быть успешными только при идентификации генов-мишеней и, предпочтительно, всех видов, содержащих эти гены. Способ по изобретению продемонстрировал большую чувствительность, специфичность и скорость по сравнению со способами, описанными в области техники (НВК), и может быть также удобно использован для наблюдения за распределением серы в окружающей среде. Еще одна задача настоящего изобретения относится к олигонуклеотидам, имеющим последовательность, выбранную из указанных выше. Эти олигонуклеотиды могут быть использованы не только в качестве праймеров для амплификации генов, но также в качестве генных зондов для идентификации гена Thio16S и гена SoxB из сероокисляющих бактерий. В этом случае при использовании методик из известного уровня техники олигонуклеотиды по изобретению маркируют таким образом, чтобы их можно было легко обнаружить, и после этого их подвергают гибридизации с анализируемой геномной ДНК или той, которая получена посредством генной амплификации (например, как в методике FISH), что позволяет идентифицировать специфические последовательности с помощью флуоресценции в образцах, содержащих клетки или микроорганизмы, как описано, например, в "In Situ Hybridization. A practical Approach" Edited by D-G. Wilkinson IRL Press, OxfordUniversity Press, 1994. Маркировку можно осуществлять разными способами, такими как, например, введение флуоресцентной, радиоактивной, хемилюминисцентной или ферментативной метки. Использование специфических зондов для гена SoxB является предпочтительным, поскольку они идентифицируют не только сероокисляющие бактерии типа Thiobacillus, но также другие виды микроорганизмов, потенциально вовлеченных в использование серы в материалах окружающей среды. С другой стороны установили, что Thiobacillus может образовывать преобладающие виды в почве в реакциях круговорота элементарной серы, и, следовательно, использование зондов Thio16S должно обеспечить возможность получать похожие ответы. Объединенное использование двух типов зондов может обеспечить в выбранных образцах контроль за эффективностью данного способа. Идентификация олигонуклеотидов по изобретению привела к использованию различных последовательностей, доступных в банках данных для гена Thio16S и гена SoxB. Последовательности выравнивали с использованием программного обеспечения для анализа последовательностей Clustal X (Thomson JD et al., Nucleic Acids Research, 24:4876-4882 (1994 для определения консервативных участков и идентификации в гомологичных областях специфических нуклеотидных последовательностей, используемых в качестве праймеров для селективной амплификации гена Thio16S и гена SoxB. На фиг. 1 представлено выравнивание нуклеотидных последовательностей для гена Thio16S в различных Thiobacilli, а на фиг. 2 - выравнивание аминокислотных последовательностей для гена SoxB у различных сероокисляющих бактерий. При анализе гомологичных областей были идентифицированы различные участки гена Thio16S и гена SoxB с консервативной последовательностью, из которых синтезировали праймеры, указанные соответственно в табл. 1 и табл. 2. На фиг. 3 показано расположение всех праймеров из табл. 3 в гене рибосомальной 16S Thiobacilli. Способ обнаружения сероокисляющих бактерий по настоящему изобретению включает, в частности, следующие стадии: выделение ДНК из образцов окружающей среды; амплификация ДНК с использованием пар праймеров, описанных выше, с помощью ПЦР или кПЦР (количественной ПЦР); анализ результатов ПЦР с помощью гель-электрофореза или иммунофлуоресценции продуктов, полученных с помощью кПЦР. Анализируемый образец может состоять из воды или почвы, взятых из образцов окружающей среды или бактериальных культур. Выделение геномной ДНК из анализируемых образцов может быть осуществлено различными способами: если используют культуры Thiobacillius, то ДНК выделяют способом CTAB/NaCl (J. Wiley. Preparation of genomic DNA from bacteria Molecular Biology Unit 2.4. (1994 и ресуспендируют в ТЕ буфере(Трис-ЭДТА (этилендиаминтетрауксусная кислота. если начинают с образцов окружающей среды (почва, вода), то в предпочтительном способе используют Fast DNA Kit (BIO 101), имеющийся в продаже от Qbiogene, или похожие способы, и ДНК ресуспендируют в DES буфере (раствор для элюции ДНК), принцип действия которого основан на адсорбции ДНК и последующем выделении из смолы. Анализ с праймерами, которые являются объектом изобретения, позволяет значительно сократить время обнаружения сероокисляющих бактерий, обеспечивая их обнаружение и количественную оценку в течение нескольких часов, в то время как традиционные способы (НВК), которые основаны на эффективном культивировании бактерий, требуют значительно более длительного периода времени (до 4 не-3 014242 дель). Используемый способ основан на амплификации ДНК с помощью ДНК-полимеразы в присутствии пар специфических праймеров (J. Sambrook, E. F. Fritsch and Т. Maniatis. A laboratory manual. CSH Laboratory Press (1989, и обычно используется для обнаружения целевых последовательностей ДНК в различных типах образцов для диагностических целей в медицине или анализов окружающей среды. Использовали температурные условия, время реакции и дополнительные агенты, которые необходимы для того, чтобы обеспечить специфическую гибридизацию фрагмента гена Thio16S и гена SoxB с праймерами. Условия, предпочтительно адаптированные для температуры отжига на стадии, предшествующей полимеризации в ПЦР, варьировали от -5 до -1 С в соответствии с наименьшей точкой плавления Tm среди тех пар зондов, которые использовали. Предпочтительное время полимеризации зависит от длины желательного продукта и оценивается примерно 1 т.п.н. полимеризующейся ДНК за минуту реакции. Условия, обеспечивающие "специфическую амплификацию", относятся к условиям, которые предотвращают амплификацию различных последовательностей из последовательностей гена Thio16S и гена SoxB. Отжиг во время реакции амплификации осуществляют при температурах, совместимых с последовательностью праймеров, в данном конкретном случае при 57 С для Thio16S и при 55 С для SoxB. Используемые буферы и ферменты представляют собой растворы, совместимые с характеристиками используемой ДНК-полимеразы, такой как, например, Taq полимераза, ampliTaq Gold. Реакции ПЦР осуществляли с парами праймеров, указанными в табл. 1 для рибосомального генаThio16S, используя условия, описанные в табл. 5 и 6, тогда как для гена SoxB использовали пары праймеров, указанных в табл. 2, используя условия, описанные в табл. 5 и 7. Пары праймеров, которые дали наилучшие результаты для рибосомального гена Thio16S и генаSoxB в отношении амплификации и специфичности в качестве диагностических последовательностей благодаря присутствию сероокисляющих бактерий, указаны ниже: Полуколичественные ПЦР-тесты проводили одновременно на образцах окружающей среды и культуре Thiobacillus consortium, состоящей из 3 сероокисляющих штаммов дикого типа, полученных из материалов, взятых из отложений серы, отобранных в лаборатории (отбор широко описан в итальянской заявке на патент Ml 03 А 000882, поданной тем же заявителем и озаглавленной: Metodo per inibire I'acidificazione biologica dell'acqua in contatto con materiali contenenti zolfo (Способ ингибирования биологического закисления воды при контакте с серосодержащими материалами), с использованием пар праймеров 445f-531 r SoxB. Они обнаружили не только присутствие, но также и различия в концентрации Thiobacilli с различиями в количестве серы, присутствующей в почве. Полученные результаты также продемонстрировали значительную корреляцию с результатами, полученными с использованием способа НВК. Условия, используемые для полуколичественных ПЦР-тестов, указаны в табл. 10 и 11. С достоверностью доступности подходящих зондов для обнаружения сероокисляющих бактерий в окружающей среде были начаты эксперименты с целью разработать способ количественной ПЦР. Способ основан на том факте, что скорость накопления продукта генной амплификации пропорциональна количеству геномной ДНК, присутствующей в реакционной смеси. Следовательно, можно, адаптируя измерительное устройство для количественной ПЦР, построить калибровочную кривую, используя пары праймеров по изобретению, смешанные с различными известными концентрациями геномной ДНК сероокисляющих бактерий, для определения количества ДНК,-4 014242 продуцируемой в процессе амплификации посредством флуориметрии, и последующего подсчета путем интерполяции количества неизвестной ДНК в анализируемых образцах. Амплификацию предпочтительно осуществляют в соответствии с условиями, указанными в набореSybrGSreen, поставляемом Applied Biosystems, или в соответствии с протоколами, предоставленными производителями. Другим преимуществом описанного способа является его легкая адаптация к используемым протоколам "in situ", таким как, например, использование портативных приборов. Следующие примеры и графические материалы иллюстрируют изобретение без ограничения его объема. Пример 1. Идентификация специфических и консервативных последовательностей гена Thio16S и гена SoxB для избирательно амплифицируемых сероокисляющих бактерий Из банков данных были взяты различные последовательности гена Thio16S и гена SoxB, представляющие различные виды бактерий Thiohacillus и сероокисляющих бактерий. Определяли консервативные области путем выравнивания с использованием программного обеспечения ClustalX для определения возможных праймеров для избирательно амплифицируемых сероокисляющих бактерий. Таким образом, были идентифицированы последовательности, приведенные на фиг. 1 для генаThio16S и на фиг. 2 для гена SoxB. Эти последовательности использовали для синтеза вырожденных олигонуклетотидов, которые использовали в качестве праймеров для амплификации. На основании исследования гомологичных областей были идентифицированы различные участки гена Thio16S с консервативной последовательностью, с которых были синтезированы праймеры, указанные в табл. 1. Таблица 1 В табл. 2 описаны праймеры для гена SoxB, идентифицированные при исследовании гомологичных областей SoxB, за исключением праймеров SoxBf и SoxBr, которые были взяты из литературы (R. Petri Пример 2. Корреляция между бактериальным ростом (НВК), закислением и присутствием серы Для проверки корреляции между концентрацией Thiobacilli и количеством серы были проведены следующие эксперименты: А) с культурами Thiobacilli consortium и серой,Б) с почвой в присутствии серы. А) Культура Thiobacilli consortium и серы 50 мл среды для Thiobacilli , содержащей (г/л): KH2PO4 (3,5); (NH4)2SO4 (0,3); MgSO4 7 Н 2 О (0,5);FeSO4 7H2O (0,018); CaCl2 (0,25) помещали в колбу объемом 100 мл. Значение рН доводили до 6 с помощью 0,1 н. HCl, и ТМ стерилизовали в паровом стерилизаторе (автоклаве) в течение 20 мин при 121 С,инокулировали 0,4% (об./об.) бактериальной суспензии Thiobacilli consortium, полученной, как описано в процитированном выше патенте. 2,0 г/л элементарной серы (в порошке при 98% - UNI, просеянной: 0,05) добавляли в ТМ культуру. Полученную таким образом культуру инкубировали в условиях слабого ротационного встряхивания (100 об./мин) в течение 72 ч при комнатной температуре и использовали в качестве инокулята. 50 мл ТМ с 5% вышеописанного инокулята и различными концентрациями серы (50, 100, 500, 1000 и 4000 млн-1) помещали в 5 колб объемом 100 мл. Культуры контролировали в течение 20 суток путем регистрации величины оптической плотности (при 600 нм) и измерения значения рН. Результаты представлены в табл. 3. Таблица 3 Из табл. 3 можно видеть, что сера при значении от 500 млн-1 до 4000 млн-1 способна вызывать усиление роста Thiobacilli и закисления культуральной среды, ниже значения 500 млн-1 нет значительных различий ни в OD, ни в рН. Б) Почва в присутствии серы Приготавливали 5 небольших контейнеров (1015 см), каждый из которых содержит 250 г почвы(просеянной до 1,4 мм, полученной из EniTecnologie centre) и 50 г почвы (просеянной до 1,4 мм, полученной из EniTecnologie centre), загрязненной различными количествами серы (10, 50, 100, 500 и 4000 млн-1). Затем добавляли 20 мл дождевой воды (с помощью распылителя), поддерживая этот объем постоянным. В табл. 4 представлены результаты роста Thiobacilli, оцененного через 20 суток при комнатной температуре способом НВК. Результаты показывают, что способ НВК позволяет обнаружить присутствие Thiohacilli, начиная с концентрации серы примерно 83 млн-1. Следовательно, способ НВК может быть использован для обнаружения присутствия следов серы с целью мониторинга окружающей среды с использованием Thiohacilli в качестве "биомаркеров". Способ НВК применяли (Е. Cochran. EEstimation of bacterial densities by means of the "most probablenumber". Biometrics 6:105-116 (1950, используя ТМ при рН 6. На практике образцы почвы разводили раствором Рингера (5 г в 45 мл) и приготавливали масштабированные серии десятикратных разведений(1 мл образца, разведенного в 9 мл раствора Рингера). Для каждого разведения 1 мл разведенной раствором Рингером почвы переносили в 5 мл среды ТМ с 0,02 г (0,4%) элементарной серы (98% серы в порошкообразной форме, просеянной UNI 0,05), и для каждого разведения приготавливали 3 пробирки объемом по 15 мл. Далее применяли два способа, предложенные в литературе:I - в котором позитивность сероокисляющих бактерий основана на смачиваемости серы и мутности культуральной среды (С. Knickerbocker. The role of blebbing in overcoming the hydrophobic barrier duringII - позитивность образцу придает снижение рН и последующее изменение цвета культуральной среды благодаря добавлению 15 мл/л индикатора рН (15% пурпурный бромкрезол) к ТМ (М. Hines. Sulfphur cycling, Manual of Environmental Microbiology (1998. Второй способ является предпочтительным, поскольку он более быстрый и более легкий в интерпретации по сравнению с первым способом. Пример 3. Определение сероокисляющих бактерий в почве и культуре Thiobacillus consortium зондами на основе генов Thio16S и SoxB Анализируемый образец состоял из ДНК, выделенной из образцов окружающей среды (почвы) и бактериальных культур Thiohacillus consortium. Использовали различные способы выделения бактериальной ДНК: из культуры Thiobacillus consortium (выращиваемой в течение 72 ч); ДНК выделяли способом CTAB/NaCl и ресуспендировали в 50 мкл ТЕ (Трис-ЭДТА); из образцов окружающей среды; этот способ начинали с 500 мг почвы и использовали Fast DNA Kit(BIO 101), ресуспендируя ДНК в конечном объеме 70 мкл DES (раствор для элюции ДНК). Реакцию ПЦР проводили с различными комбинациями пар праймеров для Thio16S из почвы и культуры Thiobacillus consortium, следуя условиям, описанным в табл. 5, и с различными комбинациями пар праймеров для SoxB из Thiobacillus consortium, следуя условиям, описанным в табл. 5 и 7. Таблица 5 Следуя вышеописанным методикам, полученные результаты после анализа на агарозном геле представлены в табл. 8 для гена Thio16S, и в табл. 9 и на фиг. 4 для гена SoxB. Таблица 8OK = получен ожидаемый продукт амплификации в виде единственной полосы или в виде преобладающей полосы +/- = получены неспецифичные полосы Затем идентифицировали две пары праймеров Т 9-Т 21 и Т 9-Т 19, способные обеспечить положительную амплификацию и специфичные результаты, для использования в качестве диагностических последовательностей для определения присутствия и количества Thiobacilli. Анализ картины продуктов амплификации для гена SoxB в культуре Thiobacillus consortium, представленной на фиг. 4, указывает пары праймеров, используемые в реакциях 14, 16, 20 и 21, являющиеся наиболее специфичными и эффективными. Следовательно, праймеры 360f, 445f, 445r, 529r, 531 г могут быть использованы для мониторинга S-окисляющих бактерий в почве (фиг. 5). Также следует подчеркнуть, что ответ, полученный с праймерами SoxB, используемыми в литературе для филогенетического исследования водных видов микроорганизмов (Chlorobium и Paracoccus),вовлеченных в цикл серы в речном эстуарии, является абсолютно неадекватным для использования этих праймеров в количественных реакциях ПЦР, поскольку наблюдалось присутствие неспецифических полос (см., например, фиг. 4) и димеров праймеров. Следовательно, можно утверждать, что идентифицированные зонды, являющиеся объектом настоящего изобретения, являются наиболее эффективными для обнаружения сероокисляющих бактерий в почве и в материалах окружающей среды в целом. Пример 4. Полуколичественные ПЦР-тесты на образцах окружающей среды и на культуре Thiobacillus consortium Для того чтобы оценить возможность использования генного зонда 445f-531 г SoxB для осуществления полуколичественных анализов на присутствие Thiobacilli в почве, разработали сравнительный тест продуктов амплификации, полученных (при разных разведениях) из ДНК, выделенной из почвы, подвергшейся загрязнению серой (образец Н, взятый из соответствующих областей лаборатории EniTecnoIogie, расположенных рядом с источником серы; обычной почвы (образец D); культуры эталонной бактерии (Thiobacillus consortium). Полуколичественную ПЦР-реакцию проводили в следующих условиях, описанных в табл. 10 и 11. Данные тесты свидетельствуют о сравнительно более высокой концентрации сероокисляющих бактерий в месте, достоверно загрязненном S0 (образец Н) относительно других типов почвы (образец D), и согласуются с результатами, полученными с помощью НВК, которые представлены в табл. 12. Таблица 12 Оба способа (НВК и ПЦР) способны продемонстрировать не только наличие Thiohacilli в почве, но и изменения ее концентрации. Праймеры 445f и 531r также успешно использовали в экспериментах с количественной ПЦР для обнаружения дозы гена SoxB в образцах окружающей среды. Для этой цели строили калибровочную кривую (стандарт) с использованием пары специфических праймеров 445f и 531r для гена SoxB, и эксперимент начинали с ДНК, выделенной из образцов окружающей среды, содержащих сероокисляющие бактерии, разведенных в различных известных концентрациях (см. ромбовидные символы, показанные на фиг. 6). Это позволяет обнаруживать присутствие и количество ДНК, содержащей гены SoxB, присутствующей в различных типах образцов окружающей среды (вода, почва и т.д.), посредством интерполяции. Сигнал, полученный с помощью праймеров для эубактерий (см. квадратные символы, показанные на фиг. 6), основанный на последовательностях 16S рДНК, показал, что все бактерии присутствуют в образце.- 10014242 Реакции без ДНК или реакции с ДНК, выделенной из образцов, в которых S-окисляющие бактерии отсутствуют, не дали положительного сигнала. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ идентификации сероокисляющих бактерий в почве, включающий выделение ДНК из почвенных образцов окружающей среды и последующую идентификацию по меньшей мере одного фрагмента рибосомального гена Thio 16S и/или гена SoxB, присутствующего у этих бактерий, посредством амплификации гена в присутствии пар олигонуклеотидов, комплементарных гену Thio 16S, выбранных из следующих пар последовательностей: и/или в присутствии пар олигонуклеотидов, комплементарных гену SoxB, где прямой праймер выбран из следующих последовательностей: и обратный праймер выбран из следующих последовательностей: 2. Способ по п.1, где амплификацию гена SoxB осуществляют в присутствии пар олигонуклеотидов,выбранных из следующих пар последовательностей: 3. Способ идентификации сероокисляющих бактерий по пп.1-2, включающий следующие стадии: выделение ДНК из образцов; приведение выделенной ДНК в контакт с парой праймеров, выбранных из тех, которые определены в п.1, в условиях, обеспечивающих специфическую амплификацию фрагмента гена SoxB; анализ продукта генной амплификации с помощью ПЦР в реальном масштабе времени, гельэлектрофореза или другого метода анализа. 4. Способ идентификации сероокисляющих бактерий по п.3, где температуры отжига в фазе, предшествующей специфической генной амплификации, варьируют от -5 до -1 С в соответствии с наименьшей температурой плавления Tm из температур плавления используемых пар зондов, и время полимеризации составляет минуту реакции на тысячу пар нуклеотидов полимеризующейся ДНК. 5. Способ количественного определения сероокисляющих бактерий, включающий: а) осуществление генной амплификации в соответствии со способом по п.3 в присутствии различных количеств геномной ДНК сероокисляющих бактерий; б) количественное определение продукта генной амплификации; в) построение калибровочной кривой; г) количественное определение геномной ДНК в анализируемых образцах посредством интерполяции. 6. Способ по п.3 или 5, где генную амплификацию осуществляют в присутствии пар олигонуклеотидов, комплементарных гену SoxB, имеющих следующую пару последовательностей: 7. Способ определения распределения серы в почве, включающий идентификацию сероокисляющих бактерий и их количественную оценку, где количественную оценку сероокисляющих бактерий осу- 11014242 ществляют способом по п.5. 8. Диагностический набор для идентификации присутствия сероокисляющих бактерий в образцах окружающей среды, основанной на идентификации гена Thio 16S посредством генной амплификации в присутствии пар олигонуклеотидов, комплементарных гену Thio 16S, выбранных из следующих пар последовательностей: или гена SoxB посредством генной амплификации в присутствии пар олигонуклеотидов, комплементарных гену SoxB, где прямой праймер выбран из следующих последовательностей: и обратный праймер выбран из следующих последовательностей: 9. Пара олигонуклеотидов, комплементарных гену Thio 16S сероокисляющих бактерий, выбранная из следующих пар последовательностей: 10. Пара олигонуклеотидов, комплементарных гену SoxB сероокисляющих бактерий, выбранная из следующих пар последовательностей: 11. Олигонуклеотид, комплементарный гену Thio 16S сероокисляющих бактерий, выбранный из одной из следующих последовательностей: 12. Олигонуклеотид, комплементарный гену Thio 16S сероокисляющих бактерий, выбранный из одной из следующих последовательностей:- 12014242 13. Способ идентификации сероокисляющих бактерий в почве, включающий гибридизацию соответствующим образом меченого зонда с геномной ДНК анализируемого образца, отличающийся тем, что зонд состоит по меньшей мере из одной из последовательностей, указанных в пп.11 и 12. 14. Способ по п.13, где геномная ДНК состоит из продукта генной амплификации, как он определен в п.1.
МПК / Метки
МПК: C12Q 1/68
Метки: идентификации, серы, среде, бактерий, сероокисляющих, элементарной, мониторинга, окружающей, способ
Код ссылки
<a href="https://eas.patents.su/25-14242-sposob-identifikacii-serookislyayushhih-bakterijj-i-monitoringa-elementarnojj-sery-v-okruzhayushhejj-srede.html" rel="bookmark" title="База патентов Евразийского Союза">Способ идентификации сероокисляющих бактерий и мониторинга элементарной серы в окружающей среде</a>
Следующий патент: Способ непрерывного производства гидроксиламмония
Случайный патент: Устройство для фильтрации вод различного генезиса и способ подготовки сорбирующего материала