Гонадотропины для фолликулогенеза
Формула / Реферат
1. Фармацевтическая композиция, содержащая рекомбинантный ФСГ, имеющий число Z, которое составляет по меньшей мере 200, предпочтительно по меньшей мере 220, более предпочтительно по меньшей мере 240 и наиболее предпочтительно по меньшей мере 260.
2. Фармацевтическая композиция по п.1, где рекомбинантный ФСГ имеет среднее значение рI менее 3,4, более предпочтительно менее 3,3 и наиболее предпочтительно менее 3,2.
3. Фармацевтическая композиция, содержащая рекомбинантный ФСГ, имеющий среднее значение рI менее 3,4, более предпочтительно менее 3,3 и наиболее предпочтительно менее 3,2.
4. Фармацевтическая композиция по любому из пп.1-3 для использования в медицине.
5. Фармацевтическая композиция по п.1 или 2, где рекомбинантный ФСГ имеет индекс антенности АИ примерно от 220 до 280.
6. Фармацевтическая композиция по любому из пп.1-5, где рекомбинантный ФСГ экспрессируется в клетках яичника китайского хомячка (СНО).
7. Фармацевтическая композиция по любому из пп.1-6, пригодная для использования при фолликулогенезе.
8. Фармацевтическая композиция по любому из пп.1-6, пригодная для индукции контролируемой гиперстимуляции яичников.
9. Фармацевтическая композиция по любому из пп.1-6, пригодная для индукции овуляции или внутриматочного оплодотворения.
10. Фармацевтическая композиция по любому из пп.1-6, пригодная для использования при лечении мужского бесплодия.
11. Фармацевтическая композиция по любому из пп.1-10, где ФСГ имеет повышенную степень сиалилирования в одном или более дополнительных сайтах гликозилирования, присутствующих на пептиде, добавленном к белку ФСГ.
12. Фармацевтическая композиция по п.11, где добавленный пептид представляет собой карбокси-концевую часть b -субъединицы человеческого хорионического гонадотропина (чХГ).
13. Фармацевтическая композиция по любому из пп.1-12, где ФСГ содержит одну или более мутаций, которые вносят в белок ФСГ один или более дополнительных сайтов гликозилирования и повышают степень его сиалилирования.
14. Фармацевтическая композиция по п.13, где мутации выбраны из одной или более из A70N, V78N, G100N, D41N/A43T в b -субъединице ФСГ и/или из одной или более из F17T, E56N, H83N в a -субъединице ФСГ.
15. Способ получения препарата рекомбинантного ФСГ, имеющего число Z, которое составляет по меньшей мере 200, где указанный способ включает в себя стадию взаимодействия ФСГ с донором сиаловой кислоты в присутствии 2,3-сиалилтрансферазы.
16. Способ по п.15, где рекомбинантный ФСГ имеет число Z, которое, по меньшей мере, составляет 220, предпочтительно по меньшей мере 240, более предпочтительно по меньшей мере 260.
17. Способ по любому из пп.15 или 16, где донором сиаловой кислоты является ЦМФ-сиаловая кислота.
18. Способ по любому из пп.15-17, где сиалилтрансфераза представляет собой крысиную ST3Gal III.
19. Способ получения препарата рекомбинантного ФСГ, имеющего число Z, которое составляет по меньшей мере 200, где указанный способ включает в себя стадию изоэлектрического фокусирования, хроматофокусирования или ионообменной хроматографии.
20. Способ получения препарата рекомбинантного ФСГ, имеющего число Z, которое составляет по меньшей мере 200, где указанный способ включает в себя обогащение культуральной среды, в которой экспрессируется рекомбинантный ФСГ, ингибиторами нейраминидазы и/или внутриклеточными предшественниками синтеза сиаловой кислоты, такими как ацетилманнозамин.
21. Способ по п.19 или 20, где рекомбинантный ФСГ экспрессируется в клетках яичника китайского хомячка (СНО).
22. Способ по любому из пп.15-21, где рекомбинантный ФСГ имеет среднее значение рI менее 3,4, более предпочтительно менее 3,3 и наиболее предпочтительно менее 3,2.
Текст
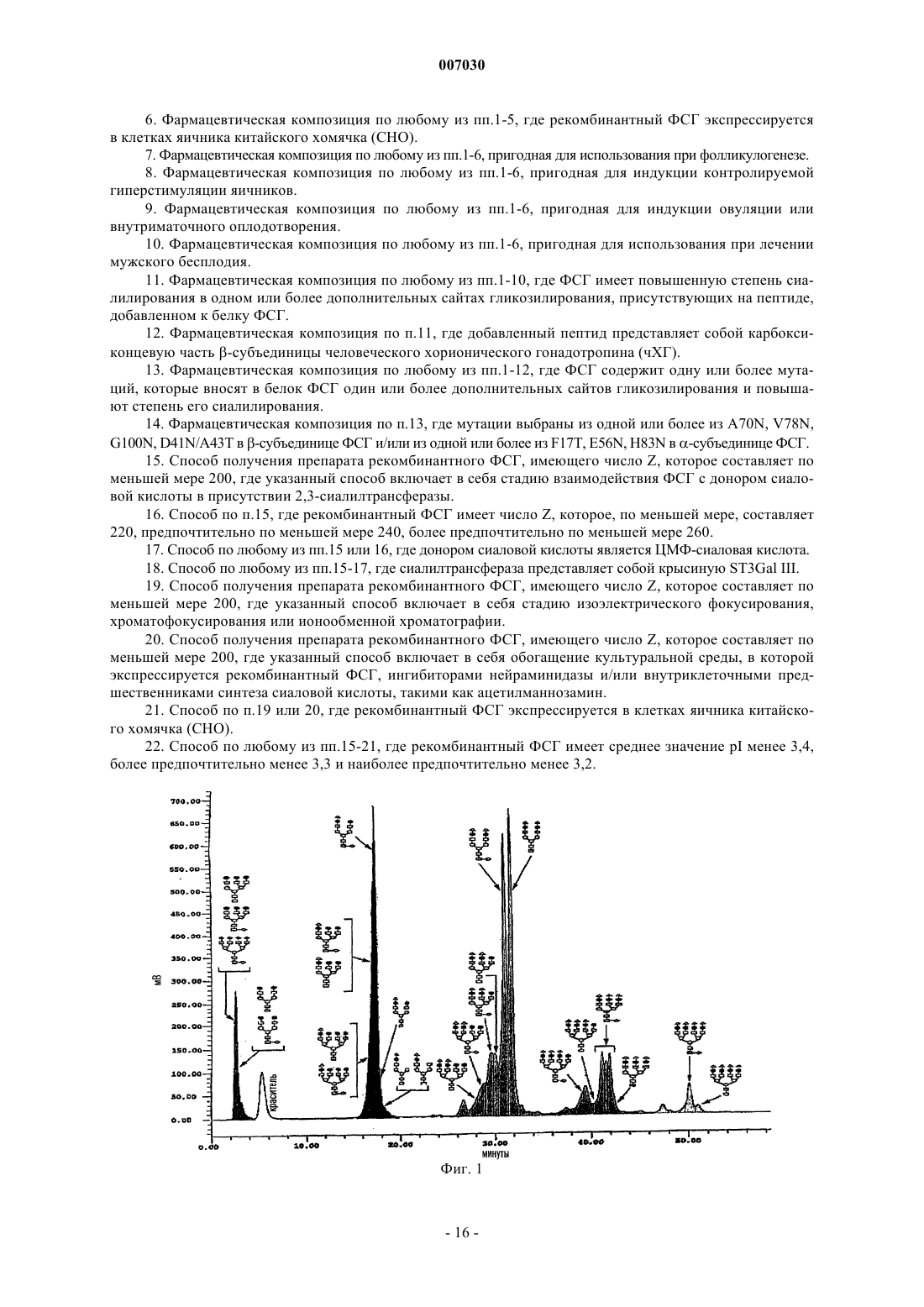
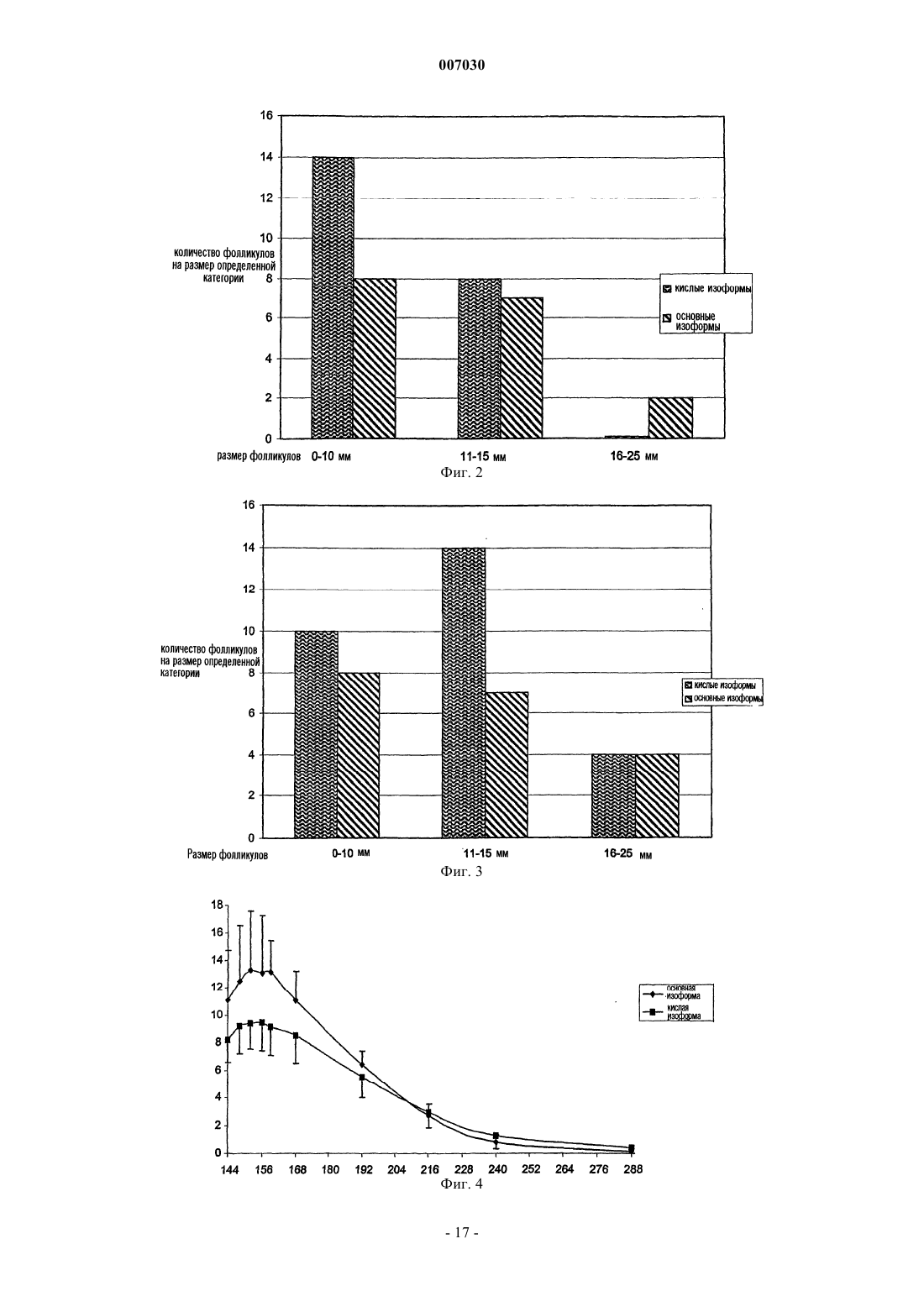
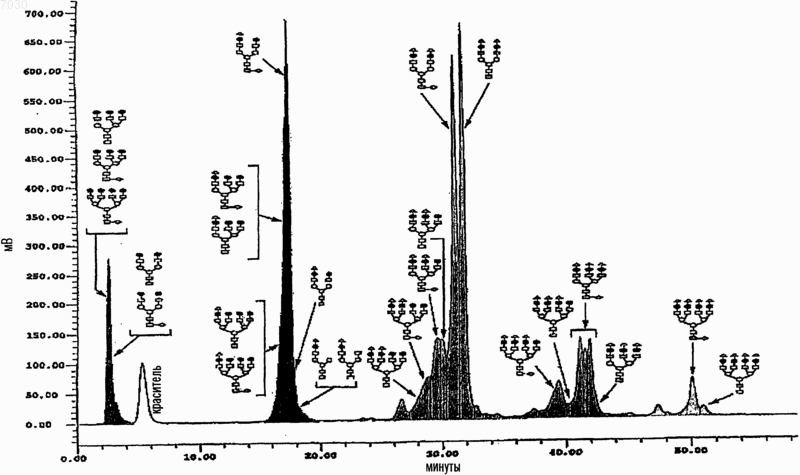
007030 Область техники, к которой относится изобретение Настоящее изобретение относится к гонадотропинам, и в частности к их использованию в методиках искусственного оплодотворения, индукции овуляции, внутриматочного оплодотворения и при мужском бесплодии. Предпосылки создания изобретения Гонадотропины представляют собой группу гетеродимерных гликопротеинов, включающую в себя фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ) и хорионический гонадотропин (ХГ). Указанные гормоны регулируют гонадную функцию у мужчин и женщин. Каждый из указанных гормонов состоит из двух соединенных нековалентной связью субъединиц:-субъединицы, которая является общей структурой для ФСГ, ЛГ и чХГ, и -субъединицы, которая уникальна для каждого из них и которая придает соответствующую биологическую специфичность каждому из указанных гормонов. Во всех гонадотропинах каждая субъединица содержит связанные с аспарагином (через N-связь) олигосахаридные боковые цепи. В общей -субъединице человеческих гормонов они присоединяются в положениях 52 и 78. В человеческих ФСГ и ХГ две N-связанные олигосахаридные боковые цепи присоединены к -субъединице в положениях 7 и 24 в случае ФСГ и в положениях 13 и 30 в случае чХГ. В человеческом ЛГ один олигосахарид присоединен в положении 30 к -субъединице. чХГ дополнительно включает в себя четыре связанные через серин (через O-связь) олигосахаридные боковые цепи, имеющиеся на концевом участке карбоксила. Как в целом для всех гликопротеинов, в гонадотропинах имеются вариации в структуре олигосахарида, которые приводят к образованию структурных изоформ, обнаруживаемых в гипофизе и кровотоке. Кроме того, имеются различия в степени кэппинга концевого углевода сиаловой кислотой. Изоформы могут быть разделены на основании их заряда, который в значительной мере определяется числом и распределением сиалилированных N-связанных олигосахаридов. Высокосиалилированные формы имеют более кислый характер, чем средние значения рI, и называются кислыми. Менее сиалилированные формы имеют сравнительно более высокие значения рI и называются основными. Вследствие структурных различий изоформы гонадотропина различаются по своей способности связываться с рецепторами клетки-мишени. Степень сиалилирования влияет на их способность сохраняться в кровотоке. В случае ФСГ несколько групп исследователей показали, что высококислотные/сиалилированные изоформы характеризуются значительно более длительным периодом полувыведения на животных моделях, таких как мышиная и крысиная (1). Было показано, что изоформный профиль эндогенного ФСГ у человека варьирует. Кислые изоформы с длительными периодами полувыведения in vivo и относительно низкой биологической эффективностью in vitro преобладают в сыворотке детей предпубертантного возраста, у пациентов с гипогонадизмом и у женщин в фолликулярной фазе. И, наоборот, менее сиалилированные и более щелочные изоформы с небольшим периодом полувыведения in vivo и относительно высокой биологической активностью invitro обнаружены в пубертантном возрасте, при лечении гонадотропин-рилизинг-гормоном и примерно в середине цикла выброса гонадотропина у женщин (2). Изоформы ФСГ, характеризующиеся повышенным содержанием сиаловых кислот, циркулируют в течение более длительного периода времени, поскольку концевые остатки сиаловых кислот кэппируют, то есть закрывают галактозные остатки, предотвращая тем самым взаимодействие с асиалогликопротеиновыми рецепторами печени и их последующее выведение из кровотока (3). Олигосахаридные (гликановые) фрагменты, присоединенные к белкам, разветвлены, и каждый концевой сахарный остаток рассматривается как антенна. Показатель Z-числа представляет собой меру того,какая доля антенн в углеводном фрагменте гликопротеина несет заряженные остатки, такие как сиаловая кислота. Десиалилированный ФСГ имеет число Z, равное 0. Полностью сиалилированный ФСГ будет иметь значение числа Z от 230 до 280. Эффективность препаратов ФСГ оценивают in vitro в тесте Стилмана-Поли (Steelman-Pohley), который позволяет определять в конкретных условиях способность препарата увеличивать массу яичников у незрелых крыс по сравнению с международным стандартным/эталонным препаратом, откалиброванным в международных единицах (ME) (4). Многие группы исследователей изучали влияние гликозилирования и сиалилирования на биологический профиль ФСГ.D'Antonio et al. оценивали скорости метаболического клиренса у самок крыс для кислотных (рI4,8) и основных (рI4,8) изоформ ФСГ грызунов, полученных при хроматофокусировании. Как и ожидалось,было показано, что основные формы характеризуются более быстрым клиренсом, чем кислотные изоформы (t1/2=0,4 ч для основной и 0,9 ч для кислотной форм). При сравнении кислотной и основной форм(на основании массы) в тесте Стилмана-Поли было показано, что основная изоформа значительно менее активна, чем кислотная изоформа (ED50=0,9 мкг/крыса для основной и 0,3 мкг/крыса для кислотной форм). При сравнении изоформ на основании значений ME между ними не выявляется разница (5).Vitt et al. провели исследование in vitro, в котором четыре препарата рекомбинантного человеческого ФСГ с различными значениями рI сравнивали по их способности вызывать увеличение размера и продукции эстрадиола (Е 2) в выделенных фолликулах мыши. Было показано, что основный ФСГ (рI 5,0-5,6) приводит к более быстрому росту фолликулов и сказывается на достижении максимального размера фолликулов в сравнении с нефракционированным рекомбинантным ФСГ. Препараты ФСГ со средним и кислым значениями pI (pI 4,5-5,0 и рI 3,6-4,6, соответственно) отставали как по скорости роста, так и по максимальному размеру фолликулов. Было показано, что основный ФСГ индуцирует секрецию Е 2 раньше и при использовании меньшей дозы, чем в случае других изоформ. Фолликулы, культивируемые с кислым ФСГ, независимо от концентрации, секретируют выявляемые концентрации E2 только после длительной инкубации (6).Timossi et al. использовали метод хроматофокусирования для разделения ФСГ из гипофиза человека на семь разных фракций с различным уровнем гликозилирования/кислотности. Фракции анализировали на их способность вызывать положительную регуляцию экспрессии ароматазы (необходимой для продукции эстрадиола) и тканевого активатора плазминогена (tPA) in vitro в зернистых клетках крысы. Отношение уровня биологической активности к иммунореактивности (Б/И) снижается, как было показано,по мере снижения рН выходящих при элюции изоформ. Авторы сделали вывод, что основные изоформы проявляют большую способность индуцировать экспрессию мРНК как ароматазы, так и tPA, а также белков, чем кислые варианты (7).Zambrano et al. провели разделение ФСГ из гипофиза человека на девять фракций с различным значением рI с использованием метода хроматофокусирования и проанализировали кислотную и основную изоформы с помощью трех иммунологических тестов и двух тестов in vitro: с точки зрения продукции эстрадиола зернистыми клетками крысы и продукции цАМФ линией фетальных клеток человека, экспрессирующих рецептор ФСГ. Отношение уровня биологической активности в биотестах к иммунореактивности (Б/И) снижается, как было показано, по мере снижения рI изоформ во всех биотестах (8). В другом исследовании Zambrano et al. провели сравнение аффинного связывания семи различных фракций кислотных и основных изоформ ФСГ из гипофиза человека в гетерологичной рецепторной системе (из зернистых клеток крысы) и гомологичной рецепторной системе (рекомбинантные человеческие клетки НЕК-293, экспрессирующие рецептор человеческого ФСГ). При использовании гетерологичного рецептора было показано увеличение аффинного связывания по мере повышения значения рI изоформы,тогда как в случае гомологичного рецептора этого не происходило. Продукция цАМФ в клетках НЕК 293 повышалась по мере повышения значения рI изоформы (9). В других исследованиях было показано, что более кислые формы ФСГ проявляют наивысшую биологическую активность in vivo (на основе массы) при оценке в рамках классического анализа по определению увеличения веса яичников (10, 11). Timossi et al. постулировали, что основные формы могут быть более активными in vivo, но что в связи с их более коротким периодом полувыведения эффект по увеличению веса яичников крысы может не проявляться. Они изучали эффект этих двух препаратов в системе быстрого реагирования: повышения активности тканевого активатора плазминогена (tPA) (12). Авторы сделали вывод, что ФСГ грызунов имеет менее кислый профиль распределения заряда, демонстрирует более высокую биоактивность in vitro и скорости клиренса плазмы и индуцирует энзиматическую активность tPA быстрее, чем высококислый препарат ФСГ. Гонадотропины играют решающую роль в репродуктивном цикле, и их использование является существенным в методиках искусственного оплодотворения, таких как оплодотворение in vitro, оплодотворение in vitro в сочетании с внутрицитоплазматической инъекцией спермы и переносом эмбриона, а также при индукции овуляции у ановулярных пациентов, подвергающихся оплодотворению in vivo либо естественным путем, либо путем внутриматочного оплодотворения. Методами искусственного оплодотворения пользуются обычно при контролируемой гиперстимуляции яичников с целью повышения числа женских гамет (13). Стандартная процедура (14) проведения контролируемой гиперстимуляции яичников включает в себя фазу понижающей регуляции, при которой эндогенные гонадотропины подавляются путем введения агониста гонадотропин-рилизинг-гормона с последующим проведением фазы стимуляции, при которой развитие фолликулов (фолликулогенез) индуцируют ежедневным введением ФСГ обычно в количестве 150-225 МЕ/день. В альтернативном варианте стимуляцию начинают после спонтанной или индуцированной менструации путем предотвращения нежелательного выброса ЛГ за счет введения антагониста гонадотропин-рилизинг-гормона (обычно начиная примерно с шестого дня фазы стимуляции). Когда имеется по меньшей мере три фолликула размером 16 мм (один из них размером 18 мм), вводят болюс чХГ (5-10000 ME) для имитации естественного выброса ЛГ и индукции овуляции. Восстановление ооцитов происходит через 36-38 ч после инъекции чХГ. Индукцию овуляции проводят обычно путем ежедневного введения ФСГ в дозе примерно 75-150 МЕ/день. Можно использовать понижающую регуляцию под действием агонистов или антагонистов гонадотропин-рилизинг-гормона, хотя менее часто, чем в случае применения методов искусственного оплодотворения, чХГ вводят для имитации выброса ЛГ перед оплодотворением in vivo, что достигается либо при обычном половом акте, либо путем внутриматочного оплодотворения.-2 007030 Типичные процедуры, описанные выше в применении к методикам искусственного оплодотворения и индукции овуляции, требуют ежедневных инъекций гонадотропина в течение длительного времени, то есть в среднем до 10 дней и вплоть до 21 дня у некоторых пациентов. Разработка препаратов ФСГ повышенной эффективности может позволить снизить ежедневные дозировки и/или сократить период лечения (то есть за счет меньшего числа инъекций) и/или позволит проводить инъекции реже. Это, в свою очередь, позволит сделать процедуры искусственного оплодотворения и индукции овуляции более удобными и лучше воспринимаемыми пациентами. Кроме того, при оплодотворении in vitro методики искусственного оплодотворения чреваты возможными неудачами. Так, например, не каждый фолликул будет продуцировать жизнеспособный ооцит и не каждый жизнеспособный ооцит будет успешно оплодотворен, и некоторые эмбрионы также могут быть нежизнеспособными. Кроме того, как только жизнеспособный эмбрион будет выбран, перенос в матку и имплантация могут оказаться неуспешными. Для того, чтобы максимализировать шансы рождения живого организма, желательно в этой связи стимулировать рост и созревание нескольких фолликулов с тем, чтобы гарантировать отбор множества ооцитов. В случае, когда показана индукция овуляции, наоборот, целью является получение не более трех, а предпочтительно одного доминантного фолликула (с тем, чтобы избежать множественной беременности). Некоторые пациенты, подвергающиеся методикам искусственного оплодотворения и индукции овуляции, характеризуются сниженным числом растущих фолликулов при лечении традиционными препаратами ФСГ. Это является ограничивающим фактором успеха в методиках искусственного оплодотворения, причем это лимитирует число эмбрионов, пригодных для переноса и/или креоконсервирования. Это может быть также и ограничивающим фактором успешности операции внутриматочного оплодотворения у пациентов, где важно получить более одного фолликула. Пациенты с указанным типом реакции включают в себя пациентов в возрасте свыше 33-35 лет, пациентов с повышенным базовым уровнем ФСГ, повышенным базовым уровнем эстрадиола или пониженным базовым уровнем ингибина b. У мужчин сперматогенез зависит от стимуляции клеток Сертоли под действием ФСГ. Дефицит ФСГ приводит к олигоспермии, а, следовательно, к бесплодию. Лечение мужского бесплодия традиционными препаратами ФСГ требует трехразовых инъекций в неделю в течение 18 месяцев. Разработка препаратов ФСГ с повышенной способностью стимулировать фолликулогенез является насущной необходимостью. Есть также потребность в новых препаратах ФСГ для лечения пациентов со сниженным ответом на ФСГ. Желательны также препараты ФСГ с повышенной эффективностью, которые позволили бы проведение лечения в более короткие сроки и/или с использованием сниженных кумулятивных доз, и/или с меньшей частотой дозирования при использовании методик искусственного оплодотворения, индукции овуляции и лечении мужского бесплодия. Краткое описание сущности изобретения Объектом настоящего изобретения является получение препарата гонадотропина для использования при индукции овуляции и контролируемой гиперстимуляции яичников, особенно в сочетании с методиками искусственного оплодотворения В первом аспекте настоящее изобретение относится к препарату ФСГ, в котором число Z составляет по меньшей мере 200 или около 200. Во втором аспекте настоящее изобретение относится к препарату ФСГ, который отличается тем,что имеет среднее значение рI ниже 3,4 или около этого значения. В третьем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей ФСГ, где ФСГ имеет число Z, составляющее по меньшей мере 200 или около 200. В четвертом аспекте настоящее изобретение относится к применению ФСГ при стимуляции фолликулогенеза, причем ФСГ имеет число Z, которое по меньшей мере составляет 200 или около 200. В пятом аспекте настоящее изобретение относится к изготовлению лекарственного средства для применения при стимуляции фолликулогенеза, причем ФСГ имеет число Z, которое по меньшей мере составляет 200 или около 200. В шестом аспекте настоящее изобретение относится к способу индукции фолликулогенеза у человека, причем указанный способ включает в себя введение ФСГ пациенту, отличающееся тем, что указанный ФСГ имеет число Z, которое по меньшей мере составляет 200 или около 200. В седьмом аспекте настоящее изобретение относится к способу получения препарата ФСГ, имеющего число Z, которое по меньшей мере составляет 200 или около 200, причем указанный способ включает в себя стадии, выбранные из проведения реакции ФСГ с донором сиаловой кислоты в присутствии 2,3-сиалилтрансферазы; выбора подходящего типа клеток для экспрессии рекомбинантного ФСГ; культивирования клетки, предпочтительно рекомбинантной, которая экспрессирует в ФСГ в условиях, благоприятствующих высокому уровню сиалилирования; и выделения изоформ ФСГ, имеющих высокое число Z, с использованием хроматографических методов. В восьмом аспекте настоящее изобретение относится к применению ФСГ при лечении мужского бесплодия, причем ФСГ имеет число Z, которое по меньшей мере составляет 200 или около 200.-3 007030 В девятом аспекте настоящее изобретение относится к применению ФСГ при изготовлении лекарственного средства для использования при лечении мужского бесплодия, причем ФСГ имеет число Z,которое по меньшей мере составляет 200 или около 200. В десятом аспекте настоящее изобретение относится к способу лечения мужского бесплодия у человека, причем указанный способ включает в себя введение ФСГ пациенту, отличающееся тем, что указанный ФСГ имеет число Z, которое составляет по меньшей мере 200 или около 200. Краткое описание фигур На фиг. 1 показана хроматограмма, соответствующая элюции с колонки GlycoSep С гликанов, высвобождающихся из ФСГ крыс; колонка 4,6 х 100 мм, заполненная полимером, покрытым дивинилбензольной смолой (5 мл), при использовании мобильной фазы, состоящей из ацетонитрила:воды 20:80, с линейным градиентом 0,25% в минуту ацетата аммония (500 мМ), с 5-й по 21-ю минуты, с последующим линейным градиентом 0,525% (500 мМ) ацетата аммония в минуту, с 21-й по 61-ю минуты. На оси Х указано время удерживания в минуту, а на оси Y указана сила сигнала в мВ. На фиг. 2 показано число фолликулов по категориям размера на 8-й день (на оси Y) у пациентов,получавших кислотную и основную изоформы ФСГ до 7-го дня. Волнистые линии обозначают результат, полученный при использовании кислотных изоформ, наклонные линии соответствуют результату,полученному с использованием основных изоформ. На фиг. 3 показано число фолликулов по категориям размера на 10-й день (по оси Y) у пациентов,получавших кислую и основную изоформы ФСГ до 7-го дня. Волнистые линии обозначают результат,полученный при использовании кислотных изоформ, наклонные линии соответствуют результату, полученному при использовании основных изоформ. На фиг. 4 показан средний уровень ФСГ в сыворотке у пациентов после введения последней дозы кислой и основной изоформ ФСГ. На оси Х показано время в часах после первой инъекции ФСГ, на осиY показана концентрация в сыворотке в МЕ/л. Квадратысоответствуют концентрации сыворотки после инъекции кислых изоформ; ромбысоответствуют концентрации сыворотки после инъекции основных изоформ ФСГ. Концентрацию в сыворотке измеряют методом иммуноанализа, например радиоиммуноанализа с использованием набора от компании Daiichi Isotope Laboratory, Japan. На фиг. 5 показана аминокислотная последовательность альфа-субъединицы зрелого человеческого ФСГ. На фиг. 6 показана аминокислотная последовательность бета-субъединицы зрелого человеческого ФСГ. Подробное описание изобретения Авторы изобретения неожиданно обнаружили, что высокосиалилированные изоформы ФСГ имеют большую эффективность в индукции фолликулогенеза у человека, чем менее сиалилированные изоформы. Применение препарата ФСГ согласно изобретению позволит использовать меньшие кумулятивные дозы ФСГ для достижения такого же или лучшего клинического результата. Авторы изобретения обнаружили, что в случае лечения пациентов равными количествами кислого ФСГ и щелочного ФСГ, на основании ME, определяемого традиционным методом, число растущих фолликулов у пациентов, принимавших кислый ФСГ, значительно выше. В том случае, когда пациентов лечат равными количествами кислого ФСГ и основного ФСГ на основе массы, число фолликулов у пациентов, принимавших кислый ФСГ, также значительно выше. У некоторых пациентов обнаруживается пониженное число растущих фолликулов при лечении традиционными препаратами ФСГ. Это является фактором, ограничивающим успешное проведение методик искусственного оплодотворения. Пациенты с указанным типом реакции включают в себя пациентов в возрасте старше 33-35 лет, пациентов с повышенным базовым уровнем ФСГ, пациентов с повышенным базовым уровнем эстрадиола или сниженным базовым уровнем ингибина b. Препарат ФСГ согласно изобретению можно вводить в виде инъекций ежедневно или через день для проявления лучшего эффекта на яичники, чем традиционные препараты. При этом повышается шанс оплодотворения клетки у данных пациентов. Авторы изобретения неожиданно обнаружили, что препараты ФСГ, имеющие большую эффективность и допускающие более редкое дозирование, могут быть получены при использовании ФСГ, имеющего число Z, по меньшей мере, составляющее 200 или около 200, предпочтительно составляющее по меньшей мере или приблизительно составляющее 210, 220, 230, 240, 250, 260, 270, 280 и 290, предпочтительность которого повышается с увеличением числа Z (число Z имеет значение в интервале указанных величин и входит, разумеется, в область настоящего изобретения). Для индукции фолликулогенеза традиционные препараты ФСГ, в основном, вводят каждый день в дозировке примерно 75-600 МЕ/день. У большинства пациентов та же кумулятивная доза традиционного препарата ФСГ может вводиться каждые 2 дня с достижением клинического результата, аналогичного тому, который наблюдается при ежедневных инъекциях (15). Выражение более редкое дозирование означает применение препаратов ФСГ,которые могут вводиться менее часто, чем каждые 2 дня, с достижением при этом того же клинического результата с точки зрения общего объема фолликулов, что и при применении традиционных препаратов,вводимых каждый день или каждые 2 дня.-4 007030 Термины кислотный и основный широко используются для обозначения препаратов ФСГ,имеющих разные степени сиалилирования. Поскольку сиаловая кислота имеет кислую природу, более высокосиалилированные молекулы имеют более низкие значения pI. С использованием изоэлектрофокусирования, хроматофокусирования или других методов разделения, таких как ионообменная хроматография, FPLC и HPLC (16), смесь изоформ может быть разделена на фракции, которые могут быть определены как кислотные или основные предпочтительно на основании их числа Z. Термин сиаловая кислота относится к любому представителю семейства карбоксилированныхcахаров, содержащему девять атомов углерода. Наиболее известным представителем семейства сиаловой кислоты является N-ацетилнейраминовая кислота (2-кето-5-ацетамидо-3,5-дидезокси-D-глицеро-D-галактононулопираноз-1-ониевая кислота, часто означаемая как Neu5Ac, NeuAC или NANA). Второй представитель семейства представляет собой N-гликолилнейраминовую кислоту (Neu5Gc или NeuGc), в которойN-ацетильная группа в NeuAc гидроксилирована. Третий представитель семейства сиаловой кислоты является 2-кето-3-дезоксинонулозоновой кислотой (KDN) (17). В указанную группу включаются также 9-замещенные сиаловые кислоты, такие как 9-O-С 1-С 6-ацил-Nеu5 Ас, подобные 9-O-лактил-Nеи 5 Ас или 9-O-ацетил-Nеu5 Ас, 9-дезокси-9-фтор-Neu5Ac и 9-азидо-9-дезокси-Nеu5 Ас. Обзор семейства сиаловых кислот приведен, например, в публикации Varki; Glycobiology 2 1992; 25-40; Sialic Acids: Chemistry,Metabolism and Function, R. Schauer, Ed. (Springer-Verlag, New York (1992. Углеводные (альтернативно гликановые) фрагменты присоединяются к пептидному скелету через один сахар либо через О- или N-гликозидную связь. Как только углеводный фрагмент становится задействованным, может происходить разветвление, результатом которого может стать появление одной,двух, трех или четырех (иногда больше) концевых сахарных остатков, или антенн. Такие углеводные фрагменты обозначаются как моно, ди-, три- или тетраразветвленные. Показатель антенности (Антенный индекс, АИ) указывает на степень разветвления углеводных остатков, указывая также на величину размера 3-D углеводных фрагментов. Для определения указанного показателя гликопротеин химически обрабатывают для высвобождения всех углеводных остатков, например, при нагревании с гидразином, или же углеводы могут быть расщеплены энзиматически, например, эндогликозидазой (N-гликаназой) (18). Выделяют углеводную смесь. При необходимости углеводную смесь подвергают реакции с меткой, такой как радиоактивная метка, хромофорная метка (например, УФ-активная), флуорофорная метка, иммунореактивная метка и т.п. Меченую углеводную смесь затем подвергают десиалилированию с использованием фермента сиалидазы с получением меченой нейтральной углеводной смеси (альтернативно стадии мечения и десиалилировния могут быть проведены в обратном порядке). Меченую нейтральную углеводную смесь затем разделяют на компоненты с использованием хроматографического способа, который позволяет дифференцировать разные виды (моно-, ди-, три- и тетраразветвленные). Хроматография(с нормальной или обращенной фазой) может быть проведена с использованием, по существу, одного метода, включающего, например, тонкослойную хроматографию, или хроматографию в толстом слое,или высокоэффективную жидкостную хроматографию HPLC. Альтернативно выделенные нейтральные углеводные смеси могут быть подвергнуты реакции со средством, обеспечивающим летучесть компонентов, и такие смеси могут быть подвергнуты газовой хроматографии (ГХ). Визуализация может быть проведена методом, соответствующим использованной метке и использованному методу хроматографирования. Так, например, если в качестве метки был использован флуорофор, для обнаружения может быть использован флуориметр; если в качестве метки был использован хромофор, для обнаружения может быть использован УФ-спектрофотометр. Если метка не использовалась для измерения пиков и времени удерживания, может быть использован масс-спектрофотометр. Соответствие полученных пиков моно-, ди-, три- и тетраразветвленным видам может быть проведено с использованием масс-спектрофотометрии или при сравнении с известными стандартами. Затем хроматограммы анализируют путем интеграции пиков, связанных с ди-, три- и тетраразветвленными видами углеводов. Процент каждого вида в общем количестве углеводов может быть затем использован для вычисления АИ по приведенному ниже уравнению АИ=2 Рди+3 Ртри+4 Ртетра,где АИ означает индекс антенности, а Рди, Ртри и Ртетра представляют собой процентное содержание от общего количества углеводов тех из них, которые являются ди-, три- и тетраразветвленными, соответственно. Могут присутствовать следовые количества других компонентов (например, моноантенных), но они не вносят существенного вклада в значение АИ. Высокий индекс антенности указывает на то, что углеводные фрагменты высокоразветвлены и имеют множество антенн. Рекомбинантный человеческий ФСГ имеет в типичном случае значение АИ примерно от 220 до 280 или в среднем примерно 255. Параметр числа Z означает параметр, определяющий то, насколько много антенн в углеводных фрагментах гликопротеина несут заряженные остатки, такие как сиаловая кислота. Для определения числа Z углеводные фрагменты высвобождают из пептида, как указано выше, и при необходимости метят. Затем смесь разделяют методом ионообменной хроматографии, которая позволяет разделить имеющиеся виды на основе их заряда. Визуализация элюированных пиков может быть проведена с помощью метки,как указывалось выше, или же могут быть использованы некоторые другие методы, такие как масс-5 007030 спектрометрия. Далее хроматограмму анализируют путем интеграции пиков, связанных с моно-, ди-,три- и тетразаряженными видами углеводов. Процент их содержания от общего количества углеводов может быть затем использован для вычисления числа Z из следующего уравнения:Z=P'моно+Р'ди+3 Р'три+4 Р'тетра,где Z означает число Z, a P'моно, Р'ди, Р'три и Р'тетра представляют собой процент моно-, ди-, три- и тетразаряженных соединений, соответственно, от общего количества углеводов. Высокое число Z означает, что большое число антенн несет заряженные остатки и что гликопротеин, в этой связи, также высоко заряжен, причем в случае остатков сиаловой кислоты он будет кислотным. Рекомбинантный человеческий ФСГ в типичном случае имеет значение числа Z в диапазоне примерно от 150 до 190 или в среднем примерно 184. Авторы изобретения неожиданно обнаружили, что изоформы ФСГ, которые имеют число Z выше чем примерно 200 или около 200, демонстрируют повышенную эффективность с точки зрения количества фолликулов при сравнении на основе ME с эквивалентной дозой изоформ ФСГ, имеющих число Z менее чем 200. Термин эквивалентная доза в контексте настоящего описания означает также количества разных изоформ ФСГ в традиционном тесте in vivo в определенных условиях, которые способны повышать массу яичников у крыс, при этом доза в ME будет одинаковой. Другими словами, эквивалентные по ME дозы различных изоформ, при определении их у крыс, будут иметь разную клиническую эффективность при введении человеку. Препараты ФСГ, характеризующиеся повышенными значениями числа Z, могут быть выделены различными способами. Так, например, партия рекомбинантного ФСГ может быть подвергнута изоэлектрическому фокусированию или хроматофокусированию, как описано, например, в указанных ниже работах (Mulders et al. (19), Zambrano et al. (20), and Timossi et al. (21. Могут быть выделены фракции,имеющие разные значения рI. Предпочтительные препараты ФСГ согласно изобретению имеют среднее значение рI менее чем примерно 3,4, более предпочтительно - менее чем примерно 3,3 и особенно предпочтительно - менее чем примерно 3,2, при этом степень предпочтительности повышается по мере снижения среднего значения pI. Параметр числа Z отражает средний уровень сиалилирования популяции видов ФСГ. Возможно,что препарат ФСГ, имеющий высокое число Z, может, тем не менее, содержать значительную часть основных (менее сиалилированных) видов. Такие основные виды могут действовать как антагонисты рецептора ФСГ, и поэтому они нежелательны. Распределение имеющихся видов может быть определено путем изоэлектрофокусирования или хроматофокусирования. Определение числа Z в результате проведения соответствующего анализа может дать представление о распределении видов. Предпочтительно,чтобы препарат имел менее или примерно 4% нейтральных углеводных видов (то есть гликановых фрагментов, не несущих заряда) и менее или примерно 16% моносиалилированных видов, и более предпочтительно, чтобы препарат имел менее или примерно 3, 2 или 1% нейтральных видов и менее или примерно 15, 12, 10, 8 или 5% моносиалилированных видов, при этом степень предпочтительности повышается со снижением процентного содержания. Область настоящего изобретения включает в себя препараты ФСГ, обладающие повышенной эффективностью с точки зрения фолликулогенеза, связанной с повышенной степенью сиалилирования в одном или более дополнительных сайтов гликозилирования белка. Такие сайты могут быть введены путем замещения остатков в белковом скелете ФСГ сериновым, треониновым, лизиновым или аспарагиновым остатками, с использованием, например, мутагенеза. Вариант способа, который может использоваться для получения таких мутантных форм ФСГ, приведен в примере 7. Для случая гликозилированияin vivo введенный сайт должен быть таким, чтобы создавать сайт N-гликозилирования в последовательности N-X'-S/T/C-X", где X' означает любой аминокислотный остаток, за исключением пролина, X" означает любой аминокислотный остаток, который может быть идентичным X', но может и отличаться от него, и который предпочтительно не является пролином, N означает аспарагин и S/T/C означает остаток, который может быть серином, треонином или цистеином, предпочтительно серином или треонином,а наиболее предпочтительно треонином. Кислотные изоформы (рI3,4) таких молекул ФСГ входят в область настоящего изобретения. Такие модифицированные молекулы ФСГ, несущие дополнительные сайты гликозилирования, описаны, например, в публикации WO 01/58493 (Maxygen). Особенно предпочтительными являются следующие мутации: в -субъединице: E4N, A70N, L73N, V78N, G100N, Y103N, F19N/I21T, L37N/Y39T, D41N/A43T,E55N/A43T, E59N/V61T и R97N/L99T; в -субъединице: E9N, F17T, F17N, R67N, V68T, E56N, H83N и F33N/R35T; где А означает аланин, D означает аспарагиновую кислоту, Е означает глутаминовую кислоту, F означает фенилаланин, G означает глицин, Н означает гистидин, I означает изолейцин, L означает лейцин, N означает аспарагин, R означает аргинин, Т означает треонин, V означает валин, Y означает тирозин, а выражение E4N означает замещение глутаминового остатка (Е) в положении 4 аспарагиновым остатком(N). В нумерации последовательности аминокислотная последовательность человеческого альфа-ФСГ пронумерована по зрелой последовательности, показанной на фиг. 5, или SEQ ID No. 1. Аминокислотная-6 007030 последовательность человеческого бета-ФСГ пронумерована по зрелой последовательности, показанной на фиг. 6, или SEQ ID No. 2. Область настоящего изобретения также охватывает препараты ФСГ, обладающие повышенной эффективностью по фолликулогенезу, связанной с повышенным уровнем сиалилирования в одном или более дополнительных сайтов гликозилирования, присутствующих на присоединенном пептиде. Под присоединенным пептидом понимается любой пептид, который включает в себя сайт гликозилирования и который может быть присоединен к амино- и/или карбоксильному концу - и/или -субъединицы ФСГ,при этом не оказывая неблагоприятного эффекта на активность ФСГ полученной молекулы ФСГ. Так,например, -субъединица в чХГ заметно крупнее, чем в других гонадотропинах, в связи с наличием примерно 34 дополнительных аминокислотных остатков на С-конце, определяемом в настоящем описании как концевой карбоксильный участок. В имеющейся в моче молекуле чХГ концевой карбоксильный участок содержит четыре муциноподобных O-связанных олигосахарида. Указанный концевой карбоксильный участок может быть лигирован с -субъединицей ФСГ, предпочтительно на карбоксильном конце субъединицы ФСГ, с образованием молекулы, обладающей активностью ФСГ и имеющей четыре дополнительных сайта гликозилирования. Кислотные изоформы (рI4,4) таких молекул ФСГ также охватываются областью настоящего изобретения. Такие молекулы описаны в документе WO 93/06844 (Вашингтонский Университет) и Boime et al. (22). Другие молекулы ФСГ, содержащие модифицированные сайты гликозилирования, описаны в WO 90/09800 (Вашингтонский Университет). Для целей настоящего описания препараты ФСГ, содержащие дополнительные сайты гликозилирования, обозначаются как ФСГgly+. Когда вводятся дополнительные сайты гликозилирования, параметры числа Z уже не могут использоваться для сравнения с нормальными препаратами ФСГ (то есть с теми,которые содержат четыре сайта гликозилирования), так как указанный параметр нормализован (представляет собой сумму процентов). Когда препарат ФСГgly+ анализируют на наличие гликановых видов,параметр числа Z+ может быть вычислен способом, аналогичным определению числа Z. Препараты ФСГgly+ согласно изобретению имеют значения числа Z+ более или примерно 200, предпочтительно более или примерно 210, 220, 230, 240, 250, 260, 270, при этом степень предпочтительности повышается с повышением значения числа Z+. Препараты ФСГgly+ согласно изобретению обладают существенно сниженными профилями рI, чем нормальный ФСГ. Особенно предпочтительными с точки зрения повышенной эффективности являются такие препараты ФСГgly+, которые имеют среднее значение рI, менее или примерно равное 4,4, более предпочтительными являются такие препараты, которые имеют среднее значение рI, менее или примерно равное 4,2, 4,0, 3,8, 3,6, 3,4, 3,3 или 3,2, при этом степень предпочтительности повышается по мере снижения среднего значения pI. Во всех вариантах осуществления настоящего изобретения предпочтителен рекомбинантный ФСГ. Для лечения больных людей предпочтителен человеческий рекомбинантный ФСГ. Препараты согласно изобретению могут быть выделены из традиционного рекомбинантного ФСГ, или они могут быть выделены из препаратов ФСГgly+. Настоящее изобретение относится также к разработке метода обогащения содержанием сиаловой кислоты с использованием способа, который изобретатели назвали сиалиловым бустингом. Рекомбинантный ФСГ (предпочтительно), или препараты рекомбинантного ФСГgly+ (также предпочтительны),или ФСГ из мочи могут быть подвергнуты сиалиловому бустингу путем обработки ферментом, таким как гликозилтрансфераза, в частности сиалилтрансферазой, в присутствии донора сиаловой кислоты,например СМР-сиаловой кислоты, как описано в WO 98/31826 (Cytel Corporation). Примеры рекомбинантных сиалилтрансфераз, а также способов получения рекомбинантных сиалилтрансфераз описаны,например, в патенте США 5541083 (Университет Калифорнии, Амген). Были описаны по меньшей мере 15 различных сиалилтрансфераз из млекопитающих, и в 13 из них было проведено клонирование кДНК. Указанные кДНК могут использоваться для получения рекомбинантным способом сиалилтрансфераз, которые также могут использоваться в способах согласно изобретению. Используемая сиалилтрансфераза должна обладать способностью переносить сиаловую кислоту на последовательности Gal1, 4GlcNAc, которые представляют наиболее часто встречающиеся предпоследние фрагменты, включающие концевую сиаловую кислоту на сиалилированных гликопротеинах. Примером сиалилтрансферазы, которая может использоваться, является ST3Gal III, которая обозначается также как (2,3)-сиалилтрансфераза (ЕС 2.4.99.6). Указанный фермент катализирует перенос сиаловой кислоты на остаток Gal в Gal1,3-гликозилNAc или Gal1,4-гликозилNАс гликозиду (23). Сиаловая кислота связывается с галактозильным (Gal) остатком с образованием -мостика между двумя сахаридами. Сахаридный мостик располагается между 2-м положением NeuAc и 3-м положением Gal. Указанный фермент может быть выделен из печени крысы (24), известны последовательности человеческой кДНК (25) и геномной ДНК (26), облегчающие получение фермента путем рекомбинантной экспрессии. В предпочтительном варианте осуществления изобретения в методах сиалилирования используются ST3GAl IIIST6GalNac II, более предпочтительно ST3Gal III, ST6Gal I, ST3Gal IV, ST6Gal II или ST3Gal V и еще более предпочтительно ST3Gal III из крысы. Количество сиалилтрансферазы составляет предпочтительно примерно от 50 мЕ на мг ФСГ или менее,предпочтительно примерно 5-25 мЕ на мг ФСГ. В предпочтительных условиях концентрация сиалилтрансферазы будет составлять примерно 10-50 мЕ/мл и концентрация ФСГ будет составлять примерно 2 мг/мл. Можно также получать ФСГ, обогащенный кислотными изоформами, путем трансфекции клетки,рекомбинантной или иной, которая экспрессирует ФСГ, геном, кодирующим сиалилтрансферазу, так чтобы указанный ген мог экспрессироваться в клетке. Ген может включать в себя геномные кодирующие последовательности (то есть содержать интроны) или он может включать в себя кодирующие последовательности кДНК. Альтернативно, если геном клетки содержит эндогенные последовательности, кодирующие сиалилтрансферазу, в геном клетки может быть вставлена конструкция, вызывающая экспрессию ФСГ. Экспрессия сиалилтрансферазы может быть повышена путем вставки в клетку активных в ней ненативных регуляторных последовательностей, связанных функционально с эндогенными последовательностями, кодирующими сиалилтрансферазу. Можно также вставить амплифицированный ген в функциональной связи с последовательностями, кодирующими сиалилтрансферазу, с тем, чтобы вызвать амплификацию геномных последовательностей, кодирующих сиалилтрансферазу. Указанные манипуляции могут быть проведены с использованием гомологичной рекомбинации, например, как описано в документе ЕР 0505500 (Applied Research ARS Holding N.V.). Степень сиалилирования препарата ФСГ может быть также повышена путем отбора для экспрессии рекомбинантного ФСГ такой клетки, в которой, по имеющимся данным, будет легче провести сиалилирование. Такие клетки включают в себя избранные клетки гипофиза и клетки яичника китайского хомячка, которые экспрессируют высокие уровни сиалилтрансфераз. Полученный из такой клетки препарат ФСГ может далее быть подвергнут фракционированию указанными выше способами с тем, чтобы выделить изоформы, имеющие высокую степень сиалилирования. Степень сиалилирования препарата ФСГ может быть также повышена путем культивирования клетки, которая экспрессирует ФСГ, предпочтительно рекомбинантный ФСГ, в условиях, благоприятствующих высокому уровню сиалилирования. Сиалилирование может быть улучшено за счет введения в культуральные среды добавок с ингибиторами нейраминидазы и/или непосредственных внутриклеточных предшественников синтеза сиаловой кислоты, таких как ацетилманнозамин. Полученный в таких условиях культивирования препарат ФСГ может быть далее подвергнут фракционированию указанными выше способами с тем, чтобы выделить изоформу, обладающую высоким уровнем сиалилирования. В случае использования сиалилового бустинга желательно, чтобы перед ферментативным сиалилированием препарат ФСГ имел высокий уровень АИ с тем, чтобы обеспечить большее количество антенн,доступных для присоединения остатков сиаловой кислоты. Предпочтительно ФСГ должен иметь значение АИ более чем примерно 220, более предпочтительно он должен иметь значение АИ более чем примерно 240, и еще более предпочтительно он должен иметь значение АИ более чем 270. ФСГ, имеющий еще более высокие значения АИ, может быть выделен, например, методом афинной хроматографии на конканавалин-А-сефарозе (Соn-А-сефарозе) при проведении элюции градиентом метилглюкозы или методом препаративной HPLC. Метод сиалилирующего бустинга согласно изобретению может быть с успехом применен к препаратам ФСГ, которые были модифицированы для введения одного или более дополнительных сайтов гликозилирования (препараты ФСГglu+). Такие препараты ФСГglu+ могут быть также разделены на фракции,имеющие высокий индекс АИ до сиалилового бустинга. Настоящее изобретение включает препараты ФСГ, полученные путем экспрессии ФСГ в клетках,которые не способны к сиалилированию, с последующим проведением сиалилового бустинга такого ФСГ. Так, например, в документе WO 99/13081 (Akzo Nobel N.V.) описана экспрессия ФСГ дикого типа и мутеинов в одноклеточном эукариоте Dictyostelium, в частности мутеинов, имеющих дополнительные сайты гликозилирования. Dictyostelium не способен осуществлять сиалилирование гликана. Настоящее изобретение включает в себя препараты ФСГ, полученные при проведении сиалилового бустинга ФСГ дикого типа или мутеинов, экспрессируемых в Dictyostelium. После проведения сиалилового бустинга препараты ФСГ, имеющие желаемую степень сиалилирования, могут бытьвыделены с использованием ионообменной хроматографии, изоэлектрофокусирования, хроматофокусирования или хроматографии на конканавалине-А (Con-A). ФСГ согласно изобретению имеет значение числа Z, составляющее по меньшей мере примерно 200,более предпочтительно - по меньшей мере примерно 210, особенно предпочтительно - по меньшей мере примерно 220 и еще более предпочтительно - по меньшей мере примерно 230, 240, 250, 260 или 270, при этом степень предпочтительности повышается с увеличением числа Z. Полностью сиалилированный ФСГ имеет значение числа Z, составляющее примерно от 230 до 280, в зависимости от индекса антенности. Очень предпочтительные препараты ФСГ согласно изобретению имеют значение числа Z, составляющее примерно от 230 до примерно 280. Препараты ФСГ согласно изобретению получают в виде форм, характеризующихся числом Z, составляющим по меньшей мере примерно 200, или предпочтительными числами Z, указанными выше.-8 007030 ФСГ согласно изобретению может быть выделен из смеси изоформ с использованием множества способов, известных специалистам в данной области. Так, например, для выделения изоформ на основе значений их рI могут быть использованы изоэлектрофокусирование, хроматофокусирование или ионообменная хроматография. Различные фракции могут быть подвергнуты анализу на содержание сиаловой кислоты, и для использования могут быть выбраны желаемые фракции. Вариант подходящих условий для проведения ионообменной хроматографии дан в примерах. Такие способы разделения могут использоваться для выделения ФСГ согласно изобретению из обычно получаемого ФСГ крысы (кФСГ) или ФСГ из мочи (мФСГ) или могут использоваться для выделения желаемых изоформ из ФСГ, обработанного сиалилтрансферазой, или с помощью других методик рекомбинантной технологии, указанных выше. В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей ФСГ согласно изобретению (то есть имеющий значение числа Z, по меньшей мере, равное примерно 200,предпочтительные значения для минимального числа Z были указаны выше). Такие фармацевтические композиции могут использоваться для стимуляции фолликулогенеза, например, в сочетании с индукцией овуляции или методиками искусственного оплодотворения. Поскольку ФСГ согласно изобретению особенно эффективен для достижения индукции и созревания множественных фолликулов, он особенно приемлем для применения в рамках методов искусственного оплодотворения, когда желательно получать множественные ооциты. Альтернативно, при тщательном подборе дозы, ФСГ согласно изобретению может использоваться для индукции монофолликулогенеза для индукции овуляции или олигофолликулогенеза (вплоть примерно до 3 фолликулов) при проведении внутриматочного оплодотворения, например при оплодотворенииin vivo. Монофолликулогенез может быть также достигнут при использовании сниженной дозы ФСГ или при снижении частоты его дозировании в сравнении с традиционными препаратами ФСГ. Например, при индукции овуляции препарат ФСГ согласно изобретению может вводиться каждые 3 дня в дозе 225-400 ME или в меньших дозах, в зависимости от реакции пациента. Реакция пациента может быть отслежена с помощью метода сонографии. ФСГ согласно изобретению может быть в типичном случае изготовлен в виде фармацевтической композиции, которая может дополнительно содержать разбавитель или наполнитель. Любой специалист со средним уровнем знаний в данной области знает множество таких разбавителей или наполнителей,пригодных для изготовления фармацевтической композиции. ФСГ согласно изобретению обычно изготавливают с получением стандартной дозированной формы, имеющей вид твердого препарата, готового к растворению, с образованием стерильного инъецируемого раствора для внутримышечного или подкожного использования. Твердое вещество обычно получают путем лиофилизации. Типичные эксципиенты и носители включают в себя сахарозу, лактозу, хлорид натрия, забуферивающие средства типа одноосновного фосфата натрия и двухосновного фосфата натрия. Раствор может быть получен при разбавлении водой для инъекций непосредственно перед использованием. ФСГ согласно изобретению может также быть изготовлен в виде раствора для инъекций, который включает в себя любой из указанных выше и других известных специалистам в данной области наполнителей и буферов. ФСГ согласно изобретению может использоваться в курсе контролируемой гиперстимуляции яичников (КГЯ). Стандартные режимы (27) КГЯ включают в себя фазу понижающей регуляции, на которой уровень эндогенного лютеинизирующего гормона (ЛГ) снижается при введении агониста гонадотропинрилизинг-гормона с проведением впоследствии стимулирующей фазы, на которой индуцируют развитие фолликулов (фолликулогенез) посредством ежедневного введения фолликулостимулирующего гормона(ФСГ) обычно в дозе примерно 75-600 МЕ/день, предпочтительно в дозе примерно 150-225 МЕ/день. Альтернативно стимуляцию начинают с применения ФСГ после спонтанной или индуцированной менструации, с последующим введением антагониста гонадотропин-рилизинг-гормона (в типичном случае начинают примерно с шестого дня фазы стимуляции). Когда имеется по меньшей мере три фолликула размером 16 мм (один из них 18 мм), вводят единичный болюс чХГ (5-10000 ME) для имитации естественного выброса ЛГ и индукции овуляции. Инъекцию чХГ проводят в типичном случае в любой из дней с 10-го по 14-й, но он может вводиться и позже, в зависимости от того, какие из указанных выше параметров реализуются. Восстановление ооцитов ограничено периодом 36-38 ч после инъекции чХГ. ФСГ согласно изобретению может также использоваться для индукции овуляции и в методах искусственного оплодотворения. Так, например, стимуляцию ФСГ препаратом согласно изобретению начинают после спонтанной или индуцированной менструации при ежедневном введении дозы 75-150 ME. Когда от 1 до 3 фолликулов достигают в диаметре по меньшей мере 16 мм, вводят единичный болюс чХГ для индукции овуляции. Оплодотворение проводят in vivo в процессе обычного полового акта или путем внутриматочного оплодотворения. В связи с тем, что ФСГ согласно изобретению обладает повышенной эффективностью в сравнении с известными препаратами ФСГ, в методиках, таких как были указано выше, могут использоваться сниженные по ME дозы ФСГ и/или указанные методики могут быть модифицированы путем сокращения периода стимуляции под действием ФСГ, с достижением тех же или даже лучших результатов с точки зре-9 007030 ния числа и жизнеспособности фолликулов. Так, например, под действием препарата ФСГ согласно изобретению может быть достигнут адекватный фолликулогенез при использовании примерно 50-150 ME ФСГ,предпочтительно примерно 50-100 ME, более предпочтительно примерно 50-75 ME ФСГ. Дозировку ФСГ вводят обычно ежедневно или каждые полдня. Длительность введения доз может составлять менее 14 дней, предпочтительно менее примерно 12 дней и более предпочтительно менее чем 11 или 10 дней. В случае индукции овуляции препараты ФСГ согласно изобретению могут вводиться в дозах 25-150 МЕ/день, предпочтительно от 50 до 125 МЕ/день. Для лечения мужского бесплодия препарат ФСГ согласно изобретению может вводиться 3 раза в дозе от 150 до 300 МЕ/неделю до достижения уровня сперматогенеза, адекватного для оплодотворения,либо в процессе обычного полового акта, либо с использованием методик искусственного оплодотворения. Авторы настоящего изобретения далее обнаружили, что в связи с повышенной эффективностью препараты ФСГ со значением числа Z, составляющим по меньшей мере 200, могут вводиться реже, чем препараты ФСГ, имеющие значение числа Z менее чем 200. (В контексте настоящего описания термины ФСГ+200, ФСГ+210, ФСГ+220 и т.д. будут использоваться для обозначения препаратов ФСГ, имеющих числаZ в диапазоне примерно 200-210, 211-220, 221-230 и т.д.) Это означает, что пациенты, которым обычно требуется введение, например, ежедневно по 150 ME традиционного ФСГ для достижения адекватного фолликулогенеза, могут иметь тот же результат при введении 225 ME ФСГ+200 каждые 3 дня или 300 ME ФСГ+200 каждые 4 дня. В связи с повышенной эффективностью ФСГ+200 в сравнении с традиционными препаратами ФСГ, указанные выше дозировки могут быть снижены для пациентов, имеющих хорошую реакцию. В случае препаратов ФСГ согласно изобретению, имеющих числа Z не менее чем примерно 230, возможно проводить инъекции только каждые 5, 6 или 7 дней, в зависимости от реакции пациента. Реакция может быть оценена методом сонографии и/или при измерении уровня эстрадиола в сыворотке крови. Другие приемлемые методики включают в себя следующие: 100 ME ФСГ+210 каждые 2 дня; 200 ME ФСГ+210 каждые 3 дня; 275 или 300 ME ФСГ+210 каждые 4 дня; 80-100 ME ФСГ+220 каждые 2 дня; 180-200 ME ФСГ+220 каждые 3 дня; 260-300 ME ФСГ+220 каждые 4 дня; 75-100 ME ФСГ+230 каждые 2 дня; 170-200 ME ФСГ+230 каждые 3 дня; 250-300 ME ФСГ+230 каждые 4 дня; 275-400 ME ФСГ+250 каждые 5 дней; 375-450 ME ФСГ+250 каждые 6 дней; 450-525 ME ФСГ+250 каждые 7 дней. Термин повышенная эффективность, используемый в настоящем описании в контексте эффекта фолликулогенеза, включает в себя любое измеряемое улучшение или повышение числа и/или жизнеспособности фолликулов индивидуума при сравнении, например, с числом и/или жизнеспособностью фолликулов, по результатам традиционного теста на повышение веса яичников у крыс, у одного или более пациентов, которым вводится эквивалентная доза (ME/ME) препарата ФСГ, имеющего число Z менее чем 200. Предпочтительно улучшение или повышение должно быть статистически значимым с вероятностью 0,05. Методы определения статистической значимости результатов хорошо известны и описаны в литературе, и может использоваться любой соответствующий метод. Изобретение ниже иллюстрируется неограничивающими примерами. Примеры Пример 1. Определение числа Z. Картирование гликана позволяет определить число Z гликопротеина. Гликановые фрагменты высвобождают из рекомбинантного человеческого ФСГ обработкой гидразином при 100 С в течение 5 ч с использованием полностью автоматизированной системы Oxford GlycoSciences GlycoPrep 1000 или эквивалентного оборудования. Разные виды гликанов отделяют от непрореагировавшего гидразина и гидразидов аминокислот с использованием колонки, содержащей покрытые оболочкой стеклянные шарики. Виды гликанов элюируют ацетатом натрия. Проводят ацетилирование гликановых видов уксусным ангидридом. Удаляют избыток реагентов с использованием колонки для ионообменной хроматографии в смешанном слое. Все непроцессированные виды гликанов собирают разбавленным раствором ацетатного буфера. Виды гликанов собирают на фильтре 0,5 м (Oxford GlycoSciences) и лиофилизируют. Высушенные гликаны метят в реакции с восстановителем, содержащим флуорофор (например, 2-аминобензамид или 2-АВ), в кислых условиях в течение 120 мин при 65 С. Меченые гликаны разных видов отделяют от избытка реагентов с использованием гидрофильной абсорбирующей мембраны, которая удерживает на себе гликаны. Гликаны восстанавливают в воде и хранят в замороженном состоянии до проведения хроматографического разделения. Меченые гликаны разных видов разделяют путем анионообменной хроматографии. Хроматографирование проводят согласно следующей процедуре. Колонка представляет собой колонку GlycoSep С размером 4,6 х 100 мм, заполненную полимером,покрытым дивинилбензольной смолой (5 м). Мобильная фаза имеет скорость 0,4 мл/мин. Мобильная фаза А: ацетонитрил (хроматографическая чистота). Мобильная фаза В: 500 мМ ацетат аммония, рН 4,5. Мобильная фаза С: сверхчистая вода.- 10007030 Выявление проводят на флуориметре, установленном на длину волны возбуждения возбуждения: 330 нм и длину волны эмиссии эмиссии: 420 нм. Элюцию проводят в следующих условиях элюирования. Начальные условия: 20% фазы А, 80% фазы С. Линейный градиент фазы В (0,25% в минуту) с 5-й по 21-ю минуты, 20% фазы А постоянно. Линейный градиент фазы В (0,525% в минуту) с 21-й по 61-ю минуты, 20% фазы А постоянно. Колонку выдерживают в температурных условиях 302 С. Гликановые виды элюируют в соответствии с величиной заряда, присущего нейтральным, моно-,ди-, три- и тетрасиалилированным видам. Типичная хроматограмма показана на фиг. 1. В полученной хроматограмме пики группируют в зависимости от диапазона времени удерживания,который соответствует степени сиалилирования, как показано в табл. 1. Таблица 1 Время удерживания и величина заряда гликанов, высвобождаемых из ФСГ крысы Результаты, полученные для каждой гликановой группы, выражали в виде процента от общей площади разных гликановых групп (нейтральных, моно-, ди-, три- и тетра-), а значение числа Z вычисляли из соотношений разных видов (Ргликан)Z=P'моно+2 Р'ди+3 Р'три+4 Р'тетра. Пример 2. Определение антенного индекса (АИ). Гликаны высвобождают из пептидного скелета путем гидразинолизиса и затем метят флуоресцентной меткой с использованием 2-аминобензамида (2-АБ), как было описано подробно в примере 1. Гликаны, меченные 2-АБ, подвергают энзиматическому десиалилированию с помощью сиалидазы(Vibrio cholerae) в 250 мМ ацетате аммония, рН 5,5, содержащем 20 мМ хлорида кальция, в течение 18 ч при 37 С. Используют примерно 0,05 Ед сиалидазы при наличии гликанов в количестве от 100 мкг ФСГ грызунов (грФСГ). Десиалилированные гликаны высушивают в вакууме и хранят при температуре -20 С до разделения методом препаративной HPLC с обращенной фазой в следующих условиях. Колонка представляет собой колонку GlycoSep R. Мобильная фаза имеет скорость течения 0,7 мл/мин. Элюент А: 50 мМ ацетат аммония, рН 6,0. Элюент В: 50 мМ ацетат аммония, рН 6,0, содержащий 8% ацетонитрила. Выявление проводят на флуориметре, установленном на длину волны возбуждения возбуждения: 330 нм и длину волны эмиссии эмиссии: 420 нм. Температура колонки составляет 30 С. Перед нанесением на колонку высушенные образцы восстанавливают элюентом А (200 мкл) в расчете на 50 мкл указанного раствора для нанесения. Используют следующие градиенты:t=76 (мин) - 55% А; 45% В Пики распределяют по ди-, три- и тетраантенным видам с использованием анализа методом масс-спектрометрии с электрораспылением (ESMS) и лазерной на основе матрицы времяпролетной ионизационной десорбционной масс-спектрометрии (Matrix Assisted Laser Desorption Ionization Time-of-Light (MALDI-TOF MS. Полученные результаты выражают в виде относительного процента Р диантенных, триантенных и тетраантенных структуру принимая сумму всех гликанов за 100%. Затем вычисляют индекс АИ с использованием приведенного ниже уравнения АИ=2 Рди+3 Ртри+4 Ртетра,где АИ означает антенный индекс, а Рди, Ртри и Ртетра означают процент от общего числа углеводов, представляя собой ди-, три- и тетраразветвленные структуры, соответственно.- 11007030 Пример 3. Разделение ФСГ на фракции в зависимости от степени сиалилирования. Рекомбинантный ФСГ разделяют на кислотную и основную фракции с использованием анионообменной хроматографии на ДЭАЭ-сефарозе FF. Используют колонку диаметром 1,6 х 20 см (ХК Pharmacia или эквивалентное устройство) для очистки в лабораторных условиях (примерно на 60 мг общего белка) и колонку диаметром 3,4 х 40 см(Vantadge Amicon или эквивалентное устройство) для крупномасштабных операций по очистке, заполненные смолой на основе ДЭАЭ-сефарозы FF. Мобильная фаза имеет скорость течения 150-250 см/ч. Уравновешивающий буфер 1: 2 М Трис-HCl, рН 7,00,1. Уравновешивающий буфер 2: 25 мМ Трис-HCl, рН 7,00,1, проводимость 2,151,5 мС/см. Элюирующий буфер 1: 25 мМ Трис, рН 7,00,1, 35 мМ NaCl, проводимость 5,80,4 мС/см (данный буфер элюирует более щелочные изоформы). Элюирующий буфер 2: 25 мМ Трис рН 7,00,1, 150 мМ NaCl, проводимость 18,30,5 мС/см (данный буфер элюирует более кислые изоформы). Регенерирующий раствор: 0,5 М NaOH, 1M NaCl. Раствор для хранения: 10 мМ NAOH. Указанную колонку поддерживают в условиях температур 233 С или 53 С. ФСГ готовят для нанесения на колонку следующим образом. Замороженную массу грФСГ (из грызунов) подвергают оттаиванию при температуре 53 С. После полного оттаивания раствор (3-4 мг грФСГ, по данным измерения оптической плотности при 276,4 нм,на мл смолы) разбавляют 2 М Трис-HCl, рН 7,00,1 в следующей пропорции: 1 часть буфера и 79 частей общей массы грФСГ. Конечная концентрация Трис-НСl составляет 25 мМ. Величину рН доводят до 7,00,1 с помощью 1M НСl. Колонку готовят, пропуская 3 объема слоя (ОС) 0,5 М NaOH с последующим пропусканием 6 ОС воды. Уравновешивание осуществляют путем пропускании 4-5 ОС уравновешивающего буфера 1 до достижения значения рН примерно 7. Промывку продолжают еще 7-8 ОС уравновешивающего буфера 2. Наносят на колонку образец грФСГ, подготовленный указанным выше способом. После завершения полного нанесения колонку промывают 3 ОС уравновешивающего буфера 1. Затем начинают элюцию элюирующим буфером 1, и собирают основную фракцию, как только начинает возрастать величина поглощения (276,4 нм), и продолжают до 201 объемов слоя. Далее элюент заменяют на элюирующий буфер 2, и приступают к сбору кислой фракции, как только начинает возрастать величина поглощения (276,4 нм), и продолжают до 31 объемов слоя. Фракции подвергают ультрафильтрации для концентрирования с использованием системы ультрафильтрации клеток типа 8400 (Amicon или эквивалентное устройство), снабженной мембраной YM3 для основной фракции и мембраной YM10 для кислой фракции. Все процедуры проводят при температуре 53 С. Пример 4. Сравнительные клинические исследования изоформ ФСГ. На волонтерах проводят сравнение эффективности двух экспериментальных партий грФСГ. Два препарата ФСГ получают при расщеплении грФСГ на две фракции, с использованием ионообменной хроматографии, как было описано выше, в примере 3. Партия А, рассматриваемая как кислая,имеет величину числа Z 220 (то есть это кислая фракция из примера 3), тогда как партия В, рассматриваемая как основная, имеет число Z 160 (то есть это основная фракция из примера 3). На основании данных традиционного анализа по оценке увеличения веса яичников у крыс заполняют ампулы продуктом из партии А и партии В так, чтобы каждая из них содержала примерно по 150 ME ФСГ. Характеристики обеих партий показаны в табл. 2. Следует отметить, что поскольку флаконы наполнялись на основании значений ME, фактическое количество ФСГ в ампулах с основным продуктом из партии В составило примерно 250% от указанного количества кислого продукта из партии А (примерно 24 мкг против примерно 9 мкг). Таблица 2 Характеристика партий ФСГ, использованных в клиническом исследовании- 12007030 Удельную биологическую активность вычисляют при делении активности в ME на вес белка. Группа пациентов включает 32 волонтера-женщины в период предменопаузы. У пациентов подавляют гипофизарную функцию посредством ежедневных инъекций декапептила (0,1 мг). Через 14 дней проводят сонографическое обследование, и, в отсутствие кист, начинают стимуляцию с использованием крысиного ФСГ (150 МЕ/день) из партии А или партии В. Оценивают рост фолликулов путем сонографии и ежедневной оценки сывороточных концентраций Е 2. В процессе стимуляции ФСГ фолликулы развиваются и растут в диаметре. Для каждого пациента подсчитывают количество фолликулов на 8-й и 10-й день стимуляции и отмечают количество фолликулов, попадающих в категорию размеров 0-10 мм, 11-15 мм и 16-25 мм. На фиг. 2 показано среднее число фолликулов на 8-й день для пациента, попадающего в соответствующую категорию в тех группах, где пациенты принимали кислую и основную изоформы. На фиг. 3 тот же самый график показан для 10-го дня. Результаты данного исследования показывают, что в то время, как в группе приема основного продукта размер фолликулов прогрессивно возрастает со временем, в группе приема кислого продукта возникает вторая совокупность фолликулов, несколько отстающая по времени от первой, которой свойственно значительное повышение уровня образования фолликулов, равное примерно двойному числу фолликулов у пациентов в группе приема основного продукта. Указанная вторая совокупность демонстрирует повышение роста, имеющее место с 8-го по 10-й день. Такой результат отмечается в группе пациентов, принимающих кислый продукт, на 10-й день, где в среднем 18 фолликулов имеют размер более чем 11 мм, тогда как в группе пациентов, принимающих основный ФСГ, на 10-й день среднее число фолликулов крупнее чем 11 мм составляет всего лишь 11. В среднем, общее число фолликулов на 10-й день в группе приема кислого продукта составляет 28,тогда как в группе приема основного продукта оно составляет 19. В среднем, общий объем фолликулов (ООФ) на пациента определяют методом сонографии. Величина ООФ в группе, получающей кислый ФСГ, на 30% выше, чем в группе, получающей основный ФСГ. Уровни ФСГ в сыворотке крови, по данным радиоиммуноанализа, выше у пациентов в группе приема основного продукта, как и ожидалось с учетом инъецированной массы белка, однако, различие составляет всего лишь примерно 30% (см. фиг. 4) в сравнении с различием при введении, достигающем 250%, что согласуется с более высокой метаболической активностью кислотных форм. Пример 5. Разделение ФСГ на фракции по величине антенного индекса (АИ). Препараты ФСГ, имеющие более высокий, чем в норме, показатель антенности, могут быть выделены с использованием HPLC или аффинной хроматографии с сефарозным производным конканавалина(Con-A). Пример 6. Сиалиловый бустинг с использованием сиалилтрансферазы. Рекомбинантный человеческий ФСГ (исходный материал; 10 мг) растворяют в буфере (0,1 МHEPES, рН 7,5) до концентрации 4,3 мг/мл. К указанному раствору добавляют рекомбинантную сиалилтрансферазу из крысы (ST3Gal III) до концентрации 100 МЕ/мл и цитидин-5'-монофосфат-N-ацетилнейраминовую кислоту (CMP-NeuAc) в качестве донора сиаловой кислоты до концентрации 20 мМ. Альтернативно, донор сиаловой кислоты может быть получен in situ с использованием 20 мМ NeuAc и 2 мМ ЦМФ в присутствии синтетазы ЦМФ-сиаловой кислоты. Реакционную смесь инкубируют при 37 С в течение 24 ч. Фракции, обогащенные сиаловой кислотой, выделяют с использованием методик, описанных в примере 3. Сиалиловый бустинг может быть также проведен с использованием исходного материала в виде ФСГ с повышенным индексом антенности, который получают по методике примера 5. Альтернативно, cиалиловый бустинг может быть проведен с использованием в качестве исходного материала ФСГ, который уже имеет повышенное число Z в сравнении с традиционным рекомбинантным ФСГ. Такой исходный материал может быть выделен с использованием методик, описанных в примере 3. Пример 7. Получение мутантов ФСГ. кДНК - и -субъединиц человеческого ФСГ подвергают субклонированию в векторе pDONR(Invitrogen). Для введения N-связанных сайтов гликозилирования в - и -субъединицы ФСГ используют набор для направленного мутагенеза (QuikChange). В системе QuikChange в качестве праймеров используются синтетические олигонуклеотиды, содержащие желаемую(ые) мутацию(и). Для введения Nсвязанных сайтов гликозилирования используют следующие пары олигонуклеотидов: СС TTG ТАТ АСА ТАС ССА ААС GCC АСС CAG TGT САС и GTG АСА CTG GGT GGC GTT TGG GTA TGT АТА СААGG для V78N, GC TGT GCT САС CAT AAC GAT TCC TTG ТАТ АСА ТАС С и GGT ATG ТАТ АСАAGG ААТ CGT TAT GGT GAG САС AGC для A70N, GAT CTG GTG TAT AAG ААС ССА ACT AGG ССС ААА АТС СА и TGG АТТ TTG GGC СТА GTT GGG ТТС ТТА ТАС АСС AGA TC для D41N/A43T,TGT ACT GTG CGA GGC CTG ААС ССС AGC ТАС TGC TCC и GGA GCA GTA GCT GGG GTT CAGGGA GAA GGT TGG GTT TTC CTG для F17T. ДНК-последовательности в мутантных кДНК подтверж- 13007030 дают с использованием набора для секвенирования ABI PRISM BigDye Terminator v3.0 Ready ReactionCycle Sequencing, после чего проводят анализ на анализаторе ABI PRISM 310 Genetic Analyzer. Вектор экспрессии в клетках млекопитающих pCl (Promega) превращают в направленный векторGATEWAY с использованием системы векторной конверсии (GATEWAY Vector Conversion System)(Invitrogen. - и -мутанты вместе с субъединицами дикого типа подвергают субклонированию в векторе экспрессии pCl с использованием системы для клонирования Gateway Cloning Technology (Invitrogen). Вектор экспрессии pCl содержит очень ранний энхансер/промотор человеческого цитомегаловируса, регулирующий экспрессию вставленного гена, интрон вверх по ходу транскрипции от гена для усиления экспрессии и поздний сигнал полиаденилирования вируса SV-40 вниз по ходу транскрипции от вставленного гена для терминации транскрипции. Альфа-мутанты E56N и F17T в pCl подвергают совместной трансфекции -субъединицей ФСГ дикого типа в pCl, тогда как -мутанты A70N, G100N, V78N иD41N/A43T в pCl подвергают совместной трансфекции -субъединицей дикого типа в pCl. В качестве контрольного действия подвергают совместной трансфекции -субъединицу дикого типа ФСГ в рСl и субъединицу в pCl. Плазмиды временно трансфицируют в клетки НЕК 293 (АТТС, CRL-10852) с использованием кальций-фосфатного метода (например, как описано в WO 96/07750). Альтернативно, плазмидуpCl, содержащую либо -субъединицу дикого типа, либо -мутант V78N, подвергают совместной трансфекции -субъединицей дикого типа в pCl. Плазмиды могут быть временно или стабильно трансфицированы в клетки СНО. Через 1 день после трансфекции среду заменяют на DMEM/F12 (Invitrogen, 11320033), содержащую 1 мкг/мл инсулина (Invitrogen, 18140-020), 6,8 нг/мл селенита натрия (Sigma, S5261) и 12,2 нг/мл цитрата железа (Sigma, F3388). Через 1 день после смены среды собирают кондиционированную среду и центрифугируют в течение 5 мин со скоростью примерно 800 хg при 4 С для удаления клеточных остатков. Супернатант отбирают и центрфугируют со скоростью 16000 хg на установке BiofugeFresco (Heraeus Instruments) в течение 5 мин, после чего среду осветляют фильтрованием через фильтр Акродиск (Acrodisc) с размером пор 0,45 мкм (Gelman Sciences, 4184). К осветленному клеточному экстракту добавляют 1 М Трис, рН 7,4 до конечной концентрации 50 мМ Трис и добавляют Твин 20 до его конечной концентрации 0,1%. Мутанты ФСГ выделяют из клеточного экстракта и очищают с помощью иммуноаффинной хроматографии на производном сефарозы с моноклональными антителами против ФСГ, иммобилизированной дивинилсульфоном (Immunoresin anti-FSH-McAb-DVS-Sepharose). Такие смолы могут быть получены с использованием методик, известных специалистам, и которые описаны, например, в WO 88/10270. Смолу уравновешивают уравновешивающим буфером, содержащим 0,1 М Трис-HCl, 0,3 М NaCl буфера при рН 7,5 и температуре 4 С. На колонку наносят ФСГ в количестве по ME (на основании данных радиоиммуноанализа), соответствующем 80-90% общей способности ФСГ связываться с материалом колонки. Не задержанные на колонке белки элюируют уравновешивающим буфером (как указано выше) до значения ОП 280 ниже чем 0,02. Абсорбированный мутантный ФСГ элюируют из иммуносмолы с использованием 1 М раствора аммиака при 4 С. Собирают элюаты, соответствующие примерно четырем объемам иммуносмолы, рН доводят до 9,0 путем добавления ледяной уксусной кислоты при 4 С, как можно быстрее после сбора фракции, и раствор подвергают ультрафильтрации на аппарате (Amicon) (мембраной, отсекающей массу от 10000 Да) и концентрируют до небольшого объема. Раствор концентрированного мутантного ФСГ затем подвергают ВЭЖХ с обращенной фазой на жидкостном хроматографе Waters Prep LC 500A, снабженном УФ-детектором и генератором для получения препаративного градиента. Перед нанесением на колонку рН раствора доводят до значения примерно 5,6. Раствор наносят на колонку C18 с обращенной фазой (Prepak 500 C18, картриджи Waters), которая была предварительно уравновешена 0,05 М аммоний-ацетатным буфером, рН 5,6 при комнатной температуре. Скорость течения составляет 100 мл/мин, и в ходе элюции отслеживают уровень поглощения элюата при 280 нм. Мутантный ФСГ элюируют градиентом изопропанола до 50% от мобильной фазы. Фракции проверяют с использованием аналитической газовой хроматографии и радиоиммуноанализа. Органический растворитель удаляют перегонкой в вакууме при температуре менее чем 40 С и затем раствор замораживают и лиофилизируют. Препараты мутантных ФСГ, экспрессированных в клетках СНО, подвергают ионообменной хроматографии, как описано в примере 3, с целью выделения фракций, имеющих числа Z+ выше чем 180, 190,200, 210, 220, 230, 240, 250 и более. Препараты мутантных ФСГ, эксперессированных в клетках СНО или НЕК 293, подвергают сиалиловому бустингу, как описано в примере 6. После сиалилового бустинга мутантный ФСГ подвергают ионообменной хроматографии по методике примера 3 с целью выделения фракции, имеющей числа Z+ выше чем 180, 190, 200, 210, 220, 230, 240, 250 и более.glycosyltransferases forms the basis for the increased size of asparagine-linked glycans at the surface of NIH 3T3 cells expressing the N-ras proto-oncogene; J. Biol. Chem. 266 1991; 21674. 24. Weinstein et al.; J. Biol. Chem. 257 1982; 13845. 25. Sasaki et al.; J. Biol. Chem. 268 1993; 22782-22787; KitagawaPaulson; J. Biol. Chem. 269 1994; 1394-1401. 26. Kitagawa et al.; J. Biol. Chem. 271 1996; 931-938. 27. For example, a conventional technique is described in EP 0 170 502 (Serono Laboratories, Inc.). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая рекомбинантный ФСГ, имеющий число Z, которое составляет по меньшей мере 200, предпочтительно по меньшей мере 220, более предпочтительно по меньшей мере 240 и наиболее предпочтительно по меньшей мере 260. 2. Фармацевтическая композиция по п.1, где рекомбинантный ФСГ имеет среднее значение рI менее 3,4, более предпочтительно менее 3,3 и наиболее предпочтительно менее 3,2. 3. Фармацевтическая композиция, содержащая рекомбинантный ФСГ, имеющий среднее значение рI менее 3,4, более предпочтительно менее 3,3 и наиболее предпочтительно менее 3,2. 4. Фармацевтическая композиция по любому из пп.1-3 для использования в медицине. 5. Фармацевтическая композиция по п.1 или 2, где рекомбинантный ФСГ имеет индекс антенности АИ примерно от 220 до 280.- 15007030 6. Фармацевтическая композиция по любому из пп.1-5, где рекомбинантный ФСГ экспрессируется в клетках яичника китайского хомячка (СНО). 7. Фармацевтическая композиция по любому из пп.1-6, пригодная для использования при фолликулогенезе. 8. Фармацевтическая композиция по любому из пп.1-6, пригодная для индукции контролируемой гиперстимуляции яичников. 9. Фармацевтическая композиция по любому из пп.1-6, пригодная для индукции овуляции или внутриматочного оплодотворения. 10. Фармацевтическая композиция по любому из пп.1-6, пригодная для использования при лечении мужского бесплодия. 11. Фармацевтическая композиция по любому из пп.1-10, где ФСГ имеет повышенную степень сиалилирования в одном или более дополнительных сайтах гликозилирования, присутствующих на пептиде,добавленном к белку ФСГ. 12. Фармацевтическая композиция по п.11, где добавленный пептид представляет собой карбоксиконцевую часть -субъединицы человеческого хорионического гонадотропина (чХГ). 13. Фармацевтическая композиция по любому из пп.1-12, где ФСГ содержит одну или более мутаций, которые вносят в белок ФСГ один или более дополнительных сайтов гликозилирования и повышают степень его сиалилирования. 14. Фармацевтическая композиция по п.13, где мутации выбраны из одной или более из A70N, V78N,G100N, D41N/A43T в -субъединице ФСГ и/или из одной или более из F17T, E56N, H83N в -субъединице ФСГ. 15. Способ получения препарата рекомбинантного ФСГ, имеющего число Z, которое составляет по меньшей мере 200, где указанный способ включает в себя стадию взаимодействия ФСГ с донором сиаловой кислоты в присутствии 2,3-сиалилтрансферазы. 16. Способ по п.15, где рекомбинантный ФСГ имеет число Z, которое, по меньшей мере, составляет 220, предпочтительно по меньшей мере 240, более предпочтительно по меньшей мере 260. 17. Способ по любому из пп.15 или 16, где донором сиаловой кислоты является ЦМФ-сиаловая кислота. 18. Способ по любому из пп.15-17, где сиалилтрансфераза представляет собой крысиную ST3Gal III. 19. Способ получения препарата рекомбинантного ФСГ, имеющего число Z, которое составляет по меньшей мере 200, где указанный способ включает в себя стадию изоэлектрического фокусирования,хроматофокусирования или ионообменной хроматографии. 20. Способ получения препарата рекомбинантного ФСГ, имеющего число Z, которое составляет по меньшей мере 200, где указанный способ включает в себя обогащение культуральной среды, в которой экспрессируется рекомбинантный ФСГ, ингибиторами нейраминидазы и/или внутриклеточными предшественниками синтеза сиаловой кислоты, такими как ацетилманнозамин. 21. Способ по п.19 или 20, где рекомбинантный ФСГ экспрессируется в клетках яичника китайского хомячка (СНО). 22. Способ по любому из пп.15-21, где рекомбинантный ФСГ имеет среднее значение рI менее 3,4,более предпочтительно менее 3,3 и наиболее предпочтительно менее 3,2.
МПК / Метки
МПК: A61K 38/24, C07K 14/59
Метки: фолликулогенеза, гонадотропины
Код ссылки
<a href="https://eas.patents.su/20-7030-gonadotropiny-dlya-follikulogeneza.html" rel="bookmark" title="База патентов Евразийского Союза">Гонадотропины для фолликулогенеза</a>
Предыдущий патент: Стимуляция срт -1 как средство уменьшения веса
Следующий патент: Пестицидная композиция, содержащая эфир молочной кислоты в качестве ингибитора роста кристаллов
Случайный патент: Способ получения углеводородных бензиновых фракций из синтез-газа