Фармацевтическая композиция для чрескожной доставки активного агента (варианты)
Номер патента: 9024
Опубликовано: 26.10.2007
Авторы: Морган Тимоти Матиас, Рид Барри Леонард, Уилкинс Нина Франсис, Клоус Кэтрин Трейси-Джейн, Финнин Барри Чарльз
Формула / Реферат
1. Фармацевтическая композиция для чрескожной доставки, содержащая по меньшей мере один физиологически активный агент, по меньшей мере один агент, способствующий проникновению через кожу, и летучий носитель, содержащий фармацевтически приемлемый растворитель, испаряющийся при физиологической температуре, причем указанная комбинация физиологически активного агента и агента, способствующего проникновению через кожу, и молярное соотношение физиологически активного агента и агента, способствующего проникновению через кожу, являются такими, что указанная композиция образует аморфное отложение, содержащее агент, способствующий проникновению через кожу, и физиологически активный агент и определяемое посредством дифференциальной сканирующей калометрии и светлопольной микроскопии после испарения летучего носителя при физиологической температуре.
2. Фармацевтическая композиция для чрескожной доставки, состоящая по меньшей мере из одного физиологически активного агента, по меньшей мере одного агента, способствующего проникновению через кожу, и летучего носителя, содержащего фармацевтически приемлемый растворитель, испаряющийся при физиологической температуре, причем указанная комбинация физиологически активного агента и агента, способствующего проникновению через кожу, и молярное соотношение физиологически активного агента и агента, способствующего проникновению через кожу, являются такими, что указанная композиция образует аморфное отложение, содержащее агент, способствующий проникновению через кожу, и физиологически активный агент и определяемое посредством дифференциальной сканирующей калометрии и светлопольной микроскопии после испарения летучего носителя при физиологической температуре.
3. Фармацевтическая композиция по п.1 или 2, которая имеет профиль скорости высвобождения физиологически активного агента, обеспечивающий соотношение максимальной концентрации (Cmax) и средней концентрации (Cavg) физиологически активного агента в интервале между введениями препарата в пределах от 1 до 5.
4. Фармацевтическая композиция по любому из пп.1-3, имеющая профиль скорости высвобождения физиологически активного агента, в основном, нулевого порядка или первого порядка в любом интервале между введениями, подходящем для получения терапевтического эффекта физиологически активного агента.
5. Фармацевтическая композиция по п.1 или 2, имеющая профиль скорости высвобождения физиологически активного агента нулевого порядка с уменьшением соотношения максимальной концентрации (Cmax) и средней концентрации (Cavg) физиологически активного агента до значения меньше 2 в интервале между введениями и ослаблением потенциальных побочных эффектов, связанных с повышенными соотношениями Cmax к Cavg.
6. Фармацевтическая композиция по п.1 или 2, имеющая профиль скорости высвобождения физиологически активного агента нулевого порядка с уменьшением соотношения максимальной концентрации (Cmax) и средней концентрации (Cavg) физиологически активного агента до значения меньше 1,5 в интервале между введениями и ослаблением потенциальных побочных эффектов, связанных с повышенными соотношениями Cmax к Cavg.
7. Фармацевтическая композиция по п.1 или 2, имеющая профиль скорости высвобождения физиологически активного агента первого порядка с увеличением соотношения Cmax и Cavg до значения, превышающего 1,5, сокращением времени максимальной системной концентрации (tmax) физиологически активного агента до значения менее 6 ч в интервале между введениями и сокращением времени до возникновения терапевтического ответа или усилением терапевтического ответа после введения однократной дозы.
8. Фармацевтическая композиция по п.1 или 2, имеющая профиль скорости высвобождения физиологически активного агента первого порядка с увеличением соотношения Cmax и Cavg до значения, превышающего 2, сокращением времени максимальной системной концентрации (tmax) физиологически активного агента до значения менее 3 ч в интервале между введениями и сокращением времени до возникновения терапевтического ответа или усилением терапевтического ответа после введения однократной дозы.
9. Фармацевтическая композиция по любому из пп.1-8, в которой физиологически активный агент представляет собой стероид, производное гормона, опиоидный анальгетик, тромболитик, препарат против тошноты, транквилизатор, соединение против мигрени, антигипертензивный агент, противомалярийное соединение, бронходилататор, агент против болезни Альцгеймера, нейролептик или антипсихотический агент, агент против болезни Паркинсона, антихолинергический, антиандрогенный или анорексический агент.
10. Фармацевтическая композиция по любому из пп.1-8, в которой физиологически активный агент представляет собой тестостерон, эстрадиол, этинилэстрадиол, несторон, левоноргестрел, лацидипин, норэтистерон ацетат, буспирон, фентанил, бупренорфин, ропинирол, скополамин, гранисетрон, амлодипин, оксибутинин, ривастигмин, ризатриптан, примахин, флуоксетин, пароксетин, такрин, N-0923 и мазиндол.
11. Фармацевтическая композиция по любому из пп.1-10, в которой носитель содержит гидрофторуглеродный пропеллент, причем наружное нанесение композиции в виде аэрозоля обеспечивает образование аморфного отложения при испарении летучего носителя.
12. Фармацевтическая композиция по п.11, в которой гидрофторуглеродный пропеллент представляет собой HFC-134a.
13. Фармацевтическая композиция по п.11, в которой летучий растворитель и пропеллент образуют однофазный раствор активного агента.
14. Фармацевтическая композиция по любому из пп.1-13, содержащая от 0,1 до 10 мас.% физиологически активного агента, от 0,1 до 10 мас.% агента, способствующего проникновению через кожу, и от 85 до 99,8 мас.% летучего носителя.
15. Фармацевтическая композиция по п.11, в которой гидрофторуглеродный пропеллент составляет от 15 до 50 об.% фармацевтической композиции в целом.
16. Фармацевтическая композиция по п.1 или 2, в которой физиологически активный агент имеет молекулярную массу менее 600 Да и температуру плавления менее 200шС.
17. Фармацевтическая композиция по любому из пп.1-16, в которой агент, способствующий проникновению в кожу, характеризуется значением органического показателя от 200 до 400 и значением неорганического показателя от 0 до 200.
18. Фармацевтическая композиция по любому из пп.1-16, в которой агент, способствующий проникновению в кожу, представляет собой липофильную жидкость, характеризующуюся давлением паров ниже 10 мм рт.ст. при атмосферном давлении и температуре 32шС и молекулярной массой в интервале от 200 до 400 Да.
19. Фармацевтическая композиция по любому из пп.1-16, в которой агенты, способствущие проникновению, содержат по меньшей мере одно из соединений, выбранных из групп, состоящих из жирных кислот, сложных эфиров жирных кислот, жирных спиртов, гликолей и сложных эфиров гликолей, 1,3-диоксаланов и 1,3-диоксанов, макроциклических кетонов, содержащих по меньшей мере 12 атомов углерода, оксазолидинонов и производных оксазолидинонов, сложных эфиров алкил-2-(N,N-дизамещенный амин)алканоатов, (N,N-дизамещенный амин)алканолалканоатов и их смесей.
20. Фармацевтическая композиция по любому из пп.1-16, в которой агент, способствующий проникновению через кожу, включает, по меньшей мере, октилсалицилат или падимат О.
21. Фармацевтическая композиция по любому из пп.1-16, в которой агент, способствующий проникновению через кожу, выбран из перечня, включающего олеиновую кислоту, олеиловый спирт, циклопентадеканон, сорбитанмоноолеат, глицеролмоноолеат, пропиленгликольмонолаурат, полиэтиленгликольмонолаурат, 2-н-нонил-1,3-диоксолан, додецил-2-(N,N-диметиламин)пропионат или его солевые производные, 2-этилгексил-2-этилгексаноат, изопропилмиристат, диметилизосорбид, 4-децилоксазолидинон-2-он, 3-метил-4-децилоксазолидинон-2-он и их смеси.
22. Фармацевтическая композиция по любому из пп.1-21, в котоЁющ растворитель содержит этанол, изопропанол или их смесь.
23. Фармацевтическая композиция по любому из пп.1-22, в которой молярное соотношение физиологически активного агента и агента, способствующего проникновению через кожу, составляет от 1:20 до 20:1.
24. Фармацевтическая композиция по любому из пп.1-23, предназначенная для размещения в камере устройства для нанесения композиции распылением, содержащего клапан подачи композиции из камеры, наконечник для диспергирования композиции в виде аэрозоля и средства дозирования аэрозоля из наконечника.
25. Применение по меньшей мере одного физиологически активного агента, по меньшей мере одного агента, способствующего проникновению через кожу, и летучего носителя, содержащего фармацевтически приемлемый растворитель, испаряющийся при физиологической температуре, для приготовления фармацевтической композиции для чрескожного введения физиологически активного агента, причем указанная комбинация физиологически активного агента и агента, способствующего проникновению через кожу, и молярное соотношение физиологически активного агента и агента, способствующего проникновению через кожу, являются такими, что указанная композиция образует аморфное отложение, содержащее агент, способствующий проникновению через кожу, и физиологически активный агент и определяемое посредством дифференциальной сканирующей калометрии и светлопольной микроскопии после испарения летучего носителя при физиологической температуре.
26. Применение по п.25, при котором фармацевтическая композиция представляет собой композицию в виде аэрозоля, обеспечивающую при нанесении ее на кожу субъекта профиль скорости высвобождения физиологически активного агента в основном нулевого порядка, с уменьшением потенциальных побочных эффектов, связанных с повышенными максимальными концентрациями активного агента в кровотоке (Cmax) в период между введениями, при поддержании эффективных средних концентраций активного агента (Cavg) в кровотоке.
27. Применение по п.25, при котором фармацевтическая композиция представляет собой композицию в виде аэрозоля, обеспечивающую при нанесении ее на кожу субъекта профиль скорости высвобождения физиологически активного агента, в основном, нулевого порядка за счет сокращения времени до возникновения терапевтического ответа на активный агент или повышение уровня терапевтического ответа на активный агент посредством уменьшения времени до получения максимальной концентрации активного агента в кровотоке (tmax) и повышенным соотношением Cmax и Cavg в период между введениями.
Текст
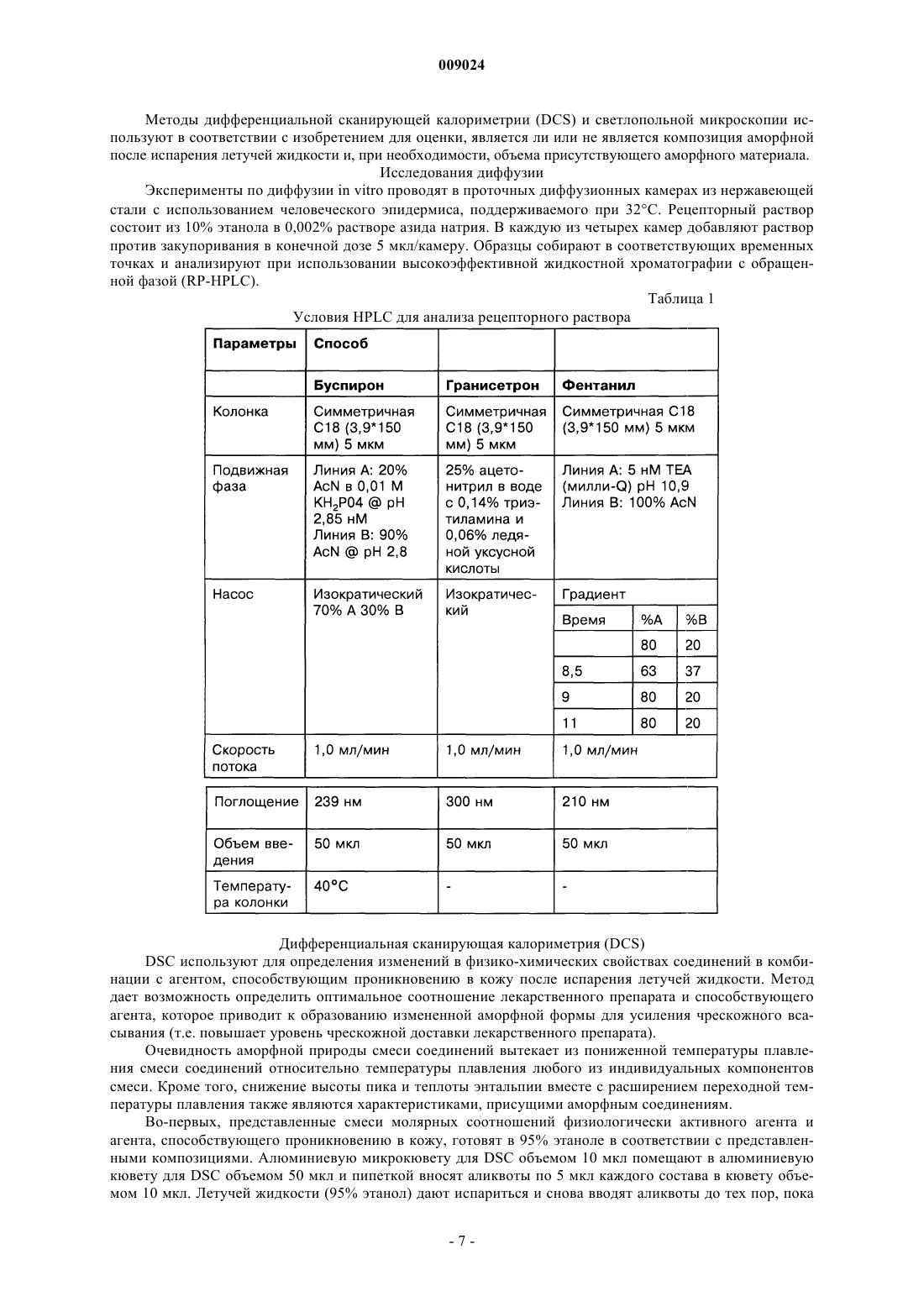
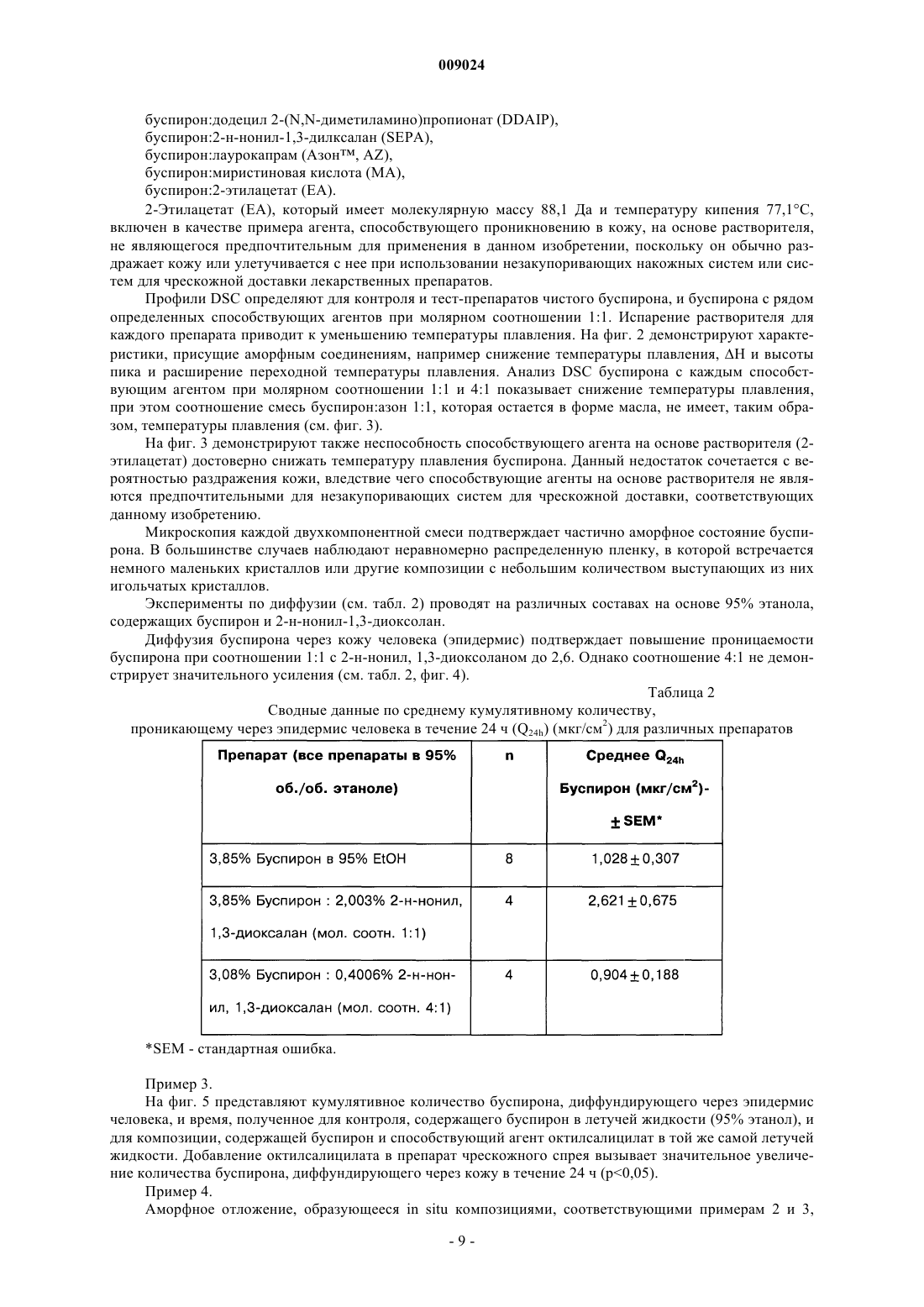
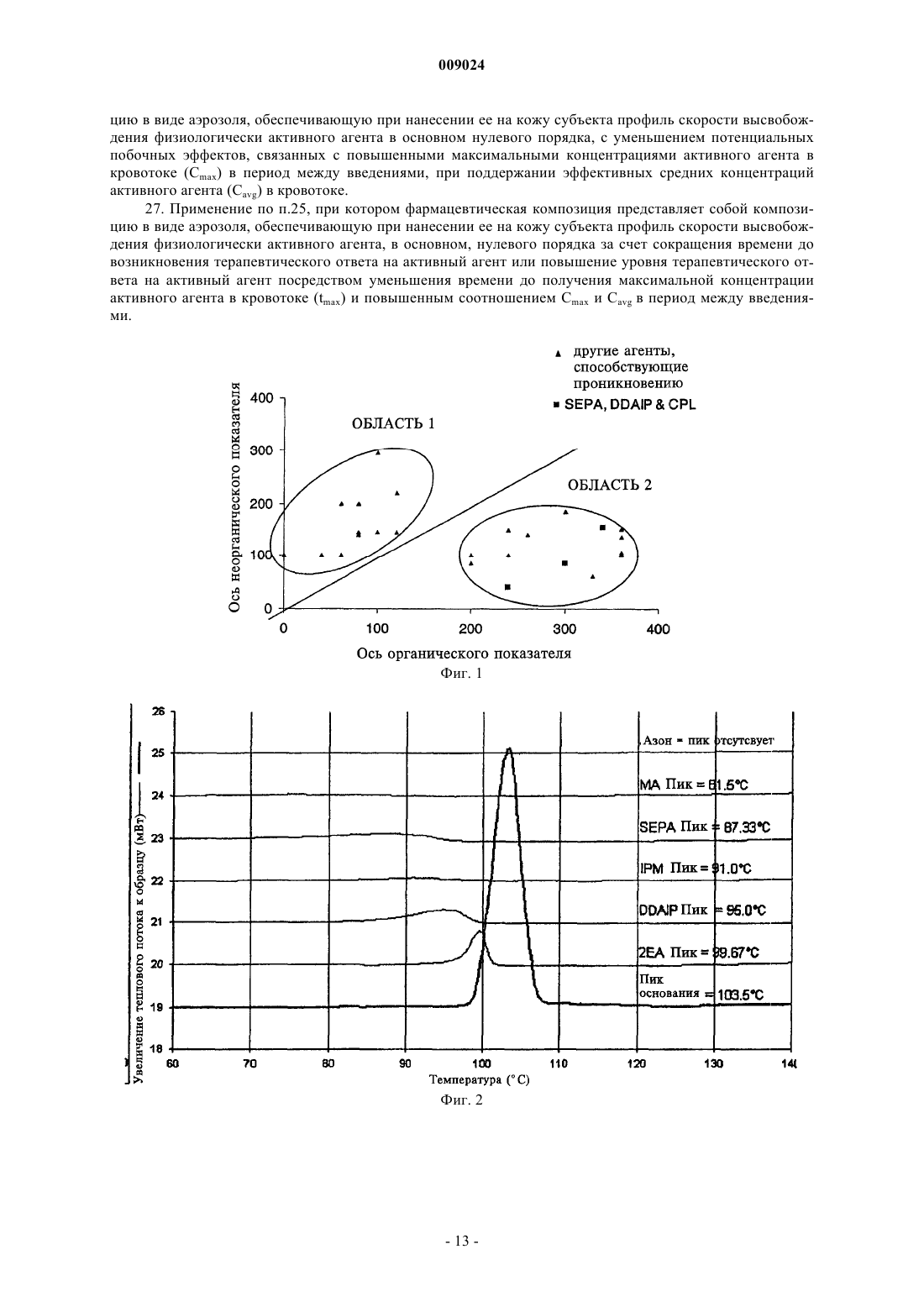
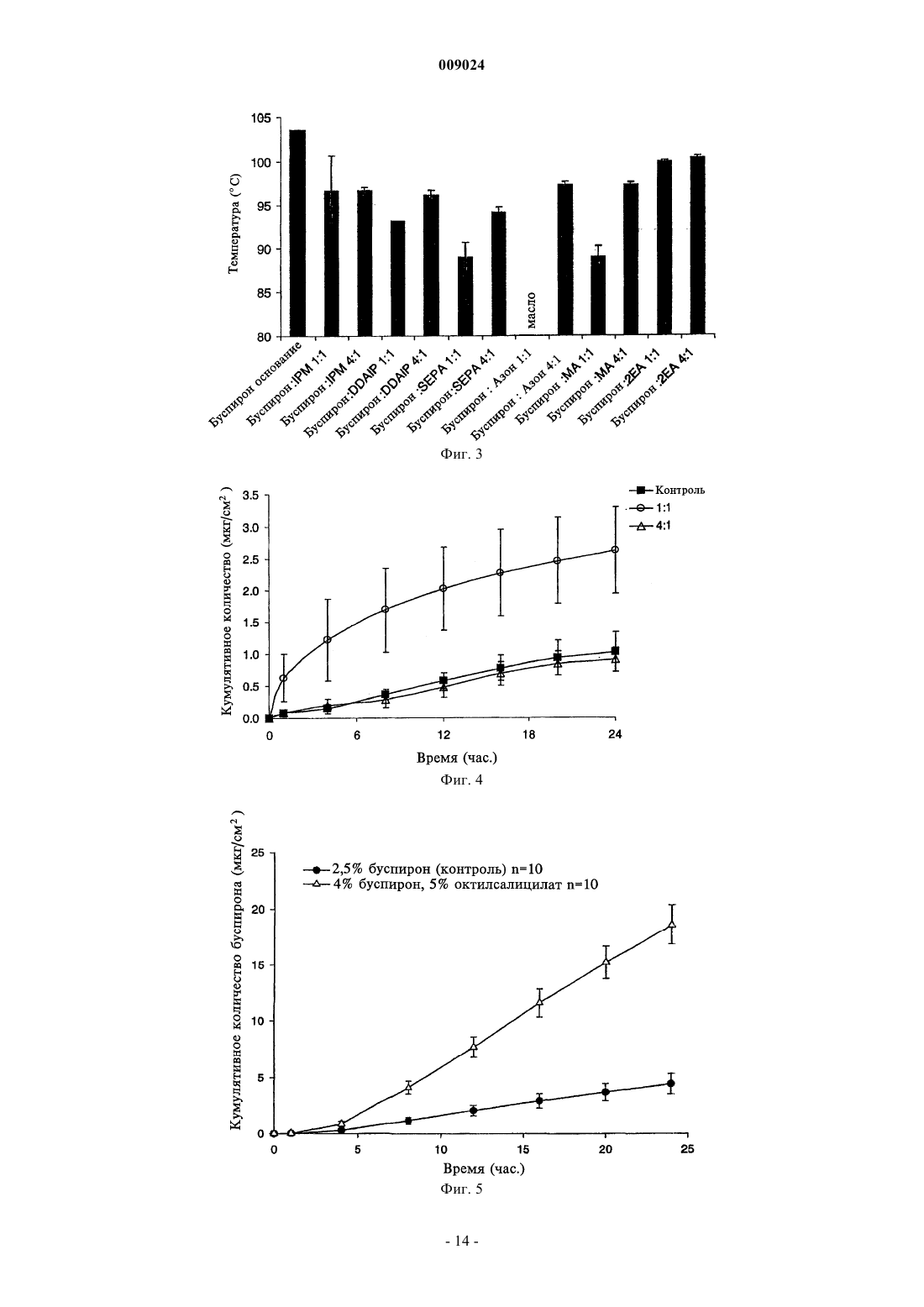
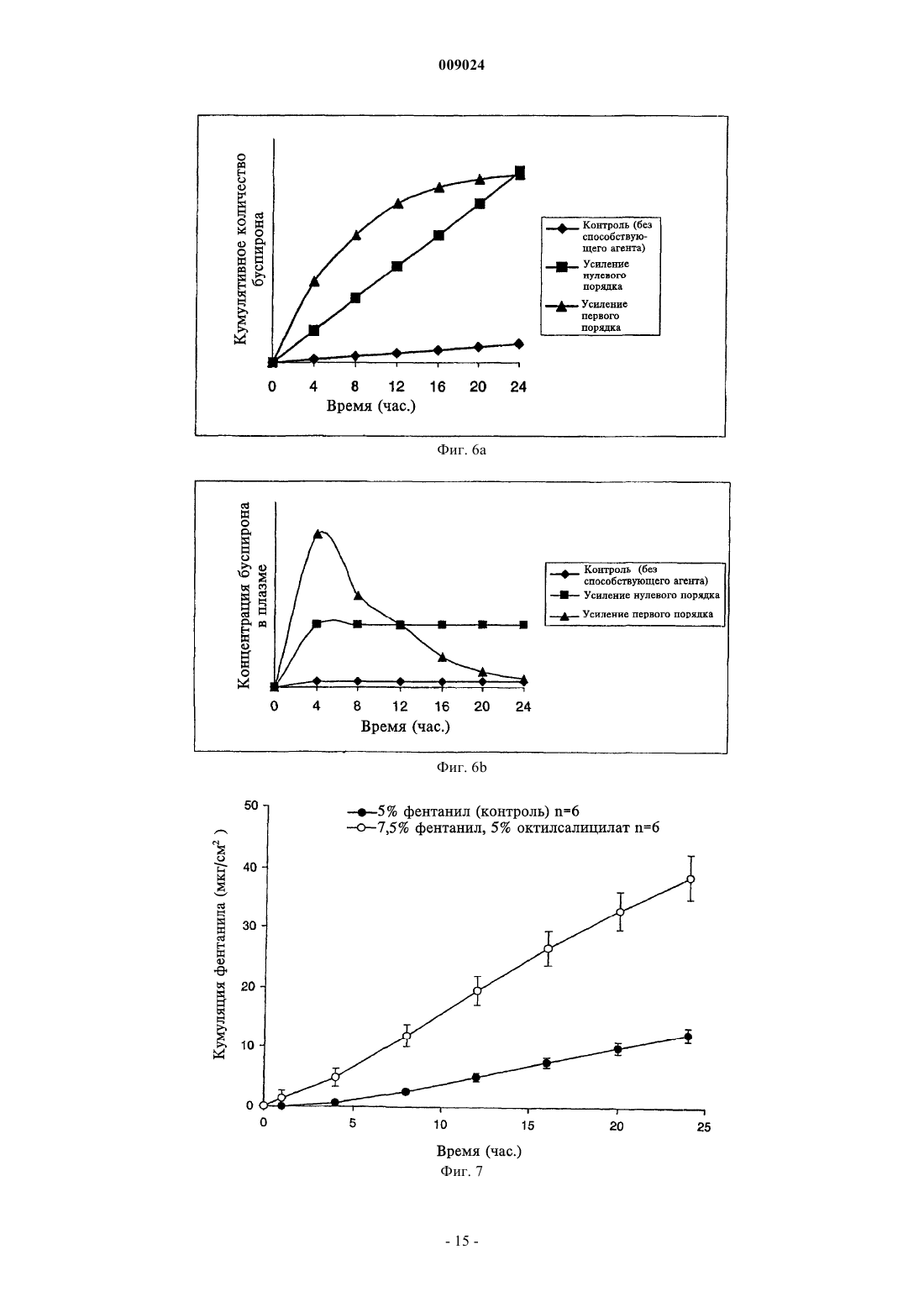
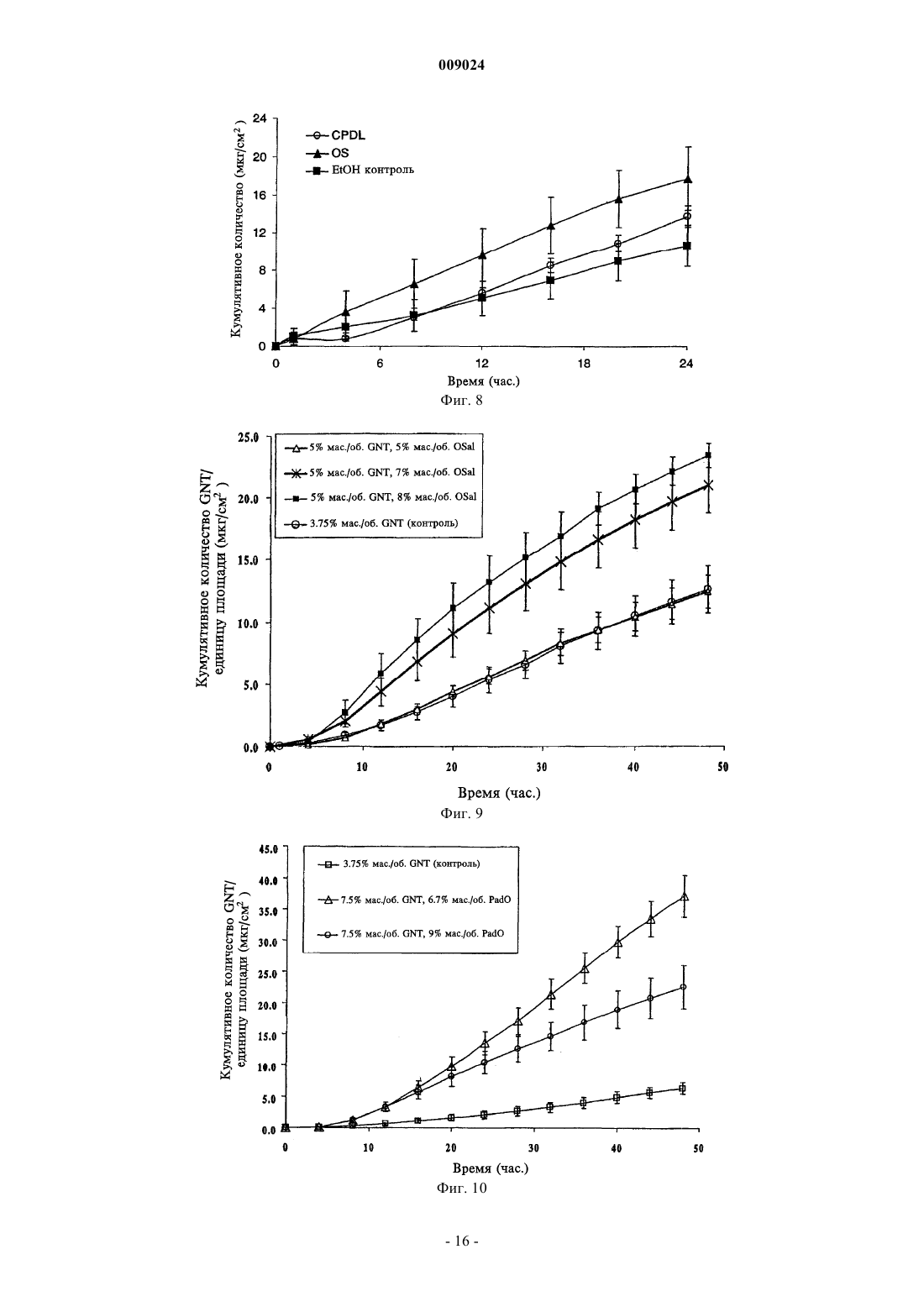
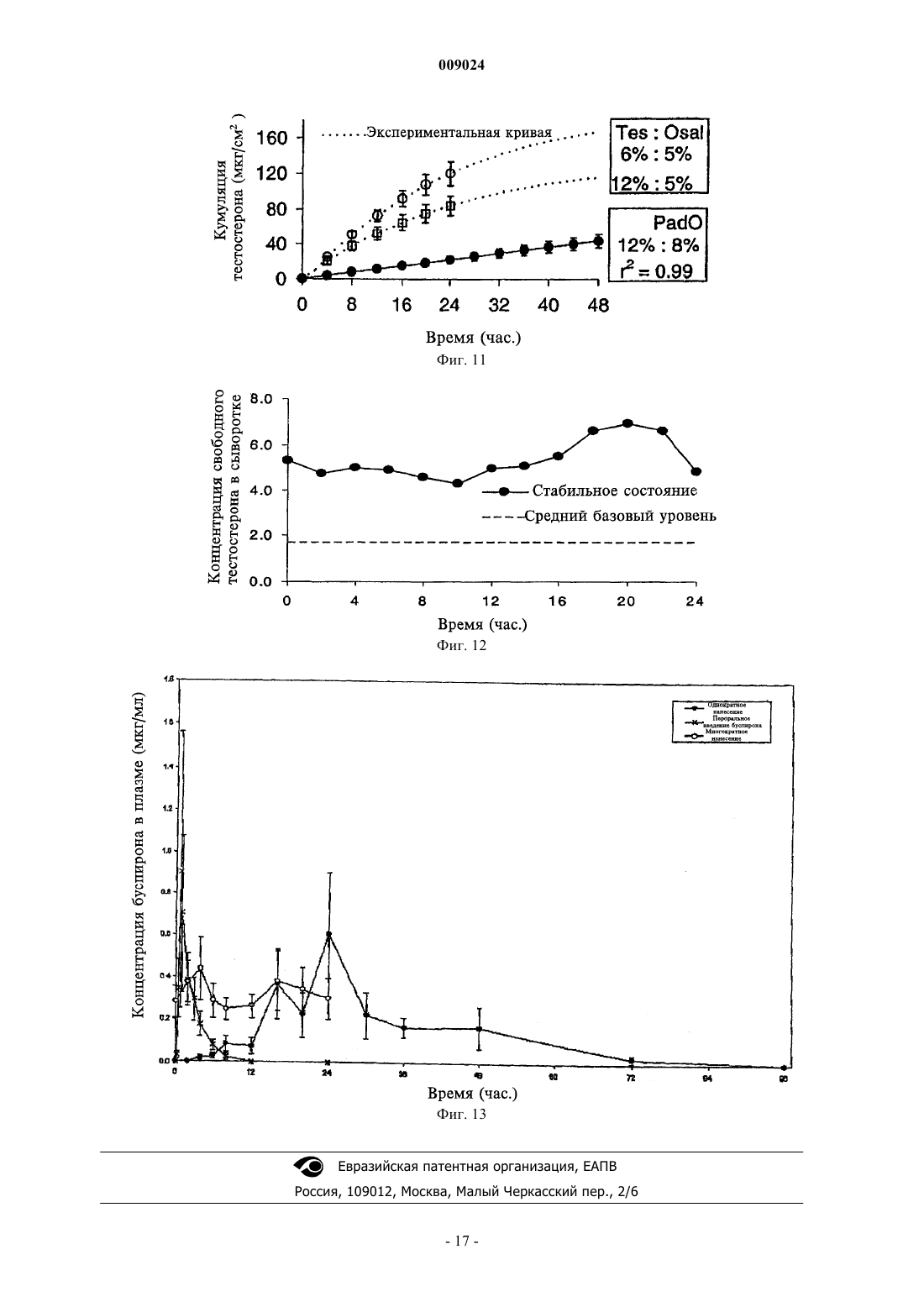
009024 Область техники, к которой относится изобретение Данное изобретение относится к композициям для чрескожной доставки физиологически активных агентов, применению данных композиций и способам чрескожной доставки физиологически активных агентов. Предшествующий уровень техники Существует постоянная потребность в способах безопасного и эффективного введения физиологически активных агентов. Для многих лекарственных препаратов важно, чтобы режим введения был простым и неинвазивным, насколько это возможно, чтобы поддерживать его соблюдение пациентами на высоком уровне. Пероральное введение представляет собой один из обычно используемых режимов введения, поскольку ему относительно просто следовать. Однако пероральный путь введения также затруднен вследствие осложнений, связанных с раздражением желудочно-кишечного тракта и метаболизмом лекарственного препарата в печени. Введение физиологически активных агентов через кожу ("чрескожная доставка лекарственного препарата") привлекает к себе повышенное внимание, поскольку она не только представляет собой простой режим дозирования, но также обеспечивает относительно медленный и контролируемый путь высвобождения физиологически активного агента в большой круг кровообращения. Однако чрескожная доставка лекарственного препарата осложняется тем фактом, что кожа ведет себя как естественный барьер и вследствие этого транспорт агентов через кожу представляет сложный механизм. По своей структуре кожа состоит их двух составных частей - относительно тонкого наружного слоя("эпидермиса") и более толстого внутреннего участка ("дермы"). Наружный слой эпидермиса ("ороговевающий слой") состоит из уплощенных мертвых клеток, которые заполнены кератином. Область между уплощенными мертвыми клетками ороговевающего слоя заполнена липидами, которые образуют ламеллярные фазы, обусловливающие свойства кожи как естественного барьера. Для эффективной чрескожной доставки физиологически активного агента, который наносят на поверхность кожи ("наружное нанесение"), агент должен сначала перераспределиться из носителя в ороговевающий слой, затем он, как правило, должен распространиться внутри ороговевающего слоя перед перераспределением из ороговевающего слоя в жизнеспособный эпидермис, дерму и кровоток. Для преодоления ряда проблем, возникающих при чрескожной доставке, которые связаны с транспортом через дермальные слои ("чрескожная абсорбция (всасывание)"), физиологически активные агенты могут быть приготовлены с включением одного или более агентов, способствующих проникновению лекарственного препарата. Например, в препаратах для наружного применения в качестве носителя может быть использован водный раствор этанола. Этанол может действовать как агент, способствующий проникновению, который увеличивает поток активного агента через кожу вследствие эффекта растворителя увлекать за собой агент (см. статью Berner и соавт., J. Pharm. Sci., 78 (5), 402-406, (1989. Памидат О, октилсалицилат (см. патент США 6299900) и Азон представляют собой дополнительные примеры агентов, способствующих проникновению, которые, как было показано, улучшают чрескожную абсорбцию. Композиции, которые образуются in situ, ранее находили применение в качестве биодеградируемых образующихся in situ пленочных покрытий (см. патент США 5792469) для формирования барьерных поверхностей для открытых кожных ран. Однако до настоящего времени применение аморфных композиций для усовершенствованных систем доставки лекарственных средств было в значительной мере ограничено твердыми системами доставки лекарственных средств, такими как пероральные капсулы, примером которых является композиция аморфного пароксетина, раскрытая в WO 99/16440, или содержащие лекарственный препарат в липком составе чрескожные пластыри типа плавящихся при нагревании, такие как описаны в патентах США 5662923, 4409206, 6264980 и публикации WO 95/18603. Данные существующие аморфные системы доставки страдают от определенного недостатка, заключающегося в том, что они часто имеют плохую стабильность при хранении в течение срока их годности. Это особенно затрудняет их разработку и создание и во многих случаях приводило к вариабельности высвобождения препарата и/или резким изменениям физического вида (например, к кристаллизации и перенасыщению в доставляющих системах типа чрескожного пластыря, содержащего лекарственный препарат в липком составе). Другими исследователями описано также применение композиции чрескожного спрея, где используют образующую пленку композицию для формирования резервуара лекарственного препарата над кожей (см. патент США 6010716), и такие системы представляют собой накожные пластыри, содержащие лекарственный препарат в липком составе, которые образуются in situ. Следовательно, существует необходимость в разработке новых систем доставки аморфных лекарственных препаратов с усовершенствованной конструкцией и улучшенной стабильностью с учетом преимуществ аморфной фармацевтической композиции. Хотя вероятно, что временное образование аморфной фармацевтической композиции можно было бы осуществить из имеющихся летучих/нелетучих носителей на спиртовой основе, таких как раскрыты в двухфазной системе носителей, где используют бензиловый спирт в качестве агента, способствующего проникновению через кожу (см. патент США 4820724), или летучих/нелетучих носителей на основе-1 009024 ацетона с использованием DMSO, DMAC в качестве агентов, способствующих проникновению (см. статью Feldmann R.J., Maibach H. I. Чрескожное проникновение 14 С-гидрокортизона у человека. II. Эффект некоторых оснований и предварительной обработки (I. Percutaneous penetration of 14C hydrocortisone inman. II. Effect of certain bases and pre-treatments), Arch. Derm. 94: 649-651, (1966. Данные существующие летучие/нелетучие доставляющие системы страдают от ограничения применения водорастворимых агентов, способствующих проникновению через кожу, которые имеют низкое сродство к коже и, таким образом, не обеспечивают надежного поддержания стабильной аморфной композиции в коже в течение периода доставки вследствие их склонности к вымыванию из кожи. Кроме того, данные системы, соответствующие предшествующему уровню техники, часто раздражают кожу вследствие природы растворителя агентов, способствующих проникновению, которые используют в таких системах, соответствующих предшествующему уровню техники (что в результате дает значительный уровень проникновения способствующего агента в жизнеспособный эпидермис). Базой других способов усиления на термодинамической основе, направленных на усовершенствование чрескожного всасывания, является: перенасыщение (см. статью Coldman M.F., Poulsen В.J., Higuchi Т., Усиление чрескожного всасывания с использованием систем летучих/нелетучих агентов в качестве носителей (Enhancement of percutaneousabsorption by the use of volatile:nonvolatile systems as vehicles), J. Pharm. Sci., 58, 1098-1102, (1969, или уменьшение температуры плавления диффузанта с использованием направленного отбора специфических энантиомеров (см. патент США 5114946), или уменьшение температуры плавления с использованием направленного отбора эвтектических смесей(см. статьи Touitou E., Chow D.D., Lawter J.R., Хиральные -блокаторы для чрескожной доставки (Chiral-blockers for transdermal delivery), Int. J. Pharm., 104, 19-28, (1994), Kaplun-Frischoff, Y.; Touitou, E., Усиление проникновения тестостерона через кожу с помощью ментола путем образования эвтектической смеси с лекарственным препаратом и взаимодействия с липидами кожи (Testosterone skin permeationSci., 86, 1394-1399, (1997), Stott P.W., Williams A.C., Barry B.W., Изучение механизма усиления чрескожного проникновения модельного -блокатора пропранолола при использовании жирных кислот, эффект снижения температуры плавления (Mechanistic study into the enhanced transdermal permeation of a model blocker, propranolol, by fatty acids: a melting point depression effect), Int. J. Pharm., 219, 161-176, (2001. Хотя задачей всех данных способов является усовершенствование чрескожного всасывания, ни один из них не решил проблему образования стабильной аморфной композиции, способной контролировать степень и/или профиль чрескожного высвобождения физиологически активного агента из кожи при избежании раздражения кожи, наблюдаемого при использовании систем и композиций, соответствующих предшествующему уровню техники. Кроме того, преимущества стабильной формирующейся in situ аморфной фармацевтической композиции в плане контроля скорости высвобождения в коже невозможно предсказать, имея существующие доставляющие системы, в основе которых лежит контроль скорости высвобождения посредством модификации резервуара для лекарственного препарата, который находится над кожей так, как описано для чрескожных матриц, которые находятся над кожей хозяина (пациента) и которые направлены на определенную модификацию профиля чрескожной доставки лекарственного препарата. Примеры подобных систем описаны в патенте США 5091186 под названием "Двухфазное устройство для чрескожной доставки лекарственных препаратов" (Biphasic transdermal drug delivery device) или в патенте США 5613958 под названием "Системы для чрескожной доставки, предназначенные для модулированного введения лекарственных препаратов" (Transdermal delivery systems for the modulated administration of drugs) или вWO 93/00058 под названием "Система доставки лекарственных препаратов на основе параметров растворимости и способы изменения концентрации насыщения лекарственного препарата" (Solubility parameterHe делают никаких допущений, что любая ссылка, включая любой патент или патентный документ,приведенные в данном описании, составляют предшествующий уровень техники. В частности, подразумевается, что, если не указано иначе, ссылка на какой-либо документ в данном контексте не означает допущения, что любой из данных документов образует часть общеизвестных основных знаний в области техники в Австралии или любой другой стране. Обсуждение ссылок позволяет утверждать, что их авторы заявляют, а заявитель сохраняет право на проверку точности и применимости любого из документов,приведенных в данном контексте. Сущность изобретения Данное изобретение является результатом исследований заявителя, касающихся агентов, способствующих проникновению, и в частности выявления того факта, что для конечных дозированных препаратов любое усиление чрескожного всасывания физиологически активного агента, по-видимому, обусловлено одним или более из следующих факторов:(а) увеличение перераспределения агента из носителя, содержащего агент, в ороговевающем слое,(b) увеличение диффузии агента в ороговевающем слое и(c) повышение уровня перераспределения агента из ороговевающего слоя в жизнеспособный эпидермис. Предшествующие исследования показали, что скорость и степень перераспределения (а) уже достаточно эффективна с добавлением или без добавления агента, способствующего проникновению (см.Morgan и соавт., J. Pharm. Sci., 87 (10), 1213-1218, (1998. Другие исследования данных авторов, а также иных исследователей показали, что повышение диффузионной способности в ороговевающем слое (b) является дозозависимым для изученных агентов, способствующих проникновению, и вследствие этого в определенный момент, когда для (b) достигается максимальный эффект, никакого дальнейшего повышения проникновения, по-видимому, не происходит. Данное изобретение основано, по меньшей мере отчасти, на том факте, что повышение и/или регулирование коэффициента распределения из ороговевающего слоя в жизнеспособный эпидермис (с) может быть достигнуто путем направленного формирования аморфного лекарственного препарата in situ таким образом, что лекарственный препарат имеет повышенную растворимость в воде, находясь в жизнеспособном эпидермисе. Для внедрения изобретения в практику данные авторы обнаружили, что некоторые комбинации физиологически активного агента и агента, способствующего проникновению, образуют аморфную твердую композицию in situ, когда их наносят наружно, и что данные комбинации могут быть использованы для контроля степени и/или профиля чрескожного высвобождения физиологически активного агента. Соответственно, в первом аспекте данное изобретение представляет композицию, включающую: один или более физиологически активных агентов,один или более агентов, способствующих проникновению, и летучий носитель, содержащий фармацевтически приемлемый растворитель,причем физиологически активный агент и агент, способствующий проникновению через кожу, образуют аморфное отложение при испарении летучего носителя для контроля степени и/или профиля чрескожного высвобождения физиологически активного агента. Аморфные отложения, которые образуются с использованием композиций, соответствующих данному изобретению, можно отличить от твердого осадка (например, солевого производного лекарственного вещества) или кристаллических полиморфных структур, поскольку аморфное отложение формируетсяin situ в коже после испарения летучего носителя. При этом физиологически активный агент способен к быстрому перераспределению из ороговевающего слоя в жизнеспособный эпидермис. В противоположность этому, было обнаружено, что образование кристаллических отложений в коже, как правило, приводит к повышенной вероятности раздражения кожи и снижению эффективности чрескожного всасывания (вследствие необходимости более высокой энергии для растворения кристалла перед диффузионным транспортом). Данная проблема усугубляется в отношении кристаллических отложений с более высокой температурой плавления. Композиции, соответствующие данному изобретению, могут быть также более приемлемыми для потребителей, чем другие наружные композиции, поскольку аморфные отложения характеризуются приятными ощущениями для кожи и при прикосновении, когда отложение втирают в кожу. В дополнение к повышению эффективности чрескожного проникновения композиция, соответствующая изобретению, вызывает меньшее раздражение, чем некоторые другие системы доставки, такие как спреи на основе бензилового спирта, поскольку использование для доставки активного агента относительно меньшего объема и типа летучих и нелетучих наполнителей в результате приводит к более низким уровням раздражения кожи. Кроме того, композиция, соответствующая изобретению, позволяет избежать проблем, связанных с кристаллизацией и/или перенасыщением, с которыми сталкиваются при использовании имеющихся аморфных композиций, таких как чрескожные пластыри аморфного типа. Эту проблему можно преодолеть, поскольку в данном изобретении аморфное отложение формируется insitu. Согласно особенно предпочтительному варианту осуществления изобретение далее представляет аэрозольную композицию для чрескожной доставки физиологические активного агента, содержащую: один или более физиологически активных агентов,один или более агентов, способствующих проникновению через кожу, и летучий носитель, содержащий летучий фармацевтически приемлемый растворитель,причем наружное нанесение композиции вызывает образование физиологически активным агентом и агентом, способствующим проникновению через кожу, аморфного отложения при испарении летучего носителя с целью контроля степени и/или профиля чрескожного высвобождения физиологически активного агента. В следующем варианте осуществления изобретение представляет фармацевтическую композицию,в которой носитель содержит гидрофторуглеродный пропеллент (газ-вытеснитель), причем наружное нанесение композиции в виде аэрозоля приводит к образованию аморфного отложения при испарении летучего носителя, при этом гидрофторуглеродный пропеллент представляет собой HFC-134A. В следующем варианте осуществления изобретение представляет устройство для нанесения распыляемой композиции (спрея), предназначенной для чрескожного введения физиологически активного-3 009024 агента, представляющее собой аэрозольный распылитель, содержащий камеру для аэрозольной композиции, клапан подачи аэрозольной композиции и средства для дозирования спрея из наконечника. Аэрозольный распылитель может дополнительно иметь средства, удерживающие наконечник распылителя на заданном расстоянии от кожи субъекта, на которую следует доставить спрей. Кроме того, применение композиций, соответствующих данному изобретению, позволяет избежать неудобства, связанного с закупориванием наконечника распыляемой композицией (спреем), которое происходит с существующими пленкообразующими спреями или аэрозолями. В следующем аспекте данное изобретение представляет способ доставки аморфного лекарственного препарата хозяину (пациенту), который включает стадии нанесения наружной композиции спрея, содержащей один или более физиологически активных агентов, один или более агентов, способствующих проникновению через кожу, и летучий фармацевтически приемлемый растворитель, на кожу хозяина таким образом, что летучий растворитель испаряется с образованием аморфного отложения, содержащего активный агент и агент, способствующий проникновению через кожу. Как используют в данном контексте, термин "аморфный" означает практически некристаллический. Методы, которые можно использовать для оценки образования аморфных композиций в потенциальных композициях, представляют собой дифференциальную сканирующую калориметрию (DCS) и светлопольную микроскопию. Авторами показано, что данные методики, как описано в данном контексте в примерах, позволяют легко определить потенциальную способность композиции к образованию аморфных остатков in situ. Комбинация физиологически активного агента и агента, способствующего проникновению через кожу, соответствующая изобретению, функционально ограничена агентами, которые, вместе взятые, образуют аморфное отложение. По этой причине предпочтительно, когда оба, как активный агент, так и агент, способствующий проникновению через кожу, являются нелетучими относительно летучего растворителя, чтобы при нанесении композиции на кожу хозяина только летучий растворитель испарялся при физиологических температурах. При практической реализации было обнаружено, что физиологически активный агент может быть выбран из круга липофильных физиологически активных агентов с молекулярной массой меньше 600 Да(дальтон) и температурой плавления меньше 200 С. Перечень пригодных физиологически активных агентов включает без ограничения перечисленным апоморфин, буторфанол, оксибутинин, ропинирол,ривастигмин, буспирон, ризатриптин, толтеродин, золмитриптан, лацидипин, трописетрон, оланзапин и метилфенидат, или фармацевтическую соль, или производное любого из вышеперечисленных препаратов. Наиболее предпочтительно, когда физиологически активный агент имеет молекулярную массу меньше 400 Да и температуру плавления меньше 200 С. По этой же причине агент, способствующий проникновению через кожу, может быть выбран из классов способствующих агентов, которые представляют собой липофильные нелетучие жидкости, у которых давление насыщенного пара ниже 10 мм рт.ст. (1,33 кПа) при атмосферном давлении и нормальной температуре кожи 32 С. Предпочтительно, когда агент, способствующий проникновению через кожу, имеет молекулярную массу в интервале 200-400 Да. Предпочтительные агенты, способствующие проникновению, для использования в соответствии с изобретением могут быть идентифицированы на основе соотношения их органических и неорганических показателей. Органические и неорганические показатели для каждого агента, способствующего проникновению, для использования в соответствии с изобретением можно определить методом, описаннымFujita в работе "Получение органических соединений по концептуальной схеме" ("Production of organiccompounds by a Conceptional Diagram"), Chem. Pharm. Bull. (Tokyo) 2: 163 (1954). При этом область 1 и область 2 обладают различными физико-химическими свойствами, при условии, что область 1 представляет собой способствующие агенты на основе растворителей. Предпочтительные агенты, способствующие проникновению, взяты из области 2 концептуальной схемы, предложенной Hori и соавт. (см. статью в J. Pharm. Pharmacol., 42: 71-72, (1990. Предпочтительная область распространяется на неорганические показатели от приблизительно 0 до приблизительно 200 и органические показатели от приблизительно 200 до приблизительно 400. Предпочтительные агенты, способствущие проникновению, включают жирные кислоты, сложные эфиры жирных кислот, жирные спирты, гликоли и сложные эфиры гликолей, 1,3-диоксоланы и 1,3 диоксаны, макроциклические кетоны, содержащие по меньшей мере 12 атомов углерода, оксазолидиноны и производные оксазолидинонов, сложные эфиры алкил-2-(N,N-дизамещенный амин)алканоатов,(N,N-дизамещенный амин)алканолалканоаты и их смеси. Наиболее предпочтительно, когда агент, способствующий проникновению в кожу, выбран из перечня, включающего олеиновую кислоту, олеиловый спирт, циклопентадеканон (СРЕ-218), сорбитанмоноолеат, глицеролмоноолеат, пропиленгликольмонолаурат, полиэтиленгликольмонолаурат, 2-н-нонил-1,3-диоксалан (SEPA), додецил-2-(N,N-диметиламин)пропионат (DDAIP) или его солевые производные, 2-этилгексил-2-этилгексаноат, изопропилмиристат, диметилизосорбид, 4-децилоксазолидинон-2-он (SR-38, TCPI, Inc.), 3-метил-4-децилоксазолидинон-2-он и их смеси. Предпочтительно, когда летучий растворитель имеет давление насыщенного пара выше 35 мм рт.ст.-4 009024 при атмосферном давлении и нормальной температуре кожи 32 С. В особенно предпочтительной форме изобретения растворитель представляет собой этанол или изопропанол или их смесь. Молярное соотношение физиологически активного агента к агенту, способствующему проникновению, может составлять от 1:100 до 100:1. Более предпочтительно, когда молярное соотношение составляет от 1:20 до 20:1. Наиболее предпочтительным молярным соотношением является 1:1. Удобно, когда композиция представляет собой композицию спрея для наружного применения, которая содержит физиологически активный агент, агент, способствующий проникновению лекарственного препарата, и летучий растворитель, и способ включает стадию нанесения композиции на кожу хозяина с образованием аморфного отложения, содержащего физиологически активное вещество. В каждом из вышеупомянутых случаев аморфное отложение предпочтительно формируется в эпидермисе хозяина или имеет укороченное время удержания в жизнеспособном эпидермисе или дерме хозяина. Под термином "жизнеспособный эпидермис" понимают богатую водой ткань под ороговевающим слоем. Перечень фигур, чертежей и иных материалов На фиг. 1 представлен график, демонстрирующий "Область 2" предпочтительного интервала неорганических и органических показателей агентов, способствующих проникновению, для использования в композициях, соответствующих изобретению. На фиг. 2 приведены профили DSC (дифференциальной сканирующей калориметрии) чистого буспирона и композиций буспирона, соответствующих изобретению, которые содержат различные агенты,способствущие проникновению. На фиг. 3 представлена гистограмма, показывающая температуру плавления ряда композиций буспирона. На фиг. 4 представлен график, демонстрирующий кумулятивное количество буспирона, диффундирующего через эпидермис человека в течение времени из контроля, содержащего буспирон, и композиций, содержащих различные соотношения буспирона и агента, способствующего проникновению 2-ннонил-1,3-диоксалана. На фиг. 5 представлен график, демонстрирующий кумулятивное количество буспирона, диффундирующего через эпидермис человека в течение времени из контроля, содержащего буспирон, и композиций, содержащих буспирон и октилсалицилат - агент, способствующий проникновению. На фиг. 6 а представлен график, демонстрирующий кумулятивное количество буспирона, диффундирующего через кожу. На фиг. 6b представлен график, показывающий концентрацию буспирона в плазме после чрескожной доставки в соответствии с профилями доставки, приведенными на 6 а. На фиг. 7 представлен график, демонстрирующий кумулятивное количество фентанила, диффундирующего через эпидермис человека в течение времени из контроля, содержащего фентанил, и композиций, содержащих фентанил и способствующий проникновению агент октилсалицилат. На фиг. 8 представлен график, демонстрирующий кумулятивное количество фентанила, диффундирующего через эпидермис человека после нанесения композиции чрескожного спрея (95% этанола), содержащей фентанил (5%) и способствующий проникновению агент октилсалицилат (5%, OS), а также следующей композиции, содержащей фентанил (5%) и способствующий проникновению агент циклопентадеканолид (5%, CPDL). На фиг. 9 представлен график, демонстрирующий кумулятивное количество гранисетрона, диффундирующего через эпидермис человека в течение времени из контроля, содержащего гранисетрон, и композиций, содержащих гранисетрон и способствующий проникновению агент октилсалицилат. На фиг. 10 представлен график, демонстрирующий кумулятивное количество гранисетрона, диффундирующего через эпидермис человека в течение времени из контроля, содержащего гранисетрон, и композиции, содержащей гранисетрон и способствующий проникновению агент падимат О. На фиг. 11 представлен график, демонстрирующий кумулятивное количество тестостерона, доставленного в течение времени, для композиций, соответствующих изобретению, обеспечивающих скорость доставки нулевого порядка или первого порядка при использовании двух различных агентов, способствующих проникновению в кожу (падимата О или октилсалицилата). На фиг. 12 представлен график, показывающий концентрации в плазме свободного тестостерона в устойчивом состоянии у женщин в периоде менопаузы при использовании композиции чрескожного спрея,содержащей оксилсалицилат (ACROSS) в качестве агента, способствующего проникновению в кожу. На фиг. 13 представлен график, показывающий концентрации в плазме буспирона у здоровых людей - добровольных участников эксперимента в устойчивом состоянии и из однократной дозы при использовании композиции чрескожного спрея, содержащей оксилсалицилат (ACROSS) в качестве агента, способствующего проникновению в кожу, по сравнению с приемом однократной дозы перорального препарата буспирона (Buspar) в пероральной дозе 15 мг у тех же субъектов (план исследований с рассмотрением противоположных гипотез). Сведения, подтверждающие возможность осуществления изобретения Преимуществом данного изобретения является стабильность композиции, что означает отсутствие тенденции к перенасыщению или кристаллизации ее в течение фармацевтического срока хранения. Это-5 009024 может быть противопоставлено чрескожным пластырям, в которых раньше кристаллизация активного агента представляла проблему. Таким образом, композицию, соответствующую изобретению, можно держать в простом контейнере в течение срока хранения, не сталкиваясь с проблемами хранения, характерными для чрескожных пластырей, соответствующих предшествующему уровню техники. Композиция, соответствующая данному изобретению, может содержать от приблизительно 0,1 до приблизительно 10% физиологически активного агента, от приблизительно 0,1 до приблизительно 10% агента, способствующего проникновению, и от приблизительно 85 до приблизительно 99,8% летучего растворителя в пересчете на массу. Предпочтительно, когда агент, способствующий проникновению в кожу, не раздражает кожу реципиента. Таким образом, способствующие агенты на основе терпенов, бензилового спирта и других растворителей могуг быть не приемлемыми для применения в композициях, соответствующих данному изобретению, поскольку они раздражают кожу, проникая в живые участки кожи в заметных количествах. Необязательно носитель может содержать дополнительные фармацевтические наполнители, например гелеобразующие агенты, такие как карбопол и производные целлюлозы. Профиль скорости высвобождения физиологически активного агента из аморфного отложения в систему кровообращения большого круга может быть направленно модифицирован с целью регуляции профиля доставки физиологически активного агента в кровообращении большого круга для достижения желательного терапевтического эффекта. Профиль скорости высвобождения нулевого порядка достигается путем образования аморфного отложения, которое имеет повышенное соотношение проникновения в кожу агента, способствующего проникновению в кожу, относительно физиологически активного агента и/или, альтернативно, путем выбора агента, способствующего проникновению в кожу или комбинации агентов, способствующих проникновению в кожу, относительно которых физиологически активный агент имеет повышенную насыщающую растворимость. Таким образом происходит модификация тенденции выхода физиологически активного агента из аморфного отложения и ограничивается изначальный взрывной выход физиологически активного агента в кожу. Абсолютное количество физиологически активного агента в кожном резервуаре также может быть увеличено, чтобы снизить протяженность плато профиля скорости высвобождения ко второй половине интервала между введениями препарата. Относительное количество кристаллического отложения к аморфному отложению также можно модифицировать с целью достижения желательного профиля скорости высвобождения. Профиль скорости высвобождения физиологически активного агента из аморфного отложения в кровообращение большого круга предпочтительно приближается к нулевому порядку в естественных условиях, чтобы снизить соотношение максимальной концентрации (Сmax) и средней концентрации (Cavg) для физиологически активного агента во время интервала между введениями препарата. Таким образом,возможно уменьшить потенциальные побочные эффекты, связанные с повышенными соотношениями Сmax к Cavg. Например, соотношения Сmax к Cavg менее 2 предпочтительны, а еще более предпочтительны менее 1,5. Напротив, профиль скорости высвобождения первого порядка может быть достигнут посредством выбора агента, способствующего проникновению в кожу, или комбинации агентов, способствующих проникновению в кожу, где физиологически активный агент имеет более низкую насыщающую растворимость, что, таким образом, повышает тенденцию к выходу физиологически активного агента из аморфного отложения и увеличивает изначальный взрывной выход физиологически активного агента с проникновением через кожу. Абсолютное количество физиологически активного агента на единицу площади также может быть снижено в кожном резервуаре для того, чтобы увеличить протяженность плато в профиле скорости высвобождения до второй половины интервала между введениями препарата. Относительное количество кристаллического отложения и аморфного отложения также может быть модифицировано для достижения желательного профиля скорости высвобождения. Предпочтительно, когда профиль скорости высвобождения физиологически активного агента из аморфного отложения в большой круг кровообращения имеет, в основном, первый порядок в естественных условиях, чтобы повысить соотношение Сmax к Cavg и уменьшить время наличия максимальной системной концентрации (tmax) для физиологически активного агента в течение интервала между введениями препарата. В данном случае возможно уменьшить время до возникновения терапевтического ответа или повысить интенсивность терапевтического ответа в интервале после введения однократной дозы. Например, соотношения Сmax к Сavg, превышающие 1,5 и более предпочтительно превышающие 2, и tmax меньше чем от 4 до 6 ч и более предпочтительно меньше чем от 2 до 3 ч. Далее изобретение будет описано со ссылкой на последующие примеры. Следует понимать, что примеры приведены как иллюстрация изобретения и что они никоим образом не ограничивают объем изобретения. Примеры Способ диффузии in vitro различных физиологически активных агентов через кожу человека используют в соответствии с изобретением для оценки действия на чрескожную доставку лекарственного препарата при добавлении различных агентов, способствующих проникновению в кожу.-6 009024 Методы дифференциальной сканирующей калориметрии (DCS) и светлопольной микроскопии используют в соответствии с изобретением для оценки, является ли или не является композиция аморфной после испарения летучей жидкости и, при необходимости, объема присутствующего аморфного материала. Исследования диффузии Эксперименты по диффузии in vitro проводят в проточных диффузионных камерах из нержавеющей стали с использованием человеческого эпидермиса, поддерживаемого при 32 С. Рецепторный раствор состоит из 10% этанола в 0,002% растворе азида натрия. В каждую из четырех камер добавляют раствор против закупоривания в конечной дозе 5 мкл/камеру. Образцы собирают в соответствующих временных точках и анализируют при использовании высокоэффективной жидкостной хроматографии с обращенной фазой (RP-HPLC). Таблица 1 Условия HPLC для анализа рецепторного раствора Дифференциальная сканирующая калориметрия (DCS)DSC используют для определения изменений в физико-химических свойствах соединений в комбинации с агентом, способствующим проникновению в кожу после испарения летучей жидкости. Метод дает возможность определить оптимальное соотношение лекарственного препарата и способствующего агента, которое приводит к образованию измененной аморфной формы для усиления чрескожного всасывания (т.е. повышает уровень чрескожной доставки лекарственного препарата). Очевидность аморфной природы смеси соединений вытекает из пониженной температуры плавления смеси соединений относительно температуры плавления любого из индивидуальных компонентов смеси. Кроме того, снижение высоты пика и теплоты энтальпии вместе с расширением переходной температуры плавления также являются характеристиками, присущими аморфным соединениям. Во-первых, представленные смеси молярных соотношений физиологически активного агента и агента, способствующего проникновению в кожу, готовят в 95% этаноле в соответствии с представленными композициями. Алюминиевую микрокювету для DSC объемом 10 мкл помещают в алюминиевую кювету для DSC объемом 50 мкл и пипеткой вносят аликвоты по 5 мкл каждого состава в кювету объемом 10 мкл. Летучей жидкости (95% этанол) дают испариться и снова вводят аликвоты до тех пор, пока-7 009024 не остается достаточное количество остатка физиологически активного агента и агента, способствующего проникновение в кожу. Кюветы выдерживают при комнатной температуре и 33% относительной влажности в течение 24 ч(что имитирует типичный используемый интервал между введениями 1 раз в день), после чего кюветы закрывают и герметично запечатывают. Затем проводят DSC под током азота при 10 С/мин в температурном диапазоне, который зависит от лекарственного препарата. Светлопольная микроскопия Светлопольную микроскопию используют для определения потенциала кристаллизации/образования аморфного твердого вещества различных физиологически активных агентов в комбинации с агентом,способствующим проникновению в кожу, после испарения летучей жидкости (95% этанол). Это дает возможность определить оптимальное соотношение лекарственного препарата и агента, способствующего проникновению в кожу, в сочетании с DSC. Аликвоты каждого препарата по 5 мкл пипеткой наносят на чистое предметное стекло при 32 С/относительной влажности окружающей среды. После испарения носителя в виде летучей жидкости (95% этанола, об./об.) предметное стекло анализируют под микроскопом Leica Wild, соединенным с диагностической камерой SPOT, в течение 1-24 ч. При оценке природы смеси, остающейся через 24 ч, объемное соотношение аморфного материала может быть установлено визуально. Пример 1. На фиг. 1 представлены органические и неорганические показатели для типичных агентов, способствующих проникновению, которые могут быть использованы в соответствии с изобретением (определяют методом, описанным Fujita в статье "Получение органических соединений по концептуальной схеме" ("Production of organic compounds by a Conceptional Diagram") (см. Chem. Pharm. Bull., Tokyo, 2: 163,(1954. Область 1 представляет собой агенты, способствущие проникновению в кожу, на основе растворителей, которые склонны раздражать кожу или испаряться из кожи при использовании незакупоривающих накожных систем или систем для чрескожной доставки лекарственных препаратов. Предпочтительные агенты, способствущие проникновению, взяты из области 2 концептуальной схемы (в том виде, как она исходно предложена Hori и соавт. (см. статью в J. Pharm. Pharmacol., 42: 71-72, (1990. Предпочтительная область распространяется на неорганические показатели от приблизительно 0 до приблизительно 200 и органические показатели от приблизительно 200 до приблизительно 400. Пример 2. В данном примере исследуют композиции, соответствующие изобретению, образованные при комбинировании буспирона с некоторыми агентами, способствующими проникновению, которые имеют ряд органических и неорганических характеристик. Физико-химические свойства буспирона представлены в следующей таблице.(CPL). Что касается фиг. 1, на ней представлен график органического показателя относительно неорганического показателя для потенциальных агентов, способствующих проникновению. Органические и неорганические покзатели определяют согласно процедуре, предложенной в статье Fujita A. (см. Chem.Pharm. Bull. (Tokyo), 2: 173, (1954. Соединения 2-н-нонил-1,3-диоксолан, додецил 2-(N,Nдиметиламино)пропионат (DDAIP) и циклопентадеканон (CPL) демонстрируют интервал органического и неорганического показателя в области 2, в основном, характеризующийся неорганическими показателями от 0 до 200 и органическими показателями от 200 до 400. Все препараты получают путем точного взвешивания соответствующего количества физиологически активного агента и агента, способствующего проникновению, в волюметрическую колбу и доведения до объема этанолом (95% об./об.). Контрольные препараты: буспирон-основание. Тест-препараты. Все содержащие способствующий агент (тест)-препараты готовят в молярных соотношениях 1:1 и 4:1 лекарственного препарата и агента, способствующего проникновению, пока не указано иначе: буспирон:изопропилмиристат (IPM),-8 009024 буспирон:додецил 2-(N,N-диметиламино)пропионат (DDAIP),буспирон:2-н-нонил-1,3-дилксалан (SEPA),буспирон:лаурокапрам (Азон, AZ),буспирон:миристиновая кислота (МА),буспирон:2-этилацетат (ЕА). 2-Этилацетат (ЕА), который имеет молекулярную массу 88,1 Да и температуру кипения 77,1 С,включен в качестве примера агента, способствующего проникновению в кожу, на основе растворителя,не являющегося предпочтительным для применения в данном изобретении, поскольку он обычно раздражает кожу или улетучивается с нее при использовании незакупоривающих накожных систем или систем для чрескожной доставки лекарственных препаратов. Профили DSC определяют для контроля и тест-препаратов чистого буспирона, и буспирона с рядом определенных способствующих агентов при молярном соотношении 1:1. Испарение растворителя для каждого препарата приводит к уменьшению температуры плавления. На фиг. 2 демонстрируют характеристики, присущие аморфным соединениям, например снижение температуры плавления, Н и высоты пика и расширение переходной температуры плавления. Анализ DSC буспирона с каждым способствующим агентом при молярном соотношении 1:1 и 4:1 показывает снижение температуры плавления,при этом соотношение смесь буспирон:азон 1:1, которая остается в форме масла, не имеет, таким образом, температуры плавления (см. фиг. 3). На фиг. 3 демонстрируют также неспособность способствующего агента на основе растворителя (2 этилацетат) достоверно снижать температуру плавления буспирона. Данный недостаток сочетается с вероятностью раздражения кожи, вледствие чего способствующие агенты на основе растворителя не являются предпочтительными для незакупоривающих систем для чрескожной доставки, соответствующих данному изобретению. Микроскопия каждой двухкомпонентной смеси подтверждает частично аморфное состояние буспирона. В большинстве случаев наблюдают неравномерно распределенную пленку, в которой встречается немного маленьких кристаллов или другие композиции с небольшим количеством выступающих из них игольчатых кристаллов. Эксперименты по диффузии (см. табл. 2) проводят на различных составах на основе 95% этанола,содержащих буспирон и 2-н-нонил-1,3-диоксолан. Диффузия буспирона через кожу человека (эпидермис) подтверждает повышение проницаемости буспирона при соотношении 1:1 с 2-н-нонил, 1,3-диоксоланом до 2,6. Однако соотношение 4:1 не демонстрирует значительного усиления (см. табл. 2, фиг. 4). Таблица 2 Сводные данные по среднему кумулятивному количеству,проникающему через эпидермис человека в течение 24 ч (Q24h) (мкг/см 2) для различных препаратовSEM - стандартная ошибка. Пример 3. На фиг. 5 представляют кумулятивное количество буспирона, диффундирующего через эпидермис человека, и время, полученное для контроля, содержащего буспирон в летучей жидкости (95% этанол), и для композиции, содержащей буспирон и способствующий агент октилсалицилат в той же самой летучей жидкости. Добавление октилсалицилата в препарат чрескожного спрея вызывает значительное увеличение количества буспирона, диффундирующего через кожу в течение 24 ч (р 0,05). Пример 4. Аморфное отложение, образующееся in situ композициями, соответствующими примерам 2 и 3,-9 009024 приводит в результате к повышенной доставке буспирона через кожу. Профиль доставки через кожу для данных усиленных аморфных композиций может быть либо профилем доставки нулевого порядка, либо профилем доставки первого порядка, при этом любая из данных ситуаций желательна для конкретной фармакотерапии. Композиция без способствующего агента демонстрирует слабое усиление проникновения буспирона через кожу и, как следствие, низкие количества лекарственного препарата, проникающие через кожу. На фиг. 6 а представляют профиль диффузии, который может быть получен при чрескожном введении буспирона нулевого и первого порядка в соответствии с изобретением, и на фиг. 6b представлен аппроксимированный профиль концентрации в плазме, который будет соответствовать каждому из профилей скорости доставки, представленных на фиг. 6 а. Профили диффузии исследованных аморфных отложений подтверждают повышение уровня доставки активного агента через кожу. Скорость доставки может быть модифицирована, чтобы она соответствовала желательной фармакотерапии, либо путем изменения агента, способствующего проникновение в кожу, который используют в композиции, либо путем изменения соотношения лекарственного препарата и способствующего агента в композиции. Пример 5. На фиг. 7 и 8 показана способность модифицировать скорость доставки фентанила путем изменения агента, способствующего проникновению. Вследствие этого тенденция к выходу может быть модифицирована, чтобы она соответствовала требующейся скорости доставки. Стабильная скорость доставки нулевого порядка в случае фентанила была бы желательной при лечении хронической боли. Пример 6. На фиг. 9 и 10 представлена возможность модифицировать скорость доставки гранисетрона путем изменения агента, способствующего проникновению, и/или соотношения лекарственного препарата и способствующего агента в композиции. Пример 7. Соотношение лекарственного препарата и агента, способствующего проникновению, варьируют с целью модуляции скорости доставки тестостерона in vitro с использованием носителей в виде чрескожных спреев. Различные концентрации тестостерона (Tes) и агентов, способствущих проникновению в кожу - октилсалицилата (OSAL) или падимата О (PadO), наносят на сброшенную змеиную кожу in vitro из конечного объема носителя (5 мкл/см 2), рассчитанного для имитации дозировки in vivo. Скорость и степень проникновения лекарственного препарата моделируют с использованием однокамерной модели с константой скорости первого порядка (см. статью Kubota K.J., Pharm. Sci., 80, 502-504, (1991. Модель диффузии in vitro позволяет точно и быстро охарактеризовать профили диффузии с помощью только трех параметров: общее % проникновение (А, измеряют в мкг), константа скорости (альфа, измеряют в ч-1) и задержка во времени (I, измеряют в ч). Варьирование соотношения Tes к Osal значительно изменяет А и I (р 0,001) и повышает нагрузку Tes в препарате PadO, что в результате приводит к доставке нулевого порядка in vitro в течение 48 ч, как показано на фиг. 11 (предполагается, что растворимость лекарственного препарата в способствующем агенте играет роль в высвобождении лекарственного препарата). Для практических целей разработки композиций простая модель диффузии с камерами может быть использована для оптимизации соотношения лекарственного препарата и способствующего агента с целью модуляции проникновения лекарственного препарата в кожу. Пример 8. Концентрации в плазме свободного тестостерона определяют у женщин в постменопаузе в стабильном состоянии после введения композиции чрескожного спрея, содержащей тестостерон 5% мас./об. и октилсалицилат 8% мас./об. в 95% этаноле. Получают профиль доставки нулевого порядка и представляют данные на фиг. 12. Пример 9. На фиг. 13 представлены результаты фармакокинетических исследований на 6 нормальных здоровых добровольцах мужского пола, в которых изучают введение однократной дозы с помощью чрескожного спрея с последующим периодом выведения, затем дают однократную пероральную дозу буспирона 15 мг (3 таблетки х 5 мг; BuSpar) с последующим периодом выведения, после которого добровольцы получают множество чрескожных доз 1 раз в день до достижения стабильного состояния. Чрескожная доза для введения 1 раз в день составляет 4 обрызгивания 91 мкл дозированного чрескожного спрея буспирона (MDTS), содержащего 4% мас./об. буспирона и 5% мас./об. октилсалицилата, которые наносят на предплечье. Для однократной дозы пероральной таблетки буспирона (15 мг) средний период полувыведения составляет 2 ч и среднее tmax составляет 0,9 ч. Среднее Cavg составляет 0,15 нг/мл, и среднее Cmax составляет 1,3 нг/мл при рассчитанном соотношении Cmax и Cavg, имеющем значение 8,7. Напротив, для следующей дозы для введения 1 раз в день чрескожного спрея буспирона, соответствующего изобретению, среднееCavg составляет 0,32 нг/мл и среднее Cmax составляет 0,49 нг/мл при рассчитанном соотношении Cmax иCavg, имеющим значение 1,5, и среднем tmax 9,3 ч. Можно ожидать, что композиция буспирона, соответствующая данному примеру, имеет определенные преимущества при использовании для лечения у человека и животных расстройства типа общей тревоги и расстройства типа гиперактивности при дефиците- 10009024 внимания, причем стабильный нулевой порядок чрескожной доставки лекарственного препарата и избежание высокого значения концентрации Cmax, обеспечиваемые изобретением, в результате благоприятно сказываются на снижении побочных эффектов, таких как желудочно-кишечные расстройства, сонливость, нарушение навыков вождения или двигательной способности и/или нарушение когнитивной функции. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для чрескожной доставки, содержащая по меньшей мере один физиологически активный агент, по меньшей мере один агент, способствующий проникновению через кожу, и летучий носитель, содержащий фармацевтически приемлемый растворитель, испаряющийся при физиологической температуре, причем указанная комбинация физиологически активного агента и агента, способствующего проникновению через кожу, и молярное соотношение физиологически активного агента и агента, способствующего проникновению через кожу, являются такими, что указанная композиция образует аморфное отложение, содержащее агент, способствующий проникновению через кожу, и физиологически активный агент и определяемое посредством дифференциальной сканирующей калометрии и светлопольной микроскопии после испарения летучего носителя при физиологической температуре. 2. Фармацевтическая композиция для чрескожной доставки, состоящая по меньшей мере из одного физиологически активного агента, по меньшей мере одного агента, способствующего проникновению через кожу, и летучего носителя, содержащего фармацевтически приемлемый растворитель, испаряющийся при физиологической температуре, причем указанная комбинация физиологически активного агента и агента, способствующего проникновению через кожу, и молярное соотношение физиологически активного агента и агента, способствующего проникновению через кожу, являются такими, что указанная композиция образует аморфное отложение, содержащее агент, способствующий проникновению через кожу, и физиологически активный агент и определяемое посредством дифференциальной сканирующей калометрии и светлопольной микроскопии после испарения летучего носителя при физиологической температуре. 3. Фармацевтическая композиция по п.1 или 2, которая имеет профиль скорости высвобождения физиологически активного агента, обеспечивающий соотношение максимальной концентрации (Cmax) и средней концентрации (Cavg) физиологически активного агента в интервале между введениями препарата в пределах от 1 до 5. 4. Фармацевтическая композиция по любому из пп.1-3, имеющая профиль скорости высвобождения физиологически активного агента, в основном, нулевого порядка или первого порядка в любом интервале между введениями, подходящем для получения терапевтического эффекта физиологически активного агента. 5. Фармацевтическая композиция по п.1 или 2, имеющая профиль скорости высвобождения физиологически активного агента нулевого порядка с уменьшением соотношения максимальной концентрации(Cmax) и средней концентрации (Cavg) физиологически активного агента до значения меньше 2 в интервале между введениями и ослаблением потенциальных побочных эффектов, связанных с повышенными соотношениями Cmax к Cavg. 6. Фармацевтическая композиция по п.1 или 2, имеющая профиль скорости высвобождения физиологически активного агента нулевого порядка с уменьшением соотношения максимальной концентрации(Cmax) и средней концентрации (Cavg) физиологически активного агента до значения меньше 1,5 в интервале между введениями и ослаблением потенциальных побочных эффектов, связанных с повышенными соотношениями Cmax к Cavg. 7. Фармацевтическая композиция по п.1 или 2, имеющая профиль скорости высвобождения физиологически активного агента первого порядка с увеличением соотношения Cmax и Cavg до значения, превышающего 1,5, сокращением времени максимальной системной концентрации (tmax) физиологически активного агента до значения менее 6 ч в интервале между введениями и сокращением времени до возникновения терапевтического ответа или усилением терапевтического ответа после введения однократной дозы. 8. Фармацевтическая композиция по п.1 или 2, имеющая профиль скорости высвобождения физиологически активного агента первого порядка с увеличением соотношения Cmax и Cavg до значения, превышающего 2, сокращением времени максимальной системной концентрации (tmax) физиологически активного агента до значения менее 3 ч в интервале между введениями и сокращением времени до возникновения терапевтического ответа или усилением терапевтического ответа после введения однократной дозы. 9. Фармацевтическая композиция по любому из пп.1-8, в которой физиологически активный агент представляет собой стероид, производное гормона, опиоидный анальгетик, тромболитик, препарат против тошноты, транквилизатор, соединение против мигрени, антигипертензивный агент, противомалярийное соединение, бронходилататор, агент против болезни Альцгеймера, нейролептик или антипсихотиче- 11009024 ский агент, агент против болезни Паркинсона, антихолинергический, антиандрогенный или анорексический агент. 10. Фармацевтическая композиция по любому из пп.1-8, в которой физиологически активный агент представляет собой тестостерон, эстрадиол, этинилэстрадиол, несторон, левоноргестрел, лацидипин, норэтистерон ацетат, буспирон, фентанил, бупренорфин, ропинирол, скополамин, гранисетрон, амлодипин,оксибутинин, ривастигмин, ризатриптан, примахин, флуоксетин, пароксетин, такрин, N-0923 и мазиндол. 11. Фармацевтическая композиция по любому из пп.1-10, в которой носитель содержит гидрофторуглеродный пропеллент, причем наружное нанесение композиции в виде аэрозоля обеспечивает образование аморфного отложения при испарении летучего носителя. 12. Фармацевтическая композиция по п.11, в которой гидрофторуглеродный пропеллент представляет собой HFC-134a. 13. Фармацевтическая композиция по п.11, в которой летучий растворитель и пропеллент образуют однофазный раствор активного агента. 14. Фармацевтическая композиция по любому из пп.1-13, содержащая от 0,1 до 10 мас.% физиологически активного агента, от 0,1 до 10 мас.% агента, способствующего проникновению через кожу, и от 85 до 99,8 мас.% летучего носителя. 15. Фармацевтическая композиция по п.11, в которой гидрофторуглеродный пропеллент составляет от 15 до 50 об.% фармацевтической композиции в целом. 16. Фармацевтическая композиция по п.1 или 2, в которой физиологически активный агент имеет молекулярную массу менее 600 Да и температуру плавления менее 200 С. 17. Фармацевтическая композиция по любому из пп.1-16, в которой агент, способствующий проникновению в кожу, характеризуется значением органического показателя от 200 до 400 и значением неорганического показателя от 0 до 200. 18. Фармацевтическая композиция по любому из пп.1-16, в которой агент, способствующий проникновению в кожу, представляет собой липофильную жидкость, характеризующуюся давлением паров ниже 10 мм рт.ст. при атмосферном давлении и температуре 32 С и молекулярной массой в интервале от 200 до 400 Да. 19. Фармацевтическая композиция по любому из пп.1-16, в которой агенты, способствущие проникновению, содержат по меньшей мере одно из соединений, выбранных из групп, состоящих из жирных кислот, сложных эфиров жирных кислот, жирных спиртов, гликолей и сложных эфиров гликолей,1,3-диоксаланов и 1,3-диоксанов, макроциклических кетонов, содержащих по меньшей мере 12 атомов углерода, оксазолидинонов и производных оксазолидинонов, сложных эфиров алкил-2-(N,N-дизамещенный амин)алканоатов, (N,N-дизамещенный амин)алканолалканоатов и их смесей. 20. Фармацевтическая композиция по любому из пп.1-16, в которой агент, способствующий проникновению через кожу, включает, по меньшей мере, октилсалицилат или падимат О. 21. Фармацевтическая композиция по любому из пп.1-16, в которой агент, способствующий проникновению через кожу, выбран из перечня, включающего олеиновую кислоту, олеиловый спирт, циклопентадеканон, сорбитанмоноолеат, глицеролмоноолеат, пропиленгликольмонолаурат, полиэтиленгликольмонолаурат, 2-н-нонил-1,3-диоксолан, додецил-2-(N,N-диметиламин)пропионат или его солевые производные, 2-этилгексил-2-этилгексаноат, изопропилмиристат, диметилизосорбид, 4-децилоксазолидинон-2-он, 3-метил-4-децилоксазолидинон-2-он и их смеси. 22. Фармацевтическая композиция по любому из пп.1-21, в которой растворитель содержит этанол,изопропанол или их смесь. 23. Фармацевтическая композиция по любому из пп.1-22, в которой молярное соотношение физиологически активного агента и агента, способствующего проникновению через кожу, составляет от 1:20 до 20:1. 24. Фармацевтическая композиция по любому из пп.1-23, предназначенная для размещения в камере устройства для нанесения композиции распылением, содержащего клапан подачи композиции из камеры, наконечник для диспергирования композиции в виде аэрозоля и средства дозирования аэрозоля из наконечника. 25. Применение по меньшей мере одного физиологически активного агента, по меньшей мере одного агента, способствующего проникновению через кожу, и летучего носителя, содержащего фармацевтически приемлемый растворитель, испаряющийся при физиологической температуре, для приготовления фармацевтической композиции для чрескожного введения физиологически активного агента, причем указанная комбинация физиологически активного агента и агента, способствующего проникновению через кожу, и молярное соотношение физиологически активного агента и агента, способствующего проникновению через кожу, являются такими, что указанная композиция образует аморфное отложение,содержащее агент, способствующий проникновению через кожу, и физиологически активный агент и определяемое посредством дифференциальной сканирующей калометрии и светлопольной микроскопии после испарения летучего носителя при физиологической температуре. 26. Применение по п.25, при котором фармацевтическая композиция представляет собой компози- 12009024 цию в виде аэрозоля, обеспечивающую при нанесении ее на кожу субъекта профиль скорости высвобождения физиологически активного агента в основном нулевого порядка, с уменьшением потенциальных побочных эффектов, связанных с повышенными максимальными концентрациями активного агента в кровотоке (Cmax) в период между введениями, при поддержании эффективных средних концентраций активного агента (Cavg) в кровотоке. 27. Применение по п.25, при котором фармацевтическая композиция представляет собой композицию в виде аэрозоля, обеспечивающую при нанесении ее на кожу субъекта профиль скорости высвобождения физиологически активного агента, в основном, нулевого порядка за счет сокращения времени до возникновения терапевтического ответа на активный агент или повышение уровня терапевтического ответа на активный агент посредством уменьшения времени до получения максимальной концентрации активного агента в кровотоке (tmax) и повышенным соотношением Cmax и Cavg в период между введениями.
МПК / Метки
МПК: A61K 9/12, A61K 9/06, A61K 9/00
Метки: активного, фармацевтическая, доставки, агента, варианты, чрескожной, композиция
Код ссылки
<a href="https://eas.patents.su/18-9024-farmacevticheskaya-kompoziciya-dlya-chreskozhnojj-dostavki-aktivnogo-agenta-varianty.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция для чрескожной доставки активного агента (варианты)</a>
Предыдущий патент: Селективные модуляторы рецептора, активируемого пролифератором пероксисом
Следующий патент: Применение ферментированного экстракта зародышей пшеницы в кормлении животных
Случайный патент: Сопло для сдвига бурового раствора при высоком давлении