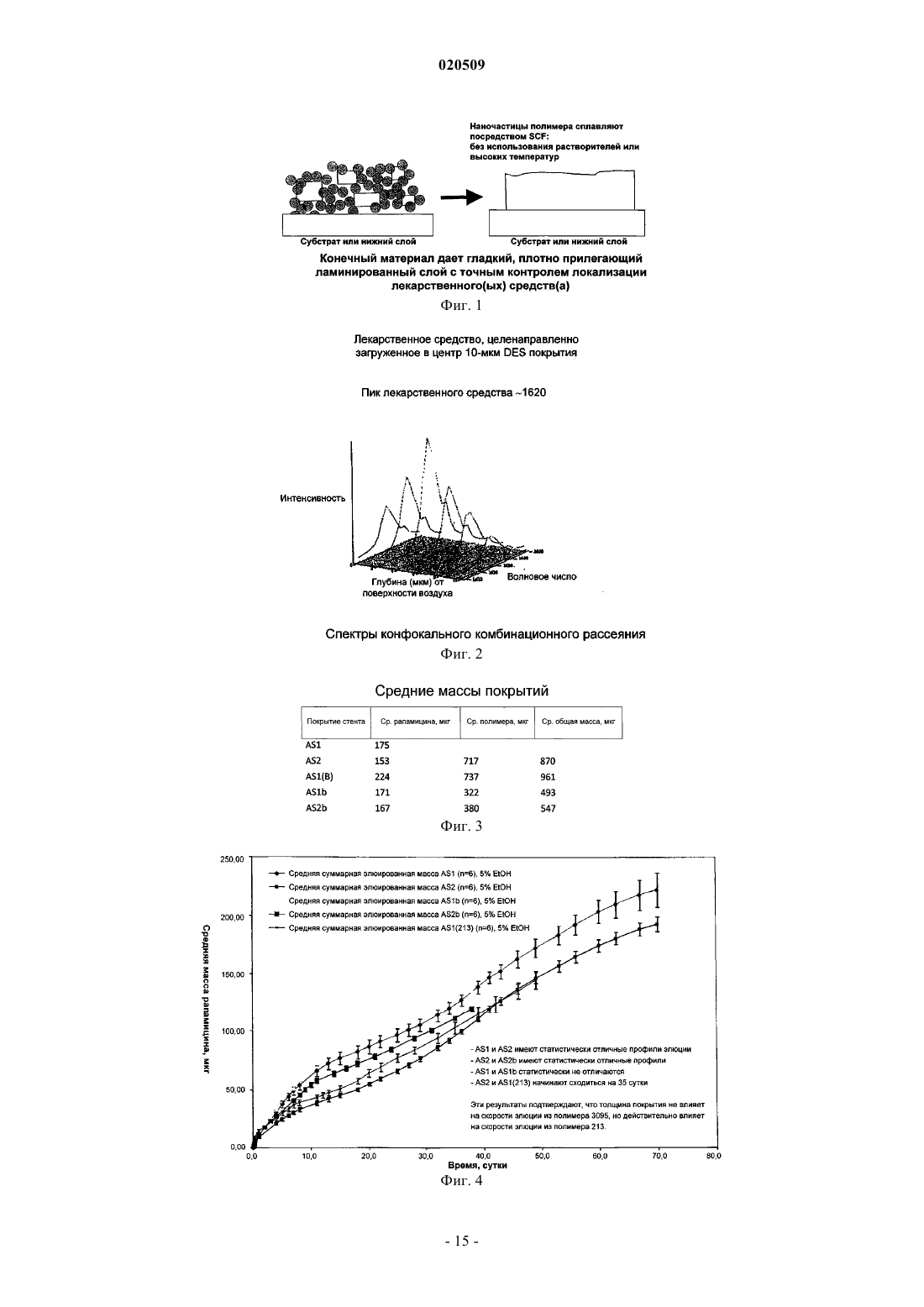
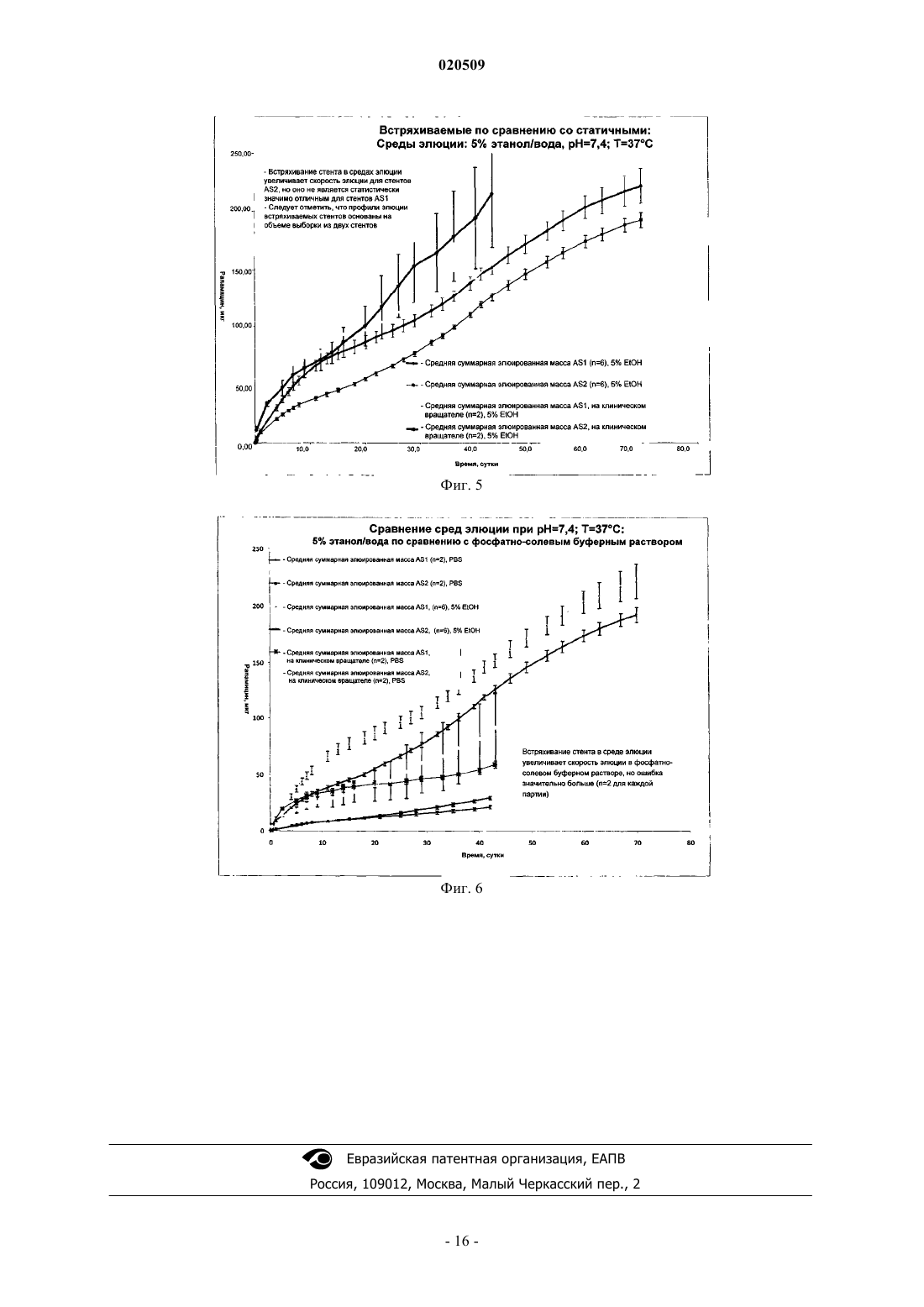
Стенты с биоразлагаемыми слоями
Формула / Реферат
1. Коронарный стент с покрытием, содержащий:
а) стентовый каркас;
б) ряд слоев, нанесенных на стентовый каркас в форме сухого порошка, с образованием стента с покрытием, где по меньшей мере один из слоев содержит биорассасывающийся полимер и по меньшей мере один из слоев содержит один или более чем один активный агент, где по меньшей мере часть активного агента находится в кристаллической форме, и где формирование слоев включает спекание в условиях, которые, по существу, не изменяют активность активного агента,
где биорассасывающийся полимер выбран из группы, включающей сополимер лактид-гликолид (PLGA), полигликолид (PGA), поли-l-лактид (LPLA), поли-dl-лактид (DLPLA), поли-e-капролактон (PCL), полидиоксанон (PDO), сополимер гликолид-триметиленкарбонат (PGA-TMC), сополимеры dl-лактид-гликолид (85/15) (DLPLG), 75/25 DLPLG, 65/35 DLPLG, 50/50 DLPLG, политриметиленкарбонат (ТМС), сополимер 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA)), сополимер l-лактид-гликолид (PGA-LPLA), сополимер dl-лактид-гликолид (PGA-DLPLA), сополимер l-лактид-dl-лактид (LPLA-DLPLA) и сополимер гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC).
2. Стент по п.1, где по меньшей мере один из слоев содержит биорассасывающийся сополимер PLGA и по меньшей мере один из слоев содержит рапамицин, где по меньшей мере часть рапамицина находится в кристаллической форме.
3. Стент по п.2, где рапамицин является по меньшей мере на 50% кристаллическим.
4. Стент по п.2, где рапамицин является по меньшей мере на 90% кристаллическим.
5. Стент по п.2, где рапамицин и полимер находятся в одном и том же слое, в отдельных слоях или образуют перекрывающиеся слои.
6. Стент по п.2, где ряд слоев включает пять слоев, нанесенных в следующей последовательности: первый слой полимера, первый слой рапамицина, второй слой полимера, второй слой рапамицина и третий слой полимера.
7. Стент по п.6, где стентовый каркас изготовлен из материала, содержащего следующее: 0,05-0,15 С, 1,00-2,00 Mn, 0,040 Si, 0,030 Р, 0,3 S, 19,00-21,00 Cr, 9,00-11,00 Ni, 14,00-16,00 W, 3,00 Fe и Со остальное, в процентном содержании по массе.
8. Стент по п.6, где стентовый каркас изготовлен из материала, содержащего следующее: максимум примерно 0,025 С, максимум 0,15 Mn, максимум 0,15 Si, максимум 0,015 Р, максимум 0,01 S, максимум 19,00-21,00 Cr, 33-37 Ni, 9,0-10,5 Mo, максимум 1,0 Fe, максимум 1,0 Ti и Со остальное, в максимальном процентном содержании по массе.
9. Стент по п.6, где слои лекарственного средства, по существу, не содержат полимер и слои полимера, по существу, не содержат лекарственное средство.
10. Стент по п.1, где биорассасывающийся полимер выбран из группы, включающей полигликолид (PGA), поли-l-лактид (LPLA), поли-dl-лактид (DLPLA), поли-e-капролактон (PCL), полидиоксанон (PDO), сополимер гликолид-триметиленкарбонат (PGA-TMC), сополимеры dl-лактид-гликолид (85/15 DLPLG), 75/25 DLPLG, 65/35 DLPLG, 50/50 DLPLG, политриметиленкарбонат (ТМС), сополимер 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA)).
11. Способ изготовления коронарного стента с покрытием, включающий:
а) предоставление стентового каркаса;
б) нанесение на стентовый каркас ряда слоев с образованием стента с покрытием, где по меньшей мере один из слоев содержит биорассасывающийся полимер и где нанесение каждого слоя из ряда слоев на стентовый каркас включает следующие стадии:
подачу через первое сопло по меньшей мере одного фармацевтического агента и/или по меньшей мере одного активного биологического агента в форме сухого порошка;
подачу через первое сопло или через второе сопло по меньшей мере одного полимера в форме сухого порошка;
нанесение на каркас частиц полимера и фармацевтического агента и/или активного биологического агента, где между каркасом и частицами полимера и фармацевтического агента и/или активного биологического агента поддерживается электрический потенциал, с образованием слоя и
спекание полученного слоя при условиях, которые, по существу, не изменяют морфологию фармацевтического агента и/или активность биологического агента,
где биорассасывающийся полимер выбран из группы, включающей сополимер лактид-гликолид (PLGA), полигликолид (PGA), поли-l-лактид (LPLA), поли-dl-лактид (DLPLA), поли-e-капролактон (PCL), полидиоксанон (PDO), сополимер гликолид-триметиленкарбонат (PGA-TMC), сополимеры dl-лактид-гликолид (85/15 DLPLG), 75/25 DLPLG, 65/35 DLPLG, 50/50 DLPLG, политриметиленкарбонат (ТМС), сополимер 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA)), сополимер l-лактид-гликолид (PGA-LPLA), сополимер dl-лактид-гликолид (PGA-DLPLA), сополимер l-лактид-dl-лактид (LPLA-DLPLA) и сополимер гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC).
12. Способ изготовления коронарного стента, включающий:
а) предоставление стентового каркаса;
б) нанесение на стентовый каркас ряда слоев с образованием коронарного стента, где по меньшей мере один из слоев содержит биорассасывающийся полимер, по меньшей мере один фармацевтический агент с терапевтически желательной морфологией и/или по меньшей мере один активный биологический агент и где нанесение каждого слоя из ряда слоев на стентовый каркас включает следующие стадии:
1) подачу через первое сопло по меньшей мере одного фармацевтического агента и/или по меньшей мере одного активного биологического агента в форме сухого порошка;
2) получение раствора сверхкритической или околосверхкритической жидкости, содержащего по меньшей мере один растворитель сверхкритической жидкости и по меньшей мере один полимер, и подачу через второе сопло полученного раствора сверхкритической или околосверхкритической жидкости при условиях, достаточных для образования твердых частиц полимера;
3) нанесение на каркас частиц полимера и фармацевтического агента и/или активного биологического агента, где между каркасом и частицами полимера и фармацевтического агента и/или активного биологического агента поддерживается электрический потенциал, с образованием слоя и
4) спекание полученного слоя при условиях, которые, по существу, не изменяют морфологию указанного фармацевтического агента и/или активность биологического агента,
где биорассасывающийся полимер выбран из группы, включающей сополимер лактид-гликолид (PLGA), полигликолид (PGA), поли-l-лактид (LPLA), поли-dl-лактид (DLPLA), поли-e-капролактон (PCL), полидиоксанон (PDO), сополимер гликолид-триметиленкарбонат (PGA-TMC), сополимеры dl-лактид-гликолид (85/15 DLPLG), 75/25 DLPLG, 65/35 DLPLG, 50/50 DLPLG, политриметиленкарбонат (ТМС), сополимер 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA)), сополимер l-лактид-гликолид (PGA-LPLA), сополимер dl-лактид-гликолид (PGA-DLPLA), сополимер l-лактид-dl-лактид (LPLA-DLPLA) и сополимер гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC).
13. Способ изготовления коронарного стента, включающий:
а) предоставление стентового каркаса;
б) нанесение на стентовый каркас ряда слоев с образованием коронарного стента, где по меньшей мере один из слоев содержит биорассасывающийся полимер, по меньшей мере один фармацевтический агент с терапевтически желательной морфологией и/или по меньшей мере один активный биологический агент и где нанесение каждого слоя из ряда слоев на стентовый каркас включает следующие стадии:
1) получение раствора сверхкритической или околосверхкритической жидкости, содержащего по меньшей мере один растворитель сверхкритической жидкости и один или более чем один фармацевтический агент и/или по меньшей мере один активный биологический агент, и подачу через первое сопло полученного раствора сверхкритической или околосверхкритической жидкости при условиях, достаточных для образования твердых частиц одного или более чем одного фармацевтического агента и/или по меньшей мере одного активного биологического агента;
2) получение раствора сверхкритической или околосверхкритической жидкости, содержащего по меньшей мере один растворитель сверхкритической жидкости и по меньшей мере один полимер, и подачу через первое сопло или через второе сопло полученного раствора сверхкритической или околосверхкритической жидкости при условиях, достаточных для образования твердых частиц полимера;
3) нанесение на каркас частиц полимера и фармацевтического агента и/или активного биологического агента, где между каркасом и частицами полимера и фармацевтического агента и/или активного биологического агента поддерживается электрический потенциал, с образованием этого слоя и
4) спекание полученного слоя при условиях, которые, по существу, не изменяют морфологию указанного фармацевтического агента и/или активность указанного биологического агента,
где биорассасывающийся полимер выбран из группы, включающей сополимер лактид-гликолид (PLGA), полигликолид (PGA), поли-l-лактид (LPLA), поли-dl-лактид (DLPLA), поли-e-капролактон (PCL), полидиоксанон (PDO), сополимер гликолид-триметиленкарбонат (PGA-TMC), сополимеры dl-лактид-гликолид (85/15 DLPLG), 75/25 DLPLG, 65/35 DLPLG, 50/50 DLPLG, политриметиленкарбонат (ТМС), сополимер 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA)), сополимер l-лактид-гликолид (PGA-LPLA), сополимер dl-лактид-гликолид (PGA-DLPLA), сополимер l-лактид-dl-лактид (LPLA-DLPLA) и сополимер гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC).
14. Способ по любому из пп.11-13, дополнительно включающий подачу третьего сухого порошка, содержащего второй фармацевтический агент с терапевтически желательной морфологией в форме сухого порошка и/или активный биологический агент, посредством которой на каркас наносят слой, содержащий по меньшей мере два разных фармацевтических агента и/или активных биологических агента, или на каркас наносят по меньшей мере два слоя, каждый из которых содержит один или два разных фармацевтических агента и/или активных биологических агента.
15. Способ по любому из пп.11-13, где каркас является электростатически заряженным.
16. Способ по любому из пп.11-13, где по меньшей мере 50% фармацевтического агента в форме порошка является кристаллическим.
17. Способ по любому из пп.11-13, где биорассасывающийся полимер выбран из группы, включающей полигликолид (PGA), поли-l-лактид (LPLA), поли-dl-лактид (DLPLA), поли-e-капролактон (PCL), полидиоксанон (PDO), сополимер гликолид-триметиленкарбонат (PGA-TMC), сополимеры dl-лактид-гликолид (85/15 DLPLG), 75/25 DLPLG, 65/35 DLPLG, 50/50 DLPLG, политриметиленкарбонат (ТМС), сополимер 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA)).
18. Способ по любому из пп.11-13, включающий нанесение 4, 10, 20, 50 или 100 слоев.
19. Способ по любому из пп.11-13, где указанные слои включают чередующиеся слои лекарственного средства и полимера.
20. Способ по п.19, где слои лекарственного средства, по существу, не содержат полимер и слои полимера, по существу, не содержат лекарственное средство.
Текст
Предложен коронарный стент с покрытием, содержащий: а) стентовый каркас; б) ряд слоев,нанесенных на стентовый каркас в форме сухого порошка с образованием коронарного стента; где по меньшей мере один из слоев содержит биорассасывающийся полимер и по меньшей мере один из слоев содержит один или более чем один активный агент; где по меньшей мере часть активного агента находится в кристаллической форме; где формирование слоев включает спекание в условиях, которые, по существу, не изменяют активность активного агента; и где биорассасывающийся полимер выбран из группы: PLGA, полигликолида (PGA), поли-lлактида (LPLA), поли-dl-лактида (DLPLA), поликапролактона (PCL), полидиоксолана (PDO),PGA-TMC, сополимера dl-лактид-гликолид (85/15) (DLPLG), 75/25 DLPL, 65/35 DLPLG, 50/50 Изобретение относится к способам изготовления стентов, содержащих биорассасывающийся полимер и фармацевтический или биологический агент в порошковой форме на субстрате. Желательно разработать стент, высвобождающий лекарственное средство, с минимальными физическими, химическими и терапевтическими последствиями в сосуде по окончании предписанного периода времени. Этот период времени основан на эффективном заживлении сосуда после открытия блокады посредством PCI (чрескожное коронарное вмешательство)/стентирования (в настоящее время ведущие клиницисты считают, что он составляет 6-18 месяцев). Также желательно разработать стенты, высвобождающие лекарственное средство, с минимальной толщиной поперечного сечения для: (а) гибкости введения, (б) доступа к малым сосудам, (в) минимизации внедрения в стенку сосуда и кровь. Краткое изложение сущности изобретения В одном аспекте настоящего изобретения предложен коронарный стент с покрытием, содержащий: а) стентовый каркас; б) ряд слоев, нанесенных на стентовый каркас в форме сухого порошка, с образованием стента с покрытием, где по меньшей мере один из слоев содержит биорассасывающийся полимер и по меньшей мере один из слоев содержит один или более чем один активный агент, где по меньшей мере часть активного агента находится в кристаллической форме, и где формирование слоев включает спекание в условиях, которые, по существу, не изменяют активность активного агента; где биорассасывающийся полимер выбран из группы: сополимера лактид-гликолид (PLGA), полигликолида (PGA), поли-l-лактида (LPLA), поли-dl-лактида (DLPLA), поликапролактона (PCL), полидиоксанона (PDO), сополимера гликолид-триметиленкарбонат (PGA-TMC), сополимера dl-лактидгликолид (85/15 DLPLG), 75/25 DLPL, 65/35 DLPLG, 50/50 DLPLG, политриметиленкарбоната (ТМС),сополимера 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA, сополимера (lлактид-гликолид (PGA-LPLA), сополимера dl-лактид-гликолид (PGA-DLPLA), сополимера l-лактид-dlлактид (LPLA-DLPLA) и сополимера гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC). В одном из воплощений коронарного стента с покрытием по меньшей мере один из слоев содержит биорассасывающийся сополимер PLGA и по меньшей мере один из слоев содержит рапамицин, где по меньшей мере часть рапамицина находится в кристаллической форме. Предпочтительно, когда рапамицин является по меньшей мере на 50% кристаллическим. Также предпочтительно, когда рапамицин является по меньшей мере на 90% кристаллическим. Предпочтительно, когда рапамицин и полимер находятся в одном и том же слое, в отдельных слоях или образуют перекрывающиеся слои. Предпочтительно,когда ряд слоев включает пять слоев, нанесенных следующим образом: первый слой полимера, первый слой рапамицина, второй слой полимера, второй слой рапамицина и третий слой полимера. Предпочтительно, когда стентовый каркас изготовлен из материала, содержащего следующее: 0,05-0,15 С, 1,00-2,00Mn, 0,040 Si, 0,030 Р, 0,3 S, 19,00-21,00 Cr, 9,00-11,00 Ni, 14,00-16,00 W, 3,00 Fe и Со (остальное), в процентном содержании по массе. Также предпочтительно, когда стентовый каркас изготовлен из материала, содержащего следующее: максимум примерно 0,025 С, максимум 0,15 Mn, максимум 0,15 Si, максимум 0,015 Р, максимум 0,01 S, максимум 19,00-21,00 Cr, 33-37 Ni, 9,0-10,5 Mo, максимум 1,0 Fe, максимум 1,0 Ti и Со (остальное), в максимальном процентном содержании по массе. Предпочтительно, когда слои лекарственного средства по существу не содержат полимера, а слои полимера, по существу, не содержат лекарственного средства. В другом воплощении коронарного стента с покрытием биорассасывающийся полимер выбран из следующих: полигликолида (PGA), поли-l-лактида (LPLA), поли-dl-лактида (DLPLA), поли-капролактона (PCL), полидиоксанона (PDO), сополимера гликолид-триметиленкарбонат (PGA-TMC),сополимера dl-лактид-гликолид (85/15 DLPLG), 75/25 DLPL, 65/35 DLPLG, 50/50 DLPLG, политриметиленкарбоната (ТМС), сополимера 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота(p(CPP:SA. В другом аспекте настоящего изобретения предложен способ изготовления коронарного стента с покрытием, включающий: а) предоставление стентового каркаса; б) нанесение на стентовый каркас ряда слоев с образованием стента с покрытием, где по меньшей мере один из слоев содержит биорассасывающийся полимер и где нанесение каждого слоя ряда слоев на стентовый каркас включает следующие стадии: подачу через первое сопло по меньшей мере одного фармацевтического агента и/или по меньшей мере одного активного биологического агента в форме сухого порошка; подачу через первое сопло или через второе сопло по меньшей мере одного полимера в форме сухого порошка; нанесение на каркас частиц полимера и фармацевтического агента и/или активного биологического агента, где между каркасом и частицами полимера и фармацевтического агента и/или активного биологического агента поддерживается электрический потенциал, с образованием слоя и спекание полученного слоя при условиях, которые, по существу, не изменяют морфологию фарма-1 020509 цевтического агента и/или активность биологического агента; где биорассасывающийся полимер выбран из группы: PLGA, полигликолида (PGA), поли-l-лактида(LPLA), поли-dl-лактида (DLPLA), поликапролактона (PCL), полидиоксанона (PDO), сополимера гликолид-триметиленкарбонат (PGA-TMC), сополимера dl-лактид-гликолид (85/15 DLPLG), 75/25 DLPL,65/35 DLPLG, 50/50 DLPLG, политриметиленкарбоната (ТМС), сополимера 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA, сополимера (l-лактид-гликолид (PGA-LPLA), сополимера dl-лактид-гликолид (PGA-DLPLA), сополимера l-лактид-dl-лактид (LPLA-DLPLA) и сополимера гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC). В еще одном аспекте настоящего изобретения предложен способ изготовления коронарного стента,включающий: а) предоставление стентового каркаса; б) нанесение на стентовый каркас ряда слоев с образованием коронарного стента, где по меньшей мере один из слоев содержит биорассасывающийся полимер, по меньшей мере один фармацевтический агент с терапевтически желательной морфологией и/или по меньшей мере один активный биологический агент и где нанесение каждого слоя из ряда слоев на стентовый каркас включает следующие стадии: 1) подачу через первое сопло по меньшей мере одного фармацевтического агента и/или по меньшей мере одного активного биологического агента в форме сухого порошка; 2) получение раствора сверхкритической или околосверхкритической жидкости, содержащего по меньшей мере один растворитель сверхкритической жидкости и по меньшей мере один полимер, и подачу через второе сопло полученного раствора сверхкритической или околосверхкритической жидкости при условиях, достаточных для образования твердых частиц полимера; 3) нанесение на каркас частиц полимера и фармацевтического агента и/или активного биологического агента, где между каркасом и частицами полимера и фармацевтического агента и/или активного биологического агента поддерживается электрический потенциал, с образованием слоя и 4) спекание полученного слоя при условиях, которые по существу не изменяют морфологию указанного фармацевтического агента и/или активность биологического агента; где биорассасывающийся полимер выбран из группы: PLGA, полигликолида (PGA), поли-l-лактида(LPLA), поли-dl-лактида (DLPLA), поликапролактона (PCL), полидиоксанона (PDO), сополимера гликолид-триметиленкарбонат (PGA-TMC), сополимера dl-лактид-гликолид (85/15 DLPLG), 75/25 DLPL,65/35 DLPLG, 50/50 DLPLG, политриметиленкарбоната (ТМС), сополимера 1,3-бис-пара(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA, сополимера (l-лактид-гликолид (PGALPLA), сополимера dl-лактид-гликолид (PGA-DLPLA), сополимера l-лактид-dl-лактид (LPLA-DLPLA) и сополимера гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC). В еще одном аспекте настоящего изобретения предложен способ изготовления коронарного стента,включающий: а) предоставление стентового каркаса; б) нанесение на стентовый каркас ряда слоев с образованием коронарного стента, где по меньшей мере один из слоев содержит биорассасывающийся полимер, по меньшей мере один фармацевтический агент с терапевтически желательной морфологией и/или по меньшей мере один активный биологический агент и где нанесение каждого слоя из ряда слоев на стентовый каркас включает следующие стадии: 1) получение раствора сверхкритической или околосверхкритической жидкости, содержащего по меньшей мере один растворитель сверхкритической жидкости и один или более чем один фармацевтический агент и/или по меньшей мере один активный биологический агент, и подачу через первое сопло полученного раствора сверхкритической или околосверхкритической жидкости при условиях, достаточных для образования твердых частиц одного или более чем одного фармацевтического агента и/или по меньшей мере одного активного биологического агента; 2) получение раствора сверхкритической или околосверхкритической жидкости, содержащего по меньшей мере один растворитель сверхкритической жидкости и по меньшей мере один полимер, и подачу через первое сопло или через второе сопло полученного раствора сверхкритической или околосверхкритической жидкости при условиях, достаточных для образования твердых частиц полимера; 3) нанесение на каркас частиц полимера и фармацевтического агента и/или активного биологического агента, где между каркасом и частицами полимера и фармацевтического агента и/или активного биологического агента поддерживается электрический потенциал, с образованием этого слоя и 4) спекание полученного слоя при условиях, которые по существу не изменяют морфологию указанного фармацевтического агента и/или активность указанного биологического агента; где биорассасывающийся полимер выбран из группы: PLGA, полигликолида (PGA), поли-l-лактида гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC). В одном из воплощений способ изготовления коронарного стента дополнительно включает подачу третьего сухого порошка, содержащего второй фармацевтический агент с терапевтически желательной морфологией в форме сухого порошка и/или активный биологический агент, посредством которой на каркас наносят слой, содержащий по меньшей мере два разных фармацевтических агента и/или активных биологических агента, или на каркас наносят по меньшей мере два слоя, каждый из которых содержит один или два разных фармацевтических агента и/или активных биологических агента. В другом воплощении способа изготовления коронарного стента каркас является электростатически заряженным. В еще одном воплощении способа изготовления коронарного стента по меньшей мере 50% фармацевтического агента в форме порошка является кристаллическим или полукристаллическим. В еще одном воплощении способа изготовления коронарного стента биорассасывающийся полимер выбран из следующих: полигликолида (PGA), поли-l-лактида (LPLA), поли-dl-лактида (DLPLA), поли-капролактона (PCL), полидиоксанона (PDO), сополимера гликолид-триметиленкарбонат (PGA-TMC),сополимера dl-лактид-гликолид (85/15 DLPLG), 75/25 DLPL, 65/35 DLPLG, 50/50 DLPLG, политриметиленкарбоната (ТМС), сополимера 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота(p(CPP:SA. В еще одном воплощении способ изготовления коронарного стента включает нанесение 4, 10, 20, 50 или 100 слоев. В еще одном воплощении способа изготовления коронарного стента указанные слои включают чередующиеся слои лекарственного средства и полимера. Предпочтительно, когда слои лекарственного средства по существу не содержат полимера, а слои полимера по существу не содержат лекарственного средства. Включение посредством ссылки Все публикации и патентные заявки, упомянутые в этом описании изобретения, включены посредством ссылки в той же самой степени, как если бы каждая отдельная публикация или патентная заявка была бы конкретно и индивидуально указана как включенная посредством ссылки. Подробное описание изобретения Согласно одному из вариантов выполнения предложен коронарный стент с покрытием, включающий стентовый каркас и покрытие рапамицин-полимер, где по меньшей мере часть рапамицина находится в кристаллической форме и покрытие рапамицин-полимер содержит один или более чем один рассасывающийся полимер. В другом варианте выполнения покрытие рапамицин-полимер имеет, по существу, однородную толщину, и рапамицин в покрытии, по существу, равномерно распределен внутри данного покрытия рапамицин-полимер. В другом варианте выполнения один или более чем один рассасывающийся полимер выбран из следующих: PLGA (сополимер лактид-гликолид); DLPLA (поли-dl-лактид); LPLA (поли-l-лактид); PGA (полигликолид); PDO (полидиоксанон); PGA-TMC (сополимер гликолид-триметиленкарбонат); PGA-LPLAl-лактид-dl-лактид); PDO-PGA-TMC (сополимер гликолид-триметиленкарбонат-диоксанон) и их комбинации. В еще одном варианте выполнения полимер представляет собой 50/50 PLGA. В еще одном варианте выполнения по меньшей мере часть указанного рапамицина образует фазу,отделенную от одной или более чем одной фазы, образованной указанным полимером. В другом варианте выполнения рапамицин является по меньшей мере на 50% кристаллическим. В другом варианте выполнения рапамицин является по меньшей мере на 75% кристаллическим. В другом варианте выполнения рапамицин является по меньшей мере на 90% кристаллическим. В другом варианте выполнения рапамицин является по меньшей мере на 95% кристаллическим. В другом варианте выполнения рапамицин является по меньшей мере на 99% кристаллическим. В другом варианте выполнения полимер представляет собой смесь двух или более чем двух полимеров. В другом варианте выполнения смесь полимеров образует непрерывную пленку вокруг частиц рапамицина. В другом варианте выполнения два или более чем два полимера являются однородно смешанными. В другом варианте выполнения данная смесь не содержит единого полимерного домена размером более чем примерно 20 нм. В другом варианте выполнения каждый полимер в указанной смеси включает дискретную фазу. В другом варианте выполнения дискретные фазы, образованные указанными полимерами в указанной смеси, имеют размер более чем примерно 10 нм. В другом варианте выполнения дискретные фазы, образованные указанными полимерами в указанной смеси, имеют размер более чем примерно 50 нм. В другом варианте выполнения рапамицин в указанном стенте имеет стабильность при хранении по меньшей мере 3 месяца. В другом варианте выполнения рапамицин в указанном стенте имеет стабильность при хранении по меньшей мере 6 месяцев. В другом варианте выполнения рапамицин в указанном стенте имеет стабильность при хранении по меньшей мере 12 месяцев. В другом варианте выполнения покрытие является, по существу, конформным. В другом варианте выполнения стент обеспечивает профиль элюции, где от примерно 10% до примерно 50% рапамицина элюируется в первую неделю после имплантации данного композита субъекту при физиологических условиях, от примерно 25% до примерно 75% рапамицина элюируется во вторую неделю, и от примерно 50% до примерно 100% рапамицина элюируется в шестую неделю. В другом варианте выполнения стент обеспечивает профиль элюции, где от примерно 10% до примерно 50% рапамицина элюируется в первую неделю после имплантации данного композита субъекту при физиологических условиях, от примерно 25% до примерно 75% рапамицина элюируется во вторую неделю и от примерно 50% до примерно 100% рапамицина элюируется в десятую неделю. В другом варианте выполнения стентовый каркас представляет собой каркас из нержавеющей стали. Согласно еще одному варианту выполнения предложен коронарный стент с покрытием, включающий: стент и макролидное иммуносупрессивное (лимус) покрытие лекарственное средство-полимер, где по меньшей мере часть данного лекарственного средства находится в кристаллической форме, и макролидное иммуносупрессивное полимерное покрытие содержит один или более чем один рассасывающийся полимер. В другом варианте выполнения макролидное иммуносупрессивное лекарственное средство включает один или более чем один агент из следующих: рапамицин, 40-О-(2-гидроксиэтил)рапамицин (эверолимус), 40-О-бензилрапамицин, 40-О-(4'-гидроксиметил)бензилрапамицин, 40-О-[4'-(1,2-дигидроксиэтил)]бензилрапамицин, 40-О-аллилрапамицин, 40-О-[3'-(2,2-диметил-1,3-диоксолан-4(S)-ил)проп-2'ен-1'-ил]рапамицин, (2':E,4'S)-40-O-(4',5'-дигидроксипент-2'-ен-1'-ил)рапамицин, 40-О-(2-гидрокси)этоксикарбонилметилрапамицин, 40-О-(3-гидрокси)пропилрапамицин, 40-О-(6-гидрокси)гексилрапамицин,40-О-[2-(2-гидрокси)этокси]этилрапамицин, 40-О-[(3S)-2,2-диметилдиоксолан-3-ил]метилрапамицин, 40O-[(2S)-2,3-дигидроксипроп-1-ил]рапамицин, 40-О-(2-ацетокси)этилрапамицин, 40-О-(2-никотиноилокси)этилрапамицин, 40-О-[2-(N-морфолион)ацетокси]этилрапамицин, 40-О-(2-N-имидазолилацетокси) этилрапамицин, 40-O-[2-(N-метил-N'-пиперазинил)ацетокси]этилрапамицин, 39-О-десметил-39,40-О,Оэтиленрапамицин, (26R)-26-дигидро-40-О-(2-гидрокси)этилрапамицин, 28-О-метилрапамицин, 40-О-(2 аминоэтил)рапамицин, 40-О-(2-ацетаминоэтил)рапамицин, 40-О-(2-никотинамидоэтил)рапамицин, 40-О(2-(N-метилимидазо-2'-илкарбэтоксамидо)этил)рапамицин, 40-О-(2-этоксикарбониламиноэтил)рапамицин, 40-О-(2-толилсульфонамидоэтил)рапамицин, 40-О-[2-(4',5'-дикарбоэтокси-1',2',3'-триазол-1'-ил) этил]рапамицин, 42-эпи-(тетразолил)рапамицин (такролимус) и 42-[3-гидрокси-2-(гидроксиметил)-2 метилпропаноат]рапамицин (темсиролимус). В другом варианте выполнения макролидное иммуносупрессивное лекарственное средство является по меньшей мере на 50% кристаллическим. Согласно другому варианту выполнения предложен способ изготовления коронарного стента с покрытием, включающий образование на стентовом каркасе покрытия макролидное иммуносупрессивное(лимус) лекарственное средство-полимер, где по меньшей мере часть данного лекарственного средства находится в кристаллической форме, и покрытие макролидное иммуносупрессивное лекарственное средство-полимер содержит один или более чем один рассасывающийся полимер. Настоящее изобретение дает несколько преимуществ, которые преодолевают или уменьшают ограничения существующей технологии биорассасывающихся стентов. Согласно одному варианту выполнения предложен коронарный стент с покрытием, включающий: стентовый каркас и покрытие рапамицин-полимер, где по меньшей мере часть рапамицина находится в кристаллической форме, и покрытие рапамицин-полимер содержит один или более чем один рассасывающийся полимер. В другом варианте выполнения покрытие рапамицин-полимер имеет, по существу, однородную толщину, и рапамицин в покрытии по существу равномерно распределен внутри данного покрытия рапамицин-полимер. В другом варианте выполнения один или более чем один рассасывающийся полимер выбран из следующего: PLGA (сополимер лактид-гликолид); DLPLA (поли-dl-лактид); LPLA (поли-l-лактид); PGA(полигликолид); PDO (полидиоксанон); PGA-TMC (сополимер гликолид-триметиленкарбонат); PGALPLA (сополимер l-лактид-гликолид); PGA-DLPLA (сополимер dl-лактид-гликолид); LPLA-DLPLA (сополимер l-лактид-dl-лактид); PDO-PGA-TMC (сополимер гликолид-триметиленкарбонат-диоксанон) и их комбинации. Согласно другому варианту выполнения предложен способ изготовления коронарного стента с покрытием, включающий следующие стадии: предоставление стентового каркаса из нержавеющей стали или кобальто-хромового стентового каркаса; образование на стентовом каркасе покрытия макролидное иммуносупрессивное (лимус) лекарственное средство-полимер, где по меньшей мере часть лекарственного средства находится в кристаллической форме, и полимер является биорассасывающимся. В другом варианте выполнения макролид наносят в форме сухого порошка. В другом варианте выполнения биорассасывающийся полимер наносят в форме сухого порошка. В другом варианте выполнения полимер наносят способом e-SEDS (электростатическое медленное расширение сверхкритических растворов). В другом варианте выполнения данный полимер наносят способом е-RESS (электростатическое быстрое расширение сверхкритических растворов). Согласно другому варианту выполнения предложен способ, дополнительно включающий спекание указанного покрытия в условиях, которые, по существу, не изменяют морфологию указанного макролида. Согласно еще одному варианту выполнения предложен коронарный стент с покрытием, включающий стентовый каркас, первый слой биорассасывающегося полимера и покрытие рапамицин-полимер,содержащее рапамицин и второй биорассасывающийся полимер, где по меньшей мере часть рапамицина находится в кристаллической форме, и где первый полимер представляет собой медленно рассасывающийся полимер, и второй полимер представляет собой быстро рассасывающийся полимер. Иллюстрация выбранных вариантов выполнения данного изобретения приведена на прилагаемых фиг. 1-6. Настоящее изобретение более подробно изложено ниже. Это описание не предназначено для того,чтобы быть подробным каталогом всех различных путей, которыми может быть реализовано данное изобретение, или всех признаков, которые могут быть добавлены к настоящему изобретению. Например,признаки, проиллюстрированные в отношении одного варианта выполнения, могут быть включены в другие варианты выполнения, и признаки, проиллюстрированные в отношении конкретного варианта выполнения, могут быть удалены из этого варианта выполнения. Кроме того, предложенные здесь многочисленные вариации и дополнения разных вариантов выполнения, которые не отклоняются от настоящего изобретения, будут очевидными специалистам в данной области техники в свете настоящего раскрытия. Следовательно, следующее описание изобретения предназначено для того, чтобы проиллюстрировать некоторые конкретные варианты выполнения данного изобретения, а не для того, чтобы подробно конкретизировать все его перестановки, комбинации и вариации. Определения Обычно подразумевают, что следующие слова и фразы в том виде, как они использованы в настоящем описании изобретения, имеют изложенные ниже значения, кроме случаев, когда контекст, в котором они используются, указывает на иное. Термин "субстрат", как он использован здесь, относится к любой поверхности, на которую желательно нанести покрытие, содержащее полимер и фармацевтический или биологический агент, где процесс нанесения покрытия, по существу, не изменяет морфологию фармацевтического агента или активность биологического агента. Биомедицинские имплантаты представляют особенный интерес для настоящего изобретения; однако подразумевается, что настоящее изобретение не ограничено этим классом субстратов. Специалисты в данной области техники примут во внимание альтернативные субстраты, для которых полезен описанный здесь способ нанесения покрытия, такие как фармацевтические ядра таблеток, часть аналитического оборудования или компоненты в диагностическом наборе (например тестполоске). Термин "биомедицинский имплантат", как он использован здесь, относится к любому имплантату для внедрения в организм субъекта, являющегося человеком или животным, включая, но не ограничиваясь ими, стенты (например сосудистые стенты), электроды, катетеры, трубки, имплантируемый водитель ритма, корпуса кардиовертера или дефибриллятора, суставы, винты, стержни, офтальмологические имплантаты, бедренные штифты, костные пластины, трансплантаты, устройства для наложения анастомоза,периваскулярные манжеты, шовный материал,скобы, шунт для использования при гидроцефалии, диализные трансплантаты, устройства для подсоединения колостомических мешков, ушные дренажные трубки, провода для водителей ритма и имплантируемых кардиовертеров и дефибрилляторов, позвоночные диски, костные стержни, фиксаторы шовного материала, гемостатические барьеры, зажимы, шурупы, пластинки, скобы, сосудистые имплантаты, тканевые адгезивы и пломбировочные материалы, тканевые каркасы, различные типы перевязочных материалов (например повязки на рану), заменители костной ткани, внутриполостные устройства, устройства иммобилизации сосудов и так далее. Имплантаты могут быть изготовлены из любого подходящего вещества, включая, но не ограничиваясь ими, органические полимеры (включая стабильные или инертные полимеры и биоразлагаемые полимеры), металлы, неорганические вещества, такие как кремний, и их композиты, включая многослойные структуры с ядром из одного вещества и одним или более чем одним покрытием из другого вещества. Субстраты, изготовленные из проводящего материала, облегчают электростатический захват. Однако в данном исследовании рассматривается применение электростатического захвата в сочетании с субстратом, который имеет низкую проводимость или который является непроводящим. Для усиления электростатического захвата при использовании непроводящего субстрата этот субстрат обрабатывают, поддер-5 020509 живая сильное электрическое поле вблизи данного субстрата. Субъекты, которым можно применять или внедрять биомедицинские имплантаты по изобретению,включают как субъектов, представляющих собой людей (включая субъектов мужского и женского пола,субъектов младенческого, ювенильного и подросткового возраста, взрослых и пожилых субъектов), так и субъектов, представляющих собой животных (включая, но не ограничиваясь ими, собак, кошек, лошадей, обезьян и так далее), для ветеринарных целей. В предпочтительном варианте выполнения биомедицинский имплантат представляет собой расширяемый внутрипросветный сосудистый трансплантат или стент (например, включающий трубку из проволочной сетки), который может быть расширен в кровеносном сосуде посредством баллона для ангиопластики, связанного с катетером для растяжения или расширения просвета кровеносного сосуда, как,например, описано в патенте США 4733665 Palmaz Shaz. Термин "фармацевтический агент", как он использован здесь, относится к любому из ряда лекарственных средств или фармацевтических соединений, которые могут быть использованы в качестве активных агентов для предупреждения или лечения заболевания (подразумевая любое лечение заболевания у млекопитающего, включая предупреждение заболевания, то есть обеспечение того, чтобы клинические симптомы заболевания не развивались; подавление заболевания, то есть остановку развития клинических симптомов; и/или облегчение заболевания, то есть обеспечение ослабления клинических симптомов). Возможно, что фармацевтические агенты по изобретению также могут включать два или более чем два лекарственных средства или фармацевтических соединения. Фармацевтические агенты включают, но не ограничиваются ими: противорестенозные агенты, противодиабетические агенты, анальгетики, противовоспалительные агенты, противоревматические агенты, антигипотензивные агенты, антигипертензивные агенты, психоактивные лекарственные средства, транквилизаторы, противорвотные агенты, миорелаксанты, глюкокортикоиды, агенты для лечения язвенного колита или болезни Крона, противоаллергические агенты, антибиотики, противоэпилептические агенты, антикоагулянты, противогрибковые агенты,средства от кашля, лекарственные средства против артериосклероза, диуретики, белки, пептиды, ферменты, ингибиторы ферментов, противоподагрические лекарственные средства, гормоны и их ингибиторы, сердечные гликозиды, иммунотерапевтические агенты и цитокины, слабительные средства, агенты,понижающие уровень липидов, лекарственные средства против мигрени, минеральные продукты, отологические средства, средства против болезни Паркинсона, терапевтические агенты для лечения заболеваний щитовидной железы, спазмолитики, ингибиторы агрегации тромбоцитов, витамины, цитостатики и ингибиторы метастазов, фитофармацевтические средства, химиотерапевтические агенты и аминокислоты. Примерами подходящих активных ингредиентов являются акарбоза, антигены, блокаторы бетарецепторов, нестероидные противовоспалительные лекарственные средства [NSAID], сердечные гликозиды, ацетилсалициловая кислота, вирусостатические агенты, акларубицин, ацикловир, цисплатин, актиномицин, альфа- и бета-симпатомиметики, дмепразол, аллопуринол, алпростадил, простагландины,амантадин, амброксол, амлодипин, метотрексат, S-аминосалициловая кислота, амитриптилин, амоксициллин, анастрозол, атенолол, азатиоприн, балсалазид, беклометазон, бетагистин, безафибрат, бикалутамид, диазепам и производные диазепама, будесонид, буфексамак, бупренорфин, метадон, соли кальция,соли калия, соли магния, кандесартан, карбамазепин, каптоприл, цефалоспорины, цетиризин, хенодезоксихолевая кислота, урсодезоксихолевая кислота, теофиллин и производные теофиллина, трипсины, циметидин, кларитромицин, клавулановая кислота, клиндамицин, клобутинол, клонидин, котримоксазол,кодеин, кофеин, витамин D и производные витамина D, колестирамин, кромоглициевая кислота, кумарин и производные кумарина, цистеин, цитарабин, циклофосфамид, циклоспорин, ципротерон, цитабарин,дапипразол, дезогестрел, дезонид, дигидралазин, дилтиазем, алкалоиды спорыньи, дименгидринат, диметилсульфоксид, диметикон, домперидон и производные домперидана, дофамин, доксазозин, доксорубицин, доксиламин, дапипразол, бензодиазепины, диклофенак, гликозидные антибиотики, дезипрамин,эконазол, ингибиторы ангиотензинпревращающего фермента (АСЕ), эналаприл, эфедрин, эпинефрин,эпоэтин и производные эпоэтина, морфинаны, антагонисты кальция, иринотекан, модафинил, орлистат,пептидные антибиотики, фенитоин, рилузолы, ризедронат, силденафил, топирамат, макролидные антибиотики, эстроген и производные эстрогена, прогестоген и производные прогестогена, тестостерон и производные тестостерона, андроген и производные андрогена, этензамид, этофенамат, этофибрат, фенофибрат, этофиллин, этопозид, фамцикловир, фамотидин, фелодипин, фенофибрат, фентанил, фентиконазол, ингибиторы гиразы, флуконазол, флударабин, флуаризин, фторурацил, флуоксетин, флурбипрофен, ибупрофен, флутамид, флувастатин, фоллитропин, формотерол, фосфомицин, фуросемид, фусидовая кислота, галлопамил, ганцикловир, гемфиброзил, гентамицин, гинкго, зверобой, глибенкламид, производные мочевины в качестве пероральных противодиабетических средств, глюкагон, глюкозамин и производные глюкозамина, глутатион, глицерин и производные глицерина, гормоны гипоталамуса, гозерелин, ингибиторы гиразы, гуанетидин, галофантрин, галоперидол, гепарин и производные гепарина,гиалуроновая кислота, гидралазин, гидрохлортиазид и производные гидрохлортиазида, салицилаты, гидроксизин, идарубицин, ифосфамид, имипрамин, индометацин, индорамин, инсулин, интерфероны, йод и производные йода, изоконазол, изопреналин, глюцитол и производные глюцитола, итраконазол, кетоконазол, кетопрофен, кетотифен, лацидипин, лансопразол, леводопа, левометадон, гормоны щитовидной железы, липоевая кислота и производные липоевой кислоты, лизиноприл, лизурид, лофепрамин, ломустин, лоперамид, лоратадин, мапротиллин, мебендазол, мебеверин, меклозин, мефенамовая кислота,мефлохин, мелоксикам, мепиндолол, мепробамат, меропенем, месалазин, месуксимид, метамизол, метформин, метотрексат, метилфенидат, метилпреднизолон, метиксен, метоклопрамид, метопролол, метронидазол, миансерин, миконазол, миноциклин, миноксидил, мизопростол, митомицин, мизоластин, моэксиприл, морфин и производные морфина, энотера, налбуфин, налоксон, тилидин, напроксен, наркотин,натамицин, неостигмин, ницерголин, ницетамид, нифедипин, нифлумовая кислота, нимодипин, ниморазол, нимустин, нисолдипин, адреналин и производные адреналина, норфлоксацин, новаминсульфон, носкапин, нистатин, офлоксацин, оланзапин, олсалазин, омепразол, омоконазол, ондансетрон, оксацепрол,оксациллин, оксиконазол, оксиметазолин, пантопразол, парацетамол, пароксетин, пенцикловир, пероральные пенициллины, пентазоцин, пентифиллин, пентоксифиллин, перфеназин, петидин, растительные экстракты, феназон, фенирамин, производные барбитуровой кислоты, фенилбутазон, фенитоин, пимозид,пиндолол, пиперазин, пирацетам, пирензепин, пирибедил, пироксикам, прамипексол, правастатин, празозин, прокаин, промазин, пропиверин, пропранолол, пропифеназон, простагландины, протионамид, проксифиллин, кветиапин, квинаприл, квинаприлат, рамиприл, ранитидин, репротерол, резерпин, рибавирин, рифампицин, рисперидон, ритонавир, ропинирол, роксатидин, рокситромицин, рускогенин, рутозид и производные рутозида, сабадилла, сальбутамол, сальметерол, скополамин, селегилин, сертаконазол,сертиндол, сертралион, силикаты, силденафил, симвастатин, ситостерол, соталол, спаглуминовая кислота, спарфлоксацин, спектиномицин, спирамицин, спираприл, спиронолактон, ставудин, стрептомицин,сукралфат, суфентанил, сулбактам, сульфонамиды, сульфасалазин, сульпирид, султамициллин, султиам,суматриптан, суксаметония хлорид, такрин, такролимус, талиолол, тамоксифен, тауролидин, тазаротен,темазепам, тенипозид, теноксикам, теразозин, тербинафин, тербуталин, терфенадин, терлипрессин, тертатолол, тетрациклины, теризолин, теобромин, теофиллин, бутизин, тиамазол, фенотиазины, тиотепа,тиагабин, тиаприд, производные пропионовой кислоты, тиклопидин, тимолол, тинидазол, тиоконазол,тиогуанин, тиоксолон, тиропрамид, тизанидин, толазолин, толбутамид, толкапон, толнафтат, толперизон,топотекан, торасемид, антиэстрогены, трамадол, трамазолин, трандолаприл, транилципромин, трапидил,тразодон, триамцинолон и производные триамцинолона, триамтерен, трифлуперидол, трифлуридин,триметоприм, тримипрамин, трипеленамин, трипролидин, трифосфамид, тромантадин, трометамол, тропальпин, троксерутин, тулобутерол, тирамин, тиротрицин, урапидил, урсодезоксихолевая кислота, хенодезоксихолевая кислота, валацикловир, вальпроевая кислота, ванкомицин, векурония хлорид, виагра,венлафаксин, верапамил, видарабин, вигабатрин, вилоазин, винбластин, винкамин, винкристин, виндезин, винорелбин, винпоцетин, виквидил, варфарин, ксантинола никотинат, ксипамид, зафирлукаст, зальцитабин, зидовудин, золмитриптан, золпидем, зопликон, зотипин и тому подобное. См., например, патент США 6897205; см. также патент США 6838528; патент США 6497729. Примеры терапевтических агентов, используемых в соответствии с данным изобретением, включают рапамицин, 40-О-(2-гидроксиэтил)рапамицин (эверолимус), 40-О-бензилрапамицин, 40-О-(4'-гидроксиметил)бензилрапамицин, 40-О-[4'-(1,2-дигидроксиэтил)]бензилрапамицин, 40-О-аллилрапамицин, 40 О-[3'-(2,2-диметил-1,3-диоксолан-4(S)-ил)-проп-2'-ен-1'-ил]рапамицин, (2':E,4'S)-40-O-(4',5'-дигидроксипент-2'-ен-1'-ил)рапамицин, 40-О-(2-гидрокси)этоксикарбонилметилрапамицин, 40-О-(3-гидрокси)пропилрапамицин, 40-О-(6-гидрокси)гексилрапамицин, 40-О-[2-(2-гидрокси)этокси]-этилрапамицин, 40-О[(3S)-2,2-диметилдиоксолан-3-ил]метилрапамицин, 40-О-[(2S)-2,3-дигидроксипроп-1-ил]рапамицин, 40 О-(2-ацетокси)этилрапамицин, 40-О-(2-никотиноилокси)этилрапамицин, 40-О-[2-(N-морфолино)ацетокси]этилрапамицин, 40-О-(2-N-имидазолилацетокси)этилрапамицин, 40-О-[2-(N-метил-N'-пиперазинил) ацетокси]этилрапамицин,39-О-десметил-39,40-О,О-этиленрапамицин,(26R)-26-дигидро-40-О-(2 гидрокси)этилрапамицин, 28-О-метилрапамицин, 40-О-(2-аминоэтил)рапамицин, 40-О-(2-ацетаминоэтил)рапамицин,40-О-(2-никотинамидоэтил)рапамицин,40-О-(2-(N-метилимидазо-2'-илкарбэтоксамидо)этил)рапамицин, 40-О-(2-этоксикарбониламиноэтил)рапамицин, 40-О-(2-толилсульфонамидоэтил)рапамицин, 40-О-[2-(4',5'-дикарбоэтокси-1',2',3'-триазол-1'-ил)этил]рапамицин, 42-эпи(тетразолил)рапамицин (такролимус) и 42-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицин (темсиролимус). Если желательно, активные ингредиенты также могут быть использованы в форме их фармацевтически приемлемых солей или производных (подразумевая соли, которые сохраняют биологическую эффективность и свойства соединений по данному изобретению, и которые не являются нежелательными с биологической точки зрения или по другой причине), и в случае хиральных активных ингредиентов, могут быть использованы как оптически активные изомеры, так и рацематы или смеси диастереоизомеров. Термин "стабильность", как он использован здесь, относится к стабильности лекарственного средства в полимерном покрытии, нанесенном на субстрат, в форме его конечного продукта (например, стабильность лекарственного средства в стенте с покрытием). Термин "стабильность" определяет разложение лекарственного средства в форме конечного продукта 5% или меньше. Термин "активный биологический агент", как он использован здесь, относится к веществу, исходно продуцируемому живыми организмами, которое может быть использовано для предупреждения или лечения заболевания (подразумевая любое лечение заболевания у млекопитающего, включая предупреж-7 020509 дение заболевания, то есть обеспечение того, чтобы клинические симптомы заболевания не развивались; подавление заболевания, то есть остановку развития клинических симптомов; и/или облегчение заболевания, то есть обеспечение ослабления клинических симптомов). Возможно, что активные биологические агенты по изобретению также могут включать два или более чем два активных биологических агента или активный биологический агент, объединенный с фармацевтическим агентом, стабилизатором или химической или биологической структурной единицей. Несмотря на то, что активный биологический агент возможно исходно продуцируется живыми организмами, активные биологические агенты по настоящему изобретению возможно также могут быть получены способами синтеза или способами, объединяющими биологическое выделение и синтетическую модификацию. В качестве неограничивающего примера, нуклеиновая кислота может быть выделена из биологического источника или получена традиционными методиками, известными специалистам в области синтеза нуклеиновых кислот. Кроме того,нуклеиновая кислота может быть дополнительно модифицирована так, чтобы она содержала группировки, не встречающиеся в природе. Неограничивающие примеры активных биологических агентов включают пептиды, белки, ферменты, гликопротеины, нуклеиновые кислоты (включая дезоксирибонуклеотидные или рибонуклеотидные полимеры либо в одноцепочечной, либо в двухцепочечной форме, и, если не ограничено иначе, охватывают известные аналоги природных нуклеотидов, которые гибридизуются с нуклеиновыми кислотами аналогично нуклеотидам, встречающимся в природе), антисмысловые нуклеиновые кислоты, жирные кислоты, противомикробные вещества, витамины, гормоны, стероиды, липиды,полисахариды, углеводы и тому подобное. Они дополнительно включают, но не ограничены ими: противорестенозные агенты, противодиабетические агенты, анальгетики, противовоспалительные агенты, противоревматические агенты, антигипотензивные агенты, антигипертензивные агенты, психоактивные лекарственные средства, транквилизаторы, противорвотные агенты, миорелаксанты, глюкокортикоиды,агенты для лечения язвенного колита или болезни Крона, противоаллергические агенты, антибиотики,противоэпилептические агенты, антикоагулянты, противогрибковые агенты, средства от кашля, лекарственные средства против артериосклероза, диуретики, белки, пептиды, ферменты, ингибиторы ферментов,противоподагрические лекарственные средства, гормоны и их ингибиторы, сердечные гликозиды, иммунотерапевтические агенты и цитокины, слабительные средства, агенты, понижающие уровень липидов,лекарственные средства против мигрени, минеральные продукты, отологические средства, средства против болезни Паркинсона, терапевтические агенты для лечения заболеваний щитовидной железы, спазмолитики, ингибиторы агрегации тромбоцитов, витамины, цитостатики и ингибиторы метастазов, фитофармацевтические средства и химиотерапевтические агенты. Предпочтительно активный биологический агент представляет собой пептид, белок или фермент, включая производные и аналоги природных пептидов, белков и ферментов. Термин "активность", как он использован здесь, относится к способности фармацевтического или активного биологического агента предупреждать или лечить заболевание (подразумевая любое лечение заболевания у млекопитающего, включая предупреждение заболевания, то есть обеспечение того, чтобы клинические симптомы заболевания не развивались; подавление заболевания, то есть остановку развития клинических симптомов; и/или облегчение заболевания, то есть обеспечение ослабления клинических симптомов). Таким образом, активность фармацевтического или активного биологического агента должна иметь терапевтическое или профилактическое значение. Термины "вторичная, третичная и четвертичная структура", как они использованы здесь, определены следующим образом. Активные биологические агенты по настоящему изобретению обычно обладают некоторой степенью вторичной, третичной и/или четвертичной структуры, от которой зависит активность данного агента. В качестве иллюстративного неограничивающего примера, вторичной, третичной и четвертичной структурой обладают белки. Вторичная структура относится к пространственной организации аминокислотных остатков, которые находятся рядом друг с другом в линейной последовательности. -Спираль и складчатый -слой представляют собой элементы вторичной структуры. Третичная структура относится к пространственной организации аминокислотных остатков, которые находятся далеко друг от друга в линейной последовательности, и к расположению дисульфидных связей. Белки, содержащие более чем одну полипептидную цепь, демонстрируют дополнительный уровень структурной организации. Каждую полипептидную цепь в таком белке называют субъединицей. Четвертичная структура относится к пространственной организации субъединиц и природе их контактов. Например, гемоглобин состоит из двух - и двух -цепей. Хорошо известно, что функция белка обусловлена его конформацией или трехмерной организацией атомов (вытянутая полипептидная цепь лишена активности). Таким образом, одним аспектом настоящего изобретения является манипулирование с активными биологическими агентами при соблюдении осторожности с целью поддержания их конформации так, чтобы не терять их терапевтическую активность. Термин "полимер", как он использован здесь, относится к ряду повторяющихся мономерных единиц, которые поперечно связаны или полимеризованы. Для осуществления настоящего изобретения можно использовать любой подходящий полимер. Возможно, что полимеры по данному изобретению также могут включать два, три, четыре или более различных полимеров. В некоторых вариантах выпол-8 020509 нения данного изобретения использован только один полимер. В некоторых предпочтительных вариантах выполнения использована комбинация двух полимеров. Для получения покрытий с разными свойствами комбинации полимеров могут находиться в различных соотношениях. Специалистам в области химии полимеров известны различные свойства полимерных соединений. Термин "терапевтически желательная морфология", как он использован здесь, относится к макроскопической форме и структуре фармацевтического агента, после того как он нанесен на субстрат, так чтобы обеспечить оптимальные условия для хранения ex vivo, сохранения in vivo и/или высвобожденияin vivo. Такие оптимальные условия могут включать, но не ограничены ими, увеличенный срок хранения,повышенную стабильность in vivo, хорошую биосовместимость, хорошую биодоступность или модифицированные скорости высвобождения. Для настоящего изобретения желательная морфология фармацевтического агента обычно является кристаллической или полукристаллической либо аморфной, хотя она может в широкой степени варьировать в зависимости от многих факторов, включая, но не ограничиваясь ими, природу фармацевтического агента, заболевание, подлежащее лечению/предупреждению, предполагаемые условия хранения субстрата перед применением или помещением в организм любого биомедицинского имплантата. Предпочтительно по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100% фармацевтического агента находится в кристаллической или полукристаллической форме. Термин "стабилизирующий агент", как он использован здесь, относится к любому веществу, которое сохраняет или увеличивает стабильность биологического агента. Желательно, если эти стабилизирующие агенты отнесены к категории признанных полностью безопасными (GRAS, Generally RegardedAs Safe) Управлением США по контролю за качеством продуктов и лекарственных средств (FDA). Примеры стабилизирующих агентов включают, но не ограничены ими, белки-носители, такие как альбумин,желатин, металлы или неорганические соли. Фармацевтически приемлемый эксципиент, который может присутствовать, кроме того, можно найти в релевантной литературе, например, в Handbook of Pharmaceutical Additives: An International Guide to More Than 6000 Products by Trade Name, Chemical, Function, andManufacturer; Michael and Irene Ash (Eds.); Gower Publishing Ltd.; Aldershot, Hampshire, England, 1995. Термин "сжатая жидкость", как он использован здесь, относится к жидкости подходящей плотности(например 0,2 г/см 3), которая при стандартной температуре и давлении представляет собой газ. Термины "сверхкритическая жидкость", "околокритическая жидкость", "околосверхкритическая жидкость","критическая жидкость", "уплотненная жидкость" или "уплотненный газ", как они использованы здесь,относятся к сжатой жидкости при условиях, когда температура составляет по меньшей мере 80% критической температуры данной жидкости, и давление составляет по меньшей мере 50% критического давления данной жидкости. Примеры веществ, которые демонстрируют сверхкритическое или околокритическое поведение,подходящих для настоящего изобретения, включают, но не ограничены ими, диоксид углерода, изобутилен, аммиак, воду, метанол, этанол, этан, пропан, бутан, пентан, диметиловый эфир, ксенон, гексафторид серы, галогенированные и частично галогенированные вещества, такие как хлорфторуглероды, гидрохлорфторуглероды, гидрофторуглероды, перфторуглероды (такие как перфторметан и перфторпропан,хлороформ, трихлор-фторметан, дихлор-фторметан, дихлор-тетрафторэтан) и их смеси. Термин "спекание", как он использован здесь, относится к процессу, посредством которого части матрицы или вся полимерная матрица становится непрерывной (например образование непрерывной полимерной пленки). Как обсуждается ниже, процесс спекания контролируют с целью получения полностью конформной непрерывной матрицы (полное спекание) или с целью получения участков или доменов непрерывного покрытия при одновременном получении в матрице пустот (разрывов). Кроме того,процесс спекания контролируют так, чтобы было получено некоторое разделение фаз между разными полимерами (например полимерами А и Б) и/или с целью получения разделения фаз между дискретными полимерными частицами. Посредством процесса спекания адгезивные свойства покрытия улучшаются с уменьшением отслаивания или отделения покрытия от субстрата во время манипуляций при использовании. Как описано ниже, в некоторых вариантах выполнения процесс спекания контролируют с целью обеспечения неполного спекания полимерной матрицы. В вариантах выполнения, включающих неполное спекание, образуется полимерная матрица с непрерывными доменами и пустоты, щели, полости, поры,каналы или промежутки, которые дают пространство для изолирования терапевтического агента, который высвобождается при контролируемых условиях. В зависимости от природы полимера, размера частиц полимера и/или других свойств полимера могут быть использованы сжатый газ, уплотненный газ,околокритическая жидкость или сверхкритическая жидкость. В одном примере для обработки субстрата,который был покрыт полимером и лекарственным средством с использованием сухого порошка и электростатических процессов покрытия RESS, используют диоксид углерода. В другом примере в процессе спекания используют изобутилен. В других примерах используют смесь диоксида углерода и изобутилена. Когда аморфное вещество нагревают до температуры, превышающей его температуру стеклования,или когда кристаллическое вещество нагревают до температуры, превышающей температуру фазового перехода, молекулы, составляющие данное вещество, являются более подвижными, что, в свою очередь,означает, что они являются более активными и, таким образом, более подверженными реакциям, таким как окисление. Однако, когда аморфное вещество поддерживают при температуре ниже его температуры стеклования, его молекулы, по существу, иммобилизованы и, таким образом, менее подвержены реакциям. Подобным образом, когда кристаллическое вещество поддерживают при температуре ниже его температуры фазового перехода, его молекулы по существу иммобилизованы и, таким образом, менее подвержены реакциям. Соответственно, переработка лекарственных компонентов при мягких условиях, таких как описанные здесь условия нанесения и спекания, минимизирует перекрестные реакции и разложение лекарственного компонента. Один тип реакции, которая минимизируется благодаря способам по изобретению, связан с возможностью избежать воздействия традиционных растворителей, что, в свою очередь, минимизирует автоокисление лекарственного средства, независимо от того, находится ли оно в аморфной, полукристаллической или кристаллической форме, путем уменьшения воздействия на него свободных радикалов, остаточных растворителей и инициаторов автоокисления. Термин "быстрое расширение сверхкритических растворов" или "RESS", как он использован здесь,включает растворение полимера в сжатой жидкости, обычно в сверхкритической жидкости, с последующим быстрым расширением в камеру при более низком давлении, обычно при условиях, близких к атмосферным. Быстрое расширение раствора сверхкритической жидкости через небольшое отверстие с сопровождающим его уменьшением плотности снижает растворяющую способность жидкости и приводит к образованию активных центров и росту полимерных частиц. Атмосфера камеры сохраняется в электрически нейтральном состоянии путем поддержания в данной камере изолированного "облака" газа. Для предотвращения переноса электрического заряда от субстрата в окружающую среду используют диоксид углерода или другой подходящий газ."Объемные свойства" покрытия, включающего фармацевтический или биологический агент, которые могут быть улучшены благодаря способам по изобретению, включают, например, адгезию, гладкость, конформность, толщину и композиционное смешивание. Термины "электростатически заряженный", или "электрический потенциал", или "электростатический захват", как они использованы здесь, относятся к скоплению образуемых при распылении частиц на субстрате, который имеет электростатический потенциал, отличный от электростатического потенциала распыляемых частиц. Таким образом, данный субстрат имеет притягивающий электронный потенциал по отношению к выходящим частицам, что приводит к улавливанию этих частиц на субстрате, то есть субстрат и частицы являются противоположно заряженными, и транспорт частиц через жидкую среду улавливающего сосуда к поверхности субстрата усиливается посредством электростатического притяжения. Этого можно достичь путем зарядки частиц и заземления субстрата или, наоборот, зарядки субстрата и заземления частиц, или каким-либо другим способом, который легко может быть предусмотрен специалистом в области электростатического захвата. Способы создания матрицы биорассасывающийся(еся) полимер(ры) + лекарственное(ые) средство(ва) на стентовой форме с образованием конечного устройства, представляют собой следующее: нанесение на стентовую форму покрытия путем напыления лекарственного средства и полимера,как это осуществляют в способе Micell (e-RESS, e-DPC, спекание с использованием сжатого газа); проведение многократных и последовательных стадий покрытия-спекания, где на каждой стадии могут быть нанесены разные вещества, создавая, таким образом, многослойную структуру со множеством тонких слоев лекарственного(ых) средств(а), полимера(ов) или лекарственного средства + полимера,которые образуют конечный стент; осуществление нанесения слоев полимера(ов) + лекарственного(ых) средств(а) с включением маскирующего покрытия на внутренней (люминальной) поверхности стента. Такое маскирующее покрытие может быть простым, например, таким как непроводящая оправка, вставленная через внутренний диаметр стентовой формы. Такое маскирование может быть проведено до добавления любых слоев или может быть целенаправленно введено после непрерывного нанесения нескольких слоев вокруг всей стентовой формы. Другим преимуществом настоящего изобретения является возможность создания стента с контролируемым (заданным) профилем элюции лекарственного средства. Благодаря возможности включения разных веществ в каждый слой многослойной структуры и возможности независимого контролирования расположения лекарственного(ых) средств(а) в этих слоях данный способ позволяет получить стент, который может высвобождать лекарственные средства с очень специфическими профилями элюции, запрограммированными последовательными и/или параллельными профилями элюции. Настоящее изобретение также обеспечивает контролируемую элюцию одного лекарственного средства без влияния на элюцию второго лекарственного средства (или разных доз одного и того же лекарственного средства). Варианты выполнения, включающие стентовую форму или каркас, обеспечивают возможность радиографического мониторинга стента в месте размещения. В альтернативном варианте выполнения внутренний диаметр стента может быть замаскирован (например, посредством непроводящей оправки). Такое маскирование предохраняет дополнительные слои, находясь на поверхности внутреннего диаметра(аблюминальной поверхности) стента. Получаемая в результате конфигурация может быть желательной для обеспечения предпочтительной элюции лекарственного средства в направлении к стенке сосуда(люминальная поверхность стента), где терапевтический эффект против рестеноза является желатель- 10020509 ным, без предоставления того же самого антипролиферативного лекарственного средства (средств) на аблюминальной поверхности, где они могут задерживать заживление, что, в свою очередь, как подозревают, является причиной проблем безопасности современных стентов, высвобождающих лекарственное средство (DES), на поздних стадиях. Настоящее изобретение обеспечивает многочисленные преимущества. Данное изобретение полезно в том, что оно обеспечивает применение принципа, объединяющего способы образования слоя на основе технологий сжатых жидкостей, способы электростатического захвата и спекания. Данный принцип дает в результате стенты, высвобождающие лекарственное средство,имеющие улучшенные терапевтические и механические свойства. Это изобретение особенно полезно в том, что в нем используют оптимизированную послойную полимерную технологию. В частности, в настоящем изобретении предложен принцип образования дискретных слоев конкретных лекарственных средств. Традиционные способы покрытия стентов путем напыления требуют того, чтобы лекарственное средство и полимер были растворены в растворителе или совместном растворителе перед осуществлением покрытия напылением. В случае предложенного здесь принципа стентовый каркас покрывают лекарственными средствами и полимерами на отдельных стадиях, которые можно проводить одновременно или поочередно. Это обеспечивает дискретное распределение активного агента (например лекарственного средства) в пределах полимерной матрицы, обеспечивая тем самым размещение более чем одного лекарственного средства в одном медицинском устройстве с промежуточным полимерным слоем или без него. Например, в настоящем изобретении предложен стент, высвобождающий два лекарственных средства. Некоторые преимущества, предоставляемые объектом изобретения, включают применение сжатых жидкостей (например сверхкритических жидкостей, например, способами на основе E-RESS); методологию нанесения без растворителей; принцип, обеспечивающий обработку при более низких температурах,сохраняя тем самым качества активного агента и полимерной матрицы; возможность включения двух,трех или более лекарственных средств при минимизации неблагоприятных эффектов от прямых взаимодействий между различными лекарственными средствами и/или их эксципиентами во время изготовления и/или хранения стентов, высвобождающих лекарственное средство; сухое нанесение; улучшенную адгезию и механические свойства слоев на стентовом каркасе; точное нанесение и быструю переработку партии; и возможность образования сложных структур. В одном варианте выполнения согласно настоящему изобретению предложен принцип доставки нескольких лекарственных средств, который дает прочные, упругие и гибкие стенты, высвобождающие лекарственные средства, включая противорестенозное лекарственное средство (например лимус или таксол) и противотромбозное лекарственное средство (например гепарин или его аналоги) и хорошо охарактеризованные биорассасывающиеся полимеры. Предложенные здесь стенты, высвобождающие лекарственное средство, минимизируют возможность возникновения тромбоза отчасти путем уменьшения или полного устранения тромбогенных полимеров и уменьшения или полного устранения остаточных лекарственных средств, которые могут ингибировать заживление. Предложенный принцип обеспечивает оптимизированную доставку нескольких лекарственных терапевтических агентов, например, для лечения ранней стадии (рестеноз) и поздней стадии (тромбоз). Предложенный принцип также обеспечивает плотно прилегающее покрытие, которое облегчает доступ через извилистые поражения без риска для покрытия. Другим преимуществом предложенного в настоящем изобретении принципа является возможность достижения весьма желательных профилей элюции (например профиль, проиллюстрированный на Фиг. 4-6). Преимущества данного изобретения включают возможность уменьшения или полного устранения потенциально тромбогенных полимеров, а также, возможно, остаточных лекарственных средств, которые могут задерживать долговременное заживление. Кроме того, согласно данному изобретению предложены полезные стенты, имеющие оптимизированную прочность и упругость покрытий, что, в свою очередь, обеспечивает доступ к сложным поражениям и снижает или полностью устраняет отслаивание. Ламинированные слои биорассасывающихся полимеров обеспечивают контролируемое высвобождение одного или более чем одного лекарственного средства. Предложенный здесь принцип уменьшает или полностью устраняет недостаток, ассоциированный с традиционными стентами, высвобождающими лекарственные средства. Например, предложенный здесь принцип обеспечивает намного лучшую настройку периода времени элюции активного агента и периода времени, необходимого для ресорбции полимерной матрицы, минимизируя тем самым тромбоз и другие неблагоприятные эффекты, ассоциированные с плохо контролируемым высвобождением лекарственного средства. Настоящее изобретение дает несколько преимуществ, которые позволяют преодолеть или ослабить ограничения современной технологии биорассасывающихся стентов. Например, неотъемлемое ограничение традиционных биорассасывающихся полимерных материалов относится к сложности получения прочного, гибкого, деформируемого (например баллонорасширяемого) стента с низким профилем. По- 11020509 лимеры обычно не имеют прочности высокоэффективных металлов. Настоящее изобретение преодолевает эти ограничения благодаря созданию многослойной структуры в по существу полимерном стенте. Не желая быть связанными какой-либо конкретной теорией или аналогией, повышенную прочность, обеспечиваемую стентами по изобретению, можно понять, сравнив прочность фанеры с прочностью тонкого листа древесины. Варианты выполнения данного изобретения, включающие тонкий металлический стентовый каркас,обеспечивают преимущества, включая возможность преодоления неотъемлемой эластичности большинства полимеров. Для полимеров обычно сложно получить высокую степень (например, 100%) пластической деформации (по сравнению с эластической деформацией, когда материалы имеют некоторый "отскок" к исходной форме). Вновь, не желая быть связанными какой-либо теорией, центральный металлический стентовый каркас (который слишком мал и непрочен для того, чтобы служить в качестве самого стента) будет действовать подобно стержням внутри пластичного деформируемого стента, в основном преодолевая любую "эластическую память" полимера. Примеры Следующие примеры приведены для того, чтобы дать возможность специалистам в данной области техники более ясно понять и применить на практике настоящее изобретение. Их не следует рассматривать как ограничивающие объем изобретения, но следует рассматривать просто как иллюстрирующие и представляющие его. Пример. В этом примере проиллюстрированы варианты выполнения, в которых предложен коронарный стент с покрытием, включающий стентовый каркас и покрытие рапамицин-полимер, где по меньшей мере часть рапамицина находится в кристаллической форме, и покрытие рапамицин-полимер содержит один или более чем один рассасывающийся полимер. В этих экспериментах использовали два разных полимера: полимер А: 50:50 PLGA-сложноэфирная концевая группа, молекулярная масса 90 кДа, скорость разложения 70 суток; полимер В: 50:50 PLGAкарбоксилатная концевая группа, молекулярная масса 29 кДа, скорость разложения 28 суток. На металлические стенты были нанесены следующие покрытия:AS2b: полимер А/рапамицин/полимер А/рапамицин/полимер В. Результаты по элюции проиллюстрированы на фиг. 4-6. Вышеизложенное иллюстрирует настоящее изобретение, и его не следует истолковывать как ограничивающее изобретение. В то время как здесь были показаны и описаны варианты выполнения настоящего изобретения для специалистов в данной области техники будет очевидно, что такие варианты выполнения приведены лишь в качестве примера. Специалисты в данной области техники теперь могут осуществить многочисленные вариации, изменения и замены без отступления от сущности данного изобретения. Следует понимать, что при применении данного изобретения на практике могут быть использованы разные альтернативы описанных здесь вариантов выполнения данного изобретения. Подразумевается, что следующая формула изобретения определяет объем данного изобретения, и что способы и структуры в пределах объема этой формулы изобретения и их эквиваленты охватываются ею. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Коронарный стент с покрытием, содержащий: а) стентовый каркас; б) ряд слоев, нанесенных на стентовый каркас в форме сухого порошка, с образованием стента с покрытием, где по меньшей мере один из слоев содержит биорассасывающийся полимер и по меньшей мере один из слоев содержит один или более чем один активный агент, где по меньшей мере часть активного агента находится в кристаллической форме, и где формирование слоев включает спекание в условиях, которые, по существу, не изменяют активность активного агента,где биорассасывающийся полимер выбран из группы, включающей сополимер лактид-гликолидl-лактид-гликолид (PGA-LPLA), сополимер dl-лактид-гликолид (PGA-DLPLA), сополимер l-лактид-dlлактид (LPLA-DLPLA) и сополимер гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC). 2. Стент по п.1, где по меньшей мере один из слоев содержит биорассасывающийся сополимерPLGA и по меньшей мере один из слоев содержит рапамицин, где по меньшей мере часть рапамицина находится в кристаллической форме. 3. Стент по п.2, где рапамицин является по меньшей мере на 50% кристаллическим. 4. Стент по п.2, где рапамицин является по меньшей мере на 90% кристаллическим. 5. Стент по п.2, где рапамицин и полимер находятся в одном и том же слое, в отдельных слоях или образуют перекрывающиеся слои. 6. Стент по п.2, где ряд слоев включает пять слоев, нанесенных в следующей последовательности: первый слой полимера, первый слой рапамицина, второй слой полимера, второй слой рапамицина и третий слой полимера. 7. Стент по п.6, где стентовый каркас изготовлен из материала, содержащего следующее: 0,05-0,15 С, 1,00-2,00 Mn, 0,040 Si, 0,030 Р, 0,3 S, 19,00-21,00 Cr, 9,00-11,00 Ni, 14,00-16,00 W, 3,00 Fe и Со остальное, в процентном содержании по массе. 8. Стент по п.6, где стентовый каркас изготовлен из материала, содержащего следующее: максимум примерно 0,025 С, максимум 0,15 Mn, максимум 0,15 Si, максимум 0,015 Р, максимум 0,01 S, максимум 19,00-21,00 Cr, 33-37 Ni, 9,0-10,5 Mo, максимум 1,0 Fe, максимум 1,0 Ti и Со остальное, в максимальном процентном содержании по массе. 9. Стент по п.6, где слои лекарственного средства, по существу, не содержат полимер и слои полимера, по существу, не содержат лекарственное средство. 10. Стент по п.1, где биорассасывающийся полимер выбран из группы, включающей полигликолидDLPLG), 75/25 DLPLG, 65/35 DLPLG, 50/50 DLPLG, политриметиленкарбонат (ТМС), сополимер 1,3 бис-пара-(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA. 11. Способ изготовления коронарного стента с покрытием, включающий: а) предоставление стентового каркаса; б) нанесение на стентовый каркас ряда слоев с образованием стента с покрытием, где по меньшей мере один из слоев содержит биорассасывающийся полимер и где нанесение каждого слоя из ряда слоев на стентовый каркас включает следующие стадии: подачу через первое сопло по меньшей мере одного фармацевтического агента и/или по меньшей мере одного активного биологического агента в форме сухого порошка; подачу через первое сопло или через второе сопло по меньшей мере одного полимера в форме сухого порошка; нанесение на каркас частиц полимера и фармацевтического агента и/или активного биологического агента, где между каркасом и частицами полимера и фармацевтического агента и/или активного биологического агента поддерживается электрический потенциал, с образованием слоя и спекание полученного слоя при условиях, которые, по существу, не изменяют морфологию фармацевтического агента и/или активность биологического агента,где биорассасывающийся полимер выбран из группы, включающей сополимер лактид-гликолидl-лактид-гликолид (PGA-LPLA), сополимер dl-лактид-гликолид (PGA-DLPLA), сополимер l-лактид-dlлактид (LPLA-DLPLA) и сополимер гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC). 12. Способ изготовления коронарного стента, включающий: а) предоставление стентового каркаса; б) нанесение на стентовый каркас ряда слоев с образованием коронарного стента, где по меньшей мере один из слоев содержит биорассасывающийся полимер, по меньшей мере один фармацевтический агент с терапевтически желательной морфологией и/или по меньшей мере один активный биологический агент и где нанесение каждого слоя из ряда слоев на стентовый каркас включает следующие стадии: 1) подачу через первое сопло по меньшей мере одного фармацевтического агента и/или по меньшей мере одного активного биологического агента в форме сухого порошка; 2) получение раствора сверхкритической или околосверхкритической жидкости, содержащего по меньшей мере один растворитель сверхкритической жидкости и по меньшей мере один полимер, и подачу через второе сопло полученного раствора сверхкритической или околосверхкритической жидкости при условиях, достаточных для образования твердых частиц полимера; 3) нанесение на каркас частиц полимера и фармацевтического агента и/или активного биологического агента, где между каркасом и частицами полимера и фармацевтического агента и/или активного биологического агента поддерживается электрический потенциал, с образованием слоя и 4) спекание полученного слоя при условиях, которые, по существу, не изменяют морфологию указанного фармацевтического агента и/или активность биологического агента,где биорассасывающийся полимер выбран из группы, включающей сополимер лактид-гликолидl-лактид-гликолид (PGA-LPLA), сополимер dl-лактид-гликолид (PGA-DLPLA), сополимер l-лактид-dlлактид (LPLA-DLPLA) и сополимер гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC). 13. Способ изготовления коронарного стента, включающий: а) предоставление стентового каркаса; б) нанесение на стентовый каркас ряда слоев с образованием коронарного стента, где по меньшей мере один из слоев содержит биорассасывающийся полимер, по меньшей мере один фармацевтический агент с терапевтически желательной морфологией и/или по меньшей мере один активный биологический агент и где нанесение каждого слоя из ряда слоев на стентовый каркас включает следующие стадии: 1) получение раствора сверхкритической или околосверхкритической жидкости, содержащего по меньшей мере один растворитель сверхкритической жидкости и один или более чем один фармацевтический агент и/или по меньшей мере один активный биологический агент, и подачу через первое сопло полученного раствора сверхкритической или околосверхкритической жидкости при условиях, достаточных для образования твердых частиц одного или более чем одного фармацевтического агента и/или по меньшей мере одного активного биологического агента; 2) получение раствора сверхкритической или околосверхкритической жидкости, содержащего по меньшей мере один растворитель сверхкритической жидкости и по меньшей мере один полимер, и подачу через первое сопло или через второе сопло полученного раствора сверхкритической или околосверхкритической жидкости при условиях, достаточных для образования твердых частиц полимера; 3) нанесение на каркас частиц полимера и фармацевтического агента и/или активного биологического агента, где между каркасом и частицами полимера и фармацевтического агента и/или активного биологического агента поддерживается электрический потенциал, с образованием этого слоя и 4) спекание полученного слоя при условиях, которые, по существу, не изменяют морфологию указанного фармацевтического агента и/или активность указанного биологического агента,где биорассасывающийся полимер выбран из группы, включающей сополимер лактид-гликолидl-лактид-гликолид (PGA-LPLA), сополимер dl-лактид-гликолид (PGA-DLPLA), сополимер l-лактид-dlлактид (LPLA-DLPLA) и сополимер гликолид-триметиленкарбонат-диоксанон (PDO-PGA-TMC). 14. Способ по любому из пп.11-13, дополнительно включающий подачу третьего сухого порошка,содержащего второй фармацевтический агент с терапевтически желательной морфологией в форме сухого порошка и/или активный биологический агент, посредством которой на каркас наносят слой, содержащий по меньшей мере два разных фармацевтических агента и/или активных биологических агента,или на каркас наносят по меньшей мере два слоя, каждый из которых содержит один или два разных фармацевтических агента и/или активных биологических агента. 15. Способ по любому из пп.11-13, где каркас является электростатически заряженным. 16. Способ по любому из пп.11-13, где по меньшей мере 50% фармацевтического агента в форме порошка является кристаллическим. 17. Способ по любому из пп.11-13, где биорассасывающийся полимер выбран из группы, включающей полигликолид (PGA), поли-l-лактид (LPLA), поли-dl-лактид (DLPLA), поликапролактон(ТМС), сополимер 1,3-бис-пара-(карбоксифенокси)пропан-себациновая кислота (p(CPP:SA. 18. Способ по любому из пп.11-13, включающий нанесение 4, 10, 20, 50 или 100 слоев. 19. Способ по любому из пп.11-13, где указанные слои включают чередующиеся слои лекарственного средства и полимера. 20. Способ по п.19, где слои лекарственного средства, по существу, не содержат полимер и слои полимера, по существу, не содержат лекарственное средство.
МПК / Метки
МПК: A61F 2/00, A61L 33/00
Метки: биоразлагаемыми, стенты, слоями
Код ссылки
<a href="https://eas.patents.su/17-20509-stenty-s-biorazlagaemymi-sloyami.html" rel="bookmark" title="База патентов Евразийского Союза">Стенты с биоразлагаемыми слоями</a>
Предыдущий патент: Выделенные антитела к sp35 и их применение
Следующий патент: Модифицированные полипептиды рецептора активина и их применение
Случайный патент: Композиционная мембрана из палладия или сплава палладия и способ её изготовления