Гипоаллергенные варианты главного аллергена из пыльцы betula verrucosa
Номер патента: 19696
Опубликовано: 30.05.2014
Авторы: Мистрелло Джованни, Дзанотта Стефания, Ронкароло Даниэла, Фаладжани Паоло
Формула / Реферат
1. Гипоаллергенный белок, который представляет собой вариант последовательности главного аллергена Bet v2 и который характеризуется пониженной реактивностью в отношении IgE по сравнению с аллергеном Bet v2 дикого типа (SEQ ID NO: 1), где указанный белок выбран из группы, состоящей из SEQ ID NO: 2-6.
2. Молекула нуклеиновой кислоты, кодирующая белок по п.1.
3. Молекула нуклеиновой кислоты по п.2, которая выбрана из группы, состоящей из SEQ ID NO: 8-12.
4. Вектор, содержащий молекулу нуклеиновой кислоты по пп.2, 3.
5. Клетка-хозяин, содержащая вектор по п.4.
6. Фармацевтическая композиция для профилактического или терапевтического лечения аллергических заболеваний, содержащая эффективное количество гипоаллергенного белка по п.1 вместе с фармацевтически приемлемыми носителями и эксципиентами.
7. Композиция по п.6, которая находится в форме вакцины.
8. Применение гипоаллергенного белка по п.1 для изготовления фармацевтической композиции для профилактического или терапевтического лечения аллергических заболеваний.
9. Применение по п.8, где аллергическое заболевание выбрано из бронхиальной астмы и аллергического конъюнктивита.
Текст
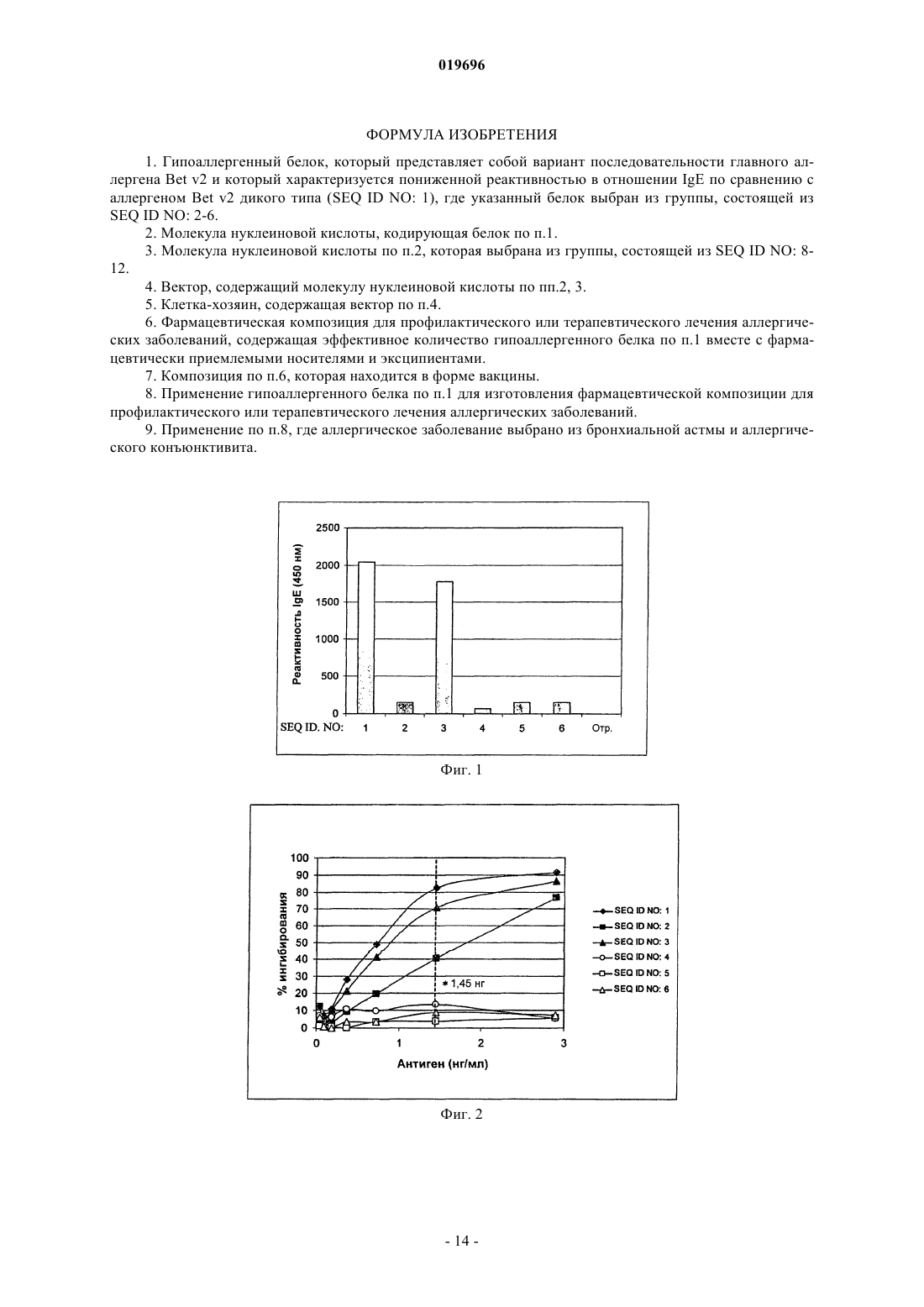
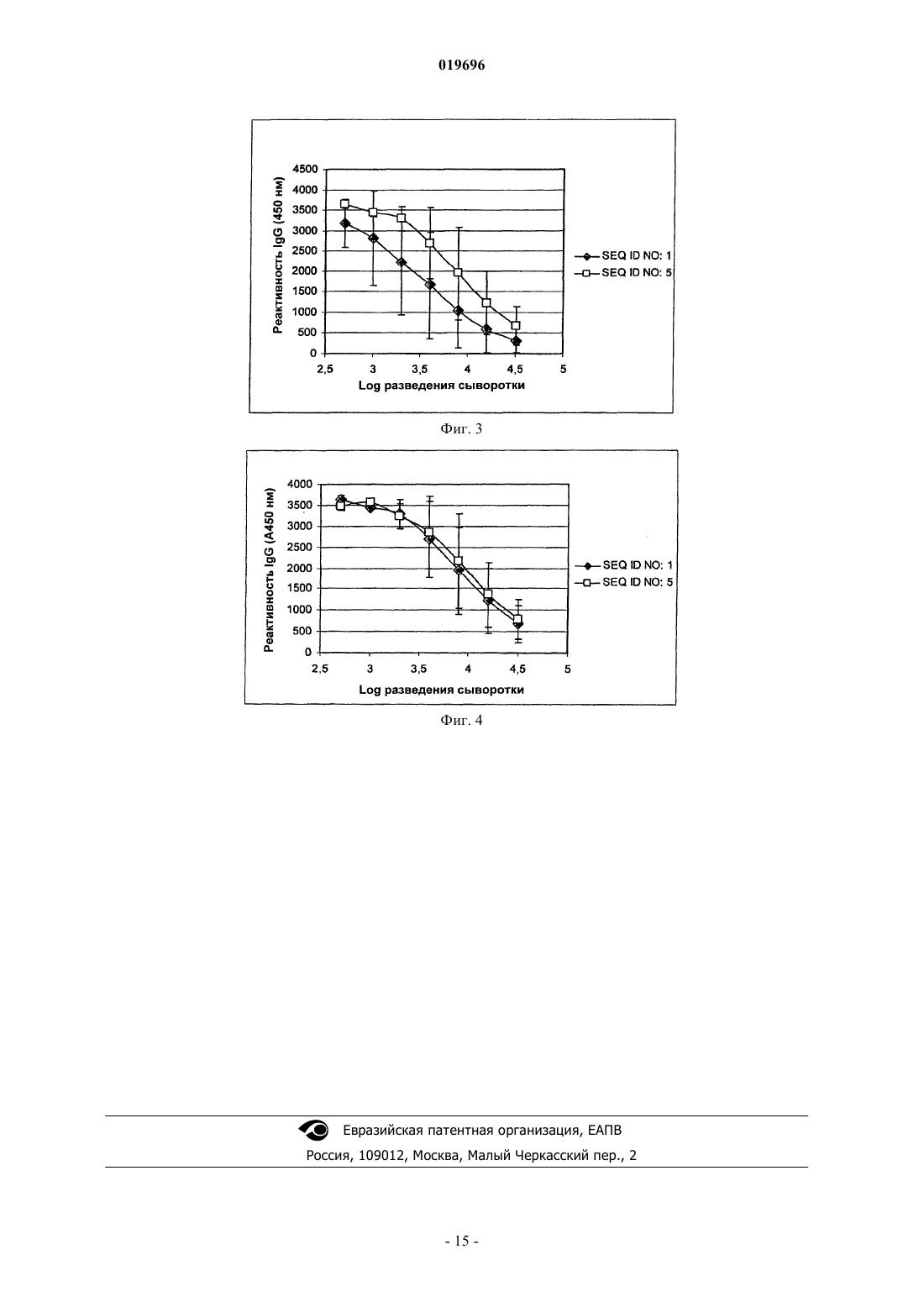
ГИПОАЛЛЕРГЕННЫЕ ВАРИАНТЫ ГЛАВНОГО АЛЛЕРГЕНА ИЗ ПЫЛЬЦЫ Betula Согласно данному изобретению предложены гипоаллергенные варианты главного аллергена Betv2 из пыльцы растения Betula verrucosa и их применение для превентивного или терапевтического лечения аллергических заболеваний. Согласно настоящему изобретению предложены варианты гипоаллергенной последовательности белка Bet v2, молекулы нуклеиновой кислоты, кодирующие их, фармацевтические композиции, содержащие их, и их применение в профилактике и терапии аллергических заболеваний, вызванных пыльцой растений вида Betula verrucosa. Предшествующий уровень техники Аллергии вызываются дисфункцией иммунной системы, которая реагирует на безвредные белки,содержащиеся в пыльце, клещах, эпителии и в определенных пищевых продуктах, путем продукции антител класса IgE. Недавние данные показывают, что более 10% населения в странах Запада страдают от этого заболевания, симптомы которого могут усугубляться со временем, приводя, например, к астме или к сенсибилизации на другие аллергены, затрудняя, таким образом, выбор подходящей терапии. Специфическая гипосенсибилизирующая иммунотерапия (СГИ), в отличие от фармакологической терапии, является единственным этиологическим лечением аллергических заболеваний, способным благоприятно изменять иммунологические параметры, характеризующие такие заболевания. Гипосенсибилизирующая иммунотерапия состоит во введении возрастающих доз стандартизированных экстрактов (вакцин), полученных из того же самого вещества, которое вызывает заболевание (1). Этим способом у пациента постепенно индуцируется вид иммунологической устойчивости к указанному веществу с последующим исчезновением аллергических симптомов. Однако риск вызова серьезных побочных эффектов (2), хотя и значительно сниженный при применении либо вакцин с медленным высвобождением, либо вакцин, вводимых путями, альтернативными инъекциями, на самом деле ограничил применение специфической гипосенсибилизирующей иммунотерапии при лечении аллергических заболеваний. В последние годы наибольшее внимание было направлено на разработку эффективных, более безопасных вакцин, особенно вакцин, состоящих из мутагенизированных рекомбинантных белков, т.е. гипоаллергенных вариантов, способных благоприятно влиять на естественное развитие заболевания без вызова нежелательных побочных эффектов (3). Одним из полезных факторов СГИ является индукция антител IgG, специфичных к сенсибилизирующему аллергену. Эти (защитные) антитела могут ингибировать связывание антиген-IgE, конкретно связывание IgE с антигеном Bet v2, изменяя трехмерную конформацию данной молекулы (4, 5). Разработка вакцин, содержащих гипоаллергенные рекомбинантные белки с неизменными иммуногенными свойствами, может улучшить терапевтической подход к аллергическим заболеваниям. Пыльца растений, таксономически известных как Fagales (береза, ольха, лещина, дуб, граб), является одной из самых важных причин аллергического ринита и астмы в регионах с умеренным климатом. Два главных аллергена пыльцы березы, Bet v1 (кДНК депонирована в GenBank сдоступа Х 15877) иBet v2 ( доступа М 65179), представляют собой белки с молекулярной массой 17 и 14 кДа соответственно (6, 7). Bet v2 принадлежит к семейству профилина, который является распространенным цитоплазматическим белком, вовлеченным в регуляцию цитоскелета эукариотической клетки. Они специфически взаимодействуют по меньшей мере с двумя клеточными (макро)молекулами, т.е. с фосфатидилинозит-4,5-бифосфатом, предотвращая, посредством этого, гидролиз данной жирной кислоты С- фосфолипазой (8), и с актином, модулируя его полимеризацию (9). Высокая экспрессия профилинов в зрелой и прорастающей пыльце свидетельствует об их участии в регуляции предшественников микрофиламентов,которая происходит в процессе прорастания (10). Профилины были идентифицированы в качестве аллергенов в пыльце из многих древесных и травянистых растений и во многих фруктах и овощах, и, таким образом, они были определены как "паналлергены", несмотря на то, что они обнаруживаются только у 20% пациентов, имеющих аллергию к пыльце (11, 12). Высокая гомология последовательности, более чем 60% у большинства растительных профилинов разного происхождения, вызывает перекрестную сенсибилизацию не только пыльцой от ботанически коррелирующих (13) и некоррелирующих (14) растений, но также между пыльцой и растительной пищей(15) или между пыльцой и латексом (16). Гомология между профилинами растений и млекопитающих является скорее низкой, тем не менее, оказалось, что они были способны связывать актин из разных видов и показывали взаимозаменяемость (17, 18, 19). Объяснением является то, что все профилины имеют аналогичную трехмерную структуру, как показано с использованием рентгеноструктурного анализа (20,21, 22). Многие исследования подтверждают иммунологическую эквивалентность профилинов. На самом деле было показано, что IgE от пациентов, сенсибилизированных к определенному профилину, способны связывать профилины другого происхождения и что связывание IgE с профилинами может взаимно ингибироваться (16). Высокая перекрестная реактивность между разными профилинами делает возможным применение одного профилина для диагностики аллергии, и рекомбинантный Bet v2 часто используется как избранный аллерген для определения профилин-специфичного IgE (23, 24). Существует много исследований по определению эпитопов IgE профилина.Vrtala (1996) (25) осуществляли мутирование Bet v2 в положениях Phe44 и Gln47, которые заменяли на Tyr44, Glu47 и Asn47 согласно одновременным исследованиям, проведенным той же самой группой(26), где был идентифицирован линейный эпитоп, распознаваемый моноклональным антителом 4 А 6. Эпитоп, распознаваемый этим антителом, был картирован с использованием синтетических додекапептидов, которые охватывали всю аминокислотную последовательность Bet v2. Пептиды, которые более эффективно связывают антитело, содержали области между аминокислотами 38-49 и 40-51. Важность остатка Gln47 в связывании пептид-IgG поддерживалась доказательством того, что 4 А 6 не был способен распознавать профилины из Nicotiana tabacum и Phleum pratense, в последовательностях которых присутствует глутамат вместо Gln47 в Bet v2. В отличие от мутации Gln47Glu47, замена от Phe44 до Tyr44 или от Gln47 на Asn47 не влияла на связывание антитела. Те же самые мутации (Gln47 на Glu или Asn иPhe44 на Tyr44), применяемые к рекомбинантному Bet v2, не были способны ослаблять связывание между профилином и IgE, как показано иммуноблоттингом и экспериментами ELISA (твердофазный иммуноферментный анализ) (25). В последующем исследовании, опубликованном в 1997 г., (22) главные эпитопы IgE были идентифицированы клонированием случайных фрагментов кДНК профилина березы из библиотеки экспрессии,проанализированной с сывороткой от пациентов, имеющих аллергию к профилинам. Три области, соответствующие альфа-спиралям, расположенные на амино- (аминокислоты 1-30) и карбокси- (аминокислоты 106-132) концах, и фрагменту, находящемуся между остатками 30 и 50, оказались более реактивными. В последующем исследовании (23) поиск эпитопов IgE был основан на сравнении между теоретическими структурными моделями профилинов из разных растений и березы или кристаллами профилина латекса. Было предсказано одиннадцать потенциальных конформационных эпитопов, состоящих из областей из смежных аминокислот, по меньшей мере 20% которых экспонированы на поверхности. Из сравнения аминокислотных последовательностей с конформационными моделями получено два типа эпитопов: видоспецифичные, характеризующиеся высокой вариабельностью, и высококонсервативные,которые с большей вероятностью участвуют в перекрестной реактивности между профилинами из разных растений. Выравнивания аминокислотных последовательностей отражают результаты исследованияFedorov (22), доказывающие наличие двух потенциальных линейных эпитопов на N-конце, трех - в области между остатками 30 и 80 и двух дополнительных - на С-конце профилина. Все эти области являются высококонсервативными у профилинов растений, проанализированных в этом исследовании. Предсказание потенциальных конформационных эпитопов было основано на анализе трехмерной модели профилина латекса Hev b8. Данный анализ доказал наличие 12 выступающих остатков, выбранных в качестве центров эпитопов. Несмотря на то что все потенциальные эпитопы были конформационными, они содержали линейные последовательности и либо консервативные, либо вариабельные остатки. В этом исследовании не сообщали о тесте для подтверждения специфической способности предложенных эпитопов к связыванию с IgE. Более новая публикация касается идентификации эпитопов IgE профилина Cucumis melo (27). Посредством определения IgE реактивности пептидов, охватывающих полную аминокислотную последовательность этого белка, идентифицировали два линейных эпитопа, которые эффективно распознаются сывороткой пациентов, имеющих аллергию на дыню: Е 1, содержащий остатки 66-75 и 81-93, и Е 2, состоящий из аминокислот 95-99 и 122-131. Два дополнительных эпитопа были охарактеризованы по более слабому ответу IgE, а именно: Е 3 (остатки 2-10) и Е 4 (35-45). Перекрытие пептидов, соответствующих эпитопам Е 1 и Е 2, с трехмерной моделью профилина дыни указывает на две области с хорошо определенными электростатическими свойствами: Е 1 и Е 2, которые ассоциированы с электропозитивными и электронегативными доменами белка соответственно. Данные, имеющиеся в литературе, говорят о частях молекул, где расположены эпитопы профилина для IgE, но не могут показать аминокислоты, участвующие в связывании IgE. Описание изобретения Теперь обнаружили, что посредством замены или делеции одного или более чем одного аминокислотного остатка в последовательности аллергена Bet v2 он становится менее реактивным к антителамIgE. В первом аспекте согласно данному изобретению предложен гипоаллергенный белок, который представляет собой вариант последовательности аллергена Bet v2 и который характеризуется: 1) пониженной реактивностью к IgE по сравнению с аллергеном Bet v2 дикого типа (SEQ ID NO: 1); 2) аминокислотной последовательностью, которая: а) по меньшей мере на 90%, предпочтительно по меньшей мере на 93%, более предпочтительно по меньшей мере на 97% идентична SEQ ID NO: 1; б) в выравнивании последовательности с SEQ ID NO: 1 имеет по меньшей мере одну замену или делецию остатков Ser или Lys, соответствующих Ser39, Lys45, Lys88 или Lys89 в SEQ ID NO: 1. В предпочтительном воплощении варианты аллергена Bet v2 согласно данному изобретению представляют собой целый ряд замен или делеций, варьирующих от 1 до 3 в указанных положениях, где генерируются варианты с одиночной, двойной или тройной заменой и/или делецией. Несмотря на то что в молекуле Bet v2 могут одновременно присутствовать замены и делеции разных аминокислотных остат-2 019696 ков, варианты, полученные одиночной заменой одного или более чем одного остатка в указанных положениях, являются предпочтительными, особенно те, в которых такие остатки заменены нейтральной,полярной или кислой аминокислотой, которая предпочтительно выбрана из Ala, Thr, Gly, Pro, Leu, lle,Ser, Phe, Glu, Asp, более предпочтительно из Ala, Thr, Ser, Gly, Glu, Asp. Примеры вариантов согласно данному изобретению идентифицированы в SEQ ID NO: 2 (замена 1 остатка), SEG ID NO: 3 (замена 1 остатка), SEQ ID NO: 4 (замена 2 остатков), SEQ ID NO: 5 (замена 3 остатков) и SEQ ID NO: 6 (замена 3 остатков). По сравнению с аналогом дикого типа варианты аллергена Bet v2 с заменой и/или делецией согласно данному изобретению показывают IgE реактивность к сыворотке пациентов с аллергией на пыльцуBetula verrucosa, которая является сниженной по меньшей мере на 10%, предпочтительно по меньшей мере на 50%, более предпочтительно по меньшей мере на 90%, где IgE реактивность измеряют, например, посредством анализа ELISA. В другом аспекте согласно данному изобретению предложен иммунологически активный пептид,соответствующий фрагменту Bet v2, содержащий по меньшей мере одну из вышеописанных замен и/или делеций. Указанный пептид предпочтительно содержит от 15 до 35, более предпочтительно от 15 до 20 аминокислотных остатков. Выражение "иммунологически активный пептид" в том виде, как оно здесь используется, указывает на пептид, который способен вызывать IgE-независимый иммунный ответ. Варианты с заменой и/или делецией согласно данному изобретению можно легко получить мутагенезом последовательности кДНК Bet v2 дикого типа (SEQ ID NO: 7) с использованием способов и методик, известных специалистам в данной области. Последовательности кДНК, кодирующие варианты с одиночной, двойной и тройной заменами,идентифицированные в SEQ ID NO: 2-6, описаны в SEQ ID NO: 8-12. В других аспектах согласно данному изобретению предложена молекула нуклеиновой кислоты, кодирующая гипоаллергенный вариант Bet v2, раскрытый здесь, или пептид, происходящий из него, и вектор экспрессии, содержащий указанную молекулу, функциональным образом связанную с генетическими элементами, контролирующими ее экспрессию в эукариотических или в прокариотических клетках,такими как транскрипционные промоторы, энхансеры, сигнальные и лидерные последовательности или другие последовательности, участвующие в регуляции транскрипции. Примеры векторов включают плазмиды, вирусы и фаги, но также можно использовать любой другой вектор, который обычно используется в генной инженерии. Данное изобретение, кроме того, включает прокариотическую или эукариотическую клеткухозяина, которая трансформирована или трансфицирована вектором по изобретению. Для клонирования вектора и экспрессии кДНК обычно используют прокариотические клетки, такие как Escherichia coli илиBacillus subtilis, или эукариотические клетки, такие как Saccharomyces cerevisiae. Кроме того, гипоаллергенные варианты согласно данному изобретению можно продуцировать в виде слитых белков. Благодаря их сниженной IgE-реактивности, варианты Bet v2 согласно настоящему изобретению можно с удобством использовать для получения фармацевтических композиций (например таблеток) для превентивного или терапевтического лечения индивидуумов, имеющих аллергию на пыльцу Betula verrucosa. В другом аспекте данное изобретение, следовательно, направлено на фармацевтическую композицию, содержащую эффективное количество предложенного здесь гипоаллергенного варианта Bet v2,возможно в комбинации с другими аллергенами Betula verrucosa и/или с фармацевтически приемлемыми носителями и эксципиентами. В предпочтительном воплощении данная фармацевтическая композиция находится в форме вакцины, подлежащей применению в профилактике или в терапии аллергических заболеваний, включая бронхиальную астму, аллергический ринит, аллергический дерматит и аллергический конъюнктивит. Теория и практика вакцинации известны любому специалисту в данной области (28,29). Следующие примеры дополнительно иллюстрируют данное изобретение. Если не указано иначе,способы, использованные в примерах, описаны в Sambrook, Fritsch ET Maniatis "Molecular cloning.A laboratory manual", II ed. Vol. 1-2-3 CSH Lab Press 1989. Краткое описание графических материалов Фиг. 1: анализ ELISA IgE реактивности на аллерген Bet v2 и на гипоаллергенные варианты Bet v2. Фиг. 2: ингибирование связывания IgE с аллергеном Bet v2. Фиг. 3: мышиный IgG ответ на соответствующие иммуногенные белки. Фиг. 4: ответ IgG у мышей, иммунизированных SEQ ID NO: 5. Пример 1. Сайт-специфичный мутагенез кДНК, кодирующей аллерген Bet v2. Сайт-специфичный мутагенез кДНК, кодирующей аллерген Bet v2 (SEQ ID NO: 7), проводили посредством клонирования кДНК в прокариотическом векторе (pBluescript, GenBankХ 52327) с последующей ПЦР (полимеразная цепная реакция) амплификацией. Олигонуклеотиды, используемые в качестве праймеров в ПЦР реакции (таблица), несли подходящие замены оснований. Для каждого мутагенеза использовали связывание комплементарного олигонуклеотида с соответствующей областью нити ДНК(30). После амплификации неизмененную исходную матрицу селективно деградировали ферментативным расщеплением, катализируемым рестрикционным ферментом Dpnl. Затем клетки Escherichia coli трансформировали мутированными молекулами. Клоны, полученные из одиночных бактериальных колоний, секвенировали по Сенджеру для определения правильной модификации оснований и отсутствия неспецифичных мутаций в кДНК. Последовательности олигонуклеотидов, использованных в качестве праймеров в сайт-специфичном мутагенезе. Мутированные основания показаны жирными буквами. Пример 2. Продукция белка Bet v2 и его вариантов. кДНК Bet v2 дикого типа (SEQ ID NO: 7) и мутированные (SEQ ID NO: 8-12) клонировали и экспрессировали в Escherichia coli согласно стандартным протоколам (31, 32). Клетки собирали центрифугированием, ресуспендировали в 1 Х PBS (забуференный фосфатом физиологический раствор) (NaH2PO4 6,46 мМ, KH2PO4 1,47 мМ, NaCl 136,89 мМ) и лизировали посредством обработки ультразвуком. Рекомбинантные белки разделяли центрифугированием. Осадок, содержащий нерастворимый белковый агрегат, ресуспендировали в денатурирующем буфере: 1 Х PBS, 6 М мочевина, и перемешивали в течение 60 мин при 4 С. Солюбилизированные рекомбинантные белки отделяли от нерастворимого дебриса центрифугированием, диализировали против 1 Х PBS, фильтровали через 1 мкм фильтр и очищали аффинной хроматографией с использованием агарозных колонок, дериватизированных полипролином (Sigma,Milan, Italy). После промывки 1 Х PBS, 2 М мочевина рекомбинантные белки элюировали 1 Х PBS, 8 М мочевина и обеспечивали их повторное сворачивание посредством диализа в течение 16 ч при 4 С в 1 Х растворе PBS. Пример 3. Характеристики сыворотки от субъектов-аллергиков. Сыворотку отбирали у индивидуумов с клиническим анамнезом сезонной аллергии на пыльцуBetula verrucosa и специфической реактивностью RAST 3+ и 4+ на аллерген Bet v2 и затем ее объединяли и использовали в этой форме. Пул сыворотки от пациентов, не имеющих аллергии, использовали в качестве негативного контроля. Пример 4. ELISA анализ реактивности вариантов Bet v2 в отношении IgE из пула сыворотки.IgE реактивность белков с SEQ ID NO: 2-6 из пула сывороток пациентов-аллергиков протестировали в анализе ELISA (фиг. 1). Одинаковое количество аллергена дикого типа и мутированных вариантов (1 мкг) в буфере 50 мМ карбонат/бикарбонат, рН 9,6, адсорбировали на лунках полистирольных планшетов для анализа ELISA путем инкубации при 4 С в течение 16 ч. Лунки промывали промывочным раствором (60 мМ фосфатный буфер, рН 6,5, содержащий 0,05% Tween-20) и блокировали разбавляющим раствором (25% сыворотка козы, 1 мМ EDTA (этилендиаминтетрауксусная кислота), 0,05% Tween-20, 0,01% тиомерсал в 150 мМ фосфатном буфере, рН 7,4). 70 мкл аликовоты пула человеческой сыворотки с RAST 3+ и 4+ в буфере для разведения добавляли к каждой пробе и инкубировали при 25 С в течение 2 ч. После трех промывок добавляли сыворотку против человеческого IgE, конъюгированную с пероксидазой (1:1500 в буфере для разведения) с последующей инкубацией при 25 С в течение 1,5 ч. После трех промывок проводили колориметрическую реакцию путем добавления 100 мкл реагента ТМВ (3,3',5,5'-тетраметилбензидин, BioFXLaboratories, Owings Mills, MD) и инкубации в течение 15 мин при 25 С. Реакцию останавливали добавлением 100 мкл 1 н. HCl и снимали показания при 450 нм с использованием спектрофотометра микропланшетного формата. По сравнению с аллергеном Bet v2 дикого типа (SEQ ID NO: 1) наблюдали среднее уменьшение IgE реактивности на 92% (SEQ ID NO: 2), 13% (SEQ ID NO: 3), 97% (SEQ ID NO: 4) и 93% (SEQ ID NO: 5 и 6), когда такие белки инкубировали с пулом сыворотки от пациентов, имеющих аллергию на пыльцу березы. Эти результаты подтвердили экспериментами REAST (энзимоаллергосорбентный тест с инвертированной последовательностью добавления реагентов) ингибирования, которые позволяют оценить реактивность гомологичных эпитопов из разных белков. Пример 5. REAST анализ ингибирования. Варианты Bet v2 ингибируют связывание между биотинилированным Bet v2 и IgE, содержащимися в пуле сыворотки Аликвоты (50 мкл) пула человеческой сыворотки с RAST 4+ и 3+ к Bet v2, разведенные 1:3 в буфере для разведения (25% сыворотка козы, 1 мМ EDTA, 0,05% Tween-20, 0,01% тиомерсал в 150 мМ фосфатном буфере, рН 7,4), подвергали предварительной икубации при 25 С в течение 1,5 ч с серийными разведениями аллергена дикого типа или его мутантов, начиная с 67 нг/мл. Данные смеси затем добавляли в лунки полистирольных планшетов для ELISA с адсорбированным человеческим антителом противIgE и инкубировали при 25 С в течение 1,5 ч. После трех промывок 0,06 М фосфатным буфером, рН 6,5,0,05% Tween-20, добавляли 0,1 мл биотинилированного антигена Bet v2 (85,3 нг/мл) в буфере для разведения при 25 С в течение 1 ч. После трех промывок добавляли пероксидазу, конъюгированную со стрептавидином (0,1 мкг/мл) в течение 30 мин при 25 С. Колориметрическую реакцию проводили со 100 мкл 1 н. HCl и регистрировали показания спектрофотометра при 450 нм. Процент ингибирования рассчитывали следующим образом: 100[(А-В)/А], где А представляет собой поглощение, измеренное при 450 нм в отсутствие ингибитора, и В представляет собой поглощение в присутствии ингибитора. В присутствии 1,45 нг ингибитора связывание Bet v2 дикого типа (SEQ ID NO: 1) с IgE из пула сыворотки пациентов-аллергиков ингибируется на 82,6% при предварительной обработке сыворотки тем же самым белком, на 40,4 и 71% при предварительной инкубации сыворотки с вариантами SEQ ID NO: 2 иSEQ ID NO: 3 соответственно, тогда как наблюдавшееся ингибирование составляет только 13,4, 4 и 8,8% при предварительной инкубации сыворотки с идентичными количествами соответственно варианта с двойной заменой (SEQ ID NO: 4) и вариантов с тройной заменой (SEQ ID NO: 5 и SEQ ID NO: 6) (фиг. 2). Эти результаты ясно показывают, что аминокислоты в положениях 39, 45, 88, 89 SEQ ID NO: 1 участвуют в распознавании аллергена Bet v2 IgE. Пример 6. Протокол для иммунизации мышей Balb/c. Две группы из 5 самок мышей Balb/c (Charles River) подкожно иммунизировали 200 мкл эмульсии,содержащей 100 мкл полного адъюванта Фрейнда и 20 мкг антигена (SEQ ID NO: 1, SEQ ID NO: 5) в 100 мкл физиологического раствора. Проводили три дополнительные бустер-иммунизации с 1-недельными интервалами, заменяя полный адъювант неполным адъювантом. В качестве контроля пяти мышам вводили несвязанный антиген. Пробу крови отбирали через семь суток после последней иммунизации из яремной вены и использовали в ELISA для контроля антительного ответа против каждого иммуногенного агента. У мышей, иммунизированных SEQ ID NO: 5, также анализировали способность распознавать белок дикого типа. Пример 7. ELISA анализ IgG-специфичного ответа у иммунизированных мышей. Одинаковые количества Bet v2 дикого типа и варианта SEQ ID NO: 5 (0,25 мкг) в 50 мМ буфере карбонат/бикарбонат, рН 9,6, адсорбировали на лунках полистирольных планшетов для ELISA анализа путем инкубации в течение 16 ч при 4 С. Лунки промывали промывочным раствором (60 мМ фосфатный буфер, рН 6,5, содержащий 0,05% Tween-20) и блокировали раствором для разведения (25% сыворотка лошади, 1 мМ EDTA, 0,05% Tween-20, 0,01% тиомерсал в 150 мМ фосфатном буфере, рН 7,4). 100 мкл аликвоты серийных разведений (в буфере для разведения) сыворотки от каждой мыши помещали в лунки и инкубировали в течение 2 ч при 25 С. После трех промывок сыворотку против мышиного IgG, конъюгированную с пероксидазой, разводили 1:2000 в буфере для разведения и добавляли в лунки с последующей инкубацией в течение 1,5 ч при 25 С. После трех промывок проводили колориметрическую реакцию путем добавления 100 мкл реагента ТМВ (BioFX Laboratories, Owings Mills, MD) и инкубировали в течение 15 мин при 25 С. Реакцию останавливали 100 мкл 1 н. HCl с последующим снятием спектрофотометрических показаний при 450 нм. Фиг. 3 и 4 показывают среднюю реактивность, полученную анализом сыворотки из 5 мышей для каждой группы. Кроме того, в экспериментах по иммунизации мышей Balb/c оказалось, что и аллерген Bet v2 дикого типа, и гипоаллергенный белок SEQ ID NO: 5 (выбранный в качестве примера мутированного аллергена) способны индуцировать IgG-специфичный иммунный ответ (фиг. 3). Антитела противSEQ ID NO: 5 были способны распознавать данный аналог SEQ ID NO: 1 дикого типа (фиг. 4), демонстрируя то, что замена остатков Lys в положениях 45, 88, 89 не определяет значительного изменения иммуногенности молекулы и ее эпитопов для IgG. Напротив, антитела, присутствующие в сыворотке мышей, иммунизированных нескоррелированным антигеном, не были способны распознавать ни Bet v2 дикого типа, ни SEQ ID NO: 5. Библиография 1) Malling H.J. (1998). "Immunotherapy as an effective tool in allergy treatment". Allergy, 53: 461. 2) Toubi E., Kessel A., Blant A., Golan T.D. (1999). "Follow-up after systemic adverse reactions of ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гипоаллергенный белок, который представляет собой вариант последовательности главного аллергена Bet v2 и который характеризуется пониженной реактивностью в отношении IgE по сравнению с аллергеном Bet v2 дикого типа (SEQ ID NO: 1), где указанный белок выбран из группы, состоящей изSEQ ID NO: 2-6. 2. Молекула нуклеиновой кислоты, кодирующая белок по п.1. 3. Молекула нуклеиновой кислоты по п.2, которая выбрана из группы, состоящей из SEQ ID NO: 812. 4. Вектор, содержащий молекулу нуклеиновой кислоты по пп.2, 3. 5. Клетка-хозяин, содержащая вектор по п.4. 6. Фармацевтическая композиция для профилактического или терапевтического лечения аллергических заболеваний, содержащая эффективное количество гипоаллергенного белка по п.1 вместе с фармацевтически приемлемыми носителями и эксципиентами. 7. Композиция по п.6, которая находится в форме вакцины. 8. Применение гипоаллергенного белка по п.1 для изготовления фармацевтической композиции для профилактического или терапевтического лечения аллергических заболеваний. 9. Применение по п.8, где аллергическое заболевание выбрано из бронхиальной астмы и аллергического конъюнктивита.
МПК / Метки
МПК: A61K 39/36, C12N 1/21, C07K 14/415, C12N 15/29
Метки: пыльцы, гипоаллергенные, verrucosa, аллергена, варианты, главного, betula
Код ссылки
<a href="https://eas.patents.su/16-19696-gipoallergennye-varianty-glavnogo-allergena-iz-pylcy-betula-verrucosa.html" rel="bookmark" title="База патентов Евразийского Союза">Гипоаллергенные варианты главного аллергена из пыльцы betula verrucosa</a>
Предыдущий патент: Жидкие композиции солей 4-[2-(4-метилфенилсульфанил)фенил]пиперидина
Следующий патент: Установка для охлаждения двигателя
Случайный патент: Приводная система для уборочной машины