Способ количественного определения уровня естественных аутоантител в биологических жидкостях человека путем иммуноферментного анализа
Номер патента: 20484
Опубликовано: 28.11.2014
Авторы: Тарасов Александр Владимирович, Сергеева Светлана Александровна, Тарасов Сергей Александрович, Вэн Дер Мэйде Питер Х.
Формула / Реферат
1. Способ количественного определения уровня естественных аутоантител в биологических жидкостях человека путем иммуноферментного анализа, включающий обработку твердой фазы физической сорбции антигеном, внесение тестируемых биологических образцов, обработку твердой фазы конъюгатсодержащим раствором, разделение твердой и жидкой фаз и спектрофотометрический анализ реакции по экстинции раствора хромагента, отличающийся тем, что в качестве твердой фазы физической сорбции используют твердую фазу физической сорбции, покрытую стрептавидином, а обработку твердой фазы физической сорбции производят предварительно биотинилированным антигеном и блокирующим агентом для закрытия на твердой фазе физической сорбции мест неспецифического связывания, в качестве которого используют биотинилированные по стандартной процедуре белки, в качестве конъюгатсодержащего раствора используют моноклональные или поликлональные антитела, меченные ферментом, реагирующие с одним или всеми изотипами человеческих иммуноглобулинов, при этом тестируемую биологическую жидкость предварительно разводят в буфере, содержащем белки, используемые для закрытия на твердой фазе физической сорбции мест неспецифического связывания, а также вещества, защищающие естественные аутоантитела от разрушения при термической обработке, и подвергают термической обработке, для каждого из тестируемых образцов биологической жидкости применяют контрольную твердую фазу физической сорбции, на которой не иммобилизирован биотинилированный антиген, а количество естественных аутоантител определяют с использованием калибровочной кривой, которая строится с использованием моноклональных или поликлональных антител к антигену.
2. Способ количественного определения уровня естественных аутоантител в биологических жидкостях человека по п.1, отличающийся тем, что перед термической обработкой тестируемую биологическую жидкость, разведенную в буфере, содержащем белки, используемые для закрытия на твердой фазе физической сорбции мест неспецифического связывания, и вещества, защищающие естественные аутоантитела от разрушения при термической обработке, дополнительно подвергают воздействию железосодержащим окислителем.
Текст
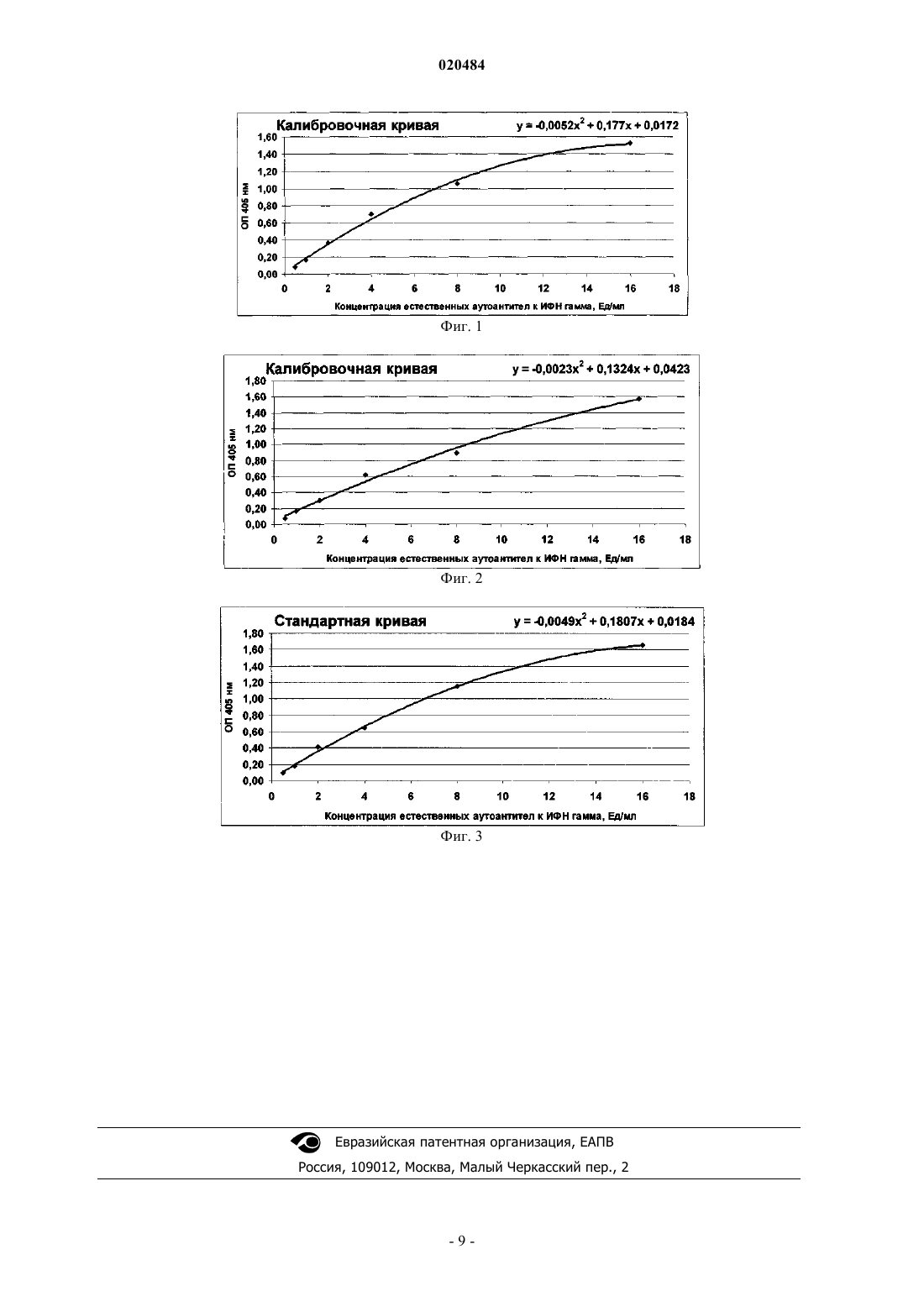
СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ УРОВНЯ ЕСТЕСТВЕННЫХ АУТОАНТИТЕЛ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ ЧЕЛОВЕКА ПУТЕМ ИММУНОФЕРМЕНТНОГО АНАЛИЗА Способ количественного определения уровня естественных аутоантител в биологических жидкостях человека, в котором в качестве твердой фазы физической сорбции используют твердую фазу физической сорбции, покрытую стрептавидином, а обработку твердой фазы физической сорбции производят предварительно биотинилированным антигеном и блокирующим агентом для закрытия на твердой фазе физической сорбции мест неспецифического связывания,в качестве которого используют биотинилированные по стандартной процедуре белки, в качестве конъюгатсодержащего раствора используют моноклональные или поликлональные антитела, меченные ферментом, реагирующие с одним или всеми изотипами человеческих иммуноглобулинов, при этом тестируемую биологическую жидкость предварительно разводят в буфере, содержащем белки, используемые для закрытия на твердой фазе физической сорбции мест неспецифического связывания, а также вещества, защищающие естественные аутоантитела от разрушения при термической обработке, и подвергают термической обработке, для каждого из тестируемого образца биологической жидкости применяют контрольную твердую фазу физической сорбции, на которой не иммобилизирован биотинилированный антиген, а количество естественных аутоантител определяют с использованием калибровочной кривой, которая строится с использованием моноклональных или поликлональных антител к антигену.(RU), Вэн Дер Мэйде Питер Х. (NL) Область техники Изобретение относится к области медицины, в частности к лабораторной диагностике, и может быть использовано для повышения эффективности и достоверности количественного определения концентрации естественных аутоантител в биологических жидкостях человека. Предшествующий уровень техники Из уровня техники известен способ количественного определения уровня аутоантител к эндогенным белкам в биологических жидкостях человека путем твердофазного иммуноферментного анализа(ИФА) (RU 2137134 C1, G01N 33/53, 1999). Однако данный способ мало пригоден для количественного определения уровня естественных аутоантител в биологических жидкостях человека. Известен также способ проведения иммуноферментного анализа, включающий адсорбцию антигенов на твердой фазе физической сорбции, инкубацию тестируемых биологических образцов, инкубацию конъюгатсодержащего раствора, спектрофотометрический анализ реакции по экстинции раствора хромагента (RU 2014610 С 1, G01N 33/535, 1994). Кроме того, также известен способ проведения иммуноферментного анализа для определения уровня естественных аутоантител, включающий адсорбцию антигенов на твердой фазе физической сорбции,инкубацию тестируемых биологических образцов, инкубацию конъюгатсодержащего раствора и спектрофотометрический анализ реакции по экстинции раствора хромагента (BMS217TEN Human anti-IFNalpha ELISA, Bender MedSystems GmbH, Австрия). Несмотря на достаточную простоту, чувствительность и специфичность данного решения, полученные результаты могут быть ложноположительными из-за неспецифического и низкоаффинного связывания различных иммуноглобулинов сыворотки или плазмы с антигеном, адсорбированным на ИФА планшете. Кроме того, присутствие в крови полиреактивных иммуноглобулинов, не являющихся естественными антителами, также приводит к получению ложноположительных результатов из-за неспецифического связывания полиреактивных иммуноглобулинов с компонентами ИФА планшета. Более того, в ИФА детектируется только фракция свободных естественных аутоантител, в то время как большая часть естественных аутоантител присутствуют в крови в связанном со своим антигеном комплексе. Раскрытие изобретения Изобретение направлено на создание технологически простого, чувствительного и специфического способа количественного определения уровня естественных аутоантител в биологических жидкостях человека ИФА методом. Решение поставленной задачи обеспечивается тем, что в способе количественного определения уровня естественных аутоантител в биологических жидкостях человека путем иммуноферментного анализа, включающем обработку твердой фазы физической сорбции антигеном, внесение тестируемых биологических образцов, обработку твердой фазы конъюгатсодержащим раствором, разделение твердой и жидкой фаз и спектрофотометрический анализ реакции по экстинции раствора хромагента, согласно изобретению, в качестве твердой фазы физической сорбции используют твердую фазу физической сорбции,покрытую стрептавидином, а обработку твердой фазы физической сорбции производят предварительно биотинилированным антигеном и блокирующим агентом для закрытия на твердой фазе физической сорбции мест неспецифического связывания, в качестве которого используют биотинилированные по стандартной процедуре белки, в качестве конъюгатсодержащего раствора используют моноклональные или поликлональные антитела, меченные ферментом, реагирующие с одним или всеми изотипами человеческих иммуноглобулинов, при этом тестируемую биологическую жидкость предварительно разводят в буфере, содержащем белки, используемые для закрытия на твердой фазе физической сорбции мест неспецифического связывания, а также вещества, защищающие естественные аутоантитела от разрушения при термической обработке, и подвергают термической обработке, для каждого тестируемого образца биологической жидкости применяют соответствующую контрольную твердую фазу физической сорбции,на которой не иммобилизирован биотинилированный антиген (т.е. для каждого тестируемого образца биологической жидкости для связывания со стрептавидином твердой фазы применяют биотинилированный контрольный белок, идентичный белку, используемому для закрытия на твердой фазе физической сорбции мест неспецифического связывания, что позволяет измерить специфический и не специфический для естественных аутоантител спектрофотометрический сигнал), а количество естественных аутоантител определяют с использованием калибровочной кривой, которая стандартизуется по моноклональным или поликлональным антителам к антигену. Кроме того, перед термической обработкой тестируемую биологическую жидкость, разведенную в буфере, содержащем белки, используемые для закрытия на твердой фазе физической сорбции мест неспецифического связывания, и вещества, защищающие естественные аутоантитела от разрушения при термической обработке, дополнительно подвергают воздействию железосодержащим окислителем. Благодаря сочетанию использования в качестве твердой фазы физической сорбции твердой фазы физической сорбции, покрытой стрептавидином, и биотинилированных антигенов, у иммобилизированного антигена все эпитопы остаются свободными для связывания с ними естественных аутоантител, и тем самым повышается чувствительность заявленного способа, в то время как прямая иммобилизация антигена приводит к конформационным изменениям и разрушению эпитопов антигена, что снижает чув-1 020484 ствительность ИФА метода. Кроме того, использование антител, меченных ферментом и реагирующих с одним или всеми изотипами человеческих иммуноглобулинов, позволяет определить уровень определенного изотипа или всех изотипов естественных аутоантител и, соответственно, расширяет функциональные возможности заявленного способа. Предварительное разведение исследуемого образца в буфере, содержащем белки, присутствующие в блокирующем буфере и используемые для закрытия на твердой фазе физической сорбции мест неспецифического связывания, минимизирует возможность неспецифического связывания антител исследуемого образца с твердой фазой, на которой иммобилизированы белки, что также повышает специфичность и чувствительность заявленного способа. Добавление железосодержащего окислителя и проведение термической обработки исследуемого образца позволяют разрушить комплекс естественных аутоантител с антигенами и антиидиотипическими антителами или обеспечивать доступность паратопов антител эпитопам антигенов за счет различных демаскирующих эффектов, а предварительное разведение исследуемого образца в буфере защищает естественные аутоантитела от разрушения при термической обработке, что позволяет определить общий уровень естественных аутоантител (т.е. как свободную и связанную с антигеном формы естественных аутоантител или естественных аутоантител с закрытыми паратопами), и тем самым снижает возможность получения ложноотрицательных результатов, повышает чувствительность, эффективность и функциональные возможности заявленного способа. Использование для каждого из исследуемого образца биологической жидкости индивидуальной контрольной твердой фазы физической сорбции, на которой иммобилизирован биотинилированный блокирующий белок, позволяет измерить специфический для естественных аутоантител спектрофотометрический сигнал и не специфический спектрофотометрический сигнал, что также снижает возможность получения ложноположительных результатов и повышает чувствительность заявленного способа. Кроме того, заявленная совокупность существенных признаков, которая обеспечивает возможность количественного определения уровня естественных аутоантител, расширяет арсенал технических средств для решения поставленной задачи. Краткое описание чертежей На фиг. 1 представлена калибровочная кривая для примера 1. На фиг. 2 показана калибровочная кривая для примера 2. На фиг. 3 показана калибровочная кривая для примера 3. Варианты осуществления изобретения Заявленный способ количественного определения уровня естественных аутоантител в биологических жидкостях человека реализуют следующим образом. Твердую фазу физической сорбции (лунки) стандартного луночного планшета покрывают стрептавидином или его аналогами (например, авидином и др.), блокируют твердую фазу физической сорбции блокирующим агентом и инкубируют с биотинилированным антигеном, к которому необходимо определить уровень естественных аутоантел, или (контрольные лунки) с биотинилированным блокирующим белком (например, бычий сывороточный альбумин, овальбумин, человеческий сывороточный альбумин,кроличий сывороточный альбумин, желатин и др.), являющимся контролем неспецифического связывания. Антигены биотинилируются минимальным количеством биотина (молярное отношение антиген:биотин составляет 1:2) для минимизации разрушения эпитопов. Подготавливают для анализа исследуемую биологическую жидкость (например, сыворотка крови,плазма крови и др.), при этом тестируемые образцы разводят (от 50 до 200000 раз) в буферном растворе,содержащем белки, входящие в состав блокирующего буфера (например, бычий сывороточный альбумин, овальбумин, человеческий сывороточный альбумин, кроличий сывороточный альбумин, желатин и др.), консерванты (например, тимерозал и др.), поверхностно-активные вещества (например, Triton Х-100 и др.), которые защищают естественные аутоантитела от разрушения при термической обработке, и проводят термическую обработку полученного раствора биологической жидкости путем инкубации в температурном диапазоне от 50 до 80 С. Предпочтительно перед термической обработкой тестируемую биологическую жидкость дополнительно обработать железосодержащим окислителем (например, хлорид железа(III) [FeCl3]). Затем термически обработанный раствор исследуемой биологической жидкости вносят в лунки так же, как и антигенспецифические антитела, используемые для построения калибровочной кривой, в качестве которых используют моноклональные или поликлональные антитела к антигену с известной концентрацией. Для проявления образовавшегося иммунного комплекса (антиген - естественные аутоантитела) используют конъюгат поликлональных или моноклональных антител (например, козьи поликлональные антитела, овечьи поликлональные антитела, мышиные моноклональные антитела и др.) к легким цепям определенного или всех иммуноглобулинов человека с ферментом (например, щелочной фосфатазой, пероксидазой хрена и др.). Определяют количество естественных аутоантител, учитывая реакцию по экстинции раствора хромагента, изменяющего свою окраску в зависимости от количества хромагента,выделенного из субстрата при разложении его ферментом (например, щелочной фосфатазой и др.) - субстрат продуцирует растворимый продукт, цветовые характеристики которого могут быть измерены спектрофотометрически при определенной длине волны. Пример 1. Для подтверждения возможности получения технического результата при осуществлении заявленного способа количественного определения уровня естественных аутоантител к интерферону гамма человека были взяты образцы сыворотки 20 здоровых доноров, у которых не проводилась интерферонотерапия, и, следовательно, в сыворотке отсутствуют аутоантитела к интерферону гамма человека, но присутствуют естественные аутоантитела к интерферону гамма человека. В часть лунок 96-луночного планшета, покрытого стрептавидином, компании Greiner bio-one GmbH(кат.655990) вносили рекомбинантный интерферон гамма человека производства eBiosciences(кат.34-8319-85) и в другую часть (контрольные лунки для исследуемых образцов) - бычий сывороточный альбумин производства Sigma Aldrich (кат.А-3803), биотинилированные по стандартной процедуре компании U-CyTech bioscience (СОПUCT-127) из расчета 100 мкл/лунка и инкубировали в течение 2 ч при температуре 37 С и при 100% влажности (принцип биотинилирования заключается в том, что свободные аминогруппы белков реагируют с D-биотиноиламинокапроновой кислоты-Nгидроксисукцинимидом (NHS-биотин) (молярное соотношение антигена к биотина составляет 1:2) путем формирования стабильной аминной связи (реакция происходит при комнатной температуре при инкубации в течение 2 ч при постоянном перемешивании); биотинилированный белок затем диализуют против фосфатного буфера для удаления NHS-биотина, не вступившего в реакцию). Образцы сыворотки крови разводили в 20 раз (100 мкл сыворотки разводили в 1900 мкл фосфатносолевого буфера, содержащего 1% Triton Х-100 и 0,002% тимерозал) и инкубировали в течение 20 мин при температуре 75 С. Затем проинкубированный раствор еще разводили в 5 раз (100 мкл проинкубированного раствора разводили в 400 мкл фосфатно-солевого буфера, содержащего 1% бычий сывороточный альбумин (БСА),1% Triton Х-100 и 0,002% тимерозал) и в дальнейшем использовали для внесения в лунки планшета (по 100 мкл в лунку). Для построения калибровочной кривой приготавливали растворы стандартных антител (мышиные моноклональные антитела к интерферону гамма человека, клон MD-2) в диапазоне концентраций от 16 до 0,5 ед/мл. За 1 ед/мл принимали 100 пкг/мл мышиных моноклональных антител. Подготовленные стандартные антитела, раствор, используемый в качестве отрицательного контроля (фосфатно-солевой буфер, содержащий 1% БСА, 1% Triton Х-100 и 0,002% тимерозал), и растворы исследуемых образцов вносили в лунки планшета, как указано в табл. 1, и инкубировали при температуре 37 С в течение 2 ч. По завершении инкубации жидкость удаляли из планшета декантированием и 5 раз планшет промывали стандартным моющим раствором (фосфатно-солевой буфер, содержащий 0,05% Твин-20 и 0,01% тимерозал). В табл. 1 приведена схема внесения образцов в лунки планшета. Таблица 1S1-S20: Исследуемые образцы 1-20. ИФН- - рекомбинантный интерферон гамма человека. БСА - бычий сывороточный альбумин Затем во все лунки планшета вносили по 100 мкл раствора, содержащего смесь конъюгированных с щелочной фосфатазой козьих антител к IgA, IgM, IgG человека (Sigma Aldrich; кат.A-3313), что позволяет определить уровень всех изотипов естественных аутоантител к интерферону гамма человека, или козьи антитела к IgG мыши (Sigma Aldrich; кат.А-3562), конъюгированные с щелочной фосфатазой,для определения уровня моноклональных антител к интерферону гамма человека (MD-2), используемых для построения калибровочной кривой. Затем планшет инкубировали в течение 1 ч при температуре 37 С. По завершении инкубации жидкость удаляли из лунок планшета декантированием и 5 раз планшет промывали стандартным моющим раствором (фосфатно-солевой буфер, содержащий 0,05% Твин-20 и 0,01% тимерозал). За 15 мин до окончания инкубации с конъюгатсодержащим раствором готовили раствор хромагента, растворяя 1 таблетку субстратного буфера и 1 таблетку субстрата (паранитрофенилфосфат), производства фирмы Sigma (кат.N-2770) в 20 мл дистиллированной воды. По 100 мкл приготовленного раствора хромагента вносили в каждую из лунок планшета и инкубировали планшет в течение 30 мин при температуре 37 С. По окончании инкубации во все лунки планшета вносили останавливающий раствор (3 н. гидроксид натрия) производства фирмы Merck KgaA (кат.1.06495) и измеряли экстинцию при длине волны 405 нм с использованием стандартного фотометра. По полученным результатам измерений рассчитывали уровень естественных аутоантител к интерферону гамма. Для этого определяли истинное значение оптической плотности (ОП) стандартных антител и истинное значение ОП исследуемых образцов следующим образом. 1. Рассчитывали среднюю ОП для отрицательного контроля (среднее арифметическое значение ОП в лунках 1G, 1 Н, 2G, 2 Н). 2. Рассчитывали среднюю ОП для стандартных антител (среднее арифметическое значение ОП в лунках соответствующего стандарта Р 1-Р 6). 3. Рассчитывали истинное значение ОП стандартных антител как разность среднего значения ОП стандартных антител и среднего значения ОП отрицательного контроля. Результаты расчетов приведены в табл. 2. Таблица 2 4. По полученным значениям истинной ОП стандартных антител построили калибровочную кривую(см. фиг. 1), где по оси ординат (у) расположены значения ОП, по оси абсцисс (х) - концентрация антител к интерферону гамма. Построенная калибровочная кривая может быть описана следующим уравнением: У = - 0,0052 х 2+ 0,177 х + 0,0172. 5. Рассчитывали среднее ОП для исследуемых образцов в лунках планшета, в которых иммобилизирован биотинилированный ИФН- (ряды 3, 5, 7, 9, 11 в табл. 1) и в которых иммобилизирован биотинилированный БСА (ряды 4, 6, 8, 10, 12 в табл. 1). Например, для исследуемого образца S1 среднее значение ОП в лунках A3, В 3 и А 4, В 4 соответственно. 6. Рассчитывали истинное значение ОП для исследуемых образцов как разность среднего значения ОП для исследуемых образцов, измеренной в лунках планшета, в которых иммобилизирован биотинилированный ИФН-, и среднего значения ОП для исследуемых образцов, измеренной в лунках планшета, в которых иммобилизирован биотинилированный БСА. Например, для исследуемого образца S1 вычитаем из среднего значения ОП, измеренного в лунках планшета A3, В 3, среднее значение ОП, измеренное в лунках планшета А 4, В 4. 7. Используя калибровочную кривую (фиг. 1), определяли концентрацию разведенных естествен-4 020484 ных аутоантител к интерферону гамма человека в исследуемых образцах. Для получения истинного значения концентрации естественных аутоантител к интерферону гамма человека в исследуемых образцах полученный результат умножали на степень разведения образцов (на 100). 8. Результаты представлены в табл. 3. Таблица 3 Пример 2. Были взяты образцы сыворотки 20 пациентов с инфекционным мононуклеозом, при котором уровень естественных аутоантител к интерферону гамма человека повышается. Все этапы определения уровня естественных аутоантител к интерферону гамма человека были аналогичны описанным в примере 1, за исключением того, что исследуемые образцы были разведены в 1000 раз, в качестве блокирующего агента использовали человеческий сывороточный альбумин, а температура инкубации равнялась 56 С. Калибровочная кривая представлена на фиг. 2, полученные результаты приведены в табл. 4. Таблица 4 Пример 3. Для подтверждения возможности получения технического результата при осуществлении заявленного способа количественного определения уровня естественных аутоантител к интерферону гамма че-5 020484 ловека, в котором перед термической обработкой тестируемую биологическую жидкость дополнительно подвергают воздействию железосодержащим окислителем, были взяты образцы сыворотки 20 здоровых доноров, у которых не проводилась интерферонотерапия, и, следовательно, в сыворотке отсутствуют аутоантитела к интерферону гамма человека, но присутствуют естественные аутоантитела к интерферону гамма человека,В часть лунок 96-луночного планшета, покрытого стрептавидином, компании Greiner bio-one GmbH(кат. . 655990) вносили рекомбинантный интерферон гамма человека производства eBiosciences(кат.34-8319-85) и в другую часть (контрольные лунки для исследуемых образцов) - бычий сывороточный альбумин производства Sigma Aldrich (кат.А-3803), биотинилированные по стандартной процедуре компании U-CyTech bioscience (СОПUCT-127) из расчета 100 мкл/лунка и инкубировали в течение 2 ч при температуре 37 С и при 100% влажности (принцип биотинилирования заключается в том, что свободные аминогруппы белков реагируют с D-биотиноиламинокапроновой кислоты-Nгидроксисукцинимидом (NHS-биотин) (молярное соотношение антигена к биотину составляет 1:2) путем формирования стабильной аминной связи (реакция происходит при комнатной температуре при инкубации в течение 2 ч при постоянном перемешивании); биотинилированный белок затем диализуют против фосфатного буфера для удаления NHS-биотина, не вступившего в реакцию). Образцы сыворотки крови разводили в 10 раз (10 мкл сыворотки разводили в 90 мкл фосфатносолевого буфера, содержащего 1% Triton Х-100 и 0,002% тимерозал), обрабатывали 2 мМ FeCl3 и инкубировали в течение 40 мин при температуре 56 С. Затем проинкубированный раствор еще разводили в 5 раз (100 мкл проинкубированного раствора разводили в 400 мкл фосфатно-солевого буфера, содержащего 1% бычий сывороточный альбумин (БСА),1% Triton Х-100 и 0,002% тимерозал), и в дальнейшем использовали для внесения в лунки планшета (по 100 мкл в лунку). Для построения калибровочной кривой приготавливали растворы стандартных антител (мышиные моноклональные антитела к интерферону гамма человека, клон MD-2) в диапазоне концентраций от 16 до 0,5 ед/мл. За 1 ед/мл принимали 100 пкг/мл мышиных моноклональных антител. Подготовленные стандартные антитела, раствор, используемый в качестве отрицательного контроля (фосфатно-солевой буфер, содержащий 1% БСА, 1% Triton Х-100 и 0,002% тимерозал), и растворы исследуемых образцов вносили в лунки планшета, как указано в табл. 1, и инкубировали при температуре 37 С в течение 2 ч. По завершении инкубации жидкость удаляли из планшета декантированием и 5 раз планшет промывали стандартным моющим раствором (фосфатно-солевой буфер, содержащий 0,05% Твин-20 и 0,01% тимерозал). В табл. 5 приведена схема внесения образцов в лунки планшета. Таблица 5S1-S20: Исследуемые образцы 1-20. ИФН- - рекомбинантный интерферон гамма человека. БСА - бычий сывороточный альбумин. Затем во все лунки планшета вносили по 100 мкл раствора, содержащего смесь конъюгированных с щелочной фосфатазой козьих антител к IgA, IgM, IgG человека (Sigma Aldrich; кат.A-3313), что позволяет определить уровень всех изотипов естественных аутоантител к интерферону гамма человека, или козьи антитела к IgG мыши (Sigma Aldrich; кат.А-3562), конъюгированные с щелочной фосфатазой,для определения уровня моноклональных антител к интерферону гамма человека (MD-2), используемых для построения калибровочной кривой. Затем планшет инкубировали в течение 1 ч при температуре 37 С. По завершении инкубации жидкость удаляли из лунок планшета декантированием и 5 раз планшет промывали стандартным моющим раствором (фосфатно-солевой буфер, содержащий 0,05% Твин-20 и 0,01% тимерозал). За 15 мин до окончания инкубации с конъюгатсодержащим раствором готовили раствор хромагента, растворяя 1 таблетку субстратного буфера и 1 таблетку субстрата (паранитрофенилфосфат), производства фирмы Sigma (кат.N-2770) в 20 мл дистиллированной воды. По 100 мкл приготовленного раствора хромагента вносили в каждую из лунок планшета и инкубировали планшет в течение 30 мин при температуре 37 С. По окончании инкубации во все лунки планшета вносили останавливающий раствор (3 н. гидроксид натрия) производства фирмы Merck KgaA (кат.1.06495) и измеряли экстинцию при длине волны 405 нм с использованием стандартного фотометра. По полученным результатам измерений рассчитывали уровень естественных аутоантител к интерферону гамма. Для этого определяли истинное значение оптической плотности (ОП) стандартных антител и истинное значение ОП исследуемых образцов следующим образом. 1. Рассчитывали среднюю ОП для отрицательного контроля (среднее арифметическое значение ОП в лунках 1G, 1 Н, 2G, 2 Н). 2. Рассчитывали среднюю ОП для стандартных антител (среднее арифметическое значение ОП в лунках соответствующего стандарта Р 1-Р 6). 3. Рассчитывали истинное значение ОП стандартных антител как разность среднего значения ОП стандартных антител и среднего значения ОП отрицательного контроля. Результаты расчетов приведены в табл. 6. Таблица 6 4. По полученным значениям истинной ОП стандартных антител построили калибровочную кривую(см. фиг. 3), где по оси ординат (у) расположены значения ОП, по оси абсцисс (х) - концентрация антител к интерферону гамма. Построенная калибровочная кривая может быть описана следующим уравнением: у = -0,0049x2 + 0,1807 х + 0,0184. 5. Рассчитывали среднее ОП для исследуемых образцов в лунках планшета, в которых иммобилизирован биотинилированный ИФН- (ряды 3, 5, 7, 9, 11 в табл. 5) и в которых иммобилизирован биотинилированный БСА (ряды 4, 6, 8, 10, 12 в табл. 5). Например, для исследуемого образца S1 среднее значение ОП в лунках A3, В 3 и А 4, В 4 соответственно. 6. Рассчитывали истинное значения ОП для исследуемых образцов как разность среднего значения ОП для исследуемых образцов, измеренной в лунках планшета, в которых иммобилизирован биотинилированный ИФН-, и среднего значение ОП для исследуемых образцов, измеренной в лунках планшета, в которых иммобилизирован биотинилированный БСА. Например, для исследуемого образца S1 вычитаем из среднего значения ОП, измеренного в лунках планшета A3, B3, среднее значение ОП, измеренное в лунках планшета A4, B4. 7. Используя калибровочную кривую (фиг. 3), определяли концентрацию разведенных естественных аутоантител к интерферону гамма человека в исследуемых образцах. Для получения истинного зна-7 020484 чения концентрации естественных аутоантител к интерферону гамма человека в исследуемых образцах полученный результат умножали на степень разведения образцов (на 100). 8. Результаты представлены в табл. 7. Таблица 7 Таким образом, приведенные примеры с использованием сыворотки крови, в которой присутствуют естественные аутоантитела к интерферону гамма человека, подтверждают эффективность и надежность количественного определения уровня естественных аутоантител к интерферону гамма человека при реализации заявленной совокупности признаков. При этом дополнительная обработка тестируемой биологической жидкости железосодержащим окислителем повышает эффективность заявленного способа, что следует из примера 3. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ количественного определения уровня естественных аутоантител в биологических жидкостях человека путем иммуноферментного анализа, включающий обработку твердой фазы физической сорбции антигеном, внесение тестируемых биологических образцов, обработку твердой фазы конъюгатсодержащим раствором, разделение твердой и жидкой фаз и спектрофотометрический анализ реакции по экстинции раствора хромагента, отличающийся тем, что в качестве твердой фазы физической сорбции используют твердую фазу физической сорбции, покрытую стрептавидином, а обработку твердой фазы физической сорбции производят предварительно биотинилированным антигеном и блокирующим агентом для закрытия на твердой фазе физической сорбции мест неспецифического связывания, в качестве которого используют биотинилированные по стандартной процедуре белки, в качестве конъюгатсодержащего раствора используют моноклональные или поликлональные антитела, меченные ферментом, реагирующие с одним или всеми изотипами человеческих иммуноглобулинов, при этом тестируемую биологическую жидкость предварительно разводят в буфере, содержащем белки, используемые для закрытия на твердой фазе физической сорбции мест неспецифического связывания, а также вещества, защищающие естественные аутоантитела от разрушения при термической обработке, и подвергают термической обработке, для каждого из тестируемых образцов биологической жидкости применяют контрольную твердую фазу физической сорбции, на которой не иммобилизирован биотинилированный антиген, а количество естественных аутоантител определяют с использованием калибровочной кривой, которая строится с использованием моноклональных или поликлональных антител к антигену. 2. Способ количественного определения уровня естественных аутоантител в биологических жидкостях человека по п.1, отличающийся тем, что перед термической обработкой тестируемую биологическую жидкость, разведенную в буфере, содержащем белки, используемые для закрытия на твердой фазе физической сорбции мест неспецифического связывания, и вещества, защищающие естественные аутоантитела от разрушения при термической обработке, дополнительно подвергают воздействию железосодержащим окислителем.
МПК / Метки
МПК: G01N 1/38, G01N 1/44, G01N 33/573
Метки: человека, количественного, биологических, жидкостях, путем, определения, естественных, уровня, способ, анализа, аутоантител, иммуноферментного
Код ссылки
<a href="https://eas.patents.su/10-20484-sposob-kolichestvennogo-opredeleniya-urovnya-estestvennyh-autoantitel-v-biologicheskih-zhidkostyah-cheloveka-putem-immunofermentnogo-analiza.html" rel="bookmark" title="База патентов Евразийского Союза">Способ количественного определения уровня естественных аутоантител в биологических жидкостях человека путем иммуноферментного анализа</a>
Предыдущий патент: Устройство управления физиотерапевтическими приборами
Следующий патент: N-ацилированные октасахариды, активирующие рецепторы fgf, их получение и применение в терапии
Случайный патент: Способ обработки потока крекинг-газа, полученного на установке пиролиза углеводородов, и установка для его осуществления