Абсолютное количественное определение нуклеиновых кислот от-пцр
Формула / Реферат
1. Способ получения калибровочных данных для абсолютного количественного определения РНК с помощью ОТ-ПЦР, где способ предусматривает:
a) получение синтетического олигонуклеотида, содержащего ампликон и промоторную последовательность, расположенную в 3'-направлении по отношению к ампликону;
b) синтез комплементарной РНК (кРНК) с помощью транскрипции олигонуклеотида in vitro;
c) количественное определение кРНК; и
d) получение калибровочных данных ПЦР, осуществляя ОТ-ПЦР, используя известные количества кРНК.
2. Способ по п.1, где промоторная последовательность представляет собой промоторную последовательность бактериофага.
3. Способ по п.2, где промоторная последовательность бактериофага представляет собой Т7-промоторную последовательность.
4. Способ по п.3, где Т7-промоторная последовательность состоит, в основном, из 5'CCTATAGTGAGTCGTATTA3' (SEQ ID NO: 1).
5. Способ по п.1, дополнительно предусматривающий 5'-фланкирующую последовательность, состоящую из 2-20 нуклеотидов, расположенных рядом с ампликоном.
6. Способ по п.5, где 5'-фланкирующая последовательность состоит из 8-12 нуклеотидов.
7. Способ по п.5, где 5'-фланкирующая последовательность содержит поли-Т-хвост.
8. Способ по п.1, где синтетический олигонуклеотид дополнительно содержит 3'-фланкирующую последовательность, состоящую из 2-20 нуклеотидов, расположенную между ампликоном и промоторной последовательностью.
9. Способ по п.8, где 3'-фланкирующая последовательность состоит из 8-12 нуклеотидов.
10. Способ по п.1, где длина ампликона составляет 30-70 нуклеотидов.
11. Способ по п.10, где длина ампликона равняется 40-60 нуклеотидам.
12. Способ по п.1, где длина синтетического олигонуклеотида составляет 60-140 нуклеотидов.
13. Способ по п.12, где длина синтетического олигонуклеотида составляет 70-130 нуклеотидов.
14. Способ по п.13, где длина синтетического олигонуклеотида составляет 80-120 нуклеотидов.
15. Способ по п.14, где длина синтетического олигонуклеотида составляет 90-110 нуклеотидов.
16. Способ определения большого количества молекул нуклеиновой кислоты, содержащих ампликон, в опытном образце, где способ предусматривает:
a) получение синтетического олигонуклеотида, содержащего ампликон и промоторную последовательность, расположенную в 3'-направлении по отношению к ампликону;
b) синтез кРНК с помощью транскрипции олигонуклеотида in vitro;
c) получение серии разведений, используя кРНК;
d) синтез одноцепочечной кДНК с помощью обратной транскрипции кРНК;
e) получение калибровочных данных ОТ-ПЦР;
g) получение данных ОТ-ПЦР опытного образца с использованием опытного образца; и
h) сравнение данных ПЦР опытного образца с калибровочными данными ПЦР.
17. Способ по п.16, дополнительно предусматривающий количественное определение кРНК.
18. Способ по п.17, дополнительно предусматривающий смешивание кРНК с гетерологичной РНК перед синтезом одноцепочечной кДНК.
Текст
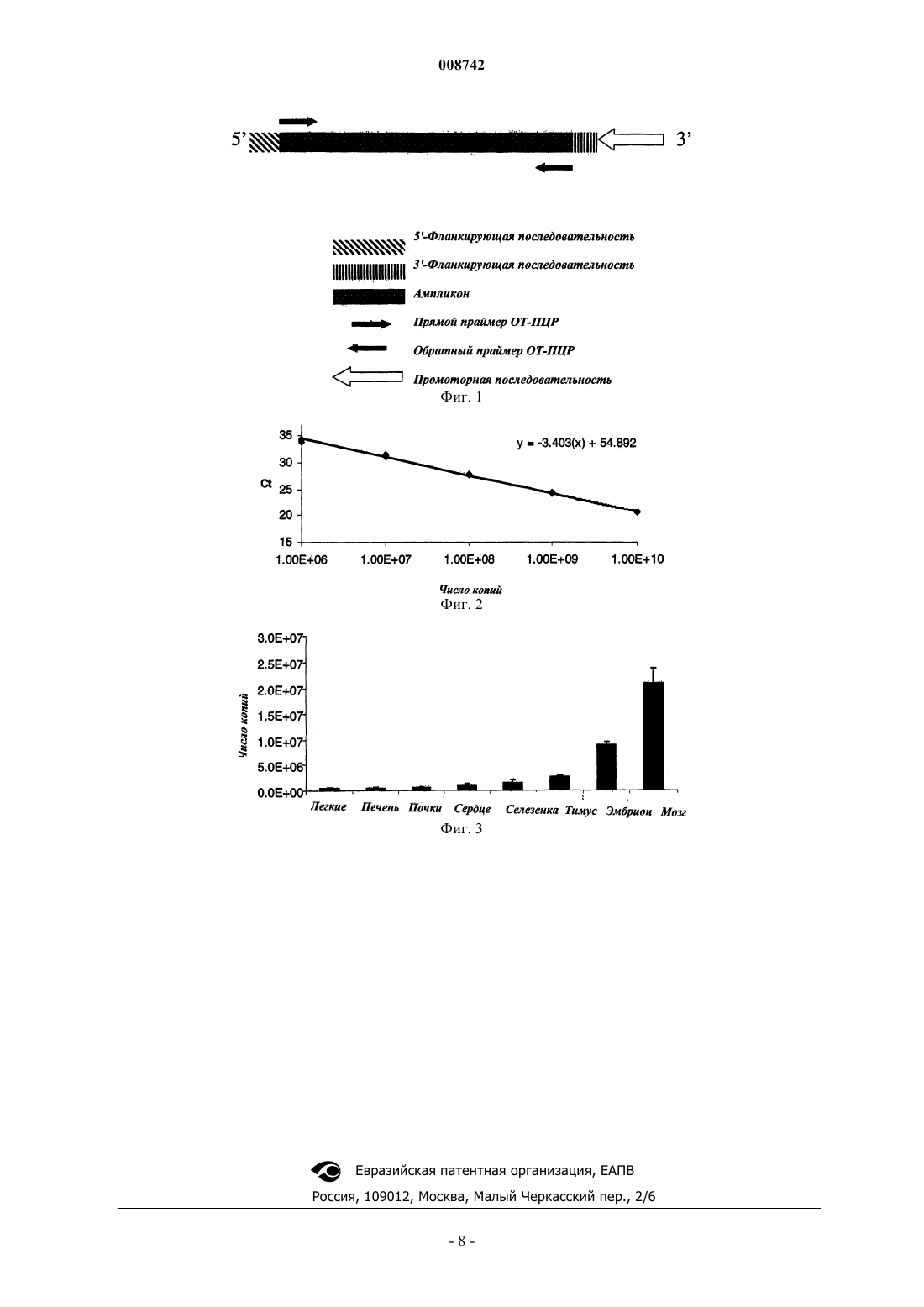
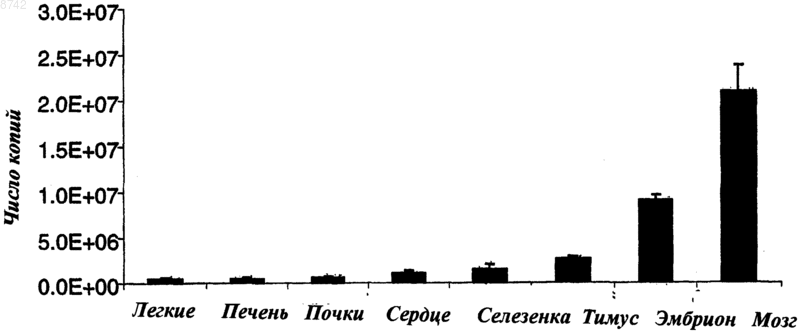
008742 Область техники Изобретение относится к молекулярной биологии. Более конкретно, изобретение относится к способам ПЦР в режиме реального времени и абсолютному количественному определению экспрессии генов. Уровень техники Основная технология ПЦР применяется для амплификации последовательности интересующей ДНК. При ПЦР с обратной транскриптазой (ОТ-ПЦР) в протокол ПЦР добавляют стадию обратной транскрипции. Это позволяет использовать основную методику ПЦР для обнаружения и количественного определения специфических транскриптов мРНК. Таким образом, ОТ-ПЦР предназначена для определения и сравнительной оценки уровня экспрессии генов. Примеры сравнительного анализа, которые могут использоваться, включают экспрессию в различных типах тканей в одном организме и в одном типе тканей в различных организмах, а также в одном типе тканей в ответ на экспериментальную(ые) обработку(и). Количественное определение может быть относительным, т.е. оно выражено в величинах кратности между пробами, или абсолютным, т.е. оно выражено в величинах реального количества РНК. Исторически после синтеза кДНК на стадии обратной транскрипции ПЦР проводили до соответствующей конечной точки на стадии амплификации и затем проводили количественное определение продукта реакции в отдельной стадии, т.е. анализе обнаружения. В варианте ОТ-ПЦР, известной как ПЦР в режиме реального времени (или кинетическая ПЦР), стадию амплификации и стадию обнаружения объединяют. Поэтапное увеличение количества продукта ПЦР определяют количественно в режиме реального времени. Такое определение проводят при введении в реакцию амплификации зонда наряду с обычными прямыми и обратными праймерами. Зонд, который гибридизуется с амплифицированной последовательностью, как правило, в длину составляет 20-25 нуклеотидов. Коммерчески доступные зондыTaqMan (Applied Biosystems, Foster City, CA) включают флуоресцентную репортерную группу (краситель) в 5'-конце и группу гасителя (краситель) на 3'-конце. В интактном зонде флуоресценция репортерной группы полностью подавляется в результате встречного гашения с помощью группы гасителя. По мере расщепления гибридизованного зонда в результате экзонуклеазного действия полимеразы Taq репортерная группа перестает гаситься, что приводит к развитию флуоресценции, которую обнаруживают и определяют количественно. Количественное определение мРНК с помощью ПЦР в режиме реального времени может быть относительным или абсолютным. В любом случае количественное определение мРНК в образце проводят по соответствующей калибровочной кривой. В случае калибровочных кривых для относительного количественного определения количество выражено по отношению к основному образцу, который часто называют калибровочным стандартом. Для экспериментальных образцов количество мишени определяют по калибровочной кривой и делят на значение калибровочного стандарта. Таким образом, калибровочный стандарт становится пробой 1, и все другие количества выражают в виде n-кратной разницы по отношению к калибровочному стандарту. Например, при изучении воздействия лекарственных препаратов на экспрессию генов необработанный контроль будет служить в качестве подходящего калибровочного стандарта. Поскольку экспериментальное количество делят на количество калибровочного стандарта, необходимость в единице калибровочной кривой, например интенсивности флуоресценции, отпадает. Это означает, что для относительного количественного определения можно использовать любой источник содержащей РНК или ДНК последовательности-мишени для построения калибровочной кривой после проведения серии подходящих разведений. В отличие от этого для абсолютного количественного определения мРНК с помощью ПЦР в режиме реального времени требуется стандарт, в котором абсолютное количество содержащей РНК последовательности-мишени известно независимо. Как правило, необходимо получить плазмиду, содержащую кДНК, содержащую последовательность-мишень. Рестрикционный фрагмент плазмиды, который содержит кДНК (и никаких других открытых рамок считывания), очищают в геле и подвергают обратной транскрипции. Значение А 260 полученной кРНК и кРНК используют для построения калибровочной кривой. Рассчитывают число копий комплементарной РНК по значению А 260 и молекулярной массе мРНК. Это не является затруднительным в тех случаях, когда повторно анализируют экспрессию одного гена,или небольшого числа генов, например, при клиническом тестировании вирусной нагрузки у ВИЧинфицированных пациентов. Однако в тех случаях, когда с помощью ПЦР в режиме реального времени требуется дать количественную оценку большому числу различных мишеней, то данный подход к абсолютному количественному определению является настолько длительным и трудоемким, что он становится не пригодным для практики. Сущность изобретения Изобретение относится к способу получения кРНК для применения при получении калибровочных данных, например калибровочной кривой, для абсолютного количественного определения РНК с помощью ОТ-ПЦР. Способ включает стадии: а) обеспечения синтетического олигонуклеотида, содержащего ампликон, промоторную последовательность, расположенную в 3'-направлении по отношению к ампликону; b) синтеза комплементарной РНК (кРНК) транскрипцией синтетического олигонуклеотида в усло-1 008742 виях in vitro; с) количественного определения кРНК независимым способом; и d) получения калибровочных данных с использованием известного количества кРНК. Предпочтительно промоторной последовательностью является промоторная последовательность бактериофага. Примером промоторной последовательности, которая может использоваться в изобретении, является Т 7-промоторная последовательность, например 5'CCTATAGTGAGTCGTATTA 3' (SEQ IDNO: 1). Синтетический олигонуклеотид необязательно включает 5'-фланкирующую последовательность из 2-20, предпочтительно из 8-12 нуклеотидов, расположенных рядом с ампликоном. В некоторых вариантах осуществления изобретения 5'-фланкирующая последовательность содержит 5-20 последовательных остатков тимина, т.е. олиго d(T)область. Синтетический олигонуклеотид необязательно содержит 3'фланкирующую последовательность из 2-20, предпочтительно из 8-12 нуклеотидов, расположенную между ампликоном и промоторной областью. Длина ампликона предпочтительно составляет от 30 до 70 нуклеотидов и более предпочтительно от 40 до 60 нуклеотидов. Длина синтетического олигонуклеотида предпочтительно равна 60-140 нуклеотидам, более предпочтительно 70-130 нуклеотидам, 80-120 нуклеотидам или 90-110 нуклеотидам. Изобретение также относится к способу ОТ-ПЦР для определения большого количества молекул специфической нуклеиновой кислоты, например специфического транскрипта РНК в опытном образце. Способ включает в себя следующие стадии: а) обеспечение синтетического олигонуклеотида, содержащего ампликон и промоторную последовательность, расположенную в 3'-направлении по отношению к ампликону;b) синтез кРНК транскрипцией олигонуклеотида в условиях in vitro; с) получение серии разведений с использованием кРНК;d) синтез одноцепочечной кДНК обратной транскрипцией кРНК; е) получени калибровочных данных ПЦР с использованием кДНК;g) получение данных ПЦР опытного образца с использованием опытного образца;h) сравнение данных ПЦР опытного образца с калибровочными данными ПЦР. В предпочтительных вариантах осуществления изобретения кРНК определяют количественно независимым методом, например при определении поглощения А 260, и смешивают с гетерологичной РНК,например дрожжевой общей РНК, перед синтезом одноцепочечной кДНК. Используемый здесь термин ампликон обозначает специфическую, заранее выбранную нуклеотидную последовательность, амплифицированную с помощью реакции ПЦР. Используемый здесь термин фланкирующая последовательность обозначает нуклеотидную последовательность, расположенную рядом с ампликоном, в синтетическом олигонуклеотиде. 5'-Фланкирующая последовательность расположена в 5'-направлении по отношению к ампликону. 3'-Фланкирующая последовательность расположена в 3'-направлении по отношению к ампликону. Используемый здесь термин калибровочные данные ПЦР обозначает данные ПЦР, полученные с использованием известных количеств нуклеотидной последовательности, соответствующей последовательности-мишени, по отношению к которым будет проводиться сравнение опытных данных для количественного определения. Калибровочные данные могут быть относительными или абсолютными. Используемый здесь термин калибровочная кривая обозначает график (обычно полулогарифмический), построенный по калибровочным данным. Используемый здесь термин синтетический олигонуклеотид обозначает нуклеиновую кислоту,содержащую специфическую последовательность нуклеотидов, полученную с использованием способов синтетической органической химии, а не ферментативной полимеризацией в живой клетке. Используемый здесь термин последовательность-мишень обозначает анализируемую последовательность, например последовательность в интересующем гене, кДНК или РНК. Если не указано иначе, то все использованные здесь технические и научные термины имеют такое же значение, которое, как правило, понятно любому специалисту в области, к которой относится изобретение. В случае противоречивых ситуаций в настоящем изобретении такие ситуации будут предупреждены и, в том числе, термины будут описаны. Все публикации, патенты и другие ссылки, упомянутые здесь, включены здесь в качестве ссылок. Материалы, методы и примеры, представленные ниже, являются только иллюстративными и не предназначены для ограничения. Другие признаки и преимущества изобретения будут понятными из подробного описания и из формулы изобретения. Краткое описание фигур На фиг. 1 представлено схематическое изображение общей структуры синтетического олигонуклеотида для применения в изобретении. Структура, представленная на фиг. 1, включает 5'- и 3'-фланкирующие последовательности, которые являются необязательными. На фиг. 2 представлена калибровочная кривая для абсолютного количественного определения кРНК с помощью ОТ-ПЦР. Очищенную кРНК подвергли шести последовательным серийным разведениям 1:10 и затем вставляли (спайкировали) в дрожжевую общую РНК. Каждое разведение кРНК использовали для синтеза кДНК, которую использовали в качестве исходной матрицы для ОТ-ПЦР. ОТ-ПЦР проводили в четырех повторениях (R2=0,9980). Значение Ct (предельное значение циклов) представляет выход-2 008742 для анализа ОТ-ПЦР. Ct является числом зарегистрированных циклов, при которых реакция становится экспоненциальной. Когда это происходит, тогда верно уравнение Ct=2 исходное количество. Сt получали для неизвестных и стандартов. Затем значение Ct для неизвестных сравнивали с Ct на калибровочной кривой. На фиг. 3 показана гистограмма, показывающая результаты абсолютного количественного определения мРНК по изобретению. По калибровочной кривой, представленной на фиг. 2, определяли число копий информационной РНК в ткани легких, печени, почек, сердца, селезенки, тимуса, эмбриона и мозга крыс. Подробное описание изобретения В настоящем изобретении новая комбинация известных элементов или стадий собрана в упрощенный способ для получения кРНК для применения при получении калибровочных данных ПЦР для абсолютного количественного определения РНК с помощью ОТ-ПЦР. Повышенная эффективность, обеспечиваемая способом, делает его практичным для проведения абсолютного количественного определения мРНК с помощью ОТ-ПЦР в режиме реального времени в тех случаях, когда необходима высокая производительность, включая большое количество различных последовательностей-мишеней. Таким образом,этот способ может использоваться в таких случаях, как фундаментальное биологическое исследование и программы по разработке лекарственных препаратов. Преимуществом изобретения является отсутствие необходимости получения плазмиды, содержащей кДНК, включающей последовательность-мишень. Кроме того, для изобретения не требуется получать и выделять рестрикционный фрагмент плазмиды, который содержит кДНК (и никаких других открытых рамок считывания). Данное упрощение является результатом применения синтетического олигонуклеотида в сочетании со стадией транскрипции in vitro. После проведения стадии транскрипцииin vitro можно использовать обычную методику ПЦР в режиме реального времени с некоторыми модификациями или без них. Подробное описание различных аспектов стадий, следующих за стадией транскрипции in vitro, см., как правило, в PCR Protocols in Molecular Toxicology, 1997, CRC Press. Также см.Sambrook et al., Molecular Cloning, A Laboratory Manual, 1989, Cold Spring Harbor Press. Если РНК, полученную транскрипцией in vitro, собираются использовать для получения калибровочных данных ПЦР для абсолютного количественного определения РНК, то образец РНК, полученный на стадии транскрипции in vitro, подвергают количественному анализу. Это можно осуществить, например, путем определения поглощения раствора РНК при 260 нм (А 260). Значение А 260 можно преобразовать в значение концентрации РНК, которое, в свою очередь, можно преобразовать в число копий, основываясь на рассчитанной молекулярной массе молекулы используемой кРНК. Конструирование синтетического олигонуклеотида может осуществить любой специалист в данной области. Как правило, синтетический олигонуклеотид содержит ампликон, промоторную последовательность и необязательные фланкирующие ампликон последовательности (фиг. 1). Нуклеотидная последовательность синтетического олигонуклеотида будет зависеть от ряда факторов, в том числе от последовательности ампликона, последовательностей, фланкирующих ампликон в последовательности-мишени,и выбора промоторной последовательности. Длина ампликона не ограничена. Предпочтительно длина ампликона находится в пределах от 30 до 70 нуклеотидов. Более предпочтительно она составляет от 40 до 60 нуклеотидов. Амплификация конкретного ампликона в системе ПЦР достигается конструированием и синтезом соответствующего прямого праймера и соответствующего обратного праймера. Конструирование и синтез праймеров для ПЦР хорошо известны в данной области, с помощью коммерчески доступного программного обеспечения для конструирования праймеров, реагентов и оборудования. Примером коммерчески доступного программного обеспечения является Primer Express (Applied Biosystems, Foster City,CA). Можно ввести в область, расположенную рядом с ампликоном, 5'-фланкирующую последовательность, 3'-фланкирующую последовательность или обе эти последовательности. Предпочтительно вводят обе эти последовательности. Фланкирующие последовательности, если они имеются, могут отличаться друг от друга по последовательности и длине. Длина необязательной(ых) фланкирующей(их) последовательности(ей) не ограничена. Предпочтительно каждая фланкирующая последовательность состоит из 2-20 нуклеотидов и более предпочтительно из 8-12 нуклеотидов. Нуклеотидная последовательность фланкирующих последовательностей не ограничена. Например, она может быть сконструирована для гибридизации с геноммишенью, но такая комплементарность не обязательна. В некоторых воплощениях изобретения 5'фланкирующая последовательность в синтетическом олигонуклеотиде включает или состоит из поли-Тхвоста. Это приводит к получению соответствующего поли-А-хвоста в продуцированной затем кРНК,которая может использоваться для праймирования в реакции обратной транскрипции. Длина подходящего поли-Т(поли-А)-хвоста составляет 5-20 нуклеотидов, предпочтительно около 16 нуклеотидов. В синтетический олигонуклеотид вводят промоторную последовательность. Можно использовать любую промоторную последовательность, которая эффективно функционирует в условиях реакции, использованных в транскрипции in vitro. Для реакций транскрипции in vitro часто используют промоторные последовательности бактериофага. Конкретными примерами промоторов, используемых в изобрете-3 008742 нии, являются промоторы Т 7, SP6 и Т 3. Предпочтительной Т 7-промоторной последовательностью является такая Т 7-промоторная последовательность, как 5'CCTATAGTGAGTCGTATTA 3' (SEQ ID NO: 1). Специалистам в данной области понятно, что концы промоторов не всегда точно определены и что часто можно внести незначительные изменения в естественные промоторные последовательности, сохраняя(или даже улучшая) промоторную функцию. Выбрать и ввести подходящую промоторную последовательность может любой специалист в данной области, не проводя чрезмерное экспериментирование. Промоторные последовательности, которые могут использоваться для применения в изобретении, являются коммерчески доступными. Полная длина синтетического олигонуклеотида, т.е. включая ампликон, промотор и необязательную(ые) фланкирующую(ие) ампликон последовательность(и), должна быть относительно небольшой и обеспечивать химический синтез и относительно большой для обеспечения транскрипции в условиях invitro. В большинстве случаев длина будет находиться в пределах от 60 до 140 нуклеотидов. Предпочтительно длина будет находиться в пределах от 70 до 130, от 80 до 120 или от 90 до 110 нуклеотидов. Точная последовательность синтетического олигонуклеотида конструируется согласно определенному отбору с учетом компонентов последовательности, указанных выше. После конструирования синтетический олигонуклеотид может синтезировать любой специалист в данной области с использованием известных методов, материалов и оборудования. Синтетические олигонуклеотиды, подходящие для применения в настоящем изобретении, могут быть получены из коммерческих источников, например Biosearch Technologies, Inc. (Novato, CA) и Invitrogen, Inc. (Carlsbad, CA). Следует понимать, что в настоящем изобретении в основном используется аналитическая методика. Таким образом, изобретение не ограничено какой-то конкретной последовательностью-мишенью, ампликоном или синтетическим олигонуклеотидом. Синтетические олигонуклеотиды, которые могут использоваться в настоящем изобретении, могут быть получены любым подходящим способом синтеза. Методы, материалы и оборудование для синтеза олигонуклеотидов, имеющих заранее определенную последовательность длиной значительно выше 100 нуклеотидов, хорошо известны в данной области. См., например, Cheng et al., 2002, Nucleic Acids Research 30 (18) e93. Из коммерческих источников могут быть получены стандартные синтезированные олигонуклеотиды, которые могут использоваться для применения в изобретении, например BiosearchTechnologies Inc. (Novato, CA); Invitrogen (Carlsbad, CA). Очищение синтетических олигонуклеотидов может быть осуществлено с использованием стандартной технологии, например с помощью ВЭЖХ с обратной фазой. Последовательности синтетических олигонуклеотидов могут быть проверены обычными методами секвенирования. Стадию транскрипции in vitro в настоящем изобретении можно осуществлять с использованием известных методов и материалов. Для достижения желаемого выхода можно использовать оптимизированные условия реакции для синтеза РНК в присутствии высокой концентрации нуклеотидов и полимеразы. Реагенты и наборы для проведения стадии транскрипции in vitro являются коммерчески доступными. Подходящим промышленно доступным набором является набор MEGAshortscript T7 (Ambion, Inc.,Austin, TX; cat. 1354). В реакции транскрипции in vitro можно использовать неполную одноцепочечную матрицу. Например, можно использовать праймер, комплементарный Т 7-промоторной области, для получения короткой двухцепочечной области, с которой Т 7-полимераза связывается и инициирует транскрипцию. Альтернативно можно использовать двухцепочечную матрицу. Например, праймер можно подвергнуть отжигу с промоторной областью синтетического олигонуклеотида и нарастить с помощью ДНК-полимеразы, например фрагмента Кленова. Затем полученную двухцепочечную матрицу можно выделить и использовать для транскрипции in vitro. В варианте с двухцепочечной матрицей можно синтезировать и подвергнуть отжигу полную вторую цепь, комплементарную синтетическому олигонуклеотиду. Продукт кРНК следует получить в виде одноцепочечных молекул. Это можно подтвердить, например, электрофорезом в геле. Для построения надежных калибровочных кривых желательно провести точное серийное разведение кРНК. Относительно получения и характеристики стандартов РНК в основном см. Collins et al., 1995,Analytical Biochemistry 226: 120-129. Предпочтительно при проведении серийных разведений используют РНК-носитель. Предпочтительным РНК-носителем является дрожжевая общая РНК в концентрации примерно 25 нг/мл (Ambion, Inc., Austin, TX; cat. 7118). В способах по изобретению синтез кДНК можно проводить обычной реакцией обратной транскрипции. Методы и материалы для реакций с участием обратной транскриптазы известны в данной области. См., например, Sambrook et al. (выше). Имеются промышленно доступные наборы для реакций обратной транскрипции из различных промышленных источников, например High Capacity cDNA Archive Kit (Applied Biosystems, Inc., Foster City, CA). Изобретение дополнительно иллюстрируется нижеследующими примерами. Примеры приводятся только в целях иллюстрации. Они ни коем образом не предназначены для ограничения объема или сущности изобретения.-4 008742 Примеры Праймер, конструирование зонда и олигонуклеотидные матрицы. Прямой и обратный праймеры Taqman и 5'-FAM-меченные зонды MGB конструировали из консенсусных последовательностей Affymetrix, используя программу Primer Express (Applied Biosystems). Олигонуклеотидные матрицы для реакции транскрипции in vitro конструировали добавлением 10 пар оснований специфической последовательности гена в 5'- и 3'-концы ампликона с последующим добавлением Т 7-промоторной области, состоящей из 5'CCTATAGTGAGTCGTATTA 3' (SEQ ID NO: 1), внешней по отношению к 10 парам оснований на 3'-конце. Транскрипция в условиях in vitro с использованием синтетических олигонуклеотидов. Реакцию транскрипции в условиях in vitro с использованием неполных одноцепочечных олигонуклеотидных матриц проводили с использованием коммерчески доступного набора (Т 7-MEGAshortscriptKit, Ambion, Inc., Austin, TX). Неполные одноцепочечные матрицы получали отжигом Т 7-праймера(5'AATTTAATACGACTCACTATAGG 3'), который является комплементарным только Т 7-промоторной области синтетической олигонуклеотидной матрицы, в 10 мМ Трис-HCl (рН 8,0), 1 мМ ЭДТА, 0,1 М NaCl в эквимолярных количествах (20 мкМ), нагревали до 95 С в течение 5 мин и охлаждали до комнатной температуры. Неполную одноцепочечную матрицу (с концентрацией 1,5 мкМ в реакции) использовали в реакции транскрипции in vitro при 37 С в течение 4 ч согласно протоколу изготовителя (Ambion, Inc.,Austin, TX). Олигонуклеотидную ДНК-матрицу выделяли добавлением 2 Е ДНКазы, не содержащей РНКазу (Ambion, Inc., Austin, TX) на 15 мин при 37 С. Реакцию заканчивали добавлением 20 мкл формамида (50% об./об.), интенсивно перемешивали и нагревали при 95 С в течение 3 мин. Реакционные смеси транскрипции in vitro очищали с использованием промышленно доступного набора согласно рекомендуемому протоколу изготовителя (MEGAclear Kit, Ambion). Определяли концентрацию кРНК при анализе поглощения в УФ-свете при 260 нм. Количество кРНК определяли разделением образца массой 150 нг электрофорезом в полиакриламидном геле с 10% мочевины ТВЕ (BioRad, Inc., Hercules, CA). Синтез кДНК для калибровочных кривых. Препараты комплементарной РНК, которые давали одну полосу нужного размера на разделяющем геле, добавляли (спайкировали в) к дрожжевой фрагментированной РНК. Вначале получали восемь последовательных серийных разведений кРНК 1:10. Аликвотную порцию каждого разведения добавляли к фону из дрожжевой фрагментированной РНК (1 мкг/мл) (Ambion, Inc., Austin, TX). Комплементарные ДНК получали в восьми соответствующих реакциях обратной транскрипции (100 мкл), которые ставили с использованием 10 мкг спайкированной дрожжевой общей (фрагментированной) РНК в качестве матрицы. Реакцию обратной транскрипции проводили с использованием промышленно доступного набора согласно рекомендованным протоколам изготовителя (High-Capacity cDNA Archive Kit, Applied Biosystems). Синтез кДНК из опытных образцов. Общую фракцию РНК легких, печени, почек, сердца, селезенки, тимуса, эмбриона и мозга крыс(10 мкг) (Ambion, Inc.) использовали в качестве матриц для синтеза кДНК с использованием набора для обратной транскрипции согласно протоколам, предоставленным изготовителем набора (High-CapacitycDNA Archive Kit, Applied Biosystems). Аликвотную порцию объемом 1 мкл из каждой реакции синтеза кДНК (100 нг общей исходной РНК-матрицы) использовали в качестве опытного образца для каждой количественной реакции ОТ-ПЦР. Термические циклы Taqman. Реакционные смеси для ПЦР в четырех параллелях для стандартов и опытных образцов смешивали в 96-луночном планшете и затем переносили в 384-луночный планшет для определения оптической плотности (Applied Biosystems, Forster City, CA). Реакционные смеси для ПЦР подвергали циклам в программируемом нагревательном блоке, модель 7900 НТ (Applied Biosystems, Forster City, CA). Условия работы программируемого нагревательного блока были следующими: 50 С в течение 2 мин (расщепление урацил N-дегликозилазой); 95 С в течение 10 мин (активация термостабильной полимеразы Taq) и 40 циклов при 95 С в течение 15 с и при 60 С в течение 60 с с 900 нМ прямого и обратного праймеров,200 нМ зонда Taqman MGB и универсальной смесью 1 (Applied Biosystems). Для каждой реакционной лунки определяли эмиссию флуоресценции каждые семь секунд для контроля наращивания. По данным ПЦР строили калибровочную кривую с использованием стандартов (фиг. 2). Для каждого опытного образца определяли количество транскриптов при сравнении с абсолютными калибровочными кривыми для кРНК с использованием программного обеспечения Sequence Detection(Applied Biosystems). Получали число копий для различных опытных образцов при сравнении ПЦРданных опытных образцов с калибровочной кривой. Результаты по числу копий обобщены на фиг. 3. Другие воплощения находятся в формуле изобретения.-5 008742 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения калибровочных данных для абсолютного количественного определения РНК с помощью ОТ-ПЦР, где способ предусматривает:b) синтез комплементарной РНК (кРНК) с помощью транскрипции олигонуклеотида in vitro;d) получение калибровочных данных ПЦР, осуществляя ОТ-ПЦР, используя известные количества кРНК. 2. Способ по п.1, где промоторная последовательность представляет собой промоторную последовательность бактериофага. 3. Способ по п.2, где промоторная последовательность бактериофага представляет собой Т 7 промоторную последовательность. 4. Способ по п.3, где Т 7-промоторная последовательность состоит, в основном, из 5'CCTATAGTGAGTCGTATTA3' (SEQ ID NO: 1). 5. Способ по п.1, дополнительно предусматривающий 5'-фланкирующую последовательность, состоящую из 2-20 нуклеотидов, расположенных рядом с ампликоном. 6. Способ по п.5, где 5'-фланкирующая последовательность состоит из 8-12 нуклеотидов. 7. Способ по п.5, где 5'-фланкирующая последовательность содержит поли-Т-хвост. 8. Способ по п.1, где синтетический олигонуклеотид дополнительно содержит 3'-фланкирующую последовательность, состоящую из 2-20 нуклеотидов, расположенную между ампликоном и промоторной последовательностью. 9. Способ по п.8, где 3'-фланкирующая последовательность состоит из 8-12 нуклеотидов. 10. Способ по п.1, где длина ампликона составляет 30-70 нуклеотидов. 11. Способ по п.10, где длина ампликона равняется 40-60 нуклеотидам. 12. Способ по п.1, где длина синтетического олигонуклеотида составляет 60-140 нуклеотидов. 13. Способ по п.12, где длина синтетического олигонуклеотида составляет 70-130 нуклеотидов. 14. Способ по п.13, где длина синтетического олигонуклеотида составляет 80-120 нуклеотидов. 15. Способ по п.14, где длина синтетического олигонуклеотида составляет 90-110 нуклеотидов. 16. Способ определения большого количества молекул нуклеиновой кислоты, содержащих ампликон, в опытном образце, где способ предусматривает:b) синтез кРНК с помощью транскрипции олигонуклеотида in vitro;d) синтез одноцепочечной кДНК с помощью обратной транскрипции кРНК;e) получение калибровочных данных ОТ-ПЦР;h) сравнение данных ПЦР опытного образца с калибровочными данными ПЦР. 17. Способ по п.16, дополнительно предусматривающий количественное определение кРНК. 18. Способ по п.17, дополнительно предусматривающий смешивание кРНК с гетерологичной РНК перед синтезом одноцепочечной кДНК.
МПК / Метки
МПК: C12P 19/34, C12Q 1/68
Метки: количественное, определение, абсолютное, нуклеиновых, кислот, от-пцр
Код ссылки
<a href="https://eas.patents.su/9-8742-absolyutnoe-kolichestvennoe-opredelenie-nukleinovyh-kislot-ot-pcr.html" rel="bookmark" title="База патентов Евразийского Союза">Абсолютное количественное определение нуклеиновых кислот от-пцр</a>
Предыдущий патент: Аналоги олигонуклеотидов с-класса с улучшенной иммуностимулирующей эффективностью
Следующий патент: Полимерные конъюгаты мутантного неубластина
Случайный патент: 5-фенилпиримидины, способ их получения, содержащие их средства и их применение