Лиофилизированный дабигатран
Формула / Реферат
1. Способ получения лиофилизированного дабигатрана формулы I
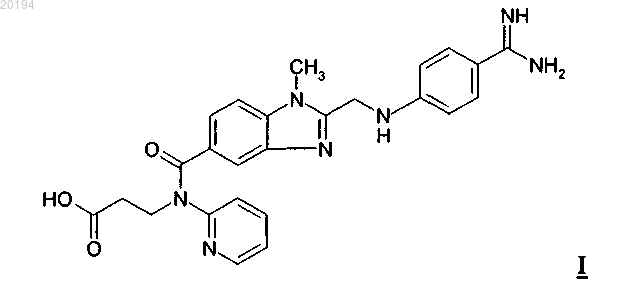
включающий стадии растворения дабигатрана в водном растворе кислоты, добавления раствора в антикоагулированную плазму человека и лиофильного высушивания раствора, полученного указанным способом.
2. Способ по п.1, отличающийся тем, что значение pH водного раствора кислоты, используемого для растворения дабигатрана, составляет не более 3, предпочтительно не более 2.
3. Способ по п.1 или 2, отличающийся тем, что водный раствор кислоты получают с использованием кислот, выбранных из группы, включающей хлористо-водородную, бромисто-водородную, серную, фосфорную, метансульфоновую, уксусную, фумаровую, лимонную, винную и малеиновую кислоты, причем наиболее предпочтительна хлористо-водородная кислота.
4. Способ по любому из пп.1-3, отличающийся тем, что антикоагулированная плазма человека содержит цитрат или ЭДТА.
5. Лиофилизированный дабигатран, который получают по способу, описанному в пп.1-4.
6. Применение лиофилизированного дабигатрана по п.5 в качестве стандартного агента для калибровки времени коагуляции образца крови.
7. Применение по п.6 в качестве стандартного агента для калибровки в коагуляционном анализе для количественного определения дабигатрана.
8. Способ определения концентрации дабигатрана в образце крови, включающий применение лиофилизированного дабигатрана по п.5.
9. Способ по п.8, отличающийся тем, что концентрацию дабигатрана определяют по времени коагуляции образца крови.
10. Способ по п.9, отличающийся тем, что коагуляцию инициируют при добавлении постоянного количества высокоочищенного тромбина человека в α-форме.
11. Набор для определения концентрации дабигатрана в образце крови, включающий набор реагентов для определения концентрации дабигатрана в образце крови, а также лиофилизированный дабигатран по п.5.
12. Набор по п.11, в котором набор реагентов для определения концентрации дабигатрана в образце крови включает реагент 1, которым является антикоагулированная плазма человека, и реагент 2, который включает высокоочищенный тромбин человека в α-форме.
13. Набор по п.12, в котором реагент 1 и реагент 2 являются лиофилизированными.
14. Применение лиофилизированного дабигатрана по п.5 для определения точности коагуляционного анализа.
15. Применение по п.14 для определения точности коагуляционного анализа для количественного определения дабигатрана.
Текст
В изобретении приведено описание лиофилизированной формы дабигатрана формулы I ее применение в качестве стандарта для калибровки для исследования фармакодинамического действия этексилата дабигатрана, а также для анализа.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Изобретение относится к лиофилизированной форме дабигатрана формулы I к ее применению в качестве стандарта для калибровки в исследованиях при определении фармакодинамического действия этексилата дабигатрана, а также для анализа. Предпосылки создания изобретения Этексилат дабигатрана формулы II является пероральным прямым ингибитором тромбина, который используется для профилактики тромбоэмболии у пациентов, перенесших полную замену коленного или бедренного сустава, а также для профилактики инсульта, прежде всего у пациентов, страдающих от мерцательной аритмии. Несмотря на то что клинический мониторинг этексилата дабигатрана не требуется, необходим надежный лабораторный метод оценки фармакодинамического действия этексилата дабигатрана. Такой метод можно использовать не только для исследования кинетики активности лекарственного средства в организме, но также для оптимизации дозы и дозировки лекарственного средства. С использованием указанного метода можно определять концентрацию лекарственного средства в крови пациента, что позволит исключить передозировку. Поэтому основной объект настоящего изобретения относится к разработке способа анализа фармакодинамического действия этексилата дабигатрана. Подробное описание изобретения Настоящее изобретение относится к способу количественного определения дабигатрана в образцах крови. Указанный способ включает определение времени свртывания крови, которое инициируют при добавлении очищенного тромбина человека. Для определения концентрации дабигатрана наиболее пригодным оказался следующий принцип исследования: для измерения концентрации дабигатрана аликвотную часть исследуемого образца плазмы разбавляют физиологическим раствором, затем добавляют постоянное количество высокоочищенного тромбина человека в -форме. Измеренное время коагуляции прямо пропорционально концентрации дабигатрана в исследуемом образце. Для определения концентрации активного вещества в исследуемом образце крови по принципу,описанному в данном контексте выше, необходимо построить калибровочную кривую, на которой отражена корреляция времени коагуляции от концентрации дабигатрана в образце. Для построения указанной калибровочной кривой исследуемый продукт должен содержать стандартные образцы дабигатрана определенной концентрации, которые добавляют в исследуемый продукт. В настоящем изобретении термин "стандартный образец дабигатрана" можно заменить термином "стандартный дабигатран для калибровки". Указанные стандарты должны обладать стабильностью, т.е. количество лекарственного средства должно оставаться постоянным при хранении стандарта при температуре-20C или выше. Необходимое свойство стандартных образцов заключается в простом способе их применения в тест-системе, чтобы обеспечить достоверную калибровочную кривую. Соединение формулы I (дабигатран) является соединением, склонным к кристаллизации в различных полиморфных формах. Кроме того, указанное соединение является гигроскопичным, что также приводит к образованию различных гидратированных форм. Соединение характеризуется низкой растворимостью. Основная цель настоящего изобретения заключается в получении формы дабигатрана, которую можно использовать в качестве стандарта для калибровки или стандарта для построения калибровочной кривой при определении времени коагуляции. Указанная цель достигается при превращении дабигатрана в лиофилизированную форму, как описано ниже. Определенное количество лекарственного вещества, дабигатрана, растворяют в водном растворе кислоты и разбавляют водой. Указанный раствор используют в качестве исходного раствора для получе-1 020194 ния различных образцов стандарта дабигатрана для калибровки. К антикоагулированной плазме человека, полученной от здоровых доноров-добровольцев (пул плазмы человека) по известной методике, добавляют различные аликвотные части исходного раствора дабигатрана, указанного в данном контексте выше, при этом получают растворы с различной концентрацией дабигатрана. Определенные объемы указанных различных растворов переносят в пригодные пробирки и высушивают лиофильно досуха в соответствующем приборе для лиофильного высушивания. Таким образом, в изобретении предлагается способ получения лиофилизированного дабигатрана,включающий стадии растворения дабигатрана в водном растворе кислоты, добавления раствора в антикоагулированную плазму человека и лиофильное высушивание полученного таким образом образца. Водный раствор кислоты, использованной для растворения дабигатрана, предпочтительно характеризуется значением рН 3, более предпочтительно 2. Кислоты предпочтительно выбирают из группы,включающей хлористо-водородную, бромисто-водородную, серную, фосфорную, метансульфоновую,уксусную, фумаровую, лимонную, винную и малеиновую кислоты. Предпочтительной является хлористо-водородная кислота. Антикоагулированную плазму человека получают по известной методике. Предпочтительно плазма представляет собой плазму человека, содержащую цитрат. Лиофилизированный дабигатран по настоящему изобретению быстро растворяется, следовательно,пригоден в качестве стандарта для калибровки при определении концентрации дабигатрана в образцах крови. Следовательно, в настоящем изобретении предлагается лиофилизированный дабигатран, который можно получить способом, описанным в данном контексте. Кроме того, в настоящем изобретении предлагается применение лиофилизированного дабигатрана по настоящему изобретению в качестве стандартного агента для калибровки. Прежде всего в изобретении предлагается применение лиофилизированного дабигатрана по настоящему изобретению в качестве стандартного агента для калибровки, предназначенного для антикоагуляционного анализа. Было установлено, что лиофилизированный дабигатран по настоящему изобретению проявляет стабильность в течение по крайней мере 24 ч при температуре 37C, в течение по крайней мере 6 месяцев при температуре 4 и -20C сответственно. Кроме того, в изобретении предлагается способ определения концентрации дабигатрана в образце крови, который заключается в применении лиофилизированного дабигатрана в качестве стандарта для калибровки. Кроме того, в изобретении предлагается указанный выше способ анализа, который заключается в том, что концентрацию дабигатрана определяют при измерении времени коагуляции образца крови. Кроме того, в изобретении предлагается указанный выше способ, в котором коагуляцию инициируют при добавлении постоянного количества высокоочищенного тромбина человека в -форме. В другом объекте настоящего изобретения предлагается набор для анализа, содержащий стандарт дабигатрана для калибровки по настоящему изобретению. Кроме того, соответственно в изобретении предлагается способ определения концентрации дабигатрана в образце крови, который заключается в применении лиофилизированного дабигатрана, полученного способом, указанным в данном контексте. Кроме того, в изобретении предлагается набор, включающий реагенты для определения концентрации дабигатрана в образце крови вместе с лиофилизированным дабигатраном, полученным способом,описанным в данномконтексте. Кроме того, в изобретении предлагается описанный выше набор, в котором реагенты для определения концентрации дабигатрана в образце крови включают реагент 1, который является антикоагулированной плазмой человека, и реагент 2, который является высокоочищенным тромбином человека в форме. В другом предпочтительном варианте набор содержит реагент 1 и реагент 2 в лиофилизированной форме. Лиофилизированные образцы дабигатрана в определенной концентрации можно использовать в системе контроля качества анализа. Точность анализа можно определять при измерении времени коагуляции в образце для контроля качества с последующим определением соответствующей концентрации дабигатрана по калибровочной кривой. Точность анализа определяют при сравнении известной требуемой концентрации образца дабигатрана для контроля качества с рассчитанной концентрацией указанного образца для качественного определения по времени коагуляции и калибровочной кривой. Следовательно, в другом варианте осуществления изобретения предлагается применение лиофилизированного дабигатрана по настоящему изобретению для определения точности анализа. Прежде всего в изобретении предлагается использование лиофилизированного дабигатрана по настоящему изобретению для определения точности антикоагуляционного анализа. Приведенные ниже примеры предназначены для более подробной иллюстрации настоящего изобретения. Материалы и методы. Хронометрические измерения коагуляции проводили с использованием двух шариковых коагулометров Behnk CL4 (фирмы Behnk Elektronik, Германия). Указанное оборудование использовали согласно инструкции фирмы-производителя. Набор для определения активности ингибитора тромбина, использованный в способе по настоящему изобретению, выпускается фирмой HYPHEN BioMed, Франция, с торговым названием HemoclotThrombin inhibitors. Компоненты набора, которые используются в настоящем изобретении, включают 2 следующих реагента: Реагент 1: нормальная плазма крови из пула, содержащая цитрат, лиофилизированная. Реагент 2: высокоочищенный тромбин человека (в -форме), содержащий ионы кальция, стабилизированный добавками и лиофилизированный. Обработку результатов коагуляционного анализа образцов плазмы, содержащей дабигатран, проводили с использованием программы для обработки результатов анализа "Analyse-it" для Excel, версия 2.09, Analyse-it Software, Ltd. РО Box 103, Leeds LS27 7WZ Англия, Великобритания. А) Получение стандартов лиофилизированного дабигатрана для калибровки. 5,55 мг дабигатрана формулы I растворяли в 200 мкл 1 М HCl и разбавляли высокоочищенной водой до конечного объема 50 мл. Указанный исходный раствор, содержащий 111 мкг/мл дабигатрана,хранили при температуре 4 С. Для получения стандартов дабигатрана для калибровки использовали плазму человека, полученную из крови здоровых доноров-добровольцев (плазмы человека из пула), содержащую цитрат. Аликвотные части исходного раствора дабигатрана разбавляли плазмой человека из пула, содержащей цитрат, при этом получали растворы с различными конечными концентрациями дабигатрана: 100, 500, 1500 и 2000 нМ дабигатрана. Аликвотные части по 500 мкл плазмы человека, содержащей дабигатран в концентрации 100, 500,1500 или 2000 нМ, переносили в полипропиленовые пробирки и лиофилизировали с использованием вакуумной центрифуги Christ Alpha RVC, Тур СМС-2 досуха в течение приблизительно 8 ч (давление: 3 мбар). Лиофилизированные стандарты дабигатрана для калибровки хранили при температуре -20C. Б) Получение стандартов для калибровки (калибровочной кривой). В каждый флакон, содержащий стандарт дабигатрана для калибровки, полученный на стадии А, в количестве 0 (контроль), 100, 500, 1500 и 2000 нМ дабигатрана добавляли 0,5 мл высокоочищенной воды, осторожно перемешивали. Выдерживали в течение 15 мин при комнатной температуре. Плазму для калибровки разбавляли в соотношении 1:8, например, смешивали 100 мкл стандарта и 700 мкл физраствора NaCl. С помощью пипетки добавляли по 50 мкл образца для калибровки в кюветы коагулометра (для каждого образца по два повтора). Для каждого стандарта для калибровки определяли время свертывания, как описано в разделе"Методика измерения". В) Получение реагентов. Рассчитывали объем реагентов, необходимый для анализа образцов на один день. В каждый сосуд с реагентами 1 и 2 добавляли 1 мл высокоочищенной воды, осторожно перемешивали, выдерживали в течение 15 мин при комнатной температуре. Стабильность полученных реагентов: Г) Получение и подготовка образцов плазмы. Образцы крови отбирали в антикоагулянт, 0,109 М тринатрий цитрат (соотношение кровь/цитрат 9:1). После центрифугирования в течение 20 мин при 2,5 g плазму декантировали. Образцы размораживали при температуре 37C в течение максимум 45 мин. Размороженные образцы хранили при комнатной температуре. Образцы плазмы разбавляли при соотношении 1:8, например, смешивали 100 мкл образца и 700 мкл физраствора NaCl. Д) Методика измерения. Сначала измеряли образцы стандартов для калибровки, полученные, как описано на стадии Б, по описанной ниже методике. После построения калибровочной кривой измеряли образцы плазмы, полученные, как описано на стадии Г. Образцы (стандарты для калибровки или плазма) перемешивали при осторожном встряхивании. Образцы плазмы (полученные, как описано на стадиях Б или Г) по 50 мкл каждого переносили в 2 кюветы (при этом получали по два повтора каждого образца). Пипеткой добавляли в кювету 100 мкл реагента 1 (предварительно инкубированного при температуре 37C). Затем включали секундомер и смесь немедленно инкубировали в течение 1 мин. При завершении времени инкубации в кювету добавляли 100 мкл реагента 2 (предварительно инкубированного при температуре 37C), включали секундомер и регистрировали период времени до остановки вращения шарика в коагулометре Behnk CL4 (время свртывания крови [с]). С использованием программного обеспечения рассчитывали среднее время свртывания крови [с] в двух повторах. Результат обоих измерений и среднее время свртывания крови распечатывали на принтере. Е) Построение калибровочной кривой. Времена коагуляции, измеренные для образцов стандартов для калибровки, содержащих 0 (контрольный образец), 100, 500, 1500 и 2000 нМ (можно использовать более широкий интервал концентраций и дополнительные концентрации, например 250 нМ), откладывали на график зависимости концентраций стандартов дабигатрана для калибровки (диаграмма разброса данных с использованием программы (MS Excel или аналогичной программы электронных таблиц). Калибровочную кривую рассчитывали методом линейного регрессионного анализа. Пример калибровочной кривой, полученной с использованием стандартов дабигатрана с концентрациями 50, 100, 250, 500, 1000, 1500 и 2000 нМ соответственноб приведен на фигуре. С использованием полученной калибровочной кривой и времени коагуляции можно рассчитать соответствующие концентрации дабигатрана в образцах плазмы. Образцы дабигатрана в определенных концентрациях, например 100, 500 и 1500 нМ, можно использовать в системе контроля качества анализа. При измерении времени коагуляции для образца, предназначенного для контроля качества, с последующим определением соответствующей концентрации дабигатрана по калибровочной кривой можно определить точность анализа. Точность анализа определяли при сравнении известной необходимой концентрации дабигатрана в образце для контроля качества и рассчитанной концентрации дабигатрана в указанном образце для контроля качества с использованием времени коагуляции и калибровочной кривой. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения лиофилизированного дабигатрана формулы I включающий стадии растворения дабигатрана в водном растворе кислоты, добавления раствора в антикоагулированную плазму человека и лиофильного высушивания раствора, полученного указанным способом. 2. Способ по п.1, отличающийся тем, что значение pH водного раствора кислоты, используемого для растворения дабигатрана, составляет не более 3, предпочтительно не более 2. 3. Способ по п.1 или 2, отличающийся тем, что водный раствор кислоты получают с использованием кислот, выбранных из группы, включающей хлористо-водородную, бромисто-водородную, серную,фосфорную, метансульфоновую, уксусную, фумаровую, лимонную, винную и малеиновую кислоты,причем наиболее предпочтительна хлористо-водородная кислота. 4. Способ по любому из пп.1-3, отличающийся тем, что антикоагулированная плазма человека содержит цитрат или ЭДТА. 5. Лиофилизированный дабигатран, который получают по способу, описанному в пп.1-4. 6. Применение лиофилизированного дабигатрана по п.5 в качестве стандартного агента для калибровки времени коагуляции образца крови. 7. Применение по п.6 в качестве стандартного агента для калибровки в коагуляционном анализе для количественного определения дабигатрана. 8. Способ определения концентрации дабигатрана в образце крови, включающий применение лиофилизированного дабигатрана по п.5. 9. Способ по п.8, отличающийся тем, что концентрацию дабигатрана определяют по времени коагуляции образца крови. 10. Способ по п.9, отличающийся тем, что коагуляцию инициируют при добавлении постоянного количества высокоочищенного тромбина человека в -форме. 11. Набор для определения концентрации дабигатрана в образце крови, включающий набор реагентов для определения концентрации дабигатрана в образце крови, а также лиофилизированный дабигатран по п.5. 12. Набор по п.11, в котором набор реагентов для определения концентрации дабигатрана в образце крови включает реагент 1, которым является антикоагулированная плазма человека, и реагент 2, который включает высокоочищенный тромбин человека в -форме. 13. Набор по п.12, в котором реагент 1 и реагент 2 являются лиофилизированными. 14. Применение лиофилизированного дабигатрана по п.5 для определения точности коагуляционного анализа. 15. Применение по п.14 для определения точности коагуляционного анализа для количественного определения дабигатрана. Калибровочная кривая для дабигатрана (0-2000), график линейной регрессии, доверительный интервал для линейной регрессии 95% и предсказанный интервал 95%
МПК / Метки
МПК: G01N 33/96, G01N 33/94
Метки: дабигатран, лиофилизированный
Код ссылки
<a href="https://eas.patents.su/6-20194-liofilizirovannyjj-dabigatran.html" rel="bookmark" title="База патентов Евразийского Союза">Лиофилизированный дабигатран</a>
Предыдущий патент: Комбинации, включающие метотрексат и ингибиторы дигидрооротатдегидрогеназы (dhodh)
Следующий патент: Погружной электродвигатель
Случайный патент: Способ и установка для изготовления строительных элементов, а также строительный элемент, изготовленный этим способом на этой установке





