Диариленины
Формула / Реферат
1. Соединение формулы I
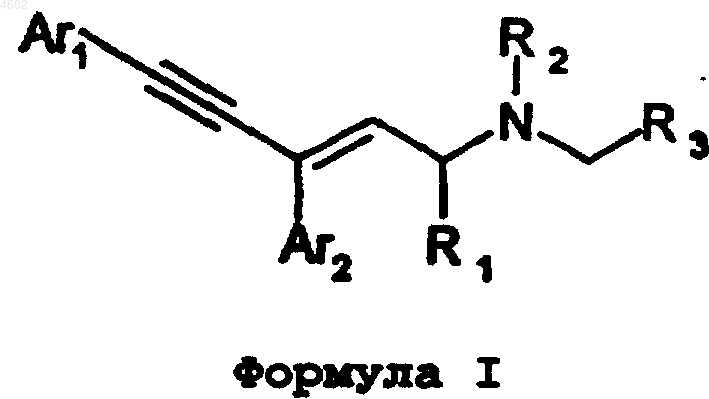
где Ar1 и Ar2 представляют независимо выбранные арильные группы, необязательно имеющие до пяти заместителей включительно, независимо выбранных из группы, состоящей из алкила, алкокси, циклоалкила, циклоалкилокси, гетероциклоалкила, гетероциклоалкилокси, алканоила, тиоалкила, аралкила, аралкилокси, арилоксиалкила, арилоксиалкокси, алкила, замещенного циклоалкилом, алкила, замещенного циклоалкилокси, алкокси, замещенного циклоалкилом, алкокси, замещенного циклоалкилокси, алкила, замещенного гетероциклоалкилом, алкила, замещенного гетероциклоалкилокси, алкокси, замещенного гетероциклоалкилом, алкокси, замещенного гетероциклоалкилокси, тиоарила, аралкилтио, тиоарилалкила, аралкилтиоалкила, галогена, NO2, CF3, CN, OH, алкилендиокси, SO2NRR', NRR', CO2R (где R и R' независимо выбирают из группы, состоящей из H и алкила) и второй арильной группы, которая может быть замещена указанным выше образом;
R1 выбирают из группы, состоящей из H и алкила;
R2 выбирают из группы, состоящей из H, алкила и бензила;
R3 выбирают из группы, состоящей из CO2R, CONRR', CONH(OH), COSR, SO2NRR', PO(OR)(OR') и тетразолила, где R и R' независимо выбирают из группы, состоящей из H и алкила, где указанные выше группы алкила и циклоалкила включают от 1 до 6 и от 3 до 8 атомов углерода соответственно, а группа гетероциклоалкила представляет собой кольцо, включающее от 3 до 8 членов;
и его соль, сольват или гидрат.
2. Соединение по п.1, где Ar1 представляет арильную группу, необязательно имеющую до трех заместителей включительно, независимо выбранных из галогена, NO2, CF3, CN, OH, SO2NRR', NRR', CO2R (где R и R' независимо выбирают из группы, состоящей из H и алкила), и заместителя формулы R"-(X)n-, где n представляет 0 или 1;
X представляет CH2 или гетероатом;
R" представляет H, алкил и арил, необязательно имеющий до трех заместителей включительно, выбранных из алкила, галогена, NO2, CF3, CN, OH, SO2NRR', NRR', CO2R, где R и R' независимо выбирают из группы, состоящей из H и алкила.
3. Соединение по п.2, где Ar1 представляет фенил.
4. Соединение по п.2, где Ar1 представляет замещенный фенил.
5. Соединение по п.2, где Ar1 представляет фенил, замещенный необязательно замещенной пятичленной арильной группой.
6. Соединение по п.5, где указанная пятичленная арильная группа включает по крайней мере один гетероатом.
7. Соединение по п.6, где указанная пятичленная арильная группа в Ar1 представляет 3-фурильную группу.
8. Соединение по п.7, где Ar1 представляет 4-(3-фурил)фенил.
9. Соединение по п.7, где Ar1 представляет 4-(3-тиенил)фенил.
10. Соединение по п.7, где Ar1 представляет 4-(1-пирролил)фенил.
11. Соединение по п.4, где Ar1 представляет фенил, замещенный низшим алкилом.
12. Соединение по п.11, где Ar1 представляет 4-(алкил)фенил.
13. Соединение по п.12, где указанную алкильную группу выбирают из метила, этила, н-пропила, изопропила и н-бутила.
14. Соединение по п.1, где Ar1 представляет алкилендиоксифенил.
15. Соединение по п.14, где Ar1 представляет метилендиоксифенил.
16. Соединение по п.15, где Ar1 представляет 3,4-метилендиоксифенил.
17. Соединение по п.1, где Ar1 представляет бензоконденсированную ароматическую группу.
18. Соединение по п.17, где Ar1 является карбоциклическим.
19. Соединение по п.18, где Ar1 представляет нафтил.
20. Соединение по п.19, где Ar1 представляет 2-нафтил.
21. Соединение по любому из пп.1-20, где Ar2 представляет арильную группу, необязательно имеющую до трех заместителей включительно, независимо выбранных из галогена, галогеналкила, алкила, галогеналкокси и алкокси.
22. Соединение по п.21, где Ar2 представляет незамещенный арил.
23. Соединение по п.22, где Ar2 представляет фенил.
24. Соединение по п.21, где Ar2 представляет замещенный фенил.
25. Соединение по п.24, где Ar2 представляет фенил, замещенный галогеном.
26. Соединение по п.25, где Ar2 представляет фенил, замещенный хлором или фтором.
27. Соединение по любому из пп.1-26, где R1 представляет H.
28. Соединение по любому из пп.1-27, где R2 представляет H.
29. Соединение по п.28, где R3 представляет метил.
30. Соединение по любому из пп.1-28, где R3 представляет COOR.
31. Соединение по п.30, где R3 представляет COOH.
32. Соединение по п.1, выбранное из
N-(5-(4-фторфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(2-фторфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(2,4-дифторфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(3-нитрофенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-нитрофенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(3-фенил-5-(2-тиометилфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-хлорфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-изопропилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(3,5-бис(трифторметил)фенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(3,5-дифенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-дифенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-трифторметилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N- (5-(4-бензилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-этилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-н-пролилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-н-бутилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-н-пентилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-феноксифенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(1-нафтил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-метилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(3-изопропилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(2-нафтил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(3,4-диметилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(2-изопропилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(3,4-метилендиоксифенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-пирролилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-трифторметоксифенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(3,4-диметоксифенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(3-фенил-5-(4-тиометилфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-метилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(3-фенил-5-(3-тиофен)-2-пентен-4-ин-1-ил)саркозина,
N-(3-фенил-5-(4-трет-бутилфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-(3-фурил)фенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-(3-тиофен)фенил)-3-фенил-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-изопропилфенил)-3-(4-(трифторметил)фенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-изопропилфенил)-3-(4-фторфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-изопропилфенил)-3-(2-фторфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-трет-бутилфенил)-3-(2-фторфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-изопропилфенил)-3-(4-хлорфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-трет-бутилфенил)-3-(4-хлорфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-изопропилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-трет-бутилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-изопропилфенил)-3-(3-фторфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-изопропилфенил)-3-(3-тиенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-изопропилфенил)-3-(4-метоксифенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(3,4-метилендиоксифенил)-3-(3-фторфенил)-2-пентен-4-ин-1-ил)саркозина,
N-(5-(4-этилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозина и
N-(5-(4-пропилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозина.
33. Соединение N-(5-(4-(3-фурил)фенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин.
34. Композиция, включающая соединение по любому из пп.1-33, и носитель.
35. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения по любому из пп.1-33, и фармацевтически приемлемый носитель.
36. Способ лечения пациента в болезненном состоянии, при котором показано ингибирование транспорта глицина, включающий стадию введения пациенту фармацевтической композиции по п.35.
37. Способ по п.36, где болезненным состоянием является шизофрения.
38. Способ по п.36, где болезненным состоянием является нарушение познавательной функции.
39. Способ по п.36, где болезненным состоянием является болезнь Альцгеймера.
Текст
1 Настоящее изобретение относится к классу диариленинов, к содержащим их фармацевтическим композициям и к способам лечения неврологических заболеваний с использованием этих соединений. Предпосылки изобретения Синаптическая передача представляет собой сложную форму межклеточных связей, которая включает значительную совокупность специализированных структур, как в пре-, так и в пост-синаптических терминальных и окружающих глиальных клетках (Kanner andSchuldiner, CRC Critical Reviews in Biochemistry,22, 1987:1032). Транспортеры секвестируют нейротрансмиттер из синапса, тем самым регулируя концентрацию нейротрансмиттеров в синапсе, а также их длительность пребывания в нем, что совместно влияет на величину синаптической передачи. Кроме того, предотвращая распространение трансмиттера в соседние синапсы, транспортеры поддерживают точность синаптической передачи. И наконец, ограничивая выделение трансмиттеров в пресинаптический терминал, транспортеры обеспечивают возможность повторных использований трансмиттеров. Транспорт нейротрансмиттеров зависит от внеклеточного натрия и разности потенциалов с двух сторон мембраны; в условиях интенсивного нейронального функционирования, как например, во время эпилептического припадка,транспортеры могут функционировать обратным образом, выделяя нейротрасмиттеры независимым от кальция не-экзоцитотическим образом. (Attwell et al., Neuron, 11, 1993:401-407). Таким образом, фармакологическая модуляция транспортеров нейротрансмиттеров обеспечивает средство для модификации синаптической активности, что обеспечивает полезный метод для лечения неврологических и психиатрических заболеваний. Аминокислота глицин является основным нейротрасмиттером в центральной нервной системе млекопитающих, и функционирует как в ингибирующих (тормозящих), так и как в возбуждающих синапсах. Под нервной системой подразумеваются как центральная, так и периферическая части нервной системы. Эти отличительные функции глицина опосредствуются двумя различными типами рецепторов, каждый из которых связан с различными классами транспортеров глицина. Тормозящее действие глицина опосредствуется рецепторами глицина,которые чувствительны к вызывающему конвульсии алкалоиду стрихнину, и поэтому их называют "стрихнин-чувствительными". Такие рецепторы содержат внутренний канал хлора,который открывается после связывания глицина с рецептором; при увеличении проводимости хлорида повышается порог запуска потенциала действия. Стрихнин-чувствительные рецепторы глицина обнаружены, главным образом, в спин 004602 2 ном мозге и в стволе головного мозга, и фармакологические агенты, которые усиливают активацию таких рецепторов таким образом усиливают нейропередачу торможения в этих участках. Глицин участвует также в возбуждающей передаче путем модуляции действий глутамата,основного возбудительного трансмиттера центральной нервной системы (Johnson and Ascher,Nature, 325, 1987:529-531; Fletcher et al., GlycineTransmission, Otterson and Storm-Mathisen, eds.,1990:193-219). Более конкретно глицин является обязательным со-агонистом класса рецептора глутамата, называемого рецептором N-метил-Dаспартата (NMDA). Активация рецепторовNMDA повышает проводимость натрия и кальция, что деполяризует нейрон, тем самым, повышая вероятность того, что он включит потенциал действия. NMDA рецепторы в гиппокампальном участке мозга играют важную роль в модели синаптической пластичности, известной как длительное потенциирование (LTP), что является существенным для определенного типа обучения и памяти (Hebb, D.O. (1949) The Organization of Behavior; Wiley, NY; Bliss andal. (1986) Nature 319: 774-116). Повышенная экспрессия выбранных NMDA рецепторных субъединиц у трансгенных мышей приводит к усилению опосредствованных NMDA-рецептором токов, усилению LTP, и к лучшим характеристикам в ряде тестов, связанных с обучением и памятью. (Tang et al. (1999) Nature 401:63). Напротив, снижение экспрессии выбранных субъединиц NMDA рецепторов у трансгенных мышей приводит к поведению, сходному с поведением фармакологически индуцированных на животных моделях шизофрении, включая усиление двигательной активности, повышенную стереотипию и дефицит социальных/половых взаимодействий (Mohn et al. (1999) Cell 98:427-436). Такое аберрантное поведение можно улучшить, используя антипсихотические галоперидол и клозапин.NMDA рецепторы широко распространены в мозге, причем с особенно высокой плотностью в коре головного мозга и гиппокампальных образованиях. Методами молекулярного клонирования было обнаружено существование в мозге млекопитающих двух классов транспортеров глицина, называемых GlyT-1 и GlyT-2. GlyT-1 находится во всем мозге и в спинном мозге, и было предположено, что его распространение соответствует распространению глутаматергических путей и NMDA рецепторов (Smith, et al.Neuron, 8, 1992:927-935). Методами молекулярного клонирования было выяснено также существование трех видов (вариантов) GlyT-1, называемых GlyT-1a, GlyT-1b и GlyT-1c. Два из них(1 а и 1b) обнаружены у грызунов, причем каждый из них демонстрирует уникальное распре 3 деление в мозге и периферических тканях(Borowsky et al., Neuron, 10, 1993:851-863; Adams et al., J. Neuroscience, 15, 1995:2524-2532) . Третий вид, 1 с, был обнаружен только в тканях человека (Kim, et al., Molecular Pharmacology,45, 1994:608-617). Эти варианты возникают в результате дифференциального сплайсинга и использования эксонов, и отличаются своими Nконцевыми участками. Напротив, GlyT-2, обнаруживается главным образом в стволе мозга и спинном мозге и его распределение близко соответствует распределению стрихнинчувствительных рецепторов глицина (Liu et al.,J. Biological Chemistry, 268, 1993:22802-22808;Jursky and Nelson, J. Neurochemistry, 64,1995:1026-1033). Другой отличительной особенностью транспорта глицина, опосредствованного GlyT-2, является то, что его не ингибирует саркозин, как это происходит в случае транспорта глицина, опосредствованного GlyT1. Эти результаты согласуются с точкой зрения,что, регулируя синаптические уровни глицина,GlyT-1 и GlyT-2 селективно можно влиять на активность NMDA рецепторов и стрихнинчувствительных рецепторов глицина, соответственно. Таким образом ожидается, что соединения,которые ингибируют или активируют транспортеры глицина, должны изменять рецепторные функции и таким образом обеспечить успех лечения различных болезненных состояний. Например, соединения, которые ингибируют опосредствованный GlyT-1 транспорт глицина, повышают концентрации глицина уNMDA рецепторов, причем эти рецепторы расположены в переднем мозге, наряду с другими локализациями. Такое повышение концентрации усиливает активность NMDA рецепторов, и тем самым облегчает состояние шизофрении и усиливает познавательную функцию. В другом варианте, соединения, которые взаимодействуют непосредственно с компонентой рецептора глицина NMDA рецептора, могут оказывать те же самые или аналогичные действия, такие как увеличение или уменьшение доступности внеклеточного глицина, вызываемое ингибированием или усилением активности GlyT-1, соответственно. См. например, Pitkanen et al., Eur. J.and Schmidt, J. Neurosci., 16, 1561-1569 (1996). В настоящем изобретении предложены соединения, которые действуют на транспорт глицина. В настоящем изобретении предложены также композиции, которые можно использовать для лечения болезненных состояний, при которых показаны модуляторы транспорта глицина, и особенно ингибиторы поглощения (захвата) глицина. Краткое содержание изобретения В соответствии с одним аспектом изобретения предложены соединения формулы IAr1 и Аr2 представляют независимо выбранные арильные группы, необязательно имеющие до пяти заместителей, независимо выбранных из группы, состоящей из алкила,алкокси, циклоалкила, циклоалкилокси, гетероциклоалкила, гетероциклоалкилокси, алканоила,тиоалкила, аралкила, аралкилокси, арилоксиалкила, арилоксиалкокси, алкила, замещенного циклоалкилом, алкила, замещенного циклоалкилокси, алкокси, замещенного циклоалкилом,алкокси, замещенного циклоалкилокси, алкила,замещенного гетероциклоалкилом, алкила, замещенного гетероциклоалкилокси, алкокси,замещенного гетероциклоалкилом, алкокси,замещенного гетероциклоалкилокси, тиоарила,аралкилтио, тиоарилалкила, аралкилтиоалкила,галогена, NO2, CF3, CN, ОН, алкилендиокси,SO2NRR', NRR', CO2R (где R и R' независимо выбирают из группы, состоящей из Н и алкила) и второй арильной группы, которая может быть замещена указанным выше образом;CO2R, CONRR', CONH(OH), COSR, SO2NRR',PO(OR)(OR') и тетразолила, где R и R' независимо выбирают из группы, состоящей из Н и алкила; и их соли, сольваты или гидраты. Было обнаружено, что соединения формулы I ингибируют транспорт глицина (или повторный захват) за счет GlyT-1 транспортеров,или они являются предшественниками (например, пролекарственными препаратами) таких соединений, и поэтому их можно использовать для лечения шизофрении, а также других заболеваний, связанных с ЦНС, таких как познавательная дисфункция, деменция (включая деменцию, связанную с болезнью Алцгеймера), дефицит внимания и депрессия. В соответствии с другим аспектом настоящего изобретения предложена фармацевтическая композиция, включающая соединение формулы I в таком количестве, которое эффективно для ингибирования транспорта глицина, и фармацевтически приемлемый носитель. В другом аспекте настоящего изобретения предложены композиции, содержащие соединение настоящего изобретения в количестве для фармацевтического использования для лечения болезненных состояний, при которых показан ингибитор транспорта глицина. Предпочтительными являются такие композиции, которые содержат соединения, пригодные для лечения бо 5 лезненных состояний, при которых необходимо опосредованное GlyT-1 ингибирование транспорта глицина, например для лечения шизофрении или познавательных дисфункций. Определения Термин арил, в том смысле, как здесь использован, означает моноциклическую ароматическую группу, такую как фенил, пиридил,фурил, тиенил и т.п., или кондесированную с бензолом ароматическую группу, такую как нафтил, инданил, хинолинил, флуоренил и т.п. Термин алкил в том смысле, как здесь использован, означает алкильные радикалы с разветвленной или неразветвленной цепью, содержащие от одного до шести атомов углерода, и включает метил, этил и т.п. Термин циклоалкил в том смысле, как здесь использован, означает карбоциклические кольца, содержащие от трех до восьми атомов углерода, и включает циклопропил, циклогексил и т.п. Аналогично, термин "циклоалкилокси" относится к такому карбоциклу, который присоединен через кислород к другой группе, и включает циклогексилокси и т.п. Термин гетероциклоалкил в том смысле,как здесь использован, означает трех-восьмичленное кольцо, содержащее до двух гетероатомов включительно, которые выбирают из группы, состоящей из N, S и О, и включает пиперидинил, пиперазинил, тиопиранил и т.п. Такие кольца, соединенные с другой группой через атом кислорода, такие как пиперидинилокси и т.п., называют гетероциклоалкилокси группами. Термины аралкил, арилоксиалкил, аралкилокси и арилоксиалкокси здесь называют алкильным или алкокси радикалом, замещенным арильной или арилокси группой и включают бензил, фенетил, бензилокси, 2-феноксиэтил и т.п. Аналогично, термины алкил замещенный циклоалкилом, алкокси замещенный циклоалкилом, алкил замещенный гетероциклоалкилом и алкокси замещенный гетероциклоалкилом,означают группы, такие как 2-циклогексилэтил и т.п. Кроме того, заместители, в которых алкильная или алкокси группа замещена другой группой через мостиковый кислород, здесь именуются как алкил замещенный циклоалкилокси,алкокси замещенный циклоалкилокси, алкил замещенный гетероциклоалкилокси и алкокси замещенный гетероциклоалкилокси. Термины алкилен (например, -СН 2-СН 2-),алкенилен (например, -СН=СН-) и алкинилен(например, -СНСН-) в том смысле, как здесь использованы, означают двухвалентный радикал с разветвленной или неразветвленной цепью, содержащий от одного до шести атомов углерода, такой как метилен, этилен, винилен,пропенилен и этинилен. Термин алкокси в том смысле, как здесь использован, означает алкокси радикалы с неразветвленной или разветвленной цепью, со 004602 6 держащие от одного до шести атомов углерода,и включает метокси, этокси и т.п. Термин тиоалкил в том смысле, как здесь использован, означает алкильные радикалы с неразветвленной или разветвленной цепью, содержащие от одного до шести атомов углерода,и включает тиометил (СН 3-S-), тиопропил и т.п. Термин тиоарил относится к арильной группе, которая соединена с другой группой мостиком серы. Аналогично, тиоарилалкильная группа представляет тиоарильную группу, соединенную с другой группой мостиком - алкиленовой группой. Аналогично, аралкилтиогруппа представляет аралкильную группу, такую как бензил, которая соединена с другой группой через атом серы. Далее, арилалкилтиоалкильная группа представляет арилалкильную группу,которая соединена с другой группой мостиком тиоалкильной группой. Термин алканоил, в том смысле как здесь использован, означает радикалы с разветвленной или неразветвленной цепью, содержащие от одного до шести атомов углерода, и включает ацетил, пропионил и т.п. Термин галоген в том смысле, как здесь использован, означает галоген, и включает и включает фтор, хлор, бром и т.п. Термин галогеналкил означает алкильную группу, замещенную одним или более из независимо выбранных атомов галогенов, такую как -СF3. Аналогично,термин галогеналкокси означает алкоксигруппу,замещенную одним или более из независимо выбранных атомов галогенов, такую как -OCF3. Термин алкилендиокси относится к группе формулы -О-(СН 2)n-O-, где концевой кислород обычно присоединен к атомам арильной группы с образованием бициклической кольцевой системы и включает метилендиокси, этилендиокси и т.п. Термин гетероатом в том смысле, как здесь использован, означает атомы, которые отличны от углерода, и включает N, S и О. Подробное описание и предпочтительные варианты Пространственное расположение заместителей относительно двойной связи для соединений формулы I соответствует представленному на рисунке. То есть, группа Аr2 и атом углерода,к которому присоединена группа R1, находятся в цис-положении относительно друг друга. Соединения формулы I включают те, в которых Ar1 и Аr2 независимо представляют необязательно замещенные арильные группы. Положения замещения на кольцах Ar1 и Аr2 будут на практике ограничены атомами углерода кольца, которые не связаны с ядром молекулы. Например, бензольное кольцо может иметь до пяти заместителей включительно: пиридин и пиран могут иметь до 4 заместителей включительно, пиррол, фуран и тиофен могут иметь до 3 заместителей включительно; имидазол может иметь до 2 заместителей включи 7 тельно, а у триазола может быть только один заместитель. В различных вариантах настоящего изобретения Ar1 представляет необязательно моноциклическую ароматическую группу, такую как бензол, пиридин пиран, тиофен, фуран, пиррол,имидазол и триазол. У Ar1 может быть 1, 2 или 3 заместителя у ароматического кольца, и они могут быть выбраны из таких групп, как алкил,алкокси, циклоалкил, циклоалкилокси, гетероциклоалкил, гетероциклоалкилокси, алканоил,тиоалкил, аралкил, аралкилокси арилоксиалкил,арилоксиалкокси, алкил, замещенный циклоалкилом, алкил, замещенный циклоалкилокси,алкокси, замещенный циклоалкилом, алкокси,замещенный циклоалкилокси, алкил, замещенный гетероциклоалкилом, алкил, замещенный гетероциклоалкилокси, алкил, замещенный гетероциклоалкилом, алкокси, замещенный гетероциклоалкилокси, тиоарил, аралкилтио, тиоарилалкил, галоген, NO2, CF3, CN, ОН, метилендиокси, этилендиокси, SO2NRR', NRR', CO2R(где R и R' независимо выбирают из группы,состоящей из Н и алкила) или арильную группу,необязательно замещенную как указано выше. В предпочтительных вариантах настоящего изобретения Ar1 выбирают из бензола, пиридина, пирана, тиофена, фурана и пиррола, необязательно замещенных 1, 2 или 3 заместителями, выбранными из галогенов, NO2, CF3, CN,ОН, алкила, алкокси, арила, аралкила, и R"(X)n,где n представляет 0 или 1; X представляет СН 2 или гетероатом; и R" представляет Н, алкил или арил, необязательно имеющий до трех заместителей включительно, независимо выбранных из алкила, галогена, NO2, CF3, CN, ОН, SO2NRR',NRR' и CO2R (где R и R' независимо выбирают из группы, состоящей из Н и алкила). В наиболее предпочтительных вариантахAr1 представляет фенил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из галогенов, NO2, CF3, CN, ОН, и R"(X)n, где n представляет 0 или 1; X представляет СН 2, О, S,или NR; и R" представляет Н, алкил или арил,необязательно имеющий до трех заместителей включительно, независимо выбранных из алкила, галогена, NO2, CF3, CN, ОН, SO2NRR', NRR',CO2R (где R и R' независимо выбирают из группы, состоящей из Н и алкила). В еще более предпочтительных вариантахAr1 представляет фенил, необязательно замещенный 1 или 2 заместителями, которые выбирают из алкила, тиоалкила, алкокси, галогенов,галогеналкилов, галогеналкокси, замещенного или незамещенного арила, замещенного или незамещенного арилокси, замещенного или незамещенного аралкила. В специфических вариантах Аr1 представляет монозамещенный фенил, у которого заместитель расположен в 4-положении, причем его выбирают из метила, этила, н-пропила, изопропила, н-бутила 3-фурила и 3-тиенила. 8 В других вариантах Ar1 представляет необязательно замещенную бензоконденсированную ароматическую группу, такую как нафталин, хинолин, индол, антрацен, флуоренил, алкилендиоксифенил и т.п., где заместителями могут быть галогены, NO2, CF3, CN, ОН, алкил,алкокси, арил, аралкил и R"(X)n, где n представляет 0 или 1; X представляет СН 2 или гетероатом; и R" представляет Н, алкил или арил, необязательно имеющий до трех заместителей включительно, которые выбирают из алкила,галогена, NO2, CF3, CN, ОН, SO2NRR', NRR',CO2R (где R и R' независимо выбирают из группы, состоящей из Н и алкила). В конкретных вариантах, Аr1 может быть нафтилом, хинолинилом, инданилом или алкилендиоксифенилом, необязательно замещенным 1 или 2 заместителями, выбранными из алкила,алкокси, тиоалкила и арила. В специфическом варианте Ar1 выбирают из незамещенного нафталина и метилендиоксифенила. В других вариантах настоящего изобретения Аr2 представляет необязательно замещенный арил, где арил представляет моноциклическую ароматическую группу, такую как бензол,пиридин, пиран, фуран, тиофен, пирролидин и т.п., или представляет бензоконденсированную ароматическую кольцевую систему, такую как нафталин, хинолин, индол, антрацен, флуоренил, алкилендиоксифенил и т.п. Могут присутствовать 1, 2 или 3 заместителя, которые независимо выбирают из галогенов, галогеналкила,алкила, галогеналкокси и алкокси. В конкретном варианте А представляет моноциклическое ароматическое кольцо, содержащее до трех заместителей включительно,которые независимо выбирают из галогена, галогеналкила, алкила, галогеналкокси и алкокси. В более конкретных вариантах А выбирают из моно- или дизамещенного фенила, где заместители выбирают из галогена, галогеналкила, алкила, галогеналкокси и алкокси. В специфических вариантах Аr2 представляет фенильную группу, которая не замещена или содержит один заместитель, выбранный из галогена и алкокси. В более специфических вариантах, Аr2 выбирают из незамещенного или монозамещенного фенила, где заместитель выбирают из хлора и фтора. В других вариантах настоящего изобретения R3 выбирают из группы, состоящей изR' независимо выбирают из группы, состоящей из Н и алкила. В конкретных вариантах R3 представляетCOOR. В предпочтительных вариантах настоящего изобретения R3 представляет СООН. Соединения формулы I включают такие,где R1 выбирают из группы, состоящей из Н и 9 алкила. Предпочтительно, чтобы R1 представлял Н. Соединения формулы I включают такие,где R2 выбирают из группы, состоящей из Н,алкила и бензила. Удобно, чтобы R2 представлял алкил; более предпочтительно, если R2 представляет метил. В предпочтительных вариантах соединениями формулы I являются такие, в которых R1 представляет Н, R2 представляет метил, R3 представляет СООН. В этом контексте желательно, чтобы Ar1 и Аr2 представляли замещенный или незамещенный фенил. Предпочтительно, чтобы Ar1 представлял либо фенил либо 4(замещенный)фенил. Если он замещен, желательно, чтобы Ar1 представлял 4-(алкил)фенильную группу, особенно если алкильная группа является алкильной группой с неразветвленной цепью, включая 4-изопропилфенил,4-этилфенил и 4-н-пропилфенил. Либо в комбинации с ним, либо независимо от него, Аr2 предпочтительно представляет фенил замещенный хлором или фтором. В другом предпочтительном варианте R1 представляет Н, R2 представляет метил, R3 представляет СООН, Аr2 представляет незамещенный фенил и Ar1 представляет 4-алкилзамещенный фенил, где алкил представляет (С 1-С 4) неразветвленную цепь. В другом предпочтительном варианте R1 представляет Н, R2 представляет метил, R3 представляет СООН, Аr2 представляет 2-хлорфенил и Ar1 представляет 4-алкилфенил, где алкильный заместитель выбирают из этила и пропила. В другом предпочтительном варианте R1 представляет Н, R2 представляет метил, R3 представляет СООН, Аr1 представляет нафтил, предпочтительно 2-нафтил, и Аr2 представляет фенил. В еще одном предпочтительном варианте настоящего изобретения R1 представляет Н, R2 представляет метил, R3 представляет СООН, Аr1 представляет 3,4-метилендиоксифенил и Аr2 представляет 3-фторфенил. В еще одном предпочтительном варианте настоящего изобретения R1 представляет Н, R2 представляет метил, R3 представляет СООН, Аr2 представляет фенил, и Аr1 представляет необязательно замещенный фенил, замещенный арилом. В более предпочтительном варианте настоящего изобретения R1 представляет Н, R2 представляет метил, R3 представляет СООН, Аr2 представляет фенил и Ar1 представляет фенил,замещенный 5-членным гетероарилом, который необязательно замещен. В наиболее предпочтительном варианте настоящего изобретения R1 представляет Н, R2 представляет метил, R3 представляет СООН, Аr2 представляет фенил и Ar1 представляет 4-(3 фурил)фенил. 10 Конкретные соединения формулы I включаютN-(3-фенил-5-(3-тиофен)-2-пентен-4-ин-1 ил)саркозин,N-(3-фенил-5-(4-трет-бутилфенил)-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-(3-фурил)фенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-(3-тиофен)фенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-изопропилфенил)-3-(4-(трифторметил)фенил)-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-изопропилфенил)-3-(4-фторфенил)-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-изопропилфенил)-3-(2-фторфенил)-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-трет-бутилфенил)-3-(2-фторфенил)-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-изопропилфенил)-3-(4-хлорфенил)2-пентен-4-ин-1-ил)саркозин,N-(5-(4-трет-бутилфенил)-3-(4-хлорфенил)-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-изопропилфенил)-3-(2-хлорфенил)2-пентен-4-ин-1-ил)саркозин,N-(5-(4-трет-бутилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-изопропилфенил)-3-(3-фторфенил)-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-изопропилфенил)-3-(3-тиенил)-2 пентен-4-ин-1-ил)саркозин,N-(5-(4-изопропилфенил)-3-(4-метоксифенил)-2-пентен-4-ин-1-ил)саркозин,N-(5-(3,4-метилендиоксифенил)-3-(3-фторфенил)-2-пентен-4-ин-1-ил)саркозин,N-(5-(4-этилфенил)-3-(2-хлорфенил)-2 пентен-4-ин-1-ил)саркозин,N-(5-(4-пропилфенил)-3-(2-хлорфенил)-2 пентен-4-ин-1-ил)саркозин. Соединения формулы I можно рассматривать как аминокислоты или как их производные. Соединения, которые содержат вместо карбоксилатной группы "эквивалент карбоксилатной группы" такой как гидроксамовая кислота, фосфоновая кислота, фосфиновая кислота, сульфоновая кислота, сульфиновая кислота, амиды или тетразолы, также рассматриваются как варианты настоящего изобретения. В другом варианте изобретения соединение формулы I предложено в меченной форме,такой как радиомеченная форма (например,метка 3 Н или 14 С введена в структуру соединения или за счет конъюгации с 125I). В предпочтительном аспекте настоящего изобретения такие соединения, которые преимущественно связываются с GlyT-1, можно использовать для идентификации лигандов GlyT-1 рецептора известными специалистам способами. Это можно осуществить, инкубируя рецептор или ткань в присутствии предполагаемого лиганда и затем инкубируя полученный препарат с эквимолярным количеством радиомеченного соединения настоящего изобретения. Лиганды GlyT-1 рецептора проявятся таким образом как те, которые преимущественно займут GlyT-1 сайт, и 12 предотвратят связывание радиомеченного соединения настоящего изобретения. В другом варианте предполагаемые лиганды GlyT-1 рецептора можно идентифицировать, вначале инкубируя радоимеченную форму соединения настоящего изобретения, а затем инкубируя полученный препарат в присутствии предполагаемого лиганда. Более эффективный лиганд GlyT-1 рецептора будет, при эквимолярной концентрации, вытеснять радиомеченное соединение настоящего изобретения. Соли присоединения кислот соединений формулы I наиболее удобно получать из фармацевтически приемлемых кислот, и они включают те, которые получены с использованием неорганических кислот, например, хлористоводородной, серной или фосфорной кислоты, и органических кислот, например, янтарной, малеиновой, уксусной или фумаровой кислоты. Можно использовать и другие фармацевтически неприемлемые соли, например, оксалаты, для выделения соединений формулы I для лабораторного использования, или для последующего превращения в фармацевтически приемлемые соли присоединения кислот. В объем настоящего изобретения включены также соли присоединения оснований (такие как соли натрия, калия и аммония), сольваты и гидраты соединений настоящего изобретения. Предпочтительны основные соли и особенно предпочтительны соли натрия и калия. Превращение конкретной соли соединения в нужную соль соединения осуществляют стандартными способами, которые хорошо известны специалистам. Соединения настоящего изобретения можно получить способами, которые аналогичны способам, принятым в этой области. Например,соединения формулы I легко получить способом, представленным на схеме 1 далее. Промежуточное соединение С получают в соответствии со способом Trost (Trost, В. М.; Sorum, M. Т.; Chan, С; Harms, A. E.; Ruther, G. J. Am.Chem. Soc. 1997, 119, 698-708; Trost, B.M.; Hachiya, I.; McIntosh, M. С. Tetrahedron Lett. 1998,39, 6445-6448), осуществляя взаимодействие арилпропиолового сложного эфира, такого как А, с триметилсилилацетиленом В в присутствии ацетата палладия и трис(2,6-диметоксифенил) фосфина. В результате восстановления сложного эфира до спирта и обработки N-бромсукцинимидом получают бромид D. В результате обработки D сложным эфиром саркозина (таким как трет-бутил саркозин) в присутствии основания получают промежуточное производное саркозина Е. В результате удаления триметилсилильной группы (например, обрабатывая карбонатом калия в метаноле), и последующего введения второй арильной группы в результате реакции сочетания Sonogashira (Sonogashira, К.;G, которое после удаления защитных групп,например, муравьиной кислотой, дает конечный продукт Н. Этот способ удобен для параллельного синтеза серии родственных соединений, в которых группа Аr2 постоянна, а группа Ar1 представляет ряд различных арильных групп. Общее промежуточное F получают в массе, и просто обрабатывают соответствующим арилиодидом в условиях реакции Sonogashira, получая нужные продукты. Схема 1 Реагенты: (i) Pd(OAc)2, фосфиновый лиганд: (ii) (a) DIBAL-H, (b) NBS, PPh3; (iii) t-Bu саркозин, К 2 СО 3, KI; (iv) K2CO3, MeOH; (v) Ar1I, CuI, Pd(PPh3)4 Et3N; (vi) муравьиная кислота,50 С. В другом варианте такие соединения можно также получить в соответствии со способом,представленным далее на схеме 2. Этот способ дополняет представленный ранее, так как он позволяет осуществить параллельный синтез серии родственных соединений, у которых постоянна группа Ar1, а группа Аr2 представляет ряд различных арильных групп. В этом случае общее промежуточное L получают в массе, и просто обрабатывают соответствующим сложным арилпропиоловым эфиром О (который легко получить из арилиодида М, обрабатывая сложный пропиоловый эфир N в присутствииCuI и Pd(PPh3)4), в указанных выше условиях, и получая, после удаления защитных групп, продукты Н. Схема 2(vii) муравьиная кислота, 50C. Для получения соединений, в которых Ar1 представляет фенил, замещенный арилом (Аr3 фенил), используют следующий способ синтеза(схема 3). Промежуточное F можно получить в соответствии со схемой 1, затем осуществить реакцию сочетания Sonogashira с бромйодбензолом, получая соединение S. Арилбромид соединения S можно затем подвергнуть взаимодействию с бороновой кислотой (Аr3-бороновая кислота) в условиях реакции сочетания Suzuki,получая промежуточное соединение G'. (G' представляет эквивалент G, схема 1, где Ar1 представляет Аr3-фенил). У G' можно затем удалить защитные группы, как на схеме 1, получая Н'. Схема 3(i) 4-бромйодбензол, Pd(PPh3)4, CuI, Et3N,при комнатной температуре в течение ночи; (ii) Аr3-бороновая кислота, Pd(PPh3)4, 2M Na2CO3,ДМФ, 110 С, 1 час; (iii) муравьиная кислота 40 С в течение ночи. Соединения, которые ингибируют опосредствованный GlyT-1 транспорт глицина, будут повышать концентрацию глицина у NMDA рецепторов, причем эти рецепторы расположены в переднем мозге, наряду с другими локализациями. Такое повышение концентрации усиливает активность NMDA рецепторов, и тем самым облегчает состояние шизофрении и усиливает познавательную функцию. В другом варианте, соединения, которые взаимодействуют непосредственно с компонентой рецептора глицина NMDA рецептора, могут оказывать те же самые или аналогичные действия, такие как увеличение или уменьшение доступности внеклеточного глицина, вызываемое ингибированием или усилением активности GlyT-1, соответственно. См. например, Pitkanen et al., Eur. J.and Schmidt, J. Neurosci., 16, 1561-1569 (1996). Соединения настоящего изобретения можно, например, вводить перорально, сублингвально, ректально, через нос, вагинально, наружно (включая использование пластырей или других приспособлений для введения через кожу), через легкие, используя аэрозоли, или па 15 рентерально, включая, например, внутримышечное, подкожное, внутрибрюшинное, внутриартериальное, внутривенное введение или введение в оболочку сухожилия. Введение можно осуществлять с помощью насоса для периодического или непрерывного введения. Соединения настоящего изобретения вводят отдельно,или объединяя с фармацевтически приемлемым носителем или эксципиентом в соответствии с общепринятой практикой. Для перорального введения соединения настоящего изобретения используют в форме таблеток, капсул, пастилок,жевательных резинок, лепешек, порошков, сиропов, эликсиров, водных растворов и суспензий, и т.п. В случае таблеток используемые носители включают лактозу, цитрат натрия и соли фосфорной кислоты. Обычно в таблетках используют такие разрыхляющие агенты, как крахмал, и смазывающие агенты, такие как стеарат магния и тальк. Для перорального введения в форме капсул удобными разбавителями являются лактоза и высокомолекулярные полиэтиленгликоли. При желании добавляют подслащивающие и/или вкусовые агенты. Для парентерального введения обычно получают стерильные растворы соединений настоящего изобретения, и величину рН этих растворов устанавливают соответствующим образом и растворы буферируют. Для внутривенного введения полную концентрацию растворенного вещества следует устанавливать таким образом, чтобы придать препарату изотоничность. Для офтальмологического использования мази и капли можно вводить с помощью известных специалистам систем доставки, таких как апликаторы или глазные капельницы. Такие композиции могут включать мукомиметики, такие как гиалуроновая кислота, хондроитинсульфат, гидроксипропилметилцеллюлоза или поливиниловый спирт, консерванты, такие как сорбиновая кислота, EDTA или бензилхлорид хрома, и обычные количества разбавителей и/или носителей. Для введения через легкие разбавители и/или носители выбирают таким образом, чтобы они обеспечивали образование аэрозолей. Суппозиторные формы соединений настоящего изобретения можно использовать для вагинального, уретрального и ректального введения. Такие суппозитории обычно получают из смеси веществ, которые являются твердыми при комнатной температуре, но плавятся при температуре тела. Вещества, которые обычно используют для создания таких носителей, включают масло теоброма, глицеринированный желатин,гидрированные растительные масла, смеси полиэтиленгликолей различного молекулярного веса и сложные эфиры жирных кислот полиэтиленгликоля. См. Remington's Pharmaceutical Sciences, 16 th Ed., Mack Publishing, Easton, PA,1980, pp. 1530-1533 для дальнейшего обсуждения дозовых форм суппозиториев. Аналогично, 004602 16 для вагинального, уретрального и ректального введения можно использовать гели или кремы. Специалистам должны быть знакомы многочисленные носители, включая без ограничений композиции для замедленного выделения,липосомальные композиции и полимерные матрицы. Примеры фармацевтически приемлемых солей присоединения кислот для использования в настоящем изобретении включают те, которые получены из минеральных кислот, таких как,например, хлористоводородная, бромистоводородная, фосфорная, метафосфорная, азотная и серная кислоты, и органических кислот, таких как винная, уксусная, лимонная, яблочная, молочная, фумаровая, бензойная, гликолевая, глюконовая, янтарная, пара-толуолсульфоновая и арилсульфоновая кислоты. Примеры фармацевтически приемлемых солей присоединения оснований для использования в способе настоящего изобретения включают те, которые получены из нетоксичных металлов, такие как натриевые,калиевые или аммонийные соли, и аминоорганические соли, такие как соли триэтиламина. Специалистам известно множество таких солей. Врач или другой профессиональный медицинский работник может подобрать соответствующую дозу и схему лечения с учетом веса субъекта, возраста и физического состояния. Дозу обычно выбирают таким образом, чтобы поддерживать уровень содержания соединений настоящего изобретения в сыворотке между около 0,01 мкг/см 3 и около 1000 мкг/см 3, предпочтительно между около 0,1 мкг/см 3 и около 100 мкг/см 3. Для парентерального введения альтернативное предпочтительное количество для введения составляет от около 0,001 мг/кг до около 10 мг/кг (в другом варианте отоколо 0,01 мг/кг до около 10 мг/кг), более предпочтительно от около 0,01 мг/кг до около 1 мг/кг (от около 0,1 мг/кг до около 1 мг/кг). Для перорального введения альтернативное предпочтительное количество составляет от около 0,001 мг/кг до около 10 мг/кг (от около 0,1 мг/кг до около 10 мг/кг), более предпочтительно от около 0,01 мг/кг до около 1 мг/кг (от около 0,1 мг/кг до около 1 мг/кг). Для введения в форме суппозиториев альтернативное предпочтительное количество составляет от около 0,1 мг/кг до около 10 мг/кг, более предпочтительно от около 0,1 мг/кг до около 1 мг/кг. Для использования при анализе активности ингибирования транспорта глицина эукариотические клетки, предпочтительно QT-6 клетки, полученные из фибробластов куропатки, трансфицируют для экспрессии одного из трех известных вариантов человеческих GlyT-1,а именно GlyT-1a, GlyT-1b или GlyT-1c, или человеческих GlyT-2. Последовательности этихGlyT-1 транспортеров описаны у Kim et al, Molec. Pharm. 45: 608-617, 1994, за исключением того, что последовательность, кодирующая экс 17 тремальный N-конец GlyT-la была просто взята из соответствующей полученной из крысы последовательности. Теперь имеется подтверждение, что эта N-концевая, кодирующая белок последовательность соответствует той, что была взята Kim et al. Последовательность человеческих GlyT-2 описана Albert et al., патентная заявка США No. 08/700,013, поданная 20 августа 1996, (включено для ссылки). Подходящие векторы экспрессии включают pRc/CMV (Invitrogen) , Zap Express Vector (Stratagene Cloning(Stratagene), LacSwitch (Stratagene), pMAM и рМАМ нео (Clontech), наряду с другими. Подходящий вектор экспрессии может способствовать экспрессии включенной GlyT ДНК в подходящих клетках хозяина, предпочтительно клетках хозяина не млекопитающего, который может быть эукариотным, грибковым или прокариотным. Такие предпочтительные клеткихозяева включают клетки амфибий, пернатых,грибков, насекомых и рептилий. Примеры Пример 1. 1-Метоксикарбонил-2-фенил-4 триметилсилил-1-бутен-4-ин (С). К раствору ацетата палладия (28 мг, 0,125 ммоль) в безводном толуоле (5 мл) добавляют трис(2,6-диметоксифенил)фосфин (55 мг, 0,125 ммоль). Через 15 мин добавляют раствор метилфенилпропиолата (1,00 г, 6,24 ммоль) в безводном толуоле (5 мл). После дополнительных 5 мин добавляют триметилсилилацетилен (0,88 мл, 0,61 г, 6,24 ммоль). Через 16 ч реакционную смесь концентрируют. В результате хроматографической обработки на колонке (10% этилацетат/гексан) получают енин С (1,39 г, 86%) в виде масла желтого цвета С: 1 Н ЯМР (CDCl3,300 МГц) 0,21 (с, 9 Н), 3,62 (с, 3 Н), 6,34 (с, 1 Н),7,33-7,44 (м, 5 Н). Пример 2. 1-Гидрокси-3-фенил-5-триметилсилил-2-пентен-4-ин. Раствор сложного эфира С (1,30 г, 5,03 ммоль) в безводном толуоле (20 мл) охлаждают в бане со смесью сухой лед/ацетон. Добавляют 1,0 М раствор диизобутилалюминийгидрида в толуоле (12,6 мл, 12,6 ммоль). Через 5 мин охлаждающую баню удаляют. Еще через 15 мин реакционную смесь снова охлаждают в бане со льдом. Реакцию гасят, добавляя целит и декагидрат сульфата натрия. Суспензию разбавляют этилацетатом и фильтруют через целит. Лепешку на фильтре промывают трижды этилацетатом. Фильтрат промывают водой и раствором соли, сушат (сульфат натрия), фильтруют и концентрируют, получая промежуточный спирт(0,821 г, 71%) в виде масла желтого цвета: 1 Н ЯМР (CDCl3, 300 МГц) 0,20 (с, 9 Н), 1,40 (т, 1 Н) ,4,31 (дд, 2 Н), 6,37 (т, 1 Н), 7,33-7,37 (м, 5 Н). Пример 3. 1-Бром-3-фенил-5-триметилсилил-2-пентен-4-ин (D). 18 Раствор полученного выше спирта (0,82 г,3,56 ммоль) в безводном дихлорметане (20 мл) охлаждают в бане со смесью сухой лед/ацетонитрил. Добавляют трифенилфосфин (1,40 г,5,34 ммоль) и N-бромсукцинимид (0,95 г, 5,34 ммоль). Через 30 мин реакцию гасят насыщенным раствором бикарбоната натрия. Реакционную смесь распределяют между насыщенным раствором бикарбоната натрия и дихлорметаном. Органическую фазу промывают раствором соли, сушат (сульфат натрия), фильтруют и концентрируют, получая сырой аллильный бромид D, который используют непосредственно на следующей стадии. Пример 4. N-(3-фенил-5-(триметилсилил)2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (Е). К раствору вышеуказанного бромида в безводном ацетонитриле (15 мл) добавляют трет-бутилсаркозин гидрохлорид (0,71 г, 3,90 ммоль), карбонат калия (4,91 г, 35,5 ммоль), и йодид калия (2,95 г, 17,8 ммоль). Через 16 ч реакционную смесь фильтруют через целит. Лепешку на фильтре промывают этилацетатом. Фильтрат выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают водой и раствором соли, сушат (сульфат натрия), фильтруют и концентрируют. В результате хроматографической обработки на колонке(0,74 г, 58% после 2 стадий) в виде бледно желтого масла. Е: 1 Н ЯМР (CDCl3, 300 МГц) 0,19 (с,9 Н), 1,41 (с, 9 Н), 2,32 (с, 3 Н), 3,10 (с, 2 Н), 3,31(д, 2 Н), 6,33 (т, 1 Н), 7,26-7,38 (м, 5 Н). Пример 5. N-(3-Фенил-2-пентен-4-ин-1-ил) саркозин, трет-бутиловый сложный эфир (F). К раствору указанного выше соединения(0,74 г, 2,06 ммоль) в метаноле (10 мл) добавляют карбонат калия (1,42 г, 10,3 ммоль). Через 20 минут реакционную смесь выливают в воду и дважды экстрагируют этилацетатом. Объединенные органические экстракты промывают раствором соли, сушат (сульфат натрия), фильтруют и концентрируют, получая конечный ацетилен F (0,58 г, 99%) в виде серовато-белого твердого вещества. F: 1 Н ЯМР (CDCl3, 300 МГц) 1,41 (с, 9 Н), 2,33 (с, 3 Н), 2,96 (с, 1 Н), 3,10 (с,2 Н), 3,33 (д, 2 Н), 6,37 (т, 1 Н), 7,26-7,39 (м, 5 Н). Пример 6-1. N-(5-(4-Фторфенил)-3-фенил 2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). К раствору конечного ацетилена F (50 мг,0,175 ммоль) в триэтиламине (2 мл) добавляют 4-фторйодбензол (26 мкл, 51 мг, 0,228 ммоль),тетракис(трифенилфосфин)палладий(0) (20 мг,0,0175 ммоль), и йодид меди(I) (10 мг, 0,0525 ммоль). Через 16 ч реакционную смесь разбавляют дихлорметаном и фильтруют. Фильтрат концентрируют. В результате хроматографической обработки на колонке (25% этилацетат/гексан) получают ацетилен G (51 мг, 77%) в виде масла желтого цвета. G: 1 Н ЯМР (CDCl3, 19 300 МГц) 1,42 (с, 9 Н), 2,35 (с, 3 Н), 3,13 (с, 2 Н),3,36 (д, 2H), 6,37 (т, 1 Н), 7,00 (дд, 2 Н), 7,26-7,44(м, 7 Н). Аналогичным способом после обработки в указанных выше условиях из промежуточного F и 1,3 эквивалента соответствующего арилиодида получают следующие соединения: 6-2:N-(5-(2-Фторфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 2 фторйодбензола, получая 45 мг (68%) масла желтого цвета. 1 Н ЯМР (CDCl3, 300 МГц) 1,42N-(5-(2,4-Дифторфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 2,4 дифторйодбензола, получая 49 мг (70%) масла желтого цвета. 1 Н ЯМР (CDCl3, 300 МГц) 1,42(с, 9 Н), 2,36 (с, 3 Н), 3,13 (с, 2 Н), 3,38 (д, 2 Н),6,42 (т, 1 Н), 6,83 (дд, 2 Н), 7,26-7,44 (м, 6 Н). 6-4: N-(5-(3-Нитрофенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 3 нитройодбензола, получая 73 мг (102%) масла желтого цвета. 1 Н ЯМР (CDCl3, 300 МГц) 1,42(д, 1 Н), 8,13 (д, 1 Н), 8,27 (с, 1 Н). 6-5: N-(5-(4-Нитрофенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 нитройодбензола, получая 31 мг (44%) масла желтого цвета. 1 Н ЯМР (CDC13, 300 МГц) 1,42(д, 2 Н). 6-6: N-(3-Фенил-5-(2-тиометилфенил)-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 2 тиометилйодбензола, получая 19 мг (26%) масла желтого цвета. 1 Н ЯМР (CDCl3) 1,42 (с, 9 Н), 2,36N-(5-(4-Хлорфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 хлорйодбензола, получая 52 мг (75%) масла желтого цвета. 1 Н ЯМР (CDCl3, 300 МГц) 1,42 20 Получают аналогичным способом из 4 изопропилйодбензола, получая 38 мг (53%) масла желтого цвета. 1 Н ЯМР (CDCl3, 300 МГц) 1,23 (д, 6 Н), 1,42 (с, 9 Н), 2,36 (с, 3 Н), 2,89 (гепт,1 Н), 3,13 (с, 2 Н), 3,36 (д, 2 Н), 6,36 (т, 1 Н), 7,16(д, 2 Н), 7,26-7,42 (м, 7 Н). 6-9: N-(5-(3,5-бис(Трифторметил)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 3,5 бис(трифторметил)йодбензола, получая 40 мг(д, 2 Н), 6,47 (т, 1 Н), 7,26-7,44 (м, 5 Н), 7,77 (с,1 Н), 7,86 (С, 2 Н). 6-10: N-(3,5-Дифенил-2-пентен-4-ин-1-ил) саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из йодбензола, получая 46 мг (33%) масла желтого цвета. 1 Н ЯМР (CDCl3, 300 МГц) 1,42 (с, 9 Н),2,36 (с, 3 Н), 3,13 (с, 2 Н), 3,36 (д, 2 Н), 6,38 (т,1 Н), 7,26-7,46 (м, 10 Н). 6-11: N-(3-Фенил-5-(4-тиометилфенил)-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 тиометилйодбензола, получая 30,0 мг (70%) масла желтого цвета. 6-12: N-(3-Фенил-5-(4-метилфенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 метилйодбензола, получая 33,0 мг (85%) масла желтого цвета. 6-13: N-(5-(3-Тиофен)-3-фенил-2-пентен-4 ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 3 йодтиофена, получая 30,0 мг (78%) масла коричневого цвета. 6-14: N-(3-Фенил-5-(4-трет-бутилфенил)-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 трет-бутилйодбензола, получая 38,0 мг (86%) масла желтого цвета. 6-15: N-(5-(4-Метоксифенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 метоксийодбензола, получая 31,0 мг (73%) масла желтого цвета. 6-16: N-(5-(2-Изопропилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 2 изопропилйодбензола, получая 27,0 мг (64%) масла янтарного цвета. 6-17: N-(5-(4-Дифенил)-3-фенил-2-пентен 4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). 21 Получают аналогичным способом из 4 бифенилйодбензола, получая 260 мг (85%) масла желтого цвета. 6-18: N-(5-(4-Трифторметилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин,третбутиловый сложный эфир, (G). Получают аналогичным способом из 4 трифторметилйодбензола, получая 240 мг (80%) масла желтого цвета. 6-19:N-(5-(4-Бензилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 бензилйодбензола, получая 240 мг (80%) светложелтого масла. 6-20: N-(5-(4-Этилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 этилйодбензола, получая 240 мг (88%) продукта 6-20: 1H ЯМР (CDCl3, 300 МГц) 1,22 (т, 3 Н),1,43 (с, 9 Н), 2,36 (с, 3 Н), 2,63 (кв, 2 Н), 3,13 (с,2 Н), 3,36 (д, 2 Н), 6,37 (т, 1 Н), 7,13 (д, 2 Н), 7,267,43 (м, 7 Н). 6-21: N-(5-(4-н-Пропилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4-нпропилйодбензола, получая 240 мг (85%) продукта 6-21: 1 Н ЯМР (CDCl3, 300 МГц) 0,93 (т,3 Н), 1,43 (с, 9 Н), 1,57 (секст, 2 Н), 2,36 (с, 3 Н) ,2,57 (т, 2 Н), 3,14 (с, 2 Н), 3,37 (д, 2 Н) , 6,37 (т,1 Н) , 7,12 (д, 2 Н) , 7,24-7,43 (м,7 Н). 6-22:N-(5-(4-н-Бутилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4-нбутилйодбензола, получая 260 мг (89%) масла желтого цвета. 6-23: N-(5-(4-н-Пентилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4-нпентилйодбензола, получая 240 мг (79%) масла желтого цвета. 6-24: N-(5-(4-Феноксифенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 феноксийодбензола, получая 34,7 мг (56%) пленки желтого цвета. 6-25: N-(5-(1-Нафтил)-3-фенил-2-пентен-4 ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 1 йоднафталина, получая 35,8 мг (63,5%) продукта 6-25: 1 Н ЯМР (CDCl3, 300 МГц) 1,43 (с, 9 Н),2,40 (с, 3 Н), 3,17 (с, 2 Н), 3,42 (д, 2 Н), 6,53 (т,1 Н), 7,33-7,57 (м, 8 Н), 7,67 (д, 1 Н), 7,75-7,85 (м,2 Н), 8,30 (д, 1 Н). 22 6-26: N-(5-(4-Метилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 метилйодбензола, получая 34,7 мг (88%) масла светло-желтого цвета. 6-27: N-(5-(3-Изопропилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 3 изопропилйодбензола, получая 17,6 мг (42%) продукта 6-27: 1 Н ЯМР (CDCl3, 300 МГц) 1,23(м, 8 Н), 7,70-7,71 (м, 1 Н). 6-28: N-(5-(2-Нафтил)-3-фенил-2-пентен-4 ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 2 йоднафталина, получая 30,0 мг (69%) бесцветного масла. 6-29: N-(5-(3,4-Диметилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 3,4 диметилйодбензола, получая 40,0 мг (98%) пленки желтого цвета. 6-30: N-(5-(2-Изопропилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 2 изопропилйодбензола, получая 27,0 мг (64%) масла янтарного цвета. 6-31: N-(5-(3,4-Метилендиоксифенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин,третбутиловый сложный эфир, (G). Получают аналогичным способом из 3,4 метилендиоксийодбензола, получая 40,0 мг(94%) масла желтого цвета. 6-32: N-(5-(4-Пирролилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 4 пирролилйодбензола, получая 41,0 мг (92%) масла светло-желтого цвета. 6-33:N-(5-(4-Трифторметоксифенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин,третбутиловый сложный эфир, (G). Получают аналогичным способом из 4 трифторметоксийодбензола, получая 28,5 мг(61%) продукта 6-33: 1 Н ЯМР (CDCl3, 300 МГц) 1,42 (с, 9 Н), 2,35 (с, 3 Н), 3,13 (с, 2 Н), 3,36 (д,2 Н), 6,39 (т, 1 Н), 7,15 (д, 2 Н), 7,26-7,39 (д, 2 Н),7,46 (д, 2 Н) 6-34: N-(5-(3,4-Диметоксифенил)-3-фенил 2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 3,4 диметоксийодбензола, получая 35,0 мг (80%) бесцветного масла. Аналогичным способом из промежуточного соединения F и 1,3 эквивалента соответст 23 вующего арилиодида, которые обрабатывают в указанных выше условиях, получают следующие соединения: 6-35: N-(5-(2-Хинолин)-3-фенил-2-пентен 4-ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из 2 йодхинолина. 6-36: N-(5-(Инданил)-3-фенил-2-пентен-4 ин-1-ил)саркозин, трет-бутиловый сложный эфир, (G). Получают аналогичным способом из йодиндана. Пример 7-1. N-(5-(4-Фторфенил)-3-фенил 2-пентен-4-ин-1-ил)саркозин, (Н). Раствор трет-бутилового сложного эфира 6-1 (51 мг, 0,135 ммоль) в 96% муравьиной кислоте нагревают при 40 С в течение 16 ч. Реакционную смесь охлаждают и концентрируют. Остаток помещают в дихлорметан и пропускают через 2 г твердофазной экстракционной трубки, элюируя дихлорметаном, затем этилацетатом и затем метанолом. Метанольную фракцию концентрируют, получая аминокислоту 7-1 (39 мг, 90%) в виде бесцветной пены : 1 Н ЯМР (CDCl3, 300 МГц) 2,72 (с, 3 Н), 3,49 (с, 2 Н),3,92 (д, 2 Н), 6,38 (т, 1 Н), 6,98 (дд, 2 Н), 7,26-7,42(м, 7 Н). Масс-спектр высокого разрешения: рассчитано 324,1400, найдено 324,1386. Аналогичным способом из соответствующих промежуточных соединений, которые обрабатывают в указанных выше условиях, получают следующие соединения: 7-2:N-(5-(2-Фторфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-2, получая 31 мг (81%) бесцветной пены. 1 Н ЯМР (CDCl3, 300 МГц) 2,68 (с,ЗН), 3,47 (с, 2 Н), 3,90 (с, 2 Н), 6,43 (с, 1 Н), 7,05N-(5-(2,4-Дифторфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-3, получая 34 мг (82%) бесцветной пены. 1 Н ЯМР (CDCl3, 300 МГц) 2,70 (с,3 Н), 3,48 (с, 2 Н), 3,91 (с, 2 Н), 6,42 (с, 1 Н), 6,78(дд, 2 Н), 7,26-7,38 (м, 6 Н). Масс-спектр высокого разрешения: рассчитано 342,1306, найдено 342,1333. 7-4: N-(5-(3-Нитрофенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 6-4, получая 42 мг (68%) бесцветной пены. 1 Н ЯМР (CDCl3, 300 МГц) 2,72 (с,3 Н), 3,50 (с, 2 Н), 3,94 (д, 2 Н), 6,50 (т, 1 Н), 7,267,48 (т, 6 Н), 7,70 (д, 1 Н), 8,12 (д, 1 Н), 8,22 (с,1 Н). Масс-спектр высокого разрешения: рассчитано 351,1345, найдено 351,1353. 24 7-5: N-(5-(4-Нитрофенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 6-5, получая 21 мг (80%) бесцветной пены. 1 Н ЯМР (CDC13, 300 МГц) 2,66 (с,3 Н), 3,43 (с, 2 Н), 3,85 (д, 2 Н), 6,51 (с, 1 Н), 7,267,53 (м, 5 Н), 7,54 (д, 2 Н), 8,14 (д, 2 Н). 7-6: N-(3-Фенил-5-(2-тиометилфенил)-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-6, получая 14 мг (87%) бесцветной пены. 1 Н ЯМР (CDCl3, 300 МГц) 2,42 (с,3 Н), 2,66 (с, 3 Н), 3,48 (с, 2 Н), 3,88 (с, 2 Н), 6,40N-(5-(4-Хлорфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-7, получая 40 мг (90%) бесцветной пены. 1 Н ЯМР (CDCl3 300 МГц) 2,68 (с, 3 Н),3,48 (с, 2 Н), 3,87 (с, 2 Н), 6,39 (с, 1 Н), 7,24-7,37(м, 9 Н). Масс-спектр высокого разрешения: рассчитано 340,1104, найдено 340,1097. 7-8: N-(5-(4-Изопропилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-8, получая 32 мг (99%) бесцветной пены. 1 Н ЯМР (CDCl3, 300 МГц) 1,21 (д,6 Н), 2,65 (с, 3 Н), 2,86 (гепт, 1 Н), 3,43 (с, 2 Н),3,86 (д, 2 Н), 6,36 (т, 1 Н), 7,14 (д, 2 Н), 7,26-7,36(м, 7 Н). Масс-спектр высокого разрешения: рассчитано 348,1964, найдено 348,1998. 7-9: N-(5-(3,5-бис(Трифторметил)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-9 получая 26 мг (76%) бесцветной пены. 1 Н ЯМР (CDCl3, 300 МГц) 2,67 (с,3 Н), 3,46 (с, 2 Н), 3,87 (д, 2 Н), 6,52 (т, 1 Н), 7,267,40 (м, 5 Н), 7,77 (с, 1 Н), 7,83 (с, 2 Н). Масс-спектр высокого разрешения: рассчитано 442,1242, найдено 442,1173. 7-10: N-(3,5-Дифенил-2-пентен-4-ин-1-ил) саркозин, (Н). Получают аналогичным способом из промежуточного 6-10, получая 18 мг (46%) бесцветной пены. 1 Н ЯМР (CDCl3, 300 МГц) 2,69(с, 3 Н), 3,48 (с, 2 Н), 3,89 (д, 2 Н), 6,40 (т, 1 Н),7,26-7,44 (м, 10 Н). Масс-спектр высокого разрешения: рассчитано 306,1494, найдено 306,1432. 7-11: N-(5-(4-Дифенил)-3-фенил-2-пентен 4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-17, получая 220,0 мг (97%) твердого вещества желтого цвета. 7-12: N-(5-(4-Трифторметилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-18, получая 200,0 мг (96%) пленки желтого цвета.N-(5-(4-Бензилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-19, получая 190,0 мг (87%) твердого вещества светло-желтого цвета. 7-14: N-(5-(4-Этилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-20, получая 176,1 мг (86%) зелено-серого твердого вещества. 7-15: N-(5-(4-н-Пропилфенил)-3-фенил-2 пентен-4-ин-1-ил)-саркозин, (Н). Получают аналогичным способом из промежуточного 6-21, получая 190,9 мг (93%) оранжево-белого твердого вещества. 7-16:N-(5-(4-н-Бутилфенил)-3-фенил-2 пентен-4-ин-1-ил) саркозин, (Н). Получают аналогичным способом из промежуточного 6-22, получая 206,0 мг (91%) твердого вещества желтого цвета. 7-17: N-(5-(4-н-Пентилфенил)-3-фенил-2 пентен-4-ин-1-ил)-саркозин, (Н). Получают аналогичным способом из промежуточного 6-23, получая 204,4 мг (98%) твердого вещества желтого цвета. 7-18: N-(5-(4-Феноксифенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-24, получая 33,0 мг (100%) твердого вещества светло-желтого цвета. 7-19: N-(5-(1-Нафтил)-3-фенил-2-пентен-4 ин-1-ил)саркозин, (Н) . Получают аналогичным способом из промежуточного 6-25, получая 25,4 мг (82%) масла желтого цвета. 7-20:N-(5-(4-Метилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-26, получая 12,6 мг (55%) твердого вещества желтого цвета. 7-21: N-(5-(3-Изопропилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-27, получая 12,6 мг (83%) масла зелено-коричневого цвета. 7-22: N-(5-(2-Нафтил)-3-фенил-2-пентен-4 ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-28, получая 25,1 мг (97%) твердого вещества желтого цвета. 7-23 : N-(5-(3,4-Диметилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-29, получая 33,2 мг (97%) твердого вещества светло-желтого цвета. 7-24: N-(5-(2-Изопропилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-30, получая 15,2 мг (66%) твердого вещества желтого цвета в виде хлопьев. 7-25: N-(5-(3,4-Метилендиоксифенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин, (Н). 26 Получают аналогичным способом из промежуточного 6-31, получая 9,5 мг (31%) твердого вещества серовато-белого цвета. 7-26: N-(5-(4-Пирролилфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-32, получая 24,1 мг (68%) твердого вещества желтого цвета. 7-27:N-(5-(4-Трифторметоксифенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-33, получая 23,0 мг (92%) твердого вещества желтого цвета. 7-28: N-(5-(3,4-Диметоксифенил)-3-фенил 2-пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-34, получая 25,7 мг (86%) твердого вещества желтого цвета. Аналогичным способом из соответствующих промежуточных соединений, обработанных в указанных выше условиях, получают следующие соединения: 7-29: N-(5-(2-хинолин)-3-фенил-2-пентен 4-ин-1-ил)саркозин. Получают аналогичным способом из 6-35. 7-30: N-(5-(инданил)-3-фенил-2-пентен-4 ин-1-ил)саркозин. Получают аналогичным способом из 6-36. Пример 8-1. N-(3-Фенил-5-(4-тиометилфенил)-2-пентен-4-ин-1-ил)саркозин, (Н). Раствор трет-бутилового сложного эфира 6-11 G (vi) (30,0 мг, 0,0736 ммоль) в 96% муравьиной кислоте нагревают при 50 С в течение 3 ч. Реакционную смесь охлаждают и концентрируют. Остаток помещают в дихлорметан и пропускают через 2 г твердофазной экстракционной трубки, элюируя дихлорметаном, затем этилацетатом, затем метанолом. Метанольную фракцию концентрируют, получая аминокислоту 8-1 (14,9 мг, 58%) в виде твердого вещества светло-желтого цвета. Аналогичным способом из соответствующих промежуточных соединений, обработанных в указанных выше условиях, получают следующие соединения: 8-2: N-(5-(4-Метилфенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-12, получая 30,0 мг (91%) твердого вещества светло-желтого цвета. 8-3: N-(3-фенил-5-(3-тиофен)-2-пентен-4 ин-1-ил) саркозин, (Н). Получают аналогичным способом из промежуточного 6-13, получая 22,0 мг (87%) твердого вещества коричневого цвета в виде пены. 8-4: N-(3-фенил-5-(4-трет-бутилфенил)-2 пентен-4-ин-1-ил)саркозин, (Н). Получают аналогичным способом из промежуточного 6-14, получая 22,9 мг (66%) твердого вещества желтого цвета. 27 Пример 9. N-(5-(4-Бромфенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин трет-бутиловый сложный эфир, (S). К раствору конечного ацетилена F (3,25 г,11,4 ммоль) в Et3N (75 мл) добавляют 4 бромйодбензол (4,19 г, 14,8 ммоль), Pd(PPh3)4(1,32 г, 1,14 ммоль), и CuI (0,65 г, 3,42 ммоль). Полученную смесь перемешивают в течение ночи и концентрируют. В результате хроматографической обработки на колонке (10%EtOAc/гексан) получают бромид S (3,84 г, 76%) в виде масла желтого цвета. Пример 10-1. N-(5-(4-(3-фурил)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин третбутиловый сложный эфир, (G'). К раствору бромида S (3,84 г, 8,72 ммоль) в DME (25 мл) добавляют 3-фуранбороновую кислоту (1,47 г, 13,1 ммоль), Pd(PPh3)4 (1,01 г,0,872 ммоль), и 2 М Na2CO3 (25 мл). Полученную смесь кипятят с обратным холодильником в течение 1 ч, охлаждают и разделяют междуEtOAc и водой. Органическую фазу промывают раствором соли, сушат (MgSO4), фильтруют и концентрируют. В результате хроматографической обработки на колонке (10-12,5% EtOAc/ гексан) получают сложный эфир G' (2,62 г, 78%) в виде масла желтого цвета. Аналогичным способом из соответствующей бороновой кислоты в указанных выше условиях получают следующие соединения: 10-2: N-(5-(4-(3-Тиофен)фенил)-3-фенил-2 пентен-4-ин-1-ил)-саркозин трет-бутиловый сложный эфир, (G'). Получают аналогичным способом из 3 тиофенбороновой кислоты, получая 21,0 мг(46%) бесцветной пленки. Аналогичным способом в указанных выше условиях из соответствующей бороновой кислоты получают следующие соединения: 10-3: N-(5-(4-(4-Метил-3-тиофен)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин третбутиловый сложный эфир. Получают аналогичным способом из S и 4 метил-3-тиофенбороновой кислоты. 10-4: N-(5-(4-(4-Метил-3-фурил)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин третбутиловый сложный эфир. Получают аналогичным способом из S и 4 метил-3-фуранбороновой кислоты. 10-5:N-(5-(4-(циклогексил)фенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин трет-бутиловый сложный эфир. Получают аналогичным способом из S и циклогексилбороновой кислоты. 10-6: N-(5-(4-(циклопентил)фенил)-3-фенил-2-пентен-4-ин-1-ил)саркозин трет-бутиловый сложный эфир. Получают аналогичным способом из S и циклопентилбороновой кислоты. Пример 11-1. N-(5-(4-(3-Фурил)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин, (Н'). 28 Сложный эфир G' (2,62 г, 6,13 ммоль) растворяют в 96% муравьиной кислоте (26 мл). Раствор нагревают при 40 С в течение ночи,затем концентрируют. В результате хроматографической обработки на колонке (0-8%MeOH/CH2Cl2) получают твердое вещество бледно-желтого цвета. В результате тщательного растирания с МеОН получают чистый Н'(0,78 г, 34%) в виде твердого вещества белого цвета. Превращения 11-1 в соответствующую натриевую соль достигают в результате суспендирования 11-1 в метаноле и добавления 1 эквивалента 6 М гидроксида натрия. Раствор концентрируют и остаток тщательно растирают с изопропанолом, получая твердое вещество белого цвета. Аналогичным способом из соответствующих промежуточных соединений, обработанных в указанных выше условиях, получают следующие соединения: 11-2: N-(5-(4-(3-тиофен)фенил)-3-фенил-2 пентен-4-ин-1-ил)саркозин, (Н'). Получают аналогичным способом из промежуточного 10-2, получая 11,7 мг (59%) твердого вещества серовато-белого цвета. 11-3: N-(5-(4-(4-метил-3-тиофен)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин. Получают аналогичным способом из 10-3. 11-4: N-(5-(4-(4-метил-3-фурил)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин. Получают аналогичным способом из 10-4. 11-5:N-(5-(4-(циклогексил)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин. Получают аналогичным способом из 10-5. 10-6:N-(5-(4-(циклопентил)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин. Получают аналогичным способом из 10-6. Пример 12-1. Этил 4-(трифторметил)фенилпропиолат (А). К раствору 4-йодбензотрифторида (256 мг,0,941 ммоль) в триэтиламине (2,5 мл) добавляют этилпропиолат (0,124 мл, 120 мг, 1,22 ммоль),Pd(PPh3)4 (109 мг, 0,0941 ммоль) и CuI (54 мг,0,282 ммоль). Через 24 ч реакционную смесь концентрируют. В результате хроматографической обработки на колонке (10% EtOAc/гексан) получают 12-1 (149 мг, 65%) в виде бесцветного масла. Аналогичным способом из соответствующего арилиодида и 1.3 эквивалентов этилпропиолата, обработанных в указанных выше условиях, получают следующие соединения: 12-2: Этил 4-фторфенилпропиолат (А). Получают аналогичным способом из 4 фторйодбензола, получая 33 мг (4%) бесцветного твердого вещества. 12-3: Этил 2-фторфенилпропиолат (А). Получают аналогичным способом из 2 фторйодбензола, получая 3.46 г (93%) бесцветного масла. 12-4: Этил 4-хлорфенилпропиолат (А). 29 Получают аналогичным способом из 4 хлорйодбензола, получая 4,60 г (100%) бесцветного твердого вещества. 12-5: Этил 2-хлорфенилпропиолат (А). Получают аналогичным способом из 2 хлорйодбензола, получая 7,64 г (100%) жидкости желтого цвета. 12-6: Этил 3-тиенилпропиолат (А). Получают аналогичным способом из 3 тиенилйодбензола, получая 90 мг (53%) твердого вещества желтого цвета. 12-7: Этил 4-метоксифенилпропиолат (А). Получают аналогичным способом из 4 метоксийодбензола, получая 117 мг (13%) бесцветного масла. Пример 13-1. 1-Этоксикарбонил-2-(4(трифторметил)фенил)-4-триметилсилил-1 бутен-4-ин (С). К раствору Pd(OAc)2 (2,6 мг, 0,0115 ммоль) в PhMe (2 мл) добавляют трис(2,6-диметоксифенил)фосфин (5,1 мг, 0,0115 ммоль). Через 15 мин добавляют раствор 12-1 (117 мг, 0,573 ммоль) в PhMe (3 мл). Через 5 мин добавляют(триметилсилил)ацетилен (0,081 мл, 56 мг, 0,573 ммоль). Через 21 ч реакционную смесь концентрируют. В результате хроматографической обработки на колонке (10% EtOAc/гексан) получают 13-1 (144 мг, 83%) в виде масла желтого цвета. Аналогичным способом из соответствующих пропиолатных промежуточных соединений, обработанных в указанных выше условиях,получают следующие соединения: 13-2: 1-Этоксикарбонил-2-(4-фторфенил)4-триметилсилил-1-бутен-4-ин (С). Получают аналогичным способом из промежуточного 12-2, получая 29 мг (58%) масла желтого цвета. 13-3: 1-Этоксикарбонил-2-(2-фторфенил)4-триметилсилил-1-бутен-4-ин (С). Получают аналогичным способом из промежуточного 12-3, получая 4,19 г (80%) масла желтого цвета. 13-4: 1-Этоксикарбонил-2-(4-хлорфенил)4-триметилсилил-1-бутен-4-ин (С). Получают аналогичным способом из промежуточного 12-4, получая 4,04 г (60%) масла коричневого цвета. 13-5: 1-Этоксикарбонил-2-(2-хлорфенил)4-триметилсилил-1-бутен-4-ин (С). Получают аналогичным способом из промежуточного 12-5, получая 10,4 г (93%) масла коричневого цвета. 13-6: 1-Этоксикарбонил-2-(3-фторфенил)4-триметилсилил-1-бутен-4-ин (С). Получают аналогичным способом из коммерческого промежуточного этил 3 фторфенилпропиолата, получая 0,73 г (85%) масла желтого цвета. 13-7: 1-Этоксикарбонил-2-(3-тиенил)-4 триметилсилил-1-бутен-4-ин (С). 30 Получают аналогичным способом из промежуточного 12-6, получая 123 мг (90%) масла желтого цвета. 13-8: 1-Этоксикарбонил-2-(4-метоксифенил)-4-триметилсилил-1-бутен-4-ин (С). Получают аналогичным способом из промежуточного 12-7, получая 144 мг (83%) масла желтого цвета. Пример 14-1. 1-Гидрокси-3-(4-(трифторметил)фенил)-5-триметилсилил-2-пентен-4-ин. Раствор 13-1 (144 мг, 0,476 ммоль) в безводном РhМе (2 мл) охлаждают в бане со смесью сухой лед/ацетон. По каплям добавляют 1,0 М раствор DIBAL-H в PhMe (1,2 мл, 1,19 ммоль). Через 5 мин охлаждающую баню удаляют. После дополнительных 15 мин реакционную смесь охлаждают в бане со льдом, и добавляют целит и Na2SO410 Н 2 О для того, чтобы погасить реакцию. Реакционную смесь фильтруют через целит. Фильтрат концентрируют. В результате хроматографической обработки на колонке (20% EtOAc/гексан) получают 14-1 (114 мг, 92%) в виде масла желтого цвета. Аналогичным способом из соответствующих сложноэфирных промежуточных соединений, обработанных в указанных выше условиях,получают следующие соединения. 14-2: 1-Гидрокси-3-(4-фторфенил)-5-триметилсилил-2-пентен-4-ин. Получают аналогичным способом из промежуточного 13-2, получая 19 мг (80%) бесцветного масла. 14-3: 1-Гидрокси-3-(2-фторфенил)-5-триметилсилил-2-пентен-4-ин. Получают аналогичным способом из промежуточного 13-3, получая 2,65 г (74%) масла желтого цвета. 14-4: 1-Гидрокси-3-(4-хлорфенил)-5-триметилсилил-2-пентен-4-ин. Получают аналогичным способом из промежуточного 13-4, получая 2,16 г (62%) масла желтого цвета. 14-5: 1-Гидрокси-3-(2-хлорфенил)-5-триметилсилил-2-пентен-4-ин. Получают аналогичным способом из промежуточного 13-5, получая 4,86 г (54%) масла желтого цвета. 14-6: 1-Гидрокси-3-(3-фторфенил)-5-триметилсилил-2-пентен-4-ин. Получают аналогичным способом из промежуточного 13-6, получая 0,47 г (74%) масла бледно-желтого цвета. 14-7: 1-Гидрокси-3-(3-тиенил)-5-триметилсилил-2-пентен-4-ин. Получают аналогичным способом из промежуточного 13-7, получая 56 мг (77%) масла желтого цвета. 14-8: 1-Гидрокси-3-(4-метоксифенил)-5 триметилсилил-2-пентен-4-ин. Получают аналогичным способом из промежуточного 13-8, получая 114 мг (92%) масла желтого цвета. 31 Пример 15-1. N-(3-(4-(Трифторметил) фенил)-5-(триметилсилил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (Е). Раствор 14-1 (115 мг, 0,385 ммоль) в безводном СН 2 Сl2 (4 мл) охлаждают в бане со смесью сухой лед/ацетонитрил. Добавляют РРh3(152 мг, 0,578 ммоль) и NBS (103 мг, 0,578 ммоль). Через 40 мин добавляют NаНСО 3. Реакционную смесь разделяют между CH2Cl2 и насыщенным NaHCO3. Органическую фазу промывают раствором соли, сушат (Na2SO4),фильтруют и концентрируют, получая сырое промежуточное соединение D (1-бром-3-(4(трифторметил)фенил)-5-триметилсилил-2 пентен-4-ин), которое используют непосредственно на следующей стадии. К раствору сырого бромида D (139 мг,0,385 ммоль) в безводном MeCN (4 мл) добавляют трет-бутилсаркозингидрохлорид (77 мг,0,424 ммоль), К 2 СO3 (532 мг, 3,85 ммоль) и KI(320 мг, 1,92 ммоль). Через 24 ч реакционную смесь выливают в воду и экстрагируют EtOAc. Органическую фазу промывают водой и раствором соли, сушат (Na2SO4), фильтруют и концентрируют. В результате хроматографической обработки на колонке (15% EtOAc/гексан) получают 15-1 (62 мг, 38% после двух стадий) в виде бесцветного масла. Аналогичным способом из соответствующего сырого бромида, обработанного в указанных выше условиях, получают следующие соединения: 15-2: N-(3-(4-фторфенил)-5-(триметилсилил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (E). Получают аналогичным способом из промежуточного 14-2, получая 18 мг (63% после двух стадий) бесцветного масла. 15-3: N-(3-(2-фторфенил)-5-(триметилсилил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (Е). Получают аналогичным способом из промежуточного 14-3, получая 3,24 г (81% после двух стадий) масла желтого цвета. 15-4: N-(3-(4-хлорфенил)-5-(триметилсилил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (Е). Получают аналогичным способом из промежуточного 14-4, получая 1,55 г (49%) масла желтого цвета. 15-5: N-(3-(2-хлорфенил)-5-(триметилсилил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (Е). Получают аналогичным способом из промежуточного 14-5, получая 5,39 г (75%) масла бледно-желтого цвета. 15-6: N-(3-(3-фторфенил)-5-(триметилсилил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (Е). Получают аналогичным способом из промежуточного 14-6, получая 0,63 г (89%) масла желтого цвета. 32 15-7: N-(3-(3-тиенил)-5-(триметилсилил)-2 пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир (Е). Получают аналогичным способом из промежуточного 14-7, получая 61 мг (71%) масла желтого цвета. 15-8:N-(3-(4-метоксифенил)-5-(триметилсилил)-2-пентен-4-ин-1-ил)саркозин, третбутиловый сложный эфир (Е). Получают аналогичным способом из промежуточного 14-8, получая 14 мг (10%) масла желтого цвета. Пример 16-1. N-(3-(4-(Трифторметил) фенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (F). К раствору 15-1 (62 мг, 0,146 ммоль) в МеОН (2 мл) добавляют К 2 СО 3 (101 мг, 0,730 ммоль). Через 15 мин реакционную смесь выливают в воду, и экстрагируют EtOAc. Органическую фазу промывают раствором соли, сушат(MgSO4), фильтруют и концентрируют, получая 16-1 (36 мг, 71%) в виде масла желтого цвета. Аналогичным способом из соответствующих триметилсилильных промежуточных соединений, обработанных в указанных выше условиях, получают следующие соединения: 16-2: N-(3-(4-Фторфенил)-2-пентен-4-ин-1 ил) саркозин, трет-бутиловый сложный эфир(F). Получают аналогичным способом из промежуточного 15-2, получая 13 мг (93%) масла желтого цвета. 16-3: N-(3-(2-Фторфенил)-2-пентен-4-ин-1 ил) саркозин, трет-бутиловый сложный эфир(F). Получают аналогичным способом из промежуточного 15-3, получая 2,22 г (85%) бесцветного масла. 16-4: N-(3-(4-Хлорфенил)-2-пентен-4-ин-1 ил) саркозин, трет-бутиловый сложный эфир(F). Получают аналогичным способом из промежуточного 15-4, получая 0,80 г (76%) масла желтого цвета. 16-5: N-(3-(2-Хлорфенил)-2-пентен-4-ин-1 ил)саркозин, трет-бутиловый сложный эфир (F). Получают аналогичным способом из промежуточного 15-5, получая 3,72 г (85%) масла желтого цвета. 16-6: N-(3-(3-Фторфенил)-2-пентен-4-ин-1 ил)саркозин, трет-бутиловый сложный эфир (F). Получают аналогичным способом из промежуточного 15-6, получая 0,42 г (83%) твердого вещества бледно-желтого цвета. 16-7: N-(3-(3-Тиенил)-2-пентен-4-ин-1-ил) саркозин, трет-бутиловый сложный эфир (F). Получают аналогичным способом из промежуточного 15-7, получая 4 6 мг (96%) твердого вещества желтого цвета. 16-8: N-(3-(4-Метоксифенил)-2-пентен-4 ин-1-ил)саркозин, трет-бутиловый сложный эфир (F). 33 Получают аналогичным способом из промежуточного 15-8, получая 15 мг (136%) масла желтого цвета. Пример 17-1. N-(5-(4-Изопропилфенил)-3(4-(трифторметил)фенил)-2-пентен-4-ин-1-ил) саркозин, трет-бутиловый сложный эфир (G). К раствору 16-1 (35 мг, 0,099 ммоль) в триэтиламине (2 мл) добавляют 4-йодизопропилбензол (32 мг, 0,129 ммоль), Pd(PPh3)4 (11 мг,0,0099 ммоль) и CuI (5,5 мг, 0,029 ммоль). Через 18 ч реакционную смесь концентрируют. В результате хроматографической обработки на колонке (10% EtOAc/гексан) получают 17-1 (40 мг, 86%) в виде бесцветного масла. Аналогичным способом из 1,3 эквивалентов соответствующего арилиодида с соответствующим алкиновым промежуточным соединением, в указанных выше условиях, получают следующие соединения: 17-2: N-(5-(4-Изопропилфенил)-3-(4-фторфенил)-2-пентен-4-ин-1-ил)саркозин,третбутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-2 и 4-изопропилйодбензола,получая 14 мг (76%) бесцветного масла. 17-3: N-(5-(4-Изопропилфенил)-3-(2-фторфенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-3 и 4-изопропилйодбензола,получая 440 мг (79%) масла желтого цвета. 17-4: N-(5-(4-трет-Бутилфенил)-3-(2-фторфенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-3 и 4-трет-бутилйодбензола,получая 500 мг (87%) масла желтого цвета. 17-5: N-(5-(4-Изопропилфенил)-3-(4-хлорфенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-4 и 4-изопропилйодбензола,получая 0,50 г (88%) масла бледно-желтого цвета. 17-6: N-(5-(4-трет-Бутилфенил)-3-(4-хлорфенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-4 и 4-трет-бутилйодбензола,получая 514 мг (83%) масла бледно-желтого цвета. 17-7: N-(5-(4-Изопропилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-5 и 4-изопропилйодбензола,получая 0,53 г (97%) масла желтого цвета. 17-8: N-(5-(4-трет-Бутилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (G). 34 Получают аналогичным способом из промежуточного 16-5 и 4-трет-бутилйодбензола 0,52 г (92%) масла желтого цвета. 17-9: N-(5-(4-Изопропилфенил)-3-(3-фторфенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-6 и 4-изопропилйодбензола 0,16 г (103%) масла желтого цвета. 17-10: N-(5-(4-Изопропилфенил)-3-(3-тиенил)-2-пентен-4-ин-1-ил) саркозин, трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-7 и 4-изопропилйодбензола 54 мг (86%) масла желтого цвета. 17-11:N-(5-(4-Изопропилфенил)-3-(4 метоксифенил)-2-пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-8 и 4-изопропилйодбензола 21 мг (129%) бесцветного масла. 17-12: N-(5-(3,4-Метилендиоксифенил)-3(3-фторфенил)-2-пентен-4-ин-1-ил)саркозин,трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-6 и 3,4-метилендиоксийодбензола 74,1 мг (106%) масла коричневого цвета. 17-13:N-(5-(4-Этилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-5 и 4-этилйодбензола 44,0 мг(110%) масла светло-желтого цвета. 17-4: N-(5-(4-Пропилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозин, трет-бутиловый сложный эфир (G). Получают аналогичным способом из промежуточного 16-5 и 4-пропилйодбензола 39,5 мг(96%) масла светло-желтого цвета. Пример 18-1. N-(5-(4-Изопропилфенил)-3(4-(трифторметил)фенил)-2-пентен-4-ин-1-ил) саркозин (Н). Раствор 17-1 (40 мг, 0,0849 ммоль) в муравьиной кислоте (2 мл) нагревают при 40 С в течение 18 ч. Реакционную смесь концентрируют. В результате хроматографической обработки на колонке (0-100% МеОН/СН 2 Сl2) получают 18-1 (36 мг, 99%) в виде масла желтого цвета. Аналогичным способом из соответствующего трет-бутилового сложноэфирного промежуточного соединения, обработанного в указанных выше условиях, получают следующие соединения: 18-2: N-(5-(4-Изопропилфенил)-3-(4-фторфенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-2, получая 13 мг (107%) бесцветного масла. 18-3: N-(5-(4-Изопропилфенил)-3-(2-фторфенил)-2-пентен-4-ин-1-ил)саркозин (Н). 35 Получают аналогичным способом из промежуточного 17-3, получая 379 мг (99%) масла бледно-желтого цвета. 18-4: N-(5-(4-трет-Бутилфенил)-3-(2-фторфенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-4, получая 434 мг (100%) масла желтого цвета. 18-5: N-(5-(4-Изопропилфенил)-3-(4-хлорфенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-5, получая 436 мг (96%) твердого вещества бежевого цвета. 18-6: N-(5-(4-трет-Бутилфенил)-3-(4-хлорфенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-6, получая 408 мг (88%) твердого вещества бежевого цвета. 18-7: N-(5-(4-Изопропилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-7, получая 438 мг (95%) серобелой пены. 18-8: N-(5-(4-трет-Бутилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-8, получая 448 мг (97%) бесцветной пены. 18-9: N-(5-(4-Изопропилфенил)-3-(3-фторфенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-9, получая 0,12 г (93%) бесцветного масла. 18-10: N-(5-(4-Изопропилфенил)-3-(3-тиенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-10, получая 34 мг (72%) твердого вещества желтого цвета. 18-11: N-(5-(4-Изопропилфенил)-3-(4-метоксифенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-11, получая 14 мг (76%) бесцветного масла. 18-12: N-(5-(3,4-Метилендиоксифенил)-3(3-фторфенил)-2-пентен-4-ин-1-ил)саркозин (H). Получают аналогичным способом из промежуточного 17-12, получая 64,1 мг (88%) масла оранжево-коричневого цвета. 18-13:N-(5-(4-Этилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-13, получая 30,1 мг (79%) бесцветного масла. 18-14: N-(5-(4-пропилфенил)-3-(2-хлорфенил)-2-пентен-4-ин-1-ил)саркозин (Н). Получают аналогичным способом из промежуточного 17-14, получая 13,9 мг (40%) масла светло-желтого цвета. Пример 20. Анализ транспорта за счет 36 Этот пример иллюстрирует способ измерения поглощения глицина трансфицированными культивируемыми клетками. Клетки, стабильно трансфицированныеGlyT-1C (see Kim, et al, Molecular Pharmacology,45, 1994:608-617) дважды промывают буферированным HEPES солевым (физиологическим) раствором (HBS). Затем клетки инкубируют в течение 10 мин при 37 С, после чего добавляют раствор, содержащий 50 нМ [3 Н] глицина (17,5 Кюри/ммоль) либо (а) не содержащий потенциального конкурента, либо (b) содержащий 10 мМ нерадиоактивного глицина, либо (с) содержащий определенную концентрацию предполагаемого лекарства. Интервал концентраций предполагаемого лекарства используют для получения данных для расчета концентрации,приводящей к 50% эффекту (например, для определения ИК 50, что соответствует концентрации лекарства, которая ингибирует поглощение глицина на 50%). Затем клетки инкубируют еще 10 мин при 37 С, после чего клетки отсасывают,и трижды промывают охлажденным льдом HBS. Клетки собирают, к ним добавляют сцинтиллирующий агент, клетки встряхивают в течение 30 мин, и определяют их радиоактивность с помощью сцинтилляционного счетчика. Сравнивали результаты, полученные для тех же клеток, которые контактировали или не контактировали с предполагаемым агентом, в зависимости от проводимого анализа. Соединения настоящего изобретения оказались активными ингибиторами GlyT-1. Пример 21. Анализ связывания с NMDA рецепторами. Этот пример иллюстрирует тесты связывания для определения взаимодействия соединений с глициновыми сайтами на NMDA рецепторе. Непосредственное связывание [3 Н]глицина с NMDA-глициновым сайтом осуществляют по способуPharmacology, 41, 923-930 (1992); Yoneda et al.,J. Neurochem, 62, 102-112 (1994). Тест на связывание осуществляют в пробирках Эппендорфа, содержащих 150 мкг мембранного белка и 50 нМ [3 Н]глицина в объеме 0,5 мл. Неспецифическое связывание определяют с 1 мМ глицина. Лекарства растворяют в аналитическом буфере (50 mМ Tris-ацетата, рН 7,4) или ДМСО (конечная концентрация 0,1%). Мембраны инкубируют на льду в течение 30 мин и связанный радиолиганд выделяют из свободного радиолиганда фильтрованием на стекловолоконных фильтрах Whatman GF/B или с помощью центрифугирования (18000 х д, 20 мин). Фильтры или осадки быстро трижды промывают охлажденным на льду 5 мМ Trisацетатным буфером. Фильтры сушат и помещают в сцинтилляционные ампулы и используют сцинтилляционный счетчик. Осадки растворяют в растворе деоксихолат/NaOH (0,1 н.) в 37 течение ночи, нейтрализуют и радиоактивность определяют с помощью сцинтилляционного счетчика. Во втором тесте на связывание с NMDAглициновым сайтом используют [3 Н]дихлоркинуреновую кислоту (DCKA) и мембраны, полученные как указано выше. См. Yoneda et al., J.Neurochem., 60, 634-645 (1993). Анализ связывания осуществляют как указано выше для[3 Н]глицина, за исключением того, что для введения метки в сайт глицина используют[3H]DCKA. Конечная концентрация [3H]DCKA составляет 10 нМ, и анализ осуществляют в течение 10 мин на льду. В третьем тесте на связывание с NMDAглициновым сайтом используют косвенную оценку сродства лигандов с сайтом, измеряя связывание [3 Н]МК-801 (дизоцилпин). См.(1994). Препараты мембран для теста те же, что и указанные выше. Анализ связывания дает возможность раздельного определения антагонистов и агонистов. Третий тест на связывание проводят для определения антагонистов следующим образом: 100 мкг мембран помещают в лунки 96 луночного планшета, вместе с глутаматом (10 мкМ) и глицином (200 нМ) , и различными концентрациями подлежащего тестированию лиганда. Анализ начинают, добавляя 5 нМNMDA рецепторами. Конечный объем аналитического материала составляет 200 мкл. Анализ осуществляют в течение 1 ч при комнатной температуре. Связанную радиоактивность отделяют от свободной в результате фильтрования,используя ТОМТЕС сборник. На антагонистическую активность указывает снижение радиоактивности, связанной с NMDA рецептором,при повышении концентрации тестируемого лиганда. Третий тест связывания проводят для определения агонистов, осуществляя тест как указано выше, за исключением того, что концентрация глицина составляет 200 нМ. На агонистическую активность указывает увеличение радиоактивности, связанной с NMDA рецептором, при увеличении концентрации тестируемого лиганда. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I где Ar1 и Аr2 представляют независимо выбранные арильные группы, необязательно имеющие до пяти заместителей включительно, независимо выбранных из группы, состоящей из алкила,алкокси, циклоалкила, циклоалкилокси, гетеро 004602 38 циклоалкила, гетероциклоалкилокси, алканоила,тиоалкила, аралкила, аралкилокси, арилоксиалкила, арилоксиалкокси, алкила, замещенного циклоалкилом, алкила, замещенного циклоалкилокси, алкокси, замещенного циклоалкилом,алкокси, замещенного циклоалкилокси, алкила,замещенного гетероциклоалкилом, алкила, замещенного гетероциклоалкилокси, алкокси,замещенного гетероциклоалкилом, алкокси,замещенного гетероциклоалкилокси, тиоарила,аралкилтио, тиоарилалкила, аралкилтиоалкила,галогена, NO2, CF3, CN, ОН, алкилендиокси,SO2NRR', NRR', CO2R (где R и R' независимо выбирают из группы, состоящей из Н и алкила) и второй арильной группы, которая может быть замещена указанным выше образом;CO2R, CONRR', CONH(OH), COSR, SO2NRR',PO(OR)(OR') и тетразолила, где R и R' независимо выбирают из группы, состоящей из Н и алкила, где указанные выше группы алкила и циклоалкила включают от 1 до 6 и от 3 до 8 атомов углерода соответственно, а группа гетероциклоалкила представляет собой кольцо,включающее от 3 до 8 членов; и его соль, сольват или гидрат. 2. Соединение по п.1, где Ar1 представляет арильную группу, необязательно имеющую до трех заместителей включительно, независимо выбранных из галогена, NO2, CF3, CN, ОН,SO2NRR', NRR', СО 2R (где R и R' независимо выбирают из группы, состоящей из Н и алкила),и заместителя формулы R"-(X)n-, где n представляет 0 или 1;R" представляет Н, алкил и арил, необязательно имеющий до трех заместителей включительно, выбранных из алкила, галогена, NO2,CF3, CN, ОН, SO2NRR', NRR', CO2R, где R и R' независимо выбирают из группы, состоящей из Н и алкила. 3. Соединение по п.2, где Ar1 представляет фенил. 4. Соединение по п.2, где Ar1 представляет замещенный фенил. 5. Соединение по п.2, где Ar1 представляет фенил, замещенный необязательно замещенной пятичленной арильной группой. 6. Соединение по п.5, где указанная пятичленная арильная группа включает по крайней мере один гетероатом. 7. Соединение по п.6, где указанная пятичленная арильная группа в Ar1 представляет 3 фурильную группу. 8. Соединение по п.7, где Ar1 представляет 4-(3-фурил)фенил. 9. Соединение по п.7, где Ar1 представляет 4-(3-тиенил)фенил. 39 10. Соединение по п.7, где Ar1 представляет 4-(1-пирролил)фенил. 11. Соединение по п.4, где Ar1 представляет фенил, замещенный низшим алкилом. 12. Соединение по п.11, где Ar1 представляет 4-(алкил)фенил. 13. Соединение по п.12, где указанную алкильную группу выбирают из метила, этила, нпропила, изопропила и н-бутила. 14. Соединение по п.1, где Ar1 представляет алкилендиоксифенил. 15. Соединение по п.14, где Ar1 представляет метилендиоксифенил. 16. Соединение по п.15, где Ar1 представляет 3,4-метилендиоксифенил. 17. Соединение по п.1, где Ar1 представляет бензоконденсированную ароматическую группу. 18. Соединение по п.17, где Ar1 является карбоциклическим. 19. Соединение по п.18, где Ar1 представляет нафтил. 20. Соединение по п.19, где Ar1 представляет 2-нафтил. 21. Соединение по любому из пп.1-20, гдеAR2 представляет арильную группу, необязательно имеющую до трех заместителей включительно, независимо выбранных из галогена, галогеналкила, алкила, галогеналкокси и алкокси. 22. Соединение по п.21, где Аr2 представляет незамещенный арил. 23. Соединение по п.22, где Аr2 представляет фенил. 24. Соединение по п.21, где Аr2 представляет замещенный фенил. 25. Соединение по п.24, где Аr2 представляет фенил, замещенный галогеном. 26. Соединение по п.25, где Аr2 представляет фенил, замещенный хлором или фтором. 27. Соединение по любому из пп.1-26, гдеR1 представляет Н. 28. Соединение по любому из пп.1-27, гдеR2 представляет Н. 29. Соединение по п.28, где R3 представляет метил. 30. Соединение по любому из пп.1-28, где 42 33. Соединение N-(5-(4-(3-фурил)фенил)-3 фенил-2-пентен-4-ин-1-ил)саркозин. 34. Композиция, включающая соединение по любому из пп.1-33, и носитель. 35. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения по любому из пп.1-33, и фармацевтически приемлемый носитель. 36. Способ лечения пациента в болезненном состоянии, при котором показано ингибирование транспорта глицина, включающий стадию введения пациенту фармацевтической композиции по п.35. 37. Способ по п.36, где болезненным состоянием является шизофрения. 38. Способ по п.36, где болезненным состоянием является нарушение познавательной функции. 39. Способ по п.36, где болезненным состоянием является болезнь Альцгеймера.
МПК / Метки
МПК: C07C 229/00, A61K 31/21
Метки: диариленины
Код ссылки
<a href="https://eas.patents.su/22-4602-diarileniny.html" rel="bookmark" title="База патентов Евразийского Союза">Диариленины</a>
Предыдущий патент: 3-(4,5-дигидроизоксазол-5-ил)бензоилпиразолы
Следующий патент: Способ профилактики и лечения заболеваний иммунной системы и средство для его осуществления
Случайный патент: Способ получения пероральных композиций кальция





















