Способ снижения внутриглазного давления у людей
Формула / Реферат
1. Способ снижения внутриглазного давления (ВГД) у человека, нуждающегося в этом, включающий стадию нанесения эффективного количества соединения А
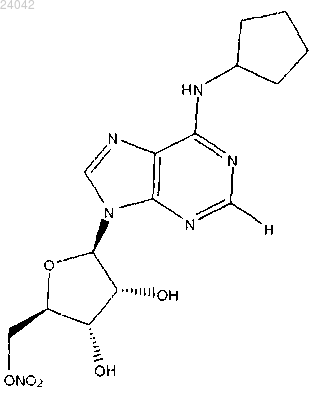
((2R,3S,4R,5R)-5-(6-(циклопентиламино)-9Н-пурин-9-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метилнитрата
на пораженный глаз человека или его фармацевтически приемлемой соли.
2. Способ по п.1, включающий стадию нанесения:
(i) от приблизительно 0,05 до приблизительно 7,0 мг/мл соединения А от 1 до 4 раз в сутки; или
(ii) приблизительно 20-700 мкг соединения А от 1 до 2 раз в сутки; или
(iii) приблизительно 350 мкг соединения А от 1 до 2 раз в сутки.
3. Способ по п.2, где соединение вводят в каплях.
4. Способ по п.3, где соединение вводят в 1-2 каплях.
5. Способ по п.1, где ВГД пораженного глаза снижают:
(i) по меньшей мере на 10%;
(ii) по меньшей мере на 10-20%;
(iii) на 20% или больше.
6. Способ по п.1, где ВГД пораженного глаза снижают:
(i) по меньшей мере на 10% более чем на 3 ч;
(ii) по меньшей мере на 10-20% более чем на 3 ч;
(iii) на 20% или больше более чем на 3 ч;
(iv) по меньшей мере на 10% по меньшей мере на 6 ч.
7. Способ по п.1, дополнительно включающий предварительное, одновременное или последующее нанесение второго средства, снижающего ВГД.
8. Способ по п.7, где второе средство, снижающее ВГД, выбирают из группы, включающей β-блокаторы, аналоги простагландина, ингибиторы карбоангидразы, ингибиторы rho-киназы, α2-агонисты, миотические средства, нейропротекторы, А3-антагонисты, А2А-агонисты, модуляторы ионного канала и их комбинации.
9. Способ по любому из пп.1-8, где ВГД пораженного глаза у человека снижают в связи с заболеванием или состоянием, выбранным из глаукомы с нормальным давлением, глазной гипертензии (ГГТ) и первичной открытоугольной глаукомы (ПОУГ).
10. Глазная фармацевтическая композиция, содержащая от приблизительно 0,05 до приблизительно 7 мг/мл соединения А по п.1 и фармацевтически приемлемый носитель или наполнитель.
11. Композиция по п.10, где указанная композиция включает от приблизительно 0,4 до приблизительно 7 мг/мл указанного соединения А.
12. Местный глазной состав для снижения внутриглазного давления, содержащий от 0,05 до приблизительно 7 мг/мл соединения А по п.1 и от 1 до приблизительно 140 мг/мл гидроксипропил β-циклодекстрина в физиологическом растворе для инъекций.
Текст
СПОСОБ СНИЖЕНИЯ ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ У ЛЮДЕЙ В изобретении приводится соединение А, композиции, включающие эффективное количество соединения А, и способы снижения внутриглазного давления, включающие введение эффективного количества соединения А субъекту, который в этом нуждается(71)(73) Заявитель и патентовладелец: ИНОТЕК ФАРМАСЬЮТИКАЛЗ КОРПОРЕЙШН (US) Родственные заявки Заявка на данный патент испрашивает приоритет по предварительной заявке на патент США 61/174655, поданной 1 мая 2009 г. Настоящее изобретение также испрашивает приоритет по предварительной заявке на патент США 61/219990, поданной 24 июня 2009 г. Содержания любых патентов,патентных заявок и ссылок, упомянутых в данном описании, настоящим включаются в настоящий документ посредством ссылки во всей своей полноте. Область техники, к которой относится изобретение В настоящем документе приведены способы снижения внутриглазного давления (ВГД) у людей. Также в данном документе приведены применения определенных соединений у субъектов-людей для снижения и/или контроля повышенного или чрезмерно колебающегося ВГД при лечении глаукомы или глазной гипертензии (ГГТ). Уровень техники Глаукома относится к группе невропатий зрительного нерва, которые характеризуются потерей ганглиоцитов сетчатки и атрофией зрительного нерва с последующей потерей поля зрения. Заболевание является основной причиной необратимой слепоты во всем мире и второй основной причиной слепоты после катаракт. Клинические испытания продемонстрировали, что повышенное ВГД является основным фактором риска для глаукомы, и подтвердили роль понижения ВГД при лечении глаукомы. Глаукому классифицируют по трем параметрам: 1) первопричина, т.е. первичная (идиопатическая) или вторичная (связанная с другими глазными или системными состояниями); 2) состояние угла передней камеры, т.е. открытоугольная (открытый доступ для исходящей внутриглазной жидкости в трабекулярную сеть) или закрытоугольная (малый угол; трабекулярная сеть заблокирована путем наложения переферической части радужки и роговицы); и 3) хронический характер, т.е. острая или хроническая. Несмотря на то что вторичные формы глаукомы с понятными этиологиями действительно существуют(например, псевдокапсулярная эксфолиация и пигментная дисперсия), наиболее общей формой глаукомы является первичная открытоугольная глаукома (ПОУГ). ГГТ является состоянием, при котором повышается ВГД, но не наблюдалось глаукоматозных показателей (Bell, 2005). Исследования глазной гипертензии продемонстрировали, что пациенты с ГГТ подвергаются совокупному риску 10% развития глаукомы через 5 лет, и что данный риск может быть уменьшен вдвое посредством начала медицинского лечения, которое снижает ВГД. Фармакотерапии, которые, как было доказано, являются эффективными для снижения внутриглазного давления, включают как средства, которые снижают продуцирование внутриглазной жидкости, так и средства, которые повышают возможность оттока. Такие терапии в целом вводят одним из двух возможных путей: местно (непосредственное нанесение на глаз) или перорально. Однако фармацевтические подходы против глазной гипертензии проявили несколько нежелательных побочных эффектов. Например, миотические средства, такие как пилокарпин, могут вызывать неясность зрения, головные боли и другие отрицательные зрительные побочные эффекты. Систематично вводимые ингибиторы карбоангидразы могут также вызвать тошноту, расстройство пищеварения, утомляемость и метаболический ацидоз. Некоторые простагландины вызывают гиперемию, зуд в глазах и потемнение ресничек и окологлазничных тканей. Кроме того, некоторые -блокаторы все чаще стали ассоциироваться с серьезными легочными побочными эффектами, которые свойственны их воздействиям на -2-рецепторы в легочной ткани. Симпатомиметики вызывают тахикардию, аритмию и гипертензию. Такие отрицательные побочные эффекты могут привести к уменьшению соблюдения больным режима и схемы лечения или к прерыванию терапии, так что нормальное зрение продолжит ухудшаться. К тому же, есть лица, которые просто не дают хороший ответ при лечении посредством конкретных существующих терапий против глаукомы. Следовательно, существует необходимость в других терапевтических средствах, которые борются с ВГД. Сущность изобретения В настоящем документе описаны соединения, фармацевтические композиции, содержащие такие соединения, и способы применения таких соединений для лечения и предупреждения заболеваний или расстройств, связанных с повышенным внутриглазным давлением. В одном варианте осуществления заболевания и состояния, вызванные повышенным ВГД у человека, выбраны из группы, состоящей из глаукомы с нормальным давлением, ГГТ и ПОУГ. Таким образом, в первом аспекте описан способ снижения внутриглазного давления, включающий стадию нанесения эффективного количества глазной фармацевтической композиции на пораженный глаз человека, при этом композиция содержит эффективное количество соединения А 2R,3S,4R,5R)-5-(2-хлор-6-(циклопентиламино)-9 Н-пурин-9-ил)-3,4-дигидрокситетрагидрофуран-2 ил)метилнитрата или его фармацевтически приемлемой соли. В одном варианте осуществления способ включает нанесение от приблизительно 0,05 до приблизительно 7,0 мг/мл соединения А от 1 до 4 раз в сутки. В другом варианте осуществления данный способ включает нанесение от приблизительно 20-700 мкг соединения А от 1 до 2 раз в сутки. В другом варианте осуществления способ включает нанесение приблизительно 350 мкг соединения А от 1 до 2 раз в сутки. При практическом осуществлении способа соединение можно вводить в каплях, например 1-2 капли. В одном варианте осуществления ВГД пораженного глаза снижается по меньшей мере на 10%, например по меньшей мере на 10-20%, например на 20% или более. В одном варианте осуществления ВГД пораженного глаза снижается по меньшей мере на 10% более чем на 3 ч, например, по меньшей мере на 10-20% более чем на 3 ч, например на 20% или больше более чем на 3 ч. В одном варианте осуществления ВГД пораженного глаза уменьшается по меньшей мере на 10% более чем на 6 ч. В другом варианте осуществления способ дополнительно включает предварительное, одновременное или последующее нанесение второго средства, снижающего ВГД. Средство, снижающее ВГД, выбирают из группы, состоящей из -блокаторов, аналогов простагландинов, ингибиторов карбоангидразы,ингибиторов rho-киназы, 2-агонистов, миотических средств, нейропротекторов, A3-антагонистов, А 2 Аагонистов, модуляторов ионного канала и их комбинации. Во втором аспекте данное изобретение направлено на способ снижения ВГД и облегчения связанных заболеваний и состояний, вызванных повышенным ВГД у субъекта-человека посредством введения эффективного количества избирательного А 1-агониста по отношению к пораженному глазу субъекта. В одном варианте осуществления заболевания и состояния, вызванные повышенным ВГД у человека, выбирают из группы, состоящей из глаукомы с нормальным давлением, ГГТ и ПОУГ. Избирательным А 1 агонистом может быть соединение А, которая определена выше. При практическом осуществлении способа избирательный А 1-агонист можно вводить в каплях, например 1-2 капли. В одном варианте осуществления данного способа ВГД пораженного глаза снижается по меньшей мере на 10%, например по меньшей мере на 10-20%, например на 20% или больше. В одном варианте осуществления ВГД пораженного глаза снижается по меньшей мере на 10% более чем на 3 ч,например по меньшей мере на 10-20% более чем на 3 ч, например на 20% или больше более чем на 3 ч. В одном варианте осуществления ВГД пораженного глаза снижается по меньшей мере на 10% более чем на 6 ч. В одном варианте осуществления способов, описанных в данном документе, эффективное количество избирательного агониста аденозинового А 1 по меньшей мере 20 мкг, например от 60 до 350 мкг,например от 60 до 700 мкг. В одном варианте осуществления эффективное количество избирательного агониста аденозинового А 1 вводят за одну дозу. В другом варианте осуществления эффективное количество избирательного агониста аденозинового А 1 вводят в виде двухкратной в сутки дозы. В другом аспекте обеспечивают глазную фармацевтическую композицию, содержащую соединение А, которая определена выше, и фармацевтически приемлемый носитель или наполнитель. Фармацевтически приемлемый носитель или наполнитель можно выбрать из группы, состоящей из офтальмологически приемлемых консервантов, поверхностно-активных веществ, средств, повышающих вязкость, средства, способствующих проникновению, загустителей, гидрофобных оснований, носителей,буферов, хлорида натрия и воды. В одном варианте осуществления композиция дополнительно содержит второе средство, снижающее ВГД, в дополнение к соединению А, которая определена выше. Второе средство, снижающее ВГД,можно выбрать из группы, включающей -блокаторы, аналоги простагландина, ингибиторы карбоангидразы, ингибиторы rho-киназы, 2-агонисты, миотические средства, нейропротекторы, A3-антагонисты,А 2 А-агонисты, модуляторы ионного канала и их комбинации. Терапевтическая композиция может содержать от приблизительно 0,05 до приблизительно 7,0 мг/мл, например от приблизительно 0,4 до приблизительно 7,0 мг/мл указанного соединения А. В следующем аспекте избирательный агонист аденозинового А 1 соединения А можно также применять для снижения и/или контроля у людей ВГД, ассоциированного с глаукомой с нормальным давлением, ГГТ и ПОУГ. В определенных вариантах осуществления при применении для лечения глаукомы с нормальным давлением или ГГТ соединения А можно составить в фармацевтически приемлемые композиции, пригодные для местной доставки в глаз. Другой вариант осуществления данного изобретения включает глазную фармацевтическую композицию, пригодную для снижения внутриглазного давления, содержащую эффективное количество соединения А. В другом аспекте данного изобретения обеспечивают глазной состав для снижения внутриглазного давления, содержащий от приблизительно 0,05 до приблизительно 7 мг/мл соединения А, которая определена выше, и от 1 до приблизительно 140 мг/мл гидроксипропил -циклодекстрина в физиологическом растворе для инъекций. В одном варианте осуществления состав содержит приблизительно 7 мг/мл соединения А, выбранного из 2R,3S,4R,5R)-5-(2-хлор-6-(циклопентиламино)-9 Н-пурин-9-ил)-3,4-дигидрокситетрагидрофуран-2-ил)метилнитрата. Дополнительно следует отметить, что применение соединения А, которое определено выше, или глазных композиций, которые определены выше, можно использовать для производства лекарственного препарата для снижения ВГД у пораженного глаза субъекта-человека. Вышеизложенное краткое описание широко описывает признаки и технические преимущества некоторых вариантов осуществлений данного изобретения. Дополнительные технические преимущества будут описаны в следующем далее детальном описании данного изобретения. Новые признаки, которые,как полагают, являются отличительными для данного изобретения, будут более понятны из детального описания данного изобретения при рассмотрении в связи с прилагаемыми фигурами и примерами. Однако фигуры и примеры, приведенные в данном документе, предназначены для помощи в иллюстрации данного изобретения или для содействия в развитии понимания данного изобретения, и не предназначены для определения объема данного изобретения. Краткое описание чертежей Фиг. 1 показывает схему повышения дозы в пределах 7 групп лечения многофокусного, рандомизированного, двойного слепого клинического исследования. Двенадцать субъектов рандомно закрепили за каждой группой лечения: 8 субъектов получили соединение А, а 4 субъекта получили плацебо. Фиг. 2 а показывает среднее ВГД (мм рт. ст.) при исследовании глаза в каждый момент времени среди всех групп лечения. Фиг. 2b показывает медианное ВГД (мм рт. ст.) при исследовании глаза среди всех групп лечения в каждый момент времени. Фиг. 3 а показывает среднее абсолютное изменение ВГД относительно ВГД до введения препарата(мм рт. ст.) при исследовании глаза среди всех групп лечения в каждый момент времени. Фиг. 3b показывает медианное абсолютное изменение ВГД относительно ВГД до введения препарата (мм рт. ст.) при исследовании глаза среди всех групп лечения. Фиг. 4 а представляет сводную диаграмму анализа данных пациентов, ответивших на лечение, в 7 группах лечения приблизительно 2 ч после введения препарата, где наибольшая доля разницы в ВГД между обработанных лекарством и обработанных плацебо глазами является различимой. Фиг. 4b представляет сводную диаграмму анализа данных пациентов, ответивших на лечение, у 7 групп лечения посредством средней доли пациентов, ответивших на лечение, на протяжении 6-часового периода наблюдения после введения препарата. Фиг. 5 показывает среднее и медианное % снижение от изначального уровня (ИУ; до введения препарата) и категорийный анализ данных пациентов, ответивших на лечение категории 350 мкг в течение всего периода наблюдений после введения препарата. Фиг. 6 показывает статистически значимое процентное снижение среднего и медианного ВГД (относительно измерений изначального уровня ВГД до введения препарата), наблюдаемое у категории 350 мкг по отношению к ответу на плацебо. Фиг. 7 показывает среднее и медианное % снижение относительно изначального уровня (ИУ; до введения препарата) и категорийный анализ данных пациентов, ответивших на лечение категории 700 мкг в течение 10-часового периода наблюдения после введения препарата. Фиг. 8 показывает статистически значимое процентное снижение среднего и медианного ВГД (относительно измерений изначального уровня ВГД до введения препарата), наблюдаемое у категории 700 мкг относительно реакции на плацебо. Подробное описание изобретения В вариантах осуществления настоящего изобретения описаны соединения, пригодные для лечения и контроля нормального или повышенного внутриглазного давления (ВГД) и/или лечения глаукомы. Аденозин представляет собой пуриновый нуклеозид, который регулирует множественные физиологические процессы. Клеточная передача сигнала посредством аденозина происходит при помощи четырех подтипов аденозиновых рецепторов: A1, А 2 А, A2B и А 3, как сообщали Ralevic и Burnstock (PharmacolRev. 50:413-492, 1988) и Fredholm BB и др. (Pharmacol Rev. 53:527-552, 2001). В глазу агонисты аденозинового рецептора A1 понижают ВГД у мышей, кроликов и обезьян (Tian В. et al. Exp. Eye Res. 64:979-989,1997; Crosson C.E. J. Pharmacol. Exp. Ther. 273: 320-326, 1995; и Avila M.Y. et al. Br. J. Pharmacol. 134:241245, 2001). Несмотря на то что в других публикациях отмечалось, что агонисты аденозинового рецептора А 1 в глазу задают традиционный путь оттока через трабекулярную сеть (Husain S et al. J. Pharmacol ExpTher. 320: 258-265, 2007), не исключалось снижение ВГД посредством других путей. Следует отметить, что высокоустойчивому, опосредованному аденозиновым рецептором A1 падению ВГД, о котором сообщалось в доклинических испытаниях, часто предшествовало среднее, но временное повышение ВГД после закапывания лиганда рецептора А 1 (Crosson CE and Grey T. Inv OphthalVisual Sci. 37, [9] 1833-1839, 1996). Временные повышения ВГД 3-9 мм рт. ст. наблюдались в 30 минутном "окне" после введения дозы. Это явление может иметь место в результате перекрестной реактивности между подтипами аденозинового рецептора в глазу. Фармакологические исследования указывают на то, что такое временное повышение ВГД может происходить вследствие, по крайней мере частично, активации аденозиновых рецепторов А 2 В (Crosson, 1996). Следовательно, разработка высокоизбирательного А 1-агониста, который будет только снижать ВГД, может оказаться более логичной, чем разработка лекарственных средств на основе аденозинового А 2-рецептора для лечения ВГД, посколько А 2 А-агонисты могут повышать, снижать или оказывать смешанные эффекты на ВГД (Konno, 2004; Konno, J. Pharmacol Sci., 2005; Konno, Eur J. Pharmacol. 2005). Известны соединения, которые действуют как избирательные агонисты аденозинового А 1, и они продемонстрировали ряд полезностей. Патент США 7423144, выданный Jagtap et al., описывает такие соединения-избирательные агонисты аденозинового А 1 для предупреждения или лечения тахиаритмии(повышенный сердечный ритм), болевых расстройств и повреждения в результате ишемии-реперфузии. Избирательные агонисты аденозинового А 1, как было обнаружено, снижают ВГД у людей при клинических исследованиях. В частности, в данном документе описывают соединение А, которое может снижать внутриглазное давление у субъекта (например, человека), который в этом нуждается. Соединение А имеет следующую структуру: Соединение А 2R,3S,4R,5R)-5-(6-(циклопентиламино)-9 Н-пурин-9-ил)-3,4-дигидрокситетрагидрофуран-2 ил)метилнитрат или их его фармацевтически приемлемые соли. Если существуют несоответствия между названием соединения и структурой соединения, то следует руководствоваться химической структурой. В другом варианте осуществления в данном документе приводится способ снижения внутриглазного давления, включающий введение эффективного количества соединения А человеку. В еще одном,другом варианте осуществления в данном документе приводится способ снижения внутриглазного давления, включающий нанесение эффективного количества соединения А на пораженный глаз человека. В еще одном, другом варианте осуществления в данном документе приводится способ лечения глаукомы,включающий введение в пораженный глаз человека эффективного количества соединения А. В другом варианте осуществления в данном документе приводится способ лечения ГГТ, включающий введение в пораженный глаз человека эффективного количества соединения А. В еще одном, другом варианте осуществления в данном документе приводится способ лечения ПОУГ, включающий введение в пораженный глаз человека эффективного количества соединения А. В одном варианте осуществления от приблизительно 0,05 до приблизительно 7,0 мг/мл соединения А наносят на пораженный глаз человека от 1 до 4 раз в сутки. В одном варианте осуществления приблизительно 20-700 мкг соединения А наносят на пораженный глаз человека от 1 до 4 раз в сутки. В другом варианте осуществления приблизительно 350 мкг соединения А наносят на пораженный глаз человека от 1 до 4 раз в сутки. Соединение А можно вводить в каплях, например 1-2 капли. В другом варианте осуществления в данном документе приводится местный глазной состав для снижения внутриглазного давления у человека, содержащий от 0,05 мг/мл до приблизительно 7 мг/мл соединения А, и от 1 мг/мл до приблизительно 140 мг/мл гидроксипропил -циклодекстрина в физиологическом растворе для инъекций. Данный состав можно применять для лечения глаукомы, ГГТ или ПОУГ у человека. В другом варианте осуществления в данном документе приводится применение соединения А для производства лекарственного препарата для снижения внутриглазного давления у субъекта. В другом варианте осуществления в данном документе приводится применение соединения А для производства лекарственного препарата для лечения глаукомы у субъекта. В другом варианте осуществления в данном документе приводится применение соединения А для производства лекарственного препарата для лечения ГГТ у субъекта. В другом варианте осуществления в данном документе приводится применение соединения А для производства лекарственного препарата для лечения ПОУГ у субъекта. В другом варианте осуществления в данном документе приводится применение соединения А для снижения внутриглазного давления у субъекта. В другом варианте осуществления в данном документе приводится применение соединения А для лечения глаукомы у субъекта. В другом варианте осуществления в данном документе приводится применение соединения А для лечения ГГТ у субъекта. В другом варианте осуществления, в данном документе приводится применение соединения А для лечения ПОУГ у субъекта. Понятно, что соединения А могут содержать один или несколько хиральных центров. Данное изобретение рассматривает все энантиомеры, диастереомеры и их смеси А. Кроме того, некоторые варианты осуществления данного изобретения включают фармацевтически приемлемые соли соединений формулы I. Фармацевтически приемлемые соли включают, но без ограничений, растворимые или диспергируемые формы соединений формулы I, которые пригодны для лечения заболевания без неуместных нежелательных эффектов, таких как аллергические реакции или токсичность. Типичные фармацевтически приемлемые соли включают, но без ограничений, соли присоединения кислоты, такие как ацетат, цитрат, бензоат, лактат или фосфат, и соли присоединения основания, такие как литиевая, натриевая, калиевая или алюминиевая. Определения Используемое в данном документе выражение "избирательный агонист аденозинового А 1" означаетA1-агонист, который обладает высокой аффинностью к рецептору A1, при этом одновременно обладая низкой аффинностью к аденозиновым рецепторам А 2 и А 3. Соединение А, приведенное выше, обладает аффинностью к рецептору А 1, значительно более высокой, чем его соответствующие аффинности к рецепторам A2A и А 3. Данные по избирательности к A1 для соединения А подытожены в таблице, приведенной ниже. В другом варианте осуществления для целей настоящего изобретения избирательный A1-агонист рассматривают как соединение, которое обладает избирательностью связывающей способности с А 1 относительно связывающей способности с А 3 более чем приблизительно 130 (т.е. A1A3 [KiA3 (нм) /KiA1(нм)]). СРА и ССРА являются примерами известных А 1-агонистов. Однако, эти соединения обладают более низким соотношением избирательности рецептор А 1/рецептор A3 если R = Н = циклопентиладенозин (СРА) и если R = Cl = 2-хлорциклопентиладенозин (ССРА). Используемая в данном документе фраза "фармацевтически приемлемая соль" представляет собой соль кислоты или основного атома азота пуринового соединения. Иллюстративные соли включают, но без ограничений, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат,кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формат, бензоат, глютамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоатные (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоатные соли. Фармацевтически приемлемая соль также может быть камфоросульфонатной солью. Выражение"фармацевтически приемлемая соль" также относится к соли пуринового соединения, имеющего кислотную функциональную группу, такую как функциональная группа карбоновой кислоты, и основание. Пригодные основания включают, но без ограничений, гидроксиды щелочных металлов, таких как натрий, калий и литий; гидроксиды щелочно-земельного металла, такого как кальций и магний; гидроксиды других металлов, таких как алюминий и цинк; аммиак и органические амины, такие как незамещенные или гидроксизамещенные моно-, ди- или триалкиламины, дициклогексиламин; трибутиламин; пиридин; N-метил, N-этиламин; диэтиламин; триэтиламин; моно-, бис- или трис-(2-ОН-низшие алкиламины),такие как моно-, бис- или трис-(2-гидроксиэтил)амин, 2-гидрокси-трет-бутиламин или трис(гидроксиметил)метиламин, N,N-ди-низший алкил-N-(гидроксил-низший алкил)амины, такие как N,Nдиметил-N-(2-гидроксиэтил)амин или три-(2-гидроксиэтил)амин; N-метил-D-глюкамин; и аминокислоты, такие как аргинин, лизин и прочее. Выражение "фармацевтически приемлемая соль" также включает гидрат пуринового соединения. Используемое в данном документе выражение "эффективное количество" относится к количеству избирательного агониста аденозинового А 1, который эффективен для (i) лечения или предупреждения повышенного ВГД или (ii) снижения ВГД у человека. Выражение "субъект", как подразумевается, включает организмы, например, прокариоты и эукариоты, которые способны страдать или поражаться заболеванием, расстройством или состоянием, связанным с повышенным ВГД. Примеры субъектов включают млекопитающих, например людей, собак,коров, лошадей, свиней, овец, коз, котов, мышей, кроликов, крыс и трансгенные животные, не относящиеся к человеку. В некоторых вариантах осуществления субъектом является человек, например, человек, страдающий от, находящийся в группе риска подвергнуться или потенциально способный начать страдать от повышения ВГД. В другом варианте осуществления субъектом является клетка. Выражение "лечить", "которого лечат", "лечащий" или "лечение" включает уменьшение или облегчение, по меньшей мере, одного симптома, связанного с состоянием, расстройством или заболеванием,или причиной которого является состояние, расстройство или заболевание, которое лечат. В некоторых вариантах осуществления лечение включает индукцию повышенного ВГД с последующей активацией соединения данного изобретения, которое будет, в свою очередь, уменьшать или ослаблять, по меньшей мере, один симптом, связанный с повышенным ВГД или причиной которого является повышенное ВГД. Например, лечением может быть уменьшение одного из нескольких симптомов расстройства или полное избавление от расстройства. Выражение "применение" включает любой один или несколько из следующих вариантов осуществлений данного изобретения, соответственно: применение при лечении повышенного ВГД; применение для производства фармацевтических композиций для применения при лечении данных заболеваний, например, при производстве лекарственного препарата; способы применения соединений данного изобретения при лечении данных заболеваний; фармацевтические препараты с соединениями по данному изобретению для лечения данных заболеваний; и соединения по данному изобретению для применения при лечении данных заболеваний; по мере необходимости и целесообразности, если не указано иное. В частности, заболевания, которые нужно вылечить, и являющиеся, таким образом, предпочтительными для применения соединения по данному изобретению, выбирают из глаукомы, ПОУГ или ГГТ. Выражение "приблизительно" или "примерно" обычно означает в пределах 20%, более предпочтительно в пределах 10% и наиболее предпочтительно опять же в пределах 5% данного значения или диапазона. Альтернативно, особенно в биологических системах, выражение "приблизительно" означает в пределах приблизительно log (т.е. порядок величины) предпочтительно в пределах показателя два заданного значения. Используемое в данном документе выражение "капля" относится к количеству офтальмологически приемлемой жидкости, которое имеет сходство с каплей жидкости. В одном варианте осуществления капля относится к объему жидкости, эквивалентному от приблизительно 5 до приблизительно 200 мкл,например, от приблизительно 30 до приблизительно 80 мкл. В данном документе используются следующие сокращения, и они имеют указанные определения: ССРА представляет собой 2-хлор-N6-циклопентиладенозин; СРА представляет собой N6 циклопентиладенозин; NECA представляет собой аденозин-5'-(N-этил)карбоксамид; ЯМР представляет собой ядерный магнитный резонанс; R-PIA представляет собой N6-(2-фенилизопропил)аденозин, Rизомер; ГГТ представляет собой глазную гипертензию или ПОУГ представляет собой первичную открытоугольную глаукому; HP CD представляет собой гидроксипропил -циклодекстрин. Способы синтеза Соединение А можно получить с помощью процедур синтеза, описанных в патенте США 7423144,раскрытие которого включено в данный документ во всей своей полноте, а также других опубликованных способов (см. Cristalli et al., J. Med. Chem. 35:2363-2369, 1992; Cristalli et al., J. Med. Chem. 37:17201726, 1994; Cristalli et al., J. Med. Chem. 38:1462-1472, 1995; and Camaioni et al., Bioorg. Med. Chem. 5:2267-2275, 1997), или с помощью процедур синтеза, описанных ниже. Схема 1 показывает способы создания нуклеозидных промежуточных соединений, которые пригодны для создания соединения по данному изобретению. Схема 1 где R2 представляет собой водород. Защищенное соединение рибозы формулы 1 можно соединить с пуриновым соединением формулы 2 с помощью лития гексаметилдисилазида и триметилсилилтрифлата, с последующим удалением ацетонида с помощью трифторуксусной кислоты с получением нуклеозидных промежуточных соединений формулы 3 и их соответствующих других аномеров формулы 4. Подобным образом, диацетат рибозы формулы 5 можно соединить с соединением формулы 2 с помощью лития гексаметилдисилазида и триметилсилилтрифлата с получением ацетонид-защищенных нуклеозидных промежуточных соединений формулы 6 и их соответствующих других аномеров формулы 7. Схема 2 показывает способ, пригодный для создания аденозиновых промежуточных соединений формулы 8, которые пригодны для создания соединения по данному изобретению. Схема 2 где R1 представляет собой водород и R2 представляет собой циклопентил. 6-Хлораденозиновое производное формулы 3 а превращают в его 2',3'-ацетонид с помощью ацетона и 2,2-диметоксипропана в присутствии камфоросульфокислоты. Ацетонид может быть далее дериватизирован с помощью амина формулы R1-NH2 в присутствии основания с получением соединения формулы 8. Методика, пригодная для создания других соединений по данному изобретению, описана в схеме 3. Схема 3 где R1 представляет собой водород и R2 представляет собой циклопентил. Аденозиновые промежуточные соединения формулы 8 можно превратить в их 5'-нитратные аналоги с помощью азотной кислоты в присутствии уксусного ангидрида или другого нитрирующего реагента,такого как MsCl/ONO3 или нитрозония тетрафторбората. Удаление ацетонида с помощью TFA/воды дает соединение по данному изобретению. Способы доставки Соединение А можно включить в различные типы глазных композиций или составов для доставки. Соединение А можно доставлять непосредственно в глаз (например, местные глазные капли или мази; средства медленного высвобождения, такие как фармацевтические губки для доставки лекарственного средства, имплантируемые в замкнутое пространство или имплантируемые рядом со склерой или внутри глаза; окологлазные, конъюнктивальные, субтеноновые, внутрикамерные, в стекловидное тело или внутриканаликулярные инъекции) или системно (например, перорально, внутривенные, подкожные или внутримышечные инъекции; парентерально, доставкой через кожу или нос) с помощью методик, хорошо известных специалистам в данной области техники. Дополнительно предполагается, что средства по данному изобретению можно составить в средства для внутриглазной вставки или внутриглазного импланта. Соединение А предпочтительно включают в местные глазные составы с рН приблизительно 4-8 для доставки в глаз. Соединение можно комбинировать с офтальмологически приемлемыми консервантами,поверхностно-активными веществами, средствами, повышающими вязкость, средствами, способствующими проникновению, буферами, хлоридом натрия и водой с образованием водной стерильной глазной суспензии или раствора. Составы глазных растворов можно получить посредством растворения соединения в физиологически приемлемом изотоническом водном буфере. К тому же, глазной раствор может включать офтальмологически приемлемое поверхностно-активное вещество для содействия при растворении соединения. Более того, глазной раствор может содержать средство для повышения вязкости или растворимости, такое как гидроксипропил -циклодекстрин (HP CD), гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или подобное, для повышения удержания состава в конъюнктивальном мешке. Также можно применять загустители, включая, но без ограничений, геллановую и ксантановую камедь. Для получения составов в виде стерильной глазной мази активный ингредиент можно скомбинировать с консервантом в соответствующем носителе, таком как минеральное масло, жидкий ланолин или белый вазелин. Составы в виде стерильного глазного геля можно получить путем суспендирования соединения в гидрофильном основании,полученном в результате комбинирования, например, карбопола-974 или подобного, в соответствии с опубликованными составами для аналогичных глазных препаратов; можно включить консерванты и средства, регулирующие тоничность. Соединение в предпочтительных вариантах осуществления содержаться в композиции в количествах, достаточных для снижения ВГД у пациентов, страдающих от повышенного ВГД, и/или поддержания нормального уровня ВГД у пациентов с ПОУГ или ГГТ. Такие количества в данном документе называют как "количество, эффективное для контроля или снижения ВГД" или еще проще "эффективное количество". Соединения в норме будут содержаться в данных составах в количестве от 0,05 до 7,0 мг/мл, но предпочтительно в количестве от 0,4 до 7,0 мг/мл. Таким образом, для местных форм выпуска 1-2 капли данных составов будут доставляться на поверхность глаз от 1 до 4 раз в сутки, на усмотрение квалифицированного клинического врача. Соединение А можно также применять в комбинации с другими средствами для лечения глаукомы,такими как, но без ограничений, -блокаторы, аналоги простагландина, ингибиторы карбоангидразы, 2 агонисты, миотические средства и нейропротекторы А 3-агонисты, А 2 А-агонисты и их комбинации. Схема клинического исследования с применением соединения A Клиническое исследование, описанное в данном документе, является многофокусным, рандомизированным, двойным слепым, плацебо-контролируемым исследованием с повышением дозы однократного местного глазного нанесения исследуемого лекарственного средства (т.е. соединения А или плацебо) на один исследуемый глаз взрослых с ГГТ или ПОУГ. "Исследуемый глаз" определяли как глаз с более высоким средним ВГД, регистрируемым между 7:00 и 8:00 утра в день перед введением дозы (день 0). Критерии приема субъектов включали мужчин и женщин без репродуктивного потенциала, возрастом 18-75 лет (включительно), которые подписали информированное согласие, которым был поставлен диагноз ГГТ или ПОУГ и которые имели низкий риск острого приступа глазного заболевания во время регистрации. Взрослых субъектов последовательно закрепили за 1 из 7 групп лечения. Каждая группа лечения включала двенадцать субъектов: 8 субъектов, рандомизированных для получения 2,5, 7,5, 20, 60, 180, 350 или 700 мкг соединения А в исследуемый глаз, и 4, рандомизированных для получения равноценного плацебо (см. табл. 1) на день 1. Таблица 1 Скрытые внутриглазные давления определяли в двух повторностях при помощи тонометра Гольдмана после обычной анестезии для роговицы. После определения показателей билатерального ВГД начального уровня (до введения препарата) утром дня 1, закрепленное исследуемое лекарственное средство(соединение А или равноценное плацебо) закапывали как однократную 50 мкл каплю только в один исследуемый глаз. Последующие билатеральные внешние обследования глаз и определения скрытых ВГД проводили в 9:00 утра, 10:00 утра, 12:00 дня и 2:00 пополудни (каждое 5 мин), соответствующие 1, 2, 4 и 6 ч после нанесения исследуемого лекарственного средства. Кроме того, в категории 700 мкг определение ВГД проводили 6:00 пополудни (18:00), что соответствует 10 ч после нанесения исследуемого лекарственного средства. Дозировка/лекарственная форма, путь и схема приема Субъектам наносили исследуемое лекарственное средство с помощью глазной пипетки в нижний конъюнктивальный мешок изучаемого глаза. Исследуемое лекарственное средство вводили только в один глаз каждому субъекту (исследуемый глаз). Дозировки варьировали в диапазоне от 2,5 до 350 мкг на 50-микролитровую каплю, на каждую соответствующую группу лечения. Сертифицированный министерством офтальмолог (или сопоставимо обученный кандидат) вводил исследуемое лекарственное средство. Рандомизированный прием субъектов в каждую последующую группу лечения утверждался после осмотра и подтверждения данных о безопасности от укомплектованных групп лечения Комитетом по исследованию безопасности, состоящим из квалифицированных врачей (т.е. терапевт, кардиолог и офтальмолог). Пример состава Состав представляет собой 1 мг соединения А на каждые 20 мг гидроксипропил -циклодекстрина(HPCD) (т.е. 1:20 вес./вес.), разведенного 0,9% физиологическим раствором для инъекций, по Фармакопее США, в концентрациях, указанных ниже. Результаты клинического испытания Результаты клинического испытания представлены на фигурах и дополнительно описаны ниже. Схема повышения дозы в 7 группах лечения многофокусного, рандомизированного, двойного слепого, клинического исследования показана на фиг. 1. Двенадцать субъектов рандомно закрепили за каждой группой лечения: 8 субъектов получили соединение А и 4 субъекта получили плацебо. Повышение для каждой последующей группы лечения утверждалось после подтверждения Комитета по исследова-9 024042 нию безопасности данных от недавно укомплектованной категории. Среднее и медианное ВГД (мм рт. ст.) в исследуемом глазу в каждый момент времени среди всех групп лечения показано на фиг. 2 а и 2b соответственно. Изменение среднее абсолютное и медианное абсолютное ВГД относительно ВГД (мм рт. ст.) до введения препарата в исследуемом глазу во всех группах лечения в каждый момент времени показано на фиг. 3 а и 3b. Фиг. 4 а представляет сводную диаграмму анализа данных пациентов, ответивших на лечение, у 7 групп лечения в 10:00 утра. У субъектов-людей, которых лечили местными глазными дозами соединения А, примерно через 2 ч после введения препарата (примерно в 10:00 утра), становится явной наибольшая доля разницы ВГД между обработанными лекарственными средством и обработанными плацебо глазами. Клиническая оценка ВГД через 2 ч после введения препарата особенна релевантна для определения наличия эффекта у людей с глаукомой/ГГТ со статистической значимостью. Фиг. 4b представляет сводную диаграмму анализа данных пациентов, ответивших на лечение, у 7 групп лечения с помощью средней доли пациентов, ответивших на лечение, в течение 6-часового периода наблюдения после введения препарата. Для получения доли ответа усредняли процентное снижение ВГД для каждого субъекта в каждый из 3-х моментов времени после введения препарата. Среднее этой величины в процентах использовали для определения доли пациентов, ответивших на лечение. Фиг. 5 представляет среднее и медианное снижение в % от изначального уровня (ИУ; до введения препарата) и категорийный анализ данных пациентов, ответивших на лечение, категории 350 мкг в течение всего периода наблюдения после введения препарата. Фигуры, представленные на фиг. 6 и 8, демонстрируют статистически значимое снижение среднего и медианного ВГД (относительно замеров ВГД изначального уровня до введения препарата), наблюдаемое в категориях 350 и 700 мкг по отношению к ответу на плацебо. Фиг. 7 представляет среднее и медианное снижение в % от изначального уровня (ИУ; до введения препарата) и категорийный анализ данных пациентов, ответивших на лечение, категории 700 мкг в течение периода наблюдения после введения препарата. Краткое описание эффективности соединения Соединение А, как было обнаружено, индуцирует понижение ВГД относительно изначального уровня до введения препарата дня 1, которое представляло собой следующее. 1. Дозозависимое понижение ВГД. а. Наблюдалась тенденция среднего и медианного снижения ВГД и процентное изменение от изначального уровня, особенно в момент времени 2 ч после введения препарата. Наибольшие снижения среднего и медианного ВГД были обнаружены при дозе 350 мкг.b. Анализ данных пациентов, ответивших на лечение, показал дозозависимый ответ на соединение А у ряда субъектов, которые достигли категорийных средних снижений от изначального уровня ВГД 10%, 15% или 20% в ходе всего периода наблюдения (6 ч). % субъектов, достигших наибольшего понижения ВГД (анализ данных пациентов, ответивших на лечение), был в группе лечения 350 мкг. 2. Статистически значимое от плацебо. а. Статистически значимые разницы от ответа на плацебо наблюдали в группах лечения 350 мкг и 700 в момент времени 2 ч после введения дозы. 3. В группе лечения 350 мкг понижение ВГД, как было обнаружено, длилось на протяжении всего периода наблюдения (6 ч). Примеры синтеза Синтез соединения А.(50 экв.) нагревали в колбе с обратным холодильником в течение 3 ч, затем охлаждали до комнатной температуры. Полученную реакционную смесь концентрировали в вакууме, и полученный остаток разбавляли водой (400 мл) и этилацетатом (400 мл). Отделяли органический слой, а водный слой экстрагировали в этилацетате (2400 мл). Объединенные органические слои промывали водой (2200 мл), сушили над сульфатом натрия, концентрировали в вакууме и сушили под вакуумом с получением твердого вещества, которое суспендировали в МеОН (400 мл), профильтровали и сушили с получением N6 циклопентиладенозина (43,8 г). 2',3'-изопропилиден-N6-циклопентиладенозин: N6-циклопентиладенозин (43 г) разбавляли ацетоном(75 экв.), и к полученному раствору добавляли 2,2-диметоксипропан (5 экв.) с последующей Dкамфоросульфокислотой (1 экв.), и полученной реакции позволяли протекать при перемешивании при комнатной температуре в течение 3 ч. Полученную реакционную смесь концентрировали в вакууме, и полученный остаток разбавляли этилацетатом, затем нейтрализовали до рН 7,0 с помощью концентрированного водного NaHCO3. Органический слой отделяли, сушили над сульфатом натрия, концентрировали в вакууме и сушили под вакуумом с получением твердого вещества, которое суспендировали в гексане(250 мл), профильтровали, промывали гексаном и сушили под вакуумом с получением 2',3'изопропилиден-N6- циклопентиладенозина (43 г). 2',3'-изопропилиден-N6-циклопентиладенозин-5'-нитрат: уксусный ангидрид (22 экв.) медленно до- 10024042 бавляли к перемешиваемому раствору азотной кислоты (5 экв., 63%) при -10 С (для охлаждения использовали ванну ацетонитрил-CO2) на протяжении периода 4 ч с поддерживаемой температурой реакции от-5 до 5 С в ходе добавления. Полученный раствор охлаждали до -20 С, и в уксусный ангидрид (37 мл, 8 эквивалентов) медленно добавляли раствор 2',3'-изопропилиден-N6-циклопентиладенозина (18,250 г,0,048 моль). Полученной реакции позволяли протекать при перемешивании при температуре от -15 до-5 С в течение 1 ч и полученную реакционную смесь медленно выливали в ледяной раствор водногоNaHCO3 (168 г в 800 мл воды) и этилацетата (350 мл), и полученному раствору позволяли перемешиваться в течение 5 мин. Органический слой отделяли, и водный слой экстрагировали с помощью этилацетата(350 мл). Объединенные органические слои промывали водой и сушили над сульфатом натрия, концентрировали в вакууме и очищали с помощью колоночной флэш-хроматографии на силикагеле с применением 70% этилацетат-гексана в качестве элюента с получением 2',3'-изопропилиден-N6 циклопентиладенозин-5'-нитрата (14,9 г). Соединение А: 2',3'-изопропилиден-N6-циклопентиладенозин-5'-нитрат (4,8 г) разбавляли смесьюTFA (20 мл) и воды (5 мл), и полученной реакции позволяли протекать при перемешивании в течение 30 мин при комнатной температуре. Полученную реакционную смесь концентрировали в вакууме, а полученный остаток разбавляли водой (10 мл) и концентрировали в вакууме. Полученный остаток разбавляли этилацетатом и промывали насыщенным водным бикарбонатом натрия, а органический слой сушили над сульфатом натрия и концентрировали в вакууме с получением белого твердого остатка, который сушили под вакуумом и затем повторно кристаллизовали из холодного этанола с получением соединения А (3,1 г). 1H-ЯМР (DMSO-d6):1,49-1,58 (м, 4 Н), 1,66-1,72 (м, 2 Н), 1,89-1,94 (м, 2 Н), 4,12-4,17 (м, 1 Н), 4,284,33 (м, 1 Н), 4,48 (ушир.с, 1 Н), 4,65-4,87 (м, 3H), 5,5 (д, J=5,1 Гц, 1 Н), 5,63 (д, J=5,7 Гц, 1 Н), 5,91 (д, J=5,1 Гц, 1 Н), 7,75 (д, J=7,5 Гц, 1 Н), 8,17 (ушир.с, 1 Н), 8,30 (с, 1 Н). МС (ES+): m/z 381,35 (М+1). Аналитич. рассчитан. для C15H20N6O6: С, 47,37; Н, 5,30; N, 22,10; Обнаруженное: С, 47,49; Н, 5,12,N, 21,96. Пример - исследования связывания Клеточная культура и мембранный препарат. Клетки СНО, стабильно трансфицированные аденозиновым рецетором А 1 человека, выращивают и поддерживают на среде Игла, модифицированной по Дюльбекко с питательной смесью F12 (DMEM/F12) без нуклеозидов, содержащей 10% фетальной телячьей сыворотки, пенициллин (100 ед./мл), стрептомицин (100 мкг/мл), L-глутамин (2 мМ) и Geneticin (G-418, 0,2 мг/мл; A2B, 0,5 мг/мл), при 37 С в 5% СО 2/95% воздуха. Затем клетки разделяют 2 или 3 раза в неделю в соотношении от 1:5 до 1:20. Мембраны для экспериментов по связыванию меченных лигандов получают из свежих или замороженных клеток, как описано у Klotz et al., Naunyn-Schmiedeberg's Arch. Pharmacol., 357:1-9 (1998). Клеточную суспензию затем гомогенизируют в ледяном гипотоническом буфере (5 мМ Tris/HCl, 2 мМEDTA, рН 7,4), и гомогенат крутят в течение 10 мин (4 С) на 1000 g. Мембраны затем осаждают из супернатанта в течение 30 мин на 100000 g и ресуспендируют в 50 мМ Tris/HCl буфере с рН 7,4 (для аденозиновых рецепторов А 3: 50 мМ Tris/HCl, 10 мМ MgCl2, 1 мМ EDTA, рН 8,25), замораживают в жидком азоте при концентрации белка 1-3 мг/мл и хранят при -80 С. Исследования связывания с аденозиновым рецептором. Аффинности выбранных пуриновых соединений к аденозиновому рецептору A1 можно определить при помощи измерения отклонения специфического связывания [3 Н] 2-хлор-N6-циклопентиладенозина в клетках СНО, стабильно трансфицированных рекомбинантным аденозиновым рецептором A1 человека,выраженного как Ki (нМ). Константы диссоциации немеченых соединений (K1-величины) определяют в экспериментах по конкурентному связыванию в 96-лунковых микропланшетах с помощью избирательного А 1-агониста 2 хлор-N6-[3 Н]циклопентиладенозина ([3 Н]ССРА, 1 нМ) для характеристики связывания с рецептором A1. Неспецифическое связывание определяют в присутствии 100 мкМ R-PIA и 1 мМ теофиллина соответственно. Подробнее см. Klotz et al., Naunyn-Schmiedeberg's Arch. Pharmacol., 357:1-9, 1998. Данные по связыванию можно рассчитать путем подбора нелинейной кривой с помощью программы SCTFIT (De Leanet al. Mol. Pharm. 1982, 21:5-16). Функциональная характеристика. Опосредованное рецепторами A1 и А 3 ингибирование активности аденилатциклазы, стимулируемой форсколином, тестировали в мембранах, полученных из клеток СНО, стабильно трансфицированных аденозиновыми рецепторами A1 и А 3 человека. Опосредованную рецепторами А 2 а и A2b стимуляцию базовой циклазной активности протестировали в мембранах, полученных из клеток СНО, стабильно трансфицированных аденозиновыми рецепторами А 2 а и А 3 человека. Ингибирование аденилатциклазы посредством аденозиновых рецепторов A1 и А 3 человека. Были детально описаны данное изобретение и его варианты осуществления. Однако объем данного изобретения, как подразумевается, не ограничивается конкретными вариантами осуществления любого процесса, производства, композиции химически связанных веществ, соединений, средств, способов и/или стадий, описанных в данном описании изобретения. Различные модификации, замены и изменения могут быть предприняты к раскрытому материалу без отступления от сути и/или неотъемлемых признаков данного изобретения. Соответственно, специалист в данной области легко поймет из описания, что последующие модификации, замены и/или изменения, выполняющие, по сути, ту же функцию или достигающие, по сути,такого же результата, что и описанные в данном документе варианты осуществления, можно использовать в соответствии с такими связанными вариантами осуществления данного изобретения. Поэтому следующая формула изобретения, как подразумевается, охватывает в пределах ее объема модификации,замены и изменения процессов, производств, композиций химически связанных веществ, соединений,средств, способов и/или стадий, раскрытых в данном документе. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ снижения внутриглазного давления (ВГД) у человека, нуждающегося в этом, включающий стадию нанесения эффективного количества соединения А 2R,3S,4R,5R)-5-(6-(циклопентиламино)-9 Н-пурин-9-ил)-3,4-дигидрокситетрагидрофуран-2 ил)метилнитрата на пораженный глаз человека или его фармацевтически приемлемой соли. 2. Способ по п.1, включающий стадию нанесения:(iii) приблизительно 350 мкг соединения А от 1 до 2 раз в сутки. 3. Способ по п.2, где соединение вводят в каплях. 4. Способ по п.3, где соединение вводят в 1-2 каплях. 5. Способ по п.1, где ВГД пораженного глаза снижают:(i) по меньшей мере на 10%;(ii) по меньшей мере на 10-20%;(iii) на 20% или больше. 6. Способ по п.1, где ВГД пораженного глаза снижают:(i) по меньшей мере на 10% более чем на 3 ч;(ii) по меньшей мере на 10-20% более чем на 3 ч;(iii) на 20% или больше более чем на 3 ч;(iv) по меньшей мере на 10% по меньшей мере на 6 ч. 7. Способ по п.1, дополнительно включающий предварительное, одновременное или последующее нанесение второго средства, снижающего ВГД. 8. Способ по п.7, где второе средство, снижающее ВГД, выбирают из группы, включающей блокаторы, аналоги простагландина, ингибиторы карбоангидразы, ингибиторы rho-киназы, 2-агонисты,миотические средства, нейропротекторы, А 3-антагонисты, А 2 А-агонисты, модуляторы ионного канала и их комбинации. 9. Способ по любому из пп.1-8, где ВГД пораженного глаза у человека снижают в связи с заболеванием или состоянием, выбранным из глаукомы с нормальным давлением, глазной гипертензии (ГГТ) и первичной открытоугольной глаукомы (ПОУГ). 10. Глазная фармацевтическая композиция, содержащая от приблизительно 0,05 до приблизительно 7 мг/мл соединения А по п.1 и фармацевтически приемлемый носитель или наполнитель. 11. Композиция по п.10, где указанная композиция включает от приблизительно 0,4 до приблизительно 7 мг/мл указанного соединения А. 12. Местный глазной состав для снижения внутриглазного давления, содержащий от 0,05 до приблизительно 7 мг/мл соединения А по п.1 и от 1 до приблизительно 140 мг/мл гидроксипропил циклодекстрина в физиологическом растворе для инъекций. Фиг. 4 а Анализ данных пациентов, ответивших на лечение, с помощью средней доли ответивших на протяжении периода наблюдений после введения препарата Фиг. 5 Среднее и медианное % изменение ВГД от момента "до введения препарата" 350 мкг-группы и плацебо Фиг. 7 Среднее и медианное % изменение ВГД от момента "до введения препарата" 700 мкг-группы и плацебо
МПК / Метки
МПК: A61P 27/02, A61K 31/7076, C07H 19/167
Метки: внутриглазного, людей, снижения, давления, способ
Код ссылки
<a href="https://eas.patents.su/19-24042-sposob-snizheniya-vnutriglaznogo-davleniya-u-lyudejj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ снижения внутриглазного давления у людей</a>












