Захват микроорганизмов, подобных микобактериям
Формула / Реферат
1. Способ получения из образца микроорганизмов, имеющих гидрофобную поверхность, причем данными микроорганизмами являются микобактерии, который включает контактирование микроорганизмов с собирающим реагентом, который имеет как гидрофобные свойства, за счет чего собирающий реагент связывается с указанными микобактериями, посредством гидрофобного взаимодействия с ними, так и полярные свойства, и который представляет собой полидиаллилдиметиламмония хлорид (поли-DADMAC), при этом указанный собирающий реагент либо находится на поверхности и собирает на нее указанные микобактерии, либо находится в растворе, и в этом случае указанный способ дополнительно включает сбор указанных микобактерий на поверхности путем связывания указанного собирающего реагента с указанной поверхностью посредством полярного взаимодействия между указанной поверхностью и указанным собирающим реагентом.
2. Способ по п.1, отличающийся тем, что указанный собирающий реагент является катионным.
3. Способ по п.2, отличающийся тем, что указанный полидиаллилдиметиламмония хлорид (DADMAC) имеет молекулярную массу от около 200000 до 500000.
4. Способ получения из жидкого образца микроорганизмов, имеющих гидрофобную поверхность, причем данными микроорганизмами являются микобактерии, который включает контактирование микроорганизмов с растворимым собирающим реагентом, который содержит поли-DADMAC, за счет чего собирающий реагент связывается с указанными микобактериями, и сбор указанных микроорганизмов на поверхности путем связывания указанного собирающего реагента с указанной поверхностью.
5. Способ по любому из предшествующих пунктов, отличающийся тем, что образец приводят в контакт с собирающим реагентом в присутствии детергента, который усиливает селективность связывания желаемых микроорганизмов.
6. Способ по п.5, отличающийся тем, что указанный детергент содержит аминокислотный амид жирной кислоты.
7. Способ по п.5, отличающийся тем, что указанный детергент содержит N-лауроилсаркозин.
8. Способ по любому из пп.5-7, отличающийся тем, что указанный детергент содержит детергент Тритон X.
9. Способ выявления микроорганизма, включающий сбор указанного микроорганизма на поверхности способом по любому из предыдущих пунктов, промывание указанных собранных микроорганизмов и выявление указанного собранного микроорганизма на указанной поверхности или после удаления с нее.
10. Способ по п.9, отличающийся тем, что определяют жизнеспособность указанных собранных микроорганизмов.
11. Способ по п.10, отличающийся тем, что указанные собранные микроорганизмы обрабатывают лекарственным средством и определяют жизнеспособность этих микроорганизмов для установления влияния этого лекарственного средства на жизнеспособность указанного микроорганизма.
12. Набор для исследования микроорганизмов, содержащий либо (а) растворимый собирающий реагент, имеющий как гидрофобные свойства, за счет чего собирающий реагент способен связываться с выявляемыми микобактериями посредством гидрофобного взаимодействия с ним, так и полярные свойства, при этом указанный собирающий агент представляет собой поли-DADMAC, субстрат, имеющий поверхность для сбора указанных микобактерий на указанной поверхности, посредством связывания указанного собирающего реагента с указанной поверхностью путем полярного взаимодействия между указанной поверхностью и указанным собирающим реагентом, либо (b) собирающий реагент, иммобилизованный на твердой поверхности, при этом указанный собирающий реагент, имеющий как гидрофобные, так и полярные свойства, за счет чего он способен связываться с выявляемым микобактериями, представляет собой поли-DADMAC и по меньшей мере одно из следующих компонентов:
фаг, способный инфицировать указанные микобактерии;
праймеры для проведения амплификации геномной нуклеиновой кислоты указанных микобактерий или указанного фага;
питательную среду для культивирования указанных микобактерий;
краситель для визуализации указанных микобактерий для микроскопического исследования;
антитело для связывания указанных микобактерий; и
возможно также содержит
питательную среду для культивирования указанных микобактерий;
детектирующий реагент для использования при выявлении метаболита, продуцируемого при культивировании указанных микобактерий;
детектирующий агент, предназначенный для определения жизнеспособности указанных микобактерий; и/или один или несколько препаратов, которые потенциально могут повлиять на жизнеспособность указанных микобактерий.
13. Набор по п.12, отличающийся тем, что указанный собирающий реагент представляет собой поли-DADMAC, имеющий молекулярную массу от около 200000 до 500000.
14. Набор по п.12 или 13, отличающийся тем, что указанный фаг, указанные праймеры, указанное антитело или указанный детектирующий агент специфичны для идентификации комплекса М. tuberculosis, M. avium, M. intracellulare, M. paratuberculosis, М. leprae, М. kansasii, M. marinum или М. fortuitum.
15. Набор по любому из пп.12-14, отличающийся тем, что указанный набор содержит детектирующий агент, специфичный в отношении жизнеспособных микроорганизмов.
16. Набор по любому из пп.12-14, отличающийся тем, что указанный набор содержит одно или несколько лекарственных средств, потенциально способных оказывать влияние на жизнеспособность указанных микроорганизмов.
Текст
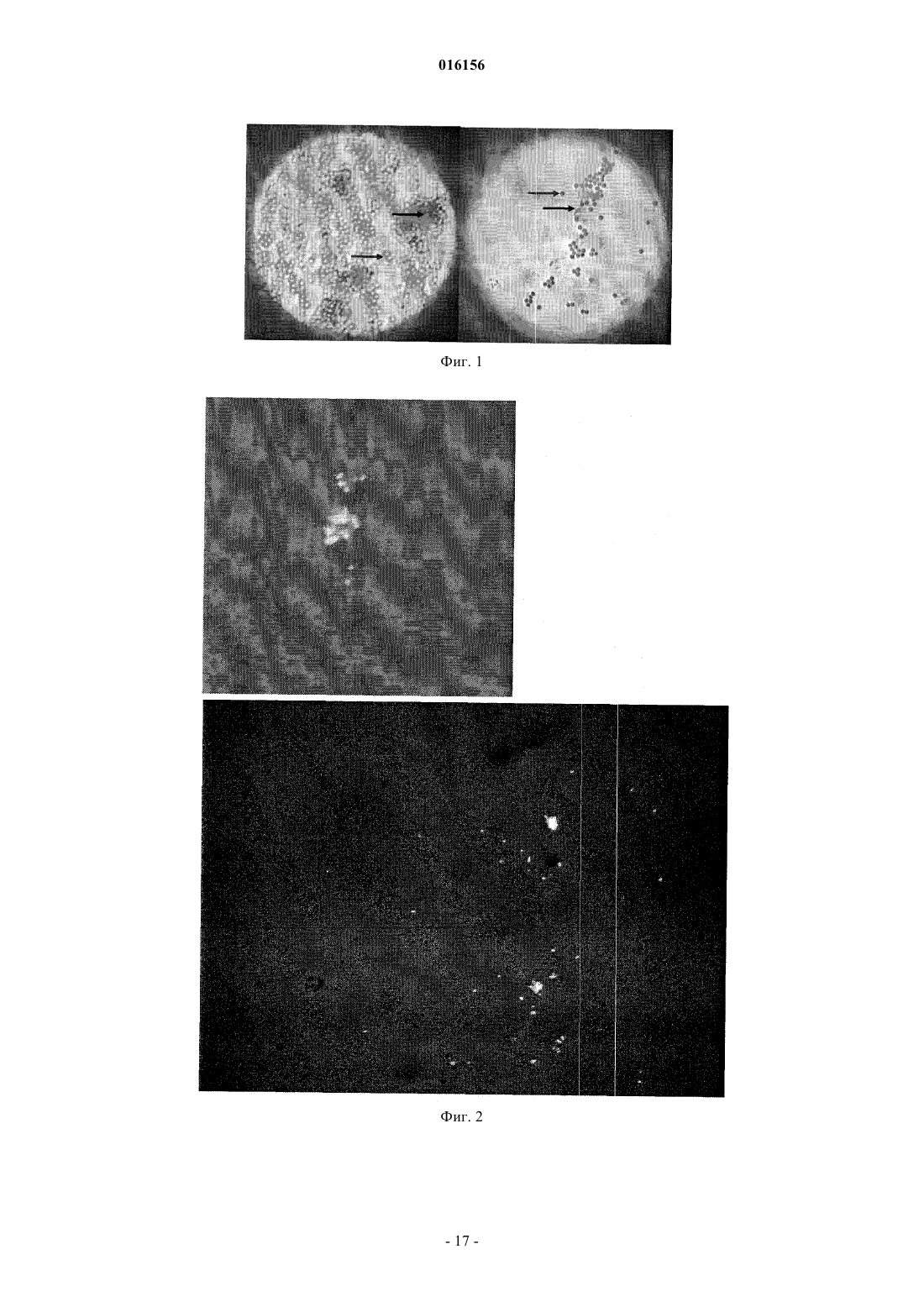
В изобретении предложен способ получения из образца микроорганизмов, имеющих гидрофобную поверхность, таких как микобактерии, в том числе М. tuberculosis, который включает контактирование указанных микроорганизмов с собирающим реагентом, таким как pDADMAC,который имеет как гидрофобные свойства для связывания с микроорганизмами посредством гидрофобного взаимодействия, так и полярные свойства, для того, чтобы собрать указанные микроорганизмы на поверхности с кислыми свойствами. Вилсон Стюарт Марк, Стенли Кристофер Джон (GB) Пыльнев Ю.А. (RU) 016156 Изобретение относится к сбору на поверхности гидрофобных микроорганизмов, таких как микобактерии, и к последующей обработке, например к анализу их наличия или к их идентификации. Патогенные микобактерии ответственны за некоторые тяжелые инфекционные заболевания у людей и животных. Микобактерии характеризуются гидрофобной восковидной оболочкой, содержащей миколовую кислоту или родственные соединения. Миколовые кислоты представляют собой сложные гидроксилированные жирные кислоты с разветвленной цепью, обычно имеющие углеродные цепи с длиной цепи в диапазоне С 77-80, которые являются причиной серьезных проблем для обработки проб, вызывая агрегацию бактерий с образованием тяжей, и удерживая их на поверхности жидкостей и вызывая устойчивость к центрифугированию. Углеводородные цепи могут содержать или не содержать редкие оксигенированные группы, такие как гидроксил, метокси, кето или карбоксил. Патогенные микобактерии включают в себя Mycobacterium tuberculosis, которая является возбудителем ТВ, микобактерии MAC комплекса (прежде всего М. avium и М. intracellulare), которые являются оппортунистическими патогенами у пациентов, больных СПИД, М. paratuberculosis, которая вызывает воспаление кишечника, М.leprae, вызывающая лепру, комплекс М. kansasii, M. marinum, M. fortuitum, и многие другие. Также существует много других непатогенных микобактерии, в том числе М. smegmatis. Также другие представители семейства Mycolata имеют аналогичные компоненты гидрофобной оболочки. У некоторых длина цепи гидрофобных жирных кислот короче, чем у микобактерии, приблизительно на 50 атомов углерода, а у других приблизительно на 30. Для диагностики микобактериальных инфекций, таких как туберкулез, наличие микроорганизмов должно быть показано с помощью микроскопии, культуральных или молекулярных способов, таких как ПЦР. Хотя микроскопия может осуществляться непосредственно из биологического образца, чаще сначала выделяют и концентрируют микобактерии из биологических образцов до анализа. Биологические образцы могут включать в себя мокроту, мочу, кровь, бронхиальный лаваж и т.д. Одним из наиболее распространенных типов образцов, получаемых для диагностики, является мокрота. Мокрота представляет особые проблемы для бактериологии. Мокрота является гетерогенной по своей природе и может быть кровянистой, гнойной и вязкой. Она также может быть контаминирована другими микроорганизмами, например, Pseudomonas. Обычно мокроту разжижают и в то же время очищают путем применения различных предварительных обработок. Такие обработки включают в себя применение 0,25-0,5 М гидроксида натрия с N-ацетилL-цистеином или без него, додецилсульфата натрия, щавелевой кислоты или трихзамещенного фосфата натрия. Время обработки может составлять 20-120 мин. Эти обработки предназначены для разжижения мокроты и уничтожения большинства контаминирующих организмов. Микобактерии имеют толстую восковидную оболочку и являются более резистентными к таким обработкам. Тем не менее, предполагается, что под действием такой обработки вплоть до 60% Mycobacterium tuberculosis погибает или оказываются нежизнеспособными. Кроме того, поскольку Mycobacterium tuberculosis и другие представители этого семейства растут так медленно, рост контаминирующих микроорганизмов, которые не погибли под действием этой обработки, все еще представляет проблему высокого процентного содержания культур,являющихся переросшими за счет быстрорастущих посторонних микроорганизмов. После обработки с использованием агрессивных очищающих средств образец центрифугируют для концентрирования микобактерий, которые затем анализируют с помощью микроскопии, культивирования или молекулярной амплификации. Эта стадия центрифугирования привносит риск инфицирования персонала лаборатории, поскольку содержание любой пробирки, которая трескается или разбивается во время центрифугирования, может попадать в воздух с мельчайшими капельками воды и заражать окружающую среду. Центрифугирование также является "узким местом" в обработке образцов, поскольку только ограниченное количество образцов может быть центрифугировано единовременно. Кроме того,центрифугирование осаждает все вещества, которые оказались денатурированными и нерастворенными под действием процедуры агрессивного очищения, и может быть получен очень большой осадок, который создает проблемы для микроскопии или молекулярных методов. Вследствие проблем, перечисленных выше, с существующими подходами очищения и концентрации было бы крайне полезным, если бы микобактерии могли быть собраны непосредственно из биологического образца. Было бы целесообразно, если бы эта процедура удаляла некоторые или все контаминирующие микроорганизмы так, чтобы химического очищения не потребовалось, или оно могло быть проведено в менее агрессивных условиях. Это также увеличило бы выживание очищенных микобактерии и повысило бы чувствительность последующих тестов. В других применениях, отличных от обработки образцов, это также могло быть полезным для связывания микобактерии с твердой поверхностью, чтобы облегчить концентрирование или обработку микроорганизмов, например, сбор и промывание микобактерии из фагового раствора для удаления экзогенных неинфицирующих фагов или сбора и переноса микобактерии из одного раствора в другой. Способы сбора микобактерии на твердых поверхностях ранее уже были предложены, включая применение связанного фага или связывающих пептидов, доставляемых фагами, иммобилизованных на бусах и действующих в качестве собирающих агентов (Stratmann et al; J Clin Microbiol. 2002 November; 40(11): 4244-4250) и включая выделение М. paratuberculosis из молока, путем использования бус, покры-1 016156 тых антителами (Grant I. R. et al; Appl Environ Microbiol. 1998 Sep; 64 (9):3153-8). Однако такой способ может быть слишком дорогостоящим для широкого применения, особенно в развивающихся странах, и может быть излишне специфичным в том, что не все желаемые бактерии будут собраны, и предусматривает использование молекул на основе белка, которые чувствительны к протеазам, денатурации и агрессивным химическим веществам. Согласно Hetland G. et al., Immunology 1994, 82, 445-449, можно нанести покрытие БЦЖ на латексные микробусины, путем инкубирования бусин с культивированными и отделенными бактериями. Однако маловероятно, что это будет эффективным для эффективного сбора таких бактерий из биологического образца, содержащего другие гидрофобные микроорганизмы или вещества. Авторы изобретения обнаружили, что полидиаллилдиметиламмония хлорид (p-DADMAC) связывает микобактерии с микробусинами карбоновой кислоты. Не связываясь следующей теорией, авторы изобретения считают, что основная цепь p-DADMAC гидрофобно взаимодействует с восковидным покрытием микобактерии и положительный заряд в остове p-DADMAC также может взаимодействовать с отрицательными зарядами на поверхности микобактерии, затем p-DADMAC ионно взаимодействует через его боковые группы четвертичного аммония с карбоновыми кислотами микробус. Авторы изобретения также обнаружили, что поверхности, покрытые p-DADMAC, такие как пластики или стекло, могут напрямую связываться с микобактериями. Таким образом, микобактерии могут быть либо собраны непосредственно на поверхностях, покрытых p-DADMAC, либо могут быть собраны на поверхности опосредовано. Настоящее изобретение, следовательно, в настоящий момент в первом аспекте относится к способу получения из образца микроорганизмов, имеющих гидрофобную поверхность, этот способ включает в себя контактирование микроорганизмов с собирающим реагентом, этот собирающий реагент имеет как гидрофобные свойства, за счет чего этот собирающий реагент связывается с указанными микроорганизмами посредством гидрофобного взаимодействия с ними, так и полярные свойства, указанный собирающий реагент либо присутствует на поверхности и собирает микроорганизмы на нее, либо присутствует в растворе, указанный способ затем дополнительно включает в себя сбор указанных микроорганизмов на поверхности путем связывания указанного поглощающего реагента на указанной поверхности посредством полярного взаимодействия между указанной поверхностью и указанным поглощающим реагентом. Предпочтительно, указанный выше способ проводят, используя собирающий агент в растворе, поэтому этот способ включает в себя контактирование микроорганизмов с собирающим реагентом в растворе, этот собирающий реагент имеет как гидрофобные свойства, за счет чего этот собирающий реагент связывается с указанными микроорганизмами посредством гидрофобного взаимодействия с ними, так и полярные свойства, например, полиионные свойства, и сбор указанных микроорганизмов на поверхности, путем связывания указанного собирающего реагента с указанной поверхностью посредством полярного взаимодействия между указанной поверхностью и указанным собирающим реагентом. Образец может представлять собой жидкий образец, такой как мокрота, моча, кровь, бронхиальный лаваж, и т.д. или может представлять собой твердый образец, такой как тканевой биоптат, например, образец кожи, который предпочтительно обрабатывают для экстракции или дисперсии микроорганизмов в жидкость для получения жидкого образца. Необязательно, указанный собирающий реагент содержит длинную углеводородную цепь, несущую многочисленные полярные, например, ионные, участки. Указанные многочисленные полярные или ионные участки могут находиться вместе в одной части, например, концевой части, указанной цепи, или могут располагаться с определенными интервалами вдоль указанной цепи, как они находятся в pDADMAC. Собирающий реактив может быть анионным, но предпочтительно является катионным, как в случаеp-DADMAC и, предпочтительно, представляет собой сам поли-диаллилдиметиламмония хлорид (DADMAC). Поскольку большинство бактериальных клеток заряжены отрицательно, эффект связывания рDADMAC с восковидным покрытием микобактерий состоит в том, что клетки преобразуются в конечный положительный заряд. Это является преимуществом, поскольку это гарантирует, что другие контаминирующие микроорганизмы, которые не связываются с p-DADMAC, остаются отрицательно заряженными и так и остаются несвязанными с микробусинами. Кроме того, в вариантах осуществления с непосредственным получением, микроорганизмы, которые не являются гидрофобными в достаточной степени, не будут связываться с поверхностями, покрытыми p-DADMAC в присутствии детергентов, таким образом, обеспечивая степень селективности в отношении типа собранных микроорганизмов. Другие собирающие реагенты, которые могут быть рассмотрены, включают в себя полилизин или полиэтиленимин. Одним вариантом выбора был бы произвольный или блок сополимер гидрофобной аминокислоты, такой как триптофан, лейцин, валин, метионин, изолейцин, цистеин, или фенилаланин, и полярной аминокислоты, такой как лизин. Собирающий реагент предпочтительно должен быть достаточно гидрофобным по характеру для гидрофобного связывания с пластиками, например, с полистирольными микропланшетами, обычно используемыми для связывания белков, или альтернативно, могут быть способными связываться со стек-2 016156 лом или поверхностями, подобными стеклу, или посредством полярного взаимодействия, либо достаточно гидрофобным по природе для гидрофобного связывания с поверхностью, которая соответственно может быть такой, которая может быть обнаружена у предметных стекол микроскопа или покровных стекол. Но она должна быть достаточно гидрофильной по природе, так, что она будет растворима в воде или в забуференной водной среде, по меньшей мере в присутствии подходящей системы детергентов или переносимого количества органического со-растворителя, такого как DMSO. Следовательно, она растворима в смеси с образцом и любыми другими используемыми материалами. Независимо от изложенной выше теории настоящее изобретение во втором независимом аспекте относится к способу получения из жидкого образца микроорганизмов, имеющих гидрофобную поверхность, этот способ включает в себя контактирование микроорганизмов с растворимым собирающим: реагентом, который содержит поли-DADMAC, посредством чего собирающий реактив связывается с указанными микроорганизмами, и сбор указанных микроорганизмов на поверхности, путем связывания указанного собирающего реактива с указанной поверхностью. В любом аспекте настоящего изобретения указанная поверхность соответственно обеспечивается бусинами. Они могут быть микро или нано величины. Соответственно они могут быть парамагнитными для легкого отделения от жидкой среды. Они могут иметь полимерную поверхность из карбоновых кислот или поверхность, характеризующуюся сульфатными или фосфатными группами. Молекулярная масса поли-DADMAC может находиться в интервале от менее 100000 (очень низкая), 100000-200000 (низкая), 200000-400000 или 500000 (средняя) или свыше 500000 (высокая). Предпочтительно, образец контактирует с собирающим реагентом в присутствии системы детергентов из одного или нескольких детергентов, которые усиливают селективность связывания желаемых микроорганизмов. Желательно микроорганизмы связываются без связывания некоторых или всех контаминирующих гидрофобных веществ, присутствующих в образце, или без связывания некоторых или всех микроорганизмов в образце, сбор которых не является желательным. Система детергентов может содержать аминокислотный амид жирной кислоты, который предпочтительно представляет собой N-лауроилсаркозин. Система детергентов альтернативно или дополнительно может содержать детергент Тритон X, предпочтительно Тритон Х-100. Для большинства образцов собирающий реагент предпочтительно предоставляется в собирающем буфере, соответственно имеющем рН от 7-10, более предпочтительно 7-9, например от 8-9 или 8,2-8,6,например фосфатном буфере или Трис-буфере. Для образцов очень густой слизистой мокроты, содержащей большие количества мукополисахаридов, которые имеют много групп карбоновой кислоты, для сбора может быть благоприятным низкий рН. При достаточно низком рН карбоксильные группы нейтрализуются и не взаимодействуют с pDADMAC или другой сульфатной или фосфатной группой, представляющей поверхность, связывающую микобактерии и последующий сбор pDADMAC, или другую поверхность. Такие условия, хотя предназначены для образцов очень слизистой мокроты, могут быть использованы со всеми образцами. Соответственно рН собирающего реагента в этом случае составляет от 0 до 4, рН 4 является все еще достаточно низким для протонирования групп карбоновой кислоты. Следовательно, в зависимости от выбора твердой поверхности, рН собирающего реагента может по меньшей мере составлять от 0 до 10. Обработка образца может, разумеется, включать в себя стадию очищения, на которой образец, или поверхность, несущая собранные микроорганизмы, обрабатывают для того, чтобы микроорганизмы, отличные от интересующих, становились нежизнеспособными. Это может осуществляться с помощью веществ, известных для этой цели, таких как гидроксид натрия с N-ацетилцистеином или без него, или только с N-ацетилцистеином. Разумеется, целью является сохранить собранные микроорганизмы, представляющие интерес, в жизнеспособном состоянии. Собранные микроорганизмы в частности могут представлять собой микобактерии, которые могут быть любыми из тех, которые упоминаются выше. Настоящее изобретение включает в себя способ выявления микроорганизмов, включающий в себя сбор указанных микроорганизмов на поверхности описанным способом, промывание указанных собранных микроорганизмов, и выявление указанных собранных микроорганизмов на указанной поверхности или после удаления с нее. Используемый способ выявления может представлять собой любой способ соответствующий исследуемому микроорганизму. Для микобактерий вообще, и для М. tuberculosis в частности, эти способы будут включать в себя культивирование и микроскопическое выявление, например, путем окрашивания,ПЦР - полимеразную цепную реакцию, ТМА - транскрипционно опосредованную амплификацию, SDA амплификацию по типу замещения цепи, или другие методики амплификации и детекции, направленные на нуклеиновые кислоты самого организма, и способы на основе фагов, в том числе FASTPlaqueTB, в котором добавляют фаг, инфицирующий микобактерий, и дают возможность войти в клетки, фаг, который остается снаружи клеток уничтожают и после дополнительного инкубирования для выхода фага из клеток, выявляют присутствие вышедшего фага, путем инфицирования дополнительных микроорганизмов. Материалы, или избранные основные материалы, необходимые для практического осуществления-3 016156 способов выявления микроорганизмов, описанных выше, могут быть предоставлены в виде набора. Соответственно, настоящее изобретение включает в себя набор для анализа микроорганизмов, содержащий растворимый собирающий реагент, имеющий как гидрофобные свойства, за счет чего этот собирающий реагент способен связываться с микроорганизмом, выявляемым посредством гидрофобного взаимодействия с ним, так и полиионные свойства, субстрат, имеющий поверхность для сбора указанных микроорганизмов на указанную поверхность, посредством связывания указанного собирающего реагента с указанной поверхностью посредством полярного взаимодействия между указанной поверхностью и указанным собирающим реагентом, и по меньшей мере одно из следующего: фаг, способный инфицировать указанный микроорганизм; праймеры для проведения амплификации геномной нуклеиновой кислоты указанного микроорганизма или указанного фага; культуральную среду для культивирования указанного микроорганизма; краситель для визуализации указанного микроорганизма для микроскопического исследования; антитело (в виде целого ли антитела, или как его часть, имеющая аффинность селективного связывания) для связывания указанного микроорганизма; или детектирующий реагент для использования при выявлении метаболита, продуцируемого при культивировании указанного микроорганизма. В соответствии с описанным выше изобретением, образец также может представлять собой газообразный образец, например, воздух, с содержащимися в нем микроорганизмами. Такой образец может быть барботирован в раствор собирающего реагента для связывания микроорганизмов с собирающим реагентом. Альтернативно настоящее изобретение включает в себя набор для анализа микроорганизмов, содержащий собирающий реагент, нанесенный, и, таким образом, иммобилизованный на твердой поверхности, указанный собирающий реагент имеет как гидрофобные, так и полиионные свойства, за счет чего этот собирающий реагент способен связывать выявляемые микроорганизмы, и по меньшей мере одно из: фаг, способный инфицировать указанный микроорганизм; праймеры для проведения амплификации геномной нуклеиновой кислоты указанного микроорганизма или указанного фага; культуральную среду для культивирования указанного микроорганизма; краситель для визуализации указанного микроорганизма для микроскопического исследования; антитело (в виде целого ли антитела, или как его часть, имеющая аффинность селективного связывания) для связывания указанного микроорганизма; или детектирующий реагент для использования при выявлении метаболита, продуцируемого при культивировании указанного микроорганизма. Твердая поверхность может представлять собой предметное стекло. Предпочтительно, собранные микобактерии, либо собранные напрямую, либо опосредованно, не повреждаются таким сбором и остаются жизнеспособными. Таким образом, настоящее изобретение может быть использовано для тестирования микроорганизмов на лекарственную чувствительность. В одном аспекте, на микобактерии воздействуют лекарственным средством, таким образом, чтобы лекарственное средство действовало на этот микроорганизм. После этого микобактерии могут быть собраны любым из описанных здесь способов, а затем могут быть исследованы на жизнеспособность, используя любое число ранее описанных способов, которые могут включать в себя микроскопию, с использованием красителей для определения жизнеспособности, способы на основе фагов, способы на основе культивирования или способы на основе ПЦР. В другом аспекте, микобактерии могут быть сначала собраны любым из описанных здесь способов, затем впоследствии их подвергают воздействию лекарственного средства таким образом, чтобы лекарственное средство могло подействовать на этот микроорганизм. После этого, микобактерии затем могут быть исследованы на жизнеспособность, с использованием любого количества описанных способов, которые могут включать в себя микроскопию, с использованием красителей для определения жизнеспособности, способы на основе фагов, способы на основе культивирования или способы на основе ПЦР. Используемые лекарственные средства могут включать в себя средства,обычно используемые для лечения туберкулеза, такие как рифампицин, стрептомицин, изониазид, этамбутол, пиразинамид и ципрофлоксацин. Материалы, или избранные основные материалы, необходимые для практического осуществления способов определения чувствительности микроорганизмов к лекарственным средствам, описанных выше, могут быть предоставлены в виде набора. Соответственно, настоящее изобретение включает в себя набор для исследования чувствительности микроорганизма к лекарственному средству, содержащий растворимый собирающий реагент, имеющий как гидрофобные свойства, за счет чего собирающий реагент способен связываться с выявляемым микроорганизмом, посредством гидрофобного взаимодействия с ним, так и полиионные свойства, субстрат, имеющий поверхность для сбора указанных микроорганизмов на указанную поверхность, путем связывания указанного собирающего реагента с указанной поверхностью посредством полярного взаимодействия между указанной поверхностью и указанным собирающим реагентом, и одно или и то, и другое из следующего:-4 016156 одно или несколько тестируемых лекарственных средств; и средства для определения, являются ли собранные микроорганизмы жизнеспособными, которые могут представлять собой одно или несколько из следующего: краситель, указывающий на жизнеспособность, для визуализации указанных микроорганизмов для микроскопического исследования; фаг, способный инфицировать указанный микроорганизм; детектирующий реагент для использования при выявлении метаболита, продуцируемого при культивировании указанных микроорганизмов; и, необязательно, одно или несколько из следующего, если еще не присутствует: фаг, способный инфицировать указанный микроорганизм; праймеры для проведения амплификации геномной нуклеиновой кислоты указанного микроорганизма или указанного фага; культуральную среду для культивирования указанного микроорганизма; краситель для визуализации указанного микроорганизма для микроскопического исследования; антитело (в виде целого ли антитела, или как его часть, имеющая аффинность селективного связывания) для связывания указанного микроорганизма; или детектирующий реагент для использования при выявлении метаболита, продуцируемого при культивировании указанного микроорганизма. Альтернативно, настоящее изобретение включает в себя набор для исследования чувствительности микроорганизма к лекарственному средству, содержащий собирающий реагент,нанесенный, и, таким образом, иммобилизованный на твердой поверхности, указанный собирающий реагент имеет как гидрофобные, так и полиионные свойства, за счет чего собирающий реагент способен связываться с выявляемым микроорганизмом, и одно или и то, и другое из следующего: одно или несколько тестируемых лекарственных средств; и средства для определения, являются ли собранные микроорганизмы жизнеспособными, которые могут представлять собой одно или несколько из следующего: краситель, указывающий на жизнеспособность, для визуализации указанных микроорганизмов для микроскопического исследования; фаг, способный инфицировать указанный микроорганизм; детектирующий реагент для использования при выявлении метаболита, продуцируемого при культивировании указанных микроорганизмов; и, необязательно, одно или несколько из следующего, если еще не присутствует: одно или несколько тестируемых лекарственных средств; фаг, способный инфицировать указанный микроорганизм; праймеры для проведения амплификации геномной нуклеиновой кислоты указанного микроорганизма или указанного фага; культуральную среду для культивирования указанного микроорганизма; краситель для визуализации указанного микроорганизма для микроскопического исследования; антитело (в виде целого ли антитела, или как его часть, имеющая аффинность селективного связывания) для связывания указанного микроорганизма; или детектирующий реагент для использования при выявлении метаболита, продуцируемого при культивировании указанного микроорганизма. Твердая поверхность может представлять собой предметное стекло. М. tuberculosis переносятся на взвешенных в воздухе частицах, воздушно-капельной взвеси инфекционных частиц, которые образуются при кашле, чихании или громком разговоре инфицированных индивидуумов, у которых имеется легочный или ларингеальный туберкулез. Размер этих частиц составляет приблизительно 1-5 мкм, и они могут оставаться в воздухе в течение нескольких часов, обеспечивая возможность их распространения по всему помещению или зданию. Заражение происходит, когда восприимчивый человек вдыхает воздушно-капельную взвесь инфекционных частиц, содержащую М. tuberculosis, которые затем проходят рот или носовые ходы, верхние дыхательные пути и бронхи, чтобы достичь альвеол. Мультирезистентность (MDR) M. tuberculosis также классифицируется по CDC (схема классификации заболеваний) как категория С агент биологического терроризма и механизмом подачи предположительно создание взвешенного в воздухе аэрозоля. Желательно защитить медико-санитарных работников, других людей в непосредственной близости от инфицированного человека, и военнослужащих от опасности заражения ингаляционным путем. Кроме того, сотрудники лаборатории, которые работают с образцами, зараженными ТВ, культурами ТВ и образцами, содержащими другие патогенные микобактерии (такие как М. paratuberculosis в фекалиях) также имеют риск заражения. В настоящее время медико-санитарные работники и сотрудники лаборатории предпринимают попытки предотвратить заражение, используя защитные маски, или более современные респираторы с фильтрами для задержки частиц.CDC рекомендует использовать респираторы с фильтрами для задержки частиц, сертифицированные Национальным институтом профессиональной безопасности и здоровья (NIOSH) (например, N95,-5 016156N99, или N100), которые способны эффективно фильтровать мельчайшие частицы в диапазоне 1-5 мкм. Защитные маски в основном состоят из легких тканых или нетканых материалов; они могут иметь несколько слоев и могут иметь обозначения, которые указывают заданный размер пор. Однако большинство масок не являются NIOSH-сертифицированными в качестве респираторов, не защищают пользователя должным образом от воздействия ТВ и не удовлетворяют требованиям OSHA (комиссия по стандартам безопасности) для защиты органов дыхания. Исследование показало, что применение защиты органов дыхания определяется для снижения риска заражения у патронажных медицинских работников следующими соотношениями (по сравнению с отсутствием защиты): хирургическая защитная маска, 2,4 раза; одноразовая маска, задерживающая пыль, дым, влагу или одноразовая маска с высокоэффективной фильтрацией воздушных частиц (НЕРА), 17,5 раз; респиратор с эластомерным НЕРА картриджем, 45,5 раз; или электроприводной воздухоочистительный респиратор (PAPR), 238 раз. (J Occup Environ Med. 1997 Sep;39(9):849-54). Хотя респиратор с фильтром для задержки частиц обеспечивает высокий уровень защиты, его недостатком является высокая стоимость и ограниченность в применении. Существует необходимость в усовершенствованной одноразовой защитной маске, которая обеспечивает усиленную защиту пользователя от взвешенной в воздухе микобактериальной инфекции в ситуациях, в которых респиратора нет в наличии или он не подходит для использования. Такая ситуация складывается в развивающихся странах,а также в обстановке лаборатории. Требуется защитная маска и/или фильтр, который предоставляет специфический и эффективный способ связывания аэрозолей, содержащих микобактерии, образованных инфицированными людьми, и случайно образованных в лаборатории, таким образом значительно повышая стандарт защиты пользователя. Настоящее изобретение, соответственно, относится к фильтру для фильтрования потока газа для удаления микроорганизмов, заключенных в нем, указанный фильтр содержит полярный собирающий реагент на или выше полярной поверхности, этот собирающий реагент имеет как гидрофобные свойства,за счет чего он способен гидрофобно связываться с бактериями, покрытыми оболочкой, путем гидрофобного взаимодействия, так и полярные свойства, например, полиионные свойства, за счет чего он связывается, или приспособлен к связыванию с указанной полярной поверхностью. Фильтр может принимать форму защитной маски для защиты того, кто ее носит, или может быть фильтровальным элементом, присоединенным к защитной маске или шлему. Это может быть фильтр,установленный или для установки в канале подачи воздуха. В предпочтительном аспекте настоящего изобретения, для обеспечения улучшенной защиты, защитная маска может быть снабжена, то есть пропитана, растворимым собирающим реагентом, имеющим как гидрофобные свойства, за. счет чего собирающий реагент связывается с микобактериями посредством гидрофобного взаимодействия, так и полярные свойства, например, полиионный характер, за счет чего собирающий реагент связывается с ионной поверхностью посредством полярного взаимодействия. Растворимый собирающий агент может быть распылен на подходящий материал маски в твердой фазе, например, материал фильтра защитной маски, а затем высушен перед упаковкой продукта. При использовании защитная маска увлажняется в результате выдоха пользователя и собирающий агент затем становится солюбилизированным в слое влаги на поверхности материала маски. Воздействие аэрозолей, содержащих микобактерии, приведет к быстрому связыванию растворимого собирающего реагента с микобактериальными клетками. Применение твердофазного материала в маске, который является полиионным, приведет к иммобилизации микобактерий на твердой фазе. Это устранит любую возможность дальнейшего образования инфекционного аэрозоля с поверхности во время вдыхания и обеспечит высокий уровень защиты оператора. В этом первом примере растворимый собирающий реагент станет связанным с полиионным твердофазным материалом маски при увлажнении и до воздействия аэрозоля. Это может оказывать эффект снижения эффективности захвата микобактерий, поскольку поверхность могла стать насыщенной собирающим реагентом и поэтому не будет связывать комплекс микобактериальные клетки/собирающий реагент в воздействующих аэрозолях. Альтернативно, связанный собирающий реагент может иметь сниженную аффинность или авидность к микроорганизмам в силу препятствий со стороны твердой поверхности. Этот недостаток можно преодолеть, используя двухслойную защитную маску, которая имеет первый наружный слой, пропитанный растворимым собирающим реагентом на нейтральном незаряженном материале. Воздействие аэрозолей приведет к образованию комплекса микобактерий/собирающий реагент, который затем становится прочно связанным полиионным материалом во втором внутреннем слое структуры защитной маски. Соответственно, настоящее изобретение включает в себя фильтр, как описано вначале, где указанный собирающий реагент представлен на твердой поверхности, имеющей низкую аффинность связывания в отношении собирающего реагента, расположенного выше указанной полярной поверхности. На сопровождающих чертежах на фиг. 1 представлена микроскопическая визуализация окрашивания по методу Циля-НильсенаMycobacterium bovis в примере 10 на стадии 5 (панель с левой стороны) и после стадии 6 (панель с пра-6 016156 вой стороны); на фиг. 2 представлены микроорганизмы, выделенные из бусин на стадии 6 примера 10 при большем (верхняя панель) и меньшем (нижняя панель) увеличении; на фиг. 3 представлены покрытые (слева) и непокрытые (справа) предметные стекла, обработанные в примере 11; и на фиг. 4 представлены микобактерии, собранные в примере 12, и окрашенные для демонстрации жизнеспособности. Далее настоящее изобретение будет описано и проиллюстрировано следующими примерами. В этих примерах, поскольку М. smegmatis имеют много общих свойств, подобных М. tuberculosis, но не являются инфекционными, их использовали в качестве репрезентативной модели организма для рода микобактерий. Примеры Пример 1. Титрование pDADMAC лиганда и собирающих бус Обоснование. Этот эксперимент проводили для определения оптимального количества лиганда и бус при использовании для сбора микобактерии. Количество собранных микобактерий анализировали с помощью ПЦР генома микобактерий. Способ. 1. Репликации 1 мкл культуры Mycobacterium smegmatis проводили в 1 мл культуральной среды 7 Н 9 OADC (среда 7 Н 9, дополненная 10% OADC, Difco). 2. Добавляли 250 мкл 5 х собирающего буфера (250 мМ Трис рН 8,3, 5% (масс/объем) Nлауроилсаркозин, 5% (об/об) тритон Х-100, 5% (масс/объем) BSA) и перемешивали. 3. Различные количества pDADMAC (Sigma Aldrich, средняя молекулярная масса, от 400000 до 500000) разведенного в воде, добавляли, перемешивали и инкубировали в течение 15 мин. 4. MyOne парамагнитные бусы карбоновой кислоты добавляли в объемном соотношении 10:1 по сравнению с исходным объемом pDADMAC, перемешивали и инкубировали 15 мин. 5. Бусы собирали с помощью магнитной установки и промывали в 1 мл PBS. 6. Добавляли 20 мкл 100 мМ NaOH, 0,05% (об/об) Тритона Х-100 и бусы ресуспендировали и нагревали при 95 С в течение 5 мин. 7. Добавляли 10 мкл 200 мМ HCl и 2 мкл элюата анализировали с помощью количественной ПЦР на Mycobacterium smegmatis. ПЦР анализ. Использовали прибор Chromo 4 производства фирмы MJ Research Inc. (Hercules, California). Использовали наборы Sybr Green (Eurogentec, Seraing, Belgium), которые позволяют выявлять ПЦР-продукт в результате флуоресценции интеркалятора двухцепочечной ДНК. Использовали следующие условия ПЦР: нагревание 95 С в течение 10 с, отжиг праймеров при 65 Св течение 15 с и удлинение при 72 С в течение 15 с. Использовали ПЦР-праймеры 5' ТСА GGC CCT CGA AAG CCG ACT GGG 3', 5' CCA GGACTC GGT АСА AGA CTC TGC 3', специфичные для генома М.smegmatis. Результаты. Заключение. 5 мкл 0,01% pDADMAC работало лучше всего, давая сигнал на цикле 25 по сравнению с циклом 34 для небактериального контроля (фон - образование димеров ПЦР-праймеров). Разведения pDADMAC и бус дали прегрессивно уменьшенное извлечение М. smegmatis. Пример 2. Исследование эффективности сбора. Эффективность сбора М. smegmatis добавленных в среду, исследовали в сравнении с тем же количеством М. smegmatis экстрагированным путем щелочного нагревания, и детектировали непосредственно с помощью ПЦР. Способ. 1. Разведения культуры Mycobacterium smegmatis были сделаны в 1 мл культуральной среды 7 Н 9-7 016156 2. Добавляли 250 мкл 5 х собирающего буфера (250 мМ Трис рН 8,3, 5% (мас./об.) Nлауроилсаркозина, 5% (об./об.) Тритона Х-100, 5% (мас./об.) BSA) и перемешивали. 3. 10 мкл 0,01%(об./об.) pDADMAC (Sigma Aldrich, средняя молекулярная масса, от 400000 до 500000) добавляли, перемешивали и инкубировали в течение 15 мин. 4. 50 мкл MyOne парамагнитных бус карбоновой кислоты добавляли, перемешивали и инкубировали в течение 15 мин. 5. Бусы собирали с помощью магнитной установки и промывали в 1 мл PBS. 6. Добавляли 20 мкл 100 мМ NaOH, 0,05% (об./об.) Тритона Х-100 и бусы ресуспендировали и нагревали при 95 С в течение 5 мин. 7. Добавляли 10 мкл 200 мМ HCl и 2 мкл элюата анализировали количественной ПЦР на наличиеMycobacterium smegmatis. 8. Кроме того, 1 мкл той же культуры М. smegmatis обрабатывали непосредственно щелочью, как описано на стадиях 6-7 выше, и анализировали с помощью ПЦР таким же образом. ПЦР анализ. ПЦР описана в примере 1. Результаты. Заключение. Эффективность сбора бактерий была очень высокой с аналогичным сигналом, генерированным от того же количества бактерий, добавленных и извлеченных, как и анализированных непосредственно. Всего лишь 10000 бактерий, добавленных в мл среды, могли быть извлечены и детектированы. Пример 3. Изучение необходимости в собирающем буфере. Обоснование. М. smegmatis добавляли в среду и извлекали в присутствии или отсутствии собирающего буфера. Способ. Способ представлял собой способ, описанный в примере 1, за исключением того, что в один образец собирающий буфер не добавляли. Результаты. Заключение. Собирающий буфер увеличивал извлечение бактерий на 2,5 цикла или примерно в 6 раз в единицах бактериальных геномов и бактерий. Это возможно вследствие воздействия детергентов на среду и снижения интерференции под действием ингибирующих элементов, которые ингибируют связывание М.smegmatis с собирающим реагентом. Пример 4. Демонстрация полезности захвата лиганда М. smegmatis в исследовании на основе фагов. Обоснование. Микобактерии могут быть протестированы на жизнеспособность через способность бактерий выступать в роли хозяина для инфицирования бактериофагами. Одной из проблем этого подхода является отделение инфицированных бактерий от экзогенных неинфицирующих бактериофагов. После отделения от экзогенного фага бактерии могут быть лизированы и исследованы на эндогенные инфицирующие бактериофаги. Способ. 100 мкл М. smegmatis добавляли к 10 мл среды 7 Н 9 OADC и инкубировали в течение 3 часов при 37 С. Также готовили отрицательный контроль без бактерий. 100 мкл (около 1010 бляшкообразующих единиц) микобактериофага D29 добавляли к обеим пробиркам, и образцы помещали обратно в термостат. 1 мл аликвот удаляли в различные моменты времени после заражения и М. smegmatis собирали из-8 016156 среды, как описано в примере 1, за исключением того, что три дополнительных промывания проводили вPBS. Собранные бактерии лизировали, как описано, и исследовали на наличие эндогенного инфицирующего фагового генома с помощью ПЦР. ПЦР проводили, как описано ранее, за исключением того, что использовали праймеры, специфичные в отношении фагового генома 5' ССТ CGG GCT AAA AAC CAC Заключение. Способность собрать М. smegmatis из среды позволила промыть бактерии и удалить экзогенный фаг. Только фаги, которые были впоследствии выявлены, представляли собой фаги, которые инфицировали бактерии. В этом примере этот способ использовали для мониторинга инфекционного процесса. Через 15 мин после добавления фага не было сигнала, детектируемого от бактерий. Фаг все же должен инфицировать и фаговый геном не реплицируется. Эндогенный фаговый геном появляется на 30 мин в бактериях, но идет на убыль в момент времени 60 мин, полностью исчезая в момент времени 90 мин,поскольку фаг реплицируется и лизирует бактерии. Сигнал снова появляется на 120 мин, поскольку высвобождаемое второе поколение реплицированных фагов проходит другой цикл инфицирования и репликации. Пример 5. Демонстрация сбора микобактерий из мокроты. Обоснование. Мокрота представляет собой сложный и вязкий матрикс. Эксперимент проводили для того, чтобы показать, что этот матрикс не помешал бы сбору микобактерий. Способ. Получали пул 5 образцов мокроты и разделяли аликвотами объемами 1 мл. К половине аликвот добавляли 10 мкл культуры M. smegmatis. Добавляли 100 мкл 5 М NaOH, 2,5% N-ацетилцистеина и инкубировали в течение 15 мин для разжижения и деконтаминации мокроты. Добавляли 100 мкл 5 М HCl, затем 250 мкл 5 х собирающего буфера (как описано ранее). Затем М. smegmatis собирали из мокроты и количественно анализировали с помощью ПЦР, как описано в примере 2, стадии 3-8. Результаты. Образцы с М. smegmatis были позитивными при цикле 20 ПЦР. Образец без бактерий (т.е. фон) был позитивным при цикле ПЦР 36,3. Заключение. Способ экстракции с использованием pDADMAC и захвата бус не ингибировался матриксом образца (мокроты) и М. smegmatis с успехом извлекались из этого образца. Пример 6. Демонстрация получения микобактерий из мокроты без необходимости разжижения и деконтаминации щелочью. Обоснование. Мокрота представляет собой сложный и вязкий матрикс. Обработка щелочью разжижает и деконтаминирует мокроту, но также может повредить микобактерий. Этот эксперимент поводили для того, чтобы показать, что процедура экстракции может быть использована без предварительной обработки щелочью. М. smegmatis снова использовали в качестве организма-модели рода микобактерий. Способ. Получали пул 5 образцов мокроты и разделяли аликвотами объемами 1 мл. К половине аликвот добавляли 10 мкл культуры М. smegmatis. Добавляли 250 мкл 5 х собирающего буфера (как описано ранее) и перемешивали. Затем М. smegmatis собирали из мокроты и количественно анализировали с помощью ПЦР, как описано в примере 2, стадии 3-8. Результаты. Образец с М. smegmatis был положительным при цикле ПЦР 24,7. Образец без бактерий (т.е. фон) остался отрицательным.-9 016156 Заключение. Способ экстракции с использованием pDADMAC и собирающих бус не требовал предварительной обработки мокроты щелочью. Было отмечено, что добавления собирающего буфера было достаточно для того, чтобы вызвать разрушение и разжижение мокроты, что впоследствии позволяло извлечь M. smegmatis из этого образца. Пример 7. Демонстрация необходимости pDADMAC лиганда в системе поглощения. Обоснование. Этот эксперимент проводили для того, чтобы показать, что собирающий реагент, показанный здесь на примере pDADMAC, является необходимым для сбора микобактерий, и что микобактерии не связываются с карбоксильными бусами в отсутствии собирающего реагента. Способ. 0,5 мл аликвоты культуры М. smegmatis в стационарной фазе центрифугировали для осаждения микроорганизмов, затем эти микроорганизмы ресуспендировали в собирающем буфере (50 мМ Трис рН 8,3, 1% (мас./об.) N-лауроилсаркозина, 1% (об./об.) Тритона Х-100, 1% (мас./об.) BSA). К одной аликвоте добавляли 10 мкл 0,01% pDADMAC, перемешивали и инкубировали в течение 15 мин. В такую же аликвоту не добавляли pDADMAC и оставляли на 15 мин. 50 мкл парамагнитных бус с карбоновой кислотой MyOne (промытых х 3 перед применением вdH2O и ресуспендированных в исходном объеме dH2O) затем добавляли к каждой аликвоте и инкубировали 15 мин. Эти аликвоты затем помещали на магнит, и любое просветление мутной суспензии микроорганизмов оценивали визуально. Супернатанты затем удаляли и сохраняли. Бусы затем промывали в x1 собирающем буфере и х 2 в среде 7 Н 9 OADC и ресуспендировали в 1 мл этой среды. Эквивалент 0,1 мкл супернатанта и суспензии бус осаждали на агаровых чашках 7 Н 9 OADC и инкубировали в течение 2 дней при 37 С после чего подсчитывали количество колоний на каждой чашке. Результаты. После добавления магнитных бус и расположения аликвот на магните, происходило значительное просветление аликвоты, которую инкубировали с собирающим реагентом pDADMAC. Это происходило вследствие сбора большинства микроорганизмов в суспензии на магнитных частицах. Аликвота, к которой не добавляли собирающий реагент, оставалась мутной, поскольку микроорганизмы оставались в суспензии. Количества собранных и несобранных бактерий в присутствии и отсутствии собирающего реагента подсчитывали из культур на агаровых пластинках и заносили в таблицу (смотри таблицу, приведенную ниже). Заключение. Сбор микобактерий, как определено по визуальной мутности, посредством бус с карбоновой кислотой, зависел от присутствия pDADMAC. Это визуальное наблюдение подтверждалось микробиологическим количественным определением. В присутствии собирающего реагента было собрано подавляющее большинство микобактерий, тогда как в отсутствие собирающего реагента происходила минимальная абсорбция на бусах. Пример 8. Демонстрация селективности лигандного захвата в отношении микобактерий. Обоснование. Этот эксперимент проводили для того, чтобы показать, что собирающий реагент pDADMAC связывается специфически с микобактериями и не связывается с другими тестируемыми микроорганизмами, в том числе характерными грамотрицательными и грамположительными микроорганизмами, которые также могут контаминировать соответствующие биологические образцы. Способ. Аликвоты по 0,5 мл культур М. smegmatis, Pseudomonas aeruginosa, Staphylococcus aureus и Escherichia coli в стационарной фазе центрифугировали для осаждения микроорганизмов, затем эти микроорганизмы ресуспендировали в собирающем буфере (50 мМ Трис рН 8,3, 1% (масс/объем) Nлауроилсаркозин, 1% (об./об.) Тритон X-100, 1% (мас./об.) BSA). К каждой аликвоте каждого микроорганизма добавляли по 10 мкл 0,01% pDADMAC, перемешивали и инкубировали в течение 15 мин.- 10016156 Затем к каждой аликвоте добавляли по 50 мкл MyOne парамагнитных бус с карбоновой кислотой(промытых х 3 до использования в dH2O и ресуспендированных в исходном объеме dH2O) и инкубировали 15 мин. Затем аликвоты размещали на магните, и любое просветление мутной суспензии микроорганизмов оценивали визуально. Затем супернатанты удаляли и сохраняли. Затем бусы промывали в x1 собирающем буфере. Аликвоты М. smegmatis затем промывали х 2 в среде 7 Н 9 OADC и ресуспендировали в 1 мл этой среды. Другие микроорганизмы промывали таким же образом в среде Мюллера Хинтона и ресуспендировали в 1 мл этой среды. Эквивалент 0,1 мкл супернатанта и суспензии бус располагали либо на агаровых пластинках 7 Н 9OADC для М. Smegmatis, либо на агаровых пластинках Мюллера Хинтона для других микроорганизмов и инкубировали при 37 С до появления бактериальных колоний, после этого подсчитывали количество колоний на каждой пластинке. Результаты. Как и раньше, суспензия М. smegmatis просветлялась при размещении на магните, демонстрируя то,что микроорганизмы были собраны из суспензии. Суспензии всех других протестированных микроорганизмов оставались очень мутными, демонстрируя то, что микроорганизмы не собирались и оставались в суспензии. Количество собранных и несобранных бактерий подсчитывали из культур на агаровых пластинках и заносили в таблицу. Заключение. Собирающий реагент pDADMAC давал возможность осуществить специфический сбор микобактерий М. smegmatis. Другие тестируемые организмы не связывались с собирающим реагентом и не были собраны. Пример 9. Изучение состава собирающего буфера, необходимого для специфического сбора бактерий. Обоснование. Этот эксперимент проводили для изучения компонентов собирающего буфера, которые являются важными для специфического связывания pDADMAC с микобактериями. Способ. Аликвоты по 0,5 мл культур of M. smegmatis, Pseudomonas aeruginosa, Staphylococcus aureus и Escherichia coli в стационарной фазе центрифугировали для осаждения микроорганизмов, затем эти микроорганизмы ресуспендировали в различных компонентах собирающего буфера. К каждой аликвоте каждого микроорганизма добавляли по 10 мкл 0,01% pDADMAC, перемешивали и инкубировали в течение 15 мин. К другой аликвоте каждого микроорганизма собирающий реагент не добавляли в качестве контроля для наблюдения за тем, как собирающий реагент опосредует сбор бактерий, 50 мкл MyOne парамагнитных бус с карбоновой кислотой (промытых х 3 перед использованием вdH2O и ресуспендированных в исходном объеме dH2O) затем добавляли к каждой аликвоте и инкубировали 15 мин. Аликвоты затем размещали на магните, и любое просветление мутной суспензии микроорганизмов оценивали визуально. Результаты. Результаты были записаны и представлены в таблице, приведенной ниже. Микроорганизмы, не являющиеся микобактериями, не собирались на бусах в отсутствие или в присутствии собирающего реагента в любых буферных условиях. Сбор микобактерий зависел от присутствия собирающего реагентаpDADMAC и сбор бактерий наблюдали во всех изучаемых буферных условиях. Оказалось, что применение буфера, содержащего только N-лауроилсаркозин, частично ингибирует сбор бактерий. При использовании саркозина в комбинации с Тритоном-Х 100, однако, эффективность сбора была восстановлена. В тех случаях, когда N-лауроилсаркозин не присутствовал в собирающем буфере, бусы были очень агрегированными после ресуспендировалия после сбора микобактерий. Включение N-лауроилсаркозина предотвращало это агрегирование после сбора бактерий и помогало обрабатывать бусы, что было бы важным для последующего промывания бус и обработке и анализа после сбора бактерий. Заключение. Как показано ранее, организмы, не являющиеся микобактериями, не собирались на бусах в присутствии или в отсутствие собирающего реагента в любых тестируемых условиях. Сбор микобактерий зависел от присутствия собирающего реагента и мог быть демонстрирован во всех тестируемых условиях.- 11016156 Включение N-лауроилсаркозина в собирающий буфер было важным для обработки после сбора бактерий и анализа собранного материала. Пример 9. Таблица результатов Пример 10. Выявление микобактерий путем лигандного захвата и микроскопическое исследование кислотоустойчивых бактерий.Mycobacterium bovis собирали из раствора и окрашивали как кислотоустойчивым цветным красителем по методу Циля-Нильсена, так и флуоресцентным красителем аурамин-фенол непосредственно на бусах или после элюции. Способ. 1. 250 мкл 5 х собирающего буфера (250 мМ Трис рН 8,3, 5% (об/об) Тритон Х-100, 5% Цвиттергент[3-(n,N-диметилмиристиламмоний)-пропансульфонат]) добавляли к 1 мл среды 7 Н 9, содержащей суспензию Mycobacterium bovis. 2. Добавляли 10 мкл 0,01%(об/об) pDADMAC, перемешивали и инкубировали в течение 15 мин. 3. Добавляли 50 мкл MyOne парамагнитных бус с карбоновой кислотой, перемешивали и инкубировали 15 мин. 4. Бусы собирали с помощью магнитной установки и промывали в 1 мл PBS. 5. Половину объема бус наносили на предметное стекло, сушили и фиксировали нагреванием перед окрашиванием по методу Циля-Нильсена. На фиг. 1, панель, находящаяся слева, собранные микобактерии видны до элюции из лиганда/бус. Магнитные бусы указаны нижней стрелкой. Собранные на бусах,высокоагрегированные кислотоустойчивые микобактерии указаны верхней стрелкой, и их можно увидеть окруженными бусами. 6. Оставшиеся бусы ресуспендировали в 100 мкл dH20 и добавляли 10 мкл хлороформа. После встряхивания для премешивания хлороформа с водным слоем, бусы притягивались к боку пробирки магнитом и супернатант наносили на предметное стекло, сушили, фиксировали нагреванием и окрашивали как по методу Циля-Нильсена, так и аурамином-фенолом. Все окрашивания проводили, как описано вMedical Microbiology, a Practical Approach, Eds., Peter Hawkey and Deidre Lewis, Oxford University Press. На фиг. 1, панель с правой стороны, собранные микобактерии видны после элюции из лиганда/бус. Элюция содержит диспергированные кислотоустойчивые микобактерии (нижняя стрелка). Некоторые бусы все еще присутствуют (верхняя стрелка). На фиг. 2 показаны микроорганизмы, собранные с бус. При большом увеличении на верхней панели можно увидеть скопление флуоресцентных микобактерий, собранных на лиганде, а на нижней панели при меньшем увеличении можно увидеть характерную "звездную ночь" флуоресценции диспергированных микобактерий. Результаты. Микобактерии собираются лиганд/парамагнитными бусами, и без элюции, после окрашивания по методу Циля-Нильсена, их можно видеть в виде высоко агрегированного розового вещества, окруженного бусами. После элюции, микобактерии отделяются от бус и диспергируются (смотри фиг. 1 и 2). Заключение. Микобактерии могут быть собраны с помощью ТВ-лиганда и могут быть визуализированы с помощью кислотоустойчивого окрашивания и микроскопии. После элюции микобактерии выделяют из бус и диспергируют. Дальнейшие эксперименты показали, что лигандный захват и протокол окрашивания хорошо работают в случае клинических образцов ТВ в мокроте и что флуоресцентная микроскопия может быть использована для более чувствительного выявления. Пример 11. Непосредственный сбор микобактерий на твердой поверхности, покрытой лигандом, с окрашиванием in situ и выявлением собранных микроорганизмов с помощью микроскопии. Обоснование. Этот эксперимент проводили для того, чтобы продемонстрировать сбор микобактерий на предметных стеклах, покрытых p-DADMAC, визуализированных с помощью окрашивания in situ и микроскопии.- 12016156 Способ. Предметное стекло покрывали p-DADMAC путем погружения предметного стекла в 2%(об./об.) pDADMAC (разведенного из 20% матричного раствора в дистиллированной воде) и оставляли испаряться до сухости. Предметное стекло без покрытия использовали в качестве контроля. Затем предметные стекла промывали в больших количествах дистиллированной воды и сушили. Добавляли 100 мкл культуры М. smegmatis к 800 мкл dH20 и 100 мкл собирающего буфера (10%(мас./об.) Цвиттергент [3-(n,Nдиметилмиристиламмоний)пропансульфонат], 10% (об./об.) Тритон X-100, 500 мМ Трис рН 8,3) наносили на предметные стекла. После инкубирования в течение 10 мин предметные стекла промывали в дистиллированной воде и окрашивали по Грамму, как описано в Medical Microbiology, a Practical Approach,Eds., Peter Hawkey and Deidre Lewis, Oxford University Press. Результаты. Грамположительные микобактерии можно было наблюдать с помощью микроскопа собранными в больших количествах на предметном стекле, покрытом p-DADMAC (смотри фиг. 3), тогда как очень мало (если имеется) микобактерий собралось на предметном стекле без покрытия. Заключение. Этот пример демонстрирует, что микобактерии могут быть собраны на предметном стекле, покрытом p-DADMAC, и что эти микобактерии могут быть окрашены in situ и рассмотрены под микроскопом. Аналогичные результаты также были получены из культур БЦЖ и окрашивания кислотоустойчивым красителем по методу Циля-Нильсена и флуоресцентным красителем аурамином-фенолом. Пример 12. Сбор микобактерий непосредственно на твердой поверхности, покрытой лигандом, с окрашиванием in situ на жизнеспособность и выявлением с помощью микроскопии. Обоснование. Этот эксперимент проводили для того, чтобы показать, что микобактерии, собранные на предметных стеклах, покрытых p-DADMAC, остаются жизнеспособными и могут быть визуализированы с помощью витальных красителей in situ с последующим микроскопическим исследованием. Способ. На предметное стекло наносили покрытие p-DADMAC путем погружения предметного стекла в 2%(об/об) p-DADMAC (разведенный из 20% маточного раствора в дистиллированной воде) и оставляли его для испарения до сухости. Предметное стекло без покрытия использовали в качестве контроля. Затем предметные стекла промывали в большом количестве дистиллированной воды и сушили. Добавляли 100 мкл культуры M. smegmatis к 800 мкл dH2O и 100 мкл собирающего буфера (10% (мас./об.) Цвиттергент[3-(n,N-диметилмиристиламмоний)-пропансульфонат], 10% (об./об.) Тритон X-100, 500 мМ Трис рН 8,3)и наносили на предметные стекла. После инкубирования в течение 10 мин предметные стекла промывали в дистиллированной воде и добавляли 1 мг/мл Тиазолил голубого тетразолиума бромида (МТТ) в 7 Н 9, среда OADC, и инкубировали в течение 30 мин при комнатной температуре. После промывания в дистиллированной воде жизнеспособные микобактерии рассматривали под микроскопом. Результаты. Краситель МТТ откладывается в виде нерастворимого синего/черного пятна в жизнеспособных микроорганизмах, собранных на предметных стеклах, покрытых p-DADMAC, позволяя выявлять жизнеспособные микроорганизмы с помощью микроскопии (см. фиг. 4). Заключение. Этот пример демонстрирует, что микобактерии могут быть собраны на предметных стеклах, покрытых p-DADMAC, и что эти собранные микобактерии остаются жизнеспособными и могут быть окрашены витальными красителями, такими как МТТ. Пример 13. Способ для использования со слизистой мокротой. Обоснование. Некоторые образцы мокроты могут быть очень густыми и слизистыми с высокой концентрацией мукополисахаридов, которые в высокой степени поперечно связаны ковалентными сульфидными мостиками и наполнены карбоксильными группами. Рассматривалось применение восстановителей, таких как дитиотеитол и N-ацетилцистеин для разрушения дисульфидных связей, но мукополисахариды в высокой концентрации все же могут мешать сбору микобактерий посредством взаимодействия отрицательно заряженных карбоксильных групп с положительно заряженным pDADMAC. Чтобы уменьшить это ингибирование, может быть целесообразным проводить сбор при низком рН - при рН,при котором карбоксильные группы нейтрализуются, но pDADMAC остается заряженным. При таких низких рН было бы невозможным собирать pDADMAC на карбоксильных бусах, поскольку они тоже потеряли бы свой заряд, следовательно, при низком рН карбоксильные бусы должны быть заменены на сульфатные бусы, которые остаются отрицательно заряженными в условиях, при которых карбоксильные бусы становятся нейтральными. Эти условия были протестированы для сбора Mycobacterium tuberculosis из мокроты, поставляемой банком мокроты Всемирной организации здравоохранения. Способ. 1. На аминные бусы BioMag (ВМ 546, Bangs Laboratories Inc., US) сначала наносили покрытие в 5%(об/об) pDADMAC (высокой молекулярной массы) в dH2O в течение 1 ч, затем после промывания в dH2O сверху покрывали 10 мг/мл декстран сульфатом (ММ 500000) в течение 1 ч в dH2O. После промывания вdH2O бусы ресуспендировали в исходном объеме dH2O и затем они были готовы к использованию.- 13016156 2. 0,5 мл образцов гнойной мокроты (либо положительной, либо отрицательной в отношении микобактерий по данным микроскопии) тестировали в течение 20 мин с 2% (мас./об.) конечного дитиотреитола. В качестве положительного контроля в несколько образцов мокроты также было добавлено известное количество культивированных БЦЖ до обработки. 3. После этой обработки, добавляли 50 мкл 10% (об/об) Тритона Х-100, 10 мМ EDTA, 20 мкл 0,004% (об/об) pDADMAC (MM 500000) и 50 мкл 2, 5 М HCl и инкубировали в течение 10 мин. Ожидается, что рН на этой стадии составлял приблизительно 0,6. 4. Затем добавляли 20 мкл парамагнитных бус, покрытых декстран сульфатом, и инкубировали в течение 10 мин. 5. Бусы собирали магнитом, промывали в 1 мл dH2O (эта стадия промывания обычно не требовалась бы, но проводилась для того, чтобы продемонстрировать активный захват микобактерий), ресуспендировали в 10 мкл dH2O и наносили на предметное стекло. Предметные стекла обрабатывали для проведения флуоресцентной микроскопии микобактерий с аурамин-фенолом, как описано в примере 10. Результаты. Десять образцов мокроты, которые по сообщениям банка мокроты ВОЗ были отрицательными в отношении микобактерий туберкулеза, были отрицательными после проведения сбора и микроскопического анализа. Десять образцов мокроты, которые по сообщениям банка мокроты ВОЗ, были положительными, были явно положительными, как были контроли, в которые были добавлены БЦЖ. Более того,контрольные образцы указывали на высокую эффективность извлечения микобактерий из мокроты, по оценкам сравнительной микроскопии, что было извлечено 90-95% внесенных микобактерий. Заключение Для густых слизистых образцов сбор микобактерий хорошо проходил при рН, который был достаточно низким для нейтрализации групп карбоновой кислоты на мукополисахаридах. В этом описании, если явным образом не указано иное, слово "или" используется в смысле оператора, который отражает истинное значение, когда встречается любое из двух или оба указанных состояния, в противоположность оператору "исключительно или", для которого требуется, чтобы встречалось только одно из условий. Слово "содержащий" используется в смысле "включающий", а не в смысле "состоящий из". Все предшествующие сведения приняты во внимание выше, тем самым включены в качестве ссылки. Никакое подтверждение любого ранее опубликованного документа здесь не должно рассматриваться, как признание или представление того, что сведения этого документа являлись общедоступным известным уровнем техники в Австралии или в другом месте на эту дату. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения из образца микроорганизмов, имеющих гидрофобную поверхность, причм данными микроорганизмами являются микобактерии, который включает контактирование микроорганизмов с собирающим реагентом, который имеет как гидрофобные свойства, за счт чего собирающий реагент связывается с указанными микобактериями, посредством гидрофобного взаимодействия с ними,так и полярные свойства, и который представляет собой полидиаллилдиметиламмония хлорид (полиDADMAC), при этом указанный собирающий реагент либо находится на поверхности и собирает на не указанные микобактерии, либо находится в растворе, и в этом случае указанный способ дополнительно включает сбор указанных микобактерий на поверхности путм связывания указанного собирающего реагента с указанной поверхностью посредством полярного взаимодействия между указанной поверхностью и указанным собирающим реагентом. 2. Способ по п.1, отличающийся тем, что указанный собирающий реагент является катионным. 3. Способ по п.2, отличающийся тем, что указанный полидиаллилдиметиламмония хлорид (DADMAC) имеет молекулярную массу от около 200000 до 500000. 4. Способ получения из жидкого образца микроорганизмов, имеющих гидрофобную поверхность,причм данными микроорганизмами являются микобактерии, который включает контактирование микроорганизмов с растворимым собирающим реагентом, который содержит поли-DADMAC, за счт чего собирающий реагент связывается с указанными микобактериями, и сбор указанных микроорганизмов на поверхности путм связывания указанного собирающего реагента с указанной поверхностью. 5. Способ по любому из предшествующих пунктов, отличающийся тем, что образец приводят в контакт с собирающим реагентом в присутствии детергента, который усиливает селективность связывания желаемых микроорганизмов. 6. Способ по п.5, отличающийся тем, что указанный детергент содержит аминокислотный амид жирной кислоты. 7. Способ по п.5, отличающийся тем, что указанный детергент содержит N-лауроилсаркозин. 8. Способ по любому из пп.5-7, отличающийся тем, что указанный детергент содержит детергент Тритон X. 9. Способ выявления микроорганизма, включающий сбор указанного микроорганизма на поверхности способом по любому из предыдущих пунктов, промывание указанных собранных микроорганизмов и- 14016156 выявление указанного собранного микроорганизма на указанной поверхности или после удаления с не. 10. Способ по п.9, отличающийся тем, что определяют жизнеспособность указанных собранных микроорганизмов. 11. Способ по п.10, отличающийся тем, что указанные собранные микроорганизмы обрабатывают лекарственным средством и определяют жизнеспособность этих микроорганизмов для установления влияния этого лекарственного средства на жизнеспособность указанного микроорганизма. 12. Набор для исследования микроорганизмов, содержащий либо (а) растворимый собирающий реагент, имеющий как гидрофобные свойства, за счт чего собирающий реагент способен связываться с выявляемыми микобактериями посредством гидрофобного взаимодействия с ним, так и полярные свойства,при этом указанный собирающий агент представляет собой поли-DADMAC, субстрат, имеющий поверхность для сбора указанных микобактерий на указанной поверхности, посредством связывания указанного собирающего реагента с указанной поверхностью путм полярного взаимодействия между указанной поверхностью и указанным собирающим реагентом, либо (b) собирающий реагент, иммобилизованный на тврдой поверхности, при этом указанный собирающий реагент, имеющий как гидрофобные, так и полярные свойства, за счет чего он способен связываться с выявляемым микобактериями, представляет собой поли-DADMAC и по меньшей мере одно из следующих компонентов: фаг, способный инфицировать указанные микобактерии; праймеры для проведения амплификации геномной нуклеиновой кислоты указанных микобактерий или указанного фага; питательную среду для культивирования указанных микобактерий; краситель для визуализации указанных микобактерий для микроскопического исследования; антитело для связывания указанных микобактерий; и возможно также содержит питательную среду для культивирования указанных микобактерий; детектирующий реагент для использования при выявлении метаболита, продуцируемого при культивировании указанных микобактерий; детектирующий агент, предназначенный для определения жизнеспособности указанных микобактерий; и/или один или несколько препаратов, которые потенциально могут повлиять на жизнеспособность указанных микобактерий. 13. Набор по п.12, отличающийся тем, что указанный собирающий реагент представляет собой поли-DADMAC, имеющий молекулярную массу от около 200000 до 500000. 14. Набор по п.12 или 13, отличающийся тем, что указанный фаг, указанные праймеры, указанное антитело или указанный детектирующий агент специфичны для идентификации комплекса М. tuberculosis, M. avium, M. intracellulare, M. paratuberculosis, М. leprae, М. kansasii, M. marinum или М. fortuitum. 15. Набор по любому из пп.12-14, отличающийся тем, что указанный набор содержит детектирующий агент, специфичный в отношении жизнеспособных микроорганизмов. 16. Набор по любому из пп.12-14, отличающийся тем, что указанный набор содержит одно или несколько лекарственных средств, потенциально способных оказывать влияние на жизнеспособность указанных микроорганизмов.
МПК / Метки
МПК: G01N 33/543
Метки: подобных, микроорганизмов, микобактериям, захват
Код ссылки
<a href="https://eas.patents.su/19-16156-zahvat-mikroorganizmov-podobnyh-mikobakteriyam.html" rel="bookmark" title="База патентов Евразийского Союза">Захват микроорганизмов, подобных микобактериям</a>
Предыдущий патент: Получение β-лактамовых антибиотиков
Следующий патент: Способ пропитывания пористых объектов
Случайный патент: Структурированная система мониторинга и управления инженерным оборудованием объекта