Способ и устройство для электрохимического извлечения меди с использованием анодной реакции двухвалентного/трехвалентного железа
Номер патента: 11201
Опубликовано: 27.02.2009
Авторы: Кук Пол Р., Сандовал Скот П., Робинсон Тимоти Дж.
Формула / Реферат
1. Способ электрохимического извлечения меди, включающий формирование электрохимической ячейки, содержащей по меньшей мере один проточный анод и по меньшей мере один плоский катод, в которой указанный катод имеет участок активной поверхности; обеспечение потока электролита через коллектор в указанную электрохимическую ячейку таким образом, что электролит протекает через по меньшей мере один проточный анод и контактирует по меньшей мере с одним плоским катодом, причем указанный электролит содержит медь и водорастворимое двухвалентное железо; окисление по меньшей мере части указанного водорастворимого двухвалентного железа в указанном электролите по меньшей мере на одном проточном аноде для преобразования двухвалентного железа в трехвалентное железо; удаление по меньшей мере части указанной меди из указанного электролита по меньшей мере на одном плоском катоде; и работу указанной электрохимической ячейки при напряжении меньше чем приблизительно 1,5 В и плотности тока больше чем приблизительно 280 А/м2 на активном плоском катоде.
2. Способ по п.1, в котором указанная стадия обеспечения потока электролита через указанную электрохимическую ячейку включает обеспечение расхода электролита приблизительно от 4,0 до 40,0 л/мин/м2 через активный плоский катод.
3. Способ по п.1, в котором указанная стадия окисления включает окисление по меньшей мере части указанного водорастворимого духвалентного железа в указанном электролите на проточном аноде, содержащем титановую сетку, имеющую электрохимически активное покрытие.
4. Способ по п.1, в котором указанная стадия обеспечения потока электролита включает создание потока электролита, имеющего концентрацию железа приблизительно от 10 до 60 г/л.
5. Способ по п.1, в котором указанная стадия обеспечения потока электролита дополнительно включает поддержание температуры указанного электролита в диапазоне приблизительно от 43 до около 82шС.
6. Способ по п.1, в котором указанная стадия обеспечения потока электролита дополнительно включает поддержание температуры указанного электролита ниже 66шС.
7. Способ по п.1, дополнительно включающий следующие стадии: удаление по меньшей мере части указанного трехвалентного железа из указанной электрохимической ячейки в возвратный поток электролита;
восстановление по меньшей мере части указанного трехвалентного железа в указанном возвратном потоке электролита в двухвалентное железо, чтобы сформировать регенерационный расход электролита; и
возврат по меньшей мере части указанного возвратного потока электролита в указанную электрохимическую ячейку.
8. Способ по п.7, в котором указанная стадия восстановления по меньшей мере части указанного трехвалентного железа включает контакт указанного двухвалентного железа с восстановителем в присутствии катализатора.
9. Способ электрохимического извлечения меди из потока электролита, содержащего медь и двухвалентное железо, включающий формирование электрохимической ячейки, содержащей по меньшей мере один анод и по меньшей мере один катод, в котором двухвалентное железо окисляется на аноде, чтобы сформировать трехвалентное железо, при этом медь выделяется в виде металлического покрытия на катоде, и в котором указанный катод имеет участок активной поверхности, причем по меньшей мере один проточный анод и коллектор для ввода электролита обеспечивают эффективную циркуляцию указанного потока электролита в указанной электрохимической ячейке, а поток электролита проходит через по меньшей мере один проточный анод и контактирует по меньшей мере с одним катодом, причем работу указанной электрохимической ячейки осуществляют при напряжении ячейки менее чем приблизительно 1,5 В при плотности тока более 280 А/м2 активного плоского катода.
10. Способ по п.9, отличающийся тем, что дополнительно обеспечивают эффективную циркуляцию электролита, создавая поток электролита через указанную электрохимическую ячейку с расходом приблизительно от 4,0 до 40 л/мин/м2 плоского катода.
11. Способ по п.9, отличающийся тем, что дополнительно включает удаление по меньшей мере части указанного трехвалентного железа из указанной электрохимической ячейки в возвратном потоке электролита;
восстановление по меньшей мере части указанного трехвалентного железа в указанном возвратном потоке электролита в двухвалентное железо и
возврат по меньшей мере части указанного возвратного потока электролита в указанную электрохимическую ячейку.
12. Устройство для электрохимического извлечения меди из потока электролита, содержащего медь и железо, в котором концентрация железа составляет приблизительно от 10 до 60 г/л, содержащее электрохимическую ячейку, включающую по меньшей мере один проточный анод, по меньшей мере один плоский катод и коллектор электролита, причем указанные элементы расположены таким образом, что поток электролита проходит через по меньшей мере один проточный анод и контактирует по меньшей мере с одним катодом.
13. Устройство по п.12, в котором указанный поток электролита содержит двухвалентное железо и трехвалентное железо и в котором концентрация трехвалентного железа в указанном потоке электролита составляет приблизительно от 0,001 до 10 г/л.
14. Устройство по п.12, в котором указанный поток электролита содержит двухвалентное железо и трехвалентное железо и в котором концентрация трехвалентного железа в указанном потоке электролита составляет приблизительно от 1 до 6 г/л.
15. Устройство по п.12, в котором указанный поток электролита содержит двухвалентное железо и трехвалентное железо и в котором концентрация трехвалентного железа в указанном потоке электролита составляет приблизительно от 2 до 4 г/л.
16. Устройство по п.12, дополнительно содержащее средства для восстановления по меньшей мере части указанного трехвалентного железа в указанном потоке электролита в двухвалентное железо путем контакта указанного трехвалентного железа с сернистым ангидридом в присутствии катализатора.
17. Устройство по п.12, в котором указанная электрохимическая ячейка содержит по меньшей мере один проточный анод, имеющий металлическую сетку, снабженную электрохимически активным покрытием.
18. Устройство по п.17, в котором указанная электрохимическая ячейка содержит по меньшей мере один анод, имеющий титановую сетку, снабженную покрытием на основе окиси иридия.
19. Устройство по п.17, в котором указанная электрохимическая ячейка содержит, по меньшей мере, титановую сетку, снабженную покрытием на основе окиси рутения.
20. Способ электрохимического извлечения меди, включающий
формирование электрохимической ячейки, содержащей по меньшей мере один проточный анод и по меньшей мере один плоский катод, в которой указанный плоский катод имеет участок активной поверхности;
формирование потока электролита через указанную электрохимическую ячейку, причем указанный электролит содержит медь и водорастворимое двухвалентное железо и в котором указанный поток электролита поступает в указанную электролитическую ячейку через коллектор электролита, содержащий множество впускных отверстий, причем поток электролита проходит через по меньшей мере один проточный анод и контактирует по меньшей мере с одним катодом;
осуществление окисления по меньшей мере части указанного водорастворимого двухвалентного железа в указанном электролите, по меньшей мере в одном проточном аноде от двухвалентного железа до трехвалентного железа;
удаление по меньшей мере части указанной меди из указанного электролита по меньшей мере у одного плоского катода и
эксплуатацию указанной электролитической ячейки при напряжении менее 1,5 В и плотности тока больше чем приблизительно 280 А на квадратный метр активного плоского катода.
21. Способ по п.20, в котором через указанное множество впускных отверстий поток электролита поступает по меньшей мере из одного пола и потолка электролитической ячейки.
22. Способ по п.3, в котором указанный металлический сетчатый анод имеет множество впускных отверстий.
Текст
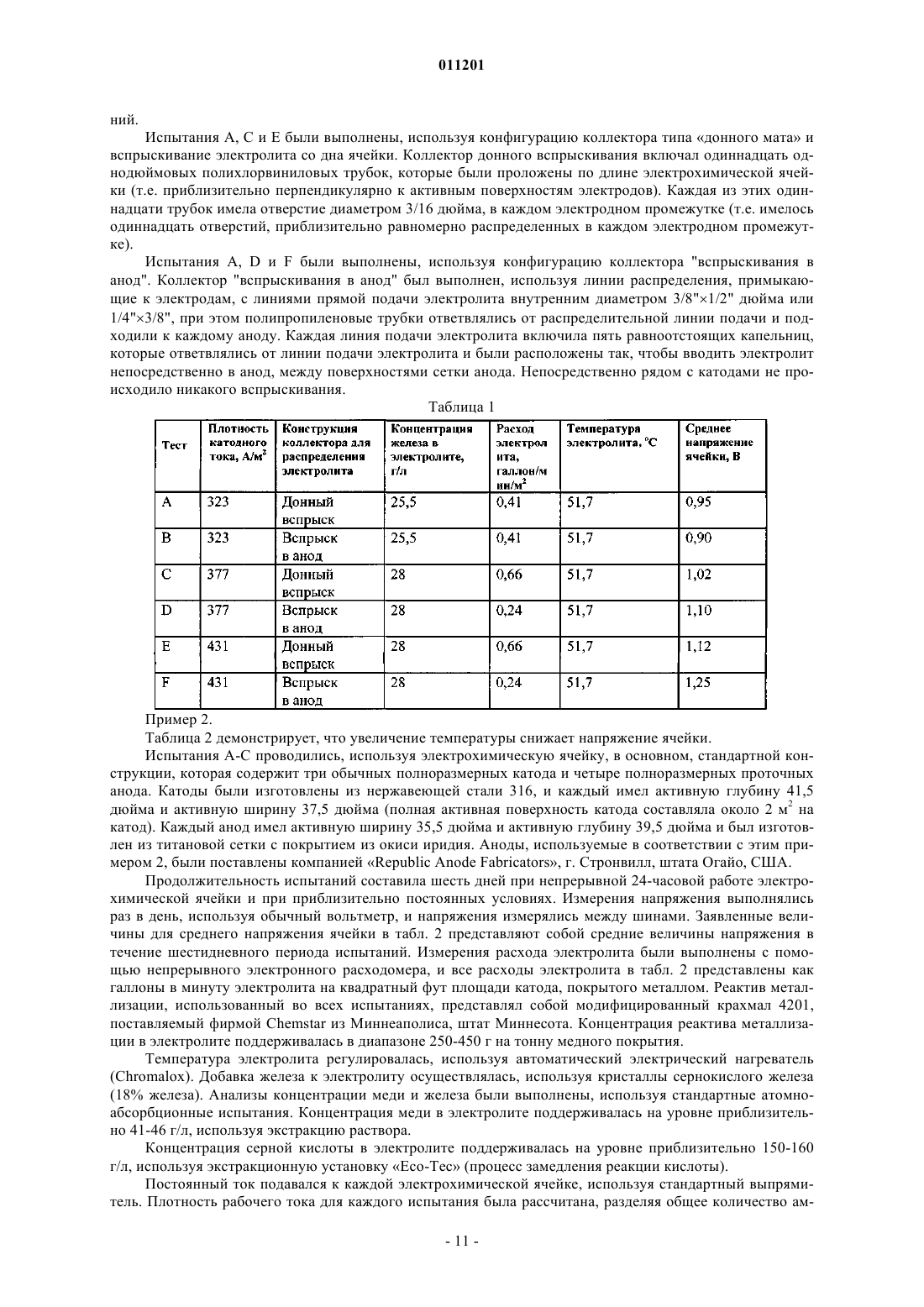
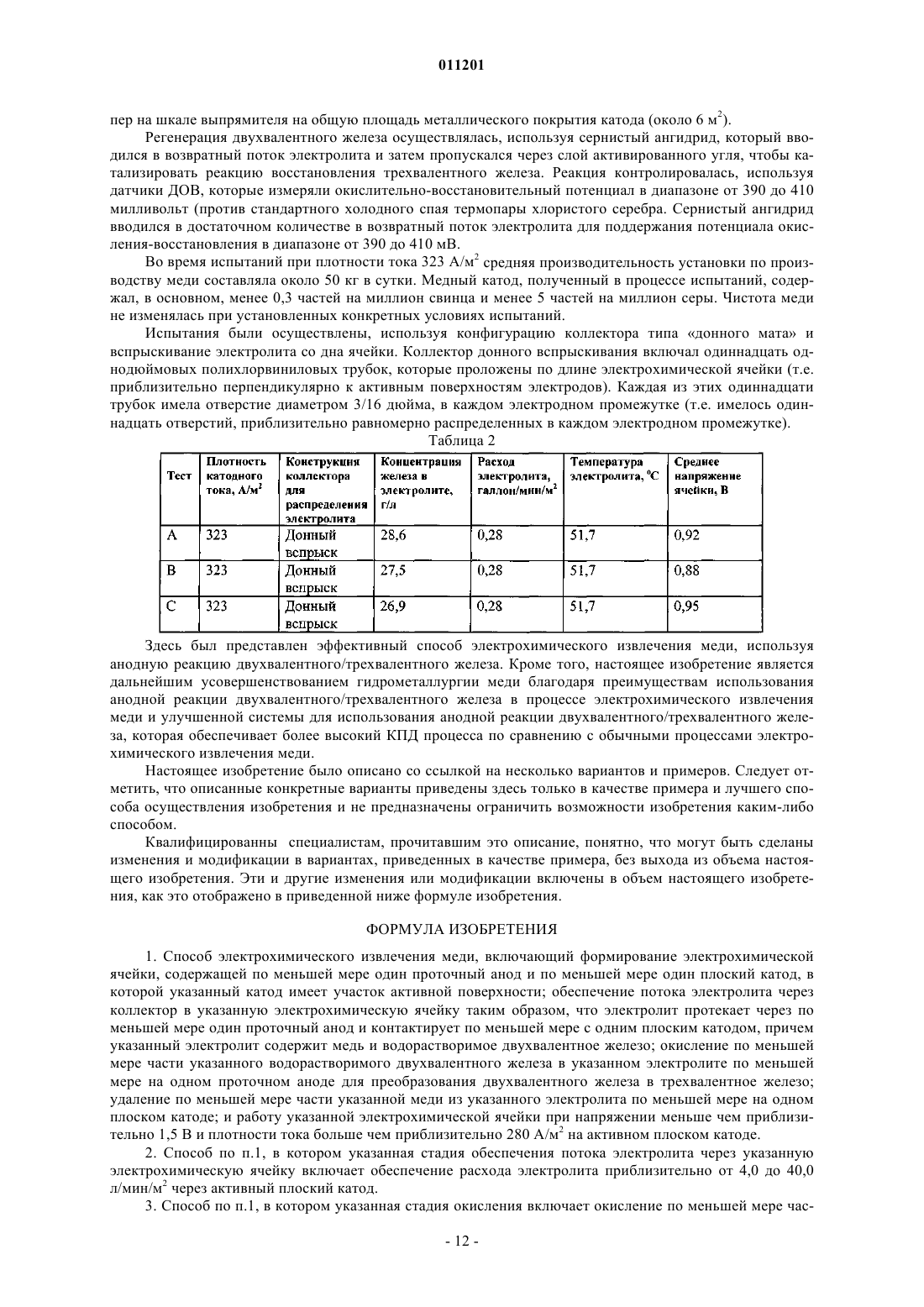
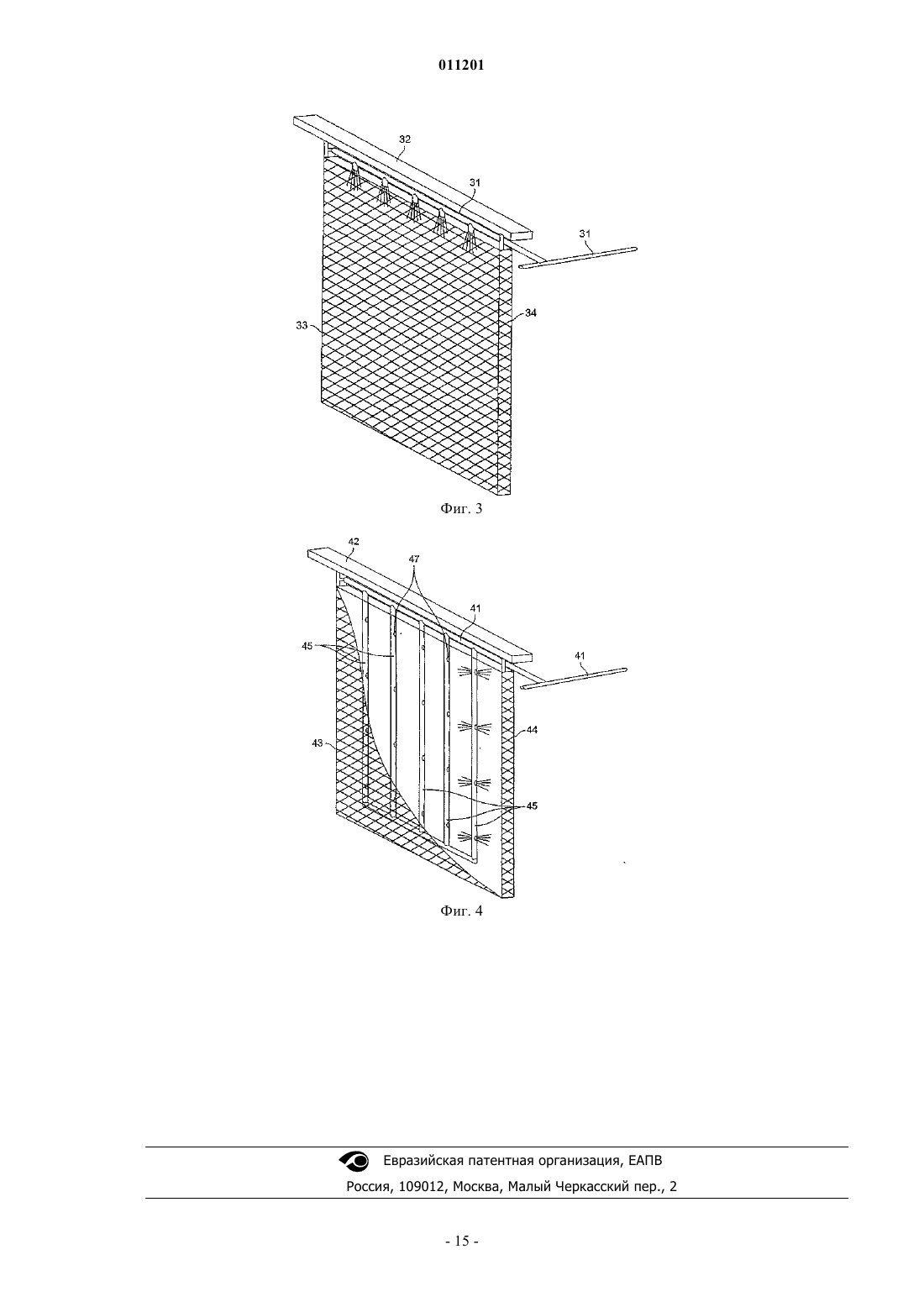
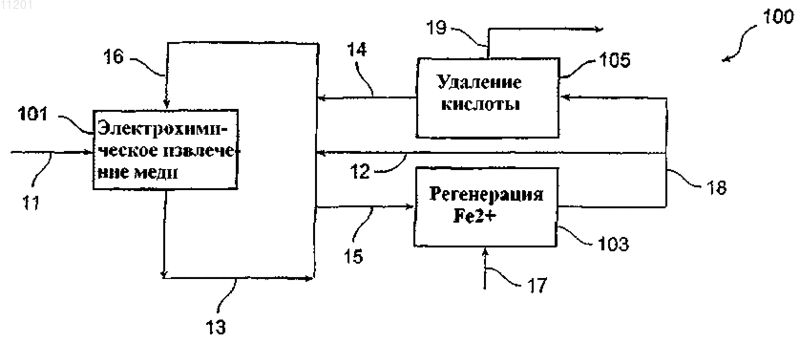
011201 Область изобретения Настоящее изобретение относится, в основном, к способу и устройству для электрохимического извлечения металлов и, более точно, к способу и устройству для электрохимического извлечения меди,используя анодную реакцию двухвалентного/трехвалентного железа. Предпосылки создания изобретения Эффективность и рентабельность электрохимического извлечения меди являются и в течение долгого времени будут являться очень важными показателями конкурентоспособности отечественной медной промышленности. Прошлые научно-исследовательские усилия в этой области были направлены, по меньшей мере, частично на создание механизмов снижения общего потребления энергии в процессе электрохимического извлечения меди, которое непосредственно влияет на рентабельность этого процесса. При обычном электрохимическом извлечении меди, в котором медь, покрывающая загрязненный анод, переносится на существенно более чистый катод в водном электролите, происходит по следующим реакциям: Катодная реакция:Cu2+ + SO42 + 2eCu0 + SO42- (E0= +0,345 V) Анодная реакция: Н 2 О- 1/2 О 2+2 Н 2 е- (Е 0= -1,230 V) Полная реакция элетролитической ячейки:Cu2SO42-+ Н 2 ОCu0 + 2 Н+ + SO42- + 1/2 О 2 (Е 0= -0,855 V). Однако обычное электрохимическое извлечение меди согласно вышеупомянутым реакциям указывает на несколько областей потенциального усовершенствования процесса для улучшения экономических показателей, увеличения эффективности и уменьшения выделения кислотных паров. На первой стадии при обычном электрохимическом извлечении меди, разложение в воде у анода приводит к образованию газообразного кислорода (О 2). При этом освобожденные пузырьки газообразного кислорода разбивают поверхностную пленку ванны электролита и выделяют пары кислоты. Желательно снизить или устранить выделение кислотных паров. На второй стадии разложение веществ в водной анодной реакции,используемой при обычном электрохимическом извлечении, вносит значительный вклад в полное напряжение ячейки через потенциал равновесия анодной реакции и перенапряжение. Разложение воды при анодной реакции создает стандартный потенциал 1,23 вольт (В), который вносит свой вклад в полное напряжение, требуемое для обычного процесса электрохимического извлечения меди. Как правило, полное напряжение ячейки составляет приблизительно 2,0 В. Уменьшение потенциала равновесия реакции у анода и/или перенапряжения снизило бы напряжение ячейки и, таким образом, сэкономило бы энергию и существенно снизило бы эксплуатационные расходы процесса электрохимического извлечения. Был найден один способ, который потенциально может снизить потребление энергии для электрохимического извлечения меди. Способ состоит в использовании анодной реакции двухвалентного/трехвалентного железа, которая протекает следующим образом: Катодная реакция:Cu2SO42-+ 2Fe2+Cu0 + 2Fe3+ + SO42- (E0= -0,425 V). Трехвалентное железо, полученное у анода в результате этой полной реакции ячейки, может быть снова восстановлено до двухвалентного железа, используя сернистый ангидрид: реакция раствора: 2Fe3+ +SO2 + 2 Н 2 О 2Fe2+ +4 Н+ + SO42-. Использование анодной реакции двухвалентного/трехвалентного железа в электролитических ячейках для электрохимического извлечения меди помогает снизить затраты энергии в этих ячейках по сравнению с обычными электролитическими ячейками для электрохимического извлечения меди, в которых используется разложение воды при анодной реакции, так как окисление двухвалентного железа (Fe2+) в трехвалентное железо (Fe3+) происходит при более низком напряжении, чем требуется для разложения воды. Однако максимальное снижение напряжения и, следовательно, максимальная экономия энергии не может быть достигнута, используя анодную реакцию двухвалентного/трехвалентного железа, если не обеспечить эффективное взаимодействие двухвалентного железа и трехвалентного железа у анода ячейки. Это объясняется тем, что окисление двухвалентного железа в трехвалентное железо в медном электролите является реакцией, управляемой процессами диффузии. Этот принцип был признан и применен,среди прочих, Исследовательским центром Горного Бюро США в г. Рино, штат Пенсильвания, и другими. В патенте США 5492608 заявлен "Коллектор циркуляции электролита для электролитических ячеек в процессе электрохимического извлечения меди, в котором используется анодная реакция двухвалентного/трехвалентного железа". Хотя, в основном, использование анодной реакции двухвалентно-1 011201 го/трехвалентного железа при электрохимическим извлечением меди известно, существующие системы имеют ряд недостатков, связанных с практической реализацией анодной реакции двухвалентного/трехвалентного железа в процессах электрохимического извлечения меди. В частности, предыдущие варианты анодной реакции двухвалентного/трехвалентного железа в процессе электрохимического извлечения меди, в основном, характеризуются ограниченной плотностью рабочего тока, в значительной степени, в результате неспособности получить достаточно высокую скорость диффузии двухвалентного железа к аноду и трехвалентного железа от анода. Иначе говоря, эти предыдущие технические решения не обеспечивали оптимальной передачи ионов двухвалентного железа к аноду и ионов трехвалентного железа от анода (или анодов) в электрохимической ячейке. Кроме того, известные устройства, в которых используется анодная реакции двухвалентного/трехвалентного железа, не обеспечивают экономичность производства медных катодов в электрохимических ячейках, в которых используются, в основном,обычные конструктивные решения. Краткое описание изобретения Настоящее изобретение относится к улучшенному процессу электрохимического извлечения меди и к устройству, предназначенному для устранения вышеуказанных недостатков известных систем электрохимического извлечения. Раскрытые здесь улучшенный процесс и устройство являются значительным усовершенствованием прототипов, поскольку они представляют собой улучшенную систему электрохимического извлечения меди, в которой используется анодная реакция двухвалентного/трехвалентного железа в сочетании с другими аспектами изобретения, что обеспечивает значительное повышение КПД процесса электрохимического извлечения, снижение потребления энергии и уменьшение выделения кислотных паров по сравнению с обычными процессами электрохимического извлечения меди и предыдущими попытками использовать анодную реакцию двухвалентного/трехвалентного железа в процессе электрохимического извлечения меди. Используемый здесь термин "альтернативная анодная реакция " относится к анодной реакции двухвалентного/трехвалентного железа, а термин "альтернативный процесс анодной реакции" относится к любому процессу электрохимического извлечения, в котором используется анодная реакция двухвалентного/трехвалентного железа. Улучшенная циркуляции электролита между электродами в электрохимической ячейке облегчает движение ионов меди к катоду, увеличивает скорость диффузии двухвалентного железа к аноду и облегчает перенос трехвалентного железа от анода. Наиболее важно то, что в альтернативном процессе анодной реакции по мере увеличения скорости диффузии двухвалентного железа к аноду полное напряжение ячейки, в основном, уменьшается, приводя к уменьшению мощности, требуемой для электрохимического извлечения меди. В дальнейшем настоящее изобретение будет описано более подробно, в основном, в отношении использования проточного анода с эффективной системой циркуляции электролита, которая обеспечивает эффективный и рентабельный процесс электрохимического извлечения меди на основе анодной реакции двухвалентного/трехвалентного железа при полном напряжении ячейки менее 1,5 В и при плотности тока более чем приблизительно 26 ампер на квадратный фут (около 280 А/м 2) и уменьшает объем кислотных паров. Кроме того, такая система позволяет использовать низкие концентрации двухвалентного железа и оптимизированный расход электролита по сравнению с известными системами при создании коммерчески выгодного изделия высокого качества (т.е. медного катода сорта LME). В соответствии с одной целью примерного варианта изобретения, электрохимическая ячейка сконструирована таким образом, что электрохимическое извлечение меди может быть достигнуто в альтернативном процессе анодной реакции при поддержании плотности тока на активном катоде более чем приблизительно 26 ампер на квадратный фут (280 А/м 2). В соответствии с другой целью примерного варианта изобретения электрохимическая ячейка сконфигурирована таким образом, что напряжение ячейки в течение альтернативного процесса анодной реакции поддерживается на уровне менее чем приблизительно 1,5 В. В соответствии с еще одной целью примерного варианта изобретения альтернативный процесс анодной реакции используется таким образом, что концентрация железа в электролите поддерживается на уровне приблизительно от 10 до 60 г на литр. В соответствии с еще одной целью примерного варианта изобретения альтернативный процесс анодной реакции используется таким образом, что температура поддерживается на уровне приблизительно от 43 до 83 С. Эти и другие признаки и преимущества настоящего изобретения станут очевидными специалистам в данной области после чтения последующего подробного описания со ссылками на приложенные чертежи, на которых показаны и описаны различные примерные варианты изобретения. Краткое описание чертежей Предмет настоящего изобретения конкретно указан в заключительной части описания и приложенной формуле изобретения. Однако для полного понимания настоящего изобретения лучше всего ознакомиться с подробным описанием и с формулой изобретения, рассматриваемыми со ссылками на приложенные чертежи, на которых одинаковые элементы обозначены одними и теми же цифровыми позициями и на которых:-2 011201 фиг. 1 - технологическая схема электрохимического процесса в соответствии с одним вариантом настоящего изобретения; фиг. 2 иллюстрирует электрохимическую ячейку, выполненную таким образом, что она работает в соответствии с одним примерным вариантом настоящего изобретения; фиг. 3 - пример проточного анода с примером коллектора для ввода электролита в анод в соответствии с целью другого примерного варианта настоящего изобретения; на фиг. 4 - другой пример проточного анода с другим примером коллектора для ввода электролита в анодный в соответствии с целью другого примерного варианта настоящего изобретения. Подробное описание изобретения Настоящее изобретение выявляет существенные преимущества по отношению к известным техническим решениям, особенно в отношении эффективности процесса, экономичности и снижения выделения кислотных паров. Кроме того, известные процессы восстановления меди на основе обычных стадий электрохимического процесса могут в многих случаях быть легко модифицированы, чтобы получить коммерческую выгоду, которая обеспечивается настоящим изобретением. На фиг. 1 представлен электрохимический процесс и показаны различные узлы примерного варианта изобретения. Электрохимический процесс 100, в основном, включает стадию электрохимического извлечения 101, стадию регенерации двухвалентного железа 103 и стадию удаления кислоты 105. Богатый медью электролит 11 вводится на стадии электрохимического извлечения 101 для восстановления меди,содержащейся в нем. На стадии электрохимического извлечения 101 катодную медь (поток, не показан) и поток электролита, обогащенный трехвалентным железом 13. По меньшей мере часть потока электролита, обогащенная трехвалентным железом 13, вводится на стадии регенерации двухвалентного железа 103, как возвратный поток электролита 15. Коллекторный поток 16 содержит часть обогащенного трехвалентным железом потока электролита 13, который не передается на стадию регенерации двухвалентного железа 103, так же как и рециркулирующие потоки 12 и 14 от стадии регенерации двухвалентного железа 103 и стадии удаления кислоты 105, соответственно, и служат для регулирования расхода и как механизм перемешивания жидкости в соответствии с одной целью изобретения, обсуждаемой ниже. В основном, увеличение плотности рабочего тока в электрохимической ячейке увеличивает напряжение ячейки. Это увеличенное напряжения, в свою очередь, приводит к увеличению затрат энергии для получения меди, что влияет на рентабельность предприятия по электрохимическому извлечению металлов. С другой стороны, некоторые другие параметры в альтернативных процессах анодной реакции, например температура и концентрация железа в электролите могут регулироваться с тем, чтобы смягчить влияние повышенной плотности тока на напряжение ячейки. Например, когда температура электролита увеличивается, напряжение ячейки имеет тенденцию к снижению. Точно так же, увеличение концентрации железа в электролите имеет тенденцию к уменьшению напряжения в электролитических ячейках электрохимического устройства, в котором используется альтернативная анодная реакция. Однако эффект смягчения увеличения температуры и повышения концентрации железа при высоком напряжении ячейки ограничен. В основном, процессы и системы, основанные на различных вариантах настоящего изобретения,обеспечивают эффективное и рентабельное использование альтернативной анодной реакции при электрохимическом извлечении меди при напряжении ячейки приблизительно менее чем 1,5 В и при плотности тока приблизительно больше чем 26 ампер на квадратный фут (280 А/м 2). Кроме того, использование таких процессов и/или систем уменьшает плотность кислотных паров и позволяет использовать низкие концентрации двухвалентного железа в электролите и оптимизировать расход электролита по сравнению с известными системами при создании изделий высокого качества, пользующихся высоким спросом на рынке. Хотя в различных вариантах изобретения в электрохимической ячейке могут использоваться различные конфигурации и комбинации анодов и катодов, предпочтительно использовать проточный анод и создать циркуляцию электролита, используя коллектор электролита, способный поддерживать удовлетворительный расход и циркуляцию электролита в электрохимической ячейке. В соответствии с другими примерными вариантами изобретения система для осуществления альтернативного процесса анодной реакции включает электрохимическую ячейку, оборудованную по меньшей мере одним проточным анодом и по меньшей мере одним катодом, причем указанная ячейка сконфигурирована таким образом, что поток и циркуляция электролита в ячейке позволяет использовать эту ячейку при напряжении ячейки менее чем приблизительно 1,5 В и при плотности тока более чем приблизительно 26 А на квадратный фут (около 280 А/м 2). В соответствии с настоящим изобретением для ввода жидкого электролита могут быть использованы различные механизмы, как подробно описано ниже. Например, коллектор потока электролита может выполнен таким образом, что он вводит электролит непосредственно в анод, либо этот коллектор может быть выполнен в виде напольного мата или другого средства принудительной циркуляции. В соответствии с различными вариантами изобретения любой механизм потока электролита, который обеспечивает эффективную передачу двухвалентного железа к аноду, перенос трехвалентного желе-3 011201 за от анода и перенос ионов меди к катоду таким образом, что электрохимическая ячейка может использоваться при напряжении ячейки менее чем приблизительно 1,5 В и при плотности тока больше чем приблизительно 26 А на квадратный фут (около 280 А/м 2), является подходящим для реализации изобретения. Эти и другие цели настоящего изобретения обсуждены ниже более подробно. В соответствии с одной целью изобретения двухвалентное железо, например, в виде сернокислого железа (FeSO4) вводится в обогащенный медью электролит, который подвергается реакции электрохимического извлечения, при котором двухвалентное и трехвалентное железо (Fe2+/Fe3+) составляют пару для анодной реакции. При этом анодная реакция двухвалентного/трехвалентного железа заменяет разложение воды при анодной реакции. Как обсуждено выше, поскольку не выделяется никакого газообразного кислорода,полученного при анодной реакции двухвалентного/трехвалентного железа, пары кислоты в результате реакций в электрохимической ячейке не образуются. Кроме того, поскольку потенциал равновесияFe2+/Fe3 + пара (т.е., Eo = -0,770 В) меньше чем этот потенциал для разложения воды (т.е. Eo= -1,230 В),напряжение ячейки снижается, уменьшая, таким образом, затраты энергии, требуемые для работы ячейки. Кроме того, как обсуждено ниже более подробно, интенсивная циркуляция электролита между электродами увеличивает скорость диффузии трхвалентного железа к аноду. Поскольку скорость диффузии двухвалентного железа к аноду увеличивается, полное напряжение ячейки, в основном, уменьшается, снижая мощность, требуемую для электрохимического извлечения меди. В соответствии с одним примерным вариантом настоящего изобретения проточный анод с коллектором для вспрыскивания электролита встроен в ячейку, как показано на фиг. 2. Используемый здесь термин "проточный анод" относится к любому аноду, выполненному таким образом, что электролит свободно проходит через него. В то время как поток жидкости от коллектора обеспечивает движение электролита, проточный анод не препятствует электролиту в электрохимической ячейке протекать через анод во время электрохимического процесса. Использование "проточного анода" с вводом электролита через коллектор снижает напряжение ячейки при низком расходе электролита по сравнению с известными техническими решениями и при более низких концентрациях железа в электролите по сравнению с известными устройствами благодаря повышенной диффузии двухвалентного железа к аноду. В известных системах, например, делались попытки увеличить плотности тока в процессе электрохимического извлечения металла с помощью грубой силы, увеличивая расход электролита, температуру электролита и концентрацию железа в электролите. Однако в этих попытках была достигнута максимальная плотность тока только порядка 26 А на квадратный фут (около 280 А/м 2), и даже в этом случае средние напряжения ячейки были много выше 1,0 В. Используя проточный анод в комбинации с эффективным вводом электролита, создатели настоящего изобретатели могут вести процессы электрохимического извлечения при плотности тока 26 А на квадратный фут (около 280 А/м 2) и напряжениях ячейки значительно ниже 1,0 В,при существенном снижении расхода электролита и концентрации железа в электролите. Снижение концентрации железа без вредного воздействия на эффективность или качество электрохимического извлечения желательны с экономической точки зрения, потому что при этом понижаются требования к качеству железа и уменьшается температура насыщения сульфата электролита, снижая, таким образом, затраты на эксплуатацию электрохимической ячейки. В соответствии с различными целями примерных вариантов изобретения коллекторы для вспрыскивания электролита со стороны дна ячейки, вспрыскивания со стороны боковой стенки и/или вспрыскивания непосредственно "в анод" встроены в ячейку, чтобы увеличить диффузию двухвалентного железа. В примере 1 демонстрируется эффективность вспрыскивания электролита "в анод" через коллектор для снижения напряжения ячейки. В одном примерном варианте изобретения достигнуто полное напряжение ячейки величиной менее чем приблизительно 1,5 В, предпочтительно менее чем приблизительно 1,20 В или приблизительно 1,25 В и наиболее предпочтительно менее чем приблизительно 0,9 В или около 1,0 В. Вообще говоря, поскольку плотность рабочего тока в электрохимической ячейке увеличивается,скорость осаждения медного покрытия также увеличивается. Иными словами, при увеличения плотности рабочего тока производится большее количество медного катода в течение данного промежутка времени и обеспечивается большая активность поверхности, чем в случае более низкой плотности рабочего тока. С другой стороны, путем увеличения плотности рабочего тока может быть произведено то же самое количество меди за данный промежуток времени, но с меньшей поверхностной активностью катода (т.е. можно использовать меньшее количество катодов или катоды меньшего размера, чтобы снизить капитальные и эксплуатационные затраты). При увеличении плотности благодаря использованию анодной реакции двухвалентного/трехвалентного железа напряжение ячейки имеет тенденцию частично повышаться из-за истощения ионов двухвалентного железа на поверхности анода. Это можно компенсировать, увеличивая перенос ионов двухвалентного железа к аноду при увеличении плотности тока, чтобы поддержать низкое напря-4 011201 жение ячейки. В известных устройствах во время процесса электрохимического извлечения меди, используя анодную реакцию двухвалентного/трехвалентного железа, плотности тока были ограничены величиной 26 А на квадратный фут (около 280 А/м 2) и ниже, в значительной степени из-за ограничений,связанных с переносом двухвалентного железа. Иначе говоря, предыдущие попытки, в которых увеличивали расход электролита и концентрацию железа в электролите, чтобы достичь высокой плотности тока,не могли обеспечить снижение полного напряжения ячейки. Различные варианты настоящего изобретения позволяют работать при плотности тока значительно выше чем 26 ампер на квадратный фут (около 280 А/м 2) при поддержании напряжения ячейки менее чем приблизительно 1,5 В. Как будет описано ниже более подробно, примерные варианты настоящего изобретения позволяют использовать электрохимические ячейки для проведения анодной реакции двухвалентного/трехвалентного железа при плотности тока приблизительно от 280 до 350 А/м 2 при напряжениях ячейки менее чем приблизительно 1,0 В; до 400 А/м 2 при напряжениях ячейки менее чем приблизительно 1,25 В и до 538 А/м 2 или выше при напряжениях ячейки менее чем 1,5 В. В соответствии с примерным вариантом изобретения плотность тока составляет приблизительно от 20 до 50 ампер на квадратный фут активного катода (приблизительно от 215 до 538 А/м 2). Плотность тока поддерживается предпочтительно больше чем 26 ампер на квадратный фут (около 280 А/м 2) и наиболее предпочтительно больше чем приблизительно 30 ампер на квадратный фут (323 А/м 2) активного катода. Однако следует отметить, что максимальная плотность рабочего тока, достижимая в соответствии с различными вариантами настоящего изобретения, будет зависеть от определенной конфигурации устройства и, таким образом, плотность рабочего тока более 538 А/м 2 активного катода вполне может быть достигнута в рамках настоящего изобретения. Одно ясное преимущество процессов, осуществляемых в соответствии с различными вариантами настоящего изобретения, состоит в том, что более высокая плотность тока по сравнению с известными техническими решениями является достижимой при том же самом напряжении ячейки с использованием проточного анода с принудительным вспрыскиванием электролита через коллектор. Например, специалисты Горного бюро США, как сообщается в отчете С.П. Сандовала и других Анодная реакция для электрохимического извлечения меди в отчете конференции Proceedings of Copper 95-COBRE 95 International Conference, том. III, стр. 423-435 (1995 г.) достигли плотности тока только приблизительно 258 А/m2 в экспериментах, в которых ячейка электрохимического извлечения использовалась непрерывно в течение пяти дней с двумя обычными катодами и тремя обычными анодами (т.е. с "непроточными" анодами) и с коллектором для ввода электролита со стороны боковой стенки. Расход электролита составлял приблизительно 0,24 грамма на кв. фут, и температура электролита была приблизительно равна 40 С. Концентрация железа в электролите при измерении составляла приблизительно 28 г/л, и среднее напряжение ячейки в течение пятидневного испытательного периода было равно 0,94 В. Однако результаты экспериментального испытания, выполненного в соответствии с примерным вариантом настоящего изобретения, ясно демонстрируют преимущества настоящего изобретения по сравнению с прототипом. При этом испытании плотность тока составляла около 323 А/м 2, т.е. на двадцать пять процентов больше, чем плотность тока, достигнутая в Горном бюро США с использованием электрохимической ячейки с тремя обычными катодами и четырьмя анодами "проточного" типа (в данном случае, сеточные титановые аноды с покрытием из окиси иридия) и с циркуляционным коллектором для донного ввода. Концентрация электролита, расход электролита, температура и напряжение ячейки были аналогичны тем, которые использовались в Горном бюро США. Далее, иллюстрируя преимущества настоящего изобретения, приведенный здесь пример 1 демонстрирует, что напряжения ячейки приблизительно 1,0 В и приблизительно 1,25 В могут быть достигнуты при плотности тока приблизительно 377 А/м 2 и приблизительно 430 А/м 2, соответственно. В обычных процессах электрохимического извлечения, где для анодной реакции используется разложение воды, смешивание электролита и пропускание потока электролита через электрохимическую ячейку достигается путем циркуляции электролита через электрохимическую ячейку и путем создания пузырьков кислорода в аноде, которые вызывают перемешивание раствора электролита по мере того, как пузырьки кислорода поднимаются к поверхности электролита в ячейке. Однако, поскольку анодная реакция двухвалентного/трехвалентного железа не создает пузырьков кислорода в аноде, циркуляция электролита является основным источником смешивания в электрохимической ячейке. Создатели настоящего изобретения усовершенствовали прототип, создав электрохимическую ячейку, выполненную таким образом, что она позволяет существенно увеличить перенос веществ между анодом (т.е. ионы двухвалентного/трехвалентного железа) и катодом (т.е. ионы меди), увеличив поток электролита и улучшив характеристики циркуляции при использовании альтернативной анодной реакции. Интенсивная циркуляция электролита между электродами увеличивает скорость передачи ионов к поверхностям электродов и от них (например, ионов меди к катоду, ионов двухвалентного железа к аноду и ионов трехвалентного железа от анода), что, в основном, снижает полное напряжение ячейки. Снижение напряжения ячейки, в свою очередь, снижает потребление энергии для электрохимического процесса. Однако интенсивная циркуляция электролита требует увеличения мощности насосной системы для подачи электролита.-5 011201 Таким образом, цели снижения напряжения ячейки и увеличения циркуляции электролита предпочтительно должны быть сбалансированы. В соответствии с одной целью примерного варианта изобретения полная мощность электрохимической ячейки может быть оптимизирована, если свести к минимуму сумму мощностей, требуемых для циркуляции электролита через электрохимическую ячейку, и мощности, требуемой для образования меди на катоде. На фиг. 2 показана электрохимическая ячейка 200, отвечающая различным целям примерного варианта изобретения. Электрохимическая ячейка 200, в основном, содержит ячейку 21, по меньшей мере один анод 23, по меньшей мере один катод 25 и коллектор потока электролита 27, включающий множество нагнетательных отверстий 29, распределенных по меньшей мере по части ячейки 21. В соответствии с одной целью изобретения электрохимическая ячейка 200 содержит устройство для выполнения стадии электрохимического извлечения 101 в электрохимическом процессе 100, показанном на фиг. 1. Эти и другие примерные варианты обсуждены ниже более подробно. В соответствии с одним аспектом примерного варианта настоящего изобретения анод 23 выполнен таким образом, что он проницаем для потока электролита. Используемый здесь термин "проточный анод" относится к аноду, конструкция которого соответствует одному варианту настоящего изобретения. Любой ныне известный или изобретенный в будущем проточный анод может использоваться в соответствии в настоящем изобретении. Возможные конфигурации включают, но не ограничены этим, металлическую вату или ткань, пористую металлическую структуру, металлическую сетку, множество металлических полосок, множество металлических проводов или прутков, перфорированные металлические листы и т.д. или их комбинации. Кроме того, конструкция анода не ограничена плоской конфигурацией, но может включать любую подходящую мультипланарную геометрическую конфигурацию. Не вдаваясь в подробную теорию работы устройства, отметим, что аноды, выполненные таким образом, обеспечивают хороший перенос двухвалентного железа к поверхности анода для окисления и эффективный перенос трехвалентного железа от поверхности анода. Соответственно, любая конфигурация,обеспечивающая такой перенос, находится в рамках настоящего изобретения. Аноды, используемые в обычных системах электрохимического извлечения, как правило, содержат свинец или свинцовый сплав, например, типа Pb-Sn-Ca. Один недостаток таких анодов состоит в том, что в процессе электрохимического извлечения небольшое количество свинца освобождается с поверхности анода и, в конечном счете, создает нежелательные отложения или "шлаки", частицы, взвешенные в электролите или другие вызывающие коррозию элементы в электрохимической ячейке и загрязняющие медный катод. Например, медный катод, полученный в результате обработки содержащего свинец анода, как правило, содержит примеси свинца на уровне приблизительно от 1 до 4 частей на миллион. Кроме того,содержащие свинец аноды ограничивают типичный полезный срок службы приблизительно четырьмясемью годами. В соответствии с одной целью предпочтительного варианта настоящего изобретения,анод, в основном, свободен от свинца. Таким образом удается избежать создания свинцовых отложений или "шлама", взвешенных в электролите частиц или других элементов, вызывающих коррозию и загрязнение конечного продукта - медного катода. Предпочтительно в соответствии с примерным вариантом настоящего изобретения анод сформирован из одного из так называемых "вентильных" металлов, включая титан (Ti), тантал (Та), цирконий (Zr) или ниобий (Nb). Анод может также быть сформирован из других металлов, типа никеля или металлического сплава, межметаллических комплексов или керамики или металлокерамики, содержащих некоторое количества вентильных металлов. Например, титан может быть сплавлен с никелем (Ni), кобальтом(Со), железом (Fe), марганцем (Mn) или медью (Cu), чтобы сформировать подходящий анод. Предпочтительно, чтобы анод содержал титан, потому что, помимо всего прочего, титан - прочный и коррозионностойкий металл. Титановые аноды, например, когда они используется в соответствии с различными целями настоящего изобретения, потенциально имеют срок службы до пятнадцати лет и более. Анод может также содержать любое электрохимически активное покрытие. Примерные покрытия включают покрытия из платины, рутения, иридия или других металлов группы VII, окислов металлов группы VIII или соединений, включающих металлы группы VIII и окислы, и составы из титана, молибдена, тантала и/или их смесей и комбинаций. Окись рутения и окись иридия предпочтительны для использования в качестве электрохимически активных покрытий на титановых анодах, когда такие аноды используются в связи с различными вариантами настоящего изобретения. В соответствии с одним вариантом изобретения анод формируется из металлической титановой сетки, покрытой пленкой на основе окиси иридия. В другом варианте изобретения анод сформирован из титановой сетки, покрытой пленкой на основе окиси рутения. Аноды, подходящие для использования в соответствии с различными вариантами изобретения, могут быть поставлены различными поставщиками. В обычных операциях электрохимического извлечения меди используют либо медный лист, либо нержавеющую сталь или титан как "болванку" катода. В соответствии с одной целью, достигаемой в примерном варианте изобретения, катод выполнен в виде металлического листа. Катод может быть сформирован из меди, медного сплава, нержавеющей стали, титана или другого металла или комбинации металлов и/или других материалов. Как показано на фиг. 2 и как известно специалистам, катод 25, как-6 011201 правило, подвешивается с верхней части электрохимической ячейки таким образом, что часть катода погружена в электролит в ячейке, а другая часть (в основном, относительно небольшая часть, приблизительно менее двадцати процентов (20%) общей поверхности катода) остается над поверхностью электролита. Часть поверхности катода, которая погружена в электролит в ячейке при ведении электрохимического процесса, называется в данном описании и, в основном, в технической литературе как "площадь активной поверхности" катода. Эта часть катода, покрывается медью в процессе электрохимического извлечения металла. В соответствии с различными вариантами настоящего изобретения, катод может быть выполнен в виде любой конфигурации, известной в настоящее время, или которая может быть изобретена в будущем квалифицированным специалистом. В некоторых вариантах настоящего изобретения эффект интенсивной циркуляции электролита на катоде при реакции должен вызвать эффективный перенос ионов меди. Чтобы содействовать развитию отложения на катоде меди высокого качества, система циркуляции электролита должна стимулировать эффективную диффузию ионов меди к поверхности катода. Когда скорость диффузии меди замедляется,форма роста кристаллов может измениться в неблагоприятную сторону, что может привести к грубой поверхностью катода. Чрезмерная шероховатость катода может вызвать увеличение пористости, которая может захватывать электролит и, таким образом, транспортировать загрязняющие примести на поверхность катода. Эффективная скорость диффузии меди это та скорость, которая обеспечивает благоприятный кристаллический рост кристаллов для гладкого катода высокого качества. Более высокая плотность тока требует более высокой скорости переноса меди к поверхности катода. Для получения конечного продукта высокого качества максимальная практическая плотность тока частично ограничивается скоростью диффузии меди, которая создает благоприятные условия для роста кристаллов. В настоящем изобретении система циркуляции электролита, используемая в электрохимической ячейке, служит для облегчения переноса ионов к аноду или от него, и она также эффективна для стимулирования эффективной диффузии ионов меди к катоду. Например, использование потока через анод усиливает перенос ионов меди к катоду и также перенос ионов двухвалентного железа к аноду и ионов трехвалентного железа от анода. В соответствии с примерным вариантом настоящего изобретения концентрация меди в электролите для электрохимического извлечения металла предпочтительно поддерживается на уровне приблизительно от 20 до 60 г меди на литр электролита. Предпочтительно, чтобы концентрация меди поддерживалась на уровне приблизительно от 30 до 50 г/л и наиболее предпочтительно приблизительно от 40 до 45 г/л. Однако в различных вариантах настоящего изобретения могут применяться процессы, в которых предпочтительно поддерживаются концентрации меди выше и/или ниже этих уровней. В целом, любая система для перекачки, циркуляции или перемешивания электролита и способная поддерживать удовлетворительный расход и циркуляцию электролита между электродами в электрохимической ячейке таким образом, что процесс, описанный здесь является реальным, может использоваться в различных вариантах настоящего изобретения. Скорость вспрыскивания электролита в электрохимическую ячейку может регулироваться, изменяя размер и/или геометрию отверстий, через которые электролит входит в электрохимическую ячейку. Например, на фиг. 2 коллектор потока электролита 27 выполнен в виде трубок внутри ячейки 21, имеющей впускные отверстия 29. Если диаметр впускных отверстий 29 уменьшен, скорость вспрыскивания электролита увеличивается, что приводит к ускоренному перемешиванию электролита. Кроме того, угол вспрыскивания электролита в электрохимическую ячейку относительно стенки ячейки и электродов может иметь любую желательную величину. Хотя на фиг. 2 в качестве примера показан вертикальный вспрыск электролита, можно создать любую конфигурацию впускных отверстий в разных направлениях. Например, если впускные отверстия, представленные на фиг. 2, приблизительно параллельны друг другу и одинаково направлены, конфигурации, содержащие множество противоположных или пересекающихся входных потоков, могут оказаться выгодными в соответствии с различными вариантами изобретения. В соответствии с одним вариантом изобретения коллектор потока электролита содержит трубки,соответственно объединенные с анодом, наложенные на него или расположенные внутри структуры анода, например вставлены между ячейками сетки примерного проточного анода. Такая конструкция показана, например, на фиг. 3, на которой коллектор 31 выполнен таким образом, что он обеспечивает вспрыскивание электролита между отверстиями 33 и 34 анодной сетки 32. Еще один примерный вариант показан на фиг. 4, на которой коллектор 41 выполнен таким образом, что он вводит электролит между отверстиями 43 и 44 сетки анода 42. Коллектор 41 включает множество связанных между собой трубок 45,проходящих приблизительно параллельно отверстиям 43 и 44 сетки анода 42, и каждая трубка имеет множество выполненных в ней отверстий 47 с целью впрыскивания электролита в анод 42, предпочтительно в потоки, текущие приблизительно параллельно отверстиям 43 и 44, как показано на фиг. 4. В соответствии с другим вариантом изобретения коллектор потока электролита представляет собой коллектор типа, напольного мата, который, в основном, содержит группу труб, уложенных параллельно друг другу по дну электролитической ячейки. Детали примерного коллектора такой конфигурации раскрыты в приведенных здесь примерах.-7 011201 В соответствии с еще одним вариантом изобретения коллектор для принудительного интенсивного ввода потока электролита встроен в электрохимическую ячейку или прикреплен к стенкам или ко дну этой ячейки, таким образом, что потоки вспрыскиваемого электролита направлены в разные стороны и параллельно электродам. Конечно, возможны и другие конфигурации. В соответствии с различными вариантами настоящего изобретения любая конфигурация коллектора потока электролита, которая обеспечивает эффективный поток электролита и перенос двухвалентного железа к аноду, перенос трехвалентного железа от анода и перенос ионов меди к катоду таким образом,что электрохимическая ячейка может использоваться при напряжении ячейки менее чем приблизительно 1,5 В и при плотности тока больше чем приблизительно 26 ампер на квадратный фут (около 280 А/м 2),подходит для практической реализации настоящего изобретения. В соответствии с примерным вариантом изобретения расход электролита поддерживается на уровне приблизительно от 4,0 до приблизительно 40,0 л/мин/м 2 активного катода. Предпочтительно, расход электролита поддерживается на уровне приблизительно от 4,0 л/мин/м 2 активного катода до приблизительно 10,0 л/мин/м 2 активного катода. Однако следует отметить, что оптимальный рабочий расход электролита в соответствии с настоящим изобретением будет зависеть от определенной конфигурации устройства для осуществления процесса и, таким образом, расходы свыше приблизительно 40,0 л/мин/м 2 или менее чем приблизительно 4,0 л/мин/м 2 активного катода могут оказаться оптимальными в других вариантах настоящего изобретения. В основном, увеличение рабочей температуры электрохимической ячейки (т.е. электролита) улучшает покрытие катода металлом. Не желая связывать себя какой-либо конкретной теорией, мы полагаем,что повышенная температура электролита обеспечивает дополнительную энергию реакции и может вызвать термодинамическое усиление реакции что, при постоянном напряжении ячейки, приводит к повышенной диффузии меди в электролите при повышенной температуре. Кроме того, повышенная температура может также увеличить диффузию железа и может завершиться общим понижением напряжения ячейки, которое, в свою очередь, обеспечивает экономическую рентабельность предприятия. Пример 2 демонстрирует понижение напряжения ячейки при увеличении температуры электролита. Обычные ячейки для электрохимического извлечения меди, как правило, работают при температуре от 45 до 52 С. В соответствии с еще одной целью примерного варианта настоящего изобретения электрохимическая ячейка используется при температуре приблизительно от 43 до 83 С. Предпочтительно электрохимическая ячейка используется при температуре свыше около 46 или около 48 С и предпочтительно при температуре ниже около 60 или около 65 С. Однако в некоторых областях применения могут оказаться выгодными температуры в диапазоне от 68 до 74 С. Однако следует понимать, что хотя более высокие рабочие температуры могут быть выгодны по причинам, приведенным выше, работа при таких высоких температурах может потребовать использования конструкционных материалов, предназначенных для эксплуатации в более тяжелых режимах. Кроме того, работа при более высоких температурах может потребовать увеличенного расхода энергии. Рабочая температура электрохимической ячейки может регулироваться с помощью любых средств,известных специалистам, включая, например, погружной нагревательный элемент, линейное нагревательное устройство (например, теплообменник) или тому подобное устройство, предпочтительно связанное с одним или несколькими устройствами регулирования температуры с обратной связью для эффективного управления производственным процессом. Гладкая поверхность покрытия оптимальна по качеству и чистоте катода, потому что гладкая поверхность катода является более плотной и имеет меньшее число раковин, в которых может оставаться электролит, вызывающий загрязнение поверхности. Хотя предпочтительно, чтобы плотность тока и параметры расхода электролита регулировались таким образом, что можно получить гладкую, покрытую металлом поверхность катода, используя электрохимическую ячейку с высокой плотностью тока, тем не менее, могут возникнуть условия, приводящие с созданию грубой поверхности катода. Таким образом, в соответствии с одной целью примерного варианта настоящего изобретения к потоку электролита добавлено эффективное количество реактива металлизации, чтобы улучшить характеристики металлизации и,таким образом, улучшить поверхностные характеристики катода и повысить чистоту катода. Любой химический агент, способный улучшить характеристики покрытой металлом поверхности катода, а именно,гладкость и пористость, может использоваться для этой цели. Например, для этой цели могут применяться подходящие реагенты металлизации (иногда называемые "агентами, способствующими сглаживанию поверхности"), которые могут включать тиомочевину, гуар, синтетические смолы, модифицированный крахмал, полиакриловую кислоту, полиакрилат, ион хлорида и/или их комбинации. При использовании эффективная концентрация реактива металлизации в электролите или, говоря иными словами, эффективный объем требуемого реактива металлизации будет зависеть от природы конкретного используемого реактива; однако концентрация реактива металлизации, в основном, будет в диапазоне приблизительно от 20 г реактива металлизации на тонну меди до 1000 г/т. Поскольку двухвалентное железо окисляется в электрохимической ячейке у анода, концентрация трхвалентного железа в электролите естественно истощается, тогда как концентрация трехвалентного-8 011201 железа в электролите естественно увеличивается. В соответствии с одной целью примерного варианта изобретения концентрация трхвалентного железа в электролите регулируется добавкой сернокислого железа к электролиту. В соответствии с другим вариантом изобретения концентрация трхвалентного железа в электролите регулируется экстракцией раствора (SX) железа из раствора выщелачивания меди. Для взаимосвязи двухвалентного/трехвалентного железа и поддержания непрерывной анодной реакции, трехвалентное железо, полученное на аноде, предпочтительно восстанавливается обратно до двухвалентного железа, чтобы поддержать удовлетворительную концентрацию железа в электролите. Кроме того, концентрация трехвалентного железа предпочтительно регулируется, чтобы обеспечить нужную плотность тока в электрохимической ячейке. В соответствии с примерным вариантом настоящего изобретения полная концентрация железа в электролите поддерживается на уровне приблизительно от 10 до 60 г железа на литр электролита. Предпочтительно, чтобы полная концентрация железа в электролите поддерживалась на уровне приблизительно от 20 до 40 г/л и наиболее предпочтительно приблизительно от 25 до 35 г/л. Однако отметим, что полная концентрация железа в электролите может изменяться в соответствии с различными вариантами изобретения, поскольку полная концентрация железа является функцией растворимости железа в электролите. Растворимость железа в электролите изменяется с другими параметрами процесса, например концентрации кислоты, концентрации меди и температуры. Как указано выше, снижение концентрации железа в электролите, в основном, желательно с экономической точки зрения, поскольку при этом снижаются требования к структуре железа и уменьшается температура насыщения электролита сульфатом,что снижает эксплуатационные расходы электрохимического извлечения металла. В соответствии с примерным вариантом настоящего изобретения концентрация трехвалентного железа в электролите поддерживается на уровне приблизительно от 0,001 до 10 г трехвалентного железа на литр электролита. Предпочтительно концентрация трехвалентного железа в электролите поддерживается на уровне приблизительно от 1 до 6 г/л и наиболее предпочтительно приблизительно от 2 до 4 г/л. Снова обращаясь к фиг. 1, в соответствии с другой целью примерного варианта изобретения, концентрация трехвалентного железа в электролите в электрохимической ячейке регулируется, удаляя, по меньшей мере, часть электролита из этой ячейки, например, как показано на фиг. 1, в виде возвратного потока электролита 15 в процессе 100. В соответствии с еще одной целью примерного варианта изобретения для снижения трехвалентного железа в потоке регенерации электролита 15 может использоваться сернистый ангидрид 17. Хотя снижение Fe3 в возвратном потоке электролита 15 на стадии регенерации двухвалентного железа 103 может быть выполнено, используя любой подходящий восстановитель или способ, сернистый ангидрид наиболее желателен как восстановитель для Fe3+, поскольку он, в основном, доступен при выполнении других операций по обработке меди, поскольку серная кислота получается как побочный продукт. При реакции с трехвалентным железом в содержащем медь электролите, сернистый ангидрид окисляется, образуя серную кислоту. Реакция сернистого ангидрида с трехвалентным железом производит два моля серной кислоты на каждый моль меди, произведенной в электрохимической ячейке, что равно на один моль больше кислоты, чем, как правило, это требуется для поддержания баланса кислоты всего процесса получения меди, в котором используется экстракция раствора (SX) в сочетании с электрохимическим извлечением металла. Избыток серной кислоты может быть удален из обогащенного кислотой электролита (показанного на фиг. 1 в виде потока 18), полученного на стадии регенерации двухвалентного железа для использования в других операциях, например на стадии выщелачивания. На фиг. 1 показано, что обогащенный кислотой поток электролита 18 на стадии регенерации двухвалентного железа 103 может быть возвращен на стадию электрохимического извлечения 101 в возвратных потоках электролита 12 и 16 и может быть введен на стадии удаления кислоты 105 для дальнейшей обработки или может быть расщеплен (как показано на фиг. 1) таким образом, что часть обогащенного кислотой потока электролита 18 возвращается на стадию электрохимического извлечения 101, а другая часть продолжает поступать на стадию удаления кислоты 105. На стадии удаления кислоты 105 избыток серной кислоты извлекается из обогащенного кислотой электролита и выходит из процесса в виде потока кислоты 19 для последующей нейтрализации или предпочтительно для использования в других операциях, например на стадии кучного выщелачивания. Поток электролита 14 с низким содержанием кислоты может затем быть возвращен на стадию электрохимического извлечения 101 вместе с возвратным потоком электролита 16, как показано на фиг. 1. Итак в электрохимическом процессе извлечения меди, где используется анодная реакция двухвалентного/трехвалентного железа в соответствии с одним вариантом настоящего изобретения, в качестве конечного продукта мы получаем два медных катода и серную кислоту. В соответствии с другой целью примерного варианта изобретения электролит, обогащенный трехвалентным железом, входит в контакт с сернистым ангидридом в присутствии катализатора, например активированного углерода, изготовленный из битуминозного угля или других видов углерода с подходящей активной поверхностной и подходящей структурой. Реакция сернистого ангидрида и трехвалентного железа предпочтительно контролируется таким образом, что концентрация двухвалентного железа и трхвалентного железа в обогащенном кислотой потоке электролита, полученным на стадии регенера-9 011201 ции железа, может регулироваться. В соответствии с целью другого варианта изобретения в системе используются два или несколько датчиков потенциала окисления-восстановления (ДОВ), при этом по меньшей мере один датчик ДОВ расположен на линии электролита, обогащенного трехвалентным железом, отходящей от точки ввода сернистого ангидрида, и по меньшей мере один датчик ДОВ в потоке от точки каталитической реакции в электролите, обогащенном трехвалентным железом. Измерения датчиков ДОВ обеспечивают индикацию отношения трехвалентное железо/двухвалентное железо в растворе; однако, точность измерений зависит от общих условий раствора, которые могут быть уникальными в каждом конкретном случае применения. Квалифицированные специалисты понимают, что могут использоваться любые способы и/или устройства для контроля отношения трехвалентное железо/двухвалентное железо в растворе. Электролит, обогащенный трехвалентным железом, будет содержать приблизительно от 0,001 грамма до 10 граммов трехвалентного железа на литр, а электролит, обедненный трехвалентным железом, будет содержать до 6 г на литр. Следующие примеры иллюстрируют, но не ограничивают настоящее изобретение. Пример 1. Таблица 1 демонстрирует преимущества проточного анода с вводом электролита в анод для достижения низкого напряжения ячейки. Коллектор в аноде создает более низкое напряжение ячейки при том же расходе или снижает требования к расходу при той же плотности тока в противоположность вводу электролита со дна ячейки. Табл. 1 также демонстрирует, что напряжение ячейки ниже 1,10 В достижимо при плотности тока приблизительно 377 А/м 2 и напряжение ячейки ниже 1,25 В достижимо при плотности тока приблизительно 430 А/м 2. Были проведены испытания A-F, используя электрохимическую ячейку, в основном, стандартной конструкции, содержащую три обычных полноразмерных катода и четыре полноразмерных проточных анода. Катоды были выполнены из нержавеющей стали 316, и каждый из них имел активную глубину 41,5 дюйма и активную ширину 37,5 дюймов (полная активная поверхность катода составляла около 2 м 2 на катод). Каждый анод имел активную ширину 35,5 дюймов и активную глубину 39,5 дюймов и был изготовлен из титановой сетки с покрытием из окиси иридия. Аноды, используемые в соответствии с этим примером 1, были поставлены компанией Republic Anode Fabricators, г. Стронвилл, штата Огайо,США. Продолжительность испытаний составила пять дней (за исключением испытаний С, D, Е и F, которые продолжались в течение 60 мин и были предназначены только для измерения напряжения при постоянных условиях, с непрерывной 24-часовой работой электрохимической ячейки при приблизительно постоянных условиях. Измерения напряжения выполнялись раз в день, используя обычный вольтметр, и эти напряжения измерялись между шинами. Заявленные величины для среднего напряжения ячейки в табл. 1 представляют собой средние величины напряжения в течение шестидневного периода испытаний. Измерения расхода электролита были выполнены с помощью непрерывного электронного расходомера,и все расходы электролита в табл. 1 представлены как галлоны в минуту электролита на квадратный фут площади катода, покрытого металлом. Реактив металлизации, использованный во всех испытаниях,представлял собой модифицированный крахмал 4201, поставляемый фирмой Chemstar из Миннеаполиса,штат Миннесота. Концентрация реактива металлизации в электролите поддерживалась равной 250-450 г на тонну медного покрытия. Температура электролита регулировалась, используя автоматический электрический нагреватель(Chromalox). Добавка железа к электролиту осуществлялась, используя кристаллы сернокислого железа(18% железа). Лабораторные анализы концентрации меди и железа осуществлялись, используя стандартные атомно-абсорбционные испытания. Концентрация меди в электролите поддерживалась на уровне приблизительно 41-46 г/л, используя экстракции раствора. Концентрация серной кислоты в электролите поддерживалась на уровне приблизительно 150-160 г/л, используя экстракционную установку Есо-Тес (процесс замедления реакции кислоты). Постоянный ток подавался к каждой электрохимической ячейке, используя стандартный выпрямитель. Плотность рабочего тока для каждого испытания была рассчитана, разделяя общее количество ампер на шкале выпрямителя на общую площадь металлического покрытия катода (6 м 2). Регенерация двухвалентного железа была выполнена, используя сернистый ангидрид, который вводился в возвратный поток электролита и затем пропускался через слой активированного угля, чтобы катализировать реакцию восстановления трехвалентного железа. Реакция контролировалась, используя датчики ДОВ, которые измеряли окислительно-восстановительный потенциал в диапазоне от 390 до 410 мВ (против стандартного холодного слоя термопары хлористого серебра). Сернистый ангидрид вводился в достаточном количестве в возвратный поток электролита для поддержания потенциала ДОВ в диапазоне от 390 до 410 мВ. В процессе испытаний А и В средняя производительность по выходу меди при плотности тока 323 А/м 2 была порядка 50 кг в сутки. Медный катод, полученный в процессе испытаний А и В, содержал менее чем 0,3 части на миллион свинца и менее чем 5 частей на миллион серы. При заданных условиях испытаний чистота меди не изменялась. Анализ пробы меди на испытаниях C-F не выполнялся из-за короткой продолжительности испыта- 10011201 ний. Испытания А, С и Е были выполнены, используя конфигурацию коллектора типа донного мата и вспрыскивание электролита со дна ячейки. Коллектор донного вспрыскивания включал одиннадцать однодюймовых полихлорвиниловых трубок, которые были проложены по длине электрохимической ячейки (т.е. приблизительно перпендикулярно к активным поверхностям электродов). Каждая из этих одиннадцати трубок имела отверстие диаметром 3/16 дюйма, в каждом электродном промежутке (т.е. имелось одиннадцать отверстий, приблизительно равномерно распределенных в каждом электродном промежутке). Испытания A, D и F были выполнены, используя конфигурацию коллектора "вспрыскивания в анод". Коллектор "вспрыскивания в анод" был выполнен, используя линии распределения, примыкающие к электродам, с линиями прямой подачи электролита внутренним диаметром 3/8"1/2" дюйма или 1/4"3/8", при этом полипропиленовые трубки ответвлялись от распределительной линии подачи и подходили к каждому аноду. Каждая линия подачи электролита включила пять равноотстоящих капельниц,которые ответвлялись от линии подачи электролита и были расположены так, чтобы вводить электролит непосредственно в анод, между поверхностями сетки анода. Непосредственно рядом с катодами не происходило никакого вспрыскивания. Таблица 1 Пример 2. Таблица 2 демонстрирует, что увеличение температуры снижает напряжение ячейки. Испытания А-С проводились, используя электрохимическую ячейку, в основном, стандартной конструкции, которая содержит три обычных полноразмерных катода и четыре полноразмерных проточных анода. Катоды были изготовлены из нержавеющей стали 316, и каждый имел активную глубину 41,5 дюйма и активную ширину 37,5 дюйма (полная активная поверхность катода составляла около 2 м 2 на катод). Каждый анод имел активную ширину 35,5 дюйма и активную глубину 39,5 дюйма и был изготовлен из титановой сетки с покрытием из окиси иридия. Аноды, используемые в соответствии с этим примером 2, были поставлены компанией Republic Anode Fabricators, г. Стронвилл, штата Огайо, США. Продолжительность испытаний составила шесть дней при непрерывной 24-часовой работе электрохимической ячейки и при приблизительно постоянных условиях. Измерения напряжения выполнялись раз в день, используя обычный вольтметр, и напряжения измерялись между шинами. Заявленные величины для среднего напряжения ячейки в табл. 2 представляют собой средние величины напряжения в течение шестидневного периода испытаний. Измерения расхода электролита были выполнены с помощью непрерывного электронного расходомера, и все расходы электролита в табл. 2 представлены как галлоны в минуту электролита на квадратный фут площади катода, покрытого металлом. Реактив металлизации, использованный во всех испытаниях, представлял собой модифицированный крахмал 4201,поставляемый фирмой Chemstar из Миннеаполиса, штат Миннесота. Концентрация реактива металлизации в электролите поддерживалась в диапазоне 250-450 г на тонну медного покрытия. Температура электролита регулировалась, используя автоматический электрический нагреватель(Chromalox). Добавка железа к электролиту осуществлялась, используя кристаллы сернокислого железа(18% железа). Анализы концентрации меди и железа были выполнены, используя стандартные атомноабсорбционные испытания. Концентрация меди в электролите поддерживалась на уровне приблизительно 41-46 г/л, используя экстракцию раствора. Концентрация серной кислоты в электролите поддерживалась на уровне приблизительно 150-160 г/л, используя экстракционную установку Есо-Тес (процесс замедления реакции кислоты). Постоянный ток подавался к каждой электрохимической ячейке, используя стандартный выпрямитель. Плотность рабочего тока для каждого испытания была рассчитана, разделяя общее количество ам- 11011201 пер на шкале выпрямителя на общую площадь металлического покрытия катода (около 6 м 2). Регенерация двухвалентного железа осуществлялась, используя сернистый ангидрид, который вводился в возвратный поток электролита и затем пропускался через слой активированного угля, чтобы катализировать реакцию восстановления трехвалентного железа. Реакция контролировалась, используя датчики ДОВ, которые измеряли окислительно-восстановительный потенциал в диапазоне от 390 до 410 милливольт (против стандартного холодного спая термопары хлористого серебра. Сернистый ангидрид вводился в достаточном количестве в возвратный поток электролита для поддержания потенциала окисления-восстановления в диапазоне от 390 до 410 мВ. Во время испытаний при плотности тока 323 А/м 2 средняя производительность установки по производству меди составляла около 50 кг в сутки. Медный катод, полученный в процессе испытаний, содержал, в основном, менее 0,3 частей на миллион свинца и менее 5 частей на миллион серы. Чистота меди не изменялась при установленных конкретных условиях испытаний. Испытания были осуществлены, используя конфигурацию коллектора типа донного мата и вспрыскивание электролита со дна ячейки. Коллектор донного вспрыскивания включал одиннадцать однодюймовых полихлорвиниловых трубок, которые проложены по длине электрохимической ячейки (т.е. приблизительно перпендикулярно к активным поверхностям электродов). Каждая из этих одиннадцати трубок имела отверстие диаметром 3/16 дюйма, в каждом электродном промежутке (т.е. имелось одиннадцать отверстий, приблизительно равномерно распределенных в каждом электродном промежутке). Таблица 2 Здесь был представлен эффективный способ электрохимического извлечения меди, используя анодную реакцию двухвалентного/трехвалентного железа. Кроме того, настоящее изобретение является дальнейшим усовершенствованием гидрометаллургии меди благодаря преимуществам использования анодной реакции двухвалентного/трехвалентного железа в процессе электрохимического извлечения меди и улучшенной системы для использования анодной реакции двухвалентного/трехвалентного железа, которая обеспечивает более высокий КПД процесса по сравнению с обычными процессами электрохимического извлечения меди. Настоящее изобретение было описано со ссылкой на несколько вариантов и примеров. Следует отметить, что описанные конкретные варианты приведены здесь только в качестве примера и лучшего способа осуществления изобретения и не предназначены ограничить возможности изобретения каким-либо способом. Квалифицированны специалистам, прочитавшим это описание, понятно, что могут быть сделаны изменения и модификации в вариантах, приведенных в качестве примера, без выхода из объема настоящего изобретения. Эти и другие изменения или модификации включены в объем настоящего изобретения, как это отображено в приведенной ниже формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ электрохимического извлечения меди, включающий формирование электрохимической ячейки, содержащей по меньшей мере один проточный анод и по меньшей мере один плоский катод, в которой указанный катод имеет участок активной поверхности; обеспечение потока электролита через коллектор в указанную электрохимическую ячейку таким образом, что электролит протекает через по меньшей мере один проточный анод и контактирует по меньшей мере с одним плоским катодом, причем указанный электролит содержит медь и водорастворимое двухвалентное железо; окисление по меньшей мере части указанного водорастворимого двухвалентного железа в указанном электролите по меньшей мере на одном проточном аноде для преобразования двухвалентного железа в трехвалентное железо; удаление по меньшей мере части указанной меди из указанного электролита по меньшей мере на одном плоском катоде; и работу указанной электрохимической ячейки при напряжении меньше чем приблизительно 1,5 В и плотности тока больше чем приблизительно 280 А/м 2 на активном плоском катоде. 2. Способ по п.1, в котором указанная стадия обеспечения потока электролита через указанную электрохимическую ячейку включает обеспечение расхода электролита приблизительно от 4,0 до 40,0 л/мин/м 2 через активный плоский катод. 3. Способ по п.1, в котором указанная стадия окисления включает окисление по меньшей мере час- 12011201 ти указанного водорастворимого духвалентного железа в указанном электролите на проточном аноде,содержащем титановую сетку, имеющую электрохимически активное покрытие. 4. Способ по п.1, в котором указанная стадия обеспечения потока электролита включает создание потока электролита, имеющего концентрацию железа приблизительно от 10 до 60 г/л. 5. Способ по п.1, в котором указанная стадия обеспечения потока электролита дополнительно включает поддержание температуры указанного электролита в диапазоне приблизительно от 43 до около 82 С. 6. Способ по п.1, в котором указанная стадия обеспечения потока электролита дополнительно включает поддержание температуры указанного электролита ниже 66 С. 7. Способ по п.1, дополнительно включающий следующие стадии: удаление по меньшей мере части указанного трехвалентного железа из указанной электрохимической ячейки в возвратный поток электролита; восстановление по меньшей мере части указанного трехвалентного железа в указанном возвратном потоке электролита в двухвалентное железо, чтобы сформировать регенерационный расход электролита; и возврат по меньшей мере части указанного возвратного потока электролита в указанную электрохимическую ячейку. 8. Способ по п.7, в котором указанная стадия восстановления по меньшей мере части указанного трехвалентного железа включает контакт указанного двухвалентного железа с восстановителем в присутствии катализатора. 9. Способ электрохимического извлечения меди из потока электролита, содержащего медь и двухвалентное железо, включающий формирование электрохимической ячейки, содержащей по меньшей мере один анод и по меньшей мере один катод, в котором двухвалентное железо окисляется на аноде, чтобы сформировать трехвалентное железо, при этом медь выделяется в виде металлического покрытия на катоде, и в котором указанный катод имеет участок активной поверхности, причем по меньшей мере один проточный анод и коллектор для ввода электролита обеспечивают эффективную циркуляцию указанного потока электролита в указанной электрохимической ячейке, а поток электролита проходит через по меньшей мере один проточный анод и контактирует по меньшей мере с одним катодом, причем работу указанной электрохимической ячейки осуществляют при напряжении ячейки менее чем приблизительно 1,5 В при плотности тока более 280 А/м 2 активного плоского катода. 10. Способ по п.9, отличающийся тем, что дополнительно обеспечивают эффективную циркуляцию электролита, создавая поток электролита через указанную электрохимическую ячейку с расходом приблизительно от 4,0 до 40 л/мин/м 2 плоского катода. 11. Способ по п.9, отличающийся тем, что дополнительно включает удаление по меньшей мере части указанного трехвалентного железа из указанной электрохимической ячейки в возвратном потоке электролита; восстановление по меньшей мере части указанного трехвалентного железа в указанном возвратном потоке электролита в двухвалентное железо и возврат по меньшей мере части указанного возвратного потока электролита в указанную электрохимическую ячейку. 12. Устройство для электрохимического извлечения меди из потока электролита, содержащего медь и железо, в котором концентрация железа составляет приблизительно от 10 до 60 г/л, содержащее электрохимическую ячейку, включающую по меньшей мере один проточный анод, по меньшей мере один плоский катод и коллектор электролита, причем указанные элементы расположены таким образом, что поток электролита проходит через по меньшей мере один проточный анод и контактирует по меньшей мере с одним катодом. 13. Устройство по п.12, в котором указанный поток электролита содержит двухвалентное железо и трехвалентное железо и в котором концентрация трехвалентного железа в указанном потоке электролита составляет приблизительно от 0,001 до 10 г/л. 14. Устройство по п.12, в котором указанный поток электролита содержит двухвалентное железо и трехвалентное железо и в котором концентрация трехвалентного железа в указанном потоке электролита составляет приблизительно от 1 до 6 г/л. 15. Устройство по п.12, в котором указанный поток электролита содержит двухвалентное железо и трехвалентное железо и в котором концентрация трехвалентного железа в указанном потоке электролита составляет приблизительно от 2 до 4 г/л. 16. Устройство по п.12, дополнительно содержащее средства для восстановления по меньшей мере части указанного трехвалентного железа в указанном потоке электролита в двухвалентное железо путем контакта указанного трехвалентного железа с сернистым ангидридом в присутствии катализатора. 17. Устройство по п.12, в котором указанная электрохимическая ячейка содержит по меньшей мере один проточный анод, имеющий металлическую сетку, снабженную электрохимически активным покрытием. 18. Устройство по п.17, в котором указанная электрохимическая ячейка содержит по меньшей мере- 13011201 один анод, имеющий титановую сетку, снабженную покрытием на основе окиси иридия. 19. Устройство по п.17, в котором указанная электрохимическая ячейка содержит, по меньшей мере, титановую сетку, снабженную покрытием на основе окиси рутения. 20. Способ электрохимического извлечения меди, включающий формирование электрохимической ячейки, содержащей по меньшей мере один проточный анод и по меньшей мере один плоский катод, в которой указанный плоский катод имеет участок активной поверхности; формирование потока электролита через указанную электрохимическую ячейку, причем указанный электролит содержит медь и водорастворимое двухвалентное железо и в котором указанный поток электролита поступает в указанную электролитическую ячейку через коллектор электролита, содержащий множество впускных отверстий, причем поток электролита проходит через по меньшей мере один проточный анод и контактирует по меньшей мере с одним катодом; осуществление окисления по меньшей мере части указанного водорастворимого двухвалентного железа в указанном электролите, по меньшей мере в одном проточном аноде от двухвалентного железа до трехвалентного железа; удаление по меньшей мере части указанной меди из указанного электролита по меньшей мере у одного плоского катода и эксплуатацию указанной электролитической ячейки при напряжении менее 1,5 В и плотности тока больше чем приблизительно 280 А на квадратный метр активного плоского катода. 21. Способ по п.20, в котором через указанное множество впускных отверстий поток электролита поступает по меньшей мере из одного пола и потолка электролитической ячейки. 22. Способ по п.3, в котором указанный металлический сетчатый анод имеет множество впускных отверстий.
МПК / Метки
МПК: C25C 1/12
Метки: извлечения, использованием, железа, устройство, способ, меди, электрохимического, анодной, реакции
Код ссылки
<a href="https://eas.patents.su/16-11201-sposob-i-ustrojjstvo-dlya-elektrohimicheskogo-izvlecheniya-medi-s-ispolzovaniem-anodnojj-reakcii-dvuhvalentnogo-trehvalentnogo-zheleza.html" rel="bookmark" title="База патентов Евразийского Союза">Способ и устройство для электрохимического извлечения меди с использованием анодной реакции двухвалентного/трехвалентного железа</a>
Предыдущий патент: Способ и устройство для регулирования светопроницаемости/прозрачности остекления или пленки
Следующий патент: Линзовый автостереоскопический дисплей и способ синтеза автостереоскопического изображения
Случайный патент: Способ выработки газа-фумиганта ( варианты ), композиция для выработки газа-фумиганта ( варианты ) и способ фумигации (варианты )