Обнаружение окисляющих липиды абзимов в образцах
Формула / Реферат
1. Способ измерения уровня абзимов в образце, согласно которому вызывают прекращение опосредуемого абзимами окисления липидов в указанном образце и определяют связывание антител с антигеном Chlamydia в указанном образце, при этом увеличение связывания в обработанном образце по сравнению с контрольными образцами служит показателем присутствия или уровня абзимов в указанном образце.
2. Способ по п.1, отличающийся тем, что указанный образец представляет собой образец крови, сыворотки или плазмы крови пациента.
3. Способ по п.2, отличающийся тем, что присутствие абзимов в указанном образце указывает на атеросклеротическое заболевание.
4. Способ по любому из пп.1-3, отличающийся тем, что указанный образец подвергают физическому воздействию для подавления опосредуемого абзимами окисления липидов.
5. Способ по п.4, отличающийся тем, что указанный образец нагревают.
6. Способ по п.5, отличающийся тем, что указанный образец нагревают по меньшей мере до 37шС в течение по меньшей мере 5 мин.
7. Способ по п.6, отличающийся тем, что указанный образец нагревают по меньшей мере до 56шС в течение по меньшей мере 30 мин.
8. Способ по п.4, отличающийся тем, что указанный образец подвергают двум или более циклам замерзания-оттаивания.
9. Способ по п.4, отличающийся тем, что указанный образец выдерживают при температуре от 0 до 4шС по меньшей мере в течение 4 дней.
10. Способ по любому из пп.1-3, отличающийся тем, что указанный образец подвергают химическому воздействию для подавления опосредуемого абзимами окисления липидов.
11. Способ по п.10, отличающийся тем, что указанный образец обрабатывают одним или более инактивирующим реагентом.
12. Способ по п.11, отличающийся тем, что указанный инактивирующий реагент представляет собой вещество, поглощающее гидроксильные радикалы, антиоксидант с низким рН, ловушку, замедлитель или поглотитель электронов.
13. Способ по п.11, отличающийся тем, что указанный инактивирующий реагент представляет собой вещество, поглощающее радикалы гидроксила.
14. Способ по любому из пп.11-13, отличающийся тем, указанный инактивирующий реагент выбирают из группы, включающей ацетилсалициловую кислоту, аскорбиновую кислоту, этилендиаминтетрауксусную кислоту, EGTA, (+) катехингаллат, азид натрия, диметилсульфоксид, гемоглобин, телитромицин (кетек) и их аналоги или производные.
15. Способ по п.11, отличающийся тем, что указанный инактивирующий реагент представляет собой бактериальную клетку.
16. Способ по п.15, отличающийся тем, что указанный инактивирующий реагент представляет собой клетку лактобактерии.
17. Способ по любому из пп.1-3, 5-9, 11-13 или 15, 16, отличающийся тем, что степень опосредуемого абзимами окисления липидов в указанном образце определяют после вышеуказанной обработки.
18. Способ по любому из пп.1-3, 5-9, 11-13 или 15, 16, отличающийся тем, что антиген Chlamydia находится на поверхности клетки Chlamydia.
19. Способ по любому из пп.1-3, 5-9, 11-13 или 15, 16, отличающийся тем, что связывание антитела с антигеном Chlamydia определяют с использованием второго антитела.
20. Способ по п.19, отличающийся тем, что указанное второе антитело связывает IgG.
21. Способ по п.19 или 20, отличающийся тем, что первый член группы, состоящей из (а) второго указанного антитела и (б) антигена или клетки Chlamydia, метят.
22. Способ по п.21, отличающийся тем, что второй член группы, состоящей из (а) второго антитела и (б) антигена или клетки Chlamydia, иммобилизуют.
23. Способ скрининга ингибитора абзима, согласно которому определяют связывание антител в образце с антигеном Chlamydia, обрабатывают указанный образец тестируемым соединением и определяют связывание антител с антигеном Chlamydia в обработанном образце, при этом увеличение связывания в обработанном образце по сравнению с необработанным образцом указывает на то, что соединение представляет собой ингибитор абзима.
24. Способ по п.23, отличающийся тем, что указанный ингибитор абзима предназначен для лечения атеросклеротического заболевания.
25. Способ по п.23 или 24, отличающийся тем, что указанный образец содержит окисляющие липиды абзимы, специфичные к Chlamydia.
26. Способ по п.25, отличающийся тем, что указанный образец отбирают у пациента, имеющего атеросклеротическое заболевание.
27. Способ по п.26, отличающийся тем, что указанный образец представляет собой образец сыворотки крови или атеромы.
28. Способ по п.27, отличающийся тем, что указанный образец представляет собой образец, обогащенный IgG.
29. Способ по п.28, отличающийся тем, что указанный инактивирующий реагент представляет собой антиоксидант с низким рН.
30. Способ по п.29, отличающийся тем, что инактивирующий реагент представляет собой вещество, поглощающее гидроксильные радикалы.
31. Способ по п.30, включающий определение активности абзимов в отношении окисления липидов в присутствии тестируемого соединения.
32. Способ по п.31, включающий идентификацию указанного соединения в качестве ингибитора абзима.
Текст
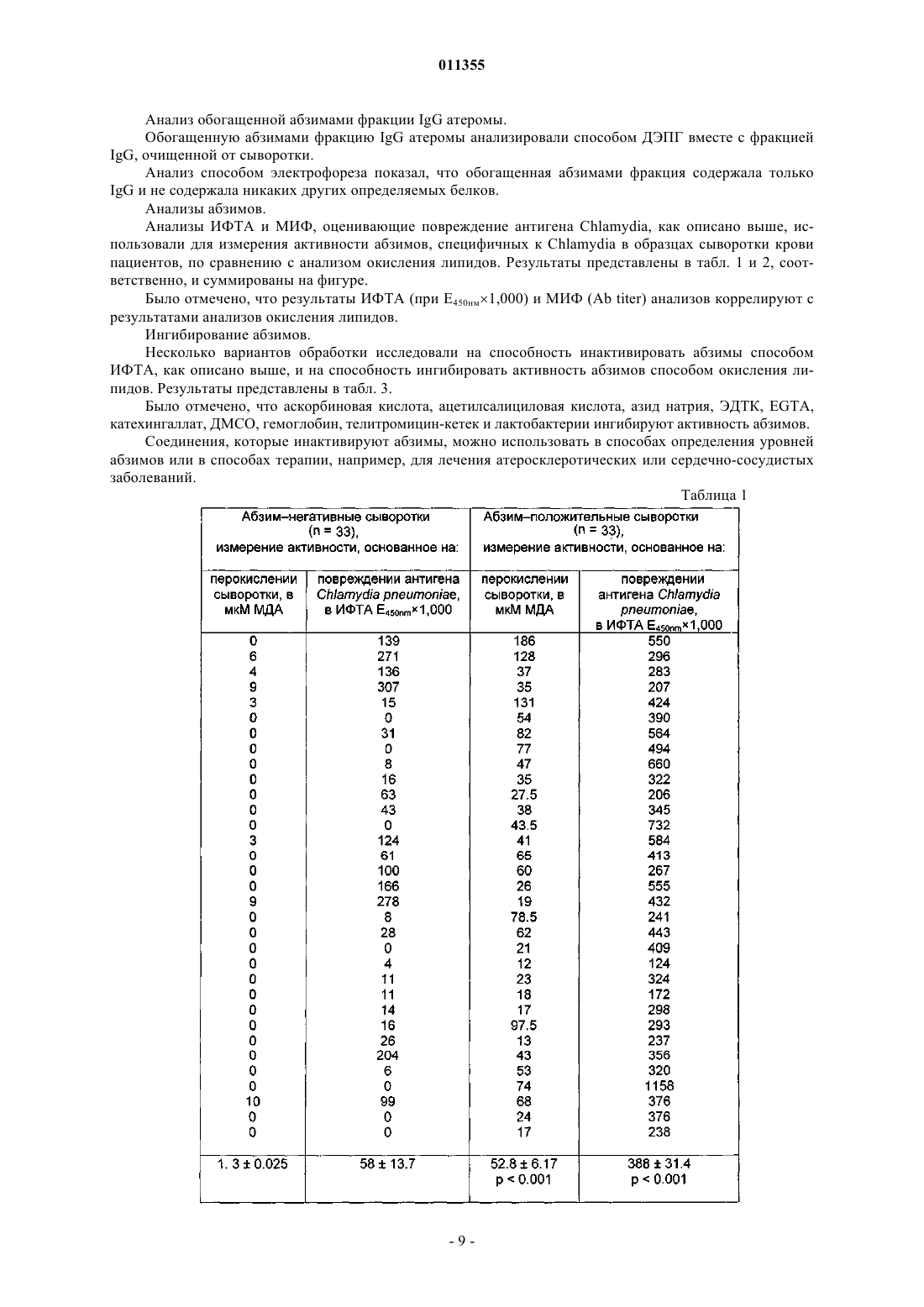
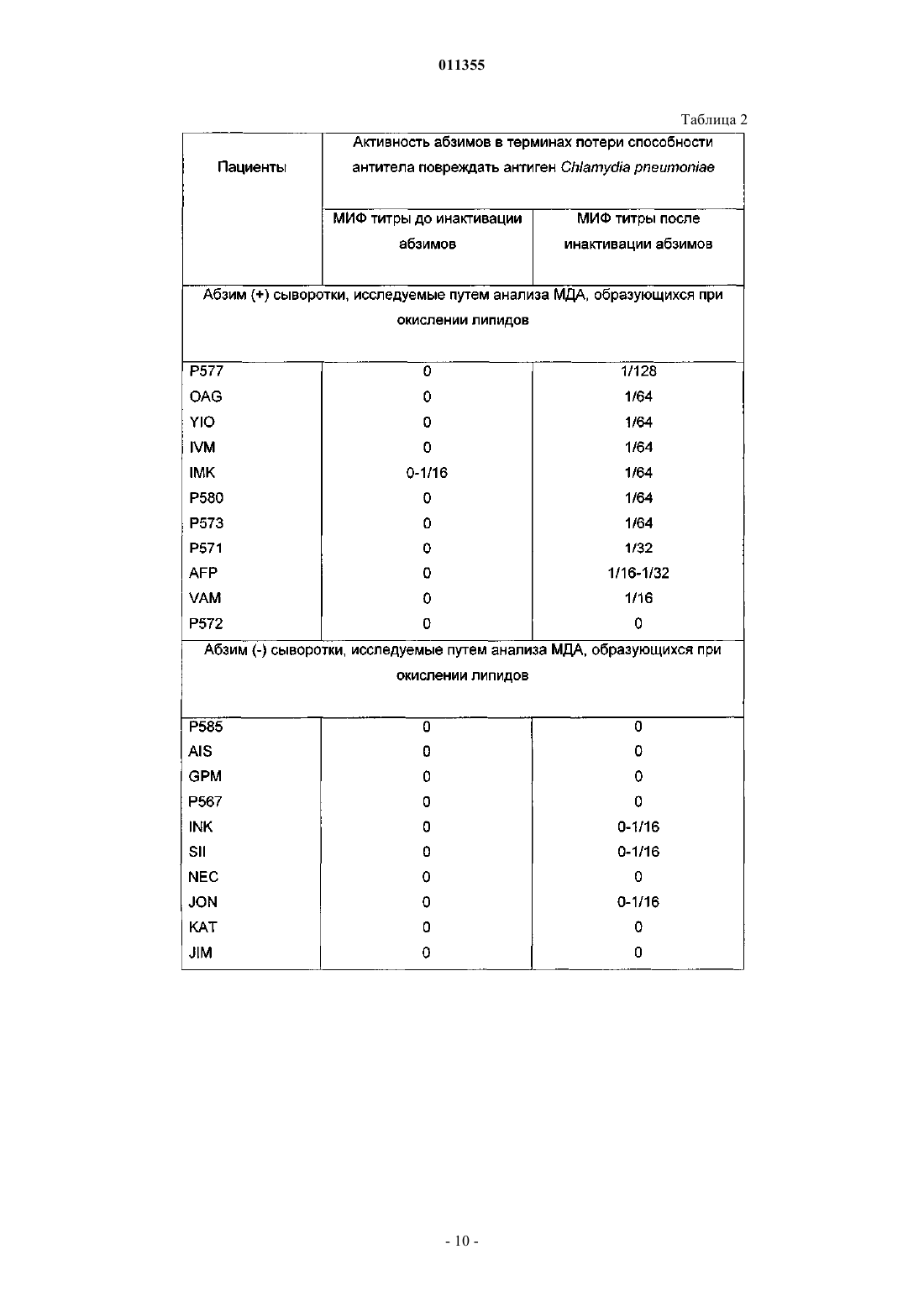
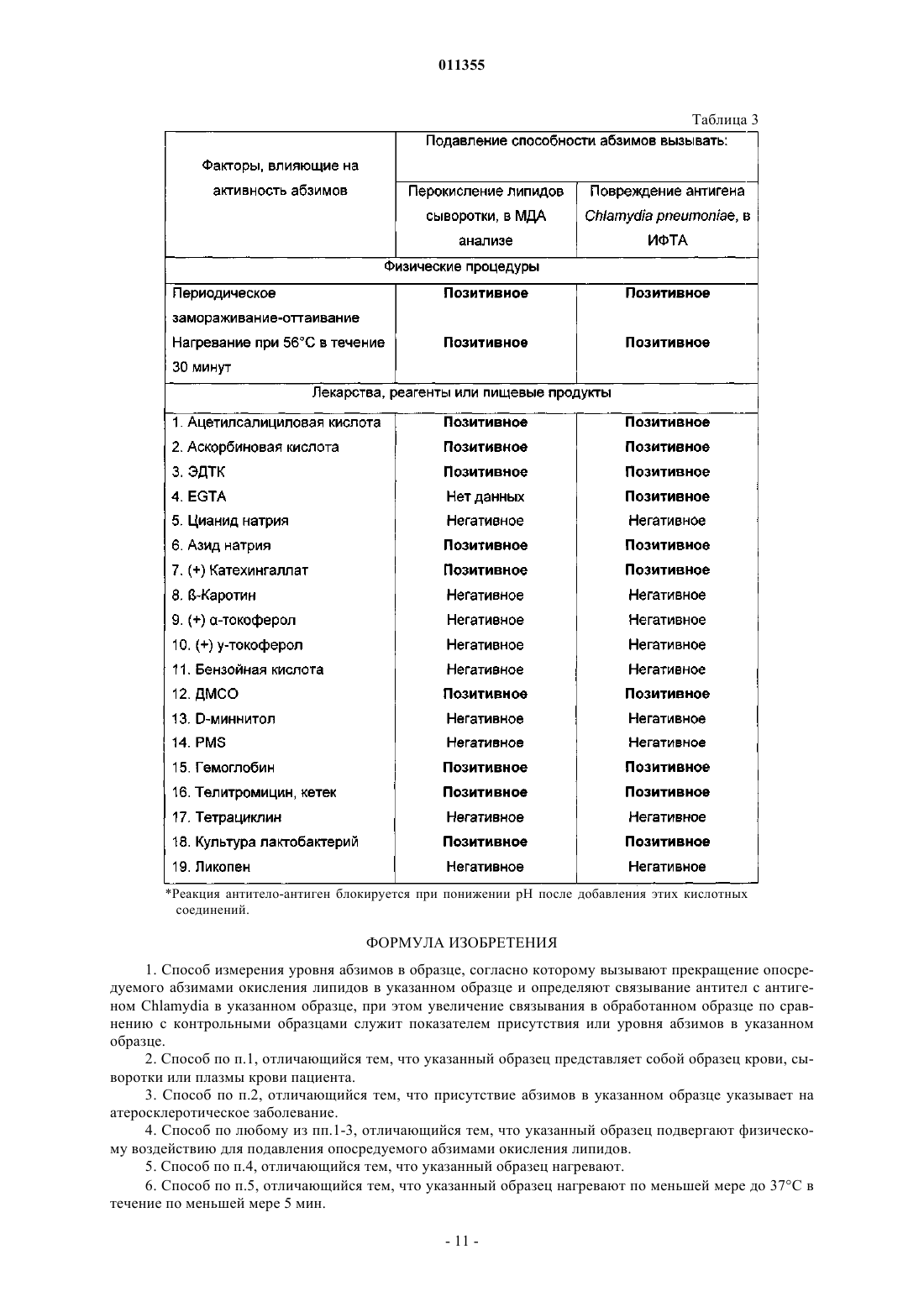
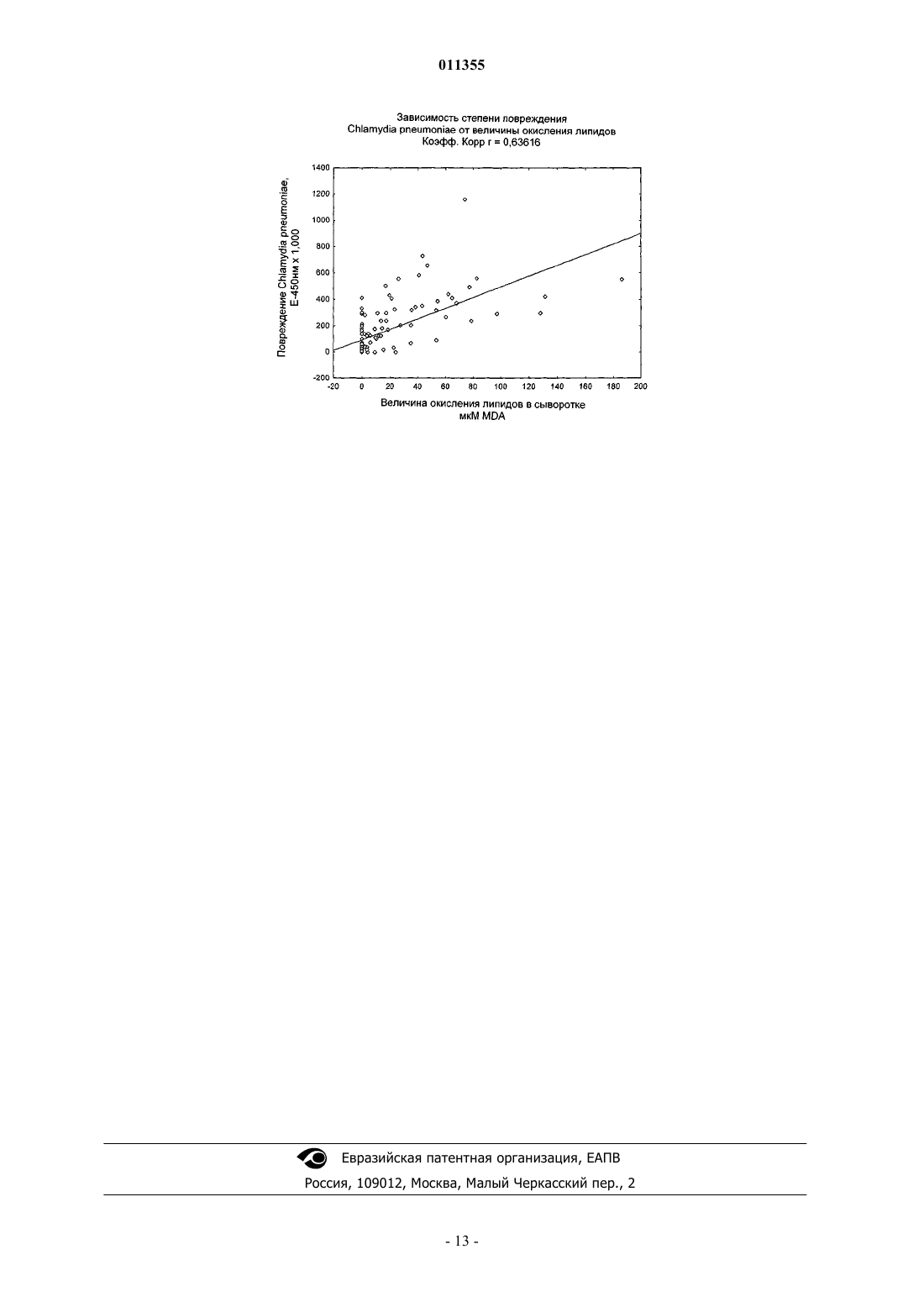
011355 Настоящее изобретение относится к способу обнаружения окисляющих липиды абзимов в образцах крови или сыворотки крови. Такой способ может быть полезен, например, при оценке состояния сердечно-сосудистой системы у пациента. Окисление липидов является одним из основных процессов, который приводит к превращению циркулирующих в крови липопротеинов в сильные атерогенные факторы [Goto Y. (1982) supra,Halliwell В., and J.M.C. Gutteridge, (1989) supra, Schultz D., and Harrison D.G. (2000) supra]. Основной причиной окисления липидов являются каталитические антитела, также известные как абзимы (см.WO 03/017992, WO 03/019196 и WO 03/019198). Абзимы являются ключевым патогенным фактором при развитии атеросклероза и важным диагностическим маркером для заболеваний, связанных с атеросклерозом, и также представляют собой мишень для терапевтического воздействия. Современные способы анализа абзимов основаны на измерении окисления липидов абзимами. Величину окисления липидов определяют, например, по уровню содержания продукта окисления липидов малондиальдегида (МДА). Уровни МДА легко можно измерить спектрофотометрическим способом, поскольку при взаимодействии малондиальдегида с тиобарбитуровой кислотой образуется окрашенный продукт [Draper, H.H. et al. Free Radic. Biol. Med. (1993), 15, 353]. Однако способы анализа абзимов на основе окисления липидов являются медленными, поскольку образование продуктов окисления липидов требует, как правило, от 8 до 12 ч. Способы анализа окисления липидов также требуют использования токсичных реагентов, таких как трихлоруксусная кислота, и больших объемов сыворотки крови пациента (обычно 2-3 мл). Автор настоящего изобретения обнаружил, что абзимы повреждают антигены Chlamydia и это повреждение можно использовать для измерения активности абзимов в простых, быстрых способах анализа с применением обычных форматов иммунологического анализа. Согласно одному аспекту настоящего изобретения предложен способ измерения уровней абзимов в пробе, согласно которому подавляют или вызывают прекращение активности опосредуемого абзимами окисления липидов в указанном образце и определяют связывание антител с антигеном Chlamydia в указанном образце. Увеличение связывания в указанном образце по сравнению с необработанными контрольными образцами указывает на присутствие абзимов в указанном образце. Степень указанного увеличения представляет собой показатель уровня абзимов в образце. Отсутствие какого-либо увеличения связывания в указанном образце по сравнению с контрольными образцами указывает на отсутствие абзимов в образце. Связывание антител в образцах, которые обработали с целью прекращения активности опосредуемого абзимами окисления липидов, и в контрольных образцах (например, необработанных образцах) можно определять одновременно или последовательно. Согласно некоторым вариантам реализации изобретения исходный образец, отобранный у пациента, можно поделить на два или несколько отдельных образцов или аликвот, при этом по меньшей мере один из указанных (аликвот) обрабатывают с целью подавления или прекращения опосредуемого абзимами окисления липидов и по меньшей мере один из указанных образцов (аликвот) оставляют необработанным в качестве контрольного. Согласно другим вариантам реализации настоящего изобретения у пациента можно отобрать два или более идентичных образца, по меньшей мере один из которых обрабатывают с целью подавления или прекращения опосредуемого абзимами окисления липидов и по меньшей мере один из которых оставляют необработанным в качестве контрольного. Присутствие абзимов в сыворотке пациента может служить признаком того, что пациент имеет атеросклеротическое заболевание или может указывать на наличие у пациента предрасположенности к такому заболеванию или риска возникновения его в будущем. Количество, уровень содержания или активность абзимов может указывать на серьезность или степень риска указанного заболевания, т.е. увеличение количества и/или активности антитела указывает на возросшие серьезность или риск заболевания. Согласно способу обследования пациента на предмет присутствия атеросклеротического заболевания подавляют или вызывают прекращение опосредуемого абзимами окисления липидов в образце, отобранном у пациента, и определяют связывание антител с антигеном Chlamydia в указанном образце. Увеличение связывания в обработанном образце по сравнению с необработанным образцом указывает на уровень содержания абзимов в указанном образце. По уровню абзимов в указанном образце можно оценить присутствие, серьезность или предрасположенность пациента к атеросклеротическому заболеванию. Указанные способы можно применять, например, при определении оптимального терапевтического лечения пациента. Например, пациенту, у которого обнаружены абзимы, направленные на липиды, что указывает на атеросклеротическое заболевание, можно назначить терапевтическое лечение для облегчения состояния или его симптоматики. Уровень или количество антилипидных абзимов может указывать на серьезность состояния и его можно использовать для определения того, является ли конкретный терапевтический курс подходящим. Предпочтительно, чтобы указанный образец представлял собой образец, который содержит плазму или сыворотку крови пациента, например образец крови, сыворотки или плазмы крови. Способы получения, хранения и приготовления подходящих образцов, взятых у пациента, хорошо известны в медицинской практике. Тестируемый образец сыворотки крови можно получить, например, путем взятия крови у-1 011355 пациента и выделения сыворотки из отобранной крови. Подходящие способы выделения включают центрифугирование с целью отделения сыворотки и плазмы от клеточного материала. Антиген Chlamydia может представлять собой любой иммуноген или иммуногенный компонент клетки Chlamydia, т.е. молекулу Chlamydia, которая вызывает или способна вызвать у млекопитающего иммунный ответ по отношению к клетке Chlamydia, например, молекулу поверхности клетки Chlamydia, или миметический или функциональный аналог такого компонента. Другими словами, антиген Chlamydia представляет собой компонент клетки Chlamydia, который способен специфичным образом связываться с антителами, восстающими против клетки Chlamydia. Антигены Chlamydia, подходящие для применения в настоящем изобретении, включают изолированные, очищенные, клонированные или синтезированные антигены Chlamydia, фрагменты или детерминанты таких антигенов, группы таких антигенов, фракцию (фракции) гомогенизата клетки Chlamydia, целую клетку Chlamydia, и любые их комбинации. При применении настоящих способов в качестве антигенов Chlamydia также можно использовать антиидиотипические антитела, которые имитируют активные детерминанты Chlamydia, или фрагменты указанных антиидиотипических антител. Подходящие способы получения антигенов Chlamydia хорошо известны в данной области техники. Например, антигены Chlamydia можно выделить и/или очистить такими способами как ВЭЖХ. Согласно некоторым предпочтительным вариантам реализации настоящего изобретения, антигенChlamydia может находиться на поверхности клетки Chlamydia и способы, описанные в настоящем описании, могут включать определение связывания антител с клеткой Chlamydia в обработанном и необработанном образце. Клетка Chlamydia может представлять собой клетку, относящуюся к видам, принадлежащим группеChlamydia psittaci. Группа Chlamydia psittaci включает Chlamydia psittaci и Chlamydia pneumoniae. Согласно некоторым вариантам реализации, клетка Chlamydia может представлять собой клетку Chlamydiapsittaci овцы. Подходящие препараты живой овечьей Chlamydia psittaci в лиофилизированной форме являются коммерчески доступными (Intervet). Связывание антител в образце с антигеном Chlamydia можно обнаружить с помощью любого подходящего средства или способа анализа. Одной возможностью является маркирование отдельными репортерными молекулами. Например, репортерной молекулой можно пометить вторичное антитело, которое связывается с антителами в образце, или клетку Chlamydia или антиген. Репортерные молекулы могут прямо или косвенно генерировать обнаруживаемые, предпочтительно измеряемые, сигналы. При необходимости, связывание репортерных молекул может быть прямым или косвенным, ковалентным, например, через пептидную связь или нековалентным. Связывание посредством пептидной связи может являться результатом экспрессии рекомбинантного гена, кодирующего связывающую молекулу (например, антитело) и репортерную молекулу. Репортерные молекулы включают флюорохромы, такие как флюоресцеин, родамин, фикоэритрин иTexas Red, пигментообразующие красители, такие как диаминобензидин, макромолекулярные коллоидные частицы или корпускулярный материал, например латексные гранулы, которые являются окрашенными, магнитными или парамагнитными, и биологически или химически активные реагенты, которые могут прямо или косвенно давать обнаруживаемые сигналы, визуально наблюдаемые, обнаруживаемые с помощью электронного оборудования или фиксируемые иным способом. Биологически или химически активные реагенты включают ферменты, которые катализируют реакции, выявляющие или изменяющие цвет или вызывающие изменения электрических свойств. Молекулы реагентов могут возбуждаться таким образом, что электронные переходы между энергетическими уровнями приводят к характеристическому спектральному поглощению или излучению. Они могут включать химические объекты, используемые при соединении с биосенсорами. Можно применять биотин/авидин или биотин/стрептавидин и системы обнаружения на основе щелочной фосфатазы. Другие примеры включают пероксидазу хрена и хемилюминесценцию. Любой указанный способ можно применять для определения связывания антитела с антигеном Chlamydia. Сигналы, генерируемые отдельными конъюгатами антитело-репортерная молекула, можно применять для количественного получения абсолютных или относительных данных о связывании соответствующего антитела в образцах (обычных и тестируемых). Способы, предлагаемые в настоящем изобретении, можно применять в любом удобном формате. Иммунологические способы анализа хорошо известны в данной области, и существует много подходящих форматов, которые можно использовать при реализации способов настоящего изобретения, например способ твердофазного иммуноферментного анализа (ТИФА), вестерн-блоттинга, микроиммунофлюоресценции (МИФ), Biacore, (Biacore, Упсала, Швеция), иммунопреципитации или иммунотурбидиметрии, агглютинации, например агглютинации на основе эритроцитов, латекса или других полимеров,иммуногистохимии, иммуноэлектрофореза, аффинной хроматографии, основанной на антителах, иIDEIA (Boots-Celltech) и других диагностических систем, усиливающих окисление-восстановление. В некоторых предпочтительных вариантах реализации настоящего изобретения можно использовать формат сэндвич анализа. Например, в сэндвич анализе можно применять иммобилизованное захваты-2 011355 вающее антитело, которое связывает антитела против Chlamydia в указанном образце и меченый антигенChlamydia или клетку, который позволяет обнаружить присутствие антител против Chlamydia, которые связаны с указанным иммобилизованным антителом. В качестве альтернативы в сэндвич анализе можно применять иммобилизованные антиген или клетку Chlamydia или меченное антитело, которое обнаруживает присутствие антител к Chlamydia, связанных с антигеном. Иммобилизованное антитело, антиген Chlamydia или клетку Chlamydia можно иммобилизовать, например, путем прикрепления к нерастворимой подложке или твердой поверхности. Подложка может быть в корпускулярной или твердой форме и может включать пластинку, пробирку, гранулы, шарик, фильтр или мембрану. Способы фиксирования антител на нерастворимых подложках известны специалистам в данной области. Неиммобилизованный компонент анализируемого образца (т.е. компонент, который находится в растворе в свободном состоянии), например антитело, антигенChlamydia или клетка Chlamydia, может содержать детектируемую метку, как описано выше. Например, антитело можно пометить флуорофором, таким как FITC или родамин, радиоизотопом или неизотопной меткой,такой как биотин или дигоксигенин; компоненты, содержащие биотин можно обнаружить, используя реагенты обнаружения, такие как например, авидин, конъюгированный с любой подходящей меткой, например флуорохромом. Способ определения связывания не является отличительной особенностью настоящего изобретения и специалисты в данной области могут выбрать подходящий способ в соответствии с их предпочтением и общими знаниями. Для прекращения опосредуемого абзимами окисления липидов образец можно обработать, используя любую физическую или химическую обработку, которая уничтожит или существенно уменьшит активность абзимов, но не окажет воздействия или существенного воздействия на связывание абзимов с антигенами Chlamydia. Согласно некоторым вариантам реализации настоящего изобретения для инактивации опосредуемого абзимами окисления липидов образец можно обработать физическими способами. Например, образец можно нагреть. Образец можно нагреть с соответствии с любым температурным режимом, который инактивирует активность окисления липидов, но не воздействует на свойства связывания специфичных антител. Подходящий температурный режим может включать нагревание указанного образца по меньшей мере до 37, по меньшей мере до 56 или по меньшей мере до 70 С. Образец можно нагревать в течение времени, достаточного для инактивации или инактивации в значительной степени опосредуемого абзимами окисления липидов без воздействия на связывание абзимов с антигеном. Например, образцы можно нагревать в течение по меньшей мере 1, по меньшей мере 5, по меньшей мере 15, по меньшей мере 45, по меньшей мере 60 мин, по меньшей мере 8, по меньшей мере 12 или по меньшей мере 24 ч. Согласно некоторым вариантам реализации настоящего изобретения указанный образец можно нагревать до 70 С в течение по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 5 или по меньшей мере 10 мин; нагревать до 56 С в течение по меньшей мере 15, по меньшей мере 20, по меньшей мере 30, по меньшей мере 45 или по меньшей мере 60 мин или нагревать до 37 С в течение по меньшей мере 8, по меньшей мере 12, по меньшей мере 24 или по меньшей мере 48 ч. Для инактивации активности окисления липидов можно применять другие способы физической обработки, не воздействующие на свойства связывания специфичных антител. Образцы можно подвергнуть периодически повторяющимся циклам замораживания-оттаивания,например двум или нескольким циклам замораживания, с последующим оттаиванием. Образцы можно подвергнуть длительному хранению, например по меньшей мере 4 дня при 0-4 С,по меньшей мере 2 или по меньшей мере 3 месяца при -10C или по меньшей мере 4 или по меньшей мере 6 месяцев при -20 С. Образцы можно подвергнуть ультразвуку высокой эенргии, микроволновому, УФ- или гаммаизлучению или любым другим электромагнитным волнам. Приемлемость использования в способах согласно настоящему изобретению того или иного способа или режима обработки можно определить путем измерения окисления липидов и активности связывания (антигенов) Chlamydia в образце после обработки, как описано в данной заявке. Подходящая обработка или режим для применения в способах согласно настоящему изобретению инактивирует опосредуемое окисление липидов, но не оказывает воздействие на свойства связывания антител против Chlamydia. Согласно другим вариантам реализации настоящего изобретения для инактивации опосредуемого абзимами окисления липидов указанный образец можно обработать химическими способами. Например,образец можно обработать одним или несколькими реагентами, инактивирующим абзимы. Инактивирующие реагенты могут включать антиоксиданты с низким рН (т.е. ингибирующие реакции окисления при рН 5,5), акцепторы гидроксильных радикалов, ловушки электронов, такие как краун-эфиры и стероиды, поглотители электронов (своеобразные подушки) такие как полимеры на основе поливинила, стоки электронов, такие как убихиноны и Q8, комплексоны меди и кальция. Подходящие инактивирующие реагенты могут включать аскорбиновую кислоту, ацетилсалициловую кислоту, азид натрия, катехины, в том числе катехингаллат, диметилсульфоксид, азитромицин, ге-3 011355 моглобин, телитромицин (Кетек) или их любые производные, аналоги и соли. Согласно другим вариантам реализации настоящего изобретения, инактивирующий реагент может представлять собой бактериальную клетку, например клетку пробиотической бактерии, например лактобактерии, или продукт такой клетки. Эффективность обработки с целью инактивации абзимов можно определить путем определения активности окисления липидов абзимами образца, например IgG, взятого из атеромы пациента, до и после указанной обработки. Можно применять любой традиционный способ определения окисления липидов. В данной области известно много способов определения окисления липидов и их можно применять для определения уменьшения или прекращения активности окисления липидов в образце. Подходящие способы описаны, например, в CRC Handbook of Methods for Oxygen Radical Research, CRC Press, BocaPress, San Diego, New York, Boston, London (1994); и Free Radicals. A practical approach. IRL Press, Oxford,New York, Tokyo (1996). В предпочтительных вариантах реализации настоящего изобретения окисление измеряют путем определения образования (т.е. присутствия или количества) продукта окисления липидов, который может включать такие альдегиды, как малондиальдегид (МДА), (липидные) пероксиды,диеновые конъюгаты или углеводородные газы. Образец, взятый у пациента, можно обработать для подавления или уменьшения активности комплемента. Согласно некоторым вариантам реализации настоящего изобретения образец можно обработать ингибитором комплемента. Ингибиторы активности комплемента хорошо известны в данной области и включают, например, такие хелатирующие Са 2+ агенты, как EGTA или этилендиаминтетраускусная кислота (EDTA), ингибиторы тимидинкиназы, в том числе, катехины, например, эпигаллокатехингаллат(ЭГКГ), полисахариды, например, зимозан, пептидильные молекулы, например, CD46, CD55, CD59, пекселизумаб, экулизумаб, компстатин, яд кобры, антитела против C1q и других компонент или промежуточных веществ активации комплемента, и фрагменты этих антител, и соединения, которые имитируют функции и свойства активации комплемента. Согласно другим вариантам реализации настоящего изобретения образец можно обработать с помощью процедуры или режима, который подавляет активность комплемента. Подходящие процедуры включают нагревание образца, например, до 56 С в течение 30 мин, или до 70 С в течение 2-5 мин, или другой температурный режим, который инактивируют систему комплемента. Можно также применять другие физические процедуры, такие как ультразвуковой шок, облучение и/или обработку лазером. Способы определения активности абзимов, которые описаны в настоящей заявке, можно также применять для скрининга (отбора) соединений, которые подавляют активность абзимов. Такие соединения можно использовать при лечении атеросклеротических заболеваний. Согласно другому аспекту настоящего изобретения предложен способ скрининга ингибитора абзимов, согласно которому определяют связывание антител в указанном образце с антигеном Chlamydia,обрабатывают образец тестируемым соединением и определяют связывание антител в обработанном образце с антигеном Chlamydia. Увеличение связывания с антигеном Chlamydia после вышеуказанной обработки свидетельствует,что данное соединение представляет собой ингибитор абзимов. Образец предпочтительно представляет собой образец, содержащий абзимы. Подходящий образец можно взять у пациента, имеющего атеросклеротическое заболевание, и он может представлять собой,например, образец сыворотки крови или образец из атеромы или органа, поврежденного атеросклерозом. Образец может быть обогащен IgG, например, за счет связывания с белком А, как описано ниже. Присутствие абзимов в указанном образце можно подтвердить, используя способы анализа на окисление липидов, известные в данной области. Ингибитор абзимов, идентифицированный указаным способом, можно применять для лечения атеросклеротического заболевания, в том числе, сердечно-сосудистого заболевания, например атеросклероза, ишемического (коронарного) заболевания сердца, инфаркта миокарда, аневризмы, атероматозного периферийного сосудистого заболевания, аортоподвздошного заболевания, хронической и критической ишемии нижних конечностей, внутренней ишемии, заболевания почечной артерии, цереброваскулярного заболевания, инсульта, атеросклеротической ретинопатии, тромбоза и аберрантного свертывания крови,и гипертонии. Указанными заболеваниями могут страдать человек или животное. Подходящее тестируемое соединение может представлять собой низкомолекулярное соединение, пептид, молекулу антитела или другую молекулу, воздействие которых на активность абзимов требуется исследовать. Подходящие тестируемые соединения можно выбрать из библиотек соединений и синтезированных соединений, например, с помощью комбинационной химии, как описано ниже. Особенно подходящие тестируемые соединения включают хелаторы металлов, например хелатирующие медь или кальций соединения,антиоксиданты, в частности антиоксиданты с низким рН (т.е. соединения, которые подавляют реакции окисления при рН 5.5), акцепторы гидроксильных радикалов, ловушки электронов, такие как краун-эфиры и стероиды, электронные поглотители (cushions), такие как полимеры на основе поливинила, и стоки электронов (drains), такие как убихиноны и Q8. Подходящие тестируемые соединения могут включать аналоги,-4 011355 соли и производные азида натрия, катехинов, в том числе, катехингаллата, диметилсульфоксида, азитромицина, гемоглобина, телитромицина, которые были идентифицированы как ингибиторы абзимов с помощью способов настоящего изобретения, а также фракции, экстракты и производные бактериальных клеток, в частности культур пробиотических бактерий, таких как лактобактерии (lactobacilli). Технология комбинаторных библиотек (Schultz, JS (1996), Biotechnol. Prog. 12:729-743) обеспечивает эффективный способ тестирования потенциально огромного числа различных веществ на способность модулировать активность абзимов. До или одновременно со скринингом, описанном выше, тестируемые соединения можно исследовать на способность связывать абзимы. Указанную процедуру можно использовать в качестве способа грубого отбора перед тестированием соединения на фактическую способность модулировать активность абзимов. Количество тестируемого соединения, которое может быть добавлено в тестовую систему согласно настоящему изобретению, будет определено опытным путем и с расхождением, зависящим от вида применяемого соединения. Как правило, можно применять концентрации предполагаемого ингибиторного соединения от примерно 0,01 до 100 нМ, например от 0,1 до 10 нМ. Соединения, которые можно применять, могут представлять собой природные или синтетические химические соединения, применяемые в программах скрининга лекарственных препаратов. Можно использовать экстракты растений, которые содержат некоторые охарактеризованные или неохарактеризованные компоненты, или экстракты, фрагменты или компоненты пробиотических бактерий, таких как лактобактерии. Выбор других потенциальных соединений-ингибиторов может быть основан на моделировании 3-мерной структуры абзима и/или липидного антигена, который он связывает, и использовании рационального дизайна лекарственного препарата с целью получения потенциальных соединений-ингибиторов с определенной молекулярной формой, размерами и характеристиками заряда. Способ скрининга, описанный в настоящей заявке, может также включать определение активности абзимов по окислению липидов в присутствии тестируемого соединения. Активность окисления липидов, в том числе активность перокисления, можно установить путем определения окисления липида-хозяина (т.е. липида из образца), липида из чужеродного антигена, такого как клетка Chlamydia, или липида из другого источника, который, например, можно добавить как часть способа анализа. Можно измерить накопление продуктов или побочных продуктов окисления, таких как совместно окисленные парные молекулы репортера, или измерить исчезновение или потребление субстратов, таких как немодифицированные липиды или сопутствующих субстратов, таких как кислород. В данной области известно много способов определения перокисления липидов, подходящие для применения в соответствии с настоящим изобретением. Подходящие способы, например, описаны в CRC(1994); и Free Radicals. A practical approach. IRL Press, Oxford, New York, Tokyo (1996). Согласно предпочтительным вариантам реализации настоящего изобретения, окисление определяют путем определения образования (т.е. присутствия или количества) продуктов окисления липидов, в том числе, альдегидов, например малондиальдегида (МДА), (липидных) пероксидов, диеновых конъюгатов или углеводородных газов. Продукты окисления липидов можно определять любым подходящим способом. Например, продукты перокисления липидов можно определить, используя ВЭЖХ (Brown,R.K., и Kelly, F.J In: Free Radicals. A practical approach. IRL Press, Oxford, New York, Tokyo (1996), 119131), УФ-спектроскопию (Kinter, M. Quantitative analysis of 4-hydroxy-2-nonenal. Ibid., 133-145), или газовую хроматографию - масс-спектрометрию (Morrow, J.D., and Roberts, L.J. F2-lsoprostanes: prostaglandinlike products of lipid peroxidation. Ibid. 147-157). Образование малондиальдегида (МДА) можно установить, например, по реакции с 2-тиобарбитуровой кислотой (предпочтительно при 1 мМ) путем измерения оптической плотности при соответствующей длине волны, например, 525 нм. Агент, идентифицированный при использовании одного или нескольких способов первичного отбора (например, в бесклеточной системе) как обладающий способностью ингибировать активность абзимов, можно исследовать далее, используя один или несколько способов вторичного отбора. Вторичный отбор может включать тестирование на активность абзимов в сосудистой системе или на биологическую функцию абзимов, например, в экспериментальной модели на животных. Подходящие биологические функции, которые можно определить при вторичном отборе, включают уменьшение размеров или количества атеросклеротических повреждений, или уменьшение других симптомов или эффектов атеросклеротического заболевания, например кровяного давления. Способы, предлагаемые в настоящем изобретении, могут включать идентификацию тестируемых соединений в качестве реагентов, которые ингибируют активность абзима. Примеры соединений, идентифицированных как ингибиторы абзима с применением способов настоящего изобретения, включают аскорбиновую кислоту, ацетилсалициловую кислоту, азид натрия, (+) катехингаллат, ДМСО, гемоглобин, телитромицин-кетек, клетки лактобактерий и другие реагенты, перечисленные в табл. 3.-5 011355 Идентифицированное соединение можно выделить или очистить и/или синтезировать или получить промышленным способом. При желании, соединение, идентифицированное в качестве ингибитора абзимов, как описано в настоящей заявке, можно модифицировать с целью оптимизации активности или обеспечения других полезных при введении пациенту характеристик, таких как увеличенный период полувыведения или уменьшенные побочные эффекты. Способы и стратегии модификации образцов соединений хорошо известны в данной области. Ингибитор абзимов, идентифицированный как описано в настоящем документе, можно приготовить в виде композиции, например медикамента, фармацевтической композиции или лекарства, с фармацевтически приемлемым наполнителем, как описано ниже. Такие композиции можно вводить пациенту. Настоящее изобретение охватывает соединение, идентифицированное способом анализа, описанным выше, в качестве ингибитора абзимов, фармацевтическую или ветеринарную композицию, медикамент, лекарство или другую композицию, содержащую такое соединение, способ, включающий введение такой композиции пациенту, например, для лечения (которое может включать профилактическое лечение) атеросклеротических заболеваний, применение таких соединений при промышленном производстве композиций для введения, например для лечения атеросклеротического заболевания, и способ производства фармацевтической или ветеринарной композиции, включающий смешивание указанного соединения с фармацевтически приемлемым наполнителем, связующим веществом или носителем и, возможно,другими ингредиентами. Независимо от того, является ли это соединение полипептидом, пептидом, молекулой нуклеиновой кислоты, низкомолекулярной молекулой или другим фармацевтически применимым соединением, которое можно назначать пациенту, введение предпочтительно осуществлять в профилактически эффективном количестве или терапевтически эффективном количестве (в зависимости от обстоятельств, хотя профилактика может считаться терапией), которое является достаточным для принесения пользы пациенту. Фактическое вводимое количество, норма и режим введения будут зависеть от природы и серьезности заболевания, которое лечат. Назначение лечения, например решение о дозировке и т.д., находится в пределах компетенции лечащего врача и других практикующих докторов. Состав можно вводить отдельно или в комбинации с другими курсами лечения, одновременно или последовательно, в зависимости от заболевания, которое лечат. Фармацевтические композиции, приготовленные согласно настоящему изобретению и для применения в соответствии с настоящим изобретением, могут содержать, помимо активного ингредиента,фармацевтически приемлемый наполнитель, носитель, буфер, стабилизатор или другие компоненты, хорошо известные специалистам в данной области. Такие материалы должны быть нетоксичными и не должны препятствовать эффективному действию активного ингредиента. Точная природа носителя или другого материала будет зависеть от способа введения, который может быть пероральным, или с помощью инъекции, например, кожной, подкожной или внутривенной. Фармацевтические композиции для перорального введения могут быть в форме таблетки, капсулы,порошка или в жидкой форме. Таблетка может включать твердый носитель, например желатин или адъювант. Жидкие фармацевтические композиции, как правило, содержат такие жидкие носители, как вода,вазелин, животные и растительные масла, минеральное масло или синтетическое масло. В жидкие композиции могут быть включены физиологический раствор, раствор декстрозы или другого сахарида или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль. Для внутривенной, кожной или подкожной инъекции или инъекции в место поражения активный ингредиент может находиться в форме приемлемого для введения парентеральным способом водного раствора,который не содержит пирогенов и имеет подходящие рН, изотоничность и стабильность. Специалисты, достаточно опытные в данной области, легко могут приготовить подходящие растворы, используя, например,изотонический наполнитель, такой как физиологический раствор для инъекций, инъекционный раствор Рингера или лактированный инъекционный раствор Рингера. При необходимости, могут быть включены консерванты, стабилизаторы, буферные агенты, антиоксиданты и/или другие добавки. Специалисты в данной области могут варьировать точный формат способов анализа, предлагаемых в настоящем изобретении, используя стандартные навыки и знания. Различные другие аспекты и варианты реализации данного изобретения будут очевидны специалистам в данной области на основе настоящего описания. Все документы, упомянутые в описании этого настоящего изобретения, полностью включены в него посредством ссылок. Изобретение охватывает каждую и любую комбинацию и часть комбинации признаков, которые описаны выше. Некоторые аспекты и варианты реализации настоящего изобретения будут далее проиллюстрированы с помощью примеров и со ссылкой на рисунки и таблицы, описанные ниже. На фигуре показано сравнение анализа окисления липидов и повреждения антигена Chlamydia в отношении измерения активности абзимов, специфичных к Chlamydia. В табл. 1 показано сравнение измерения активности абзимов против Chlamydia, как через их способность окислять липиды сыворотки крови, так и через их способность повреждать антиген Chlamydia,-6 011355 иммуноферментный твердофазный анализ. В табл. 2 показано сравнение измерения активности абзимов, специфичных к Chlamydia, как через их способность окислять липиды сыворотки, так и через их способность повреждать антиген Chlamydia,способ диагностики с помощью консерванта мертиолят-йод-формалин. В табл. 3 показано влияние различных факторов на способность абзимов вызывать перокисление липидов и повреждать антиген (антигены) Chlamydia pneumoniae. Примеры Материалы и способы. Приготовление образцов. Антитела экстрагировали из запущенных атеросклеротических повреждений человеческой аорты,извлеченной из двух пациентов мужского пола 53 и 64 лет во время операции шунтирования брюшного аортального стеноза в Центре сердечно-сосудистой хирургии Медицинского университета Ростова-наДону, Российская Федерация. После извлечения образцы немедленно помещали в 30% вес./об., растворNaCl и хранили до исследования при 0-4 С в течение 1 месяца. В контрольных экспериментах было показано, что во время этого периода, активности таких ферментов как трипсин, каталаза, супероксиддисмутаза, глютатионпероксидаза, креатинкиназа и лактатдегидрогеназа, а также уровень фрагментации иммуноглобулина (IgG) и степень перокисления липидов существенно не изменялись. Фрагменты аорты (приблизительно 200-400 мг влажного веса) разрезали на части, приблизительно по 10 мг каждая, помещали в 5,0 мл фосфатно-буферизированного соляного раствора (ФБСР) с 1% неионным детергентом Igepal CA-630 и гомогенизировали с помощью механического гомогенизатора (Ultra-Turrax) при полной мощности с 15 мм зондом три раза по 3 с с 20-секундными интервалами для охлаждения. После гомогенизации нерастворимые компоненты отделяли центрифугированием при 5000 g в течение 10 мин и надосадочную жидкость использовали для анализа. Надосадочную жидкость обрабатывали белком А, прикрепленным к поперечно сшитой 4% гранулированной агарозе при 37 С в течение 30 мин. Затем иммуноглобулиновую фракцию, прикрепленную к гранулам, центрифугировали при 5000 g в течение 10 мин и надосадочную жидкость декантировали. Для того чтобы удалить любые липопротеиды, прикрепленные к осажденным иммуноглобулинам, образцы повторно суспендировали с 10% Igepal CA-630. Затем их центрифугировали при 5000 g в течение 10 мин и надосадочную жидкость декантировали. Для удаления детергента выполняли три дополнительных промывания в избытке фосфатного буфера с центрифугированием в том же режиме. Удаление липопротеина из иммуноглобулиновой фракции подтверждалось отсутствием холестерина в этой фракции. Инактивация абзимов. Для инактивации физическими способами один и тот же образец абзимов разделяли на две аликвоты. Одну аликвоту нагревали на водяной бане в течение 30 мин при 56 С. Другую аликвоту не обрабатывали. После обработки первой аликвоты оба образца исследовали одинаковым способом. Для инактивации химическими способами разбавленный раствор делили на две порции. В одну порцию добавляли ингибитор абзимов. Использовали следующие ингибиторы абзимов: ДМСО 0,1-10%; азид натрия 10-5-10-3 М; катехины 10-6-10-3 М; кетек 10-6-10-3 М; культуру лактобактерий 1 мкМ-1 мМ; аскорбиновую кислоту 10-4-10-3 М; ацетилсалициловую кислоту 10-4-10-3 М. Образец сыворотки крови разделяли на две аликвоты и одну аликвоту разбавляли раствором, содержащим ингибитор абзимов, вторую аликвоту разбавляли контрольным раствором. Затем аликвоты исследовали одинаковым способом. Исследование абзимов с применением иммуноферментного твердофазного анализа (ИФТА). ИФТА исследования выполняли с использованием материалов и реагентов Medac, которые применяли в соответствии с инструкциями производителей. Вкратце, образцы сыворотки крови, взятые у пациентов, обрабатывали, как указано выше. 50 мкл разбавителя для образцов отбирали пипеткой в лунку А 1 микротитровального планшета в качестве пустой пробы, а в другие лунки отбирали пипеткой 50 мкл образца для негативного контроля, позитивного контроля и разбавленных образцов от пациентов. Лунки на микропланшете инкубировали во влажной камере в течение 60 мин (5 мин) при 37 С (1 С) и затем три раза промывали промывочным буферным раствором 200 мкл на лунку. Затем в каждую лунку добавляли 50 мкл конъюгата и лунки снова инкубировали во влажной камере в течение 60 мин (5 мин) при 37 С (1 С) и затем промывали. В каждую лунку добавляли 50 мкл ТМВ-субстрата и лунки на микропланшете инкубировали во влажной камере в течение 30 мин (2 мин) при 37 С (1 С). Реакцию останавливали путем добавления в каждую лунку 100 мкл стоп-раствора. В пределах 15 мин после добавления стоп-раствора снимали фотометрические показания при 450 нм (начало отсчета 620-650 нм). Для расчета результатов значение оптической плотности пустой пробы (лунка А 1) вычитали из всех других значений оптической плотности. Предпочтительно, значение оптической плотности (ОП) пустой пробы было 0,150, среднее значение ОП образца негативного контроля было 0,100 и значение ОП-7 011355 пробы позитивного контроля было 0,800. Отсечка = среднее значение ОП пробы негативного контроля+ 0,380. Серая зона = отсечка 10%. Микроиммунофлюоресценция (МИФ) на лизированных Chlamydia Готовили микроскопические препараты с антигенами Chlamydia trachomatis, С. Psittaci и С. Pneumoniae, используя очищенные элементарные тельца этих бактерий. Сыворотки разбавляли до титра 1:1024 в забуференном фосфатом физрастворе (ФБСР) и инкубировали в течение 30 мин при 37 С. После промывания в ФБСР, к пробам добавляли конъюгаты против IgG, IgA, IgM человека. После 30 мин инкубации при 37 С и промывания ФБСР препарат на предметном стекле накрывали покровным стеклом с гистологической средой. Для исследования предметных стекол использовали флуоресцентный микроскоп. Положительная реакция отображается появлением "звездного неба": флуоресцентных зеленых сигналов на немного красном фоне. Все образцы оценивали два независимых эксперта. Анализ результатов ИФТА и МИФ Если разница сигнала между обработанным и необработанным образцами составляла менее 10%(или не наблюдали увеличения в титрах при МИФ анализе), делали вывод, что активность абзимов была отрицательной. Если разница сигнала между обработанным и необработанным образцом составляла между 10 и 15% (или наблюдалось увеличение в одном титре при МИФ анализе), делали вывод, что активность абзимов была неясной или находилась в серой зоне. Если разница сигнала между обработанным и необработанным образцом составляла более 15% (или наблюдали увеличение в двух или нескольких титрах при МИФ анализе), делали вывод, что активность абзимов была положительной. Электронная микроскопия на лизированных Chlamydia. Клетки бактерий фиксировали в течение 1 ч в 2,5% растворе глутаральдегида, приготовленном в 0,2 М какодиловом буфере с рН 7,2, а затем в хромово-осмиевом растворе в течение еще 1 ч. После этого пробы обезвоживали при градиентном увеличении этанола и абсолютного ацетона и заливали Eponate 12T14 - Araldite 502. Приготавливали ультратонкие препараты, используя Ultracut Reichert - Jung, окрашенный 1% водным раствором уранилацетата и цитрата свинца. Препараты исследовали и фотографировали, используя электронный микроскоп JEM 100C(с увеличением в) 5300-53000 раз. Денатурирующий электрофорез в полиакриламидном геле (ДЭПГ) Электрофорез в полиакриламидном геле выполняли с использованием различных коммерчески доступных систем, в соответствии с инструкциями производителей. Например, способ, описанный в DPO 033/02; издание 1.0 "Protein electrophoresis using NOVEX system (SDS-PAGE)" использовали со следующими препаратами:Bis-Tris 4-12% готовые гели (Invitrogen NP0321 партия 2072272) (10 лунка); NuPAGE LDS буфер для проб 4(Invitrogen NP0007 партия 300277); NuPAGE восстановитель проб 10 (Invitrogen NP0004 партия 300505), NuPAGE MOPS SDS буфер для электрофореза 20 (Invitrogen NP0001 партия 300704); SeeBlue предварительно окрашенные маркеры (Invitrogen LC5625 партия see11214). Определение перокисления липидов Липидное перокисление оценивали по уровню концентрации МДА, которую измеряли спектрофотометрическими способами [Draper, H.H. et al Free Radic. Biol. Med. (1993), 15, 353]. Короче, уровень абзимов в образце определяли следующим образом: образцы сывороток разбавляли 1:1 0.05 М ацетатным буфером с рН 4,0 для получения конечного рН этих проб между 5,6-5,8. 990 мкл разбавленной сыворотки смешивали с 10 мкл живой овечьей вакцины Chlamydia (Intervet). Пробы инкубировали всю ночь (12-16 ч) при 37 С. К каждому образцу добавляли 250 мкл 40% трихлоруксусной кислоты и 250 мкл 1 мМ 2-тиобарбитуровой кислоты. Все образцы помещали в водяную баню и кипятили в течение 30 мин. Образцы охлаждали и центрифугировали при 3,000 g в течение 10 мин. Надосадочные жидкости собирали и измеряли их оптическую плотность при 525 нм для определения концентрации малондиальдегидов (МДА), которые являются продуктами перокисления липидов. Результаты. Воздействие абзимов на Chlamydia. Обогащенную абзимами фракцию IgG атеромы готовили, как описано выше. Воздействие обогащенной абзимами фракции IgG атеромы на элементарные и ректикулоцитные тела Chlamydia pneumoniae определяли способами МИФ и электронной спектроскопии. С применением микроиммунофлюоресцентного анализа (МИФ) наблюдали, что обогащенная абзимами фракция лизирует клетки Chlamydia pneumoniae. Электронная микроскопия показала, что обогащенная абзимами фракция лизировала как элементарные, так и ретикулярные тела Chlamydia pneumoniae.-8 011355 Анализ обогащенной абзимами фракции IgG атеромы. Обогащенную абзимами фракцию IgG атеромы анализировали способом ДЭПГ вместе с фракциейIgG, очищенной от сыворотки. Анализ способом электрофореза показал, что обогащенная абзимами фракция содержала толькоIgG и не содержала никаких других определяемых белков. Анализы абзимов. Анализы ИФТА и МИФ, оценивающие повреждение антигена Chlamydia, как описано выше, использовали для измерения активности абзимов, специфичных к Chlamydia в образцах сыворотки крови пациентов, по сравнению с анализом окисления липидов. Результаты представлены в табл. 1 и 2, соответственно, и суммированы на фигуре. Было отмечено, что результаты ИФТА (при Е 450 нм 1,000) и МИФ (Ab titer) анализов коррелируют с результатами анализов окисления липидов. Ингибирование абзимов. Несколько вариантов обработки исследовали на способность инактивировать абзимы способом ИФТА, как описано выше, и на способность ингибировать активность абзимов способом окисления липидов. Результаты представлены в табл. 3. Было отмечено, что аскорбиновая кислота, ацетилсалициловая кислота, азид натрия, ЭДТК, EGTA,катехингаллат, ДМСО, гемоглобин, телитромицин-кетек и лактобактерии ингибируют активность абзимов. Соединения, которые инактивируют абзимы, можно использовать в способах определения уровней абзимов или в способах терапии, например, для лечения атеросклеротических или сердечно-сосудистых заболеваний. Таблица 1 Реакция антитело-антиген блокируется при понижении рН после добавления этих кислотных соединений. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ измерения уровня абзимов в образце, согласно которому вызывают прекращение опосредуемого абзимами окисления липидов в указанном образце и определяют связывание антител с антигеном Chlamydia в указанном образце, при этом увеличение связывания в обработанном образце по сравнению с контрольными образцами служит показателем присутствия или уровня абзимов в указанном образце. 2. Способ по п.1, отличающийся тем, что указанный образец представляет собой образец крови, сыворотки или плазмы крови пациента. 3. Способ по п.2, отличающийся тем, что присутствие абзимов в указанном образце указывает на атеросклеротическое заболевание. 4. Способ по любому из пп.1-3, отличающийся тем, что указанный образец подвергают физическому воздействию для подавления опосредуемого абзимами окисления липидов. 5. Способ по п.4, отличающийся тем, что указанный образец нагревают. 6. Способ по п.5, отличающийся тем, что указанный образец нагревают по меньшей мере до 37 С в течение по меньшей мере 5 мин.- 11011355 7. Способ по п.6, отличающийся тем, что указанный образец нагревают по меньшей мере до 56 С в течение по меньшей мере 30 мин. 8. Способ по п.4, отличающийся тем, что указанный образец подвергают двум или более циклам замерзания-оттаивания. 9. Способ по п.4, отличающийся тем, что указанный образец выдерживают при температуре от 0 до 4 С по меньшей мере в течение 4 дней. 10. Способ по любому из пп.1-3, отличающийся тем, что указанный образец подвергают химическому воздействию для подавления опосредуемого абзимами окисления липидов. 11. Способ по п.10, отличающийся тем, что указанный образец обрабатывают одним или более инактивирующим реагентом. 12. Способ по п.11, отличающийся тем, что указанный инактивирующий реагент представляет собой вещество, поглощающее гидроксильные радикалы, антиоксидант с низким рН, ловушку, замедлитель или поглотитель электронов. 13. Способ по п.11, отличающийся тем, что указанный инактивирующий реагент представляет собой вещество, поглощающее радикалы гидроксила. 14. Способ по любому из пп.11-13, отличающийся тем, указанный инактивирующий реагент выбирают из группы, включающей ацетилсалициловую кислоту, аскорбиновую кислоту, этилендиаминтетрауксусную кислоту, EGTA, (+) катехингаллат, азид натрия, диметилсульфоксид, гемоглобин, телитромицин (кетек) и их аналоги или производные. 15. Способ по п.11, отличающийся тем, что указанный инактивирующий реагент представляет собой бактериальную клетку. 16. Способ по п.15, отличающийся тем, что указанный инактивирующий реагент представляет собой клетку лактобактерии. 17. Способ по любому из пп.1-3, 5-9, 11-13 или 15, 16, отличающийся тем, что степень опосредуемого абзимами окисления липидов в указанном образце определяют после вышеуказанной обработки. 18. Способ по любому из пп.1-3, 5-9, 11-13 или 15, 16, отличающийся тем, что антиген Chlamydia находится на поверхности клетки Chlamydia. 19. Способ по любому из пп.1-3, 5-9, 11-13 или 15, 16, отличающийся тем, что связывание антитела с антигеном Chlamydia определяют с использованием второго антитела. 20. Способ по п.19, отличающийся тем, что указанное второе антитело связывает IgG. 21. Способ по п.19 или 20, отличающийся тем, что первый член группы, состоящей из (а) второго указанного антитела и (б) антигена или клетки Chlamydia, метят. 22. Способ по п.21, отличающийся тем, что второй член группы, состоящей из (а) второго антитела и (б) антигена или клетки Chlamydia, иммобилизуют. 23. Способ скрининга ингибитора абзима, согласно которому определяют связывание антител в образце с антигеном Chlamydia, обрабатывают указанный образец тестируемым соединением и определяют связывание антител с антигеном Chlamydia в обработанном образце, при этом увеличение связывания в обработанном образце по сравнению с необработанным образцом указывает на то, что соединение представляет собой ингибитор абзима. 24. Способ по п.23, отличающийся тем, что указанный ингибитор абзима предназначен для лечения атеросклеротического заболевания. 25. Способ по п.23 или 24, отличающийся тем, что указанный образец содержит окисляющие липиды абзимы, специфичные к Chlamydia. 26. Способ по п.25, отличающийся тем, что указанный образец отбирают у пациента, имеющего атеросклеротическое заболевание. 27. Способ по п.26, отличающийся тем, что указанный образец представляет собой образец сыворотки крови или атеромы. 28. Способ по п.27, отличающийся тем, что указанный образец представляет собой образец, обогащенный IgG. 29. Способ по п.28, отличающийся тем, что указанный инактивирующий реагент представляет собой антиоксидант с низким рН. 30. Способ по п.29, отличающийся тем, что инактивирующий реагент представляет собой вещество,поглощающее гидроксильные радикалы. 31. Способ по п.30, включающий определение активности абзимов в отношении окисления липидов в присутствии тестируемого соединения. 32. Способ по п.31, включающий идентификацию указанного соединения в качестве ингибитора абзима.
МПК / Метки
МПК: G01N 33/573, G01N 33/53, G01N 33/569
Метки: абзимов, липиды, обнаружение, образцах, окисляющих
Код ссылки
<a href="https://eas.patents.su/14-11355-obnaruzhenie-okislyayushhih-lipidy-abzimov-v-obrazcah.html" rel="bookmark" title="База патентов Евразийского Союза">Обнаружение окисляющих липиды абзимов в образцах</a>
Предыдущий патент: Способ выработки газа-фумиганта ( варианты ), композиция для выработки газа-фумиганта ( варианты ) и способ фумигации (варианты )
Следующий патент: Способ химико-механического получения функциональных коллоидов, функциональные коллоиды, полученные этим способом, и их применение
Случайный патент: Усовершенствованный процесс гидроформилирования, катализируемый комплексом металл-лиганд