Система подачи невязкого полимерного раствора на основе простагландина, не содержащего консервант
Формула / Реферат
1. Офтальмологический раствор, содержащий
от 0,002 до 0,15% вес./об. по меньшей мере одного простагландина;
от 0,1 до 20% вес./об. солюбилизирующего агента, выбранного из группы, включающей глицерилгидроксистеарат макрогола, полиоксил-15-гидроксистеарат, полисорбат 20, полисорбат 60 или полисорбат 80;
от 0,05 до 0,2% вес./об. желатинирующего агента, представляющего собой карбомер;
агент, ингибирующий полимеризацию карбомера, причем агент, ингибирующий полимеризацию карбомера, представляет собой ЭДТА натрия, ацетат натрия или хлорид натрия, в концентрации от 0,01 до 1% вес./об.;
от 0,5 до 2,5% вес./об. Со-желатинирующего/со-солюбилизирующего агента, выбранного из группы, включающей полиэтиленгликоль (ПЭГ), поливиниловый спирт (ПВС) или поливинилпирролидон (ПВП);
отличающийся тем, что раствор имеет вязкость по Брукфельду при 25°C в диапазоне от 8 до 20 мПа×с, и тем, что в растворе отсутствует консервирующий агент антимикробного типа.
2. Раствор по п.1, имеющий следующий состав:

3. Раствор по п.1, имеющий следующий состав:
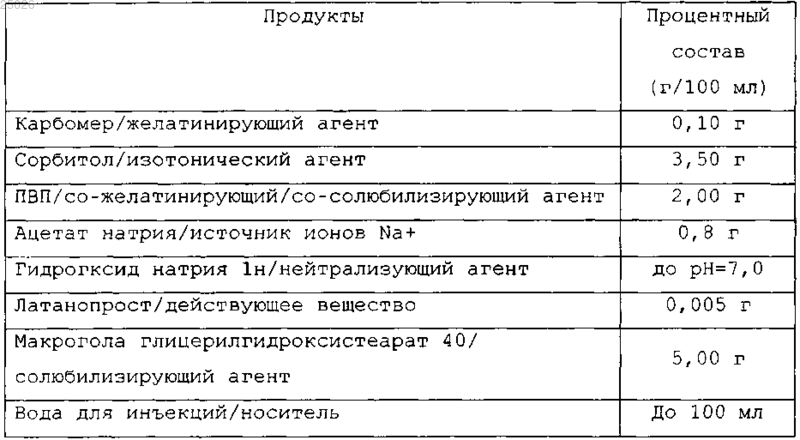
4. Раствор по п.1, имеющий следующий состав:

5. Раствор по п.1, отличающийся тем, что вязкость составляет от 10 до 14 мПа×с.
6. Раствор по п.1 или 2, отличающийся тем, что агентом антимикробного типа является четвертичный аммоний, более конкретно хлорид бензалкония (BAK).
7. Раствор по одному из пп.1, 5 и 6, отличающийся тем, что концентрация желатинирующего агента карбомера составляет 0,05-0,15% мас./об.
8. Раствор по одному из пп.1 и 5-7, отличающийся тем, что простагландин выбран из группы, включающей изопропиловый эфир 17-фенил-13,14-дигидротринорпростагландина F2α (латанопрост), 20-этилпростагландин F2α, (+)-флупростенола изопропиловый эфир (травопрост), 17-фенилтринорпростагландин F2α амид, 17-фенил-13,14-дигидротринорпростагландин F2α этиламид (биматопрост), тафлупрост простагландин F2α этаноламид, биматопрост (свободная кислота)-d4, биматопрост-d4, латанопростэтиламид, 13,14-дигидро-15-кето-20-этилпростагландин F2α (унопростон), 13,14-дигидро-15-кето-20-этилпростагландина F2α изопропиловый эфир (унопростона изопропиловый эфир), преимущественно латанопрост.
9. Раствор по одному из пп.1-8, отличающийся тем, что раствор является стабильным в течение периода не менее 18 месяцев при комнатной температуре (25 или 30°C).
10. Раствор по одному из пп.1-9, отличающийся тем, что он помещен во флаконы одноразового или многоразового пользования, выполненне из ПЭНД без добавок.
11. Раствор по одному из пп.1-10, отличающийся тем, что он дополнительно содержит антиглаукомный агент, выбранный из группы, содержащей бета-блокаторы, ингибиторы карбоангидразы и альфа-адренергические агонисты.
12. Раствор по одному из пп.1-11, отличающийся тем, что он дополнительно содержит добавку, выбранную из группы, включающей изотонизирующие агенты, антиоксиданты и буферные системы.
13. Раствор по одному из пп.1-12, предназначенный для лечения глаукомы и/или снижения внутриглазного давления.
14. Раствор по п.13 для введения человеку или животному топическим путем по одной капле в сутки упомянутого раствора в каждый глаз.
15. Флакон для одноразового или многоразового пользования, выполненный из ПЭНД без добавок, содержащий офтальмологический раствор согласно одному из пп.1-12.
Текст
СИСТЕМА ПОДАЧИ НЕВЯЗКОГО ПОЛИМЕРНОГО РАСТВОРА НА ОСНОВЕ ПРОСТАГЛАНДИНА, НЕ СОДЕРЖАЩЕГО КОНСЕРВАНТ Изобретение относится к офтальмологическому раствору, содержащему от 0,002 до 0,15% вес./об. по меньшей мере одного простагландина; от 0,1 до 20% вес./об. солюбилизирующего агента, выбранного из группы, включающей глицерилгидроксистеарат макрогола, полиоксил-15-гидроксистеарат, полисорбат 20, полисорбат 60 или полисорбат 80; от 0,05 до 0,2% вес./об. желатинирующего агента, представляющего собой карбомер; агент,ингибирующий полимеризацию карбомера, причем агент, ингибирующий полимеризацию карбомера, представляет собой ЭДТА натрия, ацетат натрия или хлорид натрия, в концентрации от 0,01 до 1% вес./об.; от 0,5 до 2,5% вес./об. со-желатинирующего/со-солюбилизирующего агента,выбранного из группы, включающей полиэтиленгликоль (ПЭГ), поливиниловый спирт (ПВС) или поливинилпирролидон (ПВП); отличающемуся тем, что раствор имеет вязкость по Брукфельду при 25C от 8 до 20 мПас, и тем, что в растворе отсутствует консервирующий агент антимикробного типа. Область техники Изобретение относится к глазным каплям или к глазному раствору, содержащему в качестве действующего вещества по меньшей мере один простагландин, причем упомянутый раствор не содержит консерванта антимикробного типа, в частности типа четвертичного аммония (например, бензалкония хлорида (ВАК. Более конкретно, в рамках настоящего изобретения разработана система подачи полимера, позволяющая раствору простагландина сохранять такую же эффективность, как и раствор, содержащий ВАК,но не иметь недостатков, связанных с токсичностью и аллергенностью. Уровень техники Простагландины являются хорошо известными действующими веществами, которые вводят человеку или животному топическим путем в виде капель для лечения глаукомы. Обычная дозировка этих препаратов составляет 1 капля/сутки в оба глаза с учетом того, что простагландины могут использоваться в виде ассоциаций со вторым антиглаукомным агентом, таким, например, как бета-блокатор, ингибитор карбоангидразы или альфа-адренергический агонист. Первый недостаток простагландинов заключается в том, что они не растворяются в воде, поэтому для растворения их внутри капель необходимо осуществить предварительный этап солюбилизации. Кроме того, другое требование для составителя заключается в том, чтобы офтальмологический раствор был бы химически стабильным во времени при комнатной температуре, практически, в течение периода от 18 до 24 месяцев. Другая характеристика, предъявляемая к офтальмологическому раствору, относится к стабильности раствора по отношению к упаковке, в которой он хранится, в частности, по отношению к упаковке из полимерного материала типа полиэтилена низкой плотности (ПЭНП). Наконец, последним требованием, которое может быть предъявлено, является устранение загрязненности офтальмологического раствора антимикробными агентами, в частности, в случае, когда упаковка, в которой находится раствор, является многодозовой. Однако эта последняя проблема решается с помощью однодозовой упаковки или устройства, предусмотренного для этой цели (например, системаABAK или COMOD). Таким образом, до сих пор большинство офтальмологических растворов на основе простагландинов, выпускаемых на рынок, содержат консервант, который, помимо своих антимикробных свойств,обеспечивает также солюбилизацию действующего вещества и отчасти его стабильность. Это относится,например, к продукту, выпускаемому фирмой PFIZER под наименованием Ксалатан, содержащему в своем составе латанопрост и BAK на уровне 0,02 мас.%. Однако следует отметить, что, несмотря на присутствие BAK, эти глазные капли нестабильны при комнатной температуре и должны храниться на холоде при температуре около 5C. Кроме того, фирмой ALLERGAN выпускаются глазные капли под наименованием Люмиган, содержащие в своем составе биматопрост и BAK на уровне 0,005 мас.%. Однако в многочисленных публикациях не рекомендуется использовать консервант антимикробного типа, в частности BAK, в офтальмологических целях в случае продолжительного лечения, как, в частности, глаукомы, из-за проблем переносимости (см. The New Class of Ophthalmic Agents: "Here's how tomanagement, выпуск май 2002). С тех пор установлено, что консерванты антимикробного типа являются токсичными при длительном применении и поэтому в настоящее время существует стремление ограничить их использование путем максимального уменьшения их концентрации в глазных каплях и даже исключить их из состава. Эта проблема была, например, рассмотрена в документе WO 97/29752, в котором раскрыто использование неионного агента типа Кремофор вместо части BAK. В предложенном составе концентрацияBAK ограничена содержанием 0,01 мас.%, при этом концентрация Кремофора EL составляет 0,05 мас.% На рынке существует продукт под наименованием Траватан, выпускаемый фирмой ALCON, содержащий в своем составе травопрост, BAK и Кремофор. Предложен также полисорбат 80 для использования в офтальмологических растворах с целью частичного снижения концентрации BAK, как, например, продукт, выпускаемый фирмой NOVARTIS под наименованием РЕСКУЛА, содержащий в своем составе унопростон и смесь BAK с полисорбатом 80,составляющую 0,015 мас.%, от раствора. В документе US 2004/0082660 описан офтальмологический раствор, не содержащий BAK, но содержащий смесь латанопроста с полисорбатом 80. Таким образом, задача, которую предлагает решить изобретение, заключается в разработке состава на основе простагландина, который должен выполнять, по меньшей мере, следующие условия: он не должен содержать антимикробный консервант; он должен быть стабилен во времени в форме раствора при комнатной температуре (минимум в течение периода от 18 до 24 месяцев); он должен быть совместим с пластиковым материалом упаковки, в которой он обыкновенно хранится, в частности упаковки из ПЭНП; он должен иметь практически такую же эффективность в отношении снижения внутриглазного дав-1 025026 ления (ВГД), что и эффективность используемого состава на основе BAK. Другая цель изобретения состоит в том, чтобы предложить достаточно текучий состав, пригодный для упаковывания по технологии асептической упаковки типа "Blow-Fill-Seal" (однодозовая). Описание изобретения Таким образом, заявителем разработана новая система подачи, которая позволяет простагландину действовать с эффективностью, сходной с эффективностью, которая достигается в присутствии BAK. Действительно, кроме своей роли консерванта, BAK и, более широко, соединения четвертичного аммония, имеют так называемый эффект "мыла", который позволяет молекулам действующего вещества широко проникать в ткани глаза, однако при этом они оказывают токсический эффект (раздражение, сухость глаза, воспаление и пр.). Поэтому система подачи, разработанная в рамках изобретения, позволяет достичь эквивалентного проникновения и эквивалентной активности благодаря отличающемуся механизму действия. Как бы то ни было, состав не имеет недостатков, присущих классическим консервантам типа BAK. Более конкретно, настоящее изобретение относится к офтальмологическому раствору, который содержит по меньшей мере один простагландин; солюбилизирующий агент; желатинирующий агент типа карбомера; агент, ингибирующий полимеризацию карбомера; со-желатинирующий/со-солюбилизирующий агент. Как говорилось выше, в таком растворе преимущественно отсутствует консервант антимикробного типа, преимущественно консервант типа четвертичного аммония, еще более преимущественно бензалкония хлорид (BAK). Далее в описании под термином "консервант антимикробного типа или антимикробный консервант" обозначают консервант, обладающий антимикробными свойствами, т.е. соединение, способное гарантировать защиту офтальмологического раствора от возможного микробного заражения. Такой агент согласно изобретению следует отличать от консервантов, воздействующих на химическую консервацию раствора, таких, например, как антиоксиданты, такие как ЭДТА. Заявленный раствор содержит в качестве действующего вещества по меньшей мере один простагландин. На практике простагландины находятся в растворе в количестве не менее одного и их выбирают из группы, включающей изопропиловый эфир 17-фенил-13,14-дигдротринорпростагландина F2 (латанопрост), 20-этилпростагландин F2, (+)-флупростенола изопропиловый эфир (травопрост), 17 фенилтринорпростагландин F2 амид, 17-фенил-13,14-дигидротринорпростагландин F2 этиламид (биматопрост), тафлупрост простагландин F2 этаноламид, биматопрост (свободная кислота)-d4, биматопростd4, латанопростэтиламид, 13,14-дигидро-15-кето-20-этилпростагланидин F2 (унопростон), 13,14 дигидро-15-кето-20-этилпростагланидина F2 изопропиловый эфир (унопростона изопропиловый эфир). Преимущественно, используют латанопрост. Согласно другой характеристике концентрация простагландина в растворе составляет 0,002-0,15% мас./об. Общеизвестно, что простагландин или простагландины могут быть скомбинированы со вторым действующим веществом, в частности с антиглаукомными агентами других классов, способными взаимодействовать с образованием синергического эффекта. Можно использовать, например, бетаблокаторы, выбираемые из группы, содержащей тимололмалеат и картеололхлорид, ингибиторах карбоангидразы, таких, например, как продукты, выбираемые из группы, содержащей хлорид дорзоламида,или альфа-адренергические агонисты, такие как, например, тартрат бримонидина. Примерами комбинаций простагландинов и бета-блокаторов могут быть, напримерXalacom - Pfizer: Латанопрост 0,005% + Тимолол 0,5%,Ganfort - Allergan: Биматопрост 0,03% + Тимолол 0,5%,Duotrav - Alcon: Травопрост 0,004% + Тимолол 0,5%. На практике антиглаукомный агент находится в растворе в количестве от 0,1 до 0,5% мас./об. Как говорилось выше, такой раствор должен содержать агент, называемый солюбилизирующий,способный солюбилизировать простагландин или простагландины. Этот солюбилизирующий агент,предпочтительно неионный, обладает преимущественно поверхностно-активными свойствами. Предпочтительно, это глицерилгидроксистеарат макрогола (гидрированное и этоксилированное касторовое масло или ПЭГ-40 Hydrogenated Castor Oil; номер CAS 61788-85-0). Другим возможным представителем является полиоксил-15-гидроксистеарат или макрогол-15-гидроксистеарат (номер CAS 70142-34-6), а также полисорбат-20 (номер CAS 9005-64-5), полисорбат-60 (номер CAS 9005-67-8) или полисорбат-80 (номерCAS 9005-65-6). Концентрация солюбилизирующего агента в растворе обычно составляет от 0,1 до 20% мас./об.,преимущественно от 0,5 до 5% мас./об. Другой важной характеристикой офтальмологического раствора является вязкость. Так, вязкость преимущественно составляет от 8 до 20 мПас (сП), более предпочтительно от 10 до 14 мПас (сП), когда измерение вязкости происходит с помощью визкозиметра с вращающимся шипинделем марки BROOKFIELD RVDV III при 25C. Следовательно, речь идет о растворе, который отличается от водного геля, характеризующегося обычно величиной вязкости от 400 до 800 мПас (сП), и представляет собой лекарственную ретард форму для достижения пролонгированного высвобождения действующего вещества. Таким образом, настоящее изобретение заключается в разработке адаптированной гелеобразующей системы, основанной на комбинации двух желатинирующих агентов и способной создать систему подачи невязкого полимера первого желатинирующего агента, в данном случае карбомера, полимеризующегося в обычных условиях с образованием геля, но полимеризация которого, расширение или сохранение формы геля ингибируется так называемым агентом обрыва цепи. Вышеупомянутый агент, ингибирующий полимеризацию карбомера, может служить источником ионов натрия, преимущественно это ЭДТА натрия, ацетат натрия или хлорид натрия. Как вариант, речь может идти о полиоле с низким молекулярным весом, таком как глицерин (см. FR 2604906). Кроме того, карбомер находится в растворе в контролируемой концентрации, преимущественно в диапазоне 0,05-0,2% мас./об. Очевидно, что относительная концентрация ингибирующего агента также является высокой: 0,01-1% мас./об. в случае ионов натрия, например 0,020,1% в случае ЭДТА натрия или 0,5-3% мас./об. в случае полиолов, например глицерина; второго агента, называемого со-желатинирующий/со-солюбилизирующий, который предназначен для того, чтобы добиться заданного уровня вязкости и потенцировать солюбилизацию действующего вещества простагландина. Обычно речь идет о полимере типа полиэтиленгликоля (ПЭГ) или типа виниловых производных как поливиниловый спирт (ПВС) или поливинилпирролидон (ПВП). Преимущественно, его концентрация составляет от 0,5 до 2,5% мас./об. Характеристика карбомера согласно изобретению дана в Европейской фармакопее, а именно: "сшитый полимер акриловой кислоты с очень высокой относительной молекулярной массой и большим содержанием карбоксильных групп", под номером Cas 9003-01-4. Существуют различные типы карбомеров, используемых согласно изобретению: 910/934/934P/940/941/971 и 974 Р, преимущественно 974 Р. Характеристика ПЭГ или макрогола согласно изобретению дана в Европейской фармакопее, а именно: "смесь полимеров общей формулы H-(OCH2-CH2)n-OH, где n обозначает среднее число оксиэтиленовых групп". Тип макрогола характеризуется числом, указывающим на среднюю относительную молекулярную массу. Преимущественно, это ПЭГ 4000, который имеет номер CAS 25322-68-3. Разумеется, композиция согласно изобретению может содержать обычные добавки, за исключением антимикробных консервантов. Можно использовать, например, изотонические агенты неионного типа,такие как полиолы (например, сорбитол). Можно также использовать антиоксиданты или буферные системы (например, гидроксид натрия в качестве нейтрализующего агента). В соответствии с конкретным вариантом осуществления композиция согласно изобретению состоит из ингредиентов, перечисленных в нижеприведенной таблице, преимущественно согласно указанному процентному составу Композиция согласно изобретению может находиться во флаконах для одноразового использования(однодозовый) или в многодозовых флаконах, например, типа Abac или Comod или эквивалентного типа, такие флаконы позволяют осуществлять подачу глазных капель без консервантов в течение нескольких дней. Таким образом, изобретение относится к одноразовому (однодозовому) или к многодозовому (многоразовому) флакону, содержащему офтальмологический раствор, описанный выше, и выполненному из ПЭНД европейского качества (EP), не содержащего добавок. Действительно, текучесть раствора в сочетании со стабильностью продукта, если он упакован в контейнеры из ПЭНД, делает его изготовление совместимым с технологией BFS. Кроме того, раствор согласно изобретению является стабильным по меньшей мере в течение 18 месяцев, даже по меньшей мере в течение 24 месяцев при комнатной температуре (25-30C). Изобретение относится также к применению офтальмологического раствора, описанного выше, для получения лекарственного средства, предназначенного для лечения глаукомы у человека или животных,в частности, в связи с его способностью снижать внутриглазное давление и/или обеспечивать нейрозащиту тканей сетчатки. Таким образом, в рамках настоящего изобретения было доказано, что эта система подачи является менее агрессивной для тканей глаза, чем системы солюбилизации согласно уровню техники, поскольку снижение внутриглазного давления происходит более равномерно и линейно после введения раствора. Практически, глазные капли вводят из расчета одна капля в сутки в каждый глаз. Изобретение относится также к терапевтическому способу лечения глаукомы у человека или животных, состоящему в инстилляции офтальмологического раствора, описанного выше, из расчета одна капля в сутки в каждый глаз. Было обнаружено, что в отличие от растворов, предлагаемых согласно уровню техники, введение композиции согласно изобретению сопровождается равномерным и постепенным снижением внутриглазного давления (ВГД), без промежуточного увеличения начального транзиторного ВГД. При использовании композиции согласно изобретению снижение ВГД начинается быстрее и достигается по меньшей мере одинаковый или даже улучшенный эффект. Не связывая себя какой-либо теорией, этот эффект в отношении ВГД можно было бы объяснить наличием матрицы подачи раствора, способной исключить или по меньшей мере ослабить агрессивный характер солюбилизирующего агента. Кроме того, композиция согласно изобретению является чрезвычайно толерантной. Изобретение и преимущества, вытекающие из него, лучше всего поясняют примеры его осуществления со ссылкой на приложенные фигуры. Фиг. 1 иллюстрирует эффект от 2 рецептур глазных капель, содержащих 0,005% латанопроста(композиция примера 1, помеченная сплошным треугольником, и Ксалатан, помеченный сплошными кружками) на внутриглазное давление (ВГД) у крыс; фиг. 2 показывает клинические данные, относящиеся к переносимости композиции примера 1 против Ксалатана: А. Субъективные глазные симптомы, связанные с инстилляцией раствора; В. Субъективные глазные симптомы, не связанные с инстилляцией; С. Общая конъюктивальная гиперемия. 1. Композиция согласно изобретению. 1 а. Композиция примера 1 2. Характеристика состава примера 1. Полученный раствор опалесцентный, без видимых частиц, с pH от 6,6 до 7,2 (состав с нейтральнымpH) и с осмоляльностью 270-340 мосмоль/кг (состав изотонический). Вязкость раствора, измеренная с помощью визкозиметра Брукфельда с вращающимся шпинделем(шпиндель n 00/камера измерения UL) составляет 8,0-14,0 мПас при 25C. Кроме того, раствор показал себя стабильным в течение по меньшей мере 24 месяцев при комнатной температуре (25 или 30C). 3. Эффективность композиции примера 1. Оценка эффективности снижения внутриглазного давления в результате введения в глаза нормотензивным крысам-альбиносам. Эффективность глазных капель состава примера 1 на внутриглазное давление оценивалась на нормотензивной крысе и сравнивалась с глазными каплями, используемыми в клиниках, а именно с продуктом Ксалатан, причем каждый из продуктов содержал латанопрост в концентрации 0,005%. Важно то,что Ксалатан содержит антимикробный агент безалкония хлорид (BAK), а формула примера 1 не содержит его. В этом эксперименте было использовано 16 крыс-самцов альбиносов (Wistar). Крыс распределяли на 2 группы, каждая из которых включала 8 животных, получавших соответственно состав примера 1 и референсный продукт Ксалатан. Всех животных лечили на уровне правого глаза путем введения 4 инстилляций по 10 мкл каждая, проводимых каждые 2 мин при общем содержании латанопроста 2 мкг. Измерения внутриглазного давления (ВГД) проводили с помощью устройства "Tonolab rebound tonometer" на обоих глазах спустя 1, 2, 4, 6 и 8 ч после введения препарата. Результаты этого испытания показаны на фиг. 1. У крысы Wistar введенная доза Ксалатана вызывала двухфазное изменение ВГД, а именно, увеличение начального давления (+11,4%) с пиком на уровне 1 ч после введения с последующим продолжительным гипотензивным ответом в промежутке от 2 до 8 ч после лечения с пиком снижения ВГД в момент t=4 ч (-18,4%). Такая же доза (2 мкг) латанопроста в составе примера 1 постоянно и постепенно снижала ВГД и достигла в момент t=4 ч снижения на 16% после топического введения. Этот эффект продолжался от 4 до 8 ч с пиком максимального снижения ВГД(-20%) в момент t=6 ч. В заключение следует отметить, что имелась первоначальная гипертензивная фаза, наблюдаемая с Ксалатаном, но отсутствующая при использовании состава примера 1 у нормотензивной крысы; состав примера 1 вызывал снижение ВГД, которое относительно близко по значению давлению, наблюдаемому с референсным продуктом, используемым в клиниках, а именно с Ксалатаном; отсутствие BAK в растворе примера 1 не сказывалось на эффекте снижения ВГД. 4. Переносимость композиции примера 1 тканями глаза. Переносимость продукта примера 1 тканями глаза по сравнению с переносимостью Ксалатана исследовалась в течение 28 дней путем проведения двух ежедневных инстилляций (50 мкл) пигментированным кроликам. Исследование привело к следующим результатам: на уровне общей переносимости все животные имели нормальное увеличение веса тела, хорошее здоровье и не проявили каких-либо особых симптом. Потребление воды и корма также протекало нормально; на уровне переносимости тканями глаза введение продукта примера 1 не оказывало эффекта на глаза, за исключением легкого и временного покраснения у 1 животного из 10. Что касается Ксалатана, то он не оказывал эффекта на глаза, за исключением легкого и временного покраснения у 2 животных из 10. Независимо от способа лечения наблюдалась окраска роговицы у некоторых животных. 1. Пример 1: от легкой до умеренной у 6 животных из 10. 2. Ксалатан: легкая у 4 животных из 10. 3. Контрольная группа: от легкой до умеренной у 7 животных из 10. Такой эффект на глаза отслеживался в ходе исследования на переносимость, когда осуществляли ежедневные повторяющиеся топические введения в глаза в течение последовательных 28 дней. Никакого другого эффекта на глаза не было обнаружено в ходе этого исследования. Введение состава примера 1 или Ксалатана не оказывало макроскопического действия на органы. Гистологический анализ тканей 2 глаз (обработанный и не обработанный) не показал никаких признаков патологии независимо от способа лечения. Как введение Ксалатана, так и введение состава примера 1 не оказывало микроскопического действия на глаза. В заключение можно сказать, что в результате двух ежедневных инстилляций по 50 мкл состава примера 1 (латанопрост 0,005%) в течение 28 дней в правый глаз пигментированных кроликов наблюдалось очень легкое воздействие на глаза и близкое тому, что наблюдалось в контрольной группе, обработанной глазными каплями Ксалатан 0,005%. Наблюдаемое воздействие на глаза рассматривалось как неспецифическое и обуславливалось главным образом повторением ежедневных инстилляций в течение 28 последовательных дней. Следовательно, в этих условиях эксперимента введение продукта примера 1 было высоко толерантным на макроскопическом и микроскопическом уровне, как и продукта Ксалатан. 5. Клинические исследования композиции примера 1. 5-1. Эффективность. Введение. Пилотное рандомизированное, простое слепое, многоцентровое, перекрестное клиническое исследование II фазы, проведенное в течение 3 месяцев с участием 30 пациентов, было осуществлено с целью сравнения фармакокинетики, эффективности и безопасности офтальмологического состава примера 1(латанопрост 0,005%) с препаратом также содержащим латанопрост в концентрации 0,005% (Ксалатан), на пациентах, у которых была диагностирована первичная открытоугольная глаукома или глазная гипертензия. Цель этого исследования состояла в сравнении результатов, полученных после одноразовой инстилляции офтальмологического препарата, содержащего латанопрост (без консерванта), и глазных капель Ксалатан (с хлоридом бензалкония в качестве консерванта) спустя 6 недель после лечения одним из 2 выбранных препаратов и 6 недель после лечения вторым выбранным препаратом, у пациентов, у которых была диагностирована первичная открытоугольная глаукома или глазная гипертензия. Это исследование проводили в соответствии с принятыми правилами качественной клинической практики (Good Clinical Practice или GCP), при необходимости, в соответствии со специфическими требованиями и Хельсинской декларацией (2004) и с местными нормативными требованиями. Протокол. Во время первого визита (Визит 1) пациентов отбирали случайным образом для проведения одного из 2 следующих способов лечения: состав на основе латанопроста 0,005%, содержащий консервант (многодозовый [MD], Ксалатан),вводимый один раз в сутки в 20 ч в оба глаза в течение 6 недель,состав на основе латанопроста 0,005% без консерванта (однодозовый [SDU], пример 1), вводимый один раз в сутки в 20 ч в оба глаза в течение 6 недель. По окончании упомянутых 6 недель субъектов испытаний поменяли и назначили им другое исследуемое лекарство (без периода промывки), т.е. те пациенты, которые получали первый состав с консервантом, в течение второго периода получали состав без консерванта и наоборот. Продолжительность второго периода исследования составила также 6 недель. Все пациенты осуществили 3 визита в исследовательский центр в процессе проведения исследования: визит для включения пациента в исследование (день 0), последующий визит (день 42) и завершающий визит (день 84). Показатель ВГД оценивали в каждом глазу в день 0, день 42 и день 84 в 8 ч (30 мин), 12 ч(30 мин), 16 ч (30 мин) и 20 ч (30 мин). Общая эффективность также оценивалась исследователем. Безопасность и переносимость препарата оценивались одновременно пациентами и исследователями. Результаты. Результаты представлены в следующей таблице. Среднее значение ВГД, полученное после лечения Ксалатаном или продуктом примера 1 Различия между средними значениями ВГД двух продуктов не являются статистически значимыми,независимо от времени их измерения. Среднесуточное значение ВГД снизилось на 6,14 мм рт.ст. (27,2%) после 6 недель терапевтического лечения с помощью Ксалатана и на 5,94 мм рт.ст. (26,3%) после 6 недель терапевтического лечения с помощью продукта примера 1. Следовательно, эффективность снижения ВГД от двух способов лечения является сопоставимой,при этом достигалось "нормальное" значение ВГД в результате двух способов лечения. Учитывая данные измерений в момент физиологического пика ВГД в 8 ч можно отметить: Ксалатан оказывал эффект снижения ВГД немного лучше, приблизительно на 0,7 мм рт.ст. Однако эта разница не имеет статистического значения (p=0,118). Кроме того, эта тенденция снижается на протяжении всего дня и инверсируется во второй половине дня и вечером, иллюстрируя таким образом эффект продукта примера 1 в течение целого дня, что уже наблюдалось во время исследования изменения снижения ВГД у нормотензивных крыс-альбиносов. Таким образом, состав примера 1 является эффективным в отношении ВГД, начиная с 8 ч утра, и остается таким же эффективным в течение целого дня, несмотря на отсутствие консерванта. В заключение можно сказать, что среднесуточные значения ВГД после 6 недель лечения 2 способами статистически не различаются, при этом отмечается эффективность со стороны продукта примера 1,не содержащего консервант, характеризующаяся поддержанием значения ВГД, называемого "нормальным", на протяжении всего дня. 5-2. Переносимость. Введение. Целью фазы III клинических исследований, кроме оценки эффективности препарата в отношении снижения внутриглазного давления, является оценка переносимости и безопасности глазных капель согласно примеру 1 (латанопрост 0,005% однодозовые глазные капли без консерванта) в сравнении с Ксалатаном (латанопрост 0,005% многодозовые глазные капли, содержащие консерванты) на пациентах,страдающих глазной гипертонией или глаукомой, получавших лечение путем ежедневной инстилляции глазных капель в течение 3 месяцев. Протокол. Международное многоцентровое, рандомизированное, простое слепое исследование с участием 2 параллельных групп было проведено в отношении референсного продукта на 360 обследованных пациентах, которые получали лечение в течение 3 месяцев. Были запрограммированы: отборочный визит (J42 для дня 42), визит для включения пациента в исследование (J0) и 3 последующие визиты J15, J42 и J84. Всего было отобрано 463 пациента, 404 пациента были включены в исследование и рандомизированы и 402 пациентам было назначено целевое лечение: 213 пациентов находились в группе примера 1 и 189 пациентов в группе Ксалатана. В итоге закончили исследование 392 пациента: 206 в группе примера 1 и 189 в группе Ксалатана. Популяция пациентов, отобранная для оценки переносимости и безопасности глазных капель, состояла из 213 пациентов в группе примера 1 и 189 пациентов в группе Ксалатана. Выборка mITTT (дляProtocol") состояла из 177 пациентов в группе примера 1 и 153 в группе Ксалатана. Популяция, отобранная для оценки переносимости и безопасности глазных капель, не различалась значительно по демографическим или другим исходным характеристикам, за исключением немного более высокого процентного содержания пациентов женского пола в группе примера 1 (53,5%) по сравнению с группой Ксалатана (45,5%). Возраст варьировал в диапазоне от 24 до 93 лет при среднем значениистандартное отклонение (CO) 64,711,5 лет. Популяция, отобранная для оценки переносимости и безопасности глазных капель, имела толщину роговицы, варьирующую от 500 до 610 мкм при среднем значенииCO, составляющем 54222 мкм в группе примера 1 и 54322 мкм в группе Ксалатана. Средняя продолжительность лечения (в среднем 83 дня) была сравнима для 2 групп лечения. Строгое следование схеме лечения, основанного на инстилляциях, соблюдалось более чем на 98% в каждой лечимой группе. Результаты. Нежелательные явления со стороны глаз. Нежелательные явления со стороны глаз (НЯ) обнаружены у 18 (8,5%) пациентов в группе примера 1 против 22 (11,6%) в группе Ксалатана. Наиболее частым явлением независимо от группы была непереносимость лекарственного средства, которая отмечалась у 1 (0,5%) пациента в группе примера 1 против 4(2,1%) пациентов в группе Ксалатана. Был отмечен сильный дискомфорт в глазах пациентов группы примера 1 и другие явления умеренной или слабой интенсивности. Нежелательные явления со стороны глаз, связанные с изучаемыми лекарственными средствами, обнаружены у 8 (3,8%) пациентов в группе примера 1 (включая 1 пациента с 1 умеренной фотофобией и 1 пациента с 1 легким кровоизлиянием в зрительный нерв, взаимосвязь с которым не была доказана) про-7 025026 тив 10 (5,3%) пациентов в группе Ксалатана. Прием лекарственного средства был прекращен в связи с НЯ со стороны глаз, отмеченными у 2 пациентов группы примера 1 (умеренная лекарственная непереносимость в день J7 и 1 умеренный зуд в глазах в день J28) и у 1 пациента в группе Ксалатана (1 умеренный аллергический конъюктивит в деньJ9). Все случаи НЯ со стороны глаз, которые явились причиной прекращения приема лекарственного средства, были связаны с препаратом, изучаемым исследователем. Все пациенты выздоровели, как только было прекращено его применение. Ни одного серьезного случая НЯ не было отмечено в этом испытании. Систематические нежелательные явления. Систематические НЯ были определены у 28 (13,1%) пациентов в группе примера 1 против 32(16,9%) в группе Ксалатана. Ни одно систематическое НЯ не было связано с изучаемым лекарственным средством в группе примера 1, но 6 случаев НЯ были обнаружены у 4 (2,1%) пациентов в группе Ксалатана, которые рассматривались исследователем как связанные с лечением (2 головные боли у одного и того же пациента, 1 головокружение, 1 мигрень и 1 сердцебиение и 1 мышечная слабость). Все симптомы были слабой интенсивности. Сильная депрессия в группе примера 1 и 1 умеренная мигрень в группе Ксалатана привели к прекращению приема тестируемого лекарственного средства, 6 пациентов имели серьезное НЯ (СНЯ): 5 пациентов в группе примера 1 (1 перелом болыпеберцовой кости, 1 сильная депрессия, 1 обморок, 1 боль в груди и 1 перелом малоберцовой кости) и 1 пациент в группе Ксалатана (1 почечные колики). Согласно заключению исследователя ни одно из них не имело отношения к лечению. Субъективные симптомы в результате инстилляции В целом субъективные глазные симптомы, связанные с инстилляцией (зуд, жжение/покалывание, ощущение слипшихся глаз, ощущение сухости глаз,ощущение инородного тела) были значительно менее частыми в группе примера 1, чем в группе Ксалатана в день J42 (p=0,001) и в день J84 (p=0,001) (см. ниже представленную таблицу). Это относится в первую очередь к симптому жжение/покалывание: 5,2% против 14,0% в день J15 (p=0,004), 6,8% против 15,1% в день J42 (p=0,006) и 7,3% против 19,9% в день J84 (p0,001) и к симптому зуд (1,5% против 5,4% в день J42 и 2,4% против 6,0% в день J84).ANOVA в применении к данной стране. Эти результаты приведены на фиг. 2 А. Субъективные симптомы, не связанные с инстилляцией. В целом отмечено меньшее число случаев субъективных глазных симптом, не связанных с инстилляцией, в худшем глазу пациентов группы примера 1 по сравнению с группой Ксалатана в день J42(0,471,19 против 0,651,54, p=0,057) и в день J84 (0,471,37 против 0,691,73, p=0,053). Аналогичные результаты получены на контрлатеральных глазах. Как в худшем, так и в контрлатеральном глазу ощущения раздражения/жжения/покалывания, не связанные с инстилляцией, появлялись менее часто в группе примера 1, чем в группе Ксалатана в деньJ42 (7,2% против 13,4%) и в день J84 (6,8% против 12,9%) причем в глазу, менее здоровом. Эти результаты иллюстрируются на фиг. 2 В. Несмотря на то что эти отличия статистически незначимы, имеется тенденция в пользу примера 1,которая подтверждает то, что наблюдалось уже при симптомах, связанных с инстилляцией. Обследование со щелевой лампой. В целом конъюктивальная гиперемия обнаруживалась менее часто в группе примера 1, чем в группе Ксалатана, в худшем глазу с частотой значительно более низкой в группе примера 1, чем в группе Ксалатана в день J42 (20,2% против 30,6%, p=0,003) и в день J84 (21,4% против 29,1%, p=0,019). Эти результаты иллюстрируются на фиг. 2 С. В каждом опыте не было выявлено никакого различия между способами лечения. Общая оценка, проведенная исследователем и пациентом. Согласно заключению исследователя переносимость была оценена как очень удовлетворительная или удовлетворительная у более чем 97% пациентов в двух группах лечения. Однако процент переноси-8 025026 мости как очень удовлетворительный был более высоким в группе примера 1, чем в группе Ксалатана в день J15 (65,1% против 59,7%) в день J42 (74,0% против 65,1%) и в день J84 (71, 4% против 62,9%). Учитывая все вариабельные параметры, значимые различия были обнаружены между 2 группами лечения в день J42 (p=0,013) и в день J84 (p=0,047). Результаты в день J15 не являлись статистически значимыми. В день J42 и J84 более 99% пациентов группы примера 1 и более 96% пациентов группы Ксалатан признали лечение приемлемым. В заключение следует отметить, что результаты по безопасности и переносимости препарата выявили лучшую местную переносимость препарата примера 1, чем Ксалатана в связи с меньшим количеством субъективных симптомов в результате инстилляции (в частности, зуд и жжение/покалывание) и с меньшим проявлением гиперемии. Переносимость чаще оценивалась как "очень удовлетворительная" у пациентов, лечившихся препаратом примера 1. Таким образом, это исследование доказывает, что местная переносимость композиции согласно изобретению (пример 1) оказывается лучшей, чем переносимость Ксалатана при достижении по меньшей мере такой же эффективности в отношении внутриглазного давления. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Офтальмологический раствор, содержащий от 0,002 до 0,15% вес./об. по меньшей мере одного простагландина; от 0,1 до 20% вес./об. солюбилизирующего агента, выбранного из группы, включающей глицерилгидроксистеарат макрогола, полиоксил-15-гидроксистеарат, полисорбат 20, полисорбат 60 или полисорбат 80; от 0,05 до 0,2% вес./об. желатинирующего агента, представляющего собой карбомер; агент, ингибирующий полимеризацию карбомера, причем агент, ингибирующий полимеризацию карбомера, представляет собой ЭДТА натрия, ацетат натрия или хлорид натрия в концентрации от 0,01 до 1% вес./об.; от 0,5 до 2,5% вес./об. со-желатинирующего/со-солюбилизирующего агента, выбранного из группы,включающей полиэтиленгликоль (ПЭГ), поливиниловый спирт (ПВС) или поливинилпирролидон (ПВП); отличающийся тем, что раствор имеет вязкость по Брукфельду при 25C в диапазоне от 8 до 20 мПас, и тем, что в растворе отсутствует консервирующий агент антимикробного типа. 2. Раствор по п.1, имеющий следующий состав: 5. Раствор по п.1, отличающийся тем, что вязкость составляет от 10 до 14 мПас. 6. Раствор по п.1 или 2, отличающийся тем, что агентом антимикробного типа является четвертичный аммоний, более конкретно хлорид бензалкония (BAK). 7. Раствор по одному из пп.1, 5 и 6, отличающийся тем, что концентрация желатинирующего агента карбомера составляет 0,05-0,15% мас./об. 8. Раствор по одному из пп.1 и 5-7, отличающийся тем, что простагландин выбран из группы, включающей изопропиловый эфир 17-фенил-13,14-дигидротринорпростагландина F2 (латанопрост), 20 этилпростагландин(травопрост),17 фенилтринорпростагландин F2 амид, 17-фенил-13,14-дигидротринорпростагландин F2 этиламид (биматопрост), тафлупрост простагландин F2 этаноламид, биматопрост (свободная кислота)-d4, биматопростd4, латанопростэтиламид, 13,14-дигидро-15-кето-20-этилпростагландин F2 (унопростон), 13,14-дигидро 15-кето-20-этилпростагландина F2 изопропиловый эфир (унопростона изопропиловый эфир), преимущественно латанопрост. 9. Раствор по одному из пп.1-8, отличающийся тем, что раствор является стабильным в течение периода не менее 18 месяцев при комнатной температуре (25 или 30C). 10. Раствор по одному из пп.1-9, отличающийся тем, что он помещен во флаконы одноразового или многоразового пользования, выполненные из ПЭНД без добавок. 11. Раствор по одному из пп.1-10, отличающийся тем, что он дополнительно содержит антиглаукомный агент, выбранный из группы, содержащей бета-блокаторы, ингибиторы карбоангидразы и альфаадренергические агонисты. 12. Раствор по одному из пп.1-11, отличающийся тем, что он дополнительно содержит добавку, выбранную из группы, включающей изотонизирующие агенты, антиоксиданты и буферные системы. 13. Раствор по одному из пп.1-12, предназначенный для лечения глаукомы и/или снижения внутриглазного давления. 14. Раствор по п.13 для введения человеку или животному топическим путем по одной капле в сутки упомянутого раствора в каждый глаз. 15. Флакон для одноразового или многоразового пользования, выполненный из ПЭНД без добавок,содержащий офтальмологический раствор согласно одному из пп.1-12.
МПК / Метки
МПК: A61K 47/14, A61K 31/557, A61K 9/00, A61K 49/00
Метки: подачи, система, невязкого, простагландина, консервант, основе, полимерного, содержащего, раствора
Код ссылки
<a href="https://eas.patents.su/12-25026-sistema-podachi-nevyazkogo-polimernogo-rastvora-na-osnove-prostaglandina-ne-soderzhashhego-konservant.html" rel="bookmark" title="База патентов Евразийского Союза">Система подачи невязкого полимерного раствора на основе простагландина, не содержащего консервант</a>
Предыдущий патент: Портативное устройство связи, система и способ связи между локальным терминалом и множеством портативных устройств
Следующий патент: Способ лечения острого нарушения мозгового и спинального кровообращения ишемического и геморрагического характера
Случайный патент: Транспортное средство и способ улучшения его эксплуатационных характеристик
















