Анализ на токсины, имеющие мишень фосфатазу
Номер патента: 2710
Опубликовано: 29.08.2002
Авторы: Дёскеланд Стейн Ове, Серрес Маргрете Хауге, Фладмарк Кари Эсполин
Формула / Реферат
1. Способ анализа на определение токсинов, имеющих мишень фосфатазу, которые ингибируют фосфопротеидфосфатазы, при котором твердую подложку с иммобилизованным на ней лигандом, приводят в контакт с
(1) образцом, подозреваемым в заражении токсином, и
(2) неиммобилизованным лигандом,
причем указанный иммобилизованный лиганд способен связываться, по меньшей мере, с одним из указанных токсинов, указанным неиммобилизованным лигандом или комплексами указанного токсина и указанного неиммобилизованного лиганда и указанный неиммобилизованный лиганд способен связываться, по меньшей мере, с одним из указанных иммобилизованных лигандов, указанным токсином или комплексами указанного токсина и указанного иммобилизованного лиганда, в соответствии с чем количество указанного иммобилизованного лиганда, связанного указанным токсином, указанным неиммобилизованным лигандом или комплексами указанного токсина и указанного неиммобилизованного лиганда, зависит от содержания токсина в указанном образце,
и причем указанный иммобилизованный и/или неиммобилизованный лиганд, связывающий токсин, представляет собой фермент фосфопротеидфосфатазу, и
причем указанный иммобилизованный лиганд способен генерировать непосредственно или косвенно различимый сигнал, когда комплекс не образуется, при образовании комплекса с указанным токсином, при образовании комплекса с комплексом указанного токсина и указанного неиммобилизованного лиганда или при образовании комплекса с указанным неиммобилизованным лигандом, либо указанный неиммобилизованный лиганд способен генерировать непосредственно или косвенно различимый сигнал, когда комплекс не образуется, или при образовании комплекса,
отделяют связанную фракцию от несвязанной фракции и
непосредственно или косвенно определяют неиммобилизованный лиганд, связанный с иммобилизованным лигандом (связанная фракция) или не образовавший комплекс в водном растворе (несвязанная фракция),
причем применение (1) и (2) по отношению к твердой подложке можно осуществить отдельно, последовательно или одновременно, и если отдельно или последовательно, то их можно осуществить в любом порядке.
2. Способ анализа по п.1, где указанный токсин, имеющий мишень фосфатазу, продуцируют водоросли или цианобактерии и, предпочтительно, где указанный токсин, который определяют, является гепатотоксином или окадаевой кислотой.
3. Способ анализа по любому из пп.1-2, где молекулы токсина, присутствующие в образце, конкурируют с неиммобилизованным лигандом за ограниченное количество сайтов связывания иммобилизованного лиганда, и любой токсин, присутствующий в указанном образце, определяют по отношению к объему неиммобилизованного лиганда, связанного или не связанного с сайтами связывания иммобилизованного лиганда.
4. Способ анализа по любому из пп.1-3, при котором определяют присутствие или отсутствие токсина, имеющего мишень фосфатазу.
5. Способ анализа по любому из пп.1-4, где исследуемый образец является поверхностной или свободной влагой из моллюсков, или водой, взятой из естественной среды, в которой живут такие моллюски, или водой, взятой из коммунально-бытового водоснабжения.
6. Способ анализа по любому из пп.1-5, где иммобилизованный или неиммобилизованный лиганд является антителом или фрагментом антитела.
7. Способ анализа по любому из пп.1-6, где фермент фосфопротеидфосфатаза является связывающим лигандом фосфопротеидфосфатазой 2А.
8. Способ анализа по любому из пп.1-7, где либо иммобилизованный, либо неиммобилизованный лиганды несут репортерную группировку и где предпочтительно неиммобилизованный лиганд несет репортерную группировку.
9. Способ анализа по п.8, где неиммобилизованный лиганд является меченным пептидным гепатотоксином или меченной окадаевой кислотой и где гепатотоксин предпочтительно выбран из нодулярина, микроцистина LC или микроцистина YR.
10. Способ анализа по любому из пп.1-9, где твердая подложка является измерительным стержнем или твердой матрицей и где твердая матрица предпочтительно является полимерными или магнитными шариками.
11. Набор для определения токсинов, имеющих мишень фосфатазу, которые ингибируют фосфопротеидфосфатазы, включающий в себя
твердую фазу, на которой иммобилизован лиганд,
неиммобилизованный лиганд, предпочтительно в водном растворе или в комплексе с иммобилизованным лигандом,
и причем иммобилизованный и/или неиммобилизованный лиганд является ферментом фосфопротеидфосфатазой, где ни один из указанных иммобилизованного и неиммобилизованного лигандов не включает в себя непосредственно или косвенно обнаружимую группировку, репортерную группировку, способную связываться с одним из указанных иммобилизованных и неиммобилизованных лигандов и генерировать различимый сигнал, причем, предпочтительно, указанная обнаружимая группировка или сигнал являются непосредственно читаемыми без лабораторного оборудования.
12. Набор по п.11, где указанный токсин, имеющий мишень фосфатазу, продуцируют водоросли или цианобактерии.
13. Набор по любому из пп.11 и 12, где указанный набор включает в себя
твердую фазу, на которой иммобилизован фермент фосфопротеидфосфатаза как лиганд, связывающий токсин,
репортерную молекулу, способную конкурентно ингибировать связывание токсинов, имеющих мишень фосфатазу, с указанным лигандом, связывающим токсины, и генерировать сигнал, читаемый без лабораторного оборудования.
14. Набор по любому из пп.11-13, где указанный набор включает в себя
магнитно перемещаемые полимерные микросферы с иммобилизованной на них фосфопротеидфосфатазой,
молекулы пептидного гепатотоксина, меченного золем золота, способные конкурентно ингибировать связывание токсинов цианобактерий с указанной фосфопротеидфосфатазой.
15. Набор по любому из пп.11-13, где указанный набор включает в себя
магнитно перемещаемые полимерные микросферы с иммобилизованной на них фосфопротеидфосфатазой,
молекулы окадаевой кислоты, меченной золем золота, способные конкурентно ингибировать связывание токсинов водорослей с указанной фосфопротеидфосфатазой.
16. Применение набора по любому из пп.11-15 для определения токсинов, имеющих мишень фосфатазу.
Текст
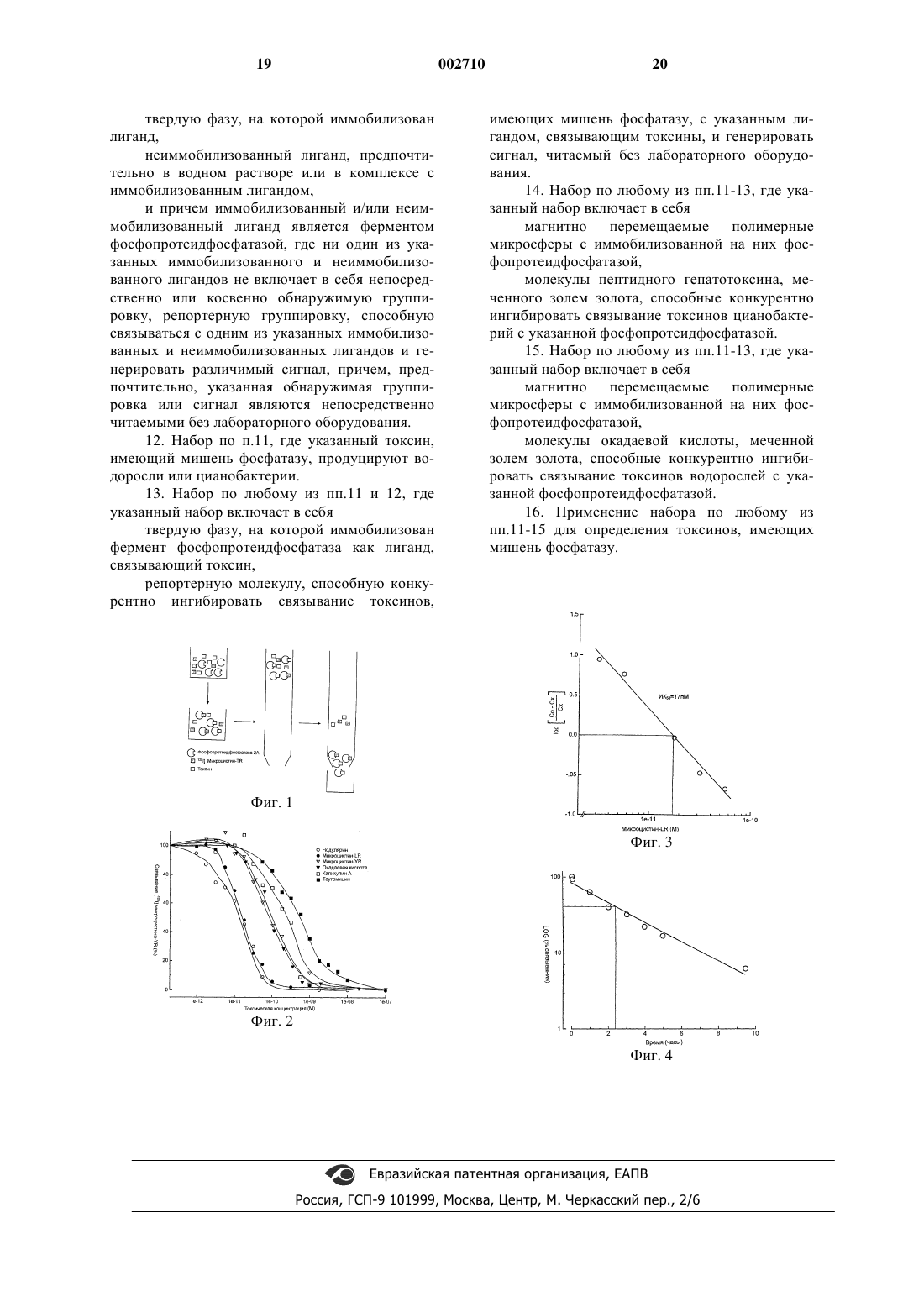
1 Настоящее изобретение относится к способу анализа на обнаружение токсинов, имеющих мишень фосфатазу, обычно продуцируемых микроводорослями, такими как, например,цианобактерии и динофлагелляты. Динофлагелляты обычно являются одноклеточными, способными к фотосинтезу, двухжгутиковыми водорослями. Некоторые из морских динофлагеллятов (например Prorocentrumsp. и Dinophysis sp.) продуцируют токсины,имеющие мишень фосфатазу, такие как окадаевая кислота и динофизистоксин, которые вызывают желудочно-кишечные расстройства при проглатывании людьми. Такие водоросли могут,таким образом, создавать затруднения, если они загрязняют места обитания моллюсков, предназначенных для потребления. Цианобактерии, которых часто называют сине-зелеными водорослями, также представляют собой организмы, способные к фотосинтезу, и являются в основном водными, и обитают в прибрежных водах, открытом море и океанах,реках, озерах и грунтовой воде, но могут также быть обитателями земли и находиться в опавших листьях и почве. Многие виды и штаммы цианобактерий, в частности, Microcystis sp., Aphanizomenon sp.,Anabena sp., Nodularia sp. и Oscillatoria sp., продуцируют токсины, которые при проглатывании людьми или другими млекопитающими, птицами и даже рыбами могут вызвать заболевание. Проглатывание таких токсинов происходит двумя основными путями: путем потребления зараженной воды или зараженных морских продуктов. Два основных типа токсинов продуцируются цианобактериями и динофлагеллятами. Нейротоксины, например анатоксины и сакситоксины, вызывают у пострадавшего паралич и в результате такое состояние часто называют паралитическим отравлением моллюсками. Отравление такими нейротоксинами является редким, но оно может оказаться смертельным. Другая форма токсинов инактивирует ферменты фосфопротеидфосфатазы в клетках организма путем связывания с этими ферментами и воздействия на их способность дефосфорилировать белковые субстраты. Эти токсины являются относительно широко распространенными, и некоторые (такие как токсины динофлагеллятов окадаевая кислота и динофизистоксин) могут вызывать тошноту, рвоту и диарею и в результате такое состояние часто называют диарейным отравлением моллюсками. Некоторые токсины, имеющие мишень фосфопротеидфосфатазу, являются стимуляторами опухолей и воздействие таких токсинов может привести к раку. Другие, такие как токсины цианобактерий микроцистин (microcystin) и нодулярин (nodularin), являются гепатотоксическими и вызывают повреждение печени. Наиболее распространенными из токсинов, имеющих мишень фосфа 002710 2 тазу, являются микроцистин, нодулярин и окадаевая кислота. Наиболее широко распространенными источниками отравления токсинами динофлагеллятов являются моллюски и печень рыб, а наиболее частой причиной отравления токсинами цианобактерий является зараженная питьевая вода и/или вода для купания. Токсины и цианобактерий, и динофлагеллятов могут, однако,укрываться в моллюсках и в воде. Особенно широко распространенным источником отравления токсинами водорослей являются мидии,поскольку они аккумулируют токсины при питании водорослями, продуцирующими токсины. Другие моллюски, например, устрицы, клемы и гребешки могут также поражаться. В дополнение, коммунально-бытовое водоснабжение, особенно если оно происходит из грунтовой воды, может также быть заражено цианобактериями, и таким образом, обеспечивать прямой путь для проглатывания токсинов. Существует некоторый интерес по отношению к потреблению водорослей и цианобактерий как здоровой пищи, богатой белками, и добавки к диете. Не существует официальных указаний по контролю за собираемыми водорослями или цианобактериями на загрязнение штаммами, продуцирующими токсины, а торговля такими родами, как Anabena и Aphanizomenon, особенно вызывает беспокойство, поскольку среди них можно обнаружить ряд штаммов, продуцирующих токсины. Дополнительно к кратковременному дискомфорту, стоимости медицинского обслуживания, коммерческим затратам на отрасль промышленности, относящейся к моллюскам, потере рабочего времени и так далее, происходящим от воздействия токсинов водорослей, было обнаружено, как упомянуто выше, что токсины,имеющие мишень фосфатазу, микроцистин и нодулярин, являются стимуляторами опухоли, и полагают, что повторное воздействие таких токсинов при клиническом или субклиническом уровне, особенно в сочетании с усиленным приемом алкоголя или курением может привести к раку, особенно печени. В настоящее время существует ряд различных способов обнаружения и количественного определения токсинов, имеющих мишень фосфатазу, из водорослей и цианобактерий. Один стандартный способ включает в себя измельчение мидий или других потенциальных источников токсинов, имеющих мишень фосфатазу, и введение мышам экстракта измельченной ткани мидии. Присутствие и уровень заражения токсинами, имеющими мишень фосфатазу, затем определяют относительно выживания мышей (Stabell et al. (1992), Food. Chem. Toxicol. 30(2): 139-44). Очевидно, что этот способ представляет собой занимающий время, грубый и дорогостоящий способ оценки безвредности пищевых продуктов и контроля за качеством. 3 Другой способ включает в себя измерение снижения ферментативной активности экзогенно добавленной фосфатазы и обнаружение, таким образом, присутствия токсинов, имеющих мишень фосфатазу, в моллюсках. Вновь, это включает в себя измельчение ткани мидий или других моллюсков, высвобождение эндогенных фосфатаз, которые являются помехой для добавленной фосфатазы, ставя под угрозу чувствительность и точность теста (Sim и MudgeToxins Eds. Codd, Jeffries, Keevil and Potter,Royal Society of Chemistry). Таким образом, существует большая потребность в быстром, чувствительном и недорогом анализе или способе, позволяющем качественно и/или количественно определить присутствие токсинов, имеющих мишень фосфатазу, в частности, токсинов водорослей и цианобактерий, имеющих мишень фосфатазу, в воде, моллюсках и/или пищевых продуктах из водорослей или цианобактерий. В частности, существует потребность в способе анализа, который является достаточно простым для осуществления на месте относительно неквалифицированным или неквалифицированным персоналом, например торговцами рыбой или персоналом водопроводных станций, и не требует лабораторного оборудования или специальных устройств для его осуществления. Таким образом, согласно первому аспекту настоящего изобретения, предложен способ анализа на определение токсинов, имеющих мишень фосфатазу, которые ингибируют фосфопротеидфосфатазы, при котором твердую подложку с иммобилизованным на ней лигандом, приводят в контакт с(2) неиммобилизованным лигандом,причем указанный иммобилизованный лиганд способен связываться, по меньшей мере, с одним из указанных токсинов, с указанным неиммобилизованным лигандом или комплексами указанного токсина и указанного неиммобилизованного лиганда, и указанный неиммобилизованный лиганд способен связываться, по меньшей мере, с одним из указанных иммобилизованных лигандов, с указанным токсином или комплексами указанного токсина и указанного иммобилизованного лиганда, в соответствии с чем количество указанного иммобилизованного лиганда, связанного указанным токсином, указанным неиммобилизованным лигандом или комплексами указанного токсина и указанного неиммобилизованного лиганда, зависит от содержания токсинов в указанном образце, и причем указанный иммобилизованный лиганд способен генерировать непосредственно или косвенно различимый сигнал, когда комплекс не образуется, при образовании комплекса с указанным токсином, при образовании ком 002710 4 плекса с комплексом указанного токсина и указанного неиммобилизованного лиганда или при образовании комплекса с указанным неиммобилизованном лигандом, либо указанный неиммобилизованный лиганд способен генерировать непосредственно или косвенно способом различимый сигнал, когда комплекс не образуется,или при образовании комплекса отделяют связанную фракцию от несвязанной фракции и непосредственно или косвенно определяют неиммобилизованный лиганд, связанный с иммобилизованным лигандом (связанная фракция) или не образовавший комплекс в водном растворе(несвязанная фракция), причем применение (1) и (2) по отношению к твердой подложке можно осуществлять отдельно, последовательно или одновременно, и если отдельно или последовательно, то их можно осуществлять в любом порядке. Таким образом, в одном воплощении определение токсинов может включать в себя определение неиммобилизованного лиганда, который не связался непосредственно или косвенно с иммобилизованным лигандом. Если неиммобилизованный лиганд конкурирует за связывание с иммобилизованным лигандом с токсином,то высокий уровень несвязанного лиганда является показателем высокой концентрации токсина. Если неиммобилизованный лиганд может образовывать комплекс с токсином, связанным с иммобилизованным лигандом, то высокий уровень несвязанного лиганда является показателем низкого уровня концентрации токсина. В другом воплощении, определение токсинов включает в себя определение неиммобилизованного лиганда, который связан непосредственно или косвенно с иммобилизованным лигандом. Если токсин и неиммобилизованный лиганд конкурируют за связывание с иммобилизованным лигандом, то высокий уровень связанного лиганда является показателем низкого уровня концентрации токсина. Если неиммобилизованный лиганд может образовывать комплекс с токсином, связанным с иммобилизованным лигандом, то высокий уровень связанного лиганда является показателем высокого уровня концентрации токсина. Предпочтительно, однако, способ по изобретению включает в себя анализ на конкурентное связывание для обнаружения токсинов,имеющих мишень фосфатазу, в частности, токсинов водорослей и цианобактерий, причем молекулы токсинов, присутствующие в образце,конкурируют с неиммобилизованным лигандом за ограниченное количество сайтов связывания иммобилизованного лиганда, и любой токсин,присутствующий в указанном образце, определяют по отношению к объему неиммобилизованного лиганда, связанного или не связанного с сайтами связывания иммобилизованного лиганда. 5 Используемые здесь термины "обнаружение", "определение" или "оценка" включают в себя как количественное определение в смысле получения абсолютной величины для количества или концентрации токсинов, имеющих мишень фосфатазу, присутствующих в образце,так и полуколичественную или качественную оценку или определение. Могут быть определены показатель, отношение, процентное или молярное указание уровня или количества присутствующего токсина, или альтернативно может быть получено простое указание присутствия или отсутствия таких токсинов в образце. В предпочтительном аспекте настоящего изобретения достигают определения просто присутствия или отсутствия токсина или полуколичественного определения присутствия токсина. В этом отношении "отсутствие" токсина может означать, что концентрация токсина находится ниже предела обнаружения способа или ниже уровня, который считают безопасным или допустимым. Образцы, используемые в способе анализа по настоящему изобретению, могут представлять собой любой образец, подозреваемый в воздействии токсинов, имеющих мишень фосфатазу, возможно, путем воздействия микроорганизмов, продуцирующих токсины, имеющие мишень фосфатазу, например воду, которая может быть морской водой, пресной водой, грунтовой водой, водой, взятой из озер, рек, водоемов, ручьев, водохранилищ, коммунальнобытового водоснабжения или может быть жидкостью, экстрагированной из моллюсков, например, путем простого сливания или извлечения с применением пипетки, или водой, в которую моллюски помещены, или может быть продуктом питания, пищевой добавкой, дополнением к питанию, альтернативным лечебным средством или подобным продуктом, который продуцируют водоросли или цианобактерии или который получают из них. Когда моллюски содержат свободную воду (например, как в устрицах), анализ может включать в себя погружение абсорбирующего субстрата (твердой подложки) в эту воду. Альтернативно, он может просто включать в себя прижатие абсорбирующего субстрата к влажному телу моллюска, например, после разламывания при открывании раковины. В предпочтительном аспекте настоящего изобретения исследуемый образец является поверхностной или свободной влагой из моллюсков. Все типы моллюсков, например гребешки,креветки, мидии и устрицы являются чувствительными к способу анализа по настоящему изобретению, но в предпочтительном аспекте,моллюски представляют собой мидии. В другом предпочтительном аспекте исследуемым образцом является вода, взятая из естественной среды, в которой такие моллюски живут, и в до 002710 6 полнительном предпочтительном аспекте образцом является вода, взятая из коммунальнобытового водоснабжения. Образец, используемый для анализа, может быть использован, по существу, в необработанном виде, но может, возможно, быть отфильтрован любым известным способом или разбавлен путем добавления воды, буфера или любой другой водной среды перед анализом, и его можно накапливать или хранить, например путем охлаждения или замораживания перед анализом. Любой лиганд, связывающий токсин, может быть использован в способе по настоящему изобретению в качестве иммобилизованного или неиммобилизованного лиганда, например,антитела, которые могут быть поликлональными или моноклональными, или фрагменты антител, например фрагменты F(ab), F(ab')2 или F(v). Такие антитела или фрагменты антител могут быть моновалентными или двухвалентными и могут быть получены с помощью гибридомной технологии или могут быть синтетического происхождения, либо быть продуктами генной инженерии или химического синтеза. Например,могут быть использованы одноцепочечные антитела или другие производные антител или вещества, подобные по действию. Антитела или фрагменты антител могут быть соответствующим образом направлены или индуцированы против любого эпитопа, компонента или структуры токсинов, имеющих мишень фосфатазу. Альтернативно, могут быть использованы соединения, обладающие сродством к токсину,например, небольшая органическая молекула или пептид, например олигопептид или полипептид, способные специфически связывать токсин, например, специфический связывающий агент, выбранный из комбинаторной химии или библиотеки фагового дисплея, или специфически связывающая последовательность ДНК или РНК. Предпочтительно, однако, лигандом, связывающим токсин, по настоящему изобретению является фермент фосфопротеидфосфатаза, и даже более предпочтительно в способе анализа используют связывающий лиганд фосфопротеидфосфатазу 2 А (фф 2 А). Также, вторым лигандом, используемым в способе анализа по настоящему изобретению,может быть любой лиганд, который связывается с токсином либо конкурентно, либо неконкурентно с первым лигандом. Альтернативно, второй лиганд может быть любым лигандом, который конкурирует с токсином за связывание с первым лигандом. Предпочтительно, первый лиганд является лигандом, связывающим токсин, более предпочтительно ферментом фосфопротеидфосфатазой. Один из двух лигандов должен быть иммобилизован, а другой должен быть не иммобилизован, и один из лигандов должен быть непосредственно или косвенно 7 обнаружимым. В предпочтительном воплощении неиммобилизованный лиганд должен удовлетворять функциональным требованиям тем,что он конкурентно ингибирует связывание токсина с иммобилизованным лигандом и может непосредственно или косвенно генерировать различимый сигнал, например, он может представлять собой молекулу, которая может быть мечена с помощью группировки, непосредственно или косвенно образующей сигнал, любой известной формы. Такие лиганды могут также принимать форму антител, которые могут быть поликлональными или моноклональными, или фрагментов антител, например фрагментовF(ab), F(ab')2 или F(b). Такие антитела или фрагменты антител могут быть моновалентными или двухвалентными и могут быть получены с помощью гибридомной технологии или могут быть синтетического происхождения, либо с помощью генной инженерии, либо химическим синтезом. Например, могут быть использованы одноцепочечные антитела или другие производные антител или вещества, подобные по действию, и небольшие органические молекулы, пептиды, олигопептиды и полипептиды, выбранные из комбинаторной библиотеки или библиотеки фагового дисплея. Антитела или фрагменты антител могут быть соответствующим образом направлены или индуцированы против любого эпитопа, компонента или структуры молекулы токсина, имеющего мишень фосфатазу, или лиганда, который связывает молекулу, имеющую мишень фосфатазу. Альтернативно, могут быть использованы соединения, обладающие сродством к токсину или лиганду, который связывает токсин, например, небольшая органическая молекула или пептид, олигопептид или полипептид, способные к специфическому связыванию токсина или лиганда, который связывает токсин,например, специфический связывающий агент,выбранный из комбинаторной химии или библиотеки фагового дисплея, или специфически связывающая последовательность ДНК или РНК. Репортерная группировка, которую, как правило, один из лигандов будет нести, может представлять собой сайт связывания для непосредственно обнаружимой группировки, например, золь металла (например золь золота), хромофор или флуорофор (например цианин, фталоцианин, мероцианин, трифенилметил, эквинанс и так далее [Topics in Applied Chemistry,Infrared Absorbing Chromophores, edited by M.probes and Research Chemicals, Haugland, Molecular Probes Inc., 1996], радиоизотопная метка,фермент, магнитная частица, агент, индуцирующий мутность и так далее, или он может уже нести такую непосредственно обнаружи 002710 8 мую группировку. Когда репортерную группировку несет иммобилизованный лиганд, она, как правило, будет представлять собой сайт связывания для непосредственно обнаружимой группировки, причем сайт связывания является либо активированным, либо в более общем случае дезактивированным, когда лиганд образует комплекс. Предпочтительно, репортерную группировку несет неиммобилизованный лиганд. В предпочтительном воплощении настоящего изобретения, неиммобилизованный лиганд является меченным, например, пептидным гепатотоксином, меченным ферментом или хромофором, или флуорофором, например, гепатотоксином, выбранным из нодулярина, микроцистина LC или микроцистина YR или альтернативно окадаевой кислоты. Хотя возможно мечение радиоизотопными метками, поскольку анализ первично предназначен для применения на месте непрофессиональными пользователями, предпочтительно использовать репортерные группировки, которые дают видимый сигнал, например, хромофоры, флуорофоры, фосфоресцирующие группировки, агенты, индуцирующие мутность, агенты, индуцирующие газовыделение, и так далее. Когда группировка, образующая сигнал,является веществом, которое связывается с сайтом связывания на одном из лигандов, она удобно будет контактировать со связанной или несвязанной фракцией, соответствующим образом, после разделения связанной и несвязанной фракций. В общем, когда сигнал должен происходить от связанной фракции, будет предпочтительным промыть субстрат, например, водой,чтобы отмыть несвязанную фракцию перед тем,как лиганд обнаруживают или он генерируется и его обнаруживают. Любой вид или штамм водорослей или цианобактерий, которые продуцируют токсины,имеющие мишень фосфатазу, могут быть включены в настоящее изобретение, но оно особенно подходит для продуцирующих токсины штаммов цианобактерий, например MicrocystisAnabena flus-aquae, или водорослей. Так например, токсины микроцистин-LR и микроцистинYR продуцируются Microcystis sp., токсин нодулярин продуцируется Nodularia sp., а токсин окадаевая кислота продуцируется Prorocentrumsp. Токсины, подвергаемые определению с помощью способа по изобретению, могут также быть любым токсином, имеющим мишень фосфатазу, продуцируемым водорослями или цианобактериями, но в предпочтительных аспектах пептидные токсины являются гепатотоксинами(из которых микроцистин и нодулярин являются наиболее распространенными) или окадаевой кислотой. 9 Таким образом, в наиболее общем смысле,способ по настоящему изобретению включает в себя простое приведение в контакт образца, подозреваемого в заражении токсинами, имеющими мишень фосфатазу, с лигандом, связывающим токсин, и репортерной молекулой, способной конкурировать с указанным токсином за сайты связывания лигандов, или одновременно,последовательно или отдельно в любом порядке, причем репортерная молекула возможно связана со связывающим лигандом перед воздействием на исследуемый образец, и определение репортерной молекулы, которая является либо связанной с твердой фазой, либо свободной в растворе. Связанная фракция может быть отделена от несвязанной фракции перед оценкой репортера с помощью любого подходящего способа,например, преципитации, центрифугирования,фильтрации, хроматографическими способами,капиллярным воздействием или просто сливанием. Твердая фаза может, например, быть в форме измерительного стержня или твердой матрицы в любой известной форме, например,полимерными или магнитными шариками, например, Dynabeads (доступны от Dynal AS). В предпочтительных воплощениях настоящего изобретения твердая фаза, на которой иммобилизованы лиганды, связывающие токсин, представлена в форме Dynabeads. Репортерная молекула может быть определена либо в связанной, либо в несвязанной фракции в зависимости от конкретного воплощения изобретения, но предпочтительно ее определяют в связанной фракции. Иммобилизуемый лиганд может быть иммобилизован любым известным способом, например, путем соединения или сочетания лиганда с любой из хорошо известных твердых подложек или матриц, которые в настоящее время широко используются или предлагаются для разделения или иммобилизации, например,твердые фазы могут принимать форму частиц,пластин, гелей, фильтров, мембран, волокон или капилляров или микропластинок для титрования, трубок или планшетов с лунками и так далее, и для удобства могут быть изготовлены из стекла, диоксида кремния, латекса, полимерного материала или магнитных шариков. Методы для связывания лиганда с твердой подложкой хорошо известны из уровня техники и широко описаны в литературе. В предпочтительных воплощениях настоящего изобретения, твердая фаза,на которой иммобилизованы лиганды, связывающие токсин, имеющий мишень фосфатазу,представлена в форме Dynabeads. Преимуществом способа анализа по настоящему изобретению является то, что его можно осуществить без сложного лабораторного оборудования и его может осуществить относительно неквалифицированный или неквалифицированный персонал. Следовательно, спо 002710 10 соб анализа пригоден для использования дома, в магазинах или в полевых условиях, и он может быть выполнен быстро и легко без больших усилий или опасных химикалий. Особым преимуществом анализа по настоящему изобретению является очень высокая степень чувствительности, которая является жизненно важной при проведении анализа образцов, в которых токсин присутствует на очень низких уровнях, например, при тестировании питьевой воды или оценке возможного заражения токсинами, имеющими мишень фосфатазу. Обычно анализ способен обнаруживать токсины в пикомолярных концентрациях, например, таких низких как 10 пМ. Удобно применять анализ для обнаружения токсинов в интервале от 15 до 560 пМ. Дополнительным преимуществом анализа по настоящему изобретению относительно существующих методов является то, что на настоящий анализ не оказывает влияния присутствие эндогенных фосфатаз, которые могут присутствовать в анализируемых образцах, в частности, например, если образцы взяты из моллюсков. В одном воплощении настоящего изобретения фосфопротеидфосфатазу иммобилизуют на твердой подложке, иммобилизованную фосфатазу приводят в контакт с исследуемым образцом, и любой токсин, имеющий мишень фосфатазу, присутствующий в образце, связывается с иммобилизованной фосфатазой. Добавляют источник репортерных молекул, которые конкурируют с токсином за сайты связывания фосфатазы. Репортерные молекулы вытесняют молекулы токсина из сайтов связывания со степенью, которая зависит от относительной концентрации молекул токсина и репортерных молекул. Степень связывания репортерных молекул облегчает обнаружение токсина, присутствующего в исследуемом образце. Предпочтительные репортеры/метки включают в себя радиоизотопные метки, хромофоры (включая флуорофоры) и ферменты, которые служат источниками хромогенных или флуорогенных продуктов. Также принимают во внимание непосредственные сцинтилляционные метки и метки, которые вызывают измеряемое изменение рассеяния света. В альтернативном воплощении молекулы фосфатазы, блокированные репортером, иммобилизованным на твердой подложке, приводят в контакт с исследуемым образцом, и любые токсины, имеющие мишень фосфатазу, присутствующие в образце, конкурируют со связанными с фосфатазой репортерными молекулами, вытесняя их с твердой фазы в водную фазу со степенью, пропорциональной количеству токсина,присутствующего в образце. Количество репортерных молекул, которые остаются связанными с твердой фазой, затем оценивают для облегче 11 ния определения присутствия токсина в исследуемом образце. При рассмотрении еще одного аспекта в настоящем изобретении предложен набор для определения токсинов цианобактерий или водорослей, имеющих мишень фосфатазу, согласно настоящему изобретению, указанный набор включает в себя твердую фазу, на которой иммобилизован лиганд,неиммобилизованный лиганд, предпочтительно в водном растворе или в комплексе с иммобилизованным лигандом, где ни один из указанных иммобилизованного и неиммобилизованного лигандов не включает в себя непосредственно или косвенно обнаружимую группу, репортерную группировку, способную связываться с одним из указанных иммобилизованным и неиммобилизованным лигандами и генерировать различимый сигнал, причем, предпочтительно, указанная обнаружимая группировка или сигнал являются непосредственно читаемыми без лабораторного оборудования. В одном предпочтительном воплощении набор по настоящему изобретению включает в себя твердую фазу, на которой иммобилизованы лиганды, связывающие токсины, имеющие мишень фосфатазу,репортерную молекулу, способную конкурентно ингибировать связывание токсинов,имеющих мишень фосфатазу, с указанным лигандом, связывающим токсин, и генерировать сигнал, читаемый без лабораторного оборудования. Особенно предпочтительное воплощение набора по настоящему изобретению включает в себя магнитно перемещаемые полимерные микросферы с иммобилизованной на них фосфопротеидфосфатазой,молекулы пептидного гепатотоксина, меченного золем золота, способные конкурентно ингибировать связывание токсинов цианобактерий с указанной фосфопротеидфосфатазой. Дополнительное особенно предпочтительное воплощение набора по настоящему изобретению включает в себя магнитно перемещаемые полимерные микросферы с иммобилизованной на них фосфопротеидфосфатазой,молекулы окадаевой кислоты, меченной золем золота, способные конкурентно ингибировать связывание токсинов водорослей с указанной фосфопротеидфосфатазой. В другом предпочтительном аспекте, применение набора включает в себя погружение пористого целлюлозного субстрата, на котором иммобилизован лиганд, связывающий токсин, и который насыщен конкурентно связывающимся лигандом, меченным хромофором (или флуорофором и так далее), в образец воды или жидкости моллюсков, оставление насыщенного субстрата инкубироваться в течение предваритель 002710 12 ного определенного периода (либо удаление из образца или в предварительно определенном объеме образца), удаление несвязанного меченного лиганда, например, путем промывания субстрата свободной от токсинов водой или путем оставления субстрата для пропитывания на предварительно определенный период времени в предварительно определенном объеме свободной от токсинов воды, и наблюдение за цветом субстрата или воды для пропитывания. Желательно, субстрат укреплен на подложке, предпочтительно подложке, меченной калибровочными цветами для облегчения сравнения цвета субстрата или воды для пропитывания для определения концентрации токсина или для указания того, находится ли концентрация токсина выше или ниже одного или более чем одного пороговых значений. Настоящее изобретение будет теперь иллюстрировано следующими неограничивающими примерами. Материалы Микроцистин YR, Микроцистин-LR, окадаевая кислота, нодулярин, каликулин A (calyculin А) и таутомицин (tautomycin) приобретены в Calbiochem (San Diego, СА). Свободный от носителя(АТФаденозинтрифосфат) получен от Amersham (Little Chalfont, UK). Альбумин (степень для радиоиммунного анализа (РИА, ацетат аммония,Хлорамин Т, диметилсульфоксид (ДМСО), дитиоэритритол (ДТЭ), этилендиаминтетрауксусная кислота (ЭДТА), этиленгликольтетрауксусная кислотаRathburn (Walkerburn, Scotland). Частично очищенная фосфопротеидфосфатаза 2 А либо получена от Upstate Biotechnology (Lake Placid, NY),либо очищена в соответствии с Resink et al. (Eur.J. Biochem. 133: 455-462 (1983. Иодирование микроцистина-YR Микроцистин YR (10 мкг) иодируют 1 мКи свободным от носителя Na125I (37 МБк), используя хлорамин Т, как описано Ciechanover et al.,(PNAS 77: 1365-1368 (1980. После реакции иодирования иодид отделяют отSep-Pak Plus (Waters, Milford, MA) в соответствии со способом Runnegar et al. (Toxicon 24: 506-509 (1986. [125I]Микроцистин-YR наносят на колонку ВЭЖХ (ВЭЖХ - высокоэффективная жидкостная хроматография) Inertsil ODS-2 размером 3 х 250 мм от Chrompack (Raritan, NJ) и элюируют градиентом ацетонитрила. Анализ на конкурентное связывание Анализ на конкурентное связывание проводят в объеме 0,5 мл буфера с 50 мМ HEPES[125I]Микроцистин-YR (1 Ки/13 нг) добавляют при 35 пМ. Фосфопротеидфосфатазу 2 А (30 пМ) добавляют последней и реакционную смесь инкубируют на льду в течение ночи.Pharmacia (Uppsala, Sweden) на колонках размером 0,7 х 15 см от Bio-Rad (Hercules, CA). Буфер 50 мМ HEPES (рН 7,2) с 1 мМ ЭДТА и 0,3 мМ ЭГТА используют при разделении, которое проводят при 4 С. Фракцию, содержащую[125I]микроцистин-YR, который связывается с фосфопротеидфосфатазой 2 А, собирают и количественно измеряют радиоактивность сцинтилляционным методом. Неспецифическое связывание [125I]микроцистина-YR определяют в контрольной реакции, где микроцистин-LR добавляют в избытке (1 мкМ). Пример 1. Фосфопротеидфосфатазу 2 А соединяют с магнитными шариками (непосредственно с шариками или посредством биотинилирования фосфатазы). Иммобилизованную фосфопротеидфосфатазу затем смешивают с образцом и токсином с радиоизотопной меткой (например[125I]микроцистином-YR). Иммобилизованную фосфопротеидфосфатазу отделяют от реакционной смеси с помощью магнитной силы. Радиоактивность, связанную с фосфопротеидфосфатазой (магнитные шарики), определяют сцинтилляционным методом. Количество радиоизотопной метки, связанной с фосфопротеидфосфатазой, уменьшается как функция токсина, связывающего фосфатазу, в образце. Пример 2. Фосфопротеидфосфатазу 2 А соединяют с магнитными шариками (непосредственно с шариками или посредством биотинилирования фосфатазы). Иммобилизованную фосфопротеидфосфатазу затем смешивают с образцом и токсином, связанным с окрашенными шариками. Иммобилизованную фосфопротеидфосфатазу отделяют от реакционной смеси с помощью магнитной силы. Окрашенные шарики, связанные с фосфопротеидфосфатазой (магнитные шарики), оценивают визуально или с помощью микроскопа с малым увеличением (напримерNikon TMS). Количество окрашенных шариков,связанных с фосфопротеидфосфатазой (магнитными шариками), уменьшается как функция токсина, связывающего фосфатазу, в образце. Пример 3. Фосфопротеидфосфатазу 2 А соединяют с магнитными шариками (непосредственно с шариками или посредством биотинилирования 14 фосфатазы). Иммобилизованную фосфопротеидфосфатазу затем смешивают с образцом и токсином, иммобилизованным на шариках, несущих иммобилизованный фермент. Этот фермент способен генерировать обнаружимый продукт (окрашенный или флуоресцентный) при подходящей инкубации с хромогенным или флуорогенным субстратом. Иммобилизованную фосфопротеидфосфатазу отделяют от реакционной смеси с помощью магнитной силы. Окраску или флуоресценцию, связанные с фосфопротеидфосфатазой (магнитными шариками), измеряют с помощью спектроскопии или флуорометрии, соответственно. Количество окраски/флуоресценции, связанной с магнитными шариками, уменьшается как функция токсина,связывающего фосфатазу, в образце. Пример 4. Сцинтилляционный непосредственный анализ. Фосфопротеидфосфатазу биотинилируют и иммобилизуют на лунках, предварительно покрытых стрептавидином и сцинтиллятором[125I]микроцистин-YR добавляют в лунки. Количество [125I]микроцистина-YR, связанного с иммобилизованной фосфопротеидфосфатазой,определяют сцинтилляционным методом. Пример 5. Ингибирование связывания [125I]-микроцистина-YR с фосфопротеидфосфатазой 2 А в присутствии различных токсинов ИК 502 (пМ) Исследуемое соединение 1 Нодулярин 15 Микроцистин-LR 17 Микроцистин-YR 75 Окадаевая кислота 100 Каликулин А 251 Таутомицин 562 1 Исследуемые соединения инкубировали с[125I]-микроцистином-YR и фосфопротеидфосфатазой 2 А, как описано выше. 2 Величина ИК 50 представляет собой концентрацию, необходимую для получения 50% ингибирования связывания [125I]-микроцистина-YR с фосфопротеидфосфатазой 2 А. Эти значения определяли в соответствии с фиг. 3. Данные представляют собой среднее значение, по меньшей мере, 3 отдельных экспериментов. Пример 6. Влияние экзогенных соединений на анализ на конкурентное связывание по сравнению с анализом на фосфопротеидфосфатазу% Активности 2 Исследуемое соединение 1 Анализ на кон- Анализ на фоскурентное свяфопротеидфосзывание фатазу 2 мМ АТФ 103,30,2 9,83,4 0,5 мМ АТФ 101,61,7 29,85,6 0,05 мМ NaPPi (PPi 101,44,1 14,21,2 неорганический пирофосфат) 50 мМ NaF 101,51,9 7,71,4(рН 7,2), или только с буфером (контроль) в течение 30 мин на льду. Активность фосфатазы измеряли путем дефосфорилирования фосфогистона, как описано. % Активности вычислен по отношению к контрольной реакции. 2 Активность в анализе на конкурентное связывание представляет собой способность фосфопротеидфосфатазы 2 А связывать [125I]микроцистин-YR в присутствии экзогенного соединения, растворенного в буфере, относительно только буфера. Данные представляют собой среднее значение, по меньшей мере, трех отдельных экспериментовстандартная ошибка. Пример 7. Чувствительность анализа на связывание для нодулярина и микроцистина-LR Ингибирование связывания(М) Вода Питьевая Морская МорскаяMilliQ, питьевой или морской воде при указанной концентрации. Аликвоты по 300 мкл этих растворов тестировали на их способность конкурировать с [125I]микроцистином-YR за связывание фосфопротеидфосфатазы 2 А, как описано выше. 2 Морскую воду разводят 1/10 в воде milliQ. Данные представлены как среднее значениестандартная ошибка. Пример 8. Эквиваленты окадаевой кислоты (ОК) в экстрактах моллюсков, как определено с помощью анализа ВЭЖХ и с помощью анализа на связывание фосфопротеидфосфатазы Эквив. ОК по Эквив. ОК по анализу на Экстракт 1 анализу ЖХВД 2 связывание 3(нМ) креаса) 1 0 0 85 2 0 0 45 3 0 0 70 4 4 2480 2100 5 1,2 748 755 6 0,8 496 805 1 Экстракты получали из гепатопанкреаса мидий, собранных вдоль Норвежского побережья. 2 Экстракты анализировали на эквиваленты окадаевой кислоты с помощью ВЭЖХ. 3 Экстракты разводили в 100% ДМСО и тестировали на способность конкурировать с [125I]микроцистином-YR за 16 связывание с фосфопротеидфосфатазой 2 А, используя анализ на связывание, как описано выше. Концентрацию эквивалентов окадаевой кислоты определяли путем сравнения данных со стандартными кривыми для окадаевой кислоты,растворенной в 100% ДМСО. Пример 9. Прилагаемые графические материалы Фиг. 1 приложенных графических материалов является схематической диаграммой анализа на конкурентное связывание для определения токсинов, связывающих фосфопротеидфосфатазу. Фосфопротеидфосфатазу 2 А инкубируют с[125I]микроцистином-YR и другим токсином,ориентированным к фосфопротеидфосфатазе 2 А. Токсин конкурирует с [125I]микроцистиномYR за связывание с фосфатазой. Добавление значительного количества токсина приводит к пониженному связыванию[125I]микроцистина-YR с фосфатазой и наоборот. После достижения равновесия связывания,[125I]микроцистин-YR, связанный с фосфопротеидфосфатазой 2 А, отделяют от свободного[125I]микроцистина-YR с помощью гельфильтрации. Фракцию, содержащую [125I]микроцистин-YR, связанный с фосфатазой, собирают, и количество радиоактивности определяют сцинтилляционным методом. Фиг. 2 приложенных графических материалов показывает влияние увеличивающихся количеств различных токсинов водорослей на связывание [125I]микроцистина-YR с фосфопротеидфосфатазой 2 А. Фосфопротеидфосфатазу 2 А (30 пМ) инкубировали в присутствии 35 пМ[125I]микроцистина-YR (1 Ки/13 нг) и 0-100 пМ различных токсинов водорослей, указанных на фиг. [125I]Микроцистин-YR, связанный с фосфопротеидфосфатазой 2 А, выделяли с помощью гель-фильтрации и радиоактивность определяли сцинтилляционным методом. Каждая кривая представляет собой среднее значение, по меньшей мере, 3 отдельных экспериментов. Фиг. 3 приложенных графических материалов показывает ИК 50 для связывания[125I]микроцистина-LR в анализе на конкурентное связывание. Связывание [125I]микроцистина-YR с фосфопротеидфосфатазой 2 А наносят на график как зависимость отношения несвязанного [125I]микроцистина-YR[125I]микроцистина-LR. Co представляет собой количество связанного [125I]микроцистина-YR в отсутствие микроцистина-YR, а Сх представляет собой количество связанного [125I]микроцистина-YR в присутствии различных концентраций микроцистина-LR. Фиг. 4 приложенных графических материалов иллюстрирует стабильность [125I]микроцистина-YR, связанного с фосфопротеидфосфа 17 тазой 2 А, в присутствии избытка микроцистинаLR. Фосфопротеидфосфатазу 2 А (1 нМ) инкубировали в присутствии [125I]микроцистина-YR(100 пМ) в течение 1 ч. [125I]Микроцистин-LR (2 мкМ) добавляли к реакционной смеси в момент времени 0. Количество [125I]микроцистина-YR,связанного с фосфопротеидфосфатазой 2 А, определяли для указанных моментов времени гель-фильтрацией и сцинтилляционным методом, как описано. Кривая представляет собой среднее значение 4 отдельных экспериментов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ анализа на определение токсинов, имеющих мишень фосфатазу, которые ингибируют фосфопротеидфосфатазы, при котором твердую подложку с иммобилизованным на ней лигандом приводят в контакт с(2) неиммобилизованным лигандом,причем указанный иммобилизованный лиганд способен связываться, по меньшей мере, с одним из указанных токсинов, указанным неиммобилизованным лигандом или комплексами указанного токсина и указанного неиммобилизованного лиганда и указанный неиммобилизованный лиганд способен связываться, по меньшей мере, с одним из указанных иммобилизованных лигандов, указанным токсином или комплексами указанного токсина и указанного иммобилизованного лиганда, в соответствии с чем количество указанного иммобилизованного лиганда, связанного указанным токсином, указанным неиммобилизованным лигандом или комплексами указанного токсина и указанного неиммобилизованного лиганда, зависит от содержания токсина в указанном образце,и причем указанный иммобилизованный и/или неиммобилизованный лиганд, связывающий токсин, представляет собой фермент фосфопротеидфосфатазу, и причем указанный иммобилизованный лиганд способен генерировать непосредственно или косвенно различимый сигнал, когда комплекс не образуется, при образовании комплекса с указанным токсином, при образовании комплекса с комплексом указанного токсина и указанного неиммобилизованного лиганда или при образовании комплекса с указанным неиммобилизованным лигандом, либо указанный неиммобилизованный лиганд способен генерировать непосредственно или косвенно различимый сигнал, когда комплекс не образуется, или при образовании комплекса,отделяют связанную фракцию от несвязанной фракции и непосредственно или косвенно определяют неиммобилизованный лиганд, связанный с иммобилизованным лигандом (связанная фракция) 18 или не образовавший комплекс в водном растворе (несвязанная фракция),причем применение (1) и (2) по отношению к твердой подложке можно осуществить отдельно, последовательно или одновременно, и если отдельно или последовательно, то их можно осуществить в любом порядке. 2. Способ анализа по п.1, где указанный токсин, имеющий мишень фосфатазу, продуцируют водоросли или цианобактерии и, предпочтительно, где указанный токсин, который определяют, является гепатотоксином или окадаевой кислотой. 3. Способ анализа по любому из пп.1-2, где молекулы токсина, присутствующие в образце,конкурируют с неиммобилизованным лигандом за ограниченное количество сайтов связывания иммобилизованного лиганда, и любой токсин,присутствующий в указанном образце, определяют по отношению к объему неиммобилизованного лиганда, связанного или не связанного с сайтами связывания иммобилизованного лиганда. 4. Способ анализа по любому из пп.1-3,при котором определяют присутствие или отсутствие токсина, имеющего мишень фосфатазу. 5. Способ анализа по любому из пп.1-4, где исследуемый образец является поверхностной или свободной влагой из моллюсков, или водой,взятой из естественной среды, в которой живут такие моллюски, или водой, взятой из коммунально-бытового водоснабжения. 6. Способ анализа по любому из пп.1-5, где иммобилизованный или неиммобилизованный лиганд является антителом или фрагментом антитела. 7. Способ анализа по любому из пп.1-6, где фермент фосфопротеидфосфатаза является связывающим лигандом фосфопротеидфосфатазой 2 А. 8. Способ анализа по любому из пп.1-7, где либо иммобилизованный, либо неиммобилизованный лиганды несут репортерную группировку и где предпочтительно неиммобилизованный лиганд несет репортерную группировку. 9. Способ анализа по п.8, где неиммобилизованный лиганд является меченным пептидным гепатотоксином или меченной окадаевой кислотой и где гепатотоксин предпочтительно выбран из нодулярина, микроцистина LC или микроцистина YR. 10. Способ анализа по любому из пп.1-9,где твердая подложка является измерительным стержнем или твердой матрицей и где твердая матрица предпочтительно является полимерными или магнитными шариками. 11. Набор для определения токсинов,имеющих мишень фосфатазу, которые ингибируют фосфопротеидфосфатазы, включающий в себя твердую фазу, на которой иммобилизован лиганд,неиммобилизованный лиганд, предпочтительно в водном растворе или в комплексе с иммобилизованным лигандом,и причем иммобилизованный и/или неиммобилизованный лиганд является ферментом фосфопротеидфосфатазой, где ни один из указанных иммобилизованного и неиммобилизованного лигандов не включает в себя непосредственно или косвенно обнаружимую группировку, репортерную группировку, способную связываться с одним из указанных иммобилизованных и неиммобилизованных лигандов и генерировать различимый сигнал, причем, предпочтительно, указанная обнаружимая группировка или сигнал являются непосредственно читаемыми без лабораторного оборудования. 12. Набор по п.11, где указанный токсин,имеющий мишень фосфатазу, продуцируют водоросли или цианобактерии. 13. Набор по любому из пп.11 и 12, где указанный набор включает в себя твердую фазу, на которой иммобилизован фермент фосфопротеидфосфатаза как лиганд,связывающий токсин,репортерную молекулу, способную конкурентно ингибировать связывание токсинов, 20 имеющих мишень фосфатазу, с указанным лигандом, связывающим токсины, и генерировать сигнал, читаемый без лабораторного оборудования. 14. Набор по любому из пп.11-13, где указанный набор включает в себя магнитно перемещаемые полимерные микросферы с иммобилизованной на них фосфопротеидфосфатазой,молекулы пептидного гепатотоксина, меченного золем золота, способные конкурентно ингибировать связывание токсинов цианобактерий с указанной фосфопротеидфосфатазой. 15. Набор по любому из пп.11-13, где указанный набор включает в себя магнитно перемещаемые полимерные микросферы с иммобилизованной на них фосфопротеидфосфатазой,молекулы окадаевой кислоты, меченной золем золота, способные конкурентно ингибировать связывание токсинов водорослей с указанной фосфопротеидфосфатазой. 16. Применение набора по любому из пп.11-15 для определения токсинов, имеющих мишень фосфатазу.
МПК / Метки
МПК: G01N 33/53, C12Q 1/42
Метки: фосфатазу, токсины, анализ, имеющие, мишень
Код ссылки
<a href="https://eas.patents.su/11-2710-analiz-na-toksiny-imeyushhie-mishen-fosfatazu.html" rel="bookmark" title="База патентов Евразийского Союза">Анализ на токсины, имеющие мишень фосфатазу</a>
Предыдущий патент: Способ приготовления солей щелочных металлов
Следующий патент: Табачные изделия с витамином е
Случайный патент: Бициклические соединения в качестве лигандов a4b2 никотинового ацетилхолинового рецептора